Method Article
Bakteriler, Böcek Hücreleri ve Bitki Sistemleri: Rekombinant Protein Farklı Biofactories İfade Karşılaştırmalı Analizi
Bu Makalede
Özet
In this study the expression of a target human recombinant protein in different production platforms was compared. We focused on traditional fermenter-based cultures and on plants, describing the set-up of each system and highlighting, on the basis of the reported results, the inherent limits and advantages for each platform.
Özet
Bitki esaslı sistemler, yüksek kaliteli, biyolojik olarak aktif ürünler, esnek ve düşük maliyetli bir üretim için bunların iyi belgelenmiş potansiyel bir sonucu olarak, rekombinant proteinlerin üretimi için değerli bir platform olarak kabul edilir.
Bu çalışmada, geçici ve stabil olarak bitki bazlı ekspresyon sistemleri, geleneksel fermentasyon cihazı dayalı hücre kültürlerinde (bakteriyel ve böcek) ve hedef insan yeniden birleştirici proteinin ifadesini karşılaştırıldı.
Her platformda için, biz set-up, optimizasyon ve üretim sürecinin uzunluğu, nihai ürün kalitesi ve verimi açıklanan ve bizim seçtiğimiz hedef rekombinant protein için özel geçici üretim maliyetlerini, değerlendirildi.
Genel olarak, sonuçlar bakteri bağlı erimez içerik korları dahilinde birikmesi, hedef proteinin üretimi için uygun olduğunu göstermektedir. Öte yandan, bitki bazlı sistemler, çok yönlü platformlar t'ninşapka Bakulovirüs / böcek hücre sistemine daha düşük maliyetlerle seçilen proteinin üretimine izin verir. Özellikle, istikrarlı transgenik hatları nihai ürünün en yüksek verim ve geçici ifade bitkiler hızlı süreç geliştirme görüntülenen. Ancak, tüm rekombinant proteinleri bitki-temelli sistemlerde yararlanabilirler, ancak burada anlatıldığı gibi iyi üretim platformu, bir vaka-by-case yaklaşımı ile ampirik olarak tespit edilmelidir.
Giriş
Recombinant proteins are commercially mass-produced in heterologous expression systems with the aid of emerging biotechnology tools. Key factors that have to be considered when choosing the heterologous expression system include: protein quality, functionality, process speed, yield and cost.
In the recombinant protein field, the market for pharmaceuticals is expanding rapidly and, consequently, most biopharmaceuticals produced today are recombinant. Proteins can be expressed in cell cultures of bacteria, yeasts, molds, mammals, plants and insects, as well as in plant systems (either via stable- or transient-transformation) and transgenic animals; each expression system has its inherent advantages and limitations and for each target recombinant protein the optimal production system has to be carefully evaluated.
Plant-based platforms are arising as an important alternative to traditional fermenter-based systems for safe and cost-effective recombinant protein production. Although downstream processing costs are comparable to those of microbial and mammalian cells, the lower up-front investment required for commercial production in plants and the potential economy of scale, provided by cultivation over large areas, are key advantages.
We evaluated plants as bioreactors for the expression of the 65 kDa isoform of human glutamic acid decarboxylase (hGAD65), one of the major autoantigen in Type 1 autoimmune diabetes (T1D). hGAD65 is largely adopted as a marker, both for classifying and monitoring the progression of the disease and its role in T1D prevention is currently under investigation in clinical trials. If these trials are successful, the global demand for recombinant hGAD65 will increase dramatically.
Here, we focus on the expression of the enzymatically inactive counterpart of hGAD65, hGAD65mut, a mutant generated by substituting the lysine residue that binds the cofactor PLP (pyridoxal-5'-phosphate) with an arginine residue (K396R)1.
hGAD65mut retains its immunogenicity and, in plant and insect cells, accumulates up to ten-fold higher than hGAD65, its wild-type counterpart. It was hypothesized that the enzymatic activity of hGAD65 interferes with plant cell metabolism to such an extent that it suppresses its own synthesis, whereas hGAD65mut, the enzymatically-inactive form, can be accumulated in plant cells to higher levels.
For the expression of hGAD65mut, the use of different technologies, widely used in plant biotechnology, was explored here and compared to traditional expression platforms (Escherichia coli and Baculovirus/insect cell-based).
In this work, the recombinant platforms developed for the expression of hGAD65mut comprising traditional and plant-based systems were reviewed and compared on the basis of process speed and yield, and of final product quality and functionality.
Protokol
İfade Vektörler 1. İnşaatı
- Ticari rekombinasyon klonlama sistemi:
- Daha önce tarif edildiği gibi 2 uygun primerler genin 5 'ucunda bir OAKK kelepçe eklenmesini sağlayan hedef gen (hGAD65mut) tam uzunlukta dizisi yükseltin.
- 1 mol oranı ekleme: vektör ve 1 ul bir 1.5 kullanarak, 6 ul bir toplam hacim içinde reaksiyonu monte edilerek giriş vektörü (topoizomeraz bağlı) 'de, yönlü klonlama kiti özelliklerine göre, jelle saflaştırıldı amplifikasyon ürünü Clone tuz çözeltisi (0.01 MgCl2 0.2 M NaCI ve benzeri). Oda sıcaklığında 5 dakika boyunca (RT) inkübe edilir.
- Kimyasal yetkili E. içine tüm reaksiyonu Dönüşümü koloni PCR 3 ile yön klonlama kiti özelliklerine ve ekran elde koloniler, ileri M13 kullanarak ve geri primerler göre coli hücreleri yönlü klonlama kitine dahil. Bir Porselen plazmid izolemutasyonlar 3 yokluğunu sağlamak için primerler ileri M13 kullanarak ve ters plazmid DNA hazırlık seti özellikleri ve sırayla uç göre sas koloni.
- Belirli bir hedef vektörleri ile Lambda Recombinase Clonase II, enzim (LR) ile rekombinasyon reaksiyonunu gerçekleştirmek için elde edilen giriş klonu kullanın: pDEST17 (pDEST17.G65mut veren) ile bakteri hücrelerinde rekombinan protein ekspresyonu için, pK7WG2 ile (geçici ya da kararlı) bitkilerde 4 (Baculo.G65mut sonuçta) doğrusallaştırılmış, viral DNA ile Bakulovirüs / böcek hücre sistemine (pK7WG2.G65mut elde edilir). Giriş 100 ng vektör, vektör, hedeflenen 150 ng ve 10 ul'lik bir nihai hacim içinde enzim karışımı 2 ul, Clonase kiti özelliklerine göre, reaksiyon bir araya getirin. 1 saat boyunca oda sıcaklığında karışım inkübe edin.
- Kimyasal olarak, yetkili E. içine yeniden birleştirme ürünü Dönüşümü Clonase kiti özelliklerine göre coli hücreleri. PCR 3 ile ekran elde koloniler her bir transformasyon reaksiyonu edilen koloniler, aynı ters GAD65mut özgü primer kullanılarak (5'-CACACGCCGGCAGCAGGT-3 ') ve aşağıdaki özel hedef vektörleri ileri primerler: pDEST17 için: 5'-TAATACGACTCACTATAGGG-3'; pK7WG2 için: 5'-AAGATGCCTCTGCCGACAGT-3 '; Bakülo doğrusallaştırılmış vektörü için: 5'-AAATGATAACCATCTCGC-3 '.
- Ticari minipreparat DNA takımı kullanılarak plazmit DNA izole etmek ve önceki aşamada tarif edilenle aynı spesifik primer kombinasyonları kullanılarak, PCR 3 ile hedef sekansın varlığını doğrulamaktadır.
- Aşağıdaki adımlarda tarif edildiği gibi yeniden birleştirici protein ekspresyonu için seçilen platform bağlı olarak, farklı hedef organizmaların dönüştürülmesi için elde edilen PCR pozitif plazmidler kullanın.
- MagnICON sistemi 5-7:
- Daha önce pICH31070.G65mut, sonuçta ayrıntılı 7'de tarif edildiği gibi, 3'-modülü pICH31070 hedef genin klonlanması. KullanBelirli bir reaksiyon döngüsü aşağıdaki gibidir: 80 ° C'de 37 ° C, 50 ° C de 5 dakika ile 30 dakika inkübasyon ve daha sonra 5 dakika.
2. Rekombinant Protein
- Bakteriyel hücre sistemi:
- E. içine pDEST17.G65mut Dönüşümü E. coli BL21 (DE3), aşağıdaki transgen spesifik primerler kullanılarak koloni PCR ile amfisilin içeren (100 ug / ml) üzerinde büyümüş standart teknikler ve ekran koloniler LB-ortamı kullanılarak elektro-hücre: 5'-CTGGTGCCAAGTGGCTCAGA-3 've 5' -CACACGCCGGCAGCAGGT-3 ', 58 ° C'lik bir tavlama sıcaklığında ve 20 saniyelik bir uzama süresi ile. Tüp plastik bir ucu ile bakteriyel hücreler çözüldükten sonra 20 ul bir toplam hacim içinde PCR reaksiyonunu yürütmek.
- Ampisilin ihtiva eden (100 ug / ml), 3 ml LB ortamı içinde 37 ° C'de gece boyunca tek bir koloni inoküle.
- Bakteri kültürü 1 sulandırmak: Taze LB ortamı 100 100 ml (dahil ampicillve benzeri) bir son OD 0.8 600 kadar 1-6 saat süreyle 37 ° C'de inkübe edin.
- 1 mM'lik bir son konsantrasyonda isopropil-β-D-1-tiogalattopiranoside (IPTG) eklenmesi ile yeniden birleştirici proteinin ifadesini teşvik eder ve kuvvetli, 37 ° C'de 3 saat boyunca çalkalanarak kültüre kuluçkalayın.
- 20 dakika boyunca 4.000 xg'de santrifüj hücreleri toplayın ve protein ekstraksiyonu (adım 3.1.1.1) için bakteriyel pelet kullanın.
- Bakulovirüs / böcek hücresi sistemi:
- Tohum Spodoptera frugiperda (Sf9) 6 çukurlu plakalara hücreleri (oyuk başına 8 x 10 5 hücre) ve non-desteklenmiş Grace Böcek Ortama 2 ml iki kez yıkayın.
- Orta damla damla transfeksiyon karışımı (5 ul LR rekombinant reaksiyonu, 6 ul Celfectin solüsyonu ve 200 ul olmayan takviye Grace'in Böcek Orta) ile çıkarın ve değiştirin.
- 5 saat boyunca 27 ° C'de inkübe edin.
- Çıkarın ve taze Sf-9 2 ml transfeksiyon karışımı yerine% 10 fetal sığır serumu, 10 ug / ml gentamisin ve 100 uM gansiklovir ile takviye edilmiş 00 orta, rekombinant bakulovirüs klonları seçmek için kullanılır.
- 27 ° C 'de 96 saat süre ile inkübasyondan sonra, 4 ° C'de karanlıkta hücreleri ve büyük parçaları ve mağaza çıkarmak için 4000 x g'de ortamı (V1, viral stok), santrifüj toplar.
- Tohum başına 1 x 10 6 Sf9 hücreleri de 2.5 mi Sf-900,% 10 foetal bovin serumu, 10 ug / ml gentamisin ve 100 uM gansiklovir ihtiva eden ve de her V1 stok 100 ul ile enfekte etmektedir.
- 27 ° C 'de 3 gün boyunca kuluçkaya bırakılır.
- Toplayın ve santrifüj ortamı 4,000 x g.
- 4 ° C'de yüzer (V2 yüksek titre stok) saklayın.
- Tohum başına 1 x 10 6 Sf9 hücreleri de 2.5 mi Sf-900,% 10 foetal bovin serumu, 10 ug / ml gentamisin ve 100 uM gansiklovir ihtiva eden ve de her V2 stokunun 25 ul ile enfekte etmektedir.
- 27 ° C 'de 3 gün boyunca kuluçkaya bırakılır.
- 4.000 xg'de santrifüj hücreleri toplayın ve protein ekstraksiyonu (adım 3.1.2. 1) için böcek hücre pelet kullanın.
- Nicotiana benthamiana geçici ifade sistemleri:
- N. büyütün sıcaklık aralığı 18-23 ° C arasında doğal ışık altında bir serada, içinde benthamina bitkiler. Agro için 4-5 haftalık bitkiler kullanın.
- Bir 13 saat gündüz / 11 saat gece ışık süresi ile 22 ° C'de bir iklim odasına agroinfected bitkiler tutun.
- Ticari rekombinasyon klonlama sistemi:
- Agrobacterium suşu EHA105 yer alır elektro-hücre tumefaciens daha önce tarif edildiği gibi 8 pK7WG2.G65mut tanıtmak ve sonra 2 LB ortamı içeren rifampisin (50 ug / ml), streptomisin (300 ug / ml) ve spektinomisin (100 ug / ml) üzerinde büyüyen kolonilerin, ekran Aşağıdaki transgen spesifik primerler kullanılarak koloni PCR 8 ile 28 ° C'de inkübasyondan gün: 5'-CATGGTGGAGCACGACACGCT-3 #8217; ve 58 ° C'lik bir tavlama sıcaklığında ve 50 saniyelik bir uzama kez 5'-CACACGCCGGCAGCAGGT-3 ',. 20 ul bir toplam hacim içinde PCR reaksiyonunu yürütmek.
- 28 ° C'de iki gün boyunca LB ortamı içeren rifampisin (50 ug / ml), streptomisin (300 ug / ml) ve spektinomisin (100 ug / ml), 30 ml bakteri ile inoküle.
- Infiltrasyon tamponu, 10 ml 20 dakika ve tekrar süspansiyon pelet (10 mM MES, 10 mM MgCl2, 100 uM asetosiringon, pH 5.6) için 4000 x g'de santrifüj ile bakteriler toplanır. OD 600 değeri ölçmek ve daha sonra aynı tamponda seyreltilmesi ile 0.9 ayarlayabilirsiniz.
NOT: Üç N. infiltre için gerekli toplam hacim benthamiana bitkileri 30 ml'dir. - N. Agrobacterium süspansiyonu sızmak için 2.5 ml iğnesiz bir şırınga kullanın benthamiana bırakır. Dikkatlice ve yavaşça şırınga süspansiyon yaprak panelleri enjekte. Üç genişletilmiş l Infiltratebitkide saçak ve üçlü olarak üç bitki kullanabilirsiniz.
NOT: Sağlık ve güvenlik nedenleri sızma işlemi sırasında koruyucu gözlük takın için. - Sıvı azot içinde agroinfiltrated yaprakları 2 gün sonrası enfeksiyon (dpi) ve dondurma toplayın. -80 ° C'de saklayın bitki dokusu.
- MagnICON sistemi:
- 5 'modülünü (pICH20111), 3' modülü (pICH31070.G65mut) ve integraz modülünü (pICH14011) - - A'da MagnICON vektörleri tanıtmak standart teknikler kullanılarak GV3101 tumefaciens ırkı. Ihtiva eden LB ortamı üzerinde büyüyen kolonilerin, ekran 50 ug / ml rifampicin ve her bir vektör için spesifik primerler kullanılarak koloni PCR ile uygun vektör spesifik antibiyotik (pICH20111 ve pICH14011, 50 ug / ml kanamisin pICH31070 için 50 ug / ml karbenisilin).
- Ayrı ayrı üç A. aşılamak tumefaciens içeren LB ortamında 5 ml suşları 50 ug / ml rifampicin ve uygun vektör spesifik antibiyotikve 28 ° C 'de bir gece boyunca çalkalanır.
- Pelet, gece boyunca, bakteriyel 20 dakika boyunca 4000 x g'de santrifüjleme ile kültür ve 10 mM MES (pH 5.5) ve 10 mM MgSO 4 ilk bakteri kültürü iki hacim bunları yeniden süspanse edin.
- Üç vektörleri içeren bakteri süspansiyonları eşit hacimlerde karıştırın ve N. şırınga infiltrasyonu için süspansiyon karışımı kullanın benthamiana bırakır. Bitki başına üç genişletilmiş yaprakları sızmak.
- 4 dpi agroinfiltrated yaprakları toplayın ve sıvı azot içinde dondurma.
- -80 ° C'de saklayın bitki dokusu.
- Nicotiana tabacum stabil ekspresyon sistemi:
- Büyümek ve N. in vitro fidanları korumak Katı bitki kültür ortamı üzerinde tabacum (var SR1.) (4.4 g / L Murashige ve Skoog - MS - orta vitaminler, 30 g / L sükroz, pH 5.8, 7 g / L ağar, bitki dahil) 25 ° C'de klima kabini içinde kontrollü koşullar altında 16 saat / 8 saat gündüz / ni ile ° Cght rejim.
- A bir ön kültür Başlangıç tumefaciens EHA105 yer alır (100 ug / ml spektinomisin, 300 ug / ml streptomisin, rifampisin 50 mg / ml), uygun antibiyotik ile birlikte sıvı YEB 5 ml ortam içinde ifade vektörü pK7WG2.G65mut barındıran ve bir orbital çalkalayıcı grubu 28 ° C sıcaklıkta gece boyunca büyümeye 200 rpm'de çalkalayarak yapılır.
- Bakteri kültürü kadar (100 ug / ml spektinomisin, 300 ug / ml streptomisin, rifampisin 50 mg / ml) YEB ortamı artı antibiyotikler 50 ml'lik bir Agrobacterium kültürü aşılamak ve 24 saat için büyümeye ön kültür, 1 ml kullanın doymuş (OD 0,5-1,0 600 değeri).
- Bir sıvı bitki yetiştirme ortamında 50 ml 20 dakika ve tekrar süspansiyon pelet için 4000 x g'de santrifüj ile bakteriler toplanır. Tamamen antibiyotik kaldırmak için iki kez bu adımı tekrarlayın.
- In vitro tütün bitkilerinden ilk sağlıklı tam genişletilmiş yaprakları atın ve yaklaşık 1 cm kareler halinde doğrayın.
- Aktarım Yaprak parçalarıDerin Petri tabaklarına bakteri süspansiyonu içeren ve 20 dakika boyunca karanlıkta bırakın.
- Süspansiyon yaprak parçalarını çıkarın ve steril filtre kağıdı üzerinde kuru kurulayın.
- 1.0 ug / ml 6-benzilaminopurin (BAP) ve 0.1 ug / ml naftalin asetik asit (NAA) ihtiva eden bir katı madde bitki kültür ortamı üzerinde bir eksene doğru yaprak parçaları (üst yaprak yüzeyi) koyun ve kontrollü bir klima kabini içinde iki gün plakalar inkübe koşulları (25 ° C, 16 saat gün / 8 saat gece).
- Sıvıya temas eden alt yüzeyi (yaprağın alt yüzeyi) (1.0 ug / ml BAP, 0.1 ug / ml NAA, 500 mg / ml sefotaksim, 100 ug / ml kanamisin içeren) bir katı kültür aracı maddesi üzerine Aktarım yaprak adettir.
- Filiz oluşumunu başlatmak için 16 saat / 8 saat gündüz / gece rejimi ile 25 ° C 'de klima kabini içinde 2-3 hafta süreyle inkübe edin. Alt kültür 1.0 ug / ml BAP, 0.1 ug / ml NAA, 500 ihtiva eden taze bir katı bitki kültür ortamına yaprak eksplantları aktararak 2 haftadaug / ml sefotaksim ve 100 ug / ml kanamisin.
- Sürgünler 500 mg / ml sefotaksim ve kök oluşumunun uyarılması için 100 ug / ml kanamisin içeren katı bir kültür ortamı içeren Magenta kutularına transfer da görünür. 1-2 hafta boyunca 25 ° C 'de 16 saat gün ışığı / 8 saat gece foto süresiyle fidanları inkübe edin.
- Ne zaman köklerinin, sera içinde toprağa bitkiler aktarın.
- Her bitki için bir yaprak parçası toplayın ve bir ticari kit ile genomik DNA izole.
- Spesifik PCR ile transgenin varlığı algılar. Aşağıdaki transgen spesifik primerler kullanılarak PCR amplifikasyonu için bir şablon olarak genomik DNA, 30 ng kullanın: 5'-CTGGTGCCAAGTGGCTCAGA-3 've 5'-CACACGCCGGCAGCAGGT-3', 58 ° C'lik bir tavlama sıcaklığında ve 20 saniyelik bir uzama kez . 50 ul bir toplam hacim içinde PCR reaksiyonunu yürütmek.
- Tris-asetat-EDTA (TAE) tamponu içinde% 1 agaroz jeli (40 mM Tr üzerinde elektroforez ile 220 baz çiftlik bir ürün Analiz), 20 mM asetik asit, ve 1 mM EDTA ihtiva eder.
- Hedef geni ihtiva eden transgenik bitkilerin seçilmesi.
- Seçilen transgenik bitkinin her birinden bir yaprak parçası toplayın ve hemen sıvı nitrojen içinde dondurularak.
- Bitki, yaprak dokusu (aşama 3.1.3) toplam protein ekstreleri hazırlayın ve daha önce en rekombinant proteini ifade eden tütün bitkisi seçmek için 2 anlatıldığı gibi western blot analizi ile her bir örnek test edin.
- Çapraz-tozlaşma önlemek için çiçeklenme önce seçilen en iyi performans gösteren bitkinin Çanta çiçekleri.
- , Çiçeklenme, meyve olgunlaşma ve tohum kurutmadan sonra, torbaları toplamak.
- Saman ayırın tohumlar ve kontrollü sıcaklık (20-24 ° C) kuru bir odada saklayın.
- İkinci nesil transgenik bitkiler üretmek ve daha sonra kendi kendine tozlaşma olmak için en iyi performans gösteren bitki seçmek için kurutulmuş tohumları ekmek.
- Sonraki nesiller için 2.4.19-2.4.21 adımda açıklanan aynı işlemi tekrarlayın.
3. Rekombinant Protein Analizi
- Toplam protein çıkarma:
- Bakteri hücreleri:
- Tris-tamponlu tuzlu su kültür hacminin yarısı içinde, aşama 2.1.5 tarif edildiği gibi toplanan bakteriyel hücre pelleti, yeniden süspanse edin (TBS - 2 mM Tris / HCl, 500 mM NaCI), 1 mM phenylmethanesulfonylfluoride (PMSF) ile desteklenmiş, pH 7.4 ile yıkanır.
- Buz üzerinde örnek tutarken sonikasyon, yarı güçte 40 saniye süreyle hücre topağı üç kez yeniden süspanse edildi.
- 4 ° C'de 20 dakika boyunca 14,000 x g'de santrifüj ile lizat açıklık getirmektedir.
- Aktarım temiz bir tüpe süpernatan ve -80 ° C 'de ayrı olarak süpernatan ve topak, hem de muhafaza edin.
- Kuvvetlice gece boyunca oda sıcaklığında çalkalayarak 6 M üre ile desteklenmiş TBS pH 8.0 yarım hücre lizatı hacminde, pellet toplanmıştır inklüzyon cisimcikleri, çözünürleştirilir.
- Oda sıcaklığında 25 dakika boyunca 10,000 x g'de santrifüj ve temiz bir supernatant toplamaktüp.
- -80 ° C de, her iki süpernatan ve topak saklayın.
- Böcek hücreleri:
- (- 137 mM NaCI, 2.7 mM KCI, 10 mM Na-2 HPO 4, 1,8 mM KH 2 PO 4, PBS), pH 7.4 fosfat tamponlu tuzlu su ile 1 ml 'si ile, aşama 2.2.12 tarif edildiği gibi toplanan enfekte edilmiş böcek hücre topağı, yıkayın.
- Liziz tamponu içinde 200 ul içinde süspanse hücreleri (20 mM Tris / HCl, pH 8.0, 0.5 M NaCI, 3 mM β-merkaptoetanol ve% 1 Tween-20), ve 30 dakika boyunca buz üzerinde inkübe edilir.
- Santrifüj, 4 ° C'de 20 dakika 14,000 xg'de hücreleri çözünebilir.
- -80 ° C'de eriyen kesirler ve mağaza toplayın ve pelet atın.
- Bitki yaprağı dokusu:
- Öğütmek N. benthamiana veya N havan ve dibek kullanılarak sıvı azot içinde ince bir toz haline tabacum dokusudur.
- Ekstraksiyon tamponu 300 ul zemin dokusu, 100 mg homojenize (40 mM Hepes pH 7.9, 5 mM DTT,% 1.5 CHAPS), Özel Sayıproteaz inhibitör kokteyli 3 ul emented ve buz üzerinde eritin.
Not: Bitki doku ağırlığı (g) ile seçilmiş oranlı hacmi (mi), 1 tampon: 3 arasındadır. - 4 ° C'de 30 dakika boyunca 30,000 x g'de santrifüjleyin özü.
- -80 ° C de bir temiz tüpe ve mağaza supernatant toplamak.
- Bakteri hücreleri:
- Coomassie jel boyama:
- Ekstraksiyon tamponu 10 ul son hacim olması için toplam protein ekstreleri (örneğin, bitki ekstresi 2 ul, bakteriyel ve böcek özler 5 ul), uygun bir seyreltme hazırlayın ve 3x örnek tamponu 5 ul (1.5 M Tris / HCl, pH 6.8, nihai 1x konsantrasyona kadar% 3 SDS,% 15 gliserol,% 4 β-merkaptoetanol).
- 10 dakika boyunca kaynatılır örnekleri.
- % 10 SDS-PAGE ile ayrı proteinler.
- Elektroforezisten sonra, yaklaşık iki dakika boyunca bir mikrodalga fırın içinde, Coomassie çözelti A (% 0.05, Brilliant Blue R-250,% 25 izopropanol,% 10 asetik asit) varlığında, ısı jelikaynama noktası kadar s.
- Hafifçe çalkalanarak oda sıcaklığına jel soğutun.
- Sil Coomassie boyaması, çözelti A
- Coomassie B çözeltisi mevcudiyetinde ısıtma ile destain jel (% 0.05, Brilliant Blue R-250,% 25 izopropanol), C (0.002%, Brilliant Blue R-250,% 10 asetik asit), ve D (% 10 asetik asit), her zaman boyama için aynı protokol izlenerek.
- Arka plan 9 açıktır kadar çözüm D son ısıtma aşamasından sonra, jel destaining bırakın.
- Western blot analizi:
- Elektroforezisten sonra, Transfer 1 saat süre ile, oda sıcaklığında PBS pH 7.4 içinde, standart teknikler ve% 4 süt bloğu kullanılarak bir nitroselüloz zar üzerine proteinleri ayrıldı.
- 4 ° C'de bir gece boyunca inkübe leke veya 1 'de, hedef proteine karşı tavşan birincil antikor ihtiva eden bloklama çözeltisi oda sıcaklığında 4 saat: 10,000 ve% 0.1 Tween-20 ile takviye edilmiştir.
- Primer antikor etiket sonraing,% 0.1 Tween-20 ihtiva eden bloklama çözeltisi ile 5 dakika her biri için, membran 3 kez yıkayın.
- 1 ile turp peroksidaz (HRP) konjuge anti-tavşan antikoru ile inkübe: 10,000 saat 1.5.
- Yıkama membran 5 dakika PBS-T ile her biri için 5 kez farklı (PBS,% 0.1 Tween-20 ile takviye edilmiştir).
- Kemilüminesan peroksidaz substrat kullanılarak batı leke işleyin.
- Radyoimüno deneyi (RIA):
- Reaktifler (antiserumu, izleyici ve protein A Sefaroz), oda sıcaklığı ve pipet 12 x 75 mm polistiren tüpler içine (yeniden birleştirici ticari hGAD65 bölgesinin 300-2,400 ng / ml) farklı konsantrasyonlarda protein ekstresi numuneler ve standartlar 20 ul ulaştığından emin olunuz.
- Antiserum 20 ul ekleyin, 01:30 Bir T1D'nin hastanın plazmaferez serum seyreltilmesi hazırladı.
- Izleyici (125-l-GAD65) 50 ul ilave edilir ve oda sıcaklığında 2 saat süreyle inkübe edin. Sadece toplam aktiviteyi tahmin etmek izleyici ile bir tüp ayarlayın.
- 50 ul ekleve protein A Sefaroz, oda sıcaklığında 1 saat boyunca inkübe edilir.
- Soğuk PBS 1 mi, 30 dakika boyunca 4 ° C'de 1500 x g'de, her bir tüp ve santrifüj içine tampon dağıtın.
- Süpernatant kaldırmak ve tüp hafifçe dokunarak kurutma kağıdı üzerinde kalan sıvıyı emmek için tüpler Durusu.
- Ölçü bir gamma sayacında 1 dakika için sayarak tüplere radyoaktivite imüno.
- Günlük ölçekte arsa toplam faaliyetle ilgili kalibratörlerin bağlama oranları (B / T%), standart eğri oluşturmak ve kalibrasyon eğrisi 10 kapalı örneklerin YAB konsantrasyonunu okumak için.
NOT: Kısıtlı alanlar, depolama, elleçleme ve radyoaktif malzemenin imhası için tasarlanmış olmalıdır.
Sonuçlar
Farklı üretim sistemlerinde bir yeniden birleştirici hedef proteinin heterolog ekspresyonu için bir deney tasarımı burada tarif edilmektedir. ilk odak Her sistemde hedef proteinin ekspresyonu için uygun koşullar kurarak farklı düzlemlerin kurulum oldu.
Hedef protein, hGAD65mut ekspresyonu, üçlü E. indüklenmiştir E. coli kültürleri. 37 ° C'de ifade 3 saat sonra, bakteri hücreleri santrifüjleme ile toplandı ve sonikasyon ile parçalanır. Bir santrifüjleme kademesinden sonra, çözünür proteinler erimez içerik korları ayrılır ve ilk analizleri (veriler gösterilmemiştir) hGAD65mut çözünmez inklüzyon cisimcikleri içinde yaygın olarak birikmiş olduğu kanıtlanmıştır. Yeniden birleştirici protein çözünürlüğü, güçlü denatüre özellikleri, hGAD65mut imkansız uygun bir miktarının hale DEA analizi ile müdahale üre 6 M kullanımını gerektirdi. Birkaç stratejiler vartr, inklüzyon gövdelerinin oluşumunu sınırlayan düşük bir sıcaklıkta 11 mikrobiyal hücrelerin büyümesi ihtiva için rapor edilmiştir. Kültürler, 15 ° C ve 20 ° C'de büyütüldü ve rekombinant protein ekspresyonu, aynı sıcaklıkta indüklenmiştir. Şekil 1A'da gösterildiği gibi, hGAD65mut çözeltilmesi tekrar üre (şerit S2) gerektirir, her iki sıcaklıkta da üretilebilir. Bu durumda, bu deneyde düşük sıcaklıklarda çözülmeyen agrega şekillendirme hGAD65mut engellemez.
HGAD65mut dizi (Baculo.G65mut) içeren baculovirüs vektörleri arasında yapışkan Sf9 hücre kültürlerinde ifade edilmiştir. V1 ve V2 yüksek titre stokları hazırlandı ve en iyi performans enfeksiyon koşulları 5-50 ul farklı viral stok hacimleri değerlendirilmesi kuruldu. Şekil 1 B 'de gösterildiği gibi, RIA ile değerlendirildiği üzere, uygun viral stok hacmi, kültür ortamının ml'si başına rekombinant proteinin 11.8 ± 0.8 ug, sonuçta 25 ul olarak tanımlanmıştıranaliz (Tablo 1).
Aşağıdaki sızma, agroinfected N. zaman ders analizi benthamiana yapraklarından iki geçici ifade sistemlerinde gerçekleştirildi. PK7WG2 tabanlı sistem için yaprak numuneleri aralığı 1-5 dpi günlük bir araya getirilmiş, toplam çözünür proteinleri (TSP) ile ekstre edildi ve TSP eşit miktarlarda western blot (Şekil 1C) ile analiz edilmiştir. Bu analiz, hedef rekombinant proteinin maksimum birikimi 2 dpi ulaşılır vurguladı. Bu nedenle, yaprak 2 dpi hasat edilmiştir ve protein ekstreleri 67.8 ug / g FLW (taze yaprak ağırlığı, Tablo 1) ortalama göstermektedir Rekombinant protein birikiminin ölçülmesi için, RIA ile analiz edilmiştir. Yeniden birleşen protein ifadesi seviyesi, bu sistem ile de 12 Pro, P19 ya da HC gibi bir transkripsiyon sonrası gen susturma (PTGS) içindeki bir bastırıcı ile yaprakların eş süzülmesiyle, iyileştirilebilir.
Aynı zamanda ders algılama N. ile gerçekleştirildi benthamiana MagnICON vektörleri ile agroinfected yaprakları: enfekte yapraklar western blot ile analiz edilmiştir TSP 1-8 dpi ve eşit miktarlarda toplanmıştır. Bu analiz, RIA ile değerlendirildiği gibi, maksimum yeniden birleştirici proteinin birikmesi, 78.8 ug / g FLW (Tablo 1) yeniden birleştirici protein arasında bir ortalama birikimi, 4 dpi (Şekil 1D) elde edilir olduğunu gösterdi.
Transgenik tütün bitkilerinde hGAD65mut sentezlenmesi, daha önce rekombinant protein seviyeleri bağımsız olarak dönüştürülen hatları arasında belirgin çeşitlilik gösteren, 12 bildirilmiştir. En iyi performans hGAD65mut T1 transgenik bitki öz-geçti ve elde edilen bitkiler (T2) tekrar iyi bir performans seçmek için analiz edildi. Bu prosedür yok kadar RIA tarafından her nesil performans denetimi, homojen bir üretim platformu geliştirmek için birkaç kuşak boyunca tekrarlandıDiğer bir gelişme (veriler gösterilmemiştir), elde edildi. Şekil 1 E'deki T5 transjenik bitkilerin temsili bir Western blot yeniden birleştirici protein verimine homojenliği belirgin olduğu, bildirilmiştir. Şekil 1F'de gösterildiği gibi, ortalama hGAD65mut verim seçim süreci boyunca 99.1 ug / g FLW (Tablo 1) ve bir seviyeye ulaşmıştır, T6, T2 yükselmiştir, tanım düzeyinde standart sapma azalmıştır.
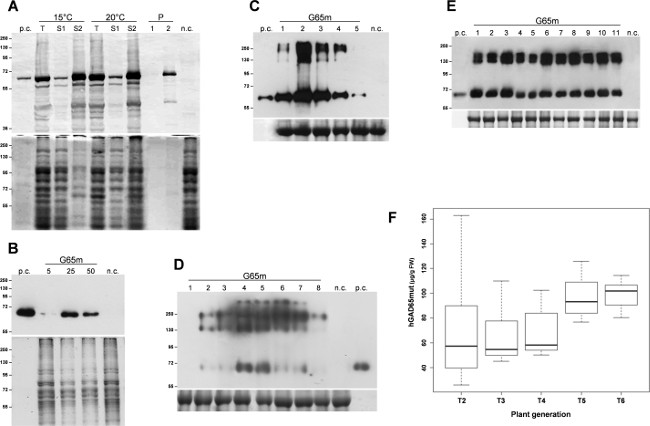
Şekil 1:. Platform set-up her platformda hGAD65mut ifade için en iyi koşulları ayarlayın. (A), E. E. coli uyarılabilir ifade platformu. Bakteri hücreleri Coomassie ile lekelenmiş kontrol yükleme, 15 ° C ya da 20 ° C'dir. Üst panel, hücre özütlerinde hGAD65mut batı lekesi (şerit başına 2 ug TSP). Alt panelde büyütülmüştür. n.c. = Negatif kontrol, kloramfenikol direnç geni içeren pDEST17 vektörü ile transforme edilen bakteri hücreleri; T: Toplam örnekleri; S1 Süpernatant, sonifikasyon ve santrifüjlemeden sonra çözünür; S2 ve P: Üst faz (1) ve Pelet (2) üre içeren bir tampon içinde çözülmüş örnek santrifüj sonrası. (B) Baculovirüs / böcek hücre platformu. sonraki viral stok hacmi test edilmiştir: 5, 25 ve 50 ul üst panel, hücre özütlerinde hGAD65mut batı benek (şerit başına 5 ug TSP) Alt panel, Coomassie ile lekelenmiş kontrol yükleme... nc negatif kontrol, dönüştürülmemiş böcek hücreleri özü =. N (C) Geçici sentezleme pK7WG2 vektörü kullanılarak benthamiana bitkileri. Numuneler, günlük 1-5 dpi (şerit 1-5). Üst panel, yaprak ekstrelerinde hGAD65mut batı leke (kulvar başına 2.5 ug TSP) toplandı. Alt paneli, Coomassie, büyük alt birim ile boyanmış denetimi yüklemedenRubisco'nun açıktır. nc = Negatif kontrol, GFP işaretleyici geni taşıyan pK7WG2 vektörü ile infiltre bitkiler. (D), N. Geçici sentezleme MagnICON vektörler kullanılarak benthamiana bitkileri. Numuneler, günlük 1-8 dpi (şerit 1-8). Üst panel, yaprak ekstrelerinde hGAD65mut batı leke (kulvar başına 5 ug TSP) toplandı. Alt paneli, Coomassie ile boyanan denetimi yüklemeden Rubisco'nun büyük alt birim belirgin olduğu . nc = negatif kontrol, sadece pICH20111 5'-modül ve pICH14011 integraz-modülü ile sızmış bitkiler. Sayılar kDa molekül ağırlıklı işaretleyici göstermektedir. PC = pozitif kontrol, Bakulovirüs / böcek hücresi sistemi ile üretilmiş ticari hGAD65 15 ng. (E) N. Kararlı sentezleme Tabacum bitkiler. Yaprak numuneleri farklı T5 bitkiler (kulvarlar 1-11) elde edilmiştir. Üst panel, yaprak ekstrelerinde hGAD65mut batı leke (kulvar başına 5 ug TSP). Alt panel, yükleme kontrolü w lekelii Coomassie. nc negatif kontrol, vahşi tip bitkiler =. Sayılar kDa molekül ağırlıklı işaretleyici göstermektedir. PC = pozitif kontrol, Bakulovirüs / böcek hücresi sistemi ile üretilmiş ticari hGAD65 15 ng. (F), N. Kararlı sentezleme Tabacum bitkiler. Türetilen birçok nesiller boyunca hGAD65mut birikiminin Boxplot temsil DEA verilerinden hesaplanan ug / g flw olarak rapor hGAD65mut T1 transgenik tütün bitkisi performans en iyi şekilde. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| Sistem | [HGAD65mut] (ug / ml) | [HGAD65mut] |
| Bakülo / böcek | 117.5 ± 7.7 | 11.8 ± 0.8 ug / ml kültür ortamı |
| Transient | 22.6 ± 0.9 | 67.8 ± 2.7 ug / g FLW |
| MagnICON | 26.3 ± 5.9 | 78.8 ± 17.8 mg / g FLW |
| Elit T6 | 33.0 ± 3.8 | 99.1 ± 11.3 ng / g FLW |
Tablo 1: - fermenterler-tabanlı (Bakülo / Böcek) ve bitki-temelli (N. benthamiana pK7WG2- ve MagnICON ve N. tabacum elit T6) hGAD65mut farklı platformlarda hGAD65mut verim verir. İkinci sütun - protein ekstrelerindeki hGAD65mut konsantrasyonu (ug / ml). Üçüncü sütun - Bitki-tabanlı platformlar için ve fermenter-tabanlı platform için hücre kültür ortamında (ug / ml) taze yaprak ağırlığı (mg / g FLW) 'de hGAD65mut içeriği.
Tartışmalar
Bakteriyel hücreler, Bakulovirüs / böcek hücreleri ve bitkiler: Bu çalışmada üç farklı ortam, bir rekombinant insan proteininin sentezlenmesi için karşılaştırıldı. (- MagnICON ve pK7WG2 tabanlı - ve istikrarlı, yani geçici) bitki bazlı bir platform daha üç yaygın olarak kullanılan ifade teknolojilerini istismar tarafından araştırılmıştır. Bu deneyde, hGAD65mut için seçilen hedef protein önceden farklı sistemlerde 13 olarak ifade edildi ve üretim ve işlevselliği kolayca saptanabilir ve 14 ölçülebilir.
HGAD65mut inklüzyon cisimcikleri oluşan çünkü bakteriyel hücreler, böylece zahmetli çözünürlüğünü gerektiren ve yerli yapısını elde etmek için yeniden katlama, hatta düşük sıcaklık koşullarında büyüyen, etkili bir üretim platformu değildi. Gerçekten de, kompleks rekombinant proteinlerin ifadesi için, bu platformun ana yetmezliği, son ürünün doğru konformasyon.
Bakulovirüs / böcek hücresi platformu immünoreaktif yeniden birleştirici proteinin yüksek ifade ettiği, ancak bu ekspresyon sisteminin ana sınırlama böcek hücreleri büyütmek için gerekli kültür ortamı, yüksek maliyeti vardır. Bu hGAD65mut 1 g için toplam üretim maliyeti (gerekli böcek hücre kültür ortamı 9 L dikkate alınarak) bu üretim platformu 700 € ulaşabileceğini tahmin edilmiştir. Bu ifade platformunun bir diğer sınırlaması aseptik manipülasyon becerileri ile personel gerektirir böcek hücrelerinin steril ekimi, ihtiyaç vardır. Hücrelerin enfeksiyonu için kullanılır, viral stok hacimleri ve viral enfeksiyonun zamanlama iki kritik parametrelerin dikkatle Bu ekspresyon sistemi içinde kontrol edilmesi gereken etkin rekombinant proteini birikmesini sağlamak. Ayrıca, Sf9 böcek hücrelerinden elde edilen toplam çözünür protein çıkarımı için kullanılan deterjan, büyük ölçüde yeniden birleştirici proteinin çözünürlüğünü etkiler.
Bitki bazlı sistemler en yararlı platfo vardırm hGAD65mut ifade: Bitki yapılan rekombinant protein immunoreaktif ve yaprak dokularında yüksek seviyelerde birikmiş oldu. Farklı bitki bazlı ekspresyon sistemleri karşılaştırıldığında, yüksek verimler stabil transforme edilmiş tütün bitkileri (Tablo 1), elde edildi, N'ye göre tütün toplam biyomas dikkate halinde geçici ekspresyonu için kullanılan benthamiana, tütün tümüyle daha yüksek bir verimlilik belirgindir. Ancak, istikrarlı dönüştürülmüş tütün bitkisi-tabanlı platform ana sınırlama bizim çalışmamızda 20 ay sürdü sistemin set-up için gerekli zamandır. Gerçekten de, bir homozigot hattı yeniden birleştirici protein ekspresyonu homojenlik için seçilmelidir ve soyları yüksek T1 başlayarak, kendi kendine çapraz döngüleri tekrar gerektirebilir. Seçilen T1 transgenik özelliğin birden fazla kopyasını taşıyan zaman, özellikle, ıslah programı 3 yıla kadar sürebilir.
Geçici sentezleme sistemleri sunulannedeniyle dönüşüm ve ifade ve anlatım platformu set-up arasında kısa aralıklarla hızlı yükseltme avantajı 4 gün gerekli. Ancak, bitki-temelli geçici sistemlerin bir sınırlama tarımsal infiltrasyon için özel yüksek-dereceli ekipmanları kullanılmadığı sürece kendi otomasyon laboratuvar ölçeğinde pek uygulanabilir olmasıdır. Bu nedenle, geçici tabanlı sistemler aracılığıyla hGAD65 büyük ölçekli üretim için uygun bir hesaplama burada gerçekleştirilemez. Öte yandan, biz T6 istikrarlı tütün hattı kullanarak rekombinant proteinin 1 g için toplam üretim maliyeti (60 tütün bitkileri yetiştirmek için toprağı dikkate alınarak) az 5 euro hesaplanabilir spekülasyon. (Bitki gelişim aşamasını büyümek ve Agrobacterium infiltrasyon durumu) birçok kritik parametreler dikkatle kontrol edilmelidir verimli agroinfiltration ve protein üretimini sağlamak, daha önce 15 rapor etmek. Bundan başka, her sentezleme için olması gereken belirli bir zaman süreci analizi denemerekombinant proteinin yüksek birikimini izin verir dpi seçmek için seslendirdi.
Burada tartışılan örnek, geleneksel sistemlere göre bitki bazlı üretimin belirli bazı avantajlar vurgular proof-of-prensibi vaka çalışması, kabul edilebilir. Özellikle, homojen rekombinant proteini sentezleyen tütün transgenik çizgiler büyük miktarlarda gerekli olan yeniden birleştirici protein seri üretimi için değerli bir platform olarak kabul edilebilir.
Açıklamalar
The authors declare that there is no conflict of interests regarding the publication of this paper.
Teşekkürler
This work was supported by the COST action ‘Molecular pharming: Plants as a production platform for high-value proteins’ FA0804. The Authors thank Dr Anatoli Giritch and Prof. Yuri Gleba for providing the MagnICON vectors for research purposes.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Yeast extract | Sigma | Y1333 | |
| Tryptone | Formedium | TRP03 | |
| Agar Bacteriological Grade | Applichem | A0949 | |
| Sf-900 II SFM medium | Gibco | 10902-088 | |
| Grace’s Insect Medium, unsupplemented | Gibco | 11595-030 | |
| Cellfectin II Reagent | Invitrogen | 10362-100 | |
| MS medium including vitamins | Duchefa Biochemie | M0222 | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Plant agar | Duchefa Biochemie | P1001 | |
| Ampicillin sodium | Duchefa Biochemie | A0104 | Toxic |
| Gentamycin sulphate | Duchefa Biochemie | G0124 | Toxic |
| Ganciclovir | Invitrogen | I2562-023 | |
| Carbenicillin disodium | Duchefa Biochemie | C0109 | Toxic |
| Kanamycin sulfate | Sigma | K4000 | Toxic |
| Rifampicin | Duchefa Biochemie | R0146 | Toxic – 25 mg/ml stock in DMSO |
| Streptomycin sulfate | Duchefa Biochemie | S0148 | Toxic |
| Spectinomycin dihydrochloride | Duchefa Biochemie | S0188 | |
| IPTG (isopropil-β-D-1-tiogalattopiranoside) | Sigma | I5502 | Toxic |
| MES hydrate | Sigma | M8250 | |
| MgCl2 | Biochemical | 436994U | |
| Acetosyringone | Sigma | D134406 | Toxic – 0.1 M stock in DMSO |
| Syringe (1 ml) | Terumo | ||
| MgSO4 | Fluka | 63136 | |
| BAP (6-Benzylaminopurine) | Sigma | B3408 | Toxic |
| NAA (Naphtalene acetic acid) | Duchefa Biochemie | N0903 | Irritant |
| Cefotaxime | Mylan Generics | ||
| Trizma base | Sigma | T1503 | Adjust pH with 1 N HCl to make Tris-HCl buffer |
| HCl | Sigma | H1758 | Corrosive |
| NaCl | Sigma | S3014 | 1 M stock |
| KCl | Sigma | P9541 | |
| Na2HPO4 | Sigma | S7907 | |
| KH2PO4 | Sigma | P9791 | |
| PMSF (Phenylmethanesulfonylfluoride) | Sigma | P7626 | Corrosive, toxic |
| Urea | Sigma | U5378 | |
| β-mercaptoethanol | Sigma | M3148 | Toxic |
| Tween-20 | Sigma | P5927 | |
| Hepes | Sigma | H3375 | |
| DTT (Dithiothreitol) | Sigma | D0632 | Toxic – 1 M stock, store at -20 °C |
| CHAPS | Duchefa Biochemie | C1374 | Toxic |
| Plant protease inhibitor cocktail | Sigma | P9599 | Do not freeze/thaw too many times |
| SDS (Sodium dodecyl sulphate) | Sigma | L3771 | Flammable, toxic, corrosive – 10% stock |
| Glycerol | Sigma | G5516 | |
| Brilliant Blue R-250 | Sigma | B7920 | |
| Isopropanol | Sigma | 24137 | Flammable |
| Acetic acid | Sigma | 27221 | Corrosive |
| Anti-Glutamic acid decarboxylase 65/67 | Sigma | G5163 | Do not freeze/thaw too many times |
| Horseradish peroxidase (HRP)-conjugate anti-rabbit antibody | Sigma | A6154 | Do not freeze/thaw too many times |
| Sf9 Cells | Life Technologies | 11496 | |
| BL21 Competent E. coli | New England Biolabs | C2530H | |
| Protein A Sepharose | Sigma | P2545 | |
| Cell culture plates | Sigma | CLS3516 | |
| Radio Immuno Assay kit | Techno Genetics | 12650805 | Radioactive material |
Referanslar
- Hampe, C. S., Hammerle, L. P., Falorni, A., Robertson, J., Lernmark, A. Site-directed mutagenesis of K396R of the 65 kDa glutamic acid decarboxylase active site obliterates enzyme activity but not antibody binding. FEBS Lett. 488 (3), 185-189 (2001).
- Avesani, L., et al. Recombinant human GAD65 accumulates to high levels in transgenic tobacco plants when expressed as an enzymatically inactive mutant. Plant Biotechnol. J. 9 (8), 862-872 (2010).
- Sambrook, J., et al. . Molecular Cloning: A laboratory manual. Second Edition. , (1989).
- Avesani, L., et al. Comparative analysis of different biofactories for the production of a major diabetes autoantigen. Transgenic Res. 23, 281-291 (2014).
- Marillonnet, S., Giritch, A., Gils, M., Kandzia, R., Klimyuk, V., Gleba, Y. In planta engineering of viral RNA replicons: efficient assembly by recombination of DNA modules delivered by Agrobacterium. Proc. Natl. Acad. Sci. (USA). 101 (18), 6852-6857 (2004).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants). Curr. Opin. Biotechnol. 18, 134-141 (2007).
- Engler, C., Kandzia, R., Marillonnet, S. A one pot, one step, precision cloning method with high throughput capability. PLoS One. 3 (11), (2008).
- Xu, R., Li, Q. Q. Protocol: streamline cloning of genes into binary vectors in Agrobacterium via the Gateway TOPO vector system. Plant Methods. 4 (4), 1-7 (2008).
- Fairbanks, G., Steck, T. L., Wallach, D. F. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606-2617 (1971).
- Falorni, A., et al. Radioimmunoassay detects the frequent occurrence of autoantibodies to the Mr 65,000 isoform of glutamic acid decarboxylase in Japanese insulin-dependent diabetes. Autoimmunity. 19, 113-125 (1994).
- Hunt, I. From gene to protein: a review of new and enabling technologies for multi-parallel protein expression. Protein Expr. Purif. 40 (1), 1-22 (2005).
- Arzola, L., et al. Transient co-expression of post-transcriptional silencing suppressor for increased in planta expression of a recombinant anthrax receptor fusion protein. Int. J. Mol. Sci. 12 (8), 4975-4990 (2011).
- Merlin, M., Gecchele, E., Capaldi, S., Pezzotti, M., Avesani, L. Comparative evaluation of recombinant protein production in different biofactories: the green perspective. Biomed. Res. Int. 2014, 136419 (2014).
- Avesani, L., et al. Improved in planta expression of the human islet autoantigen glutamic acid decarboxylase (GAD65). Transgenic Res. 12 (2), 203-212 (2003).
- Leuzinger, K., et al. Efficient agroinfiltration of Plants for high-level transient expression of recombinant proteins. J Vis Exp. (77), (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır