Method Article
Uma análise comparativa de Expressão de proteínas recombinantes em Diferentes biofábricas: bactérias, células de insectos e Sistemas de Plantas
Neste Artigo
Resumo
In this study the expression of a target human recombinant protein in different production platforms was compared. We focused on traditional fermenter-based cultures and on plants, describing the set-up of each system and highlighting, on the basis of the reported results, the inherent limits and advantages for each platform.
Resumo
Sistemas baseados em plantas são consideradas uma plataforma valiosa para a produção de proteínas recombinantes, como resultado do seu potencial bem documentado para a produção flexível, de baixo custo de elevada qualidade, produtos bioactivos.
Neste estudo, comparou-se a expressão de uma proteína recombinante humana alvo em culturas tradicionais baseados em fermentador de células bacterianas (e de insectos) com os sistemas de expressão à base de plantas, tanto transitórios e estáveis.
Para cada plataforma, foi descrita a configuração, o comprimento e optimização do processo de produção, a qualidade do produto final e os rendimentos e avaliou-se os custos de produção provisórias, específicos para a proteína recombinante alvo seleccionado.
Em geral, os nossos resultados indicam que as bactérias são inadequadas para a produção da proteína alvo, devido à sua acumulação no interior de corpos de inclusão insolúveis. Por outro lado, os sistemas à base de plantas são versáteis t plataformaschapéu permitir a produção da proteína seleccionada a custos mais baixos do que Baculovirus sistema de célula de insecto /. Em particular, linhas transgénicas estáveis demonstraram o mais alto rendimento, do produto final e transientes plantas que expressam o processo mais rápido de desenvolvimento. No entanto, nem todas as proteínas recombinantes podem beneficiar de sistemas à base de plantas, mas a melhor plataforma de produção deve ser determinada empiricamente com uma abordagem caso a caso, conforme descrito aqui.
Introdução
Recombinant proteins are commercially mass-produced in heterologous expression systems with the aid of emerging biotechnology tools. Key factors that have to be considered when choosing the heterologous expression system include: protein quality, functionality, process speed, yield and cost.
In the recombinant protein field, the market for pharmaceuticals is expanding rapidly and, consequently, most biopharmaceuticals produced today are recombinant. Proteins can be expressed in cell cultures of bacteria, yeasts, molds, mammals, plants and insects, as well as in plant systems (either via stable- or transient-transformation) and transgenic animals; each expression system has its inherent advantages and limitations and for each target recombinant protein the optimal production system has to be carefully evaluated.
Plant-based platforms are arising as an important alternative to traditional fermenter-based systems for safe and cost-effective recombinant protein production. Although downstream processing costs are comparable to those of microbial and mammalian cells, the lower up-front investment required for commercial production in plants and the potential economy of scale, provided by cultivation over large areas, are key advantages.
We evaluated plants as bioreactors for the expression of the 65 kDa isoform of human glutamic acid decarboxylase (hGAD65), one of the major autoantigen in Type 1 autoimmune diabetes (T1D). hGAD65 is largely adopted as a marker, both for classifying and monitoring the progression of the disease and its role in T1D prevention is currently under investigation in clinical trials. If these trials are successful, the global demand for recombinant hGAD65 will increase dramatically.
Here, we focus on the expression of the enzymatically inactive counterpart of hGAD65, hGAD65mut, a mutant generated by substituting the lysine residue that binds the cofactor PLP (pyridoxal-5'-phosphate) with an arginine residue (K396R)1.
hGAD65mut retains its immunogenicity and, in plant and insect cells, accumulates up to ten-fold higher than hGAD65, its wild-type counterpart. It was hypothesized that the enzymatic activity of hGAD65 interferes with plant cell metabolism to such an extent that it suppresses its own synthesis, whereas hGAD65mut, the enzymatically-inactive form, can be accumulated in plant cells to higher levels.
For the expression of hGAD65mut, the use of different technologies, widely used in plant biotechnology, was explored here and compared to traditional expression platforms (Escherichia coli and Baculovirus/insect cell-based).
In this work, the recombinant platforms developed for the expression of hGAD65mut comprising traditional and plant-based systems were reviewed and compared on the basis of process speed and yield, and of final product quality and functionality.
Protocolo
1. Construção de Vectores de Expressão
- Comercial sistema de recombinação de clonagem:
- Amplificar a sequência de comprimento total do gene alvo (hGAD65mut) com iniciadores adequados permitindo a adição de um grampo CACC na extremidade 5 'do gene, como descrito anteriormente 2.
- Clonar o produto de amplificação purificado em gel, de acordo com as especificações do kit de clonagem direccional, no vector de entrada (topoisomerase ligado) por reunião de reacção num volume total de 6 ul, usando de 1,5: 1 razão molar de inserção: vector e 1 ul de solução de sal (NaCl 0,2 M e 0,01 MgCl2). Incubar durante 5 min à temperatura ambiente (RT).
- Transformar toda a reacção em E. quimicamente competente células de E. coli de acordo com as especificações do kit de clonagem direccional e tela colónias obtidas por PCR de colónias, utilizando 3 M13 iniciadores directos e inversos que acompanha o kit de clonagem direccional. Isolar o plasmídeo a partir de um pocolônia sitive acordo com as especificações de plasmídeos de preparação DNA do kit e seqüência da inserção utilizando M13 direta e inversa primers para garantir a ausência de mutações 3.
- Usar o clone de entrada obtida para realizar a reacção de recombinação pelo Lambda II enzima recombinase clonase (LR) com vectores de destino específicos: para a expressão da proteína recombinante em células bacterianas com pDEST17 (produzindo pDEST17.G65mut), em plantas (transitórios ou estáveis) com pK7WG2 (rendendo pK7WG2.G65mut), em Baculovirus sistema de células de insectos / com o DNA viral linear (rendendo Baculo.G65mut) 4. Montar a reacção, de acordo com as especificações do kit clonase, com 100 ng de vector de entrada, de 150 ng de vector de destino e 2 ul de mistura de enzimas num volume final de 10 ul. Incubar a mistura à TA durante 1 h.
- Transformar o produto de recombinação em E. quimicamente competente células de E. coli de acordo com as especificações do kit clonase. Tela colónias obtidas por PCR 3 usando para todas as reacções de transformação colônias derivadas da mesma cartilha reverter GAD65mut específico do 'os seguintes vetores de destino primers específicos para a frente e para: pDEST17: 5'-TAATACGACTCACTATAGGG-3 (5'-CACACGCCGGCAGCAGGT-3) "; para pK7WG2: 5'-AAGATGCCTCTGCCGACAGT-3 '; para Baculo linearizado vector: 5'-AAATGATAACCATCTCGC-3 '.
- Isolar o DNA de plasmídeo de ADN utilizando um kit comercial e minipreparação confirmar a presença da sequência alvo através de PCR 3, utilizando as mesmas combinações de iniciadores específicos descritos na etapa anterior.
- Use os plasmídeos por PCR positivos obtidos para transformar diferentes organismos alvo, dependendo da plataforma escolhida para expressão da proteína recombinante tal como descrito nas etapas seguintes.
- Sistema MagnICON 5-7:
- Clonar o gene alvo no pICH31070 3'-módulo, como previamente descrito em detalhe 7, obtendo-se pICH31070.G65mut. Use aseguinte ciclo de reacção específica: 30 min de incubação a 37 ° C, 5 min a 50 ° C e depois 5 min a 80 ° C.
2. Recombinante Expressão de Proteína
- Sistema de células de bactérias:
- Transformar pDEST17.G65mut em E. coli BL21 (DE3) electrocompetentes células utilizando técnicas padrão e a tela de colónias crescidas em meio contendo ampicilina (100 ug / ml de meio LB), por colónia de PCR utilizando os iniciadores específicos do transgene seguinte: 5'-CTGGTGCCAAGTGGCTCAGA-3 'e 5' -CACACGCCGGCAGCAGGT-3 ', com uma temperatura de recozimento de 58 ° C e um tempo de alongamento de 20 segundos. Efectua-se a reacção de PCR num volume total de 20 l após a dissolução células bacterianas com uma ponta de plástico no tubo.
- Inocular uma colónia única durante a noite a 37 ° C em 3 ml de contendo ampicilina (100 ug / ml de meio LB).
- Dilui-se a cultura bacteriana de 1: 100 em 100 ml de meio LB fresco (incluindo ampicillem) e incubar a 37 ° C durante 1-6 horas até uma DO final de 600 de 0,8.
- Induzir a expressão da proteína recombinante por adição de isopropil-β-D-1-tiogalattopiranoside (IPTG) a uma concentração final de 1 mM e incuba-se a cultura com agitação vigorosa durante 3 h a 37 ° C.
- Recolher as células por centrifugação a 4000 xg durante 20 min e usar sedimento bacteriano para a extracção de proteína (passo 3.1.1.1).
- Baculovirus / sistema de células de insectos:
- Semente de Spodoptera frugiperda (Sf9), as células em placas de 6 poços (8 x 10 5 células por poço) e lavar duas vezes com 2 ml de não-suplementado Insecto meio de Grace.
- Retirar e substituir o meio gota a gota, com mistura de transfecção (5 jul LR reação recombinante, solução Celfectin 6 ul e 200 ul não suplementadas Insect meio de Grace).
- Incubar as placas a 27 ° C durante 5 h.
- Remover e substituir mistura de transfecção com 2 ml de fresco Sf-900 meio, suplementado com 10% de soro fetal bovino, 10 ng / ml de gentamicina e 100 uM ganciclovir para selecção de clones de baculovírus recombinantes.
- Após incubação durante 96 horas a 27 ° C, recolher médio (estoque viral V1), centrifugar a 4000 xg para remover as células e os detritos grandes e armazenar no escuro a 4 ° C.
- Semente de 1 x 10 6 células Sf9 por cavidade em 2,5 ml de meio Sf-900 contendo 10% de soro fetal bovino, 10 ng / ml de gentamicina e 100 uM ganciclovir e infectar com 100 ul de estoque V1 em todos os poços.
- Incubar as células durante 3 dias a 27 ° C.
- Coletar e meio de centrifugação a 4.000 x g.
- Armazenar o sobrenadante (V2 estoque de título elevado) a 4 ° C.
- Semente de 1 x 10 6 células Sf9 por cavidade em 2,5 ml de meio Sf-900 contendo 10% de soro fetal bovino, 10 ng / ml de gentamicina e 100 uM ganciclovir e infectar com 25 ul de estoque V2 em todos os poços.
- Incubar as células durante 3 dias a 27 ° C.
- Coletar as células por centrifugação a 4.000 xg e usar pellet de células de insectos para extração de proteínas (passo 3.1.2. 1).
- Nicotiana benthamiana sistemas de expressão transiente:
- Crescer N. benthamiana plantas em uma estufa, sob luz natural dentro da faixa de temperatura de 18-23 ° C. Para usar plantas agroinfecção 4-5 semanas de idade.
- Manter plantas agroinfected em uma câmara climatizada a 22 ° C com um 13 hr dia / 11 hr noite fotoperíodo.
- Comercial sistema de recombinação de clonagem:
- Introduzir pK7WG2.G65mut em estirpe de Agrobacterium tumefaciens EHA105 electrocompetentes células como anteriormente descrito 8 e triagem das colónias, cultivadas em meio LB contendo rifampicina (50 ug / ml), estreptomicina (300 ug / mL) e espectinomicina (100 ug / ml) após 2 dias de incubação a 28 ° C, por PCR, de colónias 8 usando os seguintes iniciadores específicos para o transgene: 5'-CATGGTGGAGCACGACACGCT-3 & #8217; e 5'-CACACGCCGGCAGCAGGT-3 ', com uma temperatura de recozimento de 58 ° C e um tempo de alongamento de 50 segundos. Efectua-se a reacção de PCR num volume total de 20 ul.
- Inocular bactérias em 30 ml de meio LB contendo rifampicina (50 ug / ml), estreptomicina (300 ug / mL) e espectinomicina (100 ug / ml) durante dois dias a 28 ° C.
- Recolhe bactérias por centrifugação a 4000 xg durante 20 min e ressuspender o sedimento em 10 ml de tampão de infiltração (10 mM de MES, 10 mM de MgCl2, 100 ^ M de acetosiringona, pH 5,6). Medir o valor de DO 600 e, em seguida, ajustar para 0,9 por diluição com o mesmo tampão.
NOTA: o volume total necessário para se infiltrar em três N. benthamiana plantas é de 30 ml. - Use uma seringa de 2,5 ml sem agulha para se infiltrar na suspensão Agrobacterium em N. benthamiana folhas. Cuidadosa e lentamente injectar painéis de folha com a suspensão a partir da seringa. Se infiltrar três expandiu lbeirais por planta e usar três plantas como triplicados.
NOTA: por motivos de saúde e segurança usar óculos de proteção durante o processo de infiltração. - Recolha agroinfiltrated folhas dois dias após a infecção (dpi) e congelamento em nitrogênio líquido. Loja de tecido de planta a -80 ° C.
- Sistema MagnICON:
- Introduzir os vectores MagnICON - o 'módulo (pICH20111), a 3' do módulo 5 (pICH31070.G65mut), e o módulo de integrase (pICH14011) - em A. tumefaciens estirpe GV3101, utilizando técnicas convencionais. Peneirar os colónias, foram crescidos em meio LB contendo 50 ug / ml de rifampicina e antibiótico apropriado específico do vector (50 ug / ml de carbenicilina e para pICH20111 pICH14011, 50 ug / ml de canamicina para pICH31070), por PCR de colónias, utilizando iniciadores específicos para cada vector.
- Inocular separadamente os três A. Agrobacterium estirpes em 5 ml de meio LB contendo 50 ug / ml de rifampicina e antibiótico específico do vector adequadoe agitar durante a noite a 28 ° C.
- Pellets durante a noite culturas bacterianas por centrifugação a 4.000 xg durante 20 min e ressuspender-los em dois volumes de cultura bacteriana inicial de MES 10 mM (pH 5,5) e MgSO4 10 mM.
- Mistura de volumes iguais de suspensões bacterianas contendo os três vectores e utilizar a mistura de suspensão de seringa infiltração de N. benthamiana folhas. Se infiltrar três folhas expandidas por planta.
- Coletar folhas agroinfiltrated em 4 dpi e congelar em nitrogênio líquido.
- Loja de tecido de planta a -80 ° C.
- Nicotiana tabacum sistema de expressão estável:
- Crescer e manter in vitro de plântulas de N. tabacum (var Sr1.) em meio de cultura de plantas sólido (4,4 g / L de meio Murashige e Skoog - MS - meio incluindo vitaminas, 30 g / L de sacarose, pH 5,8, 7 g / L de agar vegetal) sob condições controladas na câmara climática a 25 ° C com 16 horas de dia / 8 hr / niregime luta.
- Iniciar um pré-cultura de A. Agrobacterium EHA105 abrigando o vector de expressão pK7WG2.G65mut em 5 ml de meio de YEB líquido com os antibióticos apropriados (rifampicina 50 ug / ml, estreptomicina 300 ug / ml, espectinomicina 100 ug / ml) e crescer durante a noite a 28 ° C num conjunto agitador orbital a 200 rpm.
- Use 1 ml da pré-cultura para inocular uma cultura de 50 ml de Agrobacterium em meio YEB mais antibióticos (rifampicina 50 ug / ml, estreptomicina 300 ug / ml, espectinomicina 100 ug / ml) e crescer durante 24 horas, até que a cultura bacteriana é saturado (OD 600 valor de 0,5-1,0).
- Recolhe bactérias por centrifugação a 4000 xg durante 20 min e ressuspender o pellet em 50 ml de meio de cultura liquido para plantas. Repita esta etapa duas vezes para remover completamente antibióticos.
- Tome primeiros saudáveis folhas completamente expandidas in vitro a partir de plantas de tabaco e cortá-los em cerca de 1 cm quadrados.
- Pedaços de folhas de transferênciapara pratos fundos de Petri contendo suspensão bacteriana e deixar no escuro por 20 min.
- Remover pedaços de folhas de suspensão e secar com um papel de filtro estéril.
- Coloque pedaços de folhas com face adaxial (superfície superior da folha) na planta sólido meio de cultura contendo 1,0 mg / ml de 6-benzilaminopurina (BAP) e / ácido acético naftaleno ml 0,1 mg (NAA) e incubar as placas para dois dias em uma câmara climática a controlada condições (25 ° C, 16 h dia / noite de 8 h).
- Pedaços de folhas de transferência para meio de cultura sólido (incluindo 1,0 ug / ml de BAP, 0,1 mg / ml de NAA, 500 ug / ml de cefotaxime, 100 ug / ml de canamicina) com a superfície abaxial (superfície inferior da folha) em contacto com o meio.
- Incubar as placas durante 2-3 semanas na câmara climática a 25 ° C com 16 h / 8 h regime dia / noite para induzir a formação de rebentos. Subcultura a cada 2 semanas, transferindo explantes de folhas frescas de meio de cultura de plantas sólido contendo 1,0 mg / ml BAP, 0,1 g / ml NAA, 500ug / ml de cefotaxime e 100 ug / ml de canamicina.
- Quando aparecem rebentos transferi-los para caixas de magenta contendo meio de cultura sólido, incluindo 500 ug / ml de cefotaxime e 100 ug / ml de canamicina para induzir a formação de raízes. Incubar plântulas com 16 horas de dia / noite fotoperíodo de 8 horas a 25 ° C durante 1-2 semanas.
- Quando forma raízes, transferir as plantas ao solo na estufa.
- Colete um pedaço de folha de cada planta e isolar DNA genômico com um kit comercial.
- Detectar a presença do transgene por PCR específica. Use 30 ng de DNA genómico como modelo para a amplificação por PCR utilizando os iniciadores específicos do transgene seguinte: 5'-CTGGTGCCAAGTGGCTCAGA-3 'e 5'-CACACGCCGGCAGCAGGT-3', com uma temperatura de recozimento de 58 ° C e um tempo de alongamento de 20 seg . Efectua-se a reacção de PCR num volume total de 50 ul.
- Analisar o produto de 220 pb por electroforese em gel de agarose a 1% em acetato-EDTA-Tris tampão (TAE) (40 mM Tré, ácido acético 20 mM, e EDTA 1 mM).
- Seleccionam-se plantas transgénicas contendo o gene alvo.
- Colete um pedaço de folha de cada uma planta transgênica selecionado e congelar em nitrogênio líquido imediatamente.
- Prepare extratos de proteínas totais de tecido foliar da planta (passo 3.1.3) e testar cada amostra por western blot, como descrito anteriormente 2 para selecionar a melhor proteína recombinante expressando planta do tabaco.
- Mala flores da planta seleccionada melhor desempenho antes de florescer para evitar a polinização cruzada.
- Depois de florescer, o amadurecimento dos frutos e secagem de sementes, coletar sacos.
- Sementes separado do joio e armazená-los em um quarto seco com temperatura controlada (20-24 ° C).
- Semear as sementes secas para produzir as plantas transgênicas de segunda geração e, posteriormente, selecionar o melhor desempenho da planta a ser auto-polinização.
- Repetir o mesmo procedimento descrito nos passos 2.4.19-2.4.21 para as gerações subsequentes.
3. Análises de expressão recombinantes Proteína
- Extração de proteínas:
- As células bacterianas:
- Ressuspender o sedimento celular bacteriana, recolhidas como descrito no passo 2.1.5, em metade do volume de cultura de solução salina tamponada com Tris (TBS - 2 mM de Tris / HCl, NaCl 500 mM) pH 7,4 complementado com 1 mM de phenylmethanesulfonylfluoride (PMSF).
- Sonicate ressuspenso pellet celular três vezes por 40 segundos a metade da potência, mantendo amostra no gelo.
- Clarificar o lisado por centrifugação a 14.000 xg durante 20 min a 4 ° C.
- Transferir o sobrenadante para um tubo limpo e armazenar tanto sobrenadante e pelete separadamente a -80 ° C.
- Solubiliza-se os corpos de inclusão, recolhidos no sedimento, em metade do volume de lisado celular de TBS, pH 8,0 suplementado com ureia 6 M por agitação vigorosa durante a noite à temperatura ambiente.
- Centrifuga-se a 10000 xg durante 25 min à temperatura ambiente e recolher o sobrenadante num limpotubo.
- Armazenar ambos o sobrenadante e sedimento a -80 ° C.
- Células de inseto:
- Lavar sedimento de células infectadas de insectos, recolhidas como descrito no passo 2.2.12, com 1 ml de solução salina tamponada com fosfato (PBS - 137 mM de NaCl, 2,7 mM KCl, 10 mM de Na 2 HPO 4, 1,8 mM de KH 2 PO 4), pH 7,4.
- Ressuspender as células em 200 ul de tampão de lise (20 mM Tris / HCl pH 8,0, 0,5 M de NaCl, 3 mM β-mercaptoetanol e 1% de Tween-20) e incubar em gelo durante 30 min.
- Centrifugar as células solubilizadas a 14.000 xg durante 20 min a 4 ° C.
- Recolha frações e loja solúveis à temperatura de -80 ° C e descartar o pellet.
- Tecido foliar da planta:
- N. Moer ou N. benthamiana tecido tabacum para pó fino em azoto líquido usando almofariz e pilão.
- Homogeneizar 100 mg de tecido triturado em 300 ul de tampão de extracção (Hepes 40 mM pH 7,9, DTT 5 mM, 1,5% de CHAPS), supplemented com 3 l de inibidor de protease cocktail e descongelar no gelo.
NOTA: a proporção seleccionada entre o peso de tecido de planta (g) para tamponar o volume (ml) é de 1: 3. - Extracto Centrifugar a 30.000 xg durante 30 min a 4 ° C.
- Recolher o sobrenadante num tubo limpo e armazenar a -80 ° C.
- As células bacterianas:
- Coloração com Coomassie de gel:
- Prepare uma diluição adequada de extractos de proteína total (por exemplo, 2 ul de extracto de plantas, 5 pi de extractos bacterianos e de insecto) para um volume final de 10 ul de tampão de extracção e adicionar 5 uL de tampão de amostra de 3x (1,5 M Tris / HCl pH 6,8, 3% de SDS, 15% glicerol, 4% β-mercaptoetanol) para uma concentração final de 1x.
- Amostras ferver por 10 min.
- Proteínas Separados por 10% SDS-PAGE.
- Após a electroforese, o gel de calor na presença de uma solução de Coomassie (0,05% Brilliant Blue R-250, 25% de isopropanol, 10% de ácido acético) em um forno de microondas durante cerca de dois minutoss até o ponto de ebulição.
- Refresque-se gel à temperatura ambiente com agitação suave.
- Descartar Coomassie solução de coloração A.
- Destain gel por aquecimento na presença de Coomassie solução B (0,05% Brilliant Blue R-250, 25% de isopropanol), C (10% de ácido acético) (0,002% Brilliant Blue R-250, ácido acético a 10%) e D de cada vez seguindo o mesmo protocolo para a coloração.
- Após a última etapa de aquecimento com a solução D, deixar de descoloração gel até o fundo é claro 9.
- A análise de Western blot:
- Após a electroforese, a transferência de proteínas para uma membrana de nitrocelulose utilizando técnicas standard e bloco com 4% de leite separado em PBS, pH 7,4 à temperatura ambiente durante 1 h.
- Incubar a blot durante a noite a 4 ° C ou durante 4 horas à temperatura ambiente, na solução de bloqueio contendo o anticorpo primário de coelho criados contra a proteína alvo em 1: 10.000 e suplementado com 0,1% de Tween-20.
- Depois de etiqueta de anticorpo primárioção, lava-se a membrana 3 vezes durante 5 min cada com solução de bloqueio contendo 0,1% de Tween-20.
- Incubar com peroxidase de rábano (HRP) anticorpo anti-coelho -conjugate a 1: 10.000, durante 1,5 h.
- Lavar a membrana cinco vezes durante 5 min cada com PBS-T (PBS suplementado com 0,1% de Tween-20).
- Processar western blot utilizando o substrato de peroxidase quimioluminescente.
- Técnica de radioimunoensaio (RIA):
- Deixar os reagentes (anti-soro, e traçador de proteína A-Sepharose) a atingir a temperatura ambiente e pipeta de 20 uL de amostras de extractos de proteína e normas em diferentes concentrações (de 300-2,400 ng / ml de recombinante comercial hGAD65) em tubos de poliestireno 12 x 75 mm.
- Adicionar 20 ul de anti-soro, preparada diluindo 1:30 a partir do soro de um paciente plasmaferese DM1.
- Adicionar 50 ul de marcador (125-I-GAD65) e incubar durante 2 horas à temperatura ambiente. Definir um tubo com marcador apenas para estimar a actividade total.
- Adicionar 50 ulde proteína A Sepharose e incubação durante 1 h à temperatura ambiente.
- Repartir 1 ml de tampão PBS frio a cada tubo e centrifugar a 1500 xg, a 4 ° C durante 30 min.
- Decantar os tubos para remover o sobrenadante e absorver o líquido residual sobre papel absorvente batendo suavemente tubo.
- Medida imunoprecipitada radioactividade em todos os tubos por contagem durante 1 min num contador gama.
- Lote em escala logarítmica das taxas de ligação (B / T%) dos calibradores relacionados com a actividade total, para estabelecer a curva padrão e ler concentração GAD de amostras fora da curva de calibração 10.
NOTA: Concurso áreas deve ser projetado para o armazenamento, manuseio e descarte de material radioativo.
Resultados
Um desenho experimental para a expressão heteróloga de uma proteína alvo recombinante em diferentes sistemas de produção está descrito aqui. O primeiro foco foi a configuração das diferentes plataformas, estabelecendo as condições óptimas para a expressão da proteína alvo em cada sistema.
A expressão da proteína alvo, hGAD65mut, foi induzida em triplicado E. culturas de E. coli. Após 3 h de expressão a 37 ° C, as células bacterianas foram recolhidas por centrifugação e lisadas por sonicação. Após um passo de centrifugação, as proteínas solúveis foram separadas a partir de corpos de inclusão insolúveis e análises iniciais demonstraram que hGAD65mut acumulado prevalentemente em corpos de inclusão insolúveis (dados não mostrados). Solubilização da proteína recombinante necessária a utilização de ureia 6 M, que, para as suas fortes propriedades de desnaturação, interfere com a análise RIA, tornando impossível uma quantificação adequada de hGAD65mut. Diversas estratégias têm seen relatado para limitar a formação de corpos de inclusão, compreendendo o crescimento das células microbianas a baixa temperatura 11. As culturas foram crescidas a 15 ° C e 20 ° C, e a expressão da proteína recombinante foi induzida às mesmas temperaturas. Como mostrado na Figura 1A, a solubilização de hGAD65mut produzido em ambas as temperaturas, de novo requer ureia (pistas S2). Assim, as baixas temperaturas nesta experiência não impedem hGAD65mut a formação de agregados insolúveis.
Os vectores de baculovírus contendo a sequência hGAD65mut (Baculo.G65mut) foi expresso em culturas de células Sf9 aderentes. Stocks de título elevado V1 e V2 foram preparados e as condições de infecção com melhor desempenho foram criadas avaliar diferentes volumes de ações virais 5-50 ul. Como mostrado na Figura 1B, o volume óptimo estoque viral foi identificado como 25 ul, obtendo-se 11,8 ± 0,8 ug de proteína recombinante por ml de meio de cultura, tal como avaliado por RIAanálise (Tabela 1).
Seguindo infiltração, análise de curso de tempo de N. agroinfected benthamiana folhas foi efectuada em dois sistemas de expressão transiente. Para o sistema baseado em pK7WG2, amostras de folhas foram reunidas diária na gama de 1-5 dpi, proteínas solúveis totais (TSP) foram extraídas e quantidades iguais de TSP foram analisados por Western blot (Figura 1C). Esta análise destacou que o acúmulo máximo de proteína recombinante alvo é atingido 2 dpi. Portanto, as folhas foram colhidas 2 ppp e os extractos de proteína foram analisadas por RIA para a medição da acumulação de proteína recombinante, o que mostra uma média de 67,8 ug / g FLW (peso folha fresca, Tabela 1). Os níveis de expressão de proteínas recombinantes, utilizando este sistema, pode ser ainda melhorado, por co-infiltrando as folhas com um supressor de pós-transcricional do gene silenciador (PTGS) como P19 ou HC Pro 12.
Odetecção mesmo curso de tempo foi levada a cabo com N. benthamiana folhas agroinfected com os vetores MagnICON: folhas infectadas foram coletadas 1-8 quantidades dpi e iguais de TSP foram analisadas por western blot. Esta análise demonstrou que a acumulação máxima de proteína recombinante é obtido 4 dpi (Figura 1D), com uma média de acumulação da proteína recombinante de 78,8 ug / g FLW (Tabela 1), tal como avaliado por RIA.
A expressão de hGAD65mut em plantas de tabaco transgénicas tem sido relatada previamente 12, mostrando que os níveis de proteína recombinante variaram significativamente entre as linhas transformadas independentemente. A planta transgênica hGAD65mut T1 com melhor desempenho foi auto-cruzadas e as plantas derivadas (T2) foram analisados para selecionar novamente o melhor desempenho um. Este procedimento foi repetido ao longo de várias gerações para desenvolver uma plataforma de produção homogénea, verificar o desempenho em cada geração por RIA até que nenhummelhoria adicional foi obtida (dados não mostrados). Na Figura 1E, um western blot representativo de plantas transgénicas T5 é relatado, onde a homogeneidade do rendimento de proteína recombinante é evidente. Como mostrado na Figura 1F, o rendimento médio hGAD65mut aumentada de T2 a T6, atingindo o nível de 99,1 ug / g FLW (Tabela 1) e, durante o processo de selecção, o desvio padrão do nível de expressão diminuiu.
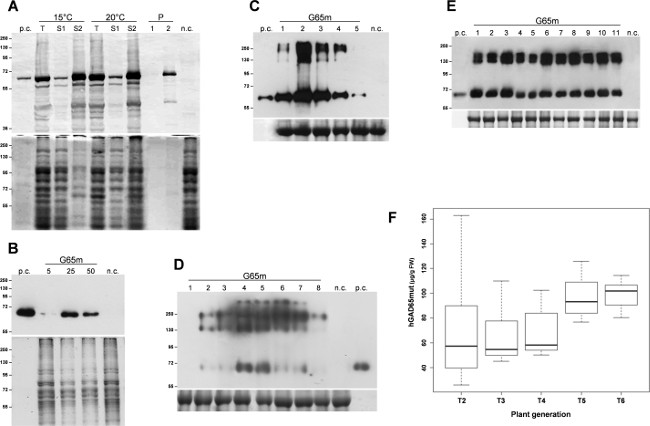
Figura 1:. Platform set-up criação de melhores condições para a expressão hGAD65mut em cada plataforma. (A) E. plataforma de expressão indutível coli. As células bacterianas foram cultivadas a 15 ° C ou 20 ° C. O painel superior, western blot de hGAD65mut em extractos celulares (TSP 2 ug por pista). Face inferior, o carregamento de controlo corados com Coomassie. n.c. = Controlo negativo, as células bacterianas transformadas com o vector contendo o gene pDEST17 cloranfenicol-resistência; T: Total de amostras; S1: Sobrenadante após sonicação e centrifugação; S2 e P: O sobrenadante (1) e Pellet (2) após a centrifugação da amostra solubilizada em tampão contendo ureia. (B) Baculovirus / plataforma de células de insectos. Os seguintes volumes de ações virais foram testados: 5, 25 e 50 ul painel superior, western blot de hGAD65mut em extratos de células (TSP 5 ug por pista) painel Lower, carregando controle corado com Coomassie... nc = controlo negativo, do extracto de células não transformadas de insectos. (C) expressão transiente em N. benthamiana plantas utilizando o vector pK7WG2. As amostras foram coletadas diariamente, 1-5 dpi (pistas 1-5). O painel superior, western blot de hGAD65mut em extratos de folhas (PTS 2,5 g por pista). Painel Lower, carregando controle corado com Coomassie, onde a grande subunidadede Rubisco é evidente. nc = controle negativo, plantas infiltrada com o vector pK7WG2 portador do gene marcador GFP. (D) Expressão transiente em N. benthamiana plantas utilizando vectores MagnICON. As amostras foram coletadas diariamente, 1-8 dpi (pistas 1-8). O painel superior, western blot de hGAD65mut em extratos de folhas (TSP 5 ug por pista). Painel Lower, carregando controle corado com Coomassie onde a grande subunidade da Rubisco é evidente . nc = controle negativo, plantas infiltrada apenas com o 5'-módulo pICH20111 e-module integrase pICH14011. Os números indicam marcador de massa molecular em kDa. pc = controlo positivo, 15 ng de hGAD65 comerciais produzidas no sistema de células de baculovírus / insecto. (E) A expressão estável em N. plantas tabacum. Amostras de folhas foram coletadas de diferentes plantas T5 (pistas 1-11). Painel superior, western blot de hGAD65mut em extratos de folhas (5 TSP ug por pista). Painel inferior, controle de carga manchado wom Coomassie. nc = controle negativo, as plantas do tipo selvagem. Os números indicam marcador de massa molecular em kDa. pc = controlo positivo, 15 ng de hGAD65 comerciais produzidas no sistema de células de baculovírus / insecto. (F) A expressão estável em N. plantas tabacum. Representação Boxplot de acumulação hGAD65mut ao longo de várias gerações derivadas de melhor desempenho hGAD65mut T1 planta do tabaco transgênico relatado como ug / g FLW calculado a partir de dados de RIA. Por favor, clique aqui para ver uma versão maior desta figura.
| Sistema | [HGAD65mut] (ug / ml) | [HGAD65mut] |
| Baculo / insecto | 117,5 ± 7,7 | 11,8 ± 0,8 ug / ml de meio de cultura |
| Transient | 22,6 ± 0,9 | 67,8 ± 2,7 ug / g FLW |
| MagnICON | 26,3 ± 5,9 | 78,8 ± 17,8 ug / g FLW |
| T6 Elite | 33,0 ± 3,8 | 99,1 ± 11,3 ug / g FLW |
Tabela 1: hGAD65mut produz rendimentos hGAD65mut em diferentes plataformas - (Baculo / Insect) à base de fermentação e à base de plantas (pK7WG2- e MagnICON em N. benthamiana e T6 elite em N. tabacum). A segunda coluna - concentração hGAD65mut em extractos de proteína (mg / ml). A terceira coluna, - o conteúdo em peso hGAD65mut folha fresca (g / g FLW) para plataformas baseadas em plantas e em meio de cultura de células (ug / ml) para a plataforma baseada no fermentador.
Discussão
Neste estudo três plataformas diferentes foram comparadas para a expressão de uma proteína humana recombinante: células bacterianas, células de baculovírus / insecto e plantas. A plataforma baseada em plantas foi mais explorado através da exploração de três tecnologias de expressão amplamente utilizados (isto é, transitória - MagnICON e pK7WG2 base - e estáveis). A proteína alvo escolhido para este experimento, hGAD65mut, foi previamente expressos em diferentes sistemas de 13, e sua produção e funcionalidade são facilmente detectáveis e mensuráveis 14.
As células bacterianas não fosse uma plataforma de produção eficaz porque hGAD65mut formado corpos de inclusão, mesmo em condições de crescimento com temperatura baixa, requerendo assim a solubilização e reenrolamento trabalhoso para atingir a sua conformação nativa. Com efeito, o principal falha desta plataforma para a expressão de proteínas recombinantes complexas é a conformação direita do produto final.
OBaculovírus plataforma células / insecto mediada uma expressão elevada da proteína recombinante imunorreactiva, mas a principal limitação deste sistema de expressão é o alto custo do meio de cultura, exige o crescimento de células de insecto. Estima-se que o total de custos de produção de 1 g de hGAD65mut poderia chegar a 700 € nesta plataforma de produção (considerando 9 L de meio de cultura de células de insectos necessário). Uma outra limitação desta plataforma de expressão é a necessidade do cultivo de células de inseto estéril, que exige pessoal com habilidades de manipulação assépticas. Para assegurar a acumulação eficiente de proteínas recombinantes dois parâmetros críticos devem ser cuidadosamente controladas no sistema de expressão: os volumes de reservas virais usados para infectar células e o momento da infecção viral. Além disso, o detergente, utilizado para a extracção da proteína total solúvel a partir de células de insecto Sf9, influencia drasticamente a solubilização da proteína recombinante.
Sistemas à base de plantas foram os platfo mais benéficarm para expressar hGAD65mut: a proteína recombinante fez-planta foi immunoreactive e acumulado em níveis elevados em tecidos foliares. Comparando diferentes sistemas de expressão à base de plantas, os rendimentos mais elevados foram obtidos em plantas de tabaco transformadas estáveis (Tabela 1) e, quando se considera a biomassa total de tabaco, em comparação com N. benthamiana, utilizado para expressão transitória, o aumento da produtividade total do tabaco é evidente. No entanto, a principal limitação da plataforma baseada em plantas de tabaco transformada estável é o tempo necessário para o set-up do sistema, que em nosso estudo levou 20 meses. Com efeito, uma linha homozigótica deve ser seleccionada para a expressão da proteína recombinante homogeneidade e podem requerer a repetição de ciclos de auto-cruzada, a partir da mais alta T1 linhas expressando. Em particular, quando o T1 seleccionado tem mais do que uma cópia da característica transgénica, o programa de melhoramento genético podem levar até 3 anos.
Os sistemas de expressão transiente oferecido avantagem de upscaling rápida devido a um curto intervalo de tempo entre a transformação e expressão eo set-up da plataforma de expressão necessária 4 dias. No entanto, uma limitação dos sistemas transientes à base de plantas é que a sua automação dificilmente é implementável em uma escala de laboratório, a menos que equipamentos de alta qualidade dedicado para agro-infiltração é usado. Assim, um cálculo adequado para a produção em larga escala de hGAD65 utilizar sistemas baseados em transientes não pode ser realizado aqui. Por outro lado, especula-se que o total dos custos de produção para 1 g de proteína recombinante usando T6 linha tabaco estável pode ser calculada em menos de 5 euros (considerando o solo para o cultivo de 60 plantas de tabaco). Para garantir a eficiente produção de proteína agroinfiltração e vários parâmetros críticos devem ser cuidadosamente controlada (estádio de desenvolvimento da planta, e cresce condição infiltração de Agrobacterium), como previamente relatado 15. Além disso, para cada expressão experimentar uma análise específica curso de tempo deve serfeita para selecionar o dpi que permite que a maior acumulação da proteína recombinante.
O exemplo discutido aqui pode ser considerado um estudo de caso de prova de princípio, que destaca algumas das vantagens específicas de produção à base de plantas em relação aos sistemas tradicionais. Em particular, linhas transgénicas de tabaco homogeneamente expressam a proteína recombinante pode ser considerada uma plataforma valiosa para a produção em massa de proteínas recombinantes que são necessários em grandes quantidades-.
Divulgações
The authors declare that there is no conflict of interests regarding the publication of this paper.
Agradecimentos
This work was supported by the COST action ‘Molecular pharming: Plants as a production platform for high-value proteins’ FA0804. The Authors thank Dr Anatoli Giritch and Prof. Yuri Gleba for providing the MagnICON vectors for research purposes.
Materiais
| Name | Company | Catalog Number | Comments |
| Yeast extract | Sigma | Y1333 | |
| Tryptone | Formedium | TRP03 | |
| Agar Bacteriological Grade | Applichem | A0949 | |
| Sf-900 II SFM medium | Gibco | 10902-088 | |
| Grace’s Insect Medium, unsupplemented | Gibco | 11595-030 | |
| Cellfectin II Reagent | Invitrogen | 10362-100 | |
| MS medium including vitamins | Duchefa Biochemie | M0222 | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Plant agar | Duchefa Biochemie | P1001 | |
| Ampicillin sodium | Duchefa Biochemie | A0104 | Toxic |
| Gentamycin sulphate | Duchefa Biochemie | G0124 | Toxic |
| Ganciclovir | Invitrogen | I2562-023 | |
| Carbenicillin disodium | Duchefa Biochemie | C0109 | Toxic |
| Kanamycin sulfate | Sigma | K4000 | Toxic |
| Rifampicin | Duchefa Biochemie | R0146 | Toxic – 25 mg/ml stock in DMSO |
| Streptomycin sulfate | Duchefa Biochemie | S0148 | Toxic |
| Spectinomycin dihydrochloride | Duchefa Biochemie | S0188 | |
| IPTG (isopropil-β-D-1-tiogalattopiranoside) | Sigma | I5502 | Toxic |
| MES hydrate | Sigma | M8250 | |
| MgCl2 | Biochemical | 436994U | |
| Acetosyringone | Sigma | D134406 | Toxic – 0.1 M stock in DMSO |
| Syringe (1 ml) | Terumo | ||
| MgSO4 | Fluka | 63136 | |
| BAP (6-Benzylaminopurine) | Sigma | B3408 | Toxic |
| NAA (Naphtalene acetic acid) | Duchefa Biochemie | N0903 | Irritant |
| Cefotaxime | Mylan Generics | ||
| Trizma base | Sigma | T1503 | Adjust pH with 1 N HCl to make Tris-HCl buffer |
| HCl | Sigma | H1758 | Corrosive |
| NaCl | Sigma | S3014 | 1 M stock |
| KCl | Sigma | P9541 | |
| Na2HPO4 | Sigma | S7907 | |
| KH2PO4 | Sigma | P9791 | |
| PMSF (Phenylmethanesulfonylfluoride) | Sigma | P7626 | Corrosive, toxic |
| Urea | Sigma | U5378 | |
| β-mercaptoethanol | Sigma | M3148 | Toxic |
| Tween-20 | Sigma | P5927 | |
| Hepes | Sigma | H3375 | |
| DTT (Dithiothreitol) | Sigma | D0632 | Toxic – 1 M stock, store at -20 °C |
| CHAPS | Duchefa Biochemie | C1374 | Toxic |
| Plant protease inhibitor cocktail | Sigma | P9599 | Do not freeze/thaw too many times |
| SDS (Sodium dodecyl sulphate) | Sigma | L3771 | Flammable, toxic, corrosive – 10% stock |
| Glycerol | Sigma | G5516 | |
| Brilliant Blue R-250 | Sigma | B7920 | |
| Isopropanol | Sigma | 24137 | Flammable |
| Acetic acid | Sigma | 27221 | Corrosive |
| Anti-Glutamic acid decarboxylase 65/67 | Sigma | G5163 | Do not freeze/thaw too many times |
| Horseradish peroxidase (HRP)-conjugate anti-rabbit antibody | Sigma | A6154 | Do not freeze/thaw too many times |
| Sf9 Cells | Life Technologies | 11496 | |
| BL21 Competent E. coli | New England Biolabs | C2530H | |
| Protein A Sepharose | Sigma | P2545 | |
| Cell culture plates | Sigma | CLS3516 | |
| Radio Immuno Assay kit | Techno Genetics | 12650805 | Radioactive material |
Referências
- Hampe, C. S., Hammerle, L. P., Falorni, A., Robertson, J., Lernmark, A. Site-directed mutagenesis of K396R of the 65 kDa glutamic acid decarboxylase active site obliterates enzyme activity but not antibody binding. FEBS Lett. 488 (3), 185-189 (2001).
- Avesani, L., et al. Recombinant human GAD65 accumulates to high levels in transgenic tobacco plants when expressed as an enzymatically inactive mutant. Plant Biotechnol. J. 9 (8), 862-872 (2010).
- Sambrook, J., et al. . Molecular Cloning: A laboratory manual. Second Edition. , (1989).
- Avesani, L., et al. Comparative analysis of different biofactories for the production of a major diabetes autoantigen. Transgenic Res. 23, 281-291 (2014).
- Marillonnet, S., Giritch, A., Gils, M., Kandzia, R., Klimyuk, V., Gleba, Y. In planta engineering of viral RNA replicons: efficient assembly by recombination of DNA modules delivered by Agrobacterium. Proc. Natl. Acad. Sci. (USA). 101 (18), 6852-6857 (2004).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants). Curr. Opin. Biotechnol. 18, 134-141 (2007).
- Engler, C., Kandzia, R., Marillonnet, S. A one pot, one step, precision cloning method with high throughput capability. PLoS One. 3 (11), (2008).
- Xu, R., Li, Q. Q. Protocol: streamline cloning of genes into binary vectors in Agrobacterium via the Gateway TOPO vector system. Plant Methods. 4 (4), 1-7 (2008).
- Fairbanks, G., Steck, T. L., Wallach, D. F. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606-2617 (1971).
- Falorni, A., et al. Radioimmunoassay detects the frequent occurrence of autoantibodies to the Mr 65,000 isoform of glutamic acid decarboxylase in Japanese insulin-dependent diabetes. Autoimmunity. 19, 113-125 (1994).
- Hunt, I. From gene to protein: a review of new and enabling technologies for multi-parallel protein expression. Protein Expr. Purif. 40 (1), 1-22 (2005).
- Arzola, L., et al. Transient co-expression of post-transcriptional silencing suppressor for increased in planta expression of a recombinant anthrax receptor fusion protein. Int. J. Mol. Sci. 12 (8), 4975-4990 (2011).
- Merlin, M., Gecchele, E., Capaldi, S., Pezzotti, M., Avesani, L. Comparative evaluation of recombinant protein production in different biofactories: the green perspective. Biomed. Res. Int. 2014, 136419 (2014).
- Avesani, L., et al. Improved in planta expression of the human islet autoantigen glutamic acid decarboxylase (GAD65). Transgenic Res. 12 (2), 203-212 (2003).
- Leuzinger, K., et al. Efficient agroinfiltration of Plants for high-level transient expression of recombinant proteins. J Vis Exp. (77), (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados