Method Article
Un'analisi comparativa di espressione della proteina ricombinante in diversi biofabbriche: batteri, cellule di insetto e impianti
In questo articolo
Riepilogo
In this study the expression of a target human recombinant protein in different production platforms was compared. We focused on traditional fermenter-based cultures and on plants, describing the set-up of each system and highlighting, on the basis of the reported results, the inherent limits and advantages for each platform.
Abstract
Sistemi a base vegetale sono considerati una valida piattaforma per la produzione di proteine ricombinanti come risultato della loro potenziale ben documentata per la produzione flessibile, a basso costo di alta qualità, prodotti bioattivi.
In questo studio, abbiamo confrontato l'espressione di una proteina ricombinante umana bersaglio nelle culture tradizionali basati fermentatori cellule (batteriche e insetti) con sistemi di espressione a base vegetale, sia transitori e stabili.
Per ogni piattaforma, abbiamo descritto il set-up, ottimizzazione e durata del processo di produzione, la qualità del prodotto finale e le rese e abbiamo valutato i costi di produzione provvisori, specifici per la proteina ricombinante bersaglio selezionato.
Nel complesso, i nostri risultati indicano che i batteri non sono adatti per la produzione della proteina bersaglio a causa della sua accumulo all'interno corpi di inclusione insolubili. D'altro canto, i sistemi a base vegetale sono piattaforme versatili tcappello permettono la produzione della proteina selezionato a bassi costi di-Baculovirus / sistema cellulare di insetto. In particolare, le linee transgeniche stabili visualizzati il massimo rendimento del prodotto finale e le piante che esprimono transitori sviluppo del processo più veloce. Tuttavia, non tutte le proteine ricombinanti possono beneficiare di sistemi a base vegetale, ma la migliore piattaforma di produzione dovrebbero essere determinati empiricamente con un approccio caso per caso, come descritto qui.
Introduzione
Recombinant proteins are commercially mass-produced in heterologous expression systems with the aid of emerging biotechnology tools. Key factors that have to be considered when choosing the heterologous expression system include: protein quality, functionality, process speed, yield and cost.
In the recombinant protein field, the market for pharmaceuticals is expanding rapidly and, consequently, most biopharmaceuticals produced today are recombinant. Proteins can be expressed in cell cultures of bacteria, yeasts, molds, mammals, plants and insects, as well as in plant systems (either via stable- or transient-transformation) and transgenic animals; each expression system has its inherent advantages and limitations and for each target recombinant protein the optimal production system has to be carefully evaluated.
Plant-based platforms are arising as an important alternative to traditional fermenter-based systems for safe and cost-effective recombinant protein production. Although downstream processing costs are comparable to those of microbial and mammalian cells, the lower up-front investment required for commercial production in plants and the potential economy of scale, provided by cultivation over large areas, are key advantages.
We evaluated plants as bioreactors for the expression of the 65 kDa isoform of human glutamic acid decarboxylase (hGAD65), one of the major autoantigen in Type 1 autoimmune diabetes (T1D). hGAD65 is largely adopted as a marker, both for classifying and monitoring the progression of the disease and its role in T1D prevention is currently under investigation in clinical trials. If these trials are successful, the global demand for recombinant hGAD65 will increase dramatically.
Here, we focus on the expression of the enzymatically inactive counterpart of hGAD65, hGAD65mut, a mutant generated by substituting the lysine residue that binds the cofactor PLP (pyridoxal-5'-phosphate) with an arginine residue (K396R)1.
hGAD65mut retains its immunogenicity and, in plant and insect cells, accumulates up to ten-fold higher than hGAD65, its wild-type counterpart. It was hypothesized that the enzymatic activity of hGAD65 interferes with plant cell metabolism to such an extent that it suppresses its own synthesis, whereas hGAD65mut, the enzymatically-inactive form, can be accumulated in plant cells to higher levels.
For the expression of hGAD65mut, the use of different technologies, widely used in plant biotechnology, was explored here and compared to traditional expression platforms (Escherichia coli and Baculovirus/insect cell-based).
In this work, the recombinant platforms developed for the expression of hGAD65mut comprising traditional and plant-based systems were reviewed and compared on the basis of process speed and yield, and of final product quality and functionality.
Protocollo
1. Costruzione di vettori di espressione
- Commercial sistema clonazione ricombinazione:
- Amplificare la sequenza intera lunghezza del gene bersaglio (hGAD65mut) con primers appropriati consenta l'aggiunta di un morsetto CACC al 5'-end del gene come precedentemente descritto 2.
- Clone il prodotto di amplificazione gel purificato, secondo le specifiche del kit clonazione direzionale, nel vettore di ingresso (topoisomerasi vincolata) assemblando la reazione in un volume totale di 6 ml, con un 1,5: 1 molare di inserto rapporto: vettoriale e 1 ml di soluzione di sale (NaCl 0,2 M e 0,01 MgCl 2). Incubare per 5 minuti a temperatura ambiente (RT).
- Trasformare l'intera reazione in chimica competente E. coli secondo le specifiche del kit clonazione direzionali e schermo colonie ottenute da colonia PCR 3, utilizzando M13 avanti e retromarcia primer inclusi nel kit clonazione direzionale. Isolare il plasmide da un pocolonia Privilegiate secondo plasmide preparazione DNA specifiche del kit e la sequenza del inserto con M13 in avanti e reverse primer per garantire l'assenza di mutazioni 3.
- Utilizzare il clone ottenuto ingresso per eseguire la reazione di ricombinazione del Lambda ricombinasi Clonase II Enzyme (LR) con vettori specifici di destinazione: per l'espressione della proteina ricombinante in cellule batteriche con pDEST17 (cedendo pDEST17.G65mut), in piante (transitorie o stabili) con pK7WG2 (cedendo pK7WG2.G65mut), in Baculovirus / sistema cellulare insetto con il DNA virale linearizzato (producendo Baculo.G65mut) 4. Assemblare la reazione, secondo le specifiche del kit clonase, con 100 ng di entrata vettoriale, 150 ng di destinazione vettoriale e 2 ml di miscela enzimatica in un volume finale di 10 pl. Incubare la miscela a temperatura ambiente per 1 ora.
- Trasforma il prodotto ricombinazione in chimicamente competente E. coli secondo le specifiche del kit clonase. Schermo colonie ottenute mediante PCR 3 utilizzando per tutte le reazioni di trasformazione colonie derivate stesso fondo invertire GAD65mut-specifica 'le seguenti specifiche primer avanti vettori di destinazione e: per pDEST17: 5'-TAATACGACTCACTATAGGG-3 (5'-CACACGCCGGCAGCAGGT-3)'; per pK7WG2: 5'-AAGATGCCTCTGCCGACAGT-3 '; per Baculo linearizzato vettore: 5'-AAATGATAACCATCTCGC-3 '.
- Isolare il DNA plasmidico utilizzando un kit commerciale minipreparation DNA e confermare la presenza della sequenza bersaglio di PCR 3, usando le stesse combinazioni di primer specifici descritti nel passaggio precedente.
- Utilizzare i plasmidi PCR-positivi ottenuti per trasformare diversi organismi bersaglio, a seconda della piattaforma scelta per l'espressione della proteina ricombinante, come descritto nelle seguenti procedure.
- Sistema MagnICON 5-7:
- Clone gene bersaglio nel pICH31070 3'-modulo, come precedentemente descritto in dettaglio 7, cedendo pICH31070.G65mut. Utilizzare ilseguente ciclo reazione specifica: 30 min di incubazione a 37 ° C, 5 min a 50 ° C e poi 5 min a 80 ° C.
2. Recombinant Protein Expression
- Sistema cellula batterica:
- Trasforma pDEST17.G65mut in E. coli BL21 (DE3) cellule electrocompetent utilizzando tecniche standard e lo schermo le colonie coltivate su-ampicillina contenente (100 mg / ml) LB-media, da colonia PCR utilizzando i primer seguito specifico transgene: 5'-CTGGTGCCAAGTGGCTCAGA-3 'e 5' -CACACGCCGGCAGCAGGT-3 ', con una temperatura di ricottura di 58 ° C e un tempo di allungamento di 20 sec. Effettuare la reazione PCR in un volume totale di 20 microlitri dopo dissoluzione cellule batteriche con una punta di plastica nel tubo.
- Seminare una singola colonia notte a 37 ° C in 3 ml di ampicillina-contenimento (100 mcg / ml) LB-media.
- Diluire la coltura batterica 1: 100 a 100 ml di fresco medio LB (compresi ampicillin) e incubare a 37 ° C per 1-6 ore fino a OD 600 finale di 0,8.
- Indurre l'espressione della proteina ricombinante mediante aggiunta di isopropil-β-D-1-tiogalattopiranoside (IPTG) ad una concentrazione finale di 1 mM e incubare coltura con vigorosa agitazione per 3 ore a 37 ° C.
- Raccogliere le cellule per centrifugazione a 4.000 xg per 20 minuti e utilizzare pellet batterico per l'estrazione di proteine (punto 3.1.1.1).
- Sistema / cell insetto Baculovirus:
- Seed Spodoptera frugiperda (Sf9) cellule in 6 pozzetti (8 x 10 5 cellule per pozzetto) e lavare due volte con 2 ml di non-integrato Insect medio di Grace.
- Rimuovere e sostituire il supporto goccia a goccia con la miscela di trasfezione (5 ml LR reazione ricombinante, soluzione Celfectin 6 ml e 200 ml non integrato Insect medio di Grace).
- Incubare le piastre a 27 ° C per 5 ore.
- Rimuovere e sostituire la miscela di trasfezione con 2 ml di fresco Sf-900 medie, supplementato con siero bovino fetale al 10%, 10 ug / ml di gentamicina e 100 mM ganciclovir per selezionare cloni ricombinanti Baculovirus.
- Dopo incubazione per 96 ore a 27 ° C, raccogliere medio (V1 magazzino virale), centrifugare a 4000 xg per rimuovere le cellule e detriti di grandi dimensioni e conservare al buio a 4 ° C.
- Seme 1 x 10 6 cellule Sf9 per pozzetto in 2.5 ml Sf-900 terreno contenente siero bovino fetale al 10%, 10 ug / ml di gentamicina e 100 pM ganciclovir ed infettare con 100 ml di V1 magazzino in ogni pozzetto.
- Incubare le cellule per 3 giorni a 27 ° C.
- Raccogliere e medie centrifugare a 4.000 x g.
- Conservare il surnatante (V2 high-titolo azionario) a 4 ° C.
- Seme 1 x 10 6 cellule Sf9 per pozzetto in 2.5 ml Sf-900 terreno contenente siero bovino fetale al 10%, 10 ug / ml di gentamicina e 100 pM ganciclovir ed infettare con 25 ml di V2 stock in ogni pozzetto.
- Incubare le cellule per 3 giorni a 27 ° C.
- Raccogliere le cellule per centrifugazione a 4.000 xg e utilizzare pellet di cellule di insetto per l'estrazione di proteine (punto 3.1.2. 1).
- Nicotiana benthamiana sistemi di espressione transitoria:
- Grow N. piante benthamiana in una serra, sotto la luce naturale all'interno del campo di temperatura 18-23 ° C. Per agroinfection utilizzare 4-5 settimane vecchi impianti.
- Mantenere piante agroinfected in una camera climatica a 22 ° C con 13 hr giorno / 11 hr notte fotoperiodo.
- Commercial sistema clonazione ricombinazione:
- Introdurre pK7WG2.G65mut in Agrobacterium tumefaciens ceppo EHA105 cellule electrocompetent come precedentemente descritto 8 e schermare le colonie, coltivate su terreno LB contenente rifampicina (50 mcg / ml), streptomicina (300 mcg / ml) e spectinomicina (100 mcg / ml) dopo 2 giorni di incubazione a 28 ° C, da colonia PCR 8 utilizzando i seguenti primer specifici transgene: 5'-CATGGTGGAGCACGACACGCT-3 & #8217; e 5'-CACACGCCGGCAGCAGGT-3 ', con una temperatura di ricottura di 58 ° C e un tempo di allungamento di 50 sec. Effettuare la reazione PCR in un volume totale di 20 microlitri.
- Seminare batteri in 30 ml di terreno LB contenente rifampicina (50 mcg / ml), streptomicina (300 mcg / ml) e spectinomicina (100 ug / ml) per due giorni a 28 ° C.
- Raccogliere batteri per centrifugazione a 4.000 xg per 20 min e risospendere pellet in 10 ml di tampone di infiltrazione (10 mM MES, 10 mM MgCl 2, 100 mM acetosyringone, pH 5,6). Misurare il valore OD 600 e quindi regolare a 0,9 diluendo nello stesso tampone.
NOTA: il volume totale necessario per infiltrazione tre N. piante benthamiana è di 30 ml. - Utilizzare una siringa da 2,5 ml senza aghi per infiltrarsi sospensione Agrobacterium in N. benthamiana lascia. Cautela e iniettare lentamente pannelli foglia con la sospensione dalla siringa. Infiltrati tre ampliato lgronda per pianta e utilizzano tre piante triplica.
NOTA: per motivi di salute e di sicurezza indossare protezioni per gli occhi durante il processo di infiltrazione. - Raccogliere agroinfiltrated foglie due giorni dopo l'infezione (dpi) e congelare in azoto liquido. Conservare tessuto vegetale a -80 ° C.
- Sistema MagnICON:
- Introdurre i vettori MagnICON - il 'modulo (pICH20111), il 3' 5 moduli (pICH31070.G65mut), e il modulo integrasi (pICH14011) - in A. tumefaciens ceppo GV3101 utilizzando tecniche standard. Schermo le colonie, cresciute su terreno LB contenente 50 mg / ml rifampicina e appropriato di antibiotici specifici per vettore (50 mg / ml per carbenicillina pICH20111 e pICH14011, 50 mg / ml kanamicina per pICH31070), dalla colonia PCR utilizzando primer specifici per ogni vettore.
- Seminare separatamente le tre A. tumefaciens ceppi in 5 ml di terreno LB contenente 50 mg / ml rifampicina e appropriato di antibiotici specifici per vettoree agitare una notte a 28 ° C.
- Pellet durante la notte colture batteriche per centrifugazione a 4.000 xg per 20 minuti e li risospendere in due volumi della coltura batterica iniziale di 10 mm (MES pH 5.5) e 10 MgSO MM 4.
- Miscelare uguali volumi di sospensioni batteriche contenenti i tre vettori e utilizzare il mix sospensione per siringa infiltrazione di N. benthamiana lascia. Infiltrati tre foglie espanse per pianta.
- Raccogliere le foglie agroinfiltrated a 4 dpi e congelare in azoto liquido.
- Conservare tessuto vegetale a -80 ° C.
- Nicotiana tabacum sistema di espressione stabile:
- Crescere e mantenere piantine in vitro di N. tabacum (Var Sr1.) su un solido terreno di coltura delle piante (4,4 g / L Murashige e Skoog - MS - media tra cui le vitamine, 30 g / L di saccarosio, pH 5,8, 7 g / L impianto agar) in condizioni controllate, in camera climatica a 25 ° C con 16 ore al giorno / 8 ore / niregime ght.
- Avviare un pre-cultura di A. tumefaciens EHA105 ospitare il pK7WG2.G65mut vettore di espressione in 5 ml di terreno YEB liquido con antibiotici appropriati (rifampicina 50 mg / ml, streptomicina 300 mg / ml, spectinomicina 100 mg / ml) e crescere durante la notte a 28 ° C in un set agitatore orbitale a 200 rpm.
- Usare 1 ml di pre-cultura per inoculare una cultura di 50 ml Agrobacterium in mezzo YEB più antibiotici (rifampicina 50 mg / ml, streptomicina 300 mg / ml, spectinomicina 100 mg / ml) e crescere per 24 ore, fino a quando la coltura batterica è saturi (OD 600 valore di 0,5-1,0).
- Raccogliere batteri per centrifugazione a 4.000 xg per 20 min e risospendere pellet in 50 ml di terreno di coltura liquido pianta. Ripetere questo passaggio due volte per rimuovere completamente gli antibiotici.
- Prendere prime foglie completamente sviluppati sani da piante di tabacco in vitro e tagliarle a circa 1 cm quadrati.
- Pezzi di foglia Transferai piatti profondi Petri contenente sospensione batterica e lasciare al buio per 20 min.
- Togliere i pezzi di foglia di sospensione e asciugare su carta da filtro sterile.
- Mettere i pezzi di foglia con lato adaxial (superficie fogliare superiore) su pianta solido terreno di coltura contenente 1,0 mg / ml a 6 benzilaminopurina (BAP) e 0,1 mg / ml di acido acetico naftalene (NAA) e incubare le piastre per due giorni in una camera climatica a controllata condizioni (25 ° C, 16 ore al giorno / 8 ore a notte).
- Pezzi di foglia trasferimento su terreno di coltura solidi (tra cui 1,0 mg / ml BAP, 0.1 mg / ml NAA, 500 mg / ml cefotaxime, 100 mg / ml kanamicina) con la superficie abaxial (superficie inferiore della foglia) in contatto con il prodotto.
- Incubare le piastre per 2-3 settimane in camera climatica a 25 ° C con 16 ore / 8 ore regime giorno / notte per indurre la formazione di sparare. Subculture ogni 2 settimane per il trasferimento di espianti fogliari di fresco mezzo di coltura vegetale solida contenente 1,0 mg / ml BAP, 0.1 mg / ml NAA, 500ug / ml cefotaxime e 100 ug / ml kanamicina.
- Quando germogli sembrano trasferirli scatole Magenta contenenti terreno di coltura solido di cui 500 mg / ml cefotaxime e 100 mg / ml kanamicina per indurre la formazione delle radici. Incubare piantine con 16 ore al giorno / 8 ore a notte fotoperiodo a 25 ° C per 1-2 settimane.
- Quando forma radici, trasferire le piante per il suolo in serra.
- Raccogliere un pezzo del foglio per ogni impianto e isolare il DNA genomico con un kit commerciale.
- Rilevare la presenza del transgene per PCR specifica. Utilizzare 30 ng di DNA genomico come stampo per amplificazione PCR utilizzando i primers specifici transgene seguente: 5'-CTGGTGCCAAGTGGCTCAGA-3 'e 5'-CACACGCCGGCAGCAGGT-3', con una temperatura di ricottura di 58 ° C e un tempo di allungamento di 20 sec . Effettuare la reazione PCR in un volume totale di 50 microlitri.
- Analizzare il prodotto 220 bp mediante elettroforesi su 1% agarosio gel in Tris-acetato-EDTA (TAE) tampone (Tr 40 mmè, 20 mM di acido acetico, e 1 mM EDTA).
- Selezionare piante transgeniche contenenti il gene bersaglio.
- Raccogliere un pezzo foglio da ciascuna pianta transgenica selezionato e congelare in azoto liquido immediatamente.
- Preparare estratti proteici totali di tessuto foglia di pianta (fase 3.1.3) e testare ogni campione mediante analisi western blot come descritto in precedenza 2 per selezionare la migliore proteina ricombinante che esprime pianta del tabacco.
- Fiori Bag del miglior impianto performante selezionato prima della fioritura per evitare l'impollinazione incrociata.
- Dopo la fioritura, la maturazione dei frutti e l'essiccazione di semi, raccogliere sacchi.
- Semi separato dalla pula e conservarle in un luogo asciutto a temperatura controllata (20-24 ° C).
- Seminare i semi essiccati di produrre piante transgeniche di seconda generazione e successivamente selezionare il miglior impianto di prestazioni di essere auto-impollinazione.
- Ripetete la stessa procedura descritta nei passaggi 2.4.19-2.4.21 per le successive generazioni.
3. Analisi Recombinant Protein Expression
- Estrazione di proteine totali:
- Le cellule batteriche:
- Risospendere il pellet di cellule batteriche, raccolti come descritto al punto 2.1.5, nella metà del volume cultura di soluzione salina tamponata con Tris (TBS - 2 mM Tris / HCl, NaCl 500 mm) pH 7.4 integrato con 1 phenylmethanesulfonylfluoride mm (PMSF).
- Sonicare risospeso pellet tre volte per 40 sec a metà potenza, mantenendo campione sul ghiaccio.
- Chiarire lisato mediante centrifugazione a 14.000 xg per 20 min a 4 ° C.
- Trasferire il surnatante in una provetta pulita e conservare sia il surnatante e pellet separatamente a -80 ° C.
- Solubilizzare i corpi di inclusione, raccolti nel pellet, a metà volume del lisato cellulare di TBS pH 8,0 addizionato con 6 M urea ad una forte agitazione per una notte a temperatura ambiente.
- Centrifugare a 10.000 xg per 25 min a temperatura ambiente e raccogliere supernatante in un ambiente pulitotube.
- Conservare sia surnatante e pellet a -80 ° C.
- Cellule di insetto:
- Lavare infettato pellet insetto, raccolti come descritto al punto 2.2.12, con 1 ml di tampone fosfato (PBS - 137 mM NaCl, 2.7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mm KH 2 PO 4) pH 7.4.
- Risospendere le cellule in 200 microlitri di tampone di lisi (20 mM Tris / HCl pH 8,0, 0,5 M NaCl, 3 mM β-mercaptoetanolo e 1% Tween-20) e incubare su ghiaccio per 30 min.
- Centrifugare cellule solubilizzato a 14000 xg per 20 min a 4 ° C.
- Raccogliere frazioni solubili e conservare a -80 ° C e scartare il pellet.
- Foglia Impianto tessuto:
- N. Grind benthamiana o N. tabacum tessuto polvere fine in azoto liquido usando mortaio e pestello.
- Omogeneizzare 100 mg di tessuto a terra in 300 ml di tampone di estrazione (40 mM Hepes pH 7,9, 5 mM DTT, 1,5% CHAPS), supplemented con 3 ml di inibitore della proteasi cocktail e scongelare su ghiaccio.
NOTA: il rapporto selezionato tra peso tessuto vegetale (g) al buffer volume (ml) è 1: 3. - Estratto Centrifugare a 30.000 xg per 30 min a 4 ° C.
- Raccogliere il surnatante in una provetta pulita e conservare a -80 ° C.
- Le cellule batteriche:
- Coomassie gel colorazione:
- Preparare una diluizione appropriata di estratti proteici totali (ad esempio, 2 ml di estratto vegetale, 5 ml di estratti batterici e insetti) ad un volume finale di 10 ml di tampone di estrazione e si aggiungono 5 ml di tampone campione 3x (1,5 M Tris / HCl pH 6,8, 3% SDS, 15% glicerolo, 4% β-mercaptoetanolo) ad una concentrazione finale 1x.
- Campioni bollire per 10 min.
- Proteine separate del 10% SDS-PAGE.
- Dopo l'elettroforesi, il gel di calore in presenza della soluzione di Coomassie A (0,05% Brilliant Blue R-250, 25% di isopropanolo, 10% di acido acetico) in un forno a microonde per circa due minutis fino al punto di ebollizione.
- Raffreddare gel a temperatura ambiente con un leggero scuotimento.
- Eliminare Coomassie soluzione colorante A.
- Gel Decolorare mediante riscaldamento in presenza di Coomassie soluzione B (0,05% Brilliant Blue R-250, 25% isopropanolo), C (10% acido acetico) (0,002% Brilliant Blue R-250, 10% di acido acetico) e D ogni volta seguendo lo stesso protocollo per la colorazione.
- Dopo l'ultimo passaggio di riscaldamento con la soluzione D, lasciare gel decolorante sino sfondo è chiaro 9.
- Occidentale blot:
- Dopo l'elettroforesi, le proteine di trasferimento su una membrana di nitrocellulosa utilizzando tecniche standard e blocco con 4% di latte separato in PBS pH 7,4 a temperatura ambiente per 1 ora.
- Incubare la blot notte a 4 ° C o per 4 ore a temperatura ambiente in soluzione di saturazione contenente coniglio anticorpo primario sollevata contro la proteina bersaglio a 1: 10.000 e integrato con 0,1% di Tween-20.
- Dopo etichetta anticorpo primarioING, lavare la membrana 3 volte per 5 minuti ciascuno con soluzione bloccante contenente 0,1% Tween-20.
- Incubare con perossidasi di rafano (HRP) anticorpi anti-coniglio -conjugate a 1: 10.000 per 1,5 ore.
- Lavare membrana 5 volte per 5 minuti ciascuno con PBS-T (PBS integrato con 0,1% Tween-20).
- Processo Western Blot utilizzando il substrato perossidasi chemiluminescente.
- Radioimmuno assay (RIA):
- Portare i reagenti (antisiero, tracciante e proteine A Sepharose) a temperatura ambiente e pipetta 20 ml di campioni di estratti di proteine e degli standard in diverse concentrazioni (da 300-2,400 ng / ml di commerciale ricombinante hGAD65) in provette di polistirene 12 x 75 millimetri.
- Aggiungere 20 ml di antisiero, preparata diluendo 1:30 il siero di plasmaferesi di un paziente T1D.
- Aggiungere 50 ml di tracciante (125-I-GAD65) e incubare per 2 ore a temperatura ambiente. Impostare un tubo con tracciante solo per valutare l'attività totale.
- Aggiungere 50 mldi proteina A Sepharose e incubare per 1 ora a temperatura ambiente.
- Erogare 1 ml di tampone PBS freddo in ciascuna provetta e centrifugare a 1500 xga 4 ° C per 30 min.
- Decantare le provette per rimuovere il surnatante e assorbire il liquido residuo su carta assorbente picchiettando delicatamente tubo.
- Misura immunoprecipitata radioattività in tutte le provette contando per 1 min in un contatore gamma.
- Terreno in scala logaritmica le tariffe vincolanti (B / T%) dei calibratori connessi all'attività totale, per stabilire la curva standard e leggere la concentrazione GAD dei campioni dalla curva di calibrazione 10.
NOTA: Aree riservate dovrebbero essere progettati per l'archiviazione, la gestione e lo smaltimento di materiale radioattivo.
Risultati
Un disegno sperimentale per l'espressione eterologa di una proteina ricombinante bersaglio in diversi sistemi di produzione è descritto qui. Il primo obiettivo è stato il set-up di diverse piattaforme stabilendo le condizioni ottimali per l'espressione della proteina bersaglio in ciascun sistema.
L'espressione della proteina bersaglio, hGAD65mut, è stata indotta in triplicato E. culture coli. Dopo 3 ore di espressione a 37 ° C, le cellule batteriche sono state raccolte per centrifugazione e lisate per sonicazione. Dopo una fase di centrifugazione, proteine solubili sono state separate dai corpi di inclusione insolubili e analisi iniziali hanno dimostrato che hGAD65mut accumulato prevalentemente in corpi di inclusione insolubili (dati non mostrati). Ricombinante proteina solubilizzazione richiesto l'uso di urea 6 M, che, per le sue forti proprietà di denaturazione, interferisce con l'analisi RIA, rendendo impossibile una corretta quantificazione di hGAD65mut. Diverse strategie sono essereen riportato per limitare la formazione di corpi di inclusione, comprendente crescere le cellule microbiche a bassa temperatura 11. Le colture sono state coltivate a 15 ° C e 20 ° C, e l'espressione della proteina ricombinante è stata indotta alle stesse temperature. Come mostrato nella Figura 1A, il solubilizzazione del prodotto hGAD65mut ad entrambe le temperature, richiede ancora urea (corsie S2). Così, basse temperature in questo esperimento non impediscono hGAD65mut formazione aggregati insolubili.
Vettori Baculovirus che contengono la sequenza hGAD65mut (Baculo.G65mut) è stato espresso in colture di cellule aderenti Sf9. V1 e V2 scorte alto titolo sono stati preparati e le condizioni di infezione più performanti sono stati istituiti valutando diverse disponibilità virali 5-50 ml. Come mostrato nella Figura 1B, lo stock virale del volume ottimale è stato identificato come 25 microlitri, ottenendo 11,8 ± 0,8 mg di proteina ricombinante per ml di terreno di coltura, come valutato mediante RIAanalisi (Tabella 1).
A seguito di infiltrazioni, tempo di analisi corso di N. agroinfected foglie benthamiana stata effettuata nei due sistemi di espressione transiente. Per il sistema basato pK7WG2, campioni di foglie sono stati raggruppati tutti i giorni nella gamma 1-5 dpi, proteine solubili totali (TSP) sono stati estratti e la stessa quantità di TSP sono stati analizzati mediante western blot (Figura 1C). Tale analisi ha evidenziato che l'accumulo massimo di bersaglio proteina ricombinante viene raggiunto 2 dpi. Pertanto, le foglie sono state raccolte 2 dpi e gli estratti proteici sono stati analizzati mediante RIA per misurare l'accumulo della proteina ricombinante, che mostra una media di 67,8 mg / g FLW (peso fresco foglia, Tabella 1). Livelli di espressione della proteina ricombinante, con questo sistema, possono essere ulteriormente migliorate, per co-infiltrandosi le foglie con un soppressore di post-trascrizionale silenziamento genico (PTGS) come P19 o HC Pro 12.
Ilstesso tempo rilevamento portate stata effettuata con N. benthamiana lascia agroinfected con i vettori MagnICON: foglie infette sono stati raccolti 1-8 dpi e la stessa quantità di TSP sono stati analizzati mediante western blot. Questa analisi ha dimostrato che il massimo accumulo proteina ricombinante è ottenuta 4 dpi (Figura 1D), con un accumulo medio della proteina ricombinante di 78,8 mg / g FLW (Tabella 1), come valutato mediante RIA.
L'espressione di hGAD65mut in piante di tabacco transgeniche è stato riportato in precedenza 12, mostrando che i livelli di proteina ricombinante variano in modo significativo tra linee trasformate in modo indipendente. La migliore performance hGAD65mut T1 pianta transgenica è stato auto-incrociate e le piante derivate (T2) sono stati analizzati per scegliere di nuovo la migliore esecuzione di uno. Questa procedura è stata ripetuta per diverse generazioni per sviluppare una piattaforma di produzione omogenea, il controllo della performance in ogni generazione da RIA fino a quando nonulteriore miglioramento è stato ottenuto (dati non mostrati). Nella Figura 1E, una macchia rappresentante occidentale T5 piante transgeniche è riportato, dove l'omogeneità dei rendimenti proteine ricombinanti è evidente. Come mostrato nella Figura 1F, la resa media hGAD65mut aumentato da T2 a T6, raggiungendo il livello di 99,1 mg / g FLW (Tabella 1) e, durante il processo di selezione, la deviazione standard del livello di espressione diminuita.
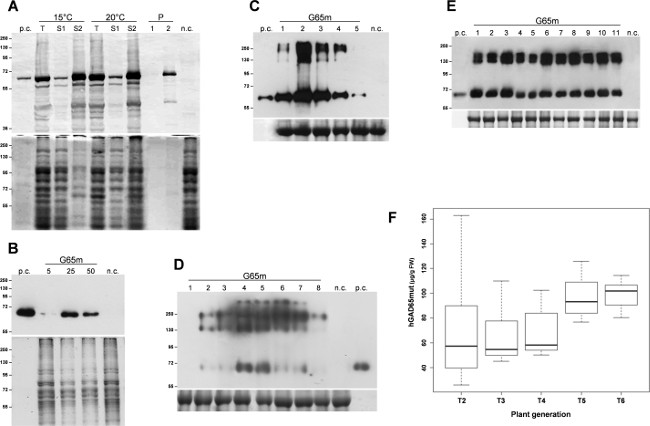
Figura 1:. Platform set-up Set up di migliori condizioni per l'espressione hGAD65mut in ciascuna piattaforma. (A) E. coli piattaforma espressione inducibile. Le cellule batteriche sono state coltivate a 20 ° C. Pannello superiore 15 ° C o, macchia occidentale hGAD65mut in estratti cellulari (2 mg TSP per corsia). Pannello inferiore, caricando il controllo macchiata di Coomassie. n.c. = Controllo negativo, le cellule batteriche trasformate con il vettore contenente il gene pDEST17 cloramfenicolo resistenza; T: Totale campioni; S1: supernatante dopo sonicazione e centrifugazione; S2 e P: Il supernatante (1) e pellet (2) dopo centrifugazione del campione solubilizzati in tampone contenente urea. (B) Baculovirus / piattaforma cellule di insetto. I seguenti disponibilità virali sono stati testati: 5, 25 e 50 ml Pannello superiore, macchia occidentale hGAD65mut in estratti cellulari (5 mcg TSP per corsia) Pannello inferiore, caricando di controllo colorati con Coomassie... nc = controllo negativo, estratto di cellule non trasformate insetti. (C) Transient espressione in N. piante benthamiana utilizzando il vettore pK7WG2. I campioni sono stati raccolti tutti i giorni, 1-5 dpi (corsie 1-5). Il pannello superiore, macchia occidentale hGAD65mut in estratti di foglie (2,5 mg TSP per corsia). Pannello inferiore, caricando di controllo colorati con Coomassie, dove la grande subunitàdi Rubisco è evidente. nc = controllo negativo, piante infiltrato con il vettore pK7WG2 porta il gene marcatore GFP. (D) espressione transiente in N. piante benthamiana utilizzando vettori MagnICON. I campioni sono stati raccolti tutti i giorni, 1-8 dpi (corsie 1-8). Il pannello superiore, macchia occidentale hGAD65mut in estratti di foglie (5 mcg TSP per corsia). Pannello inferiore, caricando di controllo colorati con Coomassie dove la grande subunità di Rubisco è evidente . nc = controllo negativo, piante infiltrato solo con la pICH20111 5'-modulo e pICH14011 integrasi modulo. I numeri indicano marcatore massa molecolare in kDa. = controllo positivo, pc 15 ng di hGAD65 commerciali prodotti nella / sistema cellulare di insetto Baculovirus. (E) l'espressione stabile in N. piante tabacum. Campioni di foglie sono stati raccolti da piante diverse T5 (corsie 1-11). Pannello superiore, macchia occidentale hGAD65mut in estratti di foglie (5 mcg TSP per corsia). Pannello inferiore, di controllo di carico macchiato wesimo Coomassie. nc = controllo negativo, piante wild-type. I numeri indicano marcatore massa molecolare in kDa. = controllo positivo, pc 15 ng di hGAD65 commerciali prodotti nella / sistema cellulare di insetto Baculovirus. (F) espressione stabile in N. piante tabacum. Rappresentazione Boxplot di accumulo hGAD65mut per diverse generazioni derivate da i migliori risultati hGAD65mut T1 piante di tabacco transgeniche segnalato come mcg / g FLW calcolato dai dati RIA. Clicca qui per vedere una versione più grande di questa figura.
| Sistema | [HGAD65mut] (mg / ml) | [HGAD65mut] |
| Baculo / insetto | 117.5 ± 7.7 | 11,8 ± 0,8 mg / ml mezzo di coltura |
| Transient | 22.6 ± 0.9 | 67.8 ± 2.7 mg / g FLW |
| MagnICON | 26.3 ± 5.9 | 78,8 ± 17,8 mg / g FLW |
| T6 Elite | 33.0 ± 3.8 | 99,1 ± 11,3 mg / g FLW |
Tabella 1: hGAD65mut produce rendimenti hGAD65mut in diverse piattaforme - fermentatori-based (Baculo / insetti) e di origine vegetale (pK7WG2- e MagnICON in N. benthamiana e T6 elite in N. tabacum). Seconda colonna - concentrazione hGAD65mut in estratti proteici (ug / ml). Terza colonna - contenuto hGAD65mut peso foglia fresca (mcg / g FLW) per piattaforme a base di piante e nel terreno di coltura (mg / ml) per la piattaforma basata fermentatore-.
Discussione
In questo studio sono stati confrontati tre piattaforme diverse per l'espressione di una proteina ricombinante umana: cellule batteriche, cellule Baculovirus / insetti e piante. La piattaforma a base vegetale è stato esaminato ulteriormente sfruttando le tre tecnologie di espressione ampiamente utilizzati (cioè transitoria - MagnICON e pK7WG2 basati - e stabili). La proteina bersaglio scelto per questo esperimento, hGAD65mut, è stata precedentemente espresso in diversi sistemi 13, e la sua produzione e la funzionalità sono facilmente rilevabili e misurabili 14.
Le cellule batteriche non erano una piattaforma di produzione efficace perché hGAD65mut formata corpi inclusi, anche in condizioni di crescita bassa temperatura, richiedendo così solubilizzazione laborioso e ripiegamento per raggiungere la sua conformazione originaria. Infatti, il fallimento principale di questa piattaforma per l'espressione di proteine ricombinanti complessi è la giusta conformazione del prodotto finale.
IlPiattaforma cellule / insetto Baculovirus mediata un'alta espressione della proteina ricombinante immunoreattiva, ma la limitazione principale di questo sistema di espressione è il costo elevato del terreno di coltura, necessaria per far crescere cellule di insetto. E 'stato stimato che i costi totali di produzione per 1 g di hGAD65mut potrebbe raggiungere € 700 in questa piattaforma di produzione (considerando 9 L insetto mezzi di coltura cellulare richiesto). Una ulteriore limitazione di questa piattaforma espressione è la necessità di coltura sterile di cellule di insetto, che richiede personale con competenze di manipolazione asettiche. Per assicurare un efficiente accumulo di proteina ricombinante due parametri critici devono essere attentamente controllati in questo sistema di espressione: i virali disponibilità utilizzati per infettare le cellule e la tempistica di infezione virale. Inoltre, il detergente, utilizzati per l'estrazione totale di proteine solubili da cellule di insetto Sf9, influenza drasticamente proteina ricombinante solubilizzazione.
Sistemi a base vegetale sono stati i platfo più vantaggiosorm per esprimere hGAD65mut: la proteina ricombinante-pianta fatta era immunoreattivo e accumulato ad alti livelli nei tessuti fogliari. Confrontando i diversi sistemi di espressione a base vegetale, i più alti rendimenti sono stati raggiunti in impianti stabili trasformate tabacco (Tabella 1) e, se si considera la biomassa totale di tabacco rispetto a N. benthamiana, utilizzato per l'espressione transiente, la maggiore produttività complessiva di tabacco è evidente. Tuttavia, il principale limite di tabacco trasformato piattaforma stabile a base vegetale è il tempo richiesto per il set-up del sistema, che nel nostro studio ha preso 20 mesi. Infatti, una linea omozigote dovrebbe essere selezionato per la proteina ricombinante espressione omogeneità e può richiedere ripetuti cicli di auto-cross, partendo dal più alto T1 esprimere linee. In particolare, quando il T1 selezionato sopporta più di una copia del tratto transgenico, il programma di allevamento può richiedere fino a 3 anni.
Sistemi di espressione transitori offerto ilvantaggio di un rapido upscaling causa di un breve intervallo tra trasformazione e di espressione e il set-up della piattaforma espressione richiesto 4 giorni. Tuttavia, una limitazione dei sistemi transitori a base vegetale è che la loro automazione è difficilmente implementabile su un laboratorio-scala se non si utilizza attrezzature di alta qualità dedicato per agro-infiltrazione. Quindi, un calcolo adatto alla produzione su larga scala hGAD65 utilizzando sistemi basati transitori, non può essere eseguita qui. D'altra parte, ipotizziamo che i costi totali di produzione per 1 g di proteina ricombinante utilizzando T6 linea tabacco stabile possono essere calcolate a meno di 5 euro (considerando il terreno per la coltivazione di piante di tabacco 60). Per garantire la agroinfiltration e proteine produzione efficiente diversi parametri critici devono essere attentamente controllati (impianti stadio di sviluppo, crescita e condizioni infiltrazione di Agrobacterium), come riportato in precedenza 15. Inoltre, per ogni espressione sperimentare una specifica analisi tempo-corso dovrebbe essereeseguita per selezionare la dpi che consente il massimo accumulo della proteina ricombinante.
L'esempio discusso qui può essere considerato un caso di studio a prova di principio, che mette in evidenza alcuni dei vantaggi specifici di produzione a base vegetale rispetto ai sistemi tradizionali. In particolare, le linee transgeniche di tabacco omogeneamente esprimenti la proteina ricombinante può essere considerato una valida piattaforma per la produzione di massa di proteine ricombinanti che sono necessari in grandi-quantitativi.
Divulgazioni
The authors declare that there is no conflict of interests regarding the publication of this paper.
Riconoscimenti
This work was supported by the COST action ‘Molecular pharming: Plants as a production platform for high-value proteins’ FA0804. The Authors thank Dr Anatoli Giritch and Prof. Yuri Gleba for providing the MagnICON vectors for research purposes.
Materiali
| Name | Company | Catalog Number | Comments |
| Yeast extract | Sigma | Y1333 | |
| Tryptone | Formedium | TRP03 | |
| Agar Bacteriological Grade | Applichem | A0949 | |
| Sf-900 II SFM medium | Gibco | 10902-088 | |
| Grace’s Insect Medium, unsupplemented | Gibco | 11595-030 | |
| Cellfectin II Reagent | Invitrogen | 10362-100 | |
| MS medium including vitamins | Duchefa Biochemie | M0222 | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Plant agar | Duchefa Biochemie | P1001 | |
| Ampicillin sodium | Duchefa Biochemie | A0104 | Toxic |
| Gentamycin sulphate | Duchefa Biochemie | G0124 | Toxic |
| Ganciclovir | Invitrogen | I2562-023 | |
| Carbenicillin disodium | Duchefa Biochemie | C0109 | Toxic |
| Kanamycin sulfate | Sigma | K4000 | Toxic |
| Rifampicin | Duchefa Biochemie | R0146 | Toxic – 25 mg/ml stock in DMSO |
| Streptomycin sulfate | Duchefa Biochemie | S0148 | Toxic |
| Spectinomycin dihydrochloride | Duchefa Biochemie | S0188 | |
| IPTG (isopropil-β-D-1-tiogalattopiranoside) | Sigma | I5502 | Toxic |
| MES hydrate | Sigma | M8250 | |
| MgCl2 | Biochemical | 436994U | |
| Acetosyringone | Sigma | D134406 | Toxic – 0.1 M stock in DMSO |
| Syringe (1 ml) | Terumo | ||
| MgSO4 | Fluka | 63136 | |
| BAP (6-Benzylaminopurine) | Sigma | B3408 | Toxic |
| NAA (Naphtalene acetic acid) | Duchefa Biochemie | N0903 | Irritant |
| Cefotaxime | Mylan Generics | ||
| Trizma base | Sigma | T1503 | Adjust pH with 1 N HCl to make Tris-HCl buffer |
| HCl | Sigma | H1758 | Corrosive |
| NaCl | Sigma | S3014 | 1 M stock |
| KCl | Sigma | P9541 | |
| Na2HPO4 | Sigma | S7907 | |
| KH2PO4 | Sigma | P9791 | |
| PMSF (Phenylmethanesulfonylfluoride) | Sigma | P7626 | Corrosive, toxic |
| Urea | Sigma | U5378 | |
| β-mercaptoethanol | Sigma | M3148 | Toxic |
| Tween-20 | Sigma | P5927 | |
| Hepes | Sigma | H3375 | |
| DTT (Dithiothreitol) | Sigma | D0632 | Toxic – 1 M stock, store at -20 °C |
| CHAPS | Duchefa Biochemie | C1374 | Toxic |
| Plant protease inhibitor cocktail | Sigma | P9599 | Do not freeze/thaw too many times |
| SDS (Sodium dodecyl sulphate) | Sigma | L3771 | Flammable, toxic, corrosive – 10% stock |
| Glycerol | Sigma | G5516 | |
| Brilliant Blue R-250 | Sigma | B7920 | |
| Isopropanol | Sigma | 24137 | Flammable |
| Acetic acid | Sigma | 27221 | Corrosive |
| Anti-Glutamic acid decarboxylase 65/67 | Sigma | G5163 | Do not freeze/thaw too many times |
| Horseradish peroxidase (HRP)-conjugate anti-rabbit antibody | Sigma | A6154 | Do not freeze/thaw too many times |
| Sf9 Cells | Life Technologies | 11496 | |
| BL21 Competent E. coli | New England Biolabs | C2530H | |
| Protein A Sepharose | Sigma | P2545 | |
| Cell culture plates | Sigma | CLS3516 | |
| Radio Immuno Assay kit | Techno Genetics | 12650805 | Radioactive material |
Riferimenti
- Hampe, C. S., Hammerle, L. P., Falorni, A., Robertson, J., Lernmark, A. Site-directed mutagenesis of K396R of the 65 kDa glutamic acid decarboxylase active site obliterates enzyme activity but not antibody binding. FEBS Lett. 488 (3), 185-189 (2001).
- Avesani, L., et al. Recombinant human GAD65 accumulates to high levels in transgenic tobacco plants when expressed as an enzymatically inactive mutant. Plant Biotechnol. J. 9 (8), 862-872 (2010).
- Sambrook, J., et al. . Molecular Cloning: A laboratory manual. Second Edition. , (1989).
- Avesani, L., et al. Comparative analysis of different biofactories for the production of a major diabetes autoantigen. Transgenic Res. 23, 281-291 (2014).
- Marillonnet, S., Giritch, A., Gils, M., Kandzia, R., Klimyuk, V., Gleba, Y. In planta engineering of viral RNA replicons: efficient assembly by recombination of DNA modules delivered by Agrobacterium. Proc. Natl. Acad. Sci. (USA). 101 (18), 6852-6857 (2004).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants). Curr. Opin. Biotechnol. 18, 134-141 (2007).
- Engler, C., Kandzia, R., Marillonnet, S. A one pot, one step, precision cloning method with high throughput capability. PLoS One. 3 (11), (2008).
- Xu, R., Li, Q. Q. Protocol: streamline cloning of genes into binary vectors in Agrobacterium via the Gateway TOPO vector system. Plant Methods. 4 (4), 1-7 (2008).
- Fairbanks, G., Steck, T. L., Wallach, D. F. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606-2617 (1971).
- Falorni, A., et al. Radioimmunoassay detects the frequent occurrence of autoantibodies to the Mr 65,000 isoform of glutamic acid decarboxylase in Japanese insulin-dependent diabetes. Autoimmunity. 19, 113-125 (1994).
- Hunt, I. From gene to protein: a review of new and enabling technologies for multi-parallel protein expression. Protein Expr. Purif. 40 (1), 1-22 (2005).
- Arzola, L., et al. Transient co-expression of post-transcriptional silencing suppressor for increased in planta expression of a recombinant anthrax receptor fusion protein. Int. J. Mol. Sci. 12 (8), 4975-4990 (2011).
- Merlin, M., Gecchele, E., Capaldi, S., Pezzotti, M., Avesani, L. Comparative evaluation of recombinant protein production in different biofactories: the green perspective. Biomed. Res. Int. 2014, 136419 (2014).
- Avesani, L., et al. Improved in planta expression of the human islet autoantigen glutamic acid decarboxylase (GAD65). Transgenic Res. 12 (2), 203-212 (2003).
- Leuzinger, K., et al. Efficient agroinfiltration of Plants for high-level transient expression of recombinant proteins. J Vis Exp. (77), (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon