Method Article
تحليل مقارن التعبير المؤتلف البروتين في Biofactories مختلفة: البكتيريا، خلايا الحشرات ونظم النبات
In This Article
Summary
In this study the expression of a target human recombinant protein in different production platforms was compared. We focused on traditional fermenter-based cultures and on plants, describing the set-up of each system and highlighting, on the basis of the reported results, the inherent limits and advantages for each platform.
Abstract
وتعتبر أنظمة المستندة إلى النباتات منصة قيمة لإنتاج البروتينات المؤتلف نتيجة لإمكاناتهم موثقة جيدا لإنتاج مرنة ومنخفضة التكلفة ذات جودة عالية، والمنتجات الحيوية النشطة.
في هذه الدراسة، قارنا التعبير عن هدف البروتين المؤتلف البشري في الثقافات التقليدية القائمة على تخمير الخلية (بكتيريا والحشرات) مع أنظمة التعبير المستندة إلى النباتات، سواء عابرة ومستقرة.
لكل منصة، وصفنا مجموعة المتابعة، والتحسين وطول عملية الإنتاج، وجودة المنتج النهائي والغلة وقمنا بتقييم تكاليف الإنتاج مؤقتة ومحددة لالمؤتلف البروتين الهدف المحدد.
وعموما، نتائجنا تشير إلى أن البكتيريا غير مناسبة لإنتاج البروتين المستهدف بسبب تراكمه داخل هيئات إدراج غير قابلة للذوبان. من ناحية أخرى، وأنظمة المستندة إلى النباتات هي منصات متعددة رقبعة تسمح للإنتاج البروتين المختارة في تكاليف أقل من الفيروسة العصوية / نظام خلية الحشرات. على وجه الخصوص، خطوط المعدلة وراثيا مستقرة عرض أعلى محصول للمنتج النهائي والنباتات التعبير عابرة أسرع عملية التنمية. ومع ذلك، قد يستفيد ليست كل البروتينات المؤتلف من أنظمة المستندة إلى النباتات ولكن ينبغي تحديد أفضل منصة إنتاج تجريبيا مع نهج كل حالة على حدة، كما هو موضح هنا.
Introduction
Recombinant proteins are commercially mass-produced in heterologous expression systems with the aid of emerging biotechnology tools. Key factors that have to be considered when choosing the heterologous expression system include: protein quality, functionality, process speed, yield and cost.
In the recombinant protein field, the market for pharmaceuticals is expanding rapidly and, consequently, most biopharmaceuticals produced today are recombinant. Proteins can be expressed in cell cultures of bacteria, yeasts, molds, mammals, plants and insects, as well as in plant systems (either via stable- or transient-transformation) and transgenic animals; each expression system has its inherent advantages and limitations and for each target recombinant protein the optimal production system has to be carefully evaluated.
Plant-based platforms are arising as an important alternative to traditional fermenter-based systems for safe and cost-effective recombinant protein production. Although downstream processing costs are comparable to those of microbial and mammalian cells, the lower up-front investment required for commercial production in plants and the potential economy of scale, provided by cultivation over large areas, are key advantages.
We evaluated plants as bioreactors for the expression of the 65 kDa isoform of human glutamic acid decarboxylase (hGAD65), one of the major autoantigen in Type 1 autoimmune diabetes (T1D). hGAD65 is largely adopted as a marker, both for classifying and monitoring the progression of the disease and its role in T1D prevention is currently under investigation in clinical trials. If these trials are successful, the global demand for recombinant hGAD65 will increase dramatically.
Here, we focus on the expression of the enzymatically inactive counterpart of hGAD65, hGAD65mut, a mutant generated by substituting the lysine residue that binds the cofactor PLP (pyridoxal-5'-phosphate) with an arginine residue (K396R)1.
hGAD65mut retains its immunogenicity and, in plant and insect cells, accumulates up to ten-fold higher than hGAD65, its wild-type counterpart. It was hypothesized that the enzymatic activity of hGAD65 interferes with plant cell metabolism to such an extent that it suppresses its own synthesis, whereas hGAD65mut, the enzymatically-inactive form, can be accumulated in plant cells to higher levels.
For the expression of hGAD65mut, the use of different technologies, widely used in plant biotechnology, was explored here and compared to traditional expression platforms (Escherichia coli and Baculovirus/insect cell-based).
In this work, the recombinant platforms developed for the expression of hGAD65mut comprising traditional and plant-based systems were reviewed and compared on the basis of process speed and yield, and of final product quality and functionality.
Protocol
1. بناء ناقلات التعبير
- التجاري نظام إعادة التركيب الاستنساخ:
- تضخيم تسلسل كامل طول الجين الهدف (hGAD65mut) مع الاشعال مناسبة تسمح إضافة المشبك CACC في نهاية 5'من الجين كما هو موضح سابقا (2).
- استنساخ المنتج التضخيم هلام تنقية، وفقا للمواصفات عدة الاستنساخ الاتجاه، في ناقلات الدخول (topoisomerase ملزمة) من خلال تجميع التفاعل في الحجم الكلي لل6 ميكرولتر، وذلك باستخدام 1.5: 1 المولي نسبة إدراج: النواقل و1 ميكرولتر من محلول الملح (كلوريد الصوديوم 0.2 M و 0.01 MgCl 2). احتضان لمدة 5 دقائق في درجة حرارة الغرفة (RT).
- تحويل رد فعل بأكمله إلى المختص كيميائيا E. خلايا القولونية وفقا لمواصفات الاتجاه عدة الاستنساخ والشاشة المستعمرات التي حصلت عليها مستعمرة PCR 3، وذلك باستخدام M13 إلى الأمام وعكس الاشعال المدرجة في هذه المجموعة الاستنساخ الاتجاه. عزل البلازميد من بومستعمرة sitive وفقا لالبلازميد إعداد DNA مواصفات عدة وتسلسل إدراج باستخدام M13 إلى الأمام وعكس الاشعال لضمان عدم وجود الطفرات 3.
- استخدام استنساخ دخول الحصول عليها لأداء رد فعل إعادة التركيب من قبل لامدا Recombinase Clonase II أنزيم (LR) مع ناقلات جهة معينة: لالمؤتلف التعبير البروتين في الخلايا البكتيرية مع pDEST17 (العائد pDEST17.G65mut)، في محطات (عابرة أو مستقرة) مع pK7WG2 (العائد pK7WG2.G65mut)، في باكولوفيروس / نظام خلية الحشرات مع الحمض النووي الفيروسي خطي (العائد Baculo.G65mut) 4. تجميع رد فعل، وفقا لمواصفات عدة clonase، مع 100 نانوغرام من ناقلات الدخول، 150 نانوغرام من ناقلات جهة و2 ميكرولتر من مزيج انزيم في الحجم النهائي من 10 ميكرولتر. احتضان هذا المزيج في RT لمدة 1 ساعة.
- تحويل المنتج إلى إعادة التركيب المختص كيميائيا E. خلايا القولونية وفقا لمواصفات عدة clonase. الشاشة المستعمرات التي حصلت عليها PCR 3 باستخدام لجميع رد فعل التحول المستعمرات المستمدة نفس التمهيدي عكس GAD65mut محددة (5'-CACACGCCGGCAGCAGGT-3 ') وناقلات جهة الاشعال إلى الأمام المحددة التالية: لpDEST17: 5'-TAATACGACTCACTATAGGG-3'؛ لpK7WG2: 5'-AAGATGCCTCTGCCGACAGT-3 '؛ لBaculo ناقلات خطي: 5'-AAATGATAACCATCTCGC-3 ".
- عزل DNA البلازميد باستخدام طقم DNA minipreparation التجارية وتأكد من وجود تسلسل الهدف بواسطة PCR 3، وذلك باستخدام نفس مجموعات محددة التمهيدي هو موضح في الخطوة السابقة.
- استخدام البلازميدات PCR-الإيجابية التي تم الحصول عليها لتحويل الكائنات المستهدفة المختلفة، اعتمادا على النظام الأساسي الذي تم اختياره لالمؤتلف التعبير البروتين كما هو موضح في الخطوات التالية.
- نظام MagnICON 5-7:
- استنساخ الجين المستهدف في 3'وحدة pICH31070، كما هو موضح سابقا بالتفصيل 7، مما أسفر عن pICH31070.G65mut. استخدامدورة التالية رد فعل محددة: 30 دقيقة الحضانة عند 37 درجة مئوية، و 5 دقائق عند 50 ° C ثم 5 دقائق عند 80 ° C.
2. المؤتلف التعبير البروتين
- نظام الخلية البكتيرية:
- تحويل pDEST17.G65mut إلى E. القولونية BL21 (DE3) خلايا electrocompetent باستخدام تقنيات القياسية وفحص المستعمرات نمت على التي تحتوي على الأمبيسلين (100 ميكروغرام / مل) LB المتوسطة، عن طريق مستعمرة PCR باستخدام بادئات التحوير محددة التالية: 5'-CTGGTGCCAAGTGGCTCAGA-3 'و 5' -CACACGCCGGCAGCAGGT-3 "، مع درجة الحرارة الصلب من 58 درجة مئوية، ووقت استطالة من 20 ثانية. تنفيذ رد فعل PCR في الحجم الكلي لل20 ميكرولتر بعد حل الخلايا البكتيرية مع طرف البلاستيك في الأنبوب.
- تطعيم مستعمرة واحدة بين عشية وضحاها في 37 درجة مئوية في 3 مل من التي تحتوي على الأمبيسلين (100 ميكروغرام / مل) LB المتوسطة.
- تمييع ثقافة البكتيرية 1: 100 في 100 مل من الطازجة المتوسطة LB (بما في ذلك ampicillفي)، واحتضان عند 37 درجة مئوية لمدة 1-6 ساعة حتى OD النهائي 600 من 0.8.
- حمل المؤتلف التعبير البروتين عن طريق إضافة isopropil-β-D-1-tiogalattopiranoside (IPTG) بتركيز نهائي من 1 ملم واحتضان الثقافة مع قوية تهز لمدة 3 ساعة على 37 درجة مئوية.
- جمع الخلايا بواسطة الطرد المركزي عند 4،000 x ج لمدة 20 دقيقة واستخدام بيليه البكتيرية لاستخراج البروتين (الخطوة 3.1.1.1).
- الفيروسة العصوية نظام خلية / الحشرات:
- البذور ورق القطن frugiperda (Sf9) الخلايا في 6 لوحات جيدا (8 × 10 5 خلايا لكل بئر) ويغسل مرتين مع 2 مل من غير أن تستكمل-غريس الحشرات متوسط.
- إزالة واستبدال المتوسطة قطرة من الحكمة مع خليط ترنسفكأيشن (5 ميكرولتر LR رد فعل المؤتلف، 6 ميكرولتر حل Celfectin و 200 ميكرولتر غير تستكمل-غريس الحشرات متوسطة).
- احتضان لوحات في 27 درجة مئوية لمدة 5 ساعة.
- إزالة واستبدال خليط ترنسفكأيشن مع 2 مل من الطازجة SF-900 المتوسطة، على أن تستكمل مع 10٪ مصل بقري جنيني، 10 ميكروغرام / مل الجنتاميسين و 100 ميكرومتر قانسيكلوفير لتحديد الحيوانات المستنسخة المؤتلف الفيروسة العصوية.
- بعد مرور فترة الحضانة لمدة 96 ساعة على 27 ° C، وجمع المتوسطة (الأسهم الفيروسي V1)، الطرد المركزي في 4،000 x ج لإزالة الخلايا والحطام كبيرة وتخزينها في الظلام في 4 درجات مئوية.
- البذور 1 × 10 6 خلايا Sf9 لكل بئر في 2.5 مل SF-900 متوسطة تحتوي على 10٪ مصل بقري جنيني، 10 ميكروغرام / مل الجنتاميسين و 100 ميكرومتر قانسيكلوفير وتصيب مع 100 ميكرولتر من الأسهم V1 في كل جيدا.
- احتضان خلايا لمدة 3 أيام في 27 ° C.
- جمع وأجهزة الطرد المركزي المتوسطة في 4،000 ز س.
- تخزين طاف (V2 الأسهم عالية عيار) في 4 درجات مئوية.
- البذور 1 × 10 6 خلايا Sf9 لكل بئر في 2.5 مل SF-900 متوسطة تحتوي على 10٪ مصل بقري جنيني، 10 ميكروغرام / مل الجنتاميسين و 100 ميكرومتر قانسيكلوفير وتصيب 25 ميكرولتر من الأسهم V2 في كل جيدا.
- احتضان خلايا لمدة 3 أيام في 27 ° C.
- جمع الخلايا بواسطة الطرد المركزي في 4،000 x ج واستخدام بيليه خلية الحشرات لاستخراج البروتين (الخطوة 3.1.2 1).
- نيكوتيانا benthamiana أنظمة التعبير عابرة:
- تنمو N. النباتات benthamiana في دفيئة، تحت الضوء الطبيعي داخل نطاق درجات الحرارة 18-23 درجة مئوية. لagroinfection استخدام النباتات 4-5 الاسبوع القديمة.
- إبقاء النباتات agroinfected في غرفة المناخ في 22 ° C مع 13 ساعة يوم / 11 ليلة في الساعة الضوئية.
- التجاري نظام إعادة التركيب الاستنساخ:
- إدخال pK7WG2.G65mut في الأجرعية المورمة سلالة EHA105 خلايا electrocompetent كما هو موضح سابقا 8 وفحص المستعمرات، ونمت على LB المتوسطة التي تحتوي على ريفامبيسين (50 ميكروغرام / مل)، الستربتومايسين (300 ميكروغرام / مل)، وسبكتينوميسين (100 ميكروغرام / مل) بعد 2 أيام من الحضانة عند 28 درجة مئوية، من قبل مستعمرة PCR 8 باستخدام بادئات التحوير محددة التالية: 5'-CATGGTGGAGCACGACACGCT-3 & #8217؛ و5'-CACACGCCGGCAGCAGGT-3 "، مع درجة الحرارة الصلب من 58 درجة مئوية، ووقت استطالة من 50 ثانية. تنفيذ رد فعل PCR في الحجم الكلي لل20 ميكرولتر.
- تطعيم البكتيريا في 30 مل من LB المتوسطة التي تحتوي على ريفامبيسين (50 ميكروغرام / مل)، الستربتومايسين (300 ميكروغرام / مل)، وسبكتينوميسين (100 ميكروغرام / مل) لمدة يومين في 28 ° C.
- جمع البكتيريا عن طريق الطرد المركزي في 4،000 x ج لمدة 20 دقيقة و resuspend بيليه في 10 مل من العازلة تسلل (10 ملي MES، 10 ملي MgCl 2، 100 ميكرومتر acetosyringone، ودرجة الحموضة 5.6). قياس قيمة OD 600 ثم تعديله إلى 0.9 عن طريق تمييع في نفس العازلة.
ملاحظة: الحجم الكلي اللازمة للتسلل ثلاثة N. النباتات benthamiana هو 30 مل. - استخدام حقنة 2.5 مل needleless التسلل إلى تعليق الأجرعية في N. benthamiana يترك. بعناية وببطء حقن وحات ورقة مع تعليق من الحقنة. التسلل توسيع ثلاثة لترالطنف للنبات وتستخدم ثلاثة مصانع كما يثلث.
ملاحظة: لأسباب الصحة والسلامة ارتداء حماية العين خلال عملية تسلل. - جمع الأوراق agroinfiltrated 2 أيام من العدوى آخر (نقطة في البوصة) وتجميد في النيتروجين السائل. متجر الأنسجة النباتية في -80 ° C.
- نظام MagnICON:
- إدخال ناقلات MagnICON - في "وحدة (pICH20111)، 3 '5 وحدة (pICH31070.G65mut)، وحدة إنزيم مدمج (pICH14011) - في A. المورمة سلالة GV3101 باستخدام تقنيات القياسية. شاشة المستعمرات، ونمت على LB المتوسطة التي تحتوي على 50 ميكروغرام / مل ريفامبيسين والمضادات الحيوية المناسبة ناقلات محددة (50 ميكروغرام / مل كربنيسيلين لpICH20111 وpICH14011، 50 ميكروغرام / مل الكاناميسين لpICH31070)، عن طريق مستعمرة PCR باستخدام بادئات محددة لكل النواقل.
- تطعيم بشكل منفصل A. ثلاثة المورمة سلالات في 5 مل من LB المتوسطة التي تحتوي على 50 ميكروغرام / مل ريفامبيسين والمضادات الحيوية ناقلات محددة المناسبةويهز بين عشية وضحاها في 28 ° C.
- بيليه الثقافات بين عشية وضحاها البكتيرية بواسطة الطرد المركزي عند 4،000 x ج لمدة 20 دقيقة و resuspend لهم في مجلدين من ثقافة البكتيرية الأولية من 10 ملي MES (الرقم الهيدروجيني 5.5) و 10 ملي MgSO 4.
- خلط كميات متساوية من تعليق البكتيرية التي تحتوي على ناقلات ثلاث واستخدام مزيج تعليق لحقنة تسلل N. benthamiana يترك. تسلل ثلاثة أوراق موسعة للنبات.
- جمع الأوراق agroinfiltrated في 4 نقطة في البوصة وتجميد في النيتروجين السائل.
- متجر الأنسجة النباتية في -80 ° C.
- نيكوتيانا تبغ نظام مستقر التعبير:
- النمو والحفاظ في المختبر شتلات من N. تبغ (فار SR1.) على الصلب مستنبت النبات (4.4 غرام / L Murashige وسكوغ - MS - المتوسطة بما في ذلك الفيتامينات، 30 ز / L السكروز، ودرجة الحموضة 5.8، 7 غ / L أجار النبات) تحت ظروف خاضعة للرقابة في غرفة المناخ في 25 ° C مع 16 ساعة يوميا / 8 ساعة / نيالنظام GHT.
- بدء قبل ثقافة A. المورمة EHA105 إيواء pK7WG2.G65mut ناقلات التعبير في 5 مل من السائل المتوسطة YEB بالمضادات الحيوية المناسبة (ريفامبيسين 50 ميكروغرام / مل، الستربتومايسين 300 ميكروغرام / مل، سبكتينوميسين 100 ميكروغرام / مل)، وتنمو بين عشية وضحاها في 28 درجة مئوية في مجموعة شاكر المداري في 200 دورة في الدقيقة.
- استخدام 1 مل من قبل الثقافة لتطعيم ثقافة 50 مل الأجرعية في YEB المتوسطة بالإضافة إلى المضادات الحيوية (ريفامبيسين 50 ميكروغرام / مل، الستربتومايسين 300 ميكروغرام / مل، سبكتينوميسين 100 ميكروغرام / مل)، وتنمو لمدة 24 ساعة، وحتى الثقافة البكتيرية هي المشبعة (OD 600 قيمة 0.5-1.0).
- جمع البكتيريا عن طريق الطرد المركزي في 4،000 x ج لمدة 20 دقيقة و resuspend بيليه في 50 مل من السائل مستنبت النبات. كرر هذه الخطوة مرتين لإزالة المضادات الحيوية تماما.
- خذ أول صحية أوراق توسعت بشكل كامل في المختبر من نباتات التبغ وقطع منها إلى حوالي 1 سم الساحات.
- قطع نقل ورقةإلى أطباق بتري العميقة التي تحتوي على تعليق البكتيرية وترك في الظلام لمدة 20 دقيقة.
- إزالة قطع ورقة من الايقاف وصمة عار الجافة على الورق مرشح العقيمة.
- ضع قطع ورقة مع الجانب متجه نحو المحور (العلوي سطح الورقة) في مصنع صلب الثقافة المتوسطة التي تحتوي على 1.0 ميكروغرام / مل 6-benzylaminopurine (BAP) و 0.1 ميكروغرام / مل حامض الخليك النفتالين (NAA)، واحتضان لوحات لمدة يومين في غرفة المناخ في ذو شاهد الشروط (25 ° C، 16 ساعة يوم / ليلة 8 ساعة).
- قطع ورقة نقل على صلب مستنبت (بما في ذلك 1.0 ميكروغرام / مل BAP، 0.1 ميكروغرام / مل NAA، 500 ميكروغرام / مل سيفوتاكسيم، 100 ميكروغرام / مل الكاناميسين) مع سطح مجافي المحور (السطح السفلي للأوراق) في اتصال مع وسيط.
- احتضان لوحات لمدة 2-3 أسابيع في غرفة المناخ عند 25 درجة مئوية مع 16 ساعة / 8 ساعة النظام اليوم / ليلة للحث على تشكيل تبادل لاطلاق النار. ثقافة فرعية كل 2 أسابيع بواسطة نقل إإكسبلنتس ورقة لالطازجة مستنبت النباتات الصلبة التي تحتوي على 1.0 ميكروغرام / مل BAP، 0.1 ميكروغرام / مل NAA، 500ميكروغرام / مل سيفوتاكسيم و 100 ميكروغرام / مل الكانامايسين.
- عندما تظهر يطلق النار على نقلها إلى مربعات أرجواني تحتوي الصلبة مستنبت بما في ذلك 500 ميكروغرام / مل سيفوتاكسيم و 100 ميكروغرام / مل الكاناميسين للحث على تشكيل الجذر. احتضان شتلات مع 16 ساعة يوميا / 8 ساعة يلة الضوئية عند 25 درجة مئوية لمدة 1-2 أسابيع.
- عندما شكل الجذور، ونقل النباتات إلى التربة في الاحتباس الحراري.
- جمع قطعة ورقة لكل مصنع وعزل الحمض النووي الجيني مع مجموعة تجارية.
- كشف عن وجود التحوير بواسطة PCR محددة. استخدام 30 نانوغرام من الحمض النووي الجيني كقالب لPCR التضخيم باستخدام بادئات التحوير محددة التالية: 5'-CTGGTGCCAAGTGGCTCAGA-3 "و5'-CACACGCCGGCAGCAGGT-3"، مع درجة الحرارة الصلب من 58 درجة مئوية، ووقت استطالة من 20 ثانية . تنفيذ رد فعل PCR في الحجم الكلي لل50 ميكرولتر.
- تحليل المنتج 220 نقطة أساس قبل الكهربائي على هلام 1٪ الاغاروز في تريس، خلات-EDTA (تاي) عازلة (40 ملي آرهو، 20 ملم حمض الخليك، و1 ملم EDTA).
- اختيار النباتات المعدلة وراثيا تحتوي على الجين المستهدف.
- جمع قطعة ورقة من كل من محطة المعدلة وراثيا المختارة وتجميد في النيتروجين السائل على الفور.
- إعداد إجمالي مقتطفات من البروتين من أنسجة أوراق النبات (الخطوة 3.1.3) واختبار كل عينة عن طريق تحليل لطخة الغربي كما هو موضح سابقا 2 لاختيار أفضل البروتين المؤتلف نبات التبغ التعبير.
- الزهور كيس من النبات اختيار أفضل أداء أمام تزهر لمنع تلاقح.
- بعد تزهر، نضج الثمار والبذور والتجفيف، وجمع الحقائب.
- بذور منفصلة عن القشر وتخزينها في غرفة جافة في درجة حرارة رقابة (20-24 درجة مئوية).
- زرع بذور مجففة لإنتاج النباتات المعدلة وراثيا الجيل الثاني وبعد ذلك حدد مصنع أفضل أداء ليكون التلقيح الذاتي.
- كرر نفس الإجراء هو موضح في الخطوات 2.4.19-2.4.21 للأجيال اللاحقة.
3. المؤتلف تحليلات التعبير البروتين
- استخراج البروتين الكلي:
- الخلايا البكتيرية:
- resuspend الكرية الخلية البكتيرية، التي تم جمعها كما هو موضح في الخطوة 2.1.5، في نصف حجم ثقافة المالحة تريس مخزنة (TBS - 2 ملي تريس / حمض الهيدروكلوريك، و 500 ملي مول كلوريد الصوديوم) ودرجة الحموضة 7.4 تستكمل مع 1 ملم phenylmethanesulfonylfluoride (PMSF).
- يصوتن معلق بيليه الخلية ثلاث مرات لمدة 40 ثانية في نصف السلطة، مع الحفاظ على عينة على الجليد.
- توضيح المحللة بواسطة الطرد المركزي عند 14،000 x ج لمدة 20 دقيقة على 4 درجات مئوية.
- نقل طاف لأنبوب نظيفة وتخزين كل من طاف وبيليه على حدة في -80 ° C.
- ذوبان الهيئات إدراج، التي تم جمعها في بيليه، في نصف حجم المحللة الخلوي للTBS درجة الحموضة 8.0 تستكمل مع 6 M اليوريا التي كتبها قوية تهز بين عشية وضحاها في درجة حرارة الغرفة.
- أجهزة الطرد المركزي في 10،000 x ج لمدة 25 دقيقة في درجة حرارة الغرفة وجمع طاف في نظيفةأنبوب.
- تخزين كل طاف وبيليه في -80 ° C.
- خلايا الحشرات:
- غسل بيليه الخلية المصابة الحشرات، التي تم جمعها كما هو موضح في الخطوة 2.2.12، مع 1 مل من الفوسفات مخزنة المالحة (PBS - 137 مم كلوريد الصوديوم، و 2.7 ملي بوكل، 10 ملي نا 2 هبو 4، 1.8 مم KH 2 PO 4) الرقم الهيدروجيني 7.4.
- Resuspend الخلايا في 200 ميكرولتر من تحلل العازلة (20 ملي تريس / حمض الهيدروكلوريك درجة الحموضة 8.0، 0.5 M كلوريد الصوديوم، 3 ملم β المركابتويثانول و 1٪ توين-20)، واحتضان على الجليد لمدة 30 دقيقة.
- الطرد المركزي يذوب الخلايا في 14،000 x ج لمدة 20 دقيقة على 4 درجات مئوية.
- جمع الكسور القابلة للذوبان وتخزينها في -80 ° C وتجاهل بيليه.
- أوراق النبات الأنسجة:
- N. طحن benthamiana أو N. تبغ الأنسجة إلى مسحوق ناعم في النيتروجين السائل باستخدام هاون ومدقة.
- التجانس 100 ملغ من الأنسجة أرض الواقع في 300 ميكرولتر من استخراج العازلة (40 ملي HEPES الرقم الهيدروجيني 7.9، 5 ملي DTT، 1.5٪ CHAPS)، ملحقemented مع 3 ميكرولتر من مثبط البروتياز الكوكتيل وذوبان الجليد على الجليد.
ملاحظة: نسبة اختيار بين وزن الأنسجة النباتية (ز) لالعازلة (مل) حجم هو 1: 3. - استخراج الطرد المركزي في 30،000 x ج لمدة 30 دقيقة على 4 درجات مئوية.
- جمع طاف في أنبوب نظيفة وتخزينها في -80 ° C.
- الخلايا البكتيرية:
- Coomassie هلام تلطيخ:
- إعداد التخفيف المناسب من إجمالي مقتطفات البروتين (على سبيل المثال، 2 ميكرولتر من مستخلصات نباتية، 5 ميكرولتر من مقتطفات البكتيرية والحشرات) إلى الحجم النهائي من 10 ميكرولتر من العازلة استخراج وإضافة 5 ميكرولتر من 3X عينة عازلة (1.5 M تريس / حمض الهيدروكلوريك درجة الحموضة 6.8 و 3٪ SDS، الجلسرين 15٪، 4٪ β المركابتويثانول) إلى تركيز 1X النهائي.
- عينات يغلي لمدة 10 دقيقة.
- البروتينات منفصلة بنسبة 10٪ SDS-PAGE.
- بعد الكهربائي، هلام الحرارة في وجود حل Coomassie ألف (0.05٪ بريليانت الأزرق R-250، و 25٪ الأيزوبروبانول، 10٪ حامض الخليك) في فرن الميكروويف لمدة دقيقتينالصورة حتى درجة الغليان.
- يبرد هلام إلى درجة حرارة الغرفة مع الهز لطيف.
- تجاهل Coomassie حل تلطيخ A.
- هلام يزيل اللون عن طريق التسخين في وجود Coomassie الحل B (0.05٪ بريليانت الأزرق R-250، و 25٪ الأيزوبروبانول)، C (0.002٪ بريليانت الأزرق R-250، وحامض الخليك 10٪) وD (10٪ حامض الخليك) في كل مرة باتباع نفس بروتوكول لتلطيخ.
- بعد الخطوة التدفئة الماضية مع الحل D، وترك هلام destaining حتى خلفية واضحة 9.
- تحليل لطخة غربية:
- بعد الكهربائي، ونقل فصل البروتينات على غشاء النيتروسليلوز باستخدام تقنيات القياسية وكتلة مع الحليب بنسبة 4٪ في PBS الرقم الهيدروجيني 7.4 في درجة حرارة الغرفة لمدة 1 ساعة.
- احتضان صمة عار بين عشية وضحاها في 4 درجات مئوية أو 4 ساعات في درجة حرارة الغرفة في عرقلة الحل تحتوي على الأجسام المضادة الأولية الأرنب التي أثيرت ضد البروتين المستهدف في 1: 10،000 وتستكمل مع 0.1٪ توين-20.
- بعد تسمية الأجسام المضادة الأوليةجي، وغسل غشاء 3 مرات لمدة 5 دقائق لكل منها عرقلة الحل تحتوي على 0.1٪ توين-20.
- احتضان مع الفجل البيروكسيديز (HRP) -conjugate الأضداد المضادة للأرنب في 1: 10،000 مقابل 1.5 ساعة.
- غسل غشاء 5 مرات لمدة 5 دقائق مع كل PBS-T (PBS تستكمل مع 0.1٪ توين-20).
- معالجة طخة غربية باستخدام الغلوثانيون الركيزة chemiluminescent.
- فحص Radioimmuno (RIA):
- السماح الكواشف (مصل، التتبع والبروتين وسيفاروز) لتصل إلى درجة حرارة الغرفة والماصة 20 ميكرولتر من البروتين استخراج العينات والمعايير بتركيزات مختلفة (من 300-2،400 نانوغرام / مل من hGAD65 التجارية المؤتلف) في أنابيب البوليسترين 12 × 75 مم.
- إضافة 20 ميكرولتر من مصل، أعدت تمييع 01:30 المصل من البلازما للمريض T1D.
- إضافة 50 ميكرولتر من التتبع (125-I-GAD65)، واحتضان لمدة 2 ساعة في درجة حرارة الغرفة. وضع أنبوب مع التتبع فقط لتقدير النشاط الكلي.
- إضافة 50 ميكرولترمن البروتين وسيفاروز واحتضان لمدة 1 ساعة في درجة حرارة الغرفة.
- الاستغناء 1 مل من برنامج تلفزيوني الباردة العازلة في كل أنبوب والطرد المركزي في 1،500 x ج في 4 درجة مئوية لمدة 30 دقيقة.
- صب الأنابيب لإزالة طاف وامتصاص السائل المتبقي على الورق النشاف من خلال استغلال بلطف الأنبوب.
- قياس النشاط الإشعاعي immunoprecipitated في جميع الأنابيب عن طريق عد لمدة 1 دقيقة في لأشعة غاما ومكافحة.
- مؤامرة في نطاق سجل معدلات ملزمة (B / T٪) من معايرة المتعلقة بالنشاط الكلي، لإنشاء منحنى القياسية، وقراءة تركيز GAD عينات من منحنى المعايرة 10.
وينبغي تصميم المقيدة مناطق للتخزين والمناولة والتخلص من المواد المشعة: ملاحظة.
النتائج
يوصف على التصميم التجريبي للتعبير مغاير لالمؤتلف البروتين المستهدف في أنظمة الإنتاج المختلفة هنا. وكان التركيز الأول على انشاء لمنصات مختلفة من خلال إنشاء الظروف المثلى للتعبير عن البروتين المستهدف في كل نظام.
التعبير عن بروتين الهدف، hGAD65mut، وكان المستحث في ثلاث نسخ E. ثقافات القولونية. وبعد 3 ساعات التعبير عند 37 درجة مئوية، وقد تم جمع الخلايا البكتيرية بواسطة الطرد المركزي و lysed من قبل صوتنة. بعد خطوة الطرد المركزي، تم فصل البروتينات القابلة للذوبان من الهيئات إدراج غير قابلة للذوبان وأظهرت التحليلات الأولية أن hGAD65mut المتراكمة سائد في الهيئات إدراج غير قابلة للذوبان (لا تظهر البيانات). المؤتلف البروتين solubilisation تتطلب استخدام اليوريا 6 M، والتي، لخصائصه تغيير طبيعة قوية، يتداخل مع تحليل RIA، مما يجعل من المستحيل على تقدير سليم للhGAD65mut. عدة استراتيجيات وقد يكونذكرت أون للحد من تشكيل الهيئات إدراج، تضم نموا في الخلايا الميكروبية في درجات حرارة منخفضة 11. كانت تزرع الثقافات في 15 ° C و 20 درجة مئوية، وكان المستحث المؤتلف التعبير البروتين في نفس درجات الحرارة. كما هو مبين في الشكل 1A، أنتجت solubilisation من hGAD65mut في كل من درجات الحرارة، ويتطلب مرة أخرى اليوريا (الممرات S2). وهكذا، ودرجات حرارة منخفضة في هذه التجربة لا تمنع hGAD65mut من تشكيل المجاميع غير قابلة للذوبان.
وأعرب عن ناقلات الفيروسة العصوية التي تحتوي على تسلسل hGAD65mut (Baculo.G65mut) في ملتصقة الثقافات خلية Sf9. تم إعداد الأسهم عالية عيار-V1 و V2 وتم تعيين الظروف العدوى الأفضل أداء ما يصل تقييم مختلف أحجام الأسهم الفيروسية 5-50 ميكرولتر. كما هو مبين في الشكل 1B، تم تحديد حجم الأمثل الأسهم الفيروسية إلى 25 ميكرولتر، مما أسفر 11.8 ± 0.8 ميكروغرام من المؤتلف البروتين لكل مل من مستنبت، وتقييمها من قبل RIAتحليل (الجدول 1).
بعد تسلل، والوقت تحليل مسار N. agroinfected وقد أجريت أوراق benthamiana في النظامين التعبير عابرة. لنظام يقوم pK7WG2، وكان يتم تجميع عينات ورقة يوميا في نقطة في البوصة مجموعة 1-5، تم استخراج البروتين الكلي القابلة للذوبان (TSP)، وتم تحليل كميات متساوية من TSP التي كتبها طخة غربية (الشكل 1C). وأبرز هذا التحليل أن تراكم الحد الأقصى لهدف المؤتلف بروتين يتم التوصل إلى 2 نقطة في البوصة. ولذلك، تم حصاد الأوراق 2 نقطة في البوصة وتم تحليل مقتطفات من البروتين وكالة ريا لقياس تراكم البروتين المؤتلف، مما يدل على ما معدله 67.8 ميكروغرام / غرام FLW (وزن ورقة جديدة، الجدول 1). مستويات بروتين تعبير المؤتلف، وذلك باستخدام هذا النظام، يمكن زيادة تحسين، من خلال التعاون يتسللون الأوراق مع القامع ما بعد الترانسكربتي جين إسكات (PTGS) مثل P19 أو HC برو 12.
الوقد أجريت نفس الوقت كشف بالطبع خارجا مع N. benthamiana يترك agroinfected مع ناقلات MagnICON: تم جمع الأوراق المصابة 1-8 كميات نقطة في البوصة وعلى قدم المساواة TSP تم تحليلها من قبل لطخة غربية. أظهر هذا التحليل أن الحد الأقصى تراكم البروتين المؤتلف يتم الحصول على 4 نقطة في البوصة (الشكل 1D)، بمتوسط تراكم البروتين المؤتلف من 78.8 ميكروغرام / غرام FLW (الجدول 1)، وتقييمها من قبل RIA.
التعبير عن hGAD65mut في نباتات التبغ المعدلة وراثيا تم الإبلاغ سابقا 12، وتبين أن مستويات البروتين المؤتلف تفاوتت بشكل ملحوظ بين خطوط تتحول بشكل مستقل. كان الأفضل أداء hGAD65mut T1 محطة المعدلة وراثيا عبرت ذاتيا وتم تحليل النباتات المشتقة (T2) مرة أخرى لتحديد أفضل أداء واحد. وتكرر هذا الإجراء على مدى عدة أجيال لتطوير منصة الإنتاج متجانسة، والتحقق من الأداء في كل جيل وكالة ريا حتى لاوقد تحقق مزيد من التحسين (لا تظهر البيانات). في الشكل 1E، وذكرت وصمة عار التمثيلية الغربية من النباتات المعدلة وراثيا T5، حيث تجانس غلة البروتين المؤتلف هو واضح. كما هو مبين في الشكل 1F، ارتفع متوسط العائد hGAD65mut من T2 لT6، ليصل إلى مستوى 99.1 ميكروغرام / غرام FLW (الجدول 1)، وأثناء عملية الاختيار، والانحراف المعياري للمستوى التعبير ورفض.
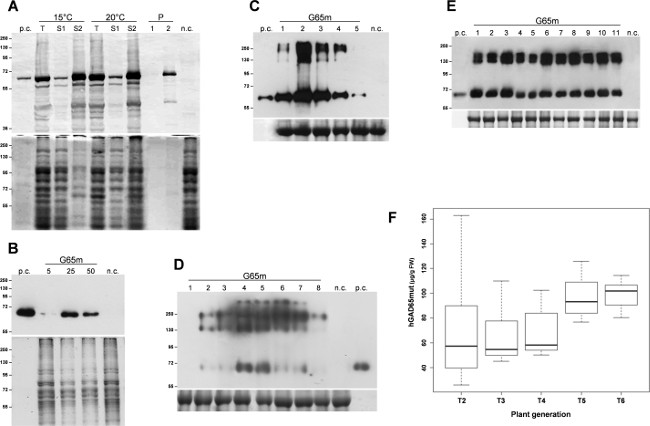
الشكل 1: منصة انشاء إعداد أفضل الظروف لhGAD65mut التعبير في كل منصة. (A) E. القولونية منصة التعبير محرض. وقد نمت الخلايا البكتيرية في 15 ° C أو 20 ° C. لوحة العلوي، وصمة عار الغربية من hGAD65mut في مقتطفات الخلية (2 ميكروغرام لكل حارة TSP). اللوحة السفلى، وتحميل السيطرة ملطخة Coomassie. ن.C. = سيطرة سلبية، الخلايا البكتيرية تحولت مع ناقلات pDEST17 تحتوي على الجين الكلورامفينيكول المقاومة. T: مجموع العينات. S1: طاف بعد صوتنة والطرد المركزي. S2 وP: طاف (1) وبيليه (2) بعد الطرد المركزي من العينة تذوب العازلة التي تحتوي على اليوريا. (B) باكولوفيروس / حشرة منصة الخلية. تم اختبار كميات الأسهم الفيروسية التالية: 5 و 25 و 50 ميكرولتر لوحة العلوي، وصمة عار الغربية من hGAD65mut في مقتطفات الخلية (5 ميكروغرام لكل حارة TSP) لوحة السفلى، وتحميل السيطرة ملطخة Coomassie... NC = سيطرة سلبية، واستخراج الخلايا غير حولت الحشرات. (C) عابر التعبير في N. النباتات benthamiana باستخدام ناقلات pK7WG2. تم جمع عينات يوميا، 1-5 نقطة في البوصة (الممرات 1-5). لوحة العلوي، وصمة عار الغربية من hGAD65mut في مقتطفات ورقة (2.5 ميكروغرام لكل حارة TSP). اللوحة السفلى، وتحميل السيطرة ملطخة Coomassie، حيث الوحيدات كبيرةمن Rubisco هو واضح. NC = سيطرة سلبية، النباتات التي تسللت مع ناقلات pK7WG2 تحمل الجين GFP علامة. (D) التعبير عابر في N. النباتات benthamiana باستخدام ناقلات MagnICON. تم جمع عينات يوميا، 1-8 نقطة في البوصة (الممرات 1-8). لوحة العلوي، وصمة عار الغربية من hGAD65mut في مقتطفات ورقة (5 ميكروغرام لكل حارة TSP). اللوحة السفلى، وتحميل السيطرة ملطخة Coomassie حيث الوحيدات كبيرة من Rubisco هو واضح . NC = سيطرة سلبية، النباتات التي تسللت فقط مع pICH20111 5'وحدة وpICH14011 إنزيم مدمج وحدة. الأرقام تشير علامة الكتلة الجزيئية في كيلو دالتون. كمبيوتر = مراقبة إيجابية، 15 نانوغرام من hGAD65 التجارية المنتجة في / نظام خلية الحشرات الفيروسة العصوية. (E) التعبير مستقرة في N. نباتات تبغ. تم جمع عينات نبات من النباتات T5 مختلفة (الممرات 1-11). لوحة العلوي، وصمة عار الغربية من hGAD65mut في مقتطفات ورقة (5 ميكروغرام لكل حارة TSP). اللوحة السفلى، تحكم التحميل ملطخة ثإيث Coomassie. NC = السيطرة السلبية والنباتات البرية من نوع. الأرقام تشير علامة الكتلة الجزيئية في كيلو دالتون. كمبيوتر = مراقبة إيجابية، 15 نانوغرام من hGAD65 التجارية المنتجة في / نظام خلية الحشرات الفيروسة العصوية. (F) التعبير مستقرة في N. نباتات تبغ. تمثيل Boxplot من تراكم hGAD65mut على مدى عدة أجيال المستمدة من الأفضل أداء hGAD65mut T1 نبات التبغ المعدلة وراثيا كما ذكرت ميكروغرام / غرام FLW المحسوبة من بيانات RIA. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
| نظام | [hGAD65mut] (ميكروغرام / مل) | [hGAD65mut] |
| Baculo / الحشرات | 117.5 ± 7.7 | 11.8 ± 0.8 ميكروغرام / مل مستنبت |
| Transienتي | 22.6 ± 0.9 | 67.8 ± 2.7 ميكروغرام / غرام FLW |
| MagnICON | 26.3 ± 5.9 | 78.8 ± 17.8 ميكروغرام / غرام FLW |
| T6 النخبة | 33.0 ± 3.8 | 99.1 ± 11.3 ميكروغرام / غرام FLW |
الجدول 1: hGAD65mut غلة المحاصيل hGAD65mut في منصات مختلفة - (Baculo / الحشرات) القائم على تخمير والمستندة إلى النباتات (pK7WG2- وMagnICON في N. benthamiana وT6 النخبة في N. تبغ). العمود الثاني - تركيز hGAD65mut في مقتطفات من البروتين (ميكروغرام / مل). العمود الثالث - المحتوى hGAD65mut في الوزن ورقة جديدة (ميكروغرام / غرام FLW) لمنصات ذات الأصل النباتي وفي الخلية مستنبت (ميكروغرام / مل) لمنصة قائمة على تخمير.
Discussion
في هذه الدراسة تم مقارنة ثلاث منصات مختلفة للتعبير عن البروتين البشري المؤتلف: الخلايا البكتيرية، وخلايا الفيروسة العصوية / الحشرات والنباتات. وكانت منصة المستندة إلى النباتات مواصلة استكشاف من خلال استغلال ثلاث تقنيات التعبير المستخدمة على نطاق واسع (أي عابر - MagnICON وpK7WG2 مقرها - ومستقرة). البروتين الهدف الذي تم اختياره لهذه التجربة، hGAD65mut، وقد أعرب سابقا في أنظمة مختلفة 13، وإنتاجه وظائف وبسهولة اكتشاف وقياس 14.
كانت الخلايا البكتيرية يست منصة الإنتاج فعالة لhGAD65mut تشكيل الهيئات إدراج، حتى في ظروف النمو درجات الحرارة المنخفضة، مما يتطلب الإذابة شاقة وrefolding لتحقيق التشكل الأصلي. والواقع أن الفشل الرئيسي من هذه المنصة للتعبير عن البروتينات المؤتلف المعقدة هو التشكل الأيمن من المنتج النهائي.
الالفيروسة العصوية منصة خلية / الحشرات بوساطة التعبير عالية من البروتين المؤتلف متفاعل مناعيا، ولكن القيد الرئيسي لهذا النظام التعبير هو ارتفاع تكلفة وسائل الإعلام والثقافة، واللازمة لزراعة خلايا الحشرات. وتشير التقديرات إلى أن إجمالي تكاليف الإنتاج ل1 غرام من hGAD65mut قد تصل إلى 700 € في هذا المنبر إنتاج (النظر في 9 L من الحشرات وسائل الإعلام ثقافة الخلية المطلوبة). وجود قيود مزيد من هذا المنبر التعبير هو الحاجة لزراعة معقمة من خلايا الحشرات، الأمر الذي يتطلب موظفين ذوي مهارات التلاعب العقيم. لضمان كفاءة تراكم البروتين المؤتلف معلمتين الحرجة يجب أن تسيطر بعناية في هذا النظام التعبير: كميات الأسهم الفيروسية المستخدمة لتصيب الخلايا وتوقيت عدوى فيروسية. وعلاوة على ذلك، والمنظفات، وتستخدم لاستخراج البروتين الكلي للذوبان من خلايا الحشرات Sf9، يؤثر بشكل كبير المؤتلف البروتين solubilisation.
كانت الأنظمة المستندة إلى النباتات وplatfo الأكثر فائدةRM للتعبير عن hGAD65mut: كان المؤتلف البروتين من صنع مصنع متفاعل مناعيا وتراكمت على مستويات عالية في الأنسجة ورقة. وبمقارنة مختلف النظم التعبير المستندة إلى النباتات، وقد تم تحقيق أعلى العوائد في محطات مستقرة تتحول التبغ (الجدول 1)، وإذا كان النظر في إجمالي الكتلة الحيوية من التبغ مقارنة N. benthamiana، وتستخدم للتعبير عابرة، وإنتاجية أعلى العامة للتبغ هو واضح. ومع ذلك، فإن القيد الرئيسي من مستقرة منصة قائمة على نبات التبغ تتحول هو الوقت اللازم لانشاء هذا النظام، الذي عقد في دراستنا 20 شهرا. في الواقع، ينبغي اختيار خط متماثل للبروتين المؤتلف التعبير التجانس وأنه قد تتطلب تكرار دورات عبر الذات، بدءا من أعلى T1 التعبير عن الخطوط. على وجه الخصوص، عندما تحمل T1 اختيار أكثر من نسخة واحدة من السمات المعدلة وراثيا، قد برنامج التربية يستغرق فترة تصل إلى 3 سنوات.
نظم التعبير عابرة عرضتميزة من الارتقاء السريع نظرا لفترة قصيرة بين التحول والتعبير وانشاء منصة التعبير المطلوبة 4 أيام. ومع ذلك، وجود قيود على أنظمة عابرة ذات الأصل النباتي هو أن الأتمتة منها هو بالكاد للتنفيذ على نطاق ومختبر ما لم يتم استخدام معدات عالية الجودة مخصصة ل-تسلل الزراعية. ومن ثم، فإن الحساب السليم لإنتاج على نطاق واسع من hGAD65 باستخدام النظم القائمة عابرة لا يمكن أن يؤديها هنا. من ناحية أخرى، ونحن التكهن بأن إجمالي تكاليف الإنتاج ل1 غرام من البروتين المؤتلف باستخدام T6 خط التبغ مستقر يمكن حساب في أقل من 5 يورو (النظر في التربة لزراعة نباتات التبغ 60). لضمان كفاءة إنتاج تسريب الأجرعية والبروتين يجب التحكم بعناية العديد من المعلمات الحرجة (المرحلة التنموية النبات، تنمو وحالة تسلل الأجرعية)، كما ذكرت سابقا 15. وعلاوة على ذلك، على كل تعبير تجربة تحليل محدد للوقت بالطبع يجب أن يكونأجريت لتحديد نقطة في البوصة التي تسمح للأعلى تراكم البروتين المؤتلف.
على سبيل المثال مناقشتها هنا يمكن اعتبار دراسة حالة إثبات صحة المبدأ، الذي يسلط الضوء على بعض من مزايا محددة للإنتاج النباتي على الأنظمة التقليدية. على وجه الخصوص، وخطوط المعدلة وراثيا معربا عن التبغ متجانس البروتين المؤتلف يمكن اعتباره منصة قيمة لانتاج كميات كبيرة من البروتينات المؤتلف مطلوبة بكميات كبيرة.
Disclosures
The authors declare that there is no conflict of interests regarding the publication of this paper.
Acknowledgements
This work was supported by the COST action ‘Molecular pharming: Plants as a production platform for high-value proteins’ FA0804. The Authors thank Dr Anatoli Giritch and Prof. Yuri Gleba for providing the MagnICON vectors for research purposes.
Materials
| Name | Company | Catalog Number | Comments |
| Yeast extract | Sigma | Y1333 | |
| Tryptone | Formedium | TRP03 | |
| Agar Bacteriological Grade | Applichem | A0949 | |
| Sf-900 II SFM medium | Gibco | 10902-088 | |
| Grace’s Insect Medium, unsupplemented | Gibco | 11595-030 | |
| Cellfectin II Reagent | Invitrogen | 10362-100 | |
| MS medium including vitamins | Duchefa Biochemie | M0222 | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Plant agar | Duchefa Biochemie | P1001 | |
| Ampicillin sodium | Duchefa Biochemie | A0104 | Toxic |
| Gentamycin sulphate | Duchefa Biochemie | G0124 | Toxic |
| Ganciclovir | Invitrogen | I2562-023 | |
| Carbenicillin disodium | Duchefa Biochemie | C0109 | Toxic |
| Kanamycin sulfate | Sigma | K4000 | Toxic |
| Rifampicin | Duchefa Biochemie | R0146 | Toxic – 25 mg/ml stock in DMSO |
| Streptomycin sulfate | Duchefa Biochemie | S0148 | Toxic |
| Spectinomycin dihydrochloride | Duchefa Biochemie | S0188 | |
| IPTG (isopropil-β-D-1-tiogalattopiranoside) | Sigma | I5502 | Toxic |
| MES hydrate | Sigma | M8250 | |
| MgCl2 | Biochemical | 436994U | |
| Acetosyringone | Sigma | D134406 | Toxic – 0.1 M stock in DMSO |
| Syringe (1 ml) | Terumo | ||
| MgSO4 | Fluka | 63136 | |
| BAP (6-Benzylaminopurine) | Sigma | B3408 | Toxic |
| NAA (Naphtalene acetic acid) | Duchefa Biochemie | N0903 | Irritant |
| Cefotaxime | Mylan Generics | ||
| Trizma base | Sigma | T1503 | Adjust pH with 1 N HCl to make Tris-HCl buffer |
| HCl | Sigma | H1758 | Corrosive |
| NaCl | Sigma | S3014 | 1 M stock |
| KCl | Sigma | P9541 | |
| Na2HPO4 | Sigma | S7907 | |
| KH2PO4 | Sigma | P9791 | |
| PMSF (Phenylmethanesulfonylfluoride) | Sigma | P7626 | Corrosive, toxic |
| Urea | Sigma | U5378 | |
| β-mercaptoethanol | Sigma | M3148 | Toxic |
| Tween-20 | Sigma | P5927 | |
| Hepes | Sigma | H3375 | |
| DTT (Dithiothreitol) | Sigma | D0632 | Toxic – 1 M stock, store at -20 °C |
| CHAPS | Duchefa Biochemie | C1374 | Toxic |
| Plant protease inhibitor cocktail | Sigma | P9599 | Do not freeze/thaw too many times |
| SDS (Sodium dodecyl sulphate) | Sigma | L3771 | Flammable, toxic, corrosive – 10% stock |
| Glycerol | Sigma | G5516 | |
| Brilliant Blue R-250 | Sigma | B7920 | |
| Isopropanol | Sigma | 24137 | Flammable |
| Acetic acid | Sigma | 27221 | Corrosive |
| Anti-Glutamic acid decarboxylase 65/67 | Sigma | G5163 | Do not freeze/thaw too many times |
| Horseradish peroxidase (HRP)-conjugate anti-rabbit antibody | Sigma | A6154 | Do not freeze/thaw too many times |
| Sf9 Cells | Life Technologies | 11496 | |
| BL21 Competent E. coli | New England Biolabs | C2530H | |
| Protein A Sepharose | Sigma | P2545 | |
| Cell culture plates | Sigma | CLS3516 | |
| Radio Immuno Assay kit | Techno Genetics | 12650805 | Radioactive material |
References
- Hampe, C. S., Hammerle, L. P., Falorni, A., Robertson, J., Lernmark, A. Site-directed mutagenesis of K396R of the 65 kDa glutamic acid decarboxylase active site obliterates enzyme activity but not antibody binding. FEBS Lett. 488 (3), 185-189 (2001).
- Avesani, L., et al. Recombinant human GAD65 accumulates to high levels in transgenic tobacco plants when expressed as an enzymatically inactive mutant. Plant Biotechnol. J. 9 (8), 862-872 (2010).
- Sambrook, J., et al. . Molecular Cloning: A laboratory manual. Second Edition. , (1989).
- Avesani, L., et al. Comparative analysis of different biofactories for the production of a major diabetes autoantigen. Transgenic Res. 23, 281-291 (2014).
- Marillonnet, S., Giritch, A., Gils, M., Kandzia, R., Klimyuk, V., Gleba, Y. In planta engineering of viral RNA replicons: efficient assembly by recombination of DNA modules delivered by Agrobacterium. Proc. Natl. Acad. Sci. (USA). 101 (18), 6852-6857 (2004).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants). Curr. Opin. Biotechnol. 18, 134-141 (2007).
- Engler, C., Kandzia, R., Marillonnet, S. A one pot, one step, precision cloning method with high throughput capability. PLoS One. 3 (11), (2008).
- Xu, R., Li, Q. Q. Protocol: streamline cloning of genes into binary vectors in Agrobacterium via the Gateway TOPO vector system. Plant Methods. 4 (4), 1-7 (2008).
- Fairbanks, G., Steck, T. L., Wallach, D. F. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606-2617 (1971).
- Falorni, A., et al. Radioimmunoassay detects the frequent occurrence of autoantibodies to the Mr 65,000 isoform of glutamic acid decarboxylase in Japanese insulin-dependent diabetes. Autoimmunity. 19, 113-125 (1994).
- Hunt, I. From gene to protein: a review of new and enabling technologies for multi-parallel protein expression. Protein Expr. Purif. 40 (1), 1-22 (2005).
- Arzola, L., et al. Transient co-expression of post-transcriptional silencing suppressor for increased in planta expression of a recombinant anthrax receptor fusion protein. Int. J. Mol. Sci. 12 (8), 4975-4990 (2011).
- Merlin, M., Gecchele, E., Capaldi, S., Pezzotti, M., Avesani, L. Comparative evaluation of recombinant protein production in different biofactories: the green perspective. Biomed. Res. Int. 2014, 136419 (2014).
- Avesani, L., et al. Improved in planta expression of the human islet autoantigen glutamic acid decarboxylase (GAD65). Transgenic Res. 12 (2), 203-212 (2003).
- Leuzinger, K., et al. Efficient agroinfiltration of Plants for high-level transient expression of recombinant proteins. J Vis Exp. (77), (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved