Method Article
細菌、昆虫細胞およびプラントシステムズ:異なるバイオファクトリーでの組換えタンパク質発現の比較分析
要約
In this study the expression of a target human recombinant protein in different production platforms was compared. We focused on traditional fermenter-based cultures and on plants, describing the set-up of each system and highlighting, on the basis of the reported results, the inherent limits and advantages for each platform.
要約
植物ベースのシステムは、高品質の、生理活性製品の柔軟な、低コスト生産のためのそれらの十分に立証された電位の結果として、組換えタンパク質の生産のための貴重なプラットフォームと考えられている。
本研究では、一過性で安定した植物に基づく発現系、伝統的な発酵槽に基づく細胞培養物(細菌および昆虫)で標的のヒト組換えタンパク質の発現を比較した。
各プラットフォームのために、我々は、セットアップ、最適化、製造工程の長さは、最終製品の品質及び収率を記載し、我々は、選択された標的組換えタンパク質に特異的な仮の製造コストを評価した。
全体として、我々の結果は、細菌は、不溶性の封入体中のその蓄積による標的タンパク質の生産に適していないことを示している。一方、植物ベースのシステムは、多目的プラットフォームトンである帽子は、バキュロウイルス/昆虫細胞系よりも低コストで選択されたタンパク質の産生を可能にする。具体的には、安定したトランスジェニック系統は、最終生成物の最高収率及び過渡発現する植物最速プロセス開発を示した。しかしながら、全ての組換えタンパク質は、植物ベースのシステムから利益を得ることができるが、ここで説明したように最高の生産プラットフォームは、ケースバイケースのアプローチを経験的に決定されるべきである。
概要
Recombinant proteins are commercially mass-produced in heterologous expression systems with the aid of emerging biotechnology tools. Key factors that have to be considered when choosing the heterologous expression system include: protein quality, functionality, process speed, yield and cost.
In the recombinant protein field, the market for pharmaceuticals is expanding rapidly and, consequently, most biopharmaceuticals produced today are recombinant. Proteins can be expressed in cell cultures of bacteria, yeasts, molds, mammals, plants and insects, as well as in plant systems (either via stable- or transient-transformation) and transgenic animals; each expression system has its inherent advantages and limitations and for each target recombinant protein the optimal production system has to be carefully evaluated.
Plant-based platforms are arising as an important alternative to traditional fermenter-based systems for safe and cost-effective recombinant protein production. Although downstream processing costs are comparable to those of microbial and mammalian cells, the lower up-front investment required for commercial production in plants and the potential economy of scale, provided by cultivation over large areas, are key advantages.
We evaluated plants as bioreactors for the expression of the 65 kDa isoform of human glutamic acid decarboxylase (hGAD65), one of the major autoantigen in Type 1 autoimmune diabetes (T1D). hGAD65 is largely adopted as a marker, both for classifying and monitoring the progression of the disease and its role in T1D prevention is currently under investigation in clinical trials. If these trials are successful, the global demand for recombinant hGAD65 will increase dramatically.
Here, we focus on the expression of the enzymatically inactive counterpart of hGAD65, hGAD65mut, a mutant generated by substituting the lysine residue that binds the cofactor PLP (pyridoxal-5'-phosphate) with an arginine residue (K396R)1.
hGAD65mut retains its immunogenicity and, in plant and insect cells, accumulates up to ten-fold higher than hGAD65, its wild-type counterpart. It was hypothesized that the enzymatic activity of hGAD65 interferes with plant cell metabolism to such an extent that it suppresses its own synthesis, whereas hGAD65mut, the enzymatically-inactive form, can be accumulated in plant cells to higher levels.
For the expression of hGAD65mut, the use of different technologies, widely used in plant biotechnology, was explored here and compared to traditional expression platforms (Escherichia coli and Baculovirus/insect cell-based).
In this work, the recombinant platforms developed for the expression of hGAD65mut comprising traditional and plant-based systems were reviewed and compared on the basis of process speed and yield, and of final product quality and functionality.
プロトコル
発現ベクターの1の構築
- 商業的組換えクローニングシステム:
- 以前に2に記載のように、適切なプライマーは、遺伝子の5 '末端にCACCクランプの付加が可能で、標的遺伝子(hGAD65mut)の完全長配列を増幅する。
- 1モル比のインサート:ベクター及び1μlの1.5を使用して、6μlの総体積で反応を組み立て(トポイソメラーゼが結合した)エントリーベクターに、方向性クローニングキットの仕様に応じて、ゲル精製した増幅産物をクローン塩溶液(0.2M NaClおよび0.01のMgCl 2)。室温(RT)で5分間インキュベートする。
- 化学的にコンピテントに反応全体を変換する大腸菌の細胞は、コロニーPCR 3でコロニーを得、方向クローニングキットの仕様および画面に従って前進M13を使用して、方向クローニングキットに含まリバースプライマー。 POからプラスミドを分離sitiveコロニーのプラスミドDNA調製キットの仕様および順序に従って挿入フォワードM13を使用し、変異3が存在しないことを確実にするためにリバースプライマー。
- 特定の宛先ベクターを用いてラムダリコンビナーゼクロナーゼII酵素(LR)により組換え反応を実行するために取得したエントリークローンを使用します。pDEST17細菌細胞における組換えタンパク質発現のために(pDEST17.G65mutが得られる)、(一過性または安定)は、植物にpK7WG2で4(Baculo.G65mut生じる)、線状化ウイルスDNAをバキュロウイルス/昆虫細胞系において、(pK7WG2.G65mut生じる)。エントリーベクター100ngの、デスティネーションベクタの150ngのと10μlの最終容量で酵素ミックスの2μlの、クロナーゼキットの仕様に応じて、反応を組み立てます。室温で1時間のミックスをインキュベートする。
- 化学的にコンピテント大腸菌への組換え製品を変換するクロナーゼキット仕様に従って大腸菌細胞 。 PCR 3によりスクリーン得られたコロニーすべての形質転換反応に由来するコロニーのために同じ逆GAD65mut特異的プライマーを用いて、(5'-CACACGCCGGCAGCAGGT-3 ')と、以下の具体的なデスティネーションベクターフォワードプライマー:pDEST17用:5'-TAATACGACTCACTATAGGG-3'; pK7WG2用:5'-AAGATGCCTCTGCCGACAGT-3 ';バキュロ線状化ベクターのために:5'-AAATGATAACCATCTCGC-3 '。
- 商業少量調製のDNAキットを用いてプラスミドDNAを単離し、前のステップで説明したのと同じ特定のプライマーの組み合わせを用いて、PCR 3によって、標的配列の存在を確認する。
- 以下のステップで説明するように、組換えタンパク質の発現のために選択されたプラットフォームに応じて、異なる標的生物を形質転換するために得られたPCR陽性のプラスミドを使用する。
- MagnICONシステム5-7:
- 以前に詳細7に記載されるようにpICH31070.G65mutを得、3'-モジュールpICH31070中の標的遺伝子をクローニングする。使用してください具体的な反応サイクルを、次の80℃、37℃、50℃、5分で30分間インキュベートし、次いで、5分間。
2.組換えタンパク質発現
- 細菌の細胞系:
- E.にpDEST17.G65mutトランスフォーム大腸菌 BL21(DE3)は、以下の導入遺伝子特異的プライマーを用いたコロニーPCRによってアンピシリン含有(100μg/ ml)を上に成長させ、標準的な技術およびスクリーニングコロニーをLB培地を使用して、エレクトロコンピテント細胞:5'-CTGGTGCCAAGTGGCTCAGA-3 'および5' -CACACGCCGGCAGCAGGT-3 '、58℃のアニーリング温度で20秒の伸長時間である。チューブプラスチックチップで細菌細胞を溶解した後、20μlの総容量でPCR反応を行う。
- アンピシリン含有(100μg/ ml)を3mlのLB培地中で37℃で一晩、単一のコロニーを接種する。
- 新鮮なLB培地100ml中の100(ampicill含む:細菌培養1に希釈で)0.8の最終OD 600まで1-6時間、37℃でインキュベートする。
- 1mMの最終濃度でisopropil-β-D-1-tiogalattopiranoside(IPTG)の添加によって、組換えタンパク質の発現を誘導し、激しく37℃で3時間振盪しながら培養物をインキュベートする。
- 20分間4000×gでの遠心分離によって細胞を収集し、タンパク質抽出(ステップ3.1.1.1)のための細菌ペレットを使用しています。
- バキュロウイルス/昆虫細胞系。
- シードヨトウガ (Sf9細胞)6ウェルプレートへの細胞(ウェル当たり8×10 5細胞)と非補充したグレース昆虫培地2mlで二回洗浄します。
- 中滴下トランスフェクション混合物(5μlのLR組換え反応、6μlのCelfectin液と200μlの非補充したグレース昆虫培地)で取り外し、交換してください。
- 5時間、27℃でプレートをインキュベートする。
- 取り外して、新鮮なのSf-9 2mlのトランスフェクション混合物を置き換え組換えバキュロウイルスクローンを選択するために、10%ウシ胎児血清、10μg/ mlのゲンタマイシンおよび100μMガンシクロビルを補充00媒体。
- 27℃で96時間インキュベートした後、4℃で暗所に細胞と大きな破片とストアを削除するために4000×gで培地(V1ウイルスストック)、遠心分離機を収集します。
- シード1×10 10%のウシ胎児血清を含む2.5ミリリットルのSf-900培地中でウェルあたり6 Sf9細胞、10μg/ mlのゲンタマイシン及び100μMガンシクロビル、すべてのウェル中にV1のストック100μlの感染する。
- 27℃で3日間、細胞をインキュベート。
- 4000×gで収集し、遠心分離媒体。
- 4℃で上清(V2高力価のストック)を保管してください。
- シード1×10 10%のウシ胎児血清を含む2.5ミリリットルのSf-900培地中でウェルあたり6 Sf9細胞、10μg/ mlのゲンタマイシン及び100μMガンシクロビル、すべてのウェル中にV2の株式の25μlの感染する。
- 27℃で3日間、細胞をインキュベート。
- 4000×gで遠心分離により細胞を収集し、タンパク質抽出する(ステップ3.1.2。1)のための昆虫細胞ペレットを使用しています。
- タバコベンサミアナ一過性発現系:
- N.を育てる温度範囲18〜23℃の中で、自然光の下で温室、中benthamiana植物 。アグロ感染のために4-5週齢の植物を使用しています。
- 13時間日/ 11時間の夜の光周期で22℃の人工気象室でagroinfected植物を保管してください。
- 商業的組換えクローニングシステム:
- アグロバクテリウム菌株EHA105エレクトロtumefaciens細胞に以前に8に記載されているようpK7WG2.G65mutを紹介し、2の後、LB培地を含むリファンピシン(50μg/ ml)を、ストレプトマイシン(300μg/ ml)をし、スペクチノ(100μg/ ml)を上に成長したコロニーをスクリーニング以下の導入遺伝子特異的プライマーを用いたコロニーPCR 8 28℃でのインキュベーションの日:5'-CATGGTGGAGCACGACACGCT-3&#8217。 5'-CACACGCCGGCAGCAGGT-3 '、58℃、50秒の伸長時間のアニーリング温度を有する。総量20μlでPCR反応を行う。
- 28℃で2日間を含むLB培地リファンピシン(50μg/ ml)を、ストレプトマイシン(300μg/ ml)を、およびスペクチノマイシン(100μg/ ml)を30mlの細菌を接種する。
- 浸透緩衝液10ml中で20分間再懸濁ペレット(10mMのMES、10のMgCl 2、100μMのアセトシリンゴン、pHは5.6)のために4000×gでの遠心分離によって細菌を収集します。 OD 600値を測定した後、同じ緩衝液中に希釈することによって0.9に調整。
注:3 N.浸潤するために必要な総容量benthamiana植物を30 mlである。 - N.におけるアグロバクテリウム懸濁液を浸透させるために2.5ミリリットル無針注射器を使用してくださいアナタバコの葉。慎重にゆっくりと注射器から懸濁液で葉のパネルを注入する。 3拡張したLに潜入工場ごとに庇と三重の3つの植物を使用しています。
注:健康と安全上の理由から浸透処理中に目の保護具を着用してください。 - 2日間アグロ浸潤葉を収集し、感染後(dpi)で、液体窒素中で凍結する。 -80℃で保存の植物組織。
- MagnICONシステム:
- 5 'モジュール(pICH20111)、3'モジュール(pICH31070.G65mut)、およびインテグラーゼモジュール(pICH14011) - - A.でMagnICONベクトルを紹介標準的な技術を用いてGV3101株ツメファシエンス 。含有するLB培地上で生育したコロニーを、画面を50μg/ mlのリファンピシン及び各ベクターに特異的なプライマーを用いたコロニーPCRにより、適切なベクター特異的抗生物質(pICH20111及びpICH14011、50μg/ mlのカナマイシンpICH31070ためのための50μg/ mlのカルベニシリン)、。
- 別途3 A.接種ツメファシエンスを含むLB培地5ml中に株を、50μg/ mlのリファンピシン及び適切なベクター特異的抗生物質そして28℃で一晩振る。
- ペレットを一晩細菌の20分間4000×gで遠心分離することによって文化や10mMのMES(pH5.5)に10 mMのMgSO 4を初期の細菌培養物の二つのボリュームで再懸濁します。
- 3ベクターを含む細菌懸濁液を等量混合し、Nの注射器浸潤用サスペンションミックスを使用アナタバコの葉。工場ごとに3つの拡張した葉を潜入。
- 4 dpiでアグロ浸潤葉を収集し、液体窒素中で凍結する。
- -80℃で保存の植物組織。
- タバコ安定した発現系:
- 成長し、Nのin vitroでの小植物を維持固体植物培養培地にタバクム(VAR Sr1が。)(4.4グラム/ Lムラシゲ·スクーグ- MS -培地ビタミンは30g / Lスクロース、pH5.8の、7グラム/ Lの植物寒天を含む)25の気候室内で制御された条件下で16時間/ 8時間の日/ NIとの°CGHT政権。
- Aの前培養を開始しますツメファシエンス EHA105は(100μg/ mlのスペクチノマイシン300μg/ mlのストレプトマイシン、リファンピシンを50μg/ ml)を適切な抗生物質を液体YEB培地5ml中に発現ベクターpK7WG2.G65mutを保有し、オービタルシェーカーセットにおいて28℃で一晩増殖200 rpmで。
- 細菌培養されるまで、(100μg/ mlのスペクチノマイシン、300μg/ mlのストレプトマイシン、リファンピシンを50μg/ ml)をYEB培地+抗生物質中で50ミリリットルのアグロバクテリウム培養に接種し、24時間成長する前培養の1ミリリットルを使用してください飽和(OD 0.5〜1.0の600値)。
- 液体植物培養培地50ml中で20分間再懸濁ペレットのために4000×gでの遠心分離によって細菌を収集します。完全に抗生物質を除去するために二回、この手順を繰り返します。
- in vitroでのタバコ植物からの最初の健全な完全に展開された葉を取り、約1cm角にそれらをカット。
- 転送葉片深いペトリ皿に細菌懸濁液を含有し、20分間、暗所で残す。
- 懸濁液から葉片を取り出し、滅菌ろ紙上で乾燥したブロット。
- を1.0μg/ mlの6-ベンジルアミノプリン(BAP)および0.1 / mlのナフタレン酢酸(NAA)を含有する固体の植物培養培地に向軸側と葉片(葉の上面)を配置し、制御されたの気候室で2日間プレートをインキュベート条件(25℃、16時間の日/ 8時間の夜)。
- 媒体と接触する背軸面(葉の下面)と(1.0 / mlのBAP、を0.1μg/ mlのNAA、500 / mlのセフォタキシム、100μg/ mlのカナマイシンを含む)固形培地上に転送葉片。
- シュート形成を誘導するために16時間/ 8時間昼/夜政権と25℃の人工気象室で2〜3週間のプレートをインキュベートします。サブカルチャー1.0 / mlのBAPを含有する新鮮な固体植物培養培地に葉の外植を転送することにより、2週間毎に、0.1 / mlのNAA、500/ mlのセフォタキシムおよび100μg/ mlカナマイシン。
- シュートは500 / mlのセフォタキシムおよび根形成を誘導するために、100μg/ mlのカナマイシンを含む固体培地を含むマゼンタボックスに転送するときに現れる。 1〜2週間、25℃で16時間の日/ 8時間の夜の光周期との苗木をインキュベートする。
- ときは根の形、温室内の土壌に植物を移す。
- 各工場の葉の部分を収集し、市販のキットを用いてゲノムDNAを単離。
- 特定のPCRによる導入遺伝子の存在を検出する。 58℃のアニーリング温度で20秒の伸長時間で、5'-CTGGTGCCAAGTGGCTCAGA-3 'および5'-CACACGCCGGCAGCAGGT-3':以下の導入遺伝子特異的プライマーを用いるPCR増幅のための鋳型としてのゲノムDNA 30ngのを使う。全量50μl中でPCR反応を行う。
- トリス - 酢酸-EDTA(TAE)緩衝液(40mMのTrを1%アガロースゲル上での電気泳動により220 bpの産物を分析する)、20 mMの酢酸、および1mM EDTA。
- 標的遺伝子を含むトランスジェニック植物を選択する。
- 選択したトランスジェニック植物のそれぞれから葉片を収集し、直ちに液体窒素中で凍結する。
- 植物の葉組織(ステップ3.1.3)からの全タンパク質抽出物を調製し、以前にタバコを発現する最良の組換えタンパク質を選択するために2に記載のようにウェスタンブロット分析により、各試料を試験する。
- 他家受粉を防ぐために、開花前に選択した最高のパフォーマンスの植物の袋の花。
- ブルーミング果実の成熟と種子乾燥後、袋を集める。
- もみ殻から独立した種子や制御された温度(20〜24℃)で乾燥した部屋に保管してください。
- 第二世代のトランスジェニック植物を生産し、その後、自家受粉すること最高のパフォーマンスの植物を選択するために乾燥した種をまく。
- 次の世代のためのステップ2.4.19-2.4.21に記載したのと同じ手順を繰り返します。
3.組換えタンパク質発現解析
- 総タンパク質抽出:
- 細菌細胞:
- 1mMのphenylmethanesulfonylfluoride(PMSF)を添加した - (2 mMトリス/塩酸、500mMのNaCl TBS)pH7.4のトリス緩衝食塩水の半分の培養容積中で、ステップ2.1.5で説明したように収集された細菌細胞ペレットを再懸濁する。
- 氷上でサンプルを維持しながら超音波処理は、半分の電力で40秒間、細胞ペレットを3回再懸濁した。
- 4℃で20分間、14000×gで遠心分離することにより、溶解物を明確にする。
- きれいなチューブに上清を移し、-80℃で別々に上清とペレットの両方を格納します。
- 激しく室温で一晩振盪することによって6 M尿素を補充したTBS pH8.0の半分の細胞溶解物の体積が、ペレット中に収集された封入体を可溶化する。
- 室温で25分間、10,000×gで遠心分離し、きれいに上清を回収しチューブ。
- -80℃で上清とペレットの両方に保管してください。
- 昆虫細胞:
- ( - 137のNaCl、2.7mMのKClを、10ミリモルのNa 2 HPO 4、1.8mMのKH 2 PO 4 PBS)pH7.4のリン酸緩衝生理食塩水1mlを、ステップ2.2.12に記載されているように収集された感染した昆虫細胞ペレットを洗浄する。
- 溶解緩衝液200μl中に細胞を再懸濁し(20 mMトリス/ HClでpHを8.0、0.5 MのNaCl、3mMのβメルカプトエタノールおよび1%のTween-20)と氷上で30分間インキュベートする。
- 遠心分離を4℃で20分間14000×gで細胞を可溶化した。
- -80℃で可溶性画とストアを収集し、ペレットを捨てる。
- 植物の葉組織。
- グラインドN.アナタバコまたはN.乳鉢と乳棒を用いて液体窒素中で微粉末にタバコ組織 。
- 抽出緩衝液300μl(40mMのヘペスpHは7.9、5mMのDTT、1.5%CHAPS)接地100mgの組織を均質化、補遺氷上のプロテアーゼ阻害剤カクテルと解凍の3μlのemented。
注3:ボリュームをバッファリングする植物組織重量(g)(ml)の間の選択比が1である。 - 4°Cで30分間30,000×gで遠心エキス。
- -80℃で清潔なチューブやストアに上清を収集します。
- 細菌細胞:
- クマシーゲル染色:
- 抽出緩衝液10μlの最終容量に全タンパク質抽出物( 例えば、植物抽出物、細菌および昆虫抽出物の5μlを2μL)の適切な希釈液を調製し、3Xサンプルバッファー5μlを添加(1.5 Mトリス/ HClのpHは6.8、最終1×濃度3%SDS、15%グリセロール、4%βメルカプトエタノール)。
- 10分間沸騰サンプル。
- 10%SDS-PAGEでタンパク質を分離する。
- 電気泳動後、約2分間、マイクロ波オーブン中クーマシー溶液A(0.05%ブリリアントブルーR-250、25%イソプロパノール、10%酢酸)の存在下で熱ゲル沸点まで、S。
- 穏やかに振盪しながら室温にゲルをクールダウン。
- クマシー染色液Aを破棄
- クーマシー溶液Bの存在下で加熱することにより脱色ゲル(0.05%ブリリアントブルーR-250、25%イソプロパノール)、C(0.002%ブリリアントブルーR-250、10%酢酸)及びD(10%酢酸)毎回染色のために同じプロトコル以下。
- 背景が9明確であるまで、溶液Dとの最後の加熱工程の後、ゲル脱色を残す。
- ウエスタンブロット分析。
- 電気泳動後、転送は1時間室温でPBS(pH7.4)中の標準的な技術および4%のミルクでブロックを用いてニトロセルロース膜上のタンパク質を分離した。
- 10,000 0.1%のTween-20を補充した:4℃でまたは1で標的タンパク質に対するウサギ一次抗体を含むブロッキング溶液中で室温で4時間、一晩ブロットをインキュベートする。
- 一次抗体のラベルの後る、0.1%のTween-20を含むブロッキング溶液で膜を5分間ずつ3回洗浄する。
- 1で西洋ワサビペルオキシダーゼ(HRP)-conjugate抗ウサギ抗体でインキュベートする:10,000 1.5時間。
- PBS-Tで5分間、膜を5回ずつ洗浄する(PBS、0.1%のTween-20を補充した)。
- 化学発光ペルオキシダーゼ基質を用いたウエスタンブロットを処理する。
- ラジオイムノアッセイ(RIA)
- 12×75mmのポリスチレンチューブに(商業組換えhGAD65の300-2,400 / mlのから)異なる濃度でタンパク質抽出サンプルおよび標準の室温とピペット20μLに到達するための試薬(抗血清、トレーサーとタンパク質Aセファロース)を許可します。
- 抗血清の20μl加え、1時30 T1D患者の血漿交換から血清を希釈する準備。
- トレーサー(125-I-GAD65)の50μl添加し、室温で2時間インキュベートする。唯一の総活性を推定するためにトレーサーチューブを設定します。
- 50μLを追加プロテインAセファロース、室温で1時間インキュベートする。
- 30分間4℃で1500×gで各チューブと遠心分離機に冷PBS緩衝液1mlを分配する。
- 上清を除去し、静かにチューブをタップして吸い取り紙に残留液を吸収するためのチューブをデカント。
- ガンマカウンターで1分間計数することにより、すべてのチューブで免疫沈降した放射能を測定します。
- 対数スケールでプロット総活性に関連するキャリブレータの結合率(B / T%)を、標準曲線を確立し、検量線10からのサンプルのGAD濃度を読み取る。
注:制限区域は、放射性物質の貯蔵、取扱い及び廃棄のために設計されるべきである。
結果
異なる生産システムにおける標的組換えタンパク質の異種発現のための実験計画は、ここに記載されている。最初の焦点は、各システムにおける標的タンパク質の発現のための最適な条件を確立することによって、異なるプラットフォームをセットアップした。
標的タンパク質、hGAD65mutの発現は、三重E.で誘導された大腸菌の培養物。 37℃での発現の3時間後、細菌細胞を遠心分離により回収し、超音波処理により溶解した。遠心分離工程の後に、可溶性タンパク質は、不溶性の封入体から分離し、最初の分析(データは示さず)hGAD65mutが不溶性の封入体で優勢に蓄積することが実証された。組換えタンパク質の可溶化は、その強力な変性特性のために、hGAD65mutの不可能適切な定量化をする、RIAの分析を妨げる尿素6 M、の使用を必要とした。いくつかの戦略がなけれいる低温11で微生物細胞を増殖からなる、封入体の形成を制限するために報告アン。培養物を15℃および20℃で増殖させ、組換えタンパク質の発現は、同じ温度で誘導した。 図1Aに示すように、hGAD65mutの可溶化は、再び尿素(レーンS2)を必要とし、いずれの温度で製造する。したがって、この実験では、低温では、不溶性凝集体を形成するのhGAD65mutを妨げない。
hGAD65mut配列(Baculo.G65mut)を含有するバキュロウイルスベクターは、付着したSf9細胞の培養物中で発現させた。 V1、V2の高力価ストックを調製し、最高のパフォーマンス感染条件は、5〜50μLから異なるウイルス在庫点数を評価する設定した。 図1Bに示すように、RIAによって評価されるように、最適なウイルスストック量は、培養培地1ml当たりの組換えタンパク質の11.8±0.8μgの得、25μlのように同定された分析( 表1)。
agroinfected N.の浸潤の後、時間経過解析ベンサミアナ葉二つ一過性発現系で行った。 pK7WG2ベースのシステムの場合、葉のサンプルを、1〜5の範囲解像度で毎日プールし、総可溶性タンパク質(TSP)を抽出し、TSPの等量をウェスタンブロット( 図1C)により分析した。この分析は、標的組換えタンパク質の最大蓄積が2 DPIに達していることを強調した。したがって、葉は2解像度を回収し、タンパク質抽出物を、67.8μgの/グラムFLW(新鮮な葉の重量は 、 表1)の平均値を示している組換えタンパク質の蓄積を測定するためのRIAにより分析した。組換えタンパク質発現レベルは、このシステムを使用して、さらに12プロP19やHC等の転写後遺伝子サイレンシング(PTGS)のサプレッサーで葉に共浸潤により、改善することができる。
ザ·同じ時間経過の検出はNで行ったアナタバコは MagnICONベクターでagroinfected葉:感染した葉は、ウェスタンブロットによって分析したTSPの1-8解像度と同等の金額を収集した。この分析は、RIAによって評価された最大の組換えタンパク質の蓄積は、78.8μgの/グラムFLW( 表1)組換えタンパク質の平均蓄積と、4解像度( 図1D)が得られることを実証した。
トランスジェニックタバコ植物におけるhGAD65mutの発現は、以前に組換えタンパク質のレベルは独立して形質転換された系統間で有意に変化していることを示し、12は報告されている。最適パフォーマンスhGAD65mut T1トランスジェニック植物は、自家交雑た派生植物(T2)はいずれかを実行し、再度最良を選択するために分析した。この手順はありませんまで、RIAにより各世代でのパフォーマンスをチェックし、均質な生産プラットフォームを開発するために、数世代にわたって繰り返したさらなる改良は(データは示していない)を達成した。 図1Eに、T5トランスジェニック植物の代表的なウェスタンブロットは、組換えタンパク質収量の均一性が明らかである場合には、報告されている。 図1Fに示すように、平均hGAD65mut収率は選択プロセスの間に、99.1μgの/グラムFLW( 表1)のレベルに達し、T6にT2に増加し、発現レベルの標準偏差が減少した。
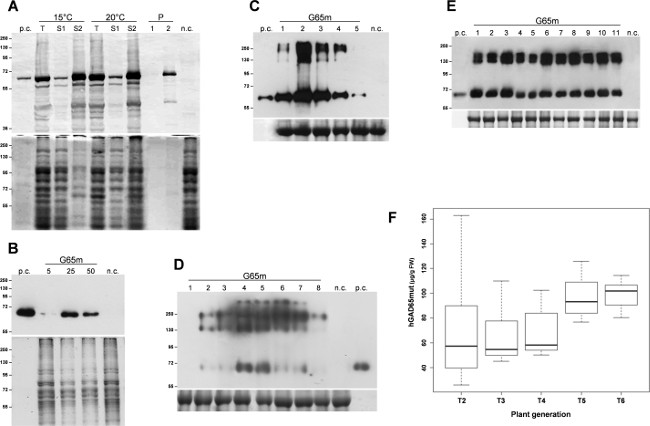
図1:プラットフォームのセットアップセットアップ各プラットフォームにおけるhGAD65mut発現のための最高の条件を設定します。 (A)E.大腸菌誘導性発現プラットフォーム。細菌細胞は、クーマシーで染色したコントロールをロードする、15°Cまたは20°C。 上のパネル 、細胞抽出物中のhGAD65mutのウェスタンブロット(レーン当たり2μgのにTSP)。 下のパネルで増殖させた。 N.C。 =陰性対照、クロラムフェニコール耐性遺伝子を含むpDEST17ベクターで形質転換した細菌細胞。 T:総サンプル。 S1:超音波処理し、遠心分離後の上清。 S2およびP:尿素含有緩衝液に可溶化試料の遠心分離後の上清(1)及びペレット(2)。 (B)バキュロウイルス/昆虫細胞プラットフォーム。 5、25と50μlのアッパーパネル 、細胞抽出物中のhGAD65mutのウェスタンブロット(レーン当たり5μgののTSP) 下のパネルを 、クマシーで染色したコントロールをロードする次のウイルス在庫点数を試験した。。。 ncは、陰性対照、非形質転換昆虫細胞の抽出物を=。 N.中(C)一過性発現pK7WG2ベクターを用いbenthamiana植物 。サンプルは、毎日1-5 DPI(レーン1-5)。 アッパーパネル 、葉の抽出物中のhGAD65mutのウェスタンブロット(レーンあたり2.5μgののTSP)を収集した。 下のパネルを 、クマシー、大サブユニットで染色したコントロールをロードするルビスコのは明らかである。のnc =陰性対照、 のgfpマーカー遺伝子を有するpK7WG2ベクターで浸潤された植物。 (D)N.における一過性発現MagnICONベクターを用いてbenthamiana植物 。サンプルは。 アッパーパネル 、葉の抽出物中のhGAD65mutのウェスタンブロット(レーン当たり5μgののTSP)、毎日1-8 DPI(レーン1-8)を収集した。ルビスコの大サブユニットが明らかであるクーマシーで染色下のパネル 、ローディングコントロールを。 NC =ネガティブコントロールは、のみpICH20111 5'-モジュール及びpICH14011インテグモジュールを浸透させた植物。数字はkDaの分子質量マーカーを示している。パソコン=陽性対照、バキュロウイルス/昆虫細胞系において産生さ商業hGAD65 15ngの。 (E)N.における安定な発現タバコ工場 。葉試料は、異なるT5植物(レーン1-11)から採取した。アッパーパネル、葉の抽出物中のhGAD65mutのウェスタンブロット(レーン当たり5μgののTSP)。ワット染色下のパネル、ローディングコントロールi番目のクマシー。 ncは陰性対照、野生型植物を=。数字はkDaの分子質量マーカーを示している。パソコン=陽性対照、バキュロウイルス/昆虫細胞系において産生さ商業hGAD65 15ngの。 (F)N.における安定な発現タバコ工場 。最高のパフォーマンスhGAD65mut T1トランスジェニックタバコ植物由来の数世代にわたるhGAD65mut蓄積の箱ひげ図表現が。RIAデータから計算μgの/グラムFLWとして報告この図の拡大版をご覧になるにはこちらをクリックしてください。
| システム | [hGAD65mut](μg/ ml)を | [hGAD65mut] |
| バキュロ/昆虫 | 117.5±7.7 | 11.8±0.8 / mlの培養培地 |
| Transienトン | 22.6±0.9 | 67.8±2.7μgの/ gのFLW |
| MagnICON | 26.3±5.9 | 78.8±17.8μgの/ gのFLW |
| エリートT6 | 33.0±3.8 | 99.1±11.3μgの/ gのFLW |
表1: - ( ベンサミアナタバコおよびN.タバコのエリートT6にpK7WG2-とMagnICON)発酵槽ベース(バキュロ/昆虫)と植物ベースのhGAD65mutはhGAD65mutの異なるプラットフォームでの収量が得られます 。第二カラム - タンパク質抽出物中hGAD65mut濃度(μg/ ml)。第三列 - 新鮮葉の重量(μgの/ gのFLW)でhGAD65mutコンテンツ植物ベースのプラットフォームのための、細胞培養培地中(μg/ ml)を発酵槽ベースのプラットフォームのために。
ディスカッション
細菌細胞、バキュロウイルス/昆虫細胞および植物:本研究では三つの異なるプラットフォームは、組換えヒトタンパク質の発現を比較した。植物ベースのプラットフォームは、さらに、(かつ安定した- -ベースMagnICONとpK7WG2 すなわち 、一過性の)3広く使用されている発現技術を利用して調査した。この実験で、hGAD65mutのために選択された標的タンパク質は、以前に別のシステム13内で発現されており、その生産と機能を容易に検出し、14測定可能である。
hGAD65mutこのように面倒な可溶化を必要とし、そのネイティブなコンフォメーションを達成するために、リフォールディングも、低温成長条件で、封入体を形成したので、細菌細胞は、効率的な生産プラットフォームではなかった。実際、複雑な組換えタンパク質の発現のために、このプラットフォームの主な障害は、最終製品の右配座である。
ザ·バキュロウイルス/昆虫細胞プラットフォームは、免疫反応性組換えタンパク質の高発現を媒介したが、この発現系の主な制限は、昆虫細胞を成長させるために必要な培地の高コストである。これは、(必要な昆虫細胞培養培地の9 Lを考慮して)hGAD65mut 1gの総製造コストは、この製造プラットフォーム700ユーロに達する可能性があると推定された。この発現プラットフォームの更なる制限は、無菌操作のスキルを持つ人材を必要とする、昆虫細胞の無菌栽培の必要性である。細胞を感染させるために使用されるウイルスストック量およびウイルス感染のタイミングの2つの重要なパラメータは、慎重にこの発現系で制御する必要があり、効率的な組換えタンパク質の蓄積を確保する。また、Sf9昆虫細胞からの全可溶性タンパク質抽出のために使用される界面活性剤は、大幅に組換えタンパク質の可溶化に影響を与える。
植物ベースのシステムは、最も有益なplatfoたRMはhGAD65mutを表現する:植物で作製された組換えタンパク質は、免疫反応性と葉組織において高レベルで蓄積した。異なる植物に基づく発現系を比較すると、最も高い収率は、安定に形質転換タバコ植物( 表1)中に達成され、N.と比較して、タバコの全バイオマスを考慮した場合ベンサミアナは 、一過性発現のために使用される、タバコの全体的により高い生産性が明らかである。しかし、安定した形質転換タバコ植物ベースのプラットフォームの主な制限は、我々の研究では20ヶ月を要し、システムのセットアップに要する時間である。実際に、ホモ接合線は、組換えタンパク質の発現の均一性のために選択されるべきであり、それは行を表現する最高T1から開始し、繰り返し自己架橋サイクルを必要とし得る。選択されたT1はトランスジェニック形質の複数のコピーが付されているときは、特に、繁殖プログラムは、3年ほどかかる場合があります。
一過性発現系が提供される形質転換および発現及び4日かかる発現プラットフォームのセットアップの間に短い間隔に起因する急速なアップスケーリングの利点。しかし、植物ベースの過渡システムの限界は、アグロ浸潤のための専用の高品位機器を使用しない限り、それらの自動化実験室規模ではほとんど実現可能であることである。したがって、一過性ベースのシステムを使用してhGAD65の大規模生産のための適切な計算をここで行うことができない。一方、我々は、T6安定タバコ系統を用いた組換えタンパク質1gの総生産コスト未満5ユーロ(60タバコ植物を成長させるための土壌を考慮して)で計算することができると推測している。以前に15を報告したように、いくつかの重要なパラメータを慎重に制御する必要があり、効率的なアグロ浸潤およびタンパク質生産を確保(植物発育段階、成長し、アグロバクテリウムの浸潤状態)にする。さらに、各発現実験のために、特定の時間経過分析があるべき組換えタンパク質の最も高い蓄積を可能にするDPIを選択するために実施。
ここで説明する例では、従来のシステムに比べて植物ベースの製造の特定の利点のいくつかを強調して証明の原理事例として考えることができる。具体的には、均一に、組換えタンパク質を発現するタバコのトランスジェニック系統は、大大量に必要とされる組換えタンパク質の大量生産のための貴重なプラットフォームと考えることができる。
開示事項
The authors declare that there is no conflict of interests regarding the publication of this paper.
謝辞
This work was supported by the COST action ‘Molecular pharming: Plants as a production platform for high-value proteins’ FA0804. The Authors thank Dr Anatoli Giritch and Prof. Yuri Gleba for providing the MagnICON vectors for research purposes.
資料
| Name | Company | Catalog Number | Comments |
| Yeast extract | Sigma | Y1333 | |
| Tryptone | Formedium | TRP03 | |
| Agar Bacteriological Grade | Applichem | A0949 | |
| Sf-900 II SFM medium | Gibco | 10902-088 | |
| Grace’s Insect Medium, unsupplemented | Gibco | 11595-030 | |
| Cellfectin II Reagent | Invitrogen | 10362-100 | |
| MS medium including vitamins | Duchefa Biochemie | M0222 | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Plant agar | Duchefa Biochemie | P1001 | |
| Ampicillin sodium | Duchefa Biochemie | A0104 | Toxic |
| Gentamycin sulphate | Duchefa Biochemie | G0124 | Toxic |
| Ganciclovir | Invitrogen | I2562-023 | |
| Carbenicillin disodium | Duchefa Biochemie | C0109 | Toxic |
| Kanamycin sulfate | Sigma | K4000 | Toxic |
| Rifampicin | Duchefa Biochemie | R0146 | Toxic – 25 mg/ml stock in DMSO |
| Streptomycin sulfate | Duchefa Biochemie | S0148 | Toxic |
| Spectinomycin dihydrochloride | Duchefa Biochemie | S0188 | |
| IPTG (isopropil-β-D-1-tiogalattopiranoside) | Sigma | I5502 | Toxic |
| MES hydrate | Sigma | M8250 | |
| MgCl2 | Biochemical | 436994U | |
| Acetosyringone | Sigma | D134406 | Toxic – 0.1 M stock in DMSO |
| Syringe (1 ml) | Terumo | ||
| MgSO4 | Fluka | 63136 | |
| BAP (6-Benzylaminopurine) | Sigma | B3408 | Toxic |
| NAA (Naphtalene acetic acid) | Duchefa Biochemie | N0903 | Irritant |
| Cefotaxime | Mylan Generics | ||
| Trizma base | Sigma | T1503 | Adjust pH with 1 N HCl to make Tris-HCl buffer |
| HCl | Sigma | H1758 | Corrosive |
| NaCl | Sigma | S3014 | 1 M stock |
| KCl | Sigma | P9541 | |
| Na2HPO4 | Sigma | S7907 | |
| KH2PO4 | Sigma | P9791 | |
| PMSF (Phenylmethanesulfonylfluoride) | Sigma | P7626 | Corrosive, toxic |
| Urea | Sigma | U5378 | |
| β-mercaptoethanol | Sigma | M3148 | Toxic |
| Tween-20 | Sigma | P5927 | |
| Hepes | Sigma | H3375 | |
| DTT (Dithiothreitol) | Sigma | D0632 | Toxic – 1 M stock, store at -20 °C |
| CHAPS | Duchefa Biochemie | C1374 | Toxic |
| Plant protease inhibitor cocktail | Sigma | P9599 | Do not freeze/thaw too many times |
| SDS (Sodium dodecyl sulphate) | Sigma | L3771 | Flammable, toxic, corrosive – 10% stock |
| Glycerol | Sigma | G5516 | |
| Brilliant Blue R-250 | Sigma | B7920 | |
| Isopropanol | Sigma | 24137 | Flammable |
| Acetic acid | Sigma | 27221 | Corrosive |
| Anti-Glutamic acid decarboxylase 65/67 | Sigma | G5163 | Do not freeze/thaw too many times |
| Horseradish peroxidase (HRP)-conjugate anti-rabbit antibody | Sigma | A6154 | Do not freeze/thaw too many times |
| Sf9 Cells | Life Technologies | 11496 | |
| BL21 Competent E. coli | New England Biolabs | C2530H | |
| Protein A Sepharose | Sigma | P2545 | |
| Cell culture plates | Sigma | CLS3516 | |
| Radio Immuno Assay kit | Techno Genetics | 12650805 | Radioactive material |
参考文献
- Hampe, C. S., Hammerle, L. P., Falorni, A., Robertson, J., Lernmark, A. Site-directed mutagenesis of K396R of the 65 kDa glutamic acid decarboxylase active site obliterates enzyme activity but not antibody binding. FEBS Lett. 488 (3), 185-189 (2001).
- Avesani, L., et al. Recombinant human GAD65 accumulates to high levels in transgenic tobacco plants when expressed as an enzymatically inactive mutant. Plant Biotechnol. J. 9 (8), 862-872 (2010).
- Sambrook, J., et al. . Molecular Cloning: A laboratory manual. Second Edition. , (1989).
- Avesani, L., et al. Comparative analysis of different biofactories for the production of a major diabetes autoantigen. Transgenic Res. 23, 281-291 (2014).
- Marillonnet, S., Giritch, A., Gils, M., Kandzia, R., Klimyuk, V., Gleba, Y. In planta engineering of viral RNA replicons: efficient assembly by recombination of DNA modules delivered by Agrobacterium. Proc. Natl. Acad. Sci. (USA). 101 (18), 6852-6857 (2004).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants). Curr. Opin. Biotechnol. 18, 134-141 (2007).
- Engler, C., Kandzia, R., Marillonnet, S. A one pot, one step, precision cloning method with high throughput capability. PLoS One. 3 (11), (2008).
- Xu, R., Li, Q. Q. Protocol: streamline cloning of genes into binary vectors in Agrobacterium via the Gateway TOPO vector system. Plant Methods. 4 (4), 1-7 (2008).
- Fairbanks, G., Steck, T. L., Wallach, D. F. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606-2617 (1971).
- Falorni, A., et al. Radioimmunoassay detects the frequent occurrence of autoantibodies to the Mr 65,000 isoform of glutamic acid decarboxylase in Japanese insulin-dependent diabetes. Autoimmunity. 19, 113-125 (1994).
- Hunt, I. From gene to protein: a review of new and enabling technologies for multi-parallel protein expression. Protein Expr. Purif. 40 (1), 1-22 (2005).
- Arzola, L., et al. Transient co-expression of post-transcriptional silencing suppressor for increased in planta expression of a recombinant anthrax receptor fusion protein. Int. J. Mol. Sci. 12 (8), 4975-4990 (2011).
- Merlin, M., Gecchele, E., Capaldi, S., Pezzotti, M., Avesani, L. Comparative evaluation of recombinant protein production in different biofactories: the green perspective. Biomed. Res. Int. 2014, 136419 (2014).
- Avesani, L., et al. Improved in planta expression of the human islet autoantigen glutamic acid decarboxylase (GAD65). Transgenic Res. 12 (2), 203-212 (2003).
- Leuzinger, K., et al. Efficient agroinfiltration of Plants for high-level transient expression of recombinant proteins. J Vis Exp. (77), (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved