Method Article
Une analyse comparative des recombinant expression des protéines dans différents bio-usines: bactéries, cellules d'insectes et Plant Systems
Dans cet article
Résumé
In this study the expression of a target human recombinant protein in different production platforms was compared. We focused on traditional fermenter-based cultures and on plants, describing the set-up of each system and highlighting, on the basis of the reported results, the inherent limits and advantages for each platform.
Résumé
Systèmes à base de plantes sont considérées comme une plate-forme précieuse pour la production de protéines recombinantes en raison de leur potentiel bien documenté pour la production à faible coût flexible de haute qualité, produits bioactifs.
Dans cette étude, nous avons comparé l'expression d'une protéine cible recombinante humaine dans les cultures traditionnelles à base de fermentation de cellules (bactériennes et d'insectes) avec les systèmes d'expression à base de plantes, à la fois transitoires et stables.
Pour chaque plate-forme, nous avons décrit la mise en place, l'optimisation et la longueur du processus de production, la qualité du produit final et les rendements et nous avons évalué les coûts de production provisoires, spécifiques de la protéine recombinante cible sélectionnée.
Dans l'ensemble, nos résultats indiquent que les bactéries ne sont pas appropriés pour la production de la protéine cible en raison de son accumulation dans les corps d'inclusion insolubles. D'autre part, les systèmes à base de plantes sont des plateformes polyvalentes tchapeau permet la production de la protéine choisie à plus faibles que les coûts-baculovirus / système de cellule d'insecte. En particulier, les lignées transgéniques stables affichent le plus haut rendement du produit final et transitoires plantes exprimant le processus de développement plus rapide. Cependant, toutes les protéines recombinantes peuvent bénéficier de systèmes à base de plantes, mais la meilleure plate-forme de production devraient être déterminées empiriquement avec une approche au cas par cas, comme décrit ici.
Introduction
Recombinant proteins are commercially mass-produced in heterologous expression systems with the aid of emerging biotechnology tools. Key factors that have to be considered when choosing the heterologous expression system include: protein quality, functionality, process speed, yield and cost.
In the recombinant protein field, the market for pharmaceuticals is expanding rapidly and, consequently, most biopharmaceuticals produced today are recombinant. Proteins can be expressed in cell cultures of bacteria, yeasts, molds, mammals, plants and insects, as well as in plant systems (either via stable- or transient-transformation) and transgenic animals; each expression system has its inherent advantages and limitations and for each target recombinant protein the optimal production system has to be carefully evaluated.
Plant-based platforms are arising as an important alternative to traditional fermenter-based systems for safe and cost-effective recombinant protein production. Although downstream processing costs are comparable to those of microbial and mammalian cells, the lower up-front investment required for commercial production in plants and the potential economy of scale, provided by cultivation over large areas, are key advantages.
We evaluated plants as bioreactors for the expression of the 65 kDa isoform of human glutamic acid decarboxylase (hGAD65), one of the major autoantigen in Type 1 autoimmune diabetes (T1D). hGAD65 is largely adopted as a marker, both for classifying and monitoring the progression of the disease and its role in T1D prevention is currently under investigation in clinical trials. If these trials are successful, the global demand for recombinant hGAD65 will increase dramatically.
Here, we focus on the expression of the enzymatically inactive counterpart of hGAD65, hGAD65mut, a mutant generated by substituting the lysine residue that binds the cofactor PLP (pyridoxal-5'-phosphate) with an arginine residue (K396R)1.
hGAD65mut retains its immunogenicity and, in plant and insect cells, accumulates up to ten-fold higher than hGAD65, its wild-type counterpart. It was hypothesized that the enzymatic activity of hGAD65 interferes with plant cell metabolism to such an extent that it suppresses its own synthesis, whereas hGAD65mut, the enzymatically-inactive form, can be accumulated in plant cells to higher levels.
For the expression of hGAD65mut, the use of different technologies, widely used in plant biotechnology, was explored here and compared to traditional expression platforms (Escherichia coli and Baculovirus/insect cell-based).
In this work, the recombinant platforms developed for the expression of hGAD65mut comprising traditional and plant-based systems were reviewed and compared on the basis of process speed and yield, and of final product quality and functionality.
Protocole
1. Construction de vecteurs d'expression
- Commercial recombinaison système de clonage:
- Amplifier la séquence du gène cible (hGAD65mut) avec des amorces appropriées permettant l'addition d'une pince de CACC à l'extrémité 5 'du gène, comme décrit précédemment 2 de pleine longueur.
- Clonage du produit d'amplification purifié sur gel, selon les directionnels spécifications de la trousse de clonage, dans le vecteur d'entrée (topoisomérase liée) par l'assemblage de la réaction dans un volume total de 6 ul, en utilisant une 1,5: 1 ratio molaire insert: vecteur et 1 ul de solution de sel (NaCl 0,2 M et 0,01 MgCl 2). Incuber pendant 5 min à température ambiante (RT).
- Transformer la totalité de la réaction dans E. chimiquement compétente cellules coli selon directionnelles spécifications du kit de clonage et colonies d'écran obtenus par PCR sur colonie 3, en utilisant M13 amorces sens et antisens inclus dans le kit de clonage directionnel. Isoler le plasmide d'un pocolonie sitif selon l'une préparation d'ADN plasmide spécifications de la trousse et la séquence insert M13 en utilisant des amorces directe et inverse pour assurer l'absence de mutations 3.
- Utilisez une entrée clone obtenu pour effectuer la réaction de recombinaison de l'Lambda recombinase Clonase II Enzyme (LR) avec des vecteurs de destination spécifiques: pour l'expression de protéines recombinantes dans des cellules bactériennes avec pDEST17 (rendement pDEST17.G65mut), dans les plantes (transitoire ou stable) avec pK7WG2 (donnant pK7WG2.G65mut), dans Baculovirus / système de cellule d'insecte avec l'ADN viral linéarisé (donnant Baculo.G65mut) 4. Monter la réaction, selon les spécifications de la trousse de Clonase, avec 100 ng de vecteur d'entrée, 150 ng de vecteur de destination et 2 ul de mélange enzymatique dans un volume final de 10 ul. Incuber le mélange à température ambiante pendant 1 heure.
- Transformer le produit de recombinaison dans E. chimiquement compétente cellules coli selon Clonase spécifications du kit. Écran colonies obtenues par PCR 3 à l'aide de toutes les colonies dérivées de la réaction de transformation de la même amorce inverse spécifique GAD65mut (5'-CACACGCCGGCAGCAGGT-3 ') et les vecteurs de destination amorces sens spécifiques suivants: pour pDEST17: 5'-TAATACGACTCACTATAGGG-3'; pour pK7WG2: 5'-AAGATGCCTCTGCCGACAGT-3 '; pour Baculo vecteur linéarisé: 5'-AAATGATAACCATCTCGC-3 '.
- Isoler l'ADN plasmidique en utilisant un kit d'ADN de minipréparation commercial et confirmer la présence de la séquence cible par PCR 3, en utilisant les mêmes combinaisons d'amorces spécifiques décrites dans l'étape précédente.
- Utilisation des plasmides PCR-positifs obtenus à transformer les organismes cibles différentes, en fonction de la plate-forme choisie pour l'expression de protéines recombinantes comme décrit dans les étapes suivantes.
- Système de MagnICON 7.5:
- Clonage du gène cible dans la 3'-module pICH31070, comme décrit précédemment en détail 7, ce qui donne pICH31070.G65mut. Utilisez lesuivant le cycle de réaction spécifique: 30 min d'incubation à 37 ° C, 5 min à 50 ° C, puis 5 min à 80 ° C.
2. Recombinant Protein Expression
- Système de cellule bactérienne:
- Transformer pDEST17.G65mut dans E. coli BL21 (DE3) Des cellules électrocompétentes utilisant des techniques classiques et l'écran les colonies cultivées sur contenant de l'ampicilline (100 ug / ml) du milieu LB, par une PCR sur colonie en utilisant les amorces spécifiques d'un transgène suivante: 5'-CTGGTGCCAAGTGGCTCAGA-3 'et 5' -CACACGCCGGCAGCAGGT-3 ', avec une température d'hybridation de 58 ° C et un temps d'élongation de 20 sec. Effectuer la réaction PCR dans un volume total de 20 ul après dissolution des cellules bactériennes avec un embout en plastique dans le tube.
- Inoculer une seule colonie pendant une nuit à 37 ° C dans 3 ml d'ampicilline contenant (100 ug / ml de milieu LB).
- Diluer la culture bactérienne 1: 100 dans 100 ml de milieu LB frais (y compris ampicillin) et incuber à 37 ° C pendant 1-6 h jusqu'à une DO finale de 0,8 600.
- Induire l'expression de la protéine recombinante par addition d'isopropil-β-D-1-tiogalattopiranoside (IPTG) à une concentration finale de 1 mM et on incube la culture avec agitation vigoureuse pendant 3 heures à 37 ° C.
- Recueillir les cellules par centrifugation à 4000 xg pendant 20 min et en utilisant culot bactérien pour l'extraction de la protéine (étape 3.1.1.1).
- Baculovirus / système de cellule d'insecte:
- Semences Spodoptera frugiperda (Sf9) cellules dans des plaques 6 puits (8 x 10 5 cellules par puits) et laver deux fois avec 2 ml de non-complété insectes milieu de Grace.
- Retirez et remplacez le goutte à goutte du mélange de transfection (5 pi LR réaction recombinant, solution de Celfectin 6 pi et 200 pi non complétée insectes milieu de Grace) moyen.
- Incuber les plaques à 27 ° C pendant 5 heures.
- Retirer et remplacer mélange de transfection avec 2 ml de frais Sf-900 milieu, complémenté avec 10% de sérum bovin foetal, 10 ug / ml de gentamycine et 100 uM de ganciclovir pour sélectionner des clones de baculovirus recombinant.
- Après une incubation de 96 h à 27 ° C, de recueillir moyen (V1 stock virale), centrifuger à 4000 xg pour éliminer les cellules et les gros débris et de stocker dans l'obscurité à 4 ° C.
- Graine 1 x 10 6 cellules Sf9 par puits dans 2,5 ml Sf-900 un milieu contenant 10% de sérum bovin foetal, 10 ug / ml de gentamycine et 100 uM de ganciclovir et d'infecter avec 100 ul de stock en V1 chaque puits.
- Incuber les cellules pendant 3 jours à 27 ° C.
- Recueillir et milieu de centrifuger à 4000 x g.
- Stocker le surnageant (V2-titre élevé stock) à 4 ° C.
- Graine 1 x 10 6 cellules Sf9 par puits dans 2,5 ml Sf-900 un milieu contenant 10% de sérum bovin foetal, 10 ug / ml de gentamycine et 100 uM de ganciclovir et d'infecter avec 25 ul de stock en V2 chaque puits.
- Incuber les cellules pendant 3 jours à 27 ° C.
- Recueillir les cellules par centrifugation à 4000 xg et en utilisant culot de cellules d'insecte pour l'extraction de la protéine (étape 3.1.2. 1).
- Nicotiana benthamiana systèmes d'expression transitoire:
- Cultivez N. benthamiana plantes dans une serre, sous la lumière naturelle dans la plage de température de 18 à 23 ° C. Pour agroinfection utiliser de vieux 4-5 semaines plantes.
- Gardez les plantes agroinfected dans une chambre climatique à 22 ° C avec un 13 h jours / 11 h nuit photopériode.
- Commercial recombinaison système de clonage:
- Introduire dans pK7WG2.G65mut souche d'Agrobacterium tumefaciens EHA105 cellules électrocompétentes 8 comme décrit précédemment et cribler les colonies cultivées sur du milieu LB contenant de la rifampicine (50 ug / ml), streptomycine (300 ug / ml) et de spectinomycine (100 ug / ml) après 2 jours d'incubation à 28 ° C, par PCR sur colonie 8 en utilisant les amorces spécifiques de transgènes suivantes: 5'-CATGGTGGAGCACGACACGCT-3 & #8217; et 5'-CACACGCCGGCAGCAGGT-3 ', avec une température d'hybridation de 58 ° C et un temps d'élongation de 50 sec. Effectuer la réaction PCR dans un volume total de 20 ul.
- Inoculer les bactéries dans 30 ml de milieu LB contenant de la rifampicine (50 ug / ml), streptomycine (300 ug / ml) et de spectinomycine (100 ug / ml) pendant deux jours à 28 ° C.
- Recueillir les bactéries par centrifugation à 4000 xg pendant 20 min et remettre en suspension le culot dans 10 ml de tampon d'infiltration (MES 10 mM, 10 mM de MgCl2, 100 uM d'acétosyringone, pH 5,6). Mesurer la valeur OD 600 puis ajuster à 0,9 par dilution dans le même tampon.
REMARQUE: le volume total nécessaire pour l'infiltration de trois N. benthamiana plantes est de 30 ml. - Utiliser une seringue sans aiguille de 2,5 ml d'infiltrer la suspension d'Agrobacterium dans N. benthamiana laisse. Soigneusement et lentement injecter panneaux de feuilles avec la suspension de la seringue. Infiltrez trois l élargicombles par plante et utilisent trois plantes triple.
REMARQUE: pour des raisons de santé et de sécurité portent des lunettes de protection pendant le processus d'infiltration. - Ramasser les feuilles 2 jours infection agroinfiltrated de poste (ppp) et le gel dans de l'azote liquide. Magasin tissu végétal à -80 ° C.
- MagnICON système:
- Présentez les vecteurs de MagnICON - le «module (pICH20111), 3 '5 module (pICH31070.G65mut), et le module de l'intégrase (pICH14011) - dans A. tumefaciens souche GV3101 utilisant des techniques standard. Cribler les colonies cultivées sur du milieu LB contenant 50 ug / ml de rifampicine et antibiotique approprié spécifique de vecteur (50 ug / ml de carbénicilline à pICH20111 et pICH14011, 50 pg / ml de kanamycine pour pICH31070), par une PCR sur colonie en utilisant des amorces spécifiques pour chaque vecteur.
- Inoculer séparément les trois A. tumefaciens souches dans 5 ml de milieu LB contenant 50 pg / ml de rifampicine et un antibiotique spécifique vecteur appropriéet agiter pendant une nuit à 28 ° C.
- Pellet cultures d'une nuit bactériennes par centrifugation à 4000 g pendant 20 min et remettre en suspension dans deux volumes de la culture bactérienne initiale de 10 mM de MES (pH 5,5) et 10 mM MgSO 4.
- Mélanger des volumes égaux de suspensions bactériennes contenant les trois vecteurs et utiliser le mélange de suspension pour seringue infiltration de N. benthamiana laisse. Infiltrez trois feuilles déployées par plante.
- Ramasser les feuilles agroinfiltrated à 4 ppp et congeler dans l'azote liquide.
- Magasin tissu végétal à -80 ° C.
- Nicotiana tabacum système d'expression stable:
- Développer et entretenir les plantules in vitro de N. tabacum (var Sr1.) sur une solide milieu de culture végétale (4,4 g / L de Murashige et Skoog - MS - support y compris les vitamines, 30 g / L de saccharose, pH 5,8, 7 g / agar usine de L) dans des conditions contrôlées en chambre climatique à 25 ° C avec 16 h jour / 8 h / niGHT régime.
- Démarrer une pré-culture de A. tumefaciens EHA105 hébergeant le pK7WG2.G65mut vecteur d'expression dans 5 ml de milieu YEB liquide avec des antibiotiques appropriés (à la rifampicine 50 ug / ml, streptomycine 300 pg / ml, la spectinomycine 100 ug / ml) et de croître pendant une nuit à 28 ° C dans un ensemble d'agitateur orbital à 200 rpm.
- Utiliser 1 ml de la pré-culture pour inoculer une culture de 50 ml d'Agrobacterium dans un milieu plus les antibiotiques YEB (rifampicine 50 ug / ml, streptomycine 300 pg / ml, la spectinomycine 100 ug / ml) et de croître pendant 24 heures, jusqu'à ce que la culture bactérienne est saturé (600 OD valeur de 0,5 à 1,0).
- Recueillir les bactéries par centrifugation à 4000 g pendant 20 min et remettre le culot dans 50 ml de milieu liquide de culture de plantes. Répétez cette étape deux fois pour enlever complètement antibiotiques.
- Prenez premières feuilles saines sont entièrement développés à partir de plantes in vitro dans de tabac et les couper en carrés d'environ 1 cm.
- morceaux de feuilles de transfertaux plats de Pétri contenant profondes suspension bactérienne et laisser dans l'obscurité pendant 20 min.
- Retirer les morceaux de feuilles de suspension et sécher sur du papier filtre stérile.
- Placez les morceaux de feuilles avec côté adaxial (surface supérieure des feuilles) sur un milieu de culture de la plante solide contenant 1,0 pg / ml 6-benzylaminopurine (BAP) et / acide acétique naphtalène ml 0,1 pg (NAA) et incuber les plaques pendant deux jours dans une chambre climatique à contrôlée conditions (25 ° C, 16 h jour / 8 h nuit).
- la feuille de transfert de pièces sur un milieu de culture solide (y compris 1,0 ug / ml de BAP, 0,1 mg / ml de NAA, 500 ug / ml de cefotaxime, 100 ug / ml de kanamycine) avec une surface abaxiale (surface inférieure de la feuille) en contact avec le milieu.
- Incuber les plaques pendant 2-3 semaines dans la chambre climatique à 25 ° C avec 16 h / 8 h régime jour / nuit pour induire la formation de tournage. Subculture toutes les 2 semaines en transférant explants de feuilles au milieu de culture de la plante solide frais contenant 1,0 pg / ml BAP, 0,1 pg / ml NAA, 500ug / ml de cefotaxime et 100 ug / ml de kanamycine.
- Lorsque les pousses apparaissent les transférer à des boîtes Magenta contenant du milieu de culture solide comprenant 500 ug / ml de cefotaxime et 100 ug / ml de kanamycine pour induire la formation de racines. Incuber plantules avec 16 h jour / 8 h nuit photopériode à 25 ° C pendant 1-2 semaines.
- Lorsque les racines forme, transférer les plantes dans le sol dans la serre.
- Prélever un morceau de feuille pour chaque plante et isoler l'ADN génomique avec un kit commercial.
- Détecter la présence du transgène par PCR spécifique. Utiliser 30 ng d'ADN génomique comme matrice pour l'amplification par PCR en utilisant les amorces spécifiques d'un transgène suivante: 5'-CTGGTGCCAAGTGGCTCAGA-3 'et 5'-CACACGCCGGCAGCAGGT-3', avec une température d'hybridation de 58 ° C et un temps d'allongement de 20 s . Effectuer la réaction PCR dans un volume total de 50 ul.
- Analyser le produit de 220 pb par électrophorèse sur gel d'agarose à 1% dans du Tris-acétate-EDTA (TAE) tampon (40 mM Trest, de l'acide acétique 20 mM, et EDTA 1 mM).
- Sélectionner des plantes transgéniques contenant le gène cible.
- Prélever un morceau de chacun de la plante transgénique sélectionnée de la feuille et congeler dans l'azote liquide immédiatement.
- Préparer des extraits de protéines totales de tissus de feuille de la plante (étape 3.1.3) et de tester chaque échantillon par analyse western blot comme décrit précédemment 2 pour sélectionner la meilleure expression de plante de tabac de protéine recombinante.
- Sac fleurs de la plante sélectionnée meilleure performant avant la floraison pour empêcher la pollinisation croisée.
- Après la floraison, maturation du fruit et le séchage de semences, la collecte des sacs.
- Séparer les graines de la paille et de les stocker dans un endroit sec à température contrôlée (20-24 ° C).
- Semez les graines séchées pour produire les secondes plantes transgéniques de la génération, puis sélectionnez l'usine la plus performante pour être auto-pollinisation.
- Répétez la même procédure décrite dans les étapes 2.4.19-2.4.21 pour les générations suivantes.
3. Protéines recombinantes Analyses d'expression
- Extraction des protéines totales:
- Les cellules bactériennes:
- Remettre en suspension le culot de cellules bactériennes, recueilli comme décrit dans l'étape 2.1.5, dans la moitié du volume de culture d'une solution saline tamponnée au Tris (TBS - 2 mM de Tris / HCl, 500 mM de NaCl) à pH 7,4 supplémenté avec phenylmethanesulfonylfluoride 1 mM (PMSF).
- Soniquer remis en suspension culot cellulaire trois fois pendant 40 secondes à mi-puissance, tout en gardant l'échantillon sur de la glace.
- Clarifier lysat par centrifugation à 14 000 g pendant 20 min à 4 ° C.
- Transférer le surnageant dans un tube propre et stocker à la fois séparément surnageant et le culot à -80 ° C.
- Solubiliser les corps d'inclusion, recueillies dans le culot, dans la moitié du volume de lysat cellulaire de TBS pH 8,0 supplémenté avec 6 M d'urée par agitation vigoureuse pendant une nuit à température ambiante.
- Centrifuger à 10 000 g pendant 25 min à température ambiante et de recueillir surnageant dans un endroit propretube.
- Stocker à la fois surnageant et le culot à -80 ° C.
- Les cellules d'insectes:
- Laver culot de cellules d'insecte infectées, recueilli comme décrit dans l'étape 02/02/12, avec 1 ml de solution saline tamponnée au phosphate (PBS - 137 mM de NaCl, 2,7 mM de KCl, 10 mM de Na 2 HPO 4, 1,8 mM de KH 2 PO 4) à pH 7,4.
- Resuspendre les cellules dans 200 ul de tampon de lyse (20 mM Tris / HCl pH 8,0, 0,5 M de NaCl, 3 mM de β-mercaptoéthanol et 1% de Tween-20) et laisser incuber sur de la glace pendant 30 min.
- Centrifugeuse cellules solubilisé à 14 000 g pendant 20 min à 4 ° C.
- Recueillir des fractions solubles et conserver à -80 ° C et jeter le culot.
- tissus de la feuille de la plante:
- N. Grind benthamiana ou N. tabacum tissus en poudre fine dans de l'azote liquide en utilisant un mortier et un pilon.
- Homogénéiser 100 mg de tissu broyé dans 300 ul de tampon d'extraction (40 mM de Hepes pH 7,9, 5 mM de DTT, 1,5% CHAPS), Supplemented avec 3 ul d'inhibiteur protéase cocktail et de dégel sur la glace.
REMARQUE: le ratio choisi entre le poids du tissu de la plante (g) mettre en mémoire tampon le volume (ml) est de 1: 3. - extrait de Centrifuger à 30 000 xg pendant 30 min à 4 ° C.
- Recueillir surnageant dans un tube propre et conserver à -80 ° C.
- Les cellules bactériennes:
- Coomassie gel coloration:
- Préparer une dilution appropriée d'extraits de protéines totales (par exemple, 2 ul d'extrait de plante, 5 ul d'extraits bactériens et les insectes) jusqu'à un volume final de 10 ul de tampon d'extraction et ajouter 5 pl de tampon d'échantillon 3X (1,5 M Tris / HCl pH 6,8, 3% de SDS, 15% de glycerol, 4% de β-mercaptoéthanol) à une concentration finale 1x.
- Faire bouillir les échantillons pendant 10 min.
- Protéines séparées par 10% SDS-PAGE.
- Après électrophorèse, le gel de la chaleur en présence de Coomassie solution A (0,05% de bleu brillant R-250, 25% d'isopropanol, de l'acide acétique à 10%) dans un four à micro-ondes pendant environ deux minutess jusqu'au point d'ébullition.
- Refroidir gel à la température ambiante en agitant doucement.
- Jeter Coomassie solution de coloration A.
- Gel Destain par chauffage en présence de Coomassie solution B (0,05% de bleu brillant R-250, 25% d'isopropanol), C (acide acétique à 10%) (0,002% de bleu brillant R-250, de l'acide acétique à 10%) et D à chaque fois suivant le même protocole pour la coloration.
- Après la dernière étape de chauffage avec une solution D, laissez gel décoloration jusqu'au fond est clair neuf.
- Analyse par Western blot:
- Après l'électrophorèse, le transfert des protéines sur une membrane de nitrocellulose en utilisant des techniques standard et des blocs avec 4% de lait dans du PBS séparée à pH 7,4 à température ambiante pendant 1 heure.
- Incuber le buvardage pendant la nuit à 4 ° C ou pendant 4 heures à la température ambiante dans la solution de blocage contenant un anticorps primaire de lapin dirigé contre la protéine cible à 1: 10 000 et supplémenté avec 0,1% de Tween-20.
- Après étiquette anticorps primaireing, laver la membrane 3 fois pendant 5 minutes chacun avec une solution de blocage contenant 0,1% de Tween-20.
- Incuber la peroxydase de raifort (HRP) d'anticorps anti-lapin -conjugate au 1: 10 000 pendant 1,5 heure.
- Laver la membrane 5 fois pendant 5 minutes chacun avec du PBS-T (PBS supplémenté avec 0,1% de Tween-20).
- Processus western blot en utilisant le substrat de la peroxydase chimioluminescent.
- dosage radioimmunologique (RIA):
- Permettre aux réactifs (antisérum, traceur et la protéine A-Sepharose) pour atteindre la température ambiante et la pipette 20 ul d'échantillons et les étalons d'extrait de protéines à différentes concentrations (de 300-2,400 ng / ml de commerce recombinant hGAD65) dans des tubes de polystyrène de 12 x 75 mm.
- Ajouter 20 ul d'antisérum, préparé dilution 1:30 du sérum de plasmaphérèse d'un patient atteint de diabète de type 1.
- Ajouter 50 ul de traceur (125 I-GAD65) et incuber pendant 2 heures à température ambiante. Fixer un tube avec traceur seulement pour estimer l'activité totale.
- Ajouter 50 ulde protéine A-Sepharose et incuber pendant 1 heure à température ambiante.
- Verser 1 ml de tampon PBS froid dans chaque tube et centrifuger à 1500 g à 4 ° C pendant 30 min.
- Décanter les tubes pour éliminer surnageant et absorber le liquide résiduel sur du papier buvard en tapotant doucement tube.
- Mesure de la radioactivité immunoprécipitée dans tous les tubes par comptage pendant 1 minute dans un compteur gamma.
- Terrain en échelle logarithmique les taux de liaison (B / T%) des calibrateurs liés à l'activité totale, pour établir la courbe standard, et lire la concentration GAD d'échantillons sur la courbe d'étalonnage 10.
NOTE: Restreint zones devraient être conçus pour le stockage, la manipulation et l'élimination des matières radioactives.
Résultats
Un modèle expérimental pour l'expression hétérologue d'une protéine recombinante cible dans différents systèmes de production est décrite ici. Le premier objectif était la mise en place des différentes plates-formes mettant en place les conditions optimales pour l'expression de la protéine cible dans chaque système.
L'expression de la protéine cible, hGAD65mut, a été induite en triple E. coli cultures. A la suite de l'expression 3 h à 37 ° C, les cellules bactériennes ont été recueillies par centrifugation et lysées par sonication. Après une étape de centrifugation, on a séparé les protéines solubles à partir de corps d'inclusion insolubles et analyses initiales ont démontré que hGAD65mut prédominante accumulé dans les corps d'inclusion insolubles (données non présentées). Solubilisation de la protéine recombinante a nécessité l'utilisation de l'urée 6 M, qui, par ses propriétés de dénaturation solides, interfère avec l'analyse RIA, ce qui rend impossible une quantification correcte du hGAD65mut. Plusieurs stratégies ont êtreen signalée pour limiter la formation de corps d'inclusion, comprenant la culture des cellules microbiennes à basse température 11. Les cultures ont été cultivées à 15 ° C et 20 ° C, et l'expression de protéine recombinante a été induite à la même température. Comme le montre la Figure 1A, la solubilisation du produit hGAD65mut aux deux températures, nécessite encore l'urée (pistes S2). Ainsi, les basses températures dans cette expérience ne empêchent pas hGAD65mut de former des agrégats insolubles.
Les vecteurs de baculovirus contenant la séquence hGAD65mut (Baculo.G65mut) a été exprimée dans des cultures de cellules Sf9 adhérentes. V1 et V2 des stocks à titre élevé ont été préparés et les conditions d'infection les plus performants ont été mis en place l'évaluation de différents volumes en stock virales 5-50 ul. Comme le montre la figure 1B, le volume virale optimale du stock a été identifié comme 25 pi, ce qui donne 11,8 ± 0,8 pg de protéine recombinante par ml de milieu de culture, tel qu'évalué par RIAanalyse (tableau 1).
Après l'infiltration, le temps d'analyse du cours de N. agroinfected feuilles benthamiana a été effectuée dans les deux systèmes d'expression transitoire. Pour le système à base de pK7WG2, des échantillons de feuilles ont été rassemblées journalière dans la plage de 1 à 5 dpi, protéines totales solubles (TSP) ont été extraits et des quantités égales de TSP ont été analysés par western blot (Figure 1C). Cette analyse a mis en évidence que l'accumulation maximale de la protéine recombinante cible est atteinte deux dpi. Par conséquent, les feuilles ont été récoltées deux dpi et les extraits de protéines ont été analysés par RIA pour mesurer l'accumulation de protéines recombinantes, qui présente une moyenne de 67,8 ug / g FLW (poids frais des feuilles, tableau 1). Les niveaux d'expression de protéines recombinantes, en utilisant ce système, peuvent être encore améliorées, par co-infiltrant les feuilles avec un suppresseur de post-transcriptionnelle Gene Silencing (PTGS) comme P19 ou HC Pro 12.
Lemême la détection temps-cours a été réalisée avec N. benthamiana feuilles agroinfected avec les vecteurs d'MagnICON: feuilles infectées ont été recueillies 1-8 montants dpi et l'égalité de TSP ont été analysés par western blot. Cette analyse a démontré que l'accumulation maximale de la protéine recombinante est obtenu 4 dpi (Figure 1D), avec un moyen d'accumulation de la protéine recombinante de 78,8 ug / g FLW (tableau 1), tel qu'évalué par RIA.
L'expression de hGAD65mut dans les plantes de tabac transgéniques a été précédemment rapporté 12, montrant que les niveaux de protéines recombinantes variaient considérablement entre lignées transformées de façon indépendante. Le hGAD65mut T1 plante transgénique plus performants ont été auto-croisés et les plantes dérivées (T2) ont été analysés pour sélectionner à nouveau le plus performant une. Cette procédure a été répétée sur plusieurs générations de développer une plateforme de production homogène, la vérification de la performance dans chaque génération par RIA jusqu'à ce qu'aucuneamélioration supplémentaire a été obtenu (données non présentées). Dans la figure 1E, un western blot représentant de T5 plantes transgéniques est rapporté, où l'homogénéité des rendements en protéines recombinantes est évident. Comme le montre la figure 1F, le rendement de hGAD65mut moyen est passé de T2 à T6, atteignant le niveau de 99,1 ug / g FLW (tableau 1) et, pendant le processus de sélection, l'écart type du niveau d'expression diminuait.
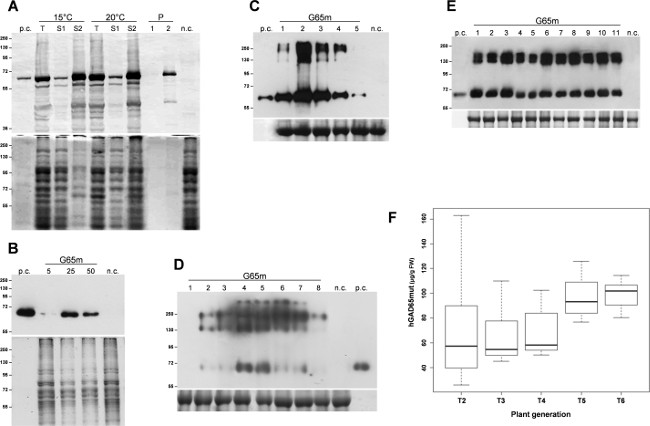
Figure 1:. Plate-forme mise en place Mettre en place de meilleures conditions pour l'expression hGAD65mut dans chaque plate-forme. (A) E. coli plateforme d'expression inductible. Les cellules bactériennes ont été cultivées à 15 ° C ou 20 ° C Panneau supérieur., Western blot des hGAD65mut dans des extraits cellulaires (2 pg de TSP par voie). Panneau inférieur, charger le contrôle colorées avec Coomassie. n.c. = Témoin négatif, les cellules bactériennes transformées avec le vecteur pDEST17 contenant le gène de résistance au chloramphénicol; T: Total des échantillons; S1: Surnageant après sonication et centrifugation; S2 et P: Le surnageant (1) et à granulés (2) après centrifugation de l'échantillon solubilisé dans un tampon contenant de l'urée. (B) Baculovirus / insectes plateforme cellulaire. Les volumes en stock virales suivants ont été testés: 5, 25 et 50 pi Panneau supérieur, de western blot des hGAD65mut dans des extraits cellulaires (5 ug de TSP par voie) Panneau inférieur, charger le contrôle colorées avec Coomassie... nc = contrôle négatif, extrait de cellules non transformées insectes. (C) Transient expression dans N. plantes benthamiana utilisant le vecteur pK7WG2. Les échantillons ont été prélevés quotidiennement, 1-5 dpi (voies 1-5). Panneau supérieur, Western blot de hGAD65mut dans des extraits de feuilles (2,5 pg de TSP par voie). Panneau inférieur, charger le contrôle colorées avec Coomassie, où la grande sous-unitéla Rubisco est évident. nc = contrôle négatif, plantes infiltré avec le vecteur pK7WG2 portant le gène marqueur GFP. (D) d'expression transitoire dans N. plantes benthamiana en utilisant des vecteurs MagnICON. Les échantillons ont été prélevés quotidiennement, 1-8 dpi (voies 1-8). Panneau supérieur, Western blot de hGAD65mut dans des extraits de feuilles (5 ug de TSP par voie). Panneau inférieur, charger le contrôle colorées avec Coomassie où la grande sous-unité de la Rubisco est évident . nc = contrôle négatif, plantes infiltré qu'avec le pICH20111 5'-module et pICH14011 intégrase-module. Les chiffres indiquent marqueur de masse moléculaire en kDa. pc = contrôle positif, 15 ng de hGAD65 commerciales produites dans la / système de cellule d'insecte Baculovirus. (E) d'expression Stable dans N. plantes tabacum. Des échantillons de feuilles ont été prélevés à partir de différentes plantes T5 (pistes 1-11). Panneau supérieur, western blot des hGAD65mut dans des extraits de feuilles (5 ug TSP par voie). Panneau inférieur, le contrôle de chargement taché wième Coomassie. nc = contrôle négatif, les plantes de type sauvage. Les chiffres indiquent marqueur de masse moléculaire en kDa. pc = contrôle positif, 15 ng de hGAD65 commerciales produites dans la / système de cellule d'insecte Baculovirus. (F) d'expression Stable dans N. plantes tabacum. Boxplot représentation de l'accumulation hGAD65mut sur plusieurs générations provenant de la plus performante hGAD65mut T1 plante de tabac transgénique rapporté en pg / g FLW calculée à partir des données RIA. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Système | [HGAD65mut] (pg / ml) | [HGAD65mut] |
| Baculo / insectes | 117,5 ± 7,7 | 11,8 ± 0,8 ng / ml de milieu de culture |
| Transient | 22,6 ± 0,9 | 67,8 ± 2,7 pg / g FLW |
| MagnICON | 26,3 ± 5,9 | 78,8 ± 17,8 pg / g FLW |
| T6 Elite | 33,0 ± 3,8 | 99,1 ± 11,3 pg / g FLW |
Tableau 1: hGAD65mut donne rendements hGAD65mut dans différentes plates-formes - (Baculo / Insecte) basée fermenteurs et à base de plantes (pK7WG2- et MagnICON dans N. benthamiana et T6 élite N. tabacum). La deuxième colonne - hGAD65mut concentration dans les extraits de protéines (ug / ml). Troisième colonne - contenu hGAD65mut poids de feuilles fraîches (pg / g de FLW) pour les plates-formes à base de plantes et en milieu de culture cellulaire (pg / ml) pour plate-forme basée fermenteur.
Discussion
Dans cette étude, trois modes différents ont été comparés pour l'expression d'une protéine recombinante humaine: des cellules bactériennes, des cellules de baculovirus / insectes et de plantes. La plate-forme à base de plantes a été étudiée plus en exploitant trois technologies d'expression largement utilisés (c.-à-transitoire - MagnICON et pK7WG2 base - et stables). La protéine cible choisie pour cette expérience, hGAD65mut, a déjà été exprimé dans différents systèmes 13, et sa production et la fonctionnalité sont facilement détectables et mesurables 14.
Les cellules bactériennes ne étaient pas une plate-forme de production efficace parce hGAD65mut formé des corps d'inclusion, même à des conditions de croissance à basse température, ce qui nécessite solubilisation laborieux et repliement pour atteindre sa conformation native. En effet, le défaut principal de cette plate-forme pour l'expression de protéines recombinantes complexes est la bonne conformation du produit final.
LeBaculovirus plate-forme de cellule / d'insecte médiée une expression élevée de la protéine recombinante immunoréactif, mais la limitation principale de ce système d'expression est le coût élevé du milieu de culture, nécessaires pour cultiver des cellules d'insecte. Il a été estimé que les coûts totaux de production pour 1 g de hGAD65mut pourraient atteindre € 700 dans cette plate-forme de production (considérant 9 L d'insecte milieux de culture cellulaire requis). Une autre limitation de cette plate-forme d'expression est la nécessité de la culture stérile de cellules d'insectes, ce qui nécessite un personnel ayant des compétences de manipulation aseptiques. Pour assurer l'efficacité de la protéine recombinante accumulation deux paramètres critiques doivent être soigneusement contrôlées dans ce système d'expression: les volumes de stocks viraux utilisés pour infecter les cellules et le moment de l'infection virale. De plus, le détergent, utilisé pour l'extraction totale de cellules d'insecte Sf9 en protéines solubles, influence fortement la solubilisation de protéines recombinantes.
Systèmes à base de plantes ont été le plus bénéfique Platform d'exprimer hGAD65mut: la protéine recombinante plante fait était immunoréactive et a accumulé à des niveaux élevés dans les tissus foliaires. Comparaison de différents systèmes d'expression à base de plantes, les rendements les plus élevés ont été obtenus dans les plantes transformées stables du tabac (tableau 1) et, si compte tenu de la biomasse totale du tabac par rapport à N. benthamiana, utilisé pour l'expression transitoire, la productivité globale accrue de tabac est évident. Cependant, la principale limitation de la plate-forme à base de plantes de tabac transformées stable est le temps nécessaire pour la mise en place du système, qui dans notre étude a duré 20 mois. En effet, une lignée homozygote doit être sélectionné pour l'expression recombinante de protéines homogénéité et elle peut nécessiter des cycles répétés d'auto-cross, à partir de la plus haute expression de lignes T1. En particulier, lorsque le T1 sélectionnée porte plus d'une copie du caractère transgénique, le programme d'élevage peut prendre jusqu'à trois années.
Les systèmes d'expression transitoire offrir laavantage de upscaling rapide due à un court intervalle entre la transformation et d'expression et la mise en place de la plate-forme d'expression nécessaire 4 jours. Toutefois, une limitation des systèmes transitoires à base de plantes est que leur automatisation ne est guère réalisable sur une échelle de laboratoire si des équipements de haute qualité dédié à l'agro-infiltration est utilisé. Ainsi, un calcul correct pour la production à grande échelle de hGAD65 utilisant des systèmes à base-transitoires ne peut être effectuée ici. D'autre part, nous pensons que les coûts de production totaux pour 1 g de protéine recombinante en utilisant T6 lignée de tabac stable peuvent être calculées à moins de 5 euros (compte tenu de sol pour la culture de 60 plants de tabac). Pour assurer la agroinfiltration et de protéines production efficace plusieurs paramètres critiques doivent être soigneusement contrôlées (usine stade de développement, de grandir et d'infiltration état d'Agrobacterium), comme indiqué précédemment 15. En outre, pour chaque expression expérimenter une analyse spécifique évolution temporelle devrait êtreeffectuée pour sélectionner la dpi qui permet la plus forte accumulation de la protéine recombinante.
L'exemple discuté ici peut être considérée comme une étude de validation de principe cas, qui met en évidence certains des avantages spécifiques de la production à base de plantes par rapport aux systèmes traditionnels. En particulier, lignées transgéniques de tabac exprimant la protéine recombinante homogène peuvent être considérés comme une plate-forme précieuse pour la production de masse de protéines recombinantes qui sont nécessaires dans les grands-quantités.
Déclarations de divulgation
The authors declare that there is no conflict of interests regarding the publication of this paper.
Remerciements
This work was supported by the COST action ‘Molecular pharming: Plants as a production platform for high-value proteins’ FA0804. The Authors thank Dr Anatoli Giritch and Prof. Yuri Gleba for providing the MagnICON vectors for research purposes.
matériels
| Name | Company | Catalog Number | Comments |
| Yeast extract | Sigma | Y1333 | |
| Tryptone | Formedium | TRP03 | |
| Agar Bacteriological Grade | Applichem | A0949 | |
| Sf-900 II SFM medium | Gibco | 10902-088 | |
| Grace’s Insect Medium, unsupplemented | Gibco | 11595-030 | |
| Cellfectin II Reagent | Invitrogen | 10362-100 | |
| MS medium including vitamins | Duchefa Biochemie | M0222 | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Plant agar | Duchefa Biochemie | P1001 | |
| Ampicillin sodium | Duchefa Biochemie | A0104 | Toxic |
| Gentamycin sulphate | Duchefa Biochemie | G0124 | Toxic |
| Ganciclovir | Invitrogen | I2562-023 | |
| Carbenicillin disodium | Duchefa Biochemie | C0109 | Toxic |
| Kanamycin sulfate | Sigma | K4000 | Toxic |
| Rifampicin | Duchefa Biochemie | R0146 | Toxic – 25 mg/ml stock in DMSO |
| Streptomycin sulfate | Duchefa Biochemie | S0148 | Toxic |
| Spectinomycin dihydrochloride | Duchefa Biochemie | S0188 | |
| IPTG (isopropil-β-D-1-tiogalattopiranoside) | Sigma | I5502 | Toxic |
| MES hydrate | Sigma | M8250 | |
| MgCl2 | Biochemical | 436994U | |
| Acetosyringone | Sigma | D134406 | Toxic – 0.1 M stock in DMSO |
| Syringe (1 ml) | Terumo | ||
| MgSO4 | Fluka | 63136 | |
| BAP (6-Benzylaminopurine) | Sigma | B3408 | Toxic |
| NAA (Naphtalene acetic acid) | Duchefa Biochemie | N0903 | Irritant |
| Cefotaxime | Mylan Generics | ||
| Trizma base | Sigma | T1503 | Adjust pH with 1 N HCl to make Tris-HCl buffer |
| HCl | Sigma | H1758 | Corrosive |
| NaCl | Sigma | S3014 | 1 M stock |
| KCl | Sigma | P9541 | |
| Na2HPO4 | Sigma | S7907 | |
| KH2PO4 | Sigma | P9791 | |
| PMSF (Phenylmethanesulfonylfluoride) | Sigma | P7626 | Corrosive, toxic |
| Urea | Sigma | U5378 | |
| β-mercaptoethanol | Sigma | M3148 | Toxic |
| Tween-20 | Sigma | P5927 | |
| Hepes | Sigma | H3375 | |
| DTT (Dithiothreitol) | Sigma | D0632 | Toxic – 1 M stock, store at -20 °C |
| CHAPS | Duchefa Biochemie | C1374 | Toxic |
| Plant protease inhibitor cocktail | Sigma | P9599 | Do not freeze/thaw too many times |
| SDS (Sodium dodecyl sulphate) | Sigma | L3771 | Flammable, toxic, corrosive – 10% stock |
| Glycerol | Sigma | G5516 | |
| Brilliant Blue R-250 | Sigma | B7920 | |
| Isopropanol | Sigma | 24137 | Flammable |
| Acetic acid | Sigma | 27221 | Corrosive |
| Anti-Glutamic acid decarboxylase 65/67 | Sigma | G5163 | Do not freeze/thaw too many times |
| Horseradish peroxidase (HRP)-conjugate anti-rabbit antibody | Sigma | A6154 | Do not freeze/thaw too many times |
| Sf9 Cells | Life Technologies | 11496 | |
| BL21 Competent E. coli | New England Biolabs | C2530H | |
| Protein A Sepharose | Sigma | P2545 | |
| Cell culture plates | Sigma | CLS3516 | |
| Radio Immuno Assay kit | Techno Genetics | 12650805 | Radioactive material |
Références
- Hampe, C. S., Hammerle, L. P., Falorni, A., Robertson, J., Lernmark, A. Site-directed mutagenesis of K396R of the 65 kDa glutamic acid decarboxylase active site obliterates enzyme activity but not antibody binding. FEBS Lett. 488 (3), 185-189 (2001).
- Avesani, L., et al. Recombinant human GAD65 accumulates to high levels in transgenic tobacco plants when expressed as an enzymatically inactive mutant. Plant Biotechnol. J. 9 (8), 862-872 (2010).
- Sambrook, J., et al. . Molecular Cloning: A laboratory manual. Second Edition. , (1989).
- Avesani, L., et al. Comparative analysis of different biofactories for the production of a major diabetes autoantigen. Transgenic Res. 23, 281-291 (2014).
- Marillonnet, S., Giritch, A., Gils, M., Kandzia, R., Klimyuk, V., Gleba, Y. In planta engineering of viral RNA replicons: efficient assembly by recombination of DNA modules delivered by Agrobacterium. Proc. Natl. Acad. Sci. (USA). 101 (18), 6852-6857 (2004).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants). Curr. Opin. Biotechnol. 18, 134-141 (2007).
- Engler, C., Kandzia, R., Marillonnet, S. A one pot, one step, precision cloning method with high throughput capability. PLoS One. 3 (11), (2008).
- Xu, R., Li, Q. Q. Protocol: streamline cloning of genes into binary vectors in Agrobacterium via the Gateway TOPO vector system. Plant Methods. 4 (4), 1-7 (2008).
- Fairbanks, G., Steck, T. L., Wallach, D. F. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606-2617 (1971).
- Falorni, A., et al. Radioimmunoassay detects the frequent occurrence of autoantibodies to the Mr 65,000 isoform of glutamic acid decarboxylase in Japanese insulin-dependent diabetes. Autoimmunity. 19, 113-125 (1994).
- Hunt, I. From gene to protein: a review of new and enabling technologies for multi-parallel protein expression. Protein Expr. Purif. 40 (1), 1-22 (2005).
- Arzola, L., et al. Transient co-expression of post-transcriptional silencing suppressor for increased in planta expression of a recombinant anthrax receptor fusion protein. Int. J. Mol. Sci. 12 (8), 4975-4990 (2011).
- Merlin, M., Gecchele, E., Capaldi, S., Pezzotti, M., Avesani, L. Comparative evaluation of recombinant protein production in different biofactories: the green perspective. Biomed. Res. Int. 2014, 136419 (2014).
- Avesani, L., et al. Improved in planta expression of the human islet autoantigen glutamic acid decarboxylase (GAD65). Transgenic Res. 12 (2), 203-212 (2003).
- Leuzinger, K., et al. Efficient agroinfiltration of Plants for high-level transient expression of recombinant proteins. J Vis Exp. (77), (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon