Method Article
Un Análisis Comparativo de Expresión recombinante de proteínas en diferentes Biofactorías: Las bacterias, células de insecto y Plant Systems
En este artículo
Resumen
In this study the expression of a target human recombinant protein in different production platforms was compared. We focused on traditional fermenter-based cultures and on plants, describing the set-up of each system and highlighting, on the basis of the reported results, the inherent limits and advantages for each platform.
Resumen
Sistemas a base de plantas se consideran una plataforma valiosa para la producción de proteínas recombinantes, como resultado de su potencial bien documentado para la producción flexible, de bajo costo de alta calidad, los productos bioactivos.
En este estudio, se comparó la expresión de una proteína recombinante humana diana en las culturas tradicionales a base de fermentador de células bacterianas y (insectos) con los sistemas de expresión basados en plantas, tanto transitorios y estables.
Para cada plataforma, se describe la puesta a punto, la optimización y la duración del proceso de producción, la calidad del producto final y los rendimientos y se evaluaron los costes de producción provisionales, específicos para la proteína recombinante diana seleccionado.
En general, nuestros resultados indican que las bacterias no son adecuados para la producción de la proteína diana debido a su acumulación dentro de cuerpos de inclusión insolubles. Por otro lado, los sistemas basados en plantas son plataformas versátiles tsombrero permite la producción de la proteína seleccionada a-menores costos que el sistema celular baculovirus / insecto. En particular, las líneas transgénicas estables muestran el más alto rendimiento del producto final y las plantas que expresan transitorios el desarrollo más rápido proceso. Sin embargo, no todas las proteínas recombinantes se pueden beneficiar de los sistemas basados en plantas, pero la mejor plataforma de producción deben determinar empíricamente con un enfoque caso por caso, como se describe aquí.
Introducción
Recombinant proteins are commercially mass-produced in heterologous expression systems with the aid of emerging biotechnology tools. Key factors that have to be considered when choosing the heterologous expression system include: protein quality, functionality, process speed, yield and cost.
In the recombinant protein field, the market for pharmaceuticals is expanding rapidly and, consequently, most biopharmaceuticals produced today are recombinant. Proteins can be expressed in cell cultures of bacteria, yeasts, molds, mammals, plants and insects, as well as in plant systems (either via stable- or transient-transformation) and transgenic animals; each expression system has its inherent advantages and limitations and for each target recombinant protein the optimal production system has to be carefully evaluated.
Plant-based platforms are arising as an important alternative to traditional fermenter-based systems for safe and cost-effective recombinant protein production. Although downstream processing costs are comparable to those of microbial and mammalian cells, the lower up-front investment required for commercial production in plants and the potential economy of scale, provided by cultivation over large areas, are key advantages.
We evaluated plants as bioreactors for the expression of the 65 kDa isoform of human glutamic acid decarboxylase (hGAD65), one of the major autoantigen in Type 1 autoimmune diabetes (T1D). hGAD65 is largely adopted as a marker, both for classifying and monitoring the progression of the disease and its role in T1D prevention is currently under investigation in clinical trials. If these trials are successful, the global demand for recombinant hGAD65 will increase dramatically.
Here, we focus on the expression of the enzymatically inactive counterpart of hGAD65, hGAD65mut, a mutant generated by substituting the lysine residue that binds the cofactor PLP (pyridoxal-5'-phosphate) with an arginine residue (K396R)1.
hGAD65mut retains its immunogenicity and, in plant and insect cells, accumulates up to ten-fold higher than hGAD65, its wild-type counterpart. It was hypothesized that the enzymatic activity of hGAD65 interferes with plant cell metabolism to such an extent that it suppresses its own synthesis, whereas hGAD65mut, the enzymatically-inactive form, can be accumulated in plant cells to higher levels.
For the expression of hGAD65mut, the use of different technologies, widely used in plant biotechnology, was explored here and compared to traditional expression platforms (Escherichia coli and Baculovirus/insect cell-based).
In this work, the recombinant platforms developed for the expression of hGAD65mut comprising traditional and plant-based systems were reviewed and compared on the basis of process speed and yield, and of final product quality and functionality.
Protocolo
1. Construcción de vectores de expresión
- Comercial sistema de clonación de recombinación:
- Amplificar la secuencia de longitud completa del gen diana (hGAD65mut) con cebadores apropiados permite la adición de una abrazadera CACC en el extremo 5 'del gen como se describió anteriormente 2.
- Clonar el producto de amplificación se purificó en gel, de acuerdo con las especificaciones del kit de clonación direccional, en el vector de entrada (topoisomerasa obligado) mediante el ensamblaje de la reacción en un volumen total de 6 l, usando una proporción de 1,5: 1 molar de inserción: vector y 1 l de solución de sal (NaCl 0,2 M y 0,01 MgCl 2). Incubar durante 5 min a temperatura ambiente (RT).
- Transformar la reacción completa en E. químicamente competentes coli células de acuerdo con las especificaciones de dirección del kit de clonación y pantalla colonias obtenidas por PCR colonia 3, utilizando M13 adelante y atrás primers incluidas en el kit de clonación direccional. Aislar el plásmido de una pocolonia sibles según las especificaciones de preparación de plásmidos de ADN del kit y la secuencia de inserción utilizando M13 adelante y atrás primers para garantizar la ausencia de mutaciones 3.
- Utilice el clon de entrada obtenida para realizar la reacción de recombinación por la recombinasa Clonase Lambda II Enzyme (LR) con destino vectores específicos: para la expresión de proteína recombinante en células bacterianas con pDEST17 (produciendo pDEST17.G65mut), en plantas (transitoria o estable) con pK7WG2 (produciendo pK7WG2.G65mut), en el sistema de baculovirus / células de insecto con el ADN viral linealizado (produciendo Baculo.G65mut) 4. Montar la reacción, de acuerdo con las especificaciones del kit Clonase, con 100 ng de vector de entrada, 150 ng de vector de destino y 2 l de mezcla de enzima en un volumen final de 10 l. Incubar la mezcla a temperatura ambiente durante 1 hr.
- Transformar el producto de recombinación en E. químicamente competentes coli células de acuerdo con las especificaciones del kit Clonase. Pantalla colonias obtenidas por PCR 3 utilizando para todas las colonias derivadas reacción de transformación de la misma cebador inverso GAD65mut-específico (5'-CACACGCCGGCAGCAGGT-3 ') y los siguientes vectores de destino cebadores directos específicos: para pDEST17: 5'-TAATACGACTCACTATAGGG-3'; para pK7WG2: 5'-AAGATGCCTCTGCCGACAGT-3 '; para Baculo vector linealizado: 5'-AAATGATAACCATCTCGC-3 '.
- Aislar el ADN plásmido utilizando un kit de minipreparación de ADN comercial y confirmar la presencia de la secuencia diana por PCR 3, utilizando las mismas combinaciones de cebadores específicos descritos en el paso anterior.
- Usa los plásmidos PCR-positivos obtenidos para transformar diferentes organismos objetivo, dependiendo de la plataforma elegida para la expresión de proteína recombinante como se describe en los pasos siguientes.
- Sistema de MagnICON 5-7:
- Clonar el gen diana en el extremo 3 'del módulo pICH31070, como se ha descrito anteriormente en detalle 7, produciendo pICH31070.G65mut. Utilice lasiguiente ciclo de reacción específica: 30 min de incubación a 37 ° C, 5 min a 50 ° C y luego 5 min a 80 ° C.
2. recombinante Expresión de Proteínas
- Sistema de células bacterianas:
- Transformar pDEST17.G65mut en E. coli BL21 (DE3) células electrocompetentes utilizando técnicas estándar y la pantalla las colonias crecidas en que contiene ampicilina (100 mg / ml) de medio LB, por colonia PCR utilizando los cebadores siguientes transgenes específicos: 5'-CTGGTGCCAAGTGGCTCAGA-3 'y 5' -CACACGCCGGCAGCAGGT-3 ', con una temperatura de hibridación de 58 ° C y un tiempo de elongación de 20 seg. Llevar a cabo la reacción de PCR en un volumen total de 20 l después de disolver las células bacterianas con una punta de plástico en el tubo.
- Inocular una única colonia durante la noche a 37 ° C en 3 ml de ampicilina que contiene (100 mg / ml) de medio LB.
- Diluir el cultivo bacteriano 1: 100 en 100 ml de medio LB fresco (incluyendo ampicillin) y se incuba a 37 ° C durante 1-6 horas hasta que una DO final de 600 0.8.
- Inducir la expresión de proteína recombinante por adición de isopropil-β-D-1-tiogalattopiranoside (IPTG) a una concentración final de 1 mM y se incuba cultivo con agitación vigorosa durante 3 horas a 37 ° C.
- Recoger las células por centrifugación a 4000 xg durante 20 min y utilizar sedimento bacteriano para la extracción de proteínas (etapa 3.1.1.1).
- Sistema / célula de insecto de baculovirus:
- Semilla Spodoptera frugiperda (Sf9) células en placas de 6 pocillos (8 x 10 5 células por pocillo) y lavar dos veces con 2 ml de no suplementada insecto de Grace Medio.
- Retire y reemplace el gota a gota con la mezcla de transfección (5 l LR reacción recombinante, solución Celfectin 6 ly 200 l no suplementada insecto de Grace Medium) medio.
- Incubar las placas a 27 ° C durante 5 horas.
- Retire y reemplace mezcla de transfección con 2 ml de fresco Sf-900 medio, suplementado con suero bovino fetal al 10%, 10 mg / ml de gentamicina y 100 mM ganciclovir para seleccionar clones de baculovirus recombinantes.
- Después de la incubación durante 96 horas a 27 ° C, recoger medio (V1 madre viral), centrifugar a 4000 xg para eliminar las células y los desechos grandes y almacenar en la oscuridad a 4 ° C.
- Semilla de 1 x 10 6 células Sf9 por pocillo en 2,5 ml Sf-900 medio que contiene suero bovino fetal al 10%, 10 mg / ml de gentamicina y 100 mM ganciclovir e infectar con 100 l de V1 stock en cada pozo.
- Se incuban las células durante 3 días a 27 ° C.
- Recoger y medio se centrifuga a 4000 x g.
- Almacenar el sobrenadante (V2 alto título de valores) a 4 ° C.
- Semilla de 1 x 10 6 células Sf9 por pocillo en 2,5 ml Sf-900 medio que contiene suero bovino fetal al 10%, 10 mg / ml de gentamicina y 100 mM ganciclovir e infectar con 25 l de V2 stock en cada pozo.
- Se incuban las células durante 3 días a 27 ° C.
- Recoger las células por centrifugación a 4000 xg y utilizar pellet de células de insectos para la extracción de proteínas (paso 3.1.2. 1).
- Nicotiana benthamiana sistemas de expresión transitoria:
- Crecer N. benthamiana plantas en un invernadero, bajo la luz natural dentro del rango de temperatura de 18-23 ° C. Para agroinfección utilizar las plantas 4-5 semanas de edad.
- Mantenga las plantas agroinfected en una cámara climática a 22 ° C con un 13 hr días / 11 hr noche fotoperiodo.
- Comercial sistema de clonación de recombinación:
- Introducir pK7WG2.G65mut en cepa de Agrobacterium tumefaciens EHA105 células electrocompetentes como se describe anteriormente y la pantalla 8, las colonias cultivadas en medio LB con rifampicina (50 mg / ml), estreptomicina (300 mg / ml) y espectinomicina (100 mg / ml) después de 2 días de incubación a 28 ° C, por colonia PCR 8 utilizando los siguientes cebadores transgenes específicos: 5'-CATGGTGGAGCACGACACGCT-3 y #8217; y 5'-CACACGCCGGCAGCAGGT-3 ', con una temperatura de hibridación de 58 ° C y un tiempo de elongación de 50 seg. Llevar a cabo la reacción de PCR en un volumen total de 20 l.
- Inocular bacterias en 30 ml de medio LB con rifampicina (50 mg / ml), estreptomicina (300 mg / ml) y espectinomicina (100 mg / ml) durante dos días a 28 ° C.
- Recoger las bacterias por centrifugación a 4000 xg durante 20 min y resuspender el pellet en 10 ml de tampón de infiltración (MES 10 mM, 10 mM de MgCl 2, 100 acetosiringona mu M, pH 5,6). Medir el valor OD 600 y luego ajustarlo a 0,9 mediante la dilución en el mismo tampón.
NOTA: el volumen total necesario para infiltrarse en tres N. benthamiana plantas es de 30 ml. - Utilice una jeringa 2,5 ml sin aguja para infiltrar la suspensión de Agrobacterium en N. benthamiana deja. Con cuidado y lentamente inyectar paneles de la hoja con la suspensión de la jeringa. Infíltrate en tres l ampliadoaleros por planta y utilizan tres plantas como triplicados.
NOTA: por razones de salud y seguridad gafas de protección durante el proceso de infiltración. - Recoger las hojas agroinfiltradas infección 2 días después (dpi) y la congelación en nitrógeno líquido. Tienda de tejidos vegetales a -80 ° C.
- Sistema MagnICON:
- Introducir los vectores MagnICON - el 'módulo (pICH20111), 3' 5 módulo (pICH31070.G65mut), y el módulo de la integrasa (pICH14011) - en A. tumefaciens cepa GV3101 utilizando técnicas estándar. Se tamizan los colonias, cultivadas en medio LB que contenía 50 mg / ml de rifampicina y antibiótico apropiado-vector específico (50 mg / ml de carbenicilina para pICH20111 y pICH14011, 50 mg / ml de kanamicina para pICH31070), mediante PCR de colonias usando cebadores específicos para cada vector.
- Inocular por separado los tres A. tumefaciens cepas en 5 ml de medio LB que contenía 50 mg / ml de rifampicina y antibióticos vector específico apropiadoy agitar durante la noche a 28 ° C.
- Pellets durante la noche cultivos de bacterias por centrifugación a 4000 xg durante 20 min y resuspender en dos volúmenes del cultivo bacteriano inicial de MES 10 mM (pH 5,5) y 10 mM MgSO 4.
- Mezclar volúmenes iguales de suspensiones bacterianas que contienen los tres vectores y utilizar la mezcla de la suspensión para la infiltración de la jeringa de N. benthamiana deja. Infíltrate en tres hojas expandidas por planta.
- Recoger las hojas agroinfiltrated en 4 dpi y congelar en nitrógeno líquido.
- Tienda de tejidos vegetales a -80 ° C.
- Nicotiana tabacum sistema de expresión estable:
- Crecer y mantener las plántulas in vitro de N. tabacum (var Sr1.) en medio de cultivo de la planta sólido (4,4 g / L de Murashige y Skoog - MS - medio, incluyendo vitaminas, 30 g / l de sacarosa, pH 5,8, 7 g / L de agar planta) bajo condiciones controladas en cámara climática a 25 ° C con 16 horas de día / 8 h / nirégimen de lucha.
- Iniciar un pre-cultivo de A. tumefaciens EHA105 que alberga el vector de expresión pK7WG2.G65mut en 5 ml de medio líquido YEB con antibióticos adecuados (rifampicina 50 mg / ml, estreptomicina 300 mg / ml, espectinomicina 100 g / ml) y crecer durante la noche a 28 ° C en un agitador orbital conjunto a 200 rpm.
- Usar 1 ml de la pre-cultivo para inocular un cultivo de 50 ml de Agrobacterium en medio YEB más antibióticos (rifampicina 50 mg / ml, estreptomicina 300 mg / ml, espectinomicina 100 g / ml) y hacer crecer durante 24 horas, hasta que el cultivo bacteriano es saturado (OD 600 valor de 0,5-1,0).
- Recoger las bacterias por centrifugación a 4000 xg durante 20 min y resuspender el pellet en 50 ml de medio de cultivo de la planta líquido. Repita este paso dos veces para eliminar completamente los antibióticos.
- Tome primero saludables hojas totalmente expandidas in vitro de plantas de tabaco en y cortarlas en aproximadamente 1 cm cuadrados.
- Trozos de hojas de Transferenciaa los platos Petri profundas que contiene suspensión bacteriana y dejar en la oscuridad durante 20 min.
- Retire los trozos de hoja de suspensión y secar sobre papel de filtro estéril.
- Coloque trozos de hoja con el lado adaxial (superficie superior de la hoja) en medio de cultivo sólido de plantas que contengan 1,0 g / ml 6-bencilaminopurina (BAP) y ácido 0,1 mg / ml naftaleno acético (NAA) y se incuban las placas durante dos días en una cámara climática en controlada condiciones (25 ° C, 16 horas día / 8 h noche).
- Trozos de hoja de transferencia sobre medio de cultivo sólido (incluyendo 1,0 mg / ml de BAP, 0,1 mg / ml de NAA, 500 mg / ml de cefotaxima, 100 mg / ml de kanamicina) con la superficie abaxial (superficie inferior de la hoja) en contacto con el medio.
- Incubar las placas durante 2-3 semanas en la cámara climática a 25 ° C con 16 h / 8 h régimen de día / noche para inducir la formación de brotes. Subcultura cada 2 semanas por la transferencia de explantes de hoja de medio de cultivo de la planta fresca sólido que contiene 1,0 mg / ml de BAP, 0,1 mg / ml de NAA, 500g / ml de cefotaxima y 100 mg / ml de kanamicina.
- Cuando los brotes aparecen transferirlos a cajas Magenta que contenían medio de cultivo sólido que incluye 500 mg / ml de cefotaxima y 100 mg / ml de kanamicina para inducir la formación de raíces. Incubar plántulas con 16 horas de día / 8 h noche fotoperiodo a 25 ° C durante 1-2 semanas.
- Cuando se forman las raíces, la transferencia de las plantas al suelo en el invernadero.
- Recoger un pedazo de hoja de cada planta y aislar el ADN genómico con un kit comercial.
- Detectar la presencia del transgén mediante PCR específica. Utilice 30 ng de ADN genómico como molde para la amplificación por PCR utilizando los cebadores siguientes transgenes específica: 5'-CTGGTGCCAAGTGGCTCAGA-3 'y 5'-CACACGCCGGCAGCAGGT-3', con una temperatura de hibridación de 58 ° C y un tiempo de elongación de 20 sec . Llevar a cabo la reacción de PCR en un volumen total de 50 l.
- Analizar el producto de 220 pb por electroforesis en gel de agarosa al 1% en Tris-EDTA-acetato tampón (TAE) (40 mM Tres decir, ácido acético 20 mM, y EDTA 1 mM).
- Seleccionar plantas transgénicas que contienen el gen diana.
- Se recoge una hoja de cada pieza de la planta transgénica seleccionada y congelar en nitrógeno líquido inmediatamente.
- Preparar extractos de proteínas totales de tejido de la hoja de la planta (paso 3.1.3) y probar cada muestra por Western blot como se describió anteriormente 2 para seleccionar la mejor planta de tabaco que expresan la proteína recombinante.
- Flores Bolsa de la mejor planta de rendimiento seleccionado antes de la floración para evitar la polinización cruzada.
- Después de la floración, la maduración del fruto y el secado de semillas, recolectar bolsas.
- Semillas separadas de la paja y guárdelas en un lugar seco a temperatura controlada (20-24 ° C).
- Sembrar las semillas secas para producir las plantas transgénicas segunda generación y posteriormente seleccionar la mejor planta de rendimiento para ser auto-polinización.
- Repita el mismo procedimiento descrito en los pasos 2.4.19-2.4.21 para las generaciones posteriores.
3. Análisis de la expresión de proteínas recombinantes
- La extracción total de proteínas:
- Las células bacterianas:
- Resuspender el sedimento celular bacteriana, recogidos como se describe en el paso 2.1.5, en la mitad del volumen de cultivo de solución salina tamponada con Tris (TBS - 2 mM Tris / HCl, NaCl 500 mM) pH 7,4 suplementado con phenylmethanesulfonylfluoride 1 mM (PMSF).
- Sonicar resuspendió sedimento celular tres veces durante 40 segundos a media potencia, manteniendo la muestra en hielo.
- Aclarar lisado por centrifugación a 14.000 xg durante 20 min a 4 ° C.
- Transferir el sobrenadante a un tubo limpio y almacenar tanto sobrenadante y el sedimento separado a -80 ° C.
- Solubilizar los cuerpos de inclusión, recogidas en el sedimento, en medio volumen de lisado celular de TBS pH 8,0 suplementado con 6 M urea por agitación vigorosa durante la noche a temperatura ambiente.
- Centrifugar a 10000 xg durante 25 min a temperatura ambiente y recoger el sobrenadante en un recipiente limpiotubo.
- Guarde tanto sobrenadante y el sedimento a -80 ° C.
- Las células de insecto:
- Lavar infectados pellet de células de insecto, recogidos como se describe en el paso 2.2.12, con 1 ml de tampón fosfato salino (PBS - NaCl 137 mM, 2,7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mM KH 2 PO 4) pH 7,4.
- Resuspender las células en 200 l de tampón de lisis (20 mM Tris / HCl pH 8,0, NaCl 0,5 M, 3 mM β-mercaptoetanol y 1% de Tween-20) e incubar en hielo durante 30 min.
- Centrifugar las células solubilizan a 14.000 xg durante 20 min a 4 ° C.
- Reunir las fracciones solubles y almacenar a -80 ° C y descartar el pellet.
- Tejido de la hoja de la planta:
- N. Grind benthamiana o N. tejido tabacum a polvo fino en nitrógeno líquido utilizando mortero.
- Homogeneizar 100 mg de tejido triturado en 300 l de tampón de extracción (40 mM Hepes pH 7,9, DTT 5 mM, 1,5% CHAPS), Suplemented con 3 l de proteasa cóctel de inhibidores y descongelar en hielo.
NOTA: la relación seleccionada entre el peso tejido de la planta (g) para amortiguar el volumen (ml) es 1: 3. - Extracto de Centrifugar a 30000 xg durante 30 min a 4 ° C.
- Recoger el sobrenadante en un tubo limpio y se almacena a -80 ° C.
- Las células bacterianas:
- Tinción Coomassie gel:
- Preparar una dilución apropiada de extractos de proteínas totales (por ejemplo, 2 l de extracto de la planta, 5 l de extractos bacterianos y de insectos) a un volumen final de 10 l de tampón de extracción y añadir 5 l de tampón de muestra 3x (1,5 M Tris / HCl pH 6,8, 3% SDS, 15% de glicerol, 4% β-mercaptoetanol) hasta una concentración 1x final.
- Muestras Hervir durante 10 minutos.
- Proteínas separadas en un 10% SDS-PAGE.
- Después de la electroforesis, el gel de calor en presencia de la solución de Coomassie A (0,05% Brilliant Blue R-250, 25% de isopropanol, 10% de ácido acético) en un horno microondas durante aproximadamente dos minutoss hasta el punto de ebullición.
- Enfriar gel a temperatura ambiente con agitación suave.
- Deseche la solución de tinción Coomassie A.
- Gel Destain por calentamiento en la presencia de Coomassie solución B (0,05% Brilliant Blue R-250, 25% de isopropanol), C (10% de ácido acético) (0,002% Brilliant Blue R-250, ácido acético al 10%) y D cada vez siguiendo el mismo protocolo para la tinción.
- Después de la última etapa de calentamiento con una solución de D, dejar destaining gel hasta que el fondo es claro 9.
- El análisis de transferencia Western:
- Después de la electroforesis, la transferencia de proteínas a una membrana de nitrocelulosa utilizando técnicas y bloque con 4% de leche estándar separados en PBS pH 7,4 a temperatura ambiente durante 1 hr.
- Incubar la blot durante la noche a 4 ° C o durante 4 horas a temperatura ambiente en la solución de bloqueo que contiene anticuerpo de conejo primario elevado contra la proteína diana a 1: 10.000 y suplementado con 0,1% de Tween-20.
- Después de etiqueta anticuerpo primarioING, lavar la membrana 3 veces durante 5 min cada uno con solución de bloqueo que contiene 0,1% de Tween-20.
- Incubar con peroxidasa de rábano (HRP) anticuerpo anti-conejo -conjugate al 1: 10.000 durante 1,5 h.
- Lavar la membrana 5 veces durante 5 minutos cada uno con PBS-T (PBS suplementado con 0,1% de Tween-20).
- Proceso de transferencia de Western usando el sustrato de peroxidasa quimioluminiscente.
- Radioinmunoensayo (RIA):
- Deje que los reactivos (antisuero, trazador y proteína A Sepharose) alcancen la temperatura ambiente y la pipeta de 20 l de muestras de extracto de proteínas y normas a diferentes concentraciones (de 300-2,400 ng / ml de hGAD65 comercial recombinante) en tubos de poliestireno de 12 x 75 mm.
- Añadir 20 l de antisuero, preparadas diluyendo 1:30 el suero de plasmaféresis de un paciente DM1.
- Añadir 50 l de trazador (125-I-GAD65) y se incuba durante 2 horas a temperatura ambiente. Establecer un tubo con trazador sólo para estimar la actividad total.
- Añadir 50 lde la proteína A Sepharose y se incuba durante 1 hora a temperatura ambiente.
- Dosificar 1 ml de tampón PBS frío en cada tubo y centrifugar a 1500 xg a 4 ° C durante 30 min.
- Decantar los tubos para eliminar el sobrenadante y absorba el líquido residual en papel secante golpeando suavemente el tubo.
- Medida inmunoprecipitó radiactividad en todos los tubos contando durante 1 min en un contador gamma.
- Parcela en escala logarítmica las tasas vinculantes (B / T%) de los calibradores relacionados con la actividad total, para establecer la curva estándar y lea la concentración GAD de muestras fuera de la curva de calibración 10.
NOTA: Restringido áreas deben estar diseñados para el almacenamiento, manipulación y eliminación de material radiactivo.
Resultados
Un diseño experimental para la expresión heteróloga de una proteína recombinante diana en diferentes sistemas de producción se describe aquí. El primer foco fue la puesta en marcha de las diferentes plataformas mediante el establecimiento de las condiciones óptimas para la expresión de la proteína diana en cada sistema.
La expresión de la proteína diana, hGAD65mut, se indujo por triplicado E. culturas coli. Después de 3 h de expresión a 37 ° C, las células bacterianas se recogieron por centrifugación y se lisaron por sonicación. Después de una etapa de centrifugación, las proteínas solubles se separaron de los cuerpos de inclusión insolubles y los análisis iniciales demostraron que hGAD65mut acumula predominantemente en cuerpos de inclusión insolubles (datos no mostrados). Solubilización de proteínas recombinantes requiere el uso de urea 6 M, que, por sus fuertes propiedades de desnaturalización, interfiere con el análisis RIA, haciendo imposible una cuantificación adecuada de hGAD65mut. Varias estrategias se seren informó para limitar la formación de cuerpos de inclusión, que comprende el cultivo de las células microbianas a baja temperatura 11. Los cultivos se cultivaron a 15 ° C y 20 ° C, y la expresión de la proteína recombinante se indujo a las mismas temperaturas. Como se muestra en la Figura 1A, la solubilización de hGAD65mut produjo a ambas temperaturas, de nuevo requiere urea (carriles S2). Por lo tanto, las bajas temperaturas en este experimento no impiden hGAD65mut la formación de agregados insolubles.
Los vectores de baculovirus que contienen la secuencia hGAD65mut (Baculo.G65mut) se expresó en cultivos de células Sf9 adherentes. Se prepararon las poblaciones de alto título V1 y V2 y las condiciones de infección con mejores resultados se establecieron la evaluación de diferentes volúmenes de reservas virales 5-50 l. Como se muestra en la Figura 1B, el volumen óptimo de stock viral fue identificado como 25 l, obteniéndose 11,8 ± 0,8 g de proteína recombinante por ml de medio de cultivo, según se evaluó por RIAanálisis (Tabla 1).
A raíz de la infiltración, tiempo de análisis de N. agroinfected hojas benthamiana se llevó a cabo en los dos sistemas de expresión transitoria. Para el sistema basado en pK7WG2, muestras de hojas se agruparon diaria en el intervalo 1-5 dpi, las proteínas solubles totales (TSP) se extrajeron y cantidades iguales de TSP se analizaron por Western blot (Figura 1C). Este análisis pone de relieve que la máxima acumulación de proteína recombinante objetivo se alcanza 2 dpi. Por lo tanto, las hojas se cosecharon 2 dpi y los extractos de proteínas se analizaron mediante RIA para medir la acumulación de proteína recombinante, que muestra un promedio de 67,8 g / g FLW (peso de la hoja fresca, Tabla 1). Los niveles de expresión de proteínas recombinantes, utilizando este sistema, se pueden mejorar aún más, por la co-infiltración de las hojas con un supresor de post-transcripcional silenciamiento génico (PTGS) como P19 o HC Pro 12.
Lamismo detección del curso del tiempo se llevó a cabo con N. benthamiana hojas agroinfected con los vectores MagnICON: hojas infectadas se recogieron 1-8 cantidades dpi y la igualdad de TSP fueron analizados por Western blot. Este análisis demostró que la acumulación máxima de proteína recombinante se obtiene 4 dpi (Figura 1D), con una acumulación media de la proteína recombinante de 78,8 g / g FLW (Tabla 1), tal como se evaluó mediante RIA.
La expresión de hGAD65mut en plantas de tabaco transgénicas se ha informado anteriormente 12, que muestra que los niveles de proteínas recombinantes variaron significativamente entre líneas transformadas independientemente. La planta transgénica hGAD65mut T1 con mejores resultados fue auto-cruzado y se analizaron las plantas derivadas (T2) para seleccionar de nuevo la mejor realización de uno. Este procedimiento se repitió durante varias generaciones para desarrollar una plataforma de producción homogéneo, comprobar el rendimiento en cada generación por RIA hasta que no semejora adicional se logró (datos no mostrados). En la Figura 1E, se informó de una transferencia de Western representativa de plantas transgénicas T5, donde la homogeneidad de los rendimientos de proteínas recombinantes es evidente. Como se muestra en la Figura 1F, el rendimiento medio hGAD65mut aumentó de T2 a T6, alcanzar el nivel de 99,1 g / g FLW (Tabla 1) y, durante el proceso de selección, la desviación estándar del nivel de expresión disminuyó.
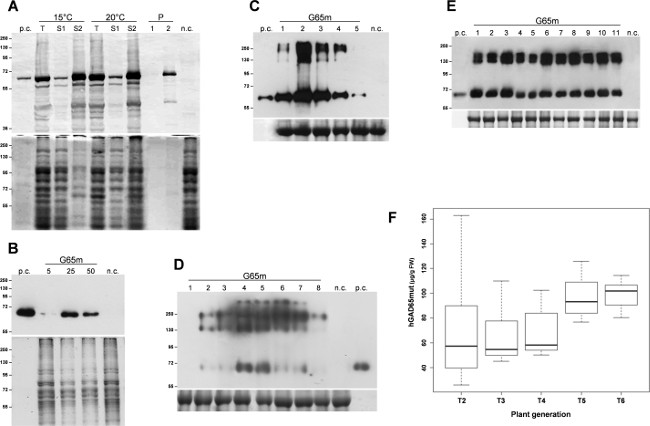
Figura 1:. Plataforma configuración Configurar de mejores condiciones para la expresión hGAD65mut en cada plataforma. (A) E. coli plataforma de expresión inducible. Las células bacterianas se cultivaron a 15 ° C o 20 ° C. El panel superior, transferencia de Western de hGAD65mut en extractos de células (TSP 2 g por carril). Panel inferior, cargando de control teñidas con Coomassie. n.c. = Control negativo, las células bacterianas transformadas con el vector pDEST17 que contiene el gen de resistencia al cloranfenicol; T: Total de muestras; S1: el sobrenadante después de la sonicación y centrifugación; S2 y P: sobrenadante (1) y Pellet (2) después de la centrifugación de la muestra solubilizada en tampón que contiene urea. (B) Baculovirus / plataforma de células de insecto. Los siguientes volúmenes de existencias virales se ensayaron: 5, 25 y 50 l Panel superior, transferencia de Western de hGAD65mut en extractos de células (TSP 5 g por carril) Panel inferior, cargando de control teñidas con Coomassie... NC = control negativo, extracto de células no transformadas de insectos. (C) La expresión transitoria en N. benthamiana plantas utilizando el vector pK7WG2. Las muestras se recogen diariamente, 1-5 ppp (carriles 1-5). EI panel superior, Western blot de hGAD65mut en extractos de hojas (TSP 2,5 g por carril). Panel inferior, cargar el control teñidas con Coomassie, donde la subunidad grandedel Rubisco es evidente. nc = control negativo, las plantas se infiltró con el vector pK7WG2 lleva el gen marcador GFP. (D) La expresión transitoria en N. benthamiana plantas usando vectores MagnICON. Las muestras se recogieron diariamente, 1-8 dpi (carriles 1-8). Panel superior, Western blot de extractos de hojas en hGAD65mut (TSP 5 g por carril). Panel inferior, cargando de control teñidas con Coomassie en donde la subunidad grande de Rubisco es evidente . nc = control negativo, las plantas se infiltraron sólo con el 5'-módulo de pICH20111 y pICH14011 integrasa-módulo. Los números indican el marcador de masa molecular en kDa. pc = control positivo, 15 ng de hGAD65 comerciales producidas en el sistema baculovirus / células de insecto. (E) La expresión estable en N. plantas tabacum. Las muestras de hojas fueron recogidos de las diferentes plantas T5 (carriles 1-11). Panel superior, western blot de hGAD65mut en extractos de hojas (5 TSP g por carril). Panel inferior, control de carga manchado wITH Coomassie. nc = control negativo, las plantas de tipo salvaje. Los números indican el marcador de masa molecular en kDa. pc = control positivo, 15 ng de hGAD65 comerciales producidas en el sistema baculovirus / células de insecto. (F) La expresión estable en N. plantas tabacum. Representación gráfica de caja de acumulación hGAD65mut largo de varias generaciones derivadas de mejor desempeño hGAD65mut T1 planta de tabaco transgénico reportado como mg / g FLW calculado a partir de datos de RIA. Por favor, haga clic aquí para ver una versión más grande de esta figura.
| Sistema | [HGAD65mut] (g / ml) | [HGAD65mut] |
| Báculo / insectos | 117,5 ± 7,7 | Medio de cultivo / ml 11,8 ± 0,8 g |
| Transient | 22,6 ± 0,9 | 67,8 ± 2,7 g / g FLW |
| MagnICON | 26,3 ± 5,9 | 78,8 ± 17,8 mg / g FLW |
| T6 Elite | 33,0 ± 3,8 | 99,1 ± 11,3 mg / g FLW |
Tabla 1: hGAD65mut produce rendimientos hGAD65mut en diferentes plataformas - (Báculo / insecto) con sede en fermentadores y de origen vegetal (pK7WG2- y MagnICON en N. benthamiana y T6 elite en N. tabacum). Segunda columna - hGAD65mut concentración en extractos de proteínas (g / ml). Tercera columna - hGAD65mut contenido en peso de la hoja fresca (g / g FLW) para las plataformas a base de plantas y en medio de cultivo celular (g / ml) para la plataforma basada en fermentador.
Discusión
En este estudio tres plataformas diferentes se compararon para la expresión de una proteína humana recombinante: células bacterianas, células de baculovirus / insectos y plantas. La plataforma basada en plantas fue explorada aún más por la explotación de tres tecnologías de expresión ampliamente utilizado (es decir, transitoria - MagnICON y pK7WG2 base - y estables). La proteína diana escogido para este experimento, hGAD65mut, se ha expresado anteriormente en diferentes sistemas de 13, y su producción y funcionalidad son fácilmente detectable y medible 14.
Las células bacterianas no eran una plataforma de producción eficaz porque hGAD65mut formado cuerpos de inclusión, incluso en condiciones de crecimiento de baja temperatura, lo que requiere la solubilización laborioso y replegamiento para alcanzar su conformación nativa. De hecho, el fallo principal de esta plataforma para la expresión de proteínas recombinantes complejas es la conformación correcta del producto final.
LaPlataforma de célula / insecto Baculovirus mediada una alta expresión de la proteína recombinante inmunorreactiva, pero la principal limitación de este sistema de expresión es el alto costo de los medios de cultivo, requerido para hacer crecer células de insectos. Se estima que los costos totales de producción de 1 g de hGAD65mut podrían elevarse a 700 euros en esta plataforma de producción (considerando 9 L de medio de cultivo de células de insecto es necesario). Otra limitación de esta plataforma de expresión es la necesidad del cultivo de células de insecto estéril, lo que requiere de personal con habilidades de manipulación aséptica. Para garantizar la acumulación eficiente proteína recombinante dos parámetros críticos deben ser controlados cuidadosamente en este sistema de expresión: los volúmenes de existencias virales utilizados para infectar células y el momento de la infección viral. Además, el detergente, que se utiliza para la extracción de proteína soluble total a partir de células de insecto Sf9, influye drásticamente solubilización de proteína recombinante.
Los sistemas basados en plantas eran la platfo más beneficiosarm para expresar hGAD65mut: la proteína recombinante hechos a planta era inmunorreactiva y acumulada en altos niveles en los tejidos foliares. Comparación de diferentes sistemas de expresión basados en plantas, los rendimientos más altos se alcanzaron en las plantas estables transformadas de tabaco (Tabla 1) y, si se considera la biomasa total del tabaco en comparación con N. benthamiana, que se utiliza para la expresión transitoria, la mayor productividad general de tabaco es evidente. Sin embargo, la principal limitación de plataforma basada en la planta de tabaco transformada estable es el tiempo requerido para la puesta a punto del sistema, que en nuestro estudio se llevó a 20 meses. De hecho, una línea homocigótica debe ser seleccionado para la homogeneidad expresión de proteína recombinante y puede requerir ciclos repetidos de auto-cruz, a partir de la más alta expresión de líneas T1. En particular, cuando la T1 seleccionada lleva más de una copia del rasgo transgénico, el programa de cría puede durar hasta 3 años.
Sistemas de expresión transitoria ofrecen laventaja de escalado rápido debido a un corto intervalo entre la transformación y de expresión y la puesta en marcha de la plataforma de expresión requiere 4 días. Sin embargo, una limitación de los sistemas de transitorios de origen vegetal es que su automatización es difícilmente realizable en una escala de laboratorio a menos que se utiliza equipo de alta calidad dedicado para la agro-infiltración. Por lo tanto, un cálculo adecuado para la producción a gran escala de hGAD65 utilizando sistemas basados en transitorios no se puede realizar aquí. Por otra parte, se especula que los costos totales de producción de 1 g de proteína recombinante utilizando línea de tabaco estable T6 pueden calcularse a menos de € 5 (considerando suelo para el cultivo de 60 plantas de tabaco). Para garantizar la agroinfiltración producción de proteínas y eficiente varios parámetros críticos deben ser cuidadosamente controlados (etapa de desarrollo de la planta, crecer y condición infiltración de Agrobacterium), como se informó anteriormente 15. Además, para cada expresión experimentar un análisis tiempo-curso específico debe serrealizado para seleccionar el dpi que permite que la mayor acumulación de la proteína recombinante.
El ejemplo expuesto aquí se puede considerar un estudio de caso de prueba de principio, que pone de relieve algunas de las ventajas específicas de la producción basada en plantas frente a los sistemas tradicionales. En particular, las líneas transgénicas de tabaco homogénea que expresan la proteína recombinante pueden considerarse una valiosa plataforma para la producción masiva de proteínas recombinantes que se requieren en-grandes cantidades.
Divulgaciones
The authors declare that there is no conflict of interests regarding the publication of this paper.
Agradecimientos
This work was supported by the COST action ‘Molecular pharming: Plants as a production platform for high-value proteins’ FA0804. The Authors thank Dr Anatoli Giritch and Prof. Yuri Gleba for providing the MagnICON vectors for research purposes.
Materiales
| Name | Company | Catalog Number | Comments |
| Yeast extract | Sigma | Y1333 | |
| Tryptone | Formedium | TRP03 | |
| Agar Bacteriological Grade | Applichem | A0949 | |
| Sf-900 II SFM medium | Gibco | 10902-088 | |
| Grace’s Insect Medium, unsupplemented | Gibco | 11595-030 | |
| Cellfectin II Reagent | Invitrogen | 10362-100 | |
| MS medium including vitamins | Duchefa Biochemie | M0222 | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Plant agar | Duchefa Biochemie | P1001 | |
| Ampicillin sodium | Duchefa Biochemie | A0104 | Toxic |
| Gentamycin sulphate | Duchefa Biochemie | G0124 | Toxic |
| Ganciclovir | Invitrogen | I2562-023 | |
| Carbenicillin disodium | Duchefa Biochemie | C0109 | Toxic |
| Kanamycin sulfate | Sigma | K4000 | Toxic |
| Rifampicin | Duchefa Biochemie | R0146 | Toxic – 25 mg/ml stock in DMSO |
| Streptomycin sulfate | Duchefa Biochemie | S0148 | Toxic |
| Spectinomycin dihydrochloride | Duchefa Biochemie | S0188 | |
| IPTG (isopropil-β-D-1-tiogalattopiranoside) | Sigma | I5502 | Toxic |
| MES hydrate | Sigma | M8250 | |
| MgCl2 | Biochemical | 436994U | |
| Acetosyringone | Sigma | D134406 | Toxic – 0.1 M stock in DMSO |
| Syringe (1 ml) | Terumo | ||
| MgSO4 | Fluka | 63136 | |
| BAP (6-Benzylaminopurine) | Sigma | B3408 | Toxic |
| NAA (Naphtalene acetic acid) | Duchefa Biochemie | N0903 | Irritant |
| Cefotaxime | Mylan Generics | ||
| Trizma base | Sigma | T1503 | Adjust pH with 1 N HCl to make Tris-HCl buffer |
| HCl | Sigma | H1758 | Corrosive |
| NaCl | Sigma | S3014 | 1 M stock |
| KCl | Sigma | P9541 | |
| Na2HPO4 | Sigma | S7907 | |
| KH2PO4 | Sigma | P9791 | |
| PMSF (Phenylmethanesulfonylfluoride) | Sigma | P7626 | Corrosive, toxic |
| Urea | Sigma | U5378 | |
| β-mercaptoethanol | Sigma | M3148 | Toxic |
| Tween-20 | Sigma | P5927 | |
| Hepes | Sigma | H3375 | |
| DTT (Dithiothreitol) | Sigma | D0632 | Toxic – 1 M stock, store at -20 °C |
| CHAPS | Duchefa Biochemie | C1374 | Toxic |
| Plant protease inhibitor cocktail | Sigma | P9599 | Do not freeze/thaw too many times |
| SDS (Sodium dodecyl sulphate) | Sigma | L3771 | Flammable, toxic, corrosive – 10% stock |
| Glycerol | Sigma | G5516 | |
| Brilliant Blue R-250 | Sigma | B7920 | |
| Isopropanol | Sigma | 24137 | Flammable |
| Acetic acid | Sigma | 27221 | Corrosive |
| Anti-Glutamic acid decarboxylase 65/67 | Sigma | G5163 | Do not freeze/thaw too many times |
| Horseradish peroxidase (HRP)-conjugate anti-rabbit antibody | Sigma | A6154 | Do not freeze/thaw too many times |
| Sf9 Cells | Life Technologies | 11496 | |
| BL21 Competent E. coli | New England Biolabs | C2530H | |
| Protein A Sepharose | Sigma | P2545 | |
| Cell culture plates | Sigma | CLS3516 | |
| Radio Immuno Assay kit | Techno Genetics | 12650805 | Radioactive material |
Referencias
- Hampe, C. S., Hammerle, L. P., Falorni, A., Robertson, J., Lernmark, A. Site-directed mutagenesis of K396R of the 65 kDa glutamic acid decarboxylase active site obliterates enzyme activity but not antibody binding. FEBS Lett. 488 (3), 185-189 (2001).
- Avesani, L., et al. Recombinant human GAD65 accumulates to high levels in transgenic tobacco plants when expressed as an enzymatically inactive mutant. Plant Biotechnol. J. 9 (8), 862-872 (2010).
- Sambrook, J., et al. Molecular Cloning: A laboratory manual. Second Edition. , Cold Spring Harbor Laboratory Press. New York. (1989).
- Avesani, L., et al. Comparative analysis of different biofactories for the production of a major diabetes autoantigen. Transgenic Res. 23, 281-291 (2014).
- Marillonnet, S., Giritch, A., Gils, M., Kandzia, R., Klimyuk, V., Gleba, Y. In planta engineering of viral RNA replicons: efficient assembly by recombination of DNA modules delivered by Agrobacterium. Proc. Natl. Acad. Sci. (USA). 101 (18), 6852-6857 (2004).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants). Curr. Opin. Biotechnol. 18, 134-141 (2007).
- Engler, C., Kandzia, R., Marillonnet, S. A one pot, one step, precision cloning method with high throughput capability. PLoS One. 3 (11), (2008).
- Xu, R., Li, Q. Q. Protocol: streamline cloning of genes into binary vectors in Agrobacterium via the Gateway TOPO vector system. Plant Methods. 4 (4), 1-7 (2008).
- Fairbanks, G., Steck, T. L., Wallach, D. F. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606-2617 (1971).
- Falorni, A., et al. Radioimmunoassay detects the frequent occurrence of autoantibodies to the Mr 65,000 isoform of glutamic acid decarboxylase in Japanese insulin-dependent diabetes. Autoimmunity. 19, 113-125 (1994).
- Hunt, I. From gene to protein: a review of new and enabling technologies for multi-parallel protein expression. Protein Expr. Purif. 40 (1), 1-22 (2005).
- Arzola, L., et al. Transient co-expression of post-transcriptional silencing suppressor for increased in planta expression of a recombinant anthrax receptor fusion protein. Int. J. Mol. Sci. 12 (8), 4975-4990 (2011).
- Merlin, M., Gecchele, E., Capaldi, S., Pezzotti, M., Avesani, L. Comparative evaluation of recombinant protein production in different biofactories: the green perspective. Biomed. Res. Int. 2014, 136419(2014).
- Avesani, L., et al. Improved in planta expression of the human islet autoantigen glutamic acid decarboxylase (GAD65). Transgenic Res. 12 (2), 203-212 (2003).
- Leuzinger, K., et al. Efficient agroinfiltration of Plants for high-level transient expression of recombinant proteins. J Vis Exp. (77), (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.