Method Article
Eine vergleichende Analyse der Expression rekombinanter Proteine in verschiedenen Biofabrik: Bakterien, Insektenzellen und Pflanzensysteme
In diesem Artikel
Zusammenfassung
In this study the expression of a target human recombinant protein in different production platforms was compared. We focused on traditional fermenter-based cultures and on plants, describing the set-up of each system and highlighting, on the basis of the reported results, the inherent limits and advantages for each platform.
Zusammenfassung
Pflanzliche Systeme sind als wertvolle Plattform für die Produktion rekombinanter Proteine als Ergebnis ihrer gut dokumentierten Potential für die flexible und kostengünstige Herstellung von qualitativ hochwertigen, bioaktive Produkte.
In dieser Studie verglichen wir die Expression eines Ziel humanen rekombinanten Protein in herkömmlichen Fermenter basierenden Zellkulturen (Bakterien und Insekten) mit pflanzlichen Expressionssysteme, sowohl transient und stabil.
Für jede Plattform beschrieben wir den Aufbau, die Optimierung und die Länge der Herstellungsverfahren, der Endproduktqualität und der Ausbeute und wir geprüft vorläufigen Herstellungskosten, die spezifisch für das ausgewählte rekombinante Zielprotein fusionieren.
Insgesamt zeigen unsere Ergebnisse, dass die Bakterien zur Produktion des Zielproteins ungeeignet aufgrund ihrer Akkumulation in unlöslichen Einschlusskörpern. Andererseits sind Pflanzenbasierte Systeme flexiblen Plattformen tKappe ermöglichen die Produktion des ausgewählten Proteins zu niedrigeren Kosten als die Baculovirus / Insektenzellsystem. Insbesondere angezeigten stabilen transgenen Linien die höchste Ausbeute des Endproduktes und vorübergehend exprimierenden Pflanzen der schnellste Prozessentwicklung. Allerdings können nicht alle rekombinanten Proteinen aus pflanzlichen Systemen profitieren, aber die beste Produktionsplattform sollte empirisch mit einer Fall-zu-Fall-Ansatz bestimmt werden kann, wie hier beschrieben.
Einleitung
Recombinant proteins are commercially mass-produced in heterologous expression systems with the aid of emerging biotechnology tools. Key factors that have to be considered when choosing the heterologous expression system include: protein quality, functionality, process speed, yield and cost.
In the recombinant protein field, the market for pharmaceuticals is expanding rapidly and, consequently, most biopharmaceuticals produced today are recombinant. Proteins can be expressed in cell cultures of bacteria, yeasts, molds, mammals, plants and insects, as well as in plant systems (either via stable- or transient-transformation) and transgenic animals; each expression system has its inherent advantages and limitations and for each target recombinant protein the optimal production system has to be carefully evaluated.
Plant-based platforms are arising as an important alternative to traditional fermenter-based systems for safe and cost-effective recombinant protein production. Although downstream processing costs are comparable to those of microbial and mammalian cells, the lower up-front investment required for commercial production in plants and the potential economy of scale, provided by cultivation over large areas, are key advantages.
We evaluated plants as bioreactors for the expression of the 65 kDa isoform of human glutamic acid decarboxylase (hGAD65), one of the major autoantigen in Type 1 autoimmune diabetes (T1D). hGAD65 is largely adopted as a marker, both for classifying and monitoring the progression of the disease and its role in T1D prevention is currently under investigation in clinical trials. If these trials are successful, the global demand for recombinant hGAD65 will increase dramatically.
Here, we focus on the expression of the enzymatically inactive counterpart of hGAD65, hGAD65mut, a mutant generated by substituting the lysine residue that binds the cofactor PLP (pyridoxal-5'-phosphate) with an arginine residue (K396R)1.
hGAD65mut retains its immunogenicity and, in plant and insect cells, accumulates up to ten-fold higher than hGAD65, its wild-type counterpart. It was hypothesized that the enzymatic activity of hGAD65 interferes with plant cell metabolism to such an extent that it suppresses its own synthesis, whereas hGAD65mut, the enzymatically-inactive form, can be accumulated in plant cells to higher levels.
For the expression of hGAD65mut, the use of different technologies, widely used in plant biotechnology, was explored here and compared to traditional expression platforms (Escherichia coli and Baculovirus/insect cell-based).
In this work, the recombinant platforms developed for the expression of hGAD65mut comprising traditional and plant-based systems were reviewed and compared on the basis of process speed and yield, and of final product quality and functionality.
Protokoll
1. Konstruktion von Expressionsvektoren
- Kommerzielle Rekombination Klonierungssystem:
- Erhöhen der Volllängensequenz des Zielgens (hGAD65mut) mit geeigneten Primern, die den Zusatz eines CACC Klemme am 5'-Ende des Gens, wie zuvor beschrieben 2.
- Klonierung des gelgereinigten Amplifikationsprodukt entsprechend den Richtungs Klonierungskit Spezifikationen, in der Eingangsvektor (Topoisomerase gebunden) durch Zusammensetzen, die Reaktion in einem Gesamtvolumen von 6 & mgr; l, mit einem 1,5: 1-Molverhältnis Insert: Vektor und 1 & mgr; Salzlösung (0,2 M NaCl und 0,01 MgCl 2). Inkubation für 5 min bei Raumtemperatur (RT).
- Verwandeln Sie das gesamte Reaktions in chemisch kompetente E. coli-Zellen gemäß Richtungs Klonierungskit Spezifikationen und Bildschirm erhaltenen Kolonien durch Kolonie-PCR 3 mit den M13 Vorwärts- und Rückwärtsprimer in der gerichteten Klonierung Kit enthalten. Trennen Sie das Plasmid von einem poempfindlichen Kolonie nach Plasmid-DNA-Präparation Kit Spezifikationen und Sequenz der Einsatz unter Verwendung von M13 Vorwärts- und Rückwärtsprimer, um die Abwesenheit von Mutationen 3 zu gewährleisten.
- Verwenden Sie das erhalten entry clone, um die Rekombinationsreaktion von der Lambda-Rekombinase Clonase II Enzyme (LR) mit spezifischen Zielvektoren durchführen: für Expression rekombinanter Proteine in Bakterienzellen mit pDEST17 (was pDEST17.G65mut), bei Pflanzen (transient oder stabil) mit pK7WG2 (Streck pK7WG2.G65mut) in Baculovirus / Insektenzellen-System mit dem linearisierten Virus-DNA (wodurch Baculo.G65mut) 4. Montieren der Reaktion nach Clonase Kit Spezifikationen, mit 100 ng der Eingangsvektor, 150 ng des Zielvektors und 2 & mgr; l Enzymgemisch in einem Endvolumen von 10 ul. Inkubieren des Gemisches bei Raumtemperatur für 1 Std.
- Wandeln Sie die Rekombinationsprodukt in chemisch kompetente E. coli-Zellen gemäß Clonase Kit Spezifikationen. Bildschirm erhaltenen Kolonien durch PCR-3 mit für alle Transformationsreaktion abgeleitet Kolonien der gleichen Reverse GAD65mut spezifischen Primers (5'-CACACGCCGGCAGCAGGT-3 ') und den folgenden spezifischen Zielvektoren Vorwärts-Primer: für pDEST17: 5'-TAATACGACTCACTATAGGG-3'; für pK7WG2: 5'-AAGATGCCTCTGCCGACAGT-3 '; für Baculo linearisierte Vektor: 5'-AAATGATAACCATCTCGC-3 '.
- Isolieren von Plasmid-DNA unter Verwendung eines kommerziellen DNA-Minipräparation Kit und bestätigen das Vorliegen der Zielsequenz durch PCR 3 mit Hilfe der in dem vorherigen Schritt beschrieben gleichen spezifischen Primer-Kombinationen.
- Mit den erhaltenen PCR-positive Plasmide, verschiedene Zielorganismen zu transformieren, in Abhängigkeit von dem für die rekombinante Proteinexpression gewählt, wie in den folgenden Schritten beschrieben Plattform.
- MagnICON System 5-7:
- Klonierung des Zielgens in der 3'-Modul pICH31070, wie zuvor im Detail 7 beschrieben, wodurch pICH31070.G65mut. Verwenden Sie diefolgenden spezifischen Reaktionszyklus: 30 min Inkubation bei 37 ° C, 5 min bei 50 ° C und dann 5 min bei 80 ° C.
2. Expression rekombinanter Proteine
- Bakterielle Zellsystem:
- Trans pDEST17.G65mut in E. coli BL21 (DE3) elektrokompetente Zellen unter Verwendung von Standardtechniken und Screening der Kolonien auf Ampicillin-haltigen (100 ug / ml) gezüchtet LB-Medium, durch Kolonie-PCR unter Verwendung der folgenden Transgen-spezifische Primer: 5'-CTGGTGCCAAGTGGCTCAGA-3 'und 5' -CACACGCCGGCAGCAGGT-3 ', mit einer Annealingtemperatur von 58 ° C und einer Dehnung von 20 sec. Durchführung der PCR-Reaktion in einem Gesamtvolumen von 20 ul nach Auflösen Bakterienzellen mit einer Kunststoffspitze in die Röhre.
- Beimpfen von einer Einzelkolonie über Nacht bei 37 ° C in 3 ml ampicillinhaltigem (100 ug / ml) LB-Medium.
- Verdünne die Bakterienkultur 1: 100 in 100 ml frisches LB-Medium (einschließlich ampicillin) und bei 37 ° C für 1-6 Stunden bis zu einer endgültigen OD 600 von 0,8.
- Induzieren rekombinanten Proteinexpression durch Zugabe von isopropil-β-D-1-tiogalattopiranoside (IPTG) in einer Endkonzentration von 1 mM und Inkubation Kultur unter heftigem Schütteln für 3 h bei 37 ° C.
- Sammle die Zellen durch Zentrifugation bei 4.000 × g für 20 min und mit Bakterienpellet zur Proteinextraktion (Schritt 3.1.1.1).
- Baculovirus / Insektenzellen-System:
- Samen Spodoptera frugiperda (Sf9) Zellen in 6-Well-Platten (8 x 10 5 Zellen pro Vertiefung) und waschen zweimal mit 2 ml nicht ergänzt Grace Insektenmedium.
- Entfernen und ersetzen Sie das Medium tropfenweise mit Transfektionsmischung (5 ul LR rekombinanten Reaktion, 6 ul Celfectin Lösung und 200 ul nicht-ergänzten Graces Insekt Medium).
- Inkubation erfolgt bei 27 ° C für 5 Stunden.
- Entfernen und ersetzen Sie Transfektion Gemisch mit 2 ml frischem Sf-900 Medium mit 10% fötalem Rinderserum, 10 ug / ml Gentamycin und 100 uM Ganciclovir ergänzt rekombinanten Baculovirus-Klone auszuwählen.
- Nach einer Inkubationszeit von 96 Stunden bei 27 ° C, sammeln Medium (V1 virale Stammlösung), Zentrifuge bei 4.000 xg für Zellen und große Trümmer und bei 4 ° C zu entfernen in der Dunkelheit.
- Seed 1 x 10 6 Sf9-Zellen pro Vertiefung in 2,5 ml Sf-900-Medium mit 10% fötalem Rinderserum, 10 ug / ml Gentamycin und 100 uM Ganciclovir und infizieren mit 100 ul V1 Lager in jede gut.
- Inkubieren Zellen 3 Tage lang bei 27 ° C.
- Sammeln und Zentrifuge Medium bei 4000 x g.
- Lagern Sie den Überstand (V2 hochtitrige Lager) bei 4 ° C.
- Seed 1 x 10 6 Sf9-Zellen pro Vertiefung in 2,5 ml Sf-900-Medium mit 10% fötalem Rinderserum, 10 ug / ml Gentamycin und 100 uM Ganciclovir und infizieren mit 25 ul V2 Lager in jede gut.
- Inkubieren Zellen 3 Tage lang bei 27 ° C.
- Sammeln Sie die Zellen durch Zentrifugation bei 4000 xg und benutzen Insektenzellpellet zur Proteinextraktion (Schritt 3.1.2. 1).
- Nicotiana benthamiana vorübergehende Expressionssysteme:
- Wachsen N. benthamiana Pflanzen im Gewächshaus, unter natürlichem Licht in einem Temperaturbereich von 18 bis 23 ° C. Für Agroinfektion verwenden 4-5 Wochen alten Pflanzen.
- Halten agroinfected Pflanzen in einer Klimakammer bei 22 ° C mit einer 13 Stunden am Tag / 11 h Nachtphotoperiode.
- Kommerzielle Rekombination Klonierungssystem:
- Einzuführen pK7WG2.G65mut in Agrobacterium tumefaciens-Stamm EHA105 elektro Zellen wie zuvor beschrieben 8 und screenen, die Kolonien auf LB-Medium, das Rifampicin (50 ug / ml), Streptomycin (300 ug / ml) und Spectinomycin (100 ug / ml) nach 2 gezüchtet Tagen Inkubation bei 28 ° C, durch Kolonie-PCR unter Verwendung der folgenden 8-Transgen-spezifische Primer: 5'-CATGGTGGAGCACGACACGCT-3 & #8217; und 5'-CACACGCCGGCAGCAGGT-3 ', mit einer Annealingtemperatur von 58 ° C und einer Elongationszeit von 50 Sekunden. Durchführung der PCR-Reaktion in einem Gesamtvolumen von 20 ul.
- Beimpfen von Bakterien in 30 ml LB-Medium, das Rifampicin (50 ug / ml), Streptomycin (300 ug / ml) und Spectinomycin (100 ug / ml) für zwei Tage bei 28 ° C.
- Sammeln Bakterien durch Zentrifugation bei 4.000 × g für 20 min und das Pellet erneut in 10 ml Infiltrations Puffer (10 mM MES, 10 mM MgCl 2, 100 & mgr; M Acetosyringon, pH 5,6). Messen Sie die OD600-Wert und passen Sie sie auf 0,9 durch Verdünnen in dem gleichen Puffer.
HINWEIS: das Gesamtvolumen zum Infiltrieren drei N. erforderlich benthamiana Pflanzen ist 30 ml. - Verwenden Sie eine 2,5 ml Spritze ohne Nadel, um die Agrobacterium-Suspension in N. infiltrieren benthamiana Blätter. Vorsichtig und langsam injiziert Blatt Platten mit der Suspension aus der Spritze. Infiltrieren drei erweitert lTraufe pro Pflanze und verwenden drei Pflanzen als dreifach.
HINWEIS: für Gesundheits- und Sicherheitsgründen eine Schutzbrille tragen bei Infiltrationsprozess. - Sammeln agroinfiltrated Blättern 2 Tage nach der Infektion (dpi) und gefrier in flüssigem Stickstoff. Speicher Pflanzengewebe bei -80 ° C.
- MagnICON System:
- Führen Sie die magnICON Vektoren - die "Modul (pICH20111), die 3'-5-Modul (pICH31070.G65mut) und die Integrase-Modul (pICH14011) - in A. tumefaciens GV3101 Stamm unter Verwendung von Standardverfahren. Bildschirm die Kolonien auf LB-Medium gezüchtet 50 ug / ml Rifampicin und geeigneten Vektor spezifische Antibiotika (50 ug / ml Carbenicillin für pICH20111 und pICH14011, 50 ug / ml Kanamycin für pICH31070), durch Kolonie-PCR mit spezifischen Primern für jeden Vektor.
- Impfen Sie separat die drei A. tumefaciens-Stämme in 5 ml LB-Medium, das 50 ug / ml Rifampicin und entsprechenden vektorspezifischen antibiotischenund schütteln über Nacht bei 28 ° C.
- Pellet über Nacht Bakterienkulturen durch Zentrifugation bei 4.000 xg für 20 Minuten und Resuspendieren sie in zwei Volumen der anfänglichen Bakterienkultur von 10 mM MES (pH 5,5) und 10 mM MgSO 4.
- Mischen Sie gleiche Volumina Bakteriensuspensionen mit den drei Vektoren und verwenden Sie die Aufhängung Mix für Spritze Infiltration von N. benthamiana Blätter. Infiltrieren drei entwickelte Blätter pro Pflanze.
- Sammeln agroinfiltrated Blätter 4 dpi und frieren in flüssigem Stickstoff.
- Speicher Pflanzengewebe bei -80 ° C.
- Nicotiana tabacum stabiles Expressionssystem:
- Aufbau und zur Pflege in vitro Pflänzchen von N. tabacum (var Sr1.) auf festen Pflanzenkulturmedium (4,4 g / l Murashige und Skoog - MS - Medium, das Vitamine, 30 g / l Saccharose, pH 5,8, 7 g / L Plant Agar) unter kontrollierten Bedingungen im Klimaraum bei 25 ° C bei 16 h / 8 h Tag / night Regimes.
- Starten Sie eine Vorkultur von A. tumefaciens EHA105 den Expressionsvektor pK7WG2.G65mut in 5 ml YEB Flüssigmedium mit geeigneten Antibiotika (Rifampicin 50 & mgr; g / ml, Streptomycin 300 ug / ml Spectinomycin 100 ug / ml) und über Nacht wachsen bei 28 ° C in einem Orbitalschüttler set bei 200 Umdrehungen pro Minute.
- Verwenden 1 ml der Vorkultur, um eine 50 ml Agrobacterium-Kultur in YEB-Medium plus Antibiotika beimpfen (Rifampicin 50 & mgr; g / ml, Streptomycin 300 ug / ml Spectinomycin 100 ug / ml) wachsen und für 24 h, bis die Bakterienkultur gesättigte (OD 600-Wert von 0,5 bis 1,0).
- Sammeln Bakterien durch Zentrifugation bei 4.000 × g für 20 min und das Pellet erneut in 50 ml des flüssigen Pflanzenkulturmedium. Wiederholen Sie diesen Schritt zweimal gegen Antibiotika vollständig zu entfernen.
- Nehmen Sie die erste gesunde voll entwickelte Blätter von in-vitro-Tabakpflanzen und schneiden sie in ca. 1 cm große Quadrate.
- Überblattstücketiefe Petrischalen mit Bakteriensuspension und verlassen im Dunkeln für 20 min.
- Entfernen Sie Blattstücke von der Aussetzung und trocken tupfen auf sterilem Filterpapier.
- Platzieren Blattstückchen mit adaxial Seite (obere Blattoberfläche) auf festen Pflanzenkulturmedium, das 1,0 ug / ml 6-Benzylaminopurin (BAP) und 0,1 & mgr; g / ml Naphthalinessigsäure (NAA) und inkubieren Platten für zwei Tage in einem Klimaraum bei kontrollierter Bedingungen (25 ° C, 16 Stunden am Tag / 8 Stunden Nacht).
- Überblattstücke auf festen Kulturmedium (einschließlich 1,0 g / ml BAP, 0,1 ug / ml NAA, 500 ug / ml Cefotaxim, 100 ug / ml Kanamycin) mit abaxial Oberfläche (untere Oberfläche des Blattes) in Kontakt mit dem Medium.
- Platten für 2-3 Wochen in der Klimakammer Inkubation bei 25 ° C und 16 h / 8 h Tag / Nacht-Regime Triebbildung zu induzieren. Subculture alle 2 Wochen durch die Übertragung von Blatt Explantate auf frisches festen Pflanzenkulturmedium, das 1,0 ug / ml BAP, 0,1 ug / ml NAA, 500ug / ml Cefotaxim und 100 & mgr; g / ml Kanamycin.
- Wenn Triebe erscheinen, übergeben sie an Magenta-Boxen mit festen Kulturmedium mit 500 ug / ml Cefotaxim und 100 ug / ml Kanamycin, um die Wurzelbildung zu induzieren. Pflänzchen mit 16 Stunden am Tag / 8 h Nachtphotoperiode Inkubation bei 25 ° C für 1-2 Wochen.
- Wenn Wurzeln bilden, übertragen Sie die Pflanzen auf Boden im Gewächshaus.
- Sammeln Sie ein Blattstück für jede Anlage und Isolierung genomischer DNA mit einem kommerziellen Kit.
- Die Anwesenheit des Transgens durch spezifische PCR. Benutzen 30 ng genomische DNA als Matrize für die PCR-Amplifikation unter Verwendung der folgenden Transgen-spezifische Primer: 5'-CTGGTGCCAAGTGGCTCAGA-3 'und 5'-CACACGCCGGCAGCAGGT-3', mit einer Annealingtemperatur von 58 ° C und einer Dehnung von 20 sec . Durchführung der PCR-Reaktion in einem Gesamtvolumen von 50 ul.
- Analysieren Sie den 220 bp-Produkt durch Elektrophorese auf 1% Agarosegel in Tris-Acetat-EDTA-Puffer (TAE) (40 mM Trist, 20 mM Essigsäure und 1 mM EDTA).
- Wählen transgenen Pflanzen, die das Zielgen.
- Sammeln einer Blattstück aus jedem der ausgewählten transgenen Pflanze und gefrier sofort in flüssigem Stickstoff.
- Bereiten Gesamtproteinextrakten aus Pflanzenblattgewebe (Schritt 3.1.3) und testen Sie jede Probe durch Western-Blot-Analyse, wie oben beschrieben 2, um die besten rekombinante Protein exprimieren Tabakpflanze zu wählen.
- Tasche Blumen des ausgewählten leistungsstärksten Anlage vor der Blüte, um Kreuzbestäubung zu verhindern.
- Nach der Blüte, Fruchtreife und Samentrocknung, sammeln Taschen.
- Separate Samen von der Spreu und speichern sie in einem trockenen Raum bei kontrollierter Temperatur (20-24 ° C).
- Säen Sie die getrockneten Samen, um die zweite Generation transgener Pflanzen zu produzieren und anschließend wählen Sie die leistungsstärksten Anlage selbst bestäubt werden.
- Wiederholen stufen 2.4.19-2.4.21 nachfolgenden Generationen der gleichen Vorgehensweise.
3. Expression rekombinanter Proteine Analysen
- Gesamtproteinextraktion:
- Bakterienzellen:
- Resuspendieren bakterielle Zellpellet gesammelt, wie in Schritt 2.1.5 beschrieben, in der Hälfte des Kulturvolumens von Tris-gepufferter Saline (TBS - 2 mM Tris / HCl, 500 mM NaCl), pH 7,4 mit 1 mM Phenylmethansulfonylfluorid (PMSF) ergänzt.
- Ultraschallbehandlung resuspendiert Zellpellet dreimal für 40 Sekunden bei halber Leistung, während Probe auf Eis.
- Klärung Lysat durch Zentrifugieren bei 14.000 xg für 20 min bei 4 ° C.
- Überstand in ein sauberes Röhrchen und lagern, Überstand und Pellet getrennt bei -80 ° C.
- Solubilisieren der Einschlusskörper, in dem Pellet gesammelt, in Halb Zelllysat Volumen TBS, pH 8,0, mit 6 M Harnstoff durch kräftiges Schütteln über Nacht bei Raumtemperatur ergänzt.
- Zentrifugieren bei 10.000 xg für 25 min bei Raumtemperatur und Sammeln Stand in ein sauberesRohr.
- Bewahren Sie beide Überstand und Pellet bei -80 ° C.
- Insektenzellen:
- Waschen infizierten Insektenzellpellet gesammelt, wie in Schritt 2.2.12 beschrieben, mit 1 ml phosphatgepufferter Kochsalzlösung (PBS - 137 mM NaCl, 2,7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mM KH 2 PO 4), pH 7,4.
- Zellen in 200 ul Lysepuffer (20 mM Tris / HCl pH 8,0, 0,5 M NaCl, 3 mM β-Mercaptoethanol und 1% Tween-20) und Inkubieren auf Eis für 30 min.
- Zentrifuge solubilisiert Zellen bei 14.000 × g für 20 min bei 4 ° C.
- Sammeln löslichen Fraktionen und bei -80 ° C und entsorgen Sie die Pellets.
- Pflanzenblattgewebe:
- Grind N. benthamiana oder N. tabacum Gewebe zu einem feinen Pulver in flüssigem Stickstoff mit Mörser und Stößel.
- Homogenisieren 100 mg des Grundgewebes in 300 ul Extraktionspuffer (40 mM Hepes pH 7,9, 5 mM DTT, 1,5% CHAPS), supplmit 3 ul Proteaseinhibitorcocktail emented und Auftauen auf Eis.
Hinweis: Das ausgewählte Verhältnis zwischen Pflanzengewebe Gewicht (g) Volumen (ml) 1-Puffer: 3. - Zentrifuge Extrakt bei 30.000 xg für 30 min bei 4 ° C.
- Sammeln Überstand in ein sauberes Röhrchen und bei -80 ° C.
- Bakterienzellen:
- Coomassie-Gel-Färbung:
- Eine geeignete Verdünnung des Gesamtproteinextrakte (beispielsweise 2 & mgr; l Pflanzenextrakt, 5 & mgr; l der bakteriellen und Insektenextrakte) bis zu einem Endvolumen von 10 & mgr; l Extraktionspuffer und mit 5 ul 3 x Probenpuffer (1,5 M Tris / HCl pH 6,8, 3% SDS, 15% Glycerin, 4% β-Mercaptoethanol) auf eine endgültige Konzentration 1x.
- Kochen Sie die Proben für 10 min.
- Getrennte Proteine durch 10% SDS-PAGE.
- Nach der Elektrophorese Wärme-Gel in Gegenwart von Coomassie-Lösung A (0,05% Brilliantblau R-250, 25% Isopropanol, 10% Essigsäure) in einem Mikrowellenofen für etwa 2 Minutens, bis zum Siedepunkt.
- Cool down Gel auf Raumtemperatur unter leichtem Schütteln.
- Verwerfen Coomassiefärbung Lösung A
- Destain Gel durch Erhitzen in Gegenwart von Coomassie-Lösung B (0,05% Brilliantblau R-250, 25% Isopropanol), C (0,002% Brilliant Blue R-250, 10% Essigsäure) und D (10% Essigsäure) jedesmal Nach dem gleichen Protokoll für die Färbung.
- Nach dem letzten Heizschritt mit Lösung D, lassen Gel Entfärben bis Hintergrund klar 9.
- Western Blot-Analyse:
- Nach der Elektrophorese, Transfer trennten Proteine auf eine Nitrocellulosemembran unter Verwendung von Standardtechniken und Block mit 4% Milch in PBS, pH 7,4, bei Raumtemperatur 1 Std.
- Inkubieren des Blots über Nacht bei 4 ° C oder für 4 h bei Raumtemperatur in der Blockierungslösung, enthaltend Kaninchen primären Antikörper gegen das Zielprotein in 1 angehoben: 10.000 und mit 0,1% Tween-20 ergänzt.
- Nach der primären Antikörpermarkierunging, waschen Sie die Membran 3 mal 5 Minuten mit jeweils Blockierungslösung, die 0,1% Tween-20.
- Inkubieren mit Meerrettich-Peroxidase (HRP) -Konjugat-Antikaninchen-Antikörper bei 1: 10.000 für 1,5 Std.
- Waschen der Membran 5 mal für jede mit PBS-T 5 min (PBS, ergänzt mit 0,1% Tween-20).
- Verarbeiten Western Blot unter Verwendung des chemilumineszenten Peroxidase-Substrat.
- Radioimmunassay (RIA):
- Alle Reagenzien (Antiserum, Tracer und Protein A-Sepharose) auf Raumtemperatur und Pipette 20 ul Proteinextrakt Proben und Standards mit unterschiedlichen Konzentrationen (von 300-2,400 ng / ml des kommerziellen rekombinanten hGAD65) in 12 x 75 mm Polystyrolröhrchen zu erreichen.
- In 20 ul Antiserum, vorbereitet Verdünnung 1.30 das Serum aus Plasmapherese eines T1D Patienten.
- In 50 ul des Tracers (125-I-GAD65) und Inkubation für 2 Stunden bei Raumtemperatur. Stellen Sie ein Rohr mit Tracer nur die Gesamtaktivität schätzen.
- In 50 ulProtein-A-Sepharose und Inkubation für 1 h bei Raumtemperatur.
- Können 1 ml kaltem PBS in jedes Röhrchen und zentrifugiere Puffer bei 1.500 × g bei 4 ° C für 30 min.
- Dekantieren der Röhrchen zu Stand zu entfernen und zu absorbieren Restflüssigkeit auf Löschpapier durch leichtes Antippen Rohr.
- Maßnahme immunpräzipitiert Radioaktivität in allen Röhrchen durch Zählen für 1 min in einem Gamma-Zähler.
- Grundstück in logarithmischen Skala die Bindungsrate (B / T%) der Kalibratoren zur Gesamtaktivität bezogen, um die Standardkurve zu etablieren und zu lesen GAD Konzentration von Proben aus der Eichkurve 10.
HINWEIS: Sperrflächen sollten für die Lagerung, Handhabung und Entsorgung von radioaktivem Material ausgelegt sein.
Ergebnisse
Eine Versuchsanordnung für die heterologe Expression eines rekombinanten Zielproteins in verschiedenen Produktionssystemen wird hier beschrieben. Der erste Schwerpunkt war der Aufbau der verschiedenen Plattformen durch Festlegung der optimalen Bedingungen für die Expression des Zielproteins in jedem System.
Die Expression des Target-Proteins, hGAD65mut, wurde dreifach induzierten E. coli-Kulturen. Nach 3 h der Expression bei 37 ° C wurden die Bakterienzellen durch Zentrifugation gesammelt und durch Beschallung lysiert. Nach einem Zentrifugationsschritt wurden die löslichen Proteine von unlöslichen Einschlusskörpern getrennt und erste Analysen zeigten, dass hGAD65mut vorwiegend in unlöslichen Einschlusskörpern akkumuliert (Daten nicht gezeigt). Rekombinantes Protein Solubilisierung erforderte den Einsatz von Harnstoff 6 M, die für ihre starke Denaturierung Eigenschaften, stört RIA-Analyse, so dass nicht eine richtige Quantifizierung hGAD65mut. Es wurden mehrere Strategien seinen berichteten zum Begrenzen der Bildung von Einschlusskörpern, umfassend das Züchten der mikrobiellen Zellen bei niedriger Temperatur 11. Die Kulturen wurden bei 15 ° C und 20 ° C gezüchtet, und rekombinante Proteinexpression wurde bei den gleichen Temperaturen induziert. Wie in 1A gezeigt, ist die Solubilisierung hGAD65mut hergestellt bei beiden Temperaturen, wiederum erfordert Harnstoff (Spuren S2). So müssen niedrigen Temperaturen in diesem Experiment nicht verhindern hGAD65mut Bildung von unlöslichen Aggregaten.
Baculovirus-Vektoren, die die hGAD65mut Sequenz (Baculo.G65mut) wurde in adhärente Sf9-Zellkulturen exprimiert. V1 und V2 mit hohem Titer Aktien wurden hergestellt, und die leistungsfähigsten Infektionsbedingungen wurden die Bewertung verschiedener Virus Lagerbestand 5-50 ul eingestellt. Wie in 1B gezeigt, wurde die optimale Virusstammvolumen von 25 ul identifiziert, wodurch man 11,8 ± 0,8 ug rekombinantes Protein pro ml Kulturmedium, wie durch RIA untersuchtAnalyse (Tabelle 1).
Nach Infiltration, Zeitverlaufsanalyse von agroinfected N. benthamiana Blättern wurde in den beiden transienten Expressionssystemen durchgeführt. Für die pK7WG2 basierte System wurden Blattproben täglich im Bereich von 1-5 dpi gepoolt wurden gesamten löslichen Proteine (TSP) extrahiert und gleiche Mengen von TSP wurden durch Western-Blot (Figur 1C) analysiert. Diese Analyse hervorgehoben, dass die maximale Anreicherung von Ziel rekombinanten Proteins erreicht 2 DPI. Daher wurden die Blätter 2 dpi geerntet und die Proteinextrakte wurden durch RIA zur Messung von rekombinanten Proteinakkumulation, die einen Durchschnitt von 67,8 g / g FLW (Frischgewicht Blatt, Tabelle 1) zeigt, analysiert. Rekombinantes Protein Expressionsniveaus, mit diesem System kann weiter verbessert werden, durch Co-Infiltration der Blätter mit einem Suppressor posttranskriptioneller Gene Silencing (PTGS) wie P19 oder HC Pro 12.
DieGleichzeitig Gängen Nachweis erfolgte mit N. geführt benthamiana Blätter mit den magnICON Vektoren agroinfected: infizierte Blätter 1-8 dpi und gleiche Mengen von TSP wurden durch Western-Blot analysiert gesammelt. Diese Untersuchung zeigte, dass eine maximale rekombinanten Proteinakkumulation erhält 4 dpi (1D), mit einer mittleren Anreicherung des rekombinanten Proteins von 78,8 & mgr; g / g FLW (Tabelle 1), wie durch RIA untersucht.
Die Expression hGAD65mut in transgenen Tabakpflanzen wurde bereits berichtet 12 ist, zeigt, dass rekombinantes Protein-Spiegel signifikant unter unabhängig transformierten Linien variiert. Die leistungsfähigsten hGAD65mut T1 transgenen Pflanze war selbst gekreuzt und die daraus abgeleiteten Pflanzen (T2) wurden analysiert, um zu wählen wieder das beste Ergebnis erzielt man. Dieses Verfahren wurde über mehrere Generationen hinweg wiederholt werden, um eine homogene Produktionsplattform zu entwickeln, die Überprüfung der Leistung in jeder Generation von RIA, bis keineweitere Verbesserung erzielt (Daten nicht gezeigt). In Figur 1E ist eine repräsentative Western-Blot von T5 transgenen Pflanzen berichtet, in denen die Homogenität des rekombinanten Proteinausbeuten ist offensichtlich. Wie in 1F gezeigt ist, erhöht die durchschnittliche hGAD65mut Ausbeute von T2 bis T6 und erreichte Niveau von 99,1 & mgr; g / g FLW (Tabelle 1), und bei der Auswahl der Standardabweichung des Expressionsniveau gesunken.
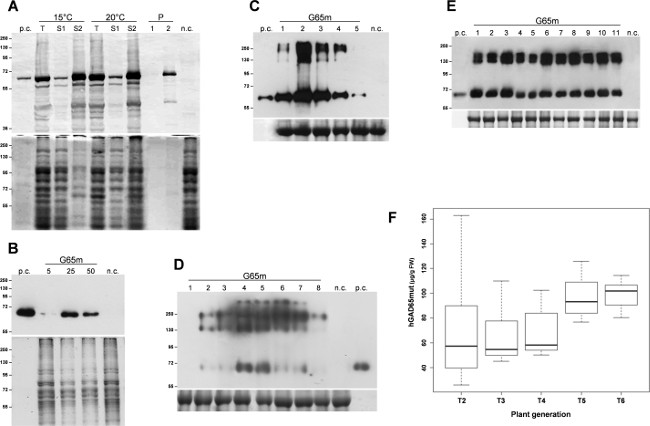
Abb. 1: Platform-Setup Einrichten der besten Bedingungen für hGAD65mut Ausdruck in jeder Plattform. (A) E. coli induzierbare Expression Plattform. Bakterienzellen wurden bei 15 ° C oder 20 ° C. Oberplatte, Western-Blot von hGAD65mut in Zellextrakten (2 ug TSP pro Spur). Das untere Feld angebaut, Ladesteuerung mit Coomassie gefärbt. n.c. = Negativkontrolle, Bakterienzellen mit dem Vektor pDEST17 die Chloramphenicol-Resistenz-Gen enthält, transformiert sind; T insgesamt Proben; S1: Der Überstand nach der Beschallung und Zentrifugation; S2 und P: Der Überstand (1) und Pellet (2) nach dem Zentrifugieren der Probe in harnstoffhaltigen Puffer solubilisiert. (B), Baculovirus / Insektenzellen-Plattform. Folgende Virus Lagerbestand wurden getestet: 5, 25 und 50 & mgr; Oberplatte, Western-Blot von hGAD65mut in Zellextrakten (5 ug TSP pro Spur) Untere Tafel, Ladesteuerung mit Coomassie gefärbt... nc = Negativkontrolle, Extrakt aus nicht-transformierten Insektenzellen. (C) Eine vorübergehende Expression in N. benthamiana Pflanzen mit dem pK7WG2 Vektor. Die Proben wurden täglich gesammelt, 1-5 dpi (Spuren 1-5). Oberes Feld, Western-Blot von hGAD65mut in Blattextrakten (2,5 ug TSP pro Spur). Unteres Feld, Ladekontrolle mit Coomassie, wo die große Untereinheit gebeiztvon Rubisco ist offensichtlich. nc = Negativkontrolle, Pflanzen, die mit dem pK7WG2 Vektor, der das GFP-Markergen infiltriert. (D) Eine vorübergehende Expression in N. benthamiana Pflanzen mit magnICON Vektoren. Die Proben wurden täglich gesammelt, 1-8 dpi (Spuren 1-8). Oberes Feld, Western-Blot von hGAD65mut in Blattextrakten (5 ug TSP pro Spur). Unteres Feld, Ladesteuerung mit Coomassie gefärbt, wo die große Untereinheit von Rubisco ist offensichtlich, . nc = Negativkontrolle, Pflanzen nur mit pICH20111 5'-Modul und pICH14011 Integrase-Modul infiltriert. Die Zahlen geben molekulare Marker in kDa. pc = positive Kontrolle 15 ng der kommerziellen hGAD65 im Baculovirus / Insektenzellen-System produziert. (E) Eine stabile Expression in N. tabacum Pflanzen. Blattproben wurden von verschiedenen Pflanzen T5 (Spuren 1-11) gesammelt. Oberes Feld, Western-Blot von hGAD65mut in Blattextrakten (5 ug TSP pro Spur). Das untere Feld, Ladekontrolle befleckt with Coomassie. nc = Negativkontrolle, Wildtyp-Pflanzen. Die Zahlen geben molekulare Marker in kDa. pc = positive Kontrolle 15 ng der kommerziellen hGAD65 im Baculovirus / Insektenzellen-System produziert. (F) Stabile Expression in N. tabacum Pflanzen. Boxplot Darstellung hGAD65mut Akkumulation über mehrere Generationen abgeleitet besten Performance hGAD65mut T1 transgenen Tabakpflanze ab RIA Daten berechnet g / g FLW gemeldet. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
| System | [HGAD65mut] (& mgr; g / ml) | [HGAD65mut] |
| Baculo / Insekten | 117,5 ± 7,7 | 11,8 ± 0,8 ug / ml Kulturmedium |
| Transient | 22,6 ± 0,9 | 67,8 ± 2,7 pg / g FLW |
| MagnICON | 26,3 ± 5,9 | 78,8 ± 17,8 pg / g FLW |
| Elite T6 | 33,0 ± 3,8 | 99,1 ± 11,3 pg / g FLW |
Tabelle 1: hGAD65mut ergibt hGAD65mut Renditen in verschiedenen Plattformen - Fermenter-basierte (Baculo / Insekt) und pflanzlichen (pK7WG2- und magnICON in N. benthamiana und Elite-T6 in N. tabacum). Zweite Spalte - hGAD65mut Konzentration in Proteinextrakten (ug / ml). Dritte Säule - hGAD65mut Gehalt in frischem Blattgewicht (g / g FLW) für pflanzliche Plattformen und in Zellkulturmedium (ug / ml) für Fermenter-basierten Plattform.
Diskussion
Bakterienzellen, Baculovirus / Insektenzellen und Pflanzen: In dieser Studie wurden drei verschiedene Plattformen für die Expression eines rekombinanten humanen Proteins verglichen. (- MagnICON und pK7WG2 basiert - und stabile dh transient) Die Anlage-basierte Plattform wurde durch die Nutzung von drei weit verbreitete Ausdruck Technologien erforscht. Der für dieses Experiment, hGAD65mut, ausgewählten Zielproteins wurde zuvor in verschiedenen Systemen 13 zum Ausdruck gebracht, und seine Herstellung und Funktionalität sind leicht nachweisbar und messbar 14.
Bakterienzellen wurden keine effektive Produktionsplattform weil hGAD65mut gebildeten Einschlusskörper auch bei niedrigen Temperaturwachstumsbedingungen, was somit mühsam Solubilisierung und Rückfaltung in seine native Konformation zu erreichen. Tatsächlich ist die Haupt Versagen dieser Plattform zur Vermittlung komplexer rekombinanter Proteine die richtige Konformation des Endprodukts.
DieBaculovirus / Insektenzellen-Plattform vermittelt eine hohe Expression des immunreaktiven rekombinanten Proteins, aber die wichtigste Einschränkung dieses Expressionssystems sind die hohen Kosten der Kulturmedien erforderlich sind, um Insektenzellen zu wachsen. Es wurde geschätzt, dass die Gesamtproduktionskosten für 1 g hGAD65mut könnten € 700 in dieser Produktionsplattform zu erreichen (unter Berücksichtigung 9 L von Insektenzellkulturmedien erforderlich). Eine weitere Einschränkung dieses Ausdrucks Plattform ist die Notwendigkeit von sterilen Anbau von Insektenzellen, die Personal mit aseptischen Manipulation Fähigkeiten erfordert. Die verwendet werden, um Zellen zu infizieren virales Stockvolumen und den Zeitpunkt der Virusinfektion: Um eine rekombinante Proteinakkumulation zwei kritische Parameter müssen sorgfältig in diesem Expressionssystem gesteuert werden, zu gewährleisten. Weiterhin können die Reinigungsmittel für das gesamte lösliche Protein Extraktion aus Sf9-Insektenzellen verwendet werden, drastisch beeinflusst rekombinanten Proteins Solubilisierung.
Pflanzliche Systeme waren die meisten Vorteile platform hGAD65mut auszudrücken: die Anlage werden auch rekombinante Protein war immunreaktiv und in hohen Konzentrationen in das Blattgewebe akkumuliert. Vergleich verschiedener pflanzlicher Expressionssysteme wurden die höchsten Ausbeuten in stabilen transformierten Tabakpflanzen (Tabelle 1) und erreicht, wenn unter Berücksichtigung der gesamten Biomasse von Tabak gegenüber N. benthamiana, für vorübergehende Expression verwendet, ist die Gesamt höhere Produktivität der Tabak evident. Ist die Haupteinschränkung stabil transformierten Tabakpflanzen-basierte Plattform jedoch die Zeit für den Aufbau des Systems, die in unserer Studie wurde 20 Monate benötigt. Tatsächlich sollte eine homozygote Linie für die rekombinante Proteinexpression Homogenität ausgewählt werden, und es kann wiederholt erfordern selbstvernetzenden Zyklen, beginnend mit der höchsten T1 exprimierenden Linien. Insbesondere, wenn der ausgewählte T1 trägt mehr als eine Kopie der transgenen Merkmale kann das Zuchtprogramm von bis zu 3 Jahren.
Vorübergehende Expressionssysteme bot dieVorteil einer schnellen Upscaling durch Kurzintervall zwischen Transformation und Expression und den Aufbau des Expressionsplattform benötigt 4 Tage. Allerdings ist eine Beschränkung der pflanzliche transiente Systeme, dass deren Automatisierung kaum umsetzbar auf einem Labormaßstab sei denn gewidmet hochwertigen Anlagen für Agroinfiltration verwendet. Daher kann eine korrekte Berechnung für die großtechnische Produktion von hGAD65 Verwendung transient-basierte Systeme hier nicht durchgeführt werden. Auf der anderen Seite, kann spekuliert werden, dass die gesamten Herstellungskosten für 1 g an rekombinantem Protein mit T6 stabiler Tabaklinie kann bei weniger als Euro 5 berechnet werden (unter Berücksichtigung der Boden für den Anbau von 60 Tabakpflanzen). Um die effiziente Agroinfiltration und der Proteinherstellung mehrere kritische Parameter sollten sorgfältig kontrolliert werden, zu gewährleisten (Pflanzenentwicklungsstadium, zu wachsen und Infiltration Zustand Agrobacterium), wie bereits berichtet 15. Außerdem für jeden Ausdruck experimentieren eine bestimmte Zeitverlaufsanalyse solltedurchgeführt, um die dpi, die die höchste Akkumulation des rekombinanten Proteins ermöglicht auszuwählen.
Die hier diskutierten Beispiel kann als ein Proof-of-Prinzip Fallstudie, dass einige der spezifischen Vorteile der pflanzlichen Produktion gegenüber herkömmlichen Systemen beleuchtet werden. Insbesondere kann Tabak transgenen Linien homogen das rekombinante Protein exprimieren als wertvolle Plattform für die Massenproduktion von rekombinanten Proteinen, die in großen-Mengen benötigt werden.
Offenlegungen
The authors declare that there is no conflict of interests regarding the publication of this paper.
Danksagungen
This work was supported by the COST action ‘Molecular pharming: Plants as a production platform for high-value proteins’ FA0804. The Authors thank Dr Anatoli Giritch and Prof. Yuri Gleba for providing the MagnICON vectors for research purposes.
Materialien
| Name | Company | Catalog Number | Comments |
| Yeast extract | Sigma | Y1333 | |
| Tryptone | Formedium | TRP03 | |
| Agar Bacteriological Grade | Applichem | A0949 | |
| Sf-900 II SFM medium | Gibco | 10902-088 | |
| Grace’s Insect Medium, unsupplemented | Gibco | 11595-030 | |
| Cellfectin II Reagent | Invitrogen | 10362-100 | |
| MS medium including vitamins | Duchefa Biochemie | M0222 | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Plant agar | Duchefa Biochemie | P1001 | |
| Ampicillin sodium | Duchefa Biochemie | A0104 | Toxic |
| Gentamycin sulphate | Duchefa Biochemie | G0124 | Toxic |
| Ganciclovir | Invitrogen | I2562-023 | |
| Carbenicillin disodium | Duchefa Biochemie | C0109 | Toxic |
| Kanamycin sulfate | Sigma | K4000 | Toxic |
| Rifampicin | Duchefa Biochemie | R0146 | Toxic – 25 mg/ml stock in DMSO |
| Streptomycin sulfate | Duchefa Biochemie | S0148 | Toxic |
| Spectinomycin dihydrochloride | Duchefa Biochemie | S0188 | |
| IPTG (isopropil-β-D-1-tiogalattopiranoside) | Sigma | I5502 | Toxic |
| MES hydrate | Sigma | M8250 | |
| MgCl2 | Biochemical | 436994U | |
| Acetosyringone | Sigma | D134406 | Toxic – 0.1 M stock in DMSO |
| Syringe (1 ml) | Terumo | ||
| MgSO4 | Fluka | 63136 | |
| BAP (6-Benzylaminopurine) | Sigma | B3408 | Toxic |
| NAA (Naphtalene acetic acid) | Duchefa Biochemie | N0903 | Irritant |
| Cefotaxime | Mylan Generics | ||
| Trizma base | Sigma | T1503 | Adjust pH with 1 N HCl to make Tris-HCl buffer |
| HCl | Sigma | H1758 | Corrosive |
| NaCl | Sigma | S3014 | 1 M stock |
| KCl | Sigma | P9541 | |
| Na2HPO4 | Sigma | S7907 | |
| KH2PO4 | Sigma | P9791 | |
| PMSF (Phenylmethanesulfonylfluoride) | Sigma | P7626 | Corrosive, toxic |
| Urea | Sigma | U5378 | |
| β-mercaptoethanol | Sigma | M3148 | Toxic |
| Tween-20 | Sigma | P5927 | |
| Hepes | Sigma | H3375 | |
| DTT (Dithiothreitol) | Sigma | D0632 | Toxic – 1 M stock, store at -20 °C |
| CHAPS | Duchefa Biochemie | C1374 | Toxic |
| Plant protease inhibitor cocktail | Sigma | P9599 | Do not freeze/thaw too many times |
| SDS (Sodium dodecyl sulphate) | Sigma | L3771 | Flammable, toxic, corrosive – 10% stock |
| Glycerol | Sigma | G5516 | |
| Brilliant Blue R-250 | Sigma | B7920 | |
| Isopropanol | Sigma | 24137 | Flammable |
| Acetic acid | Sigma | 27221 | Corrosive |
| Anti-Glutamic acid decarboxylase 65/67 | Sigma | G5163 | Do not freeze/thaw too many times |
| Horseradish peroxidase (HRP)-conjugate anti-rabbit antibody | Sigma | A6154 | Do not freeze/thaw too many times |
| Sf9 Cells | Life Technologies | 11496 | |
| BL21 Competent E. coli | New England Biolabs | C2530H | |
| Protein A Sepharose | Sigma | P2545 | |
| Cell culture plates | Sigma | CLS3516 | |
| Radio Immuno Assay kit | Techno Genetics | 12650805 | Radioactive material |
Referenzen
- Hampe, C. S., Hammerle, L. P., Falorni, A., Robertson, J., Lernmark, A. Site-directed mutagenesis of K396R of the 65 kDa glutamic acid decarboxylase active site obliterates enzyme activity but not antibody binding. FEBS Lett. 488 (3), 185-189 (2001).
- Avesani, L., et al. Recombinant human GAD65 accumulates to high levels in transgenic tobacco plants when expressed as an enzymatically inactive mutant. Plant Biotechnol. J. 9 (8), 862-872 (2010).
- Sambrook, J., et al. Molecular Cloning: A laboratory manual. Second Edition. , Cold Spring Harbor Laboratory Press. New York. (1989).
- Avesani, L., et al. Comparative analysis of different biofactories for the production of a major diabetes autoantigen. Transgenic Res. 23, 281-291 (2014).
- Marillonnet, S., Giritch, A., Gils, M., Kandzia, R., Klimyuk, V., Gleba, Y. In planta engineering of viral RNA replicons: efficient assembly by recombination of DNA modules delivered by Agrobacterium. Proc. Natl. Acad. Sci. (USA). 101 (18), 6852-6857 (2004).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants). Curr. Opin. Biotechnol. 18, 134-141 (2007).
- Engler, C., Kandzia, R., Marillonnet, S. A one pot, one step, precision cloning method with high throughput capability. PLoS One. 3 (11), (2008).
- Xu, R., Li, Q. Q. Protocol: streamline cloning of genes into binary vectors in Agrobacterium via the Gateway TOPO vector system. Plant Methods. 4 (4), 1-7 (2008).
- Fairbanks, G., Steck, T. L., Wallach, D. F. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606-2617 (1971).
- Falorni, A., et al. Radioimmunoassay detects the frequent occurrence of autoantibodies to the Mr 65,000 isoform of glutamic acid decarboxylase in Japanese insulin-dependent diabetes. Autoimmunity. 19, 113-125 (1994).
- Hunt, I. From gene to protein: a review of new and enabling technologies for multi-parallel protein expression. Protein Expr. Purif. 40 (1), 1-22 (2005).
- Arzola, L., et al. Transient co-expression of post-transcriptional silencing suppressor for increased in planta expression of a recombinant anthrax receptor fusion protein. Int. J. Mol. Sci. 12 (8), 4975-4990 (2011).
- Merlin, M., Gecchele, E., Capaldi, S., Pezzotti, M., Avesani, L. Comparative evaluation of recombinant protein production in different biofactories: the green perspective. Biomed. Res. Int. 2014, 136419(2014).
- Avesani, L., et al. Improved in planta expression of the human islet autoantigen glutamic acid decarboxylase (GAD65). Transgenic Res. 12 (2), 203-212 (2003).
- Leuzinger, K., et al. Efficient agroinfiltration of Plants for high-level transient expression of recombinant proteins. J Vis Exp. (77), (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten