Method Article
Mikroglia ve nöronlar için örnek Boyama: Cryosectioned Rat Beyin Dokusu Üzerine İmmünohistokimya için Astar
Bu Makalede
Özet
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Özet
İmmünohistokimya yerinde antijenlerin varlığı, konumu ve göreceli bolluk tespiti için yaygın olarak kullanılan bir tekniktir. Bu giriş seviyesi protokol mikroglia ve bir örnek olarak nöronal elemanlar için işaretlerini kullanarak, reaktifler, ekipman, ve kemirgen beyin dokusunun immünohistokimyasal boyama tamamlamak için gerekli teknikler anlatılmaktadır. Özellikle, bu kağıt sırasıyla Iba1 ve Pan-nöronal için immünohistokimya yoluyla mikroglia ve nöronların floresan görselleştirme için bir adım-adım protokoldür. Floresans çift etiketleme doğru hücre tipleri, reseptörler, ligand arasındaki etkileşimi gözlemlemek için bir fırsat sağlamaktadır, aynı numune içinde birden fazla protein lokalizasyonu için özellikle yararlı olduğu ve / veya bir başka yanı sıra protein ko- göre hücre dışı matris Tek bir hücrenin içinde yerelleştirme. Diğer görselleştirme teknikleri aksine, floresan immünohistokimyası boyama yoğunluğu azalabilirUygun önlemler alınmazsa, lekelenmeye önümüzdeki aylarda hafta. Floresan kez daha etkilidir ve iki ya da daha fazlası arasında daha kesin bir ayrım yapmaya imkan tanımaktadır Bu sınırlama rağmen, pek çok uygulamada floresans çift etiketleme, örneğin 3,3'-diaminobenzidin tetrahidroklorid (DAB) veya alkalin fosfataz (AP) gibi alternatifler tercih edilir belirteçler. Tartışma sorun giderme ipuçları ve başarıyı teşvik etmek için tavsiyeler içerir.
Giriş
İmmünohistokimya ilgi antijenlere spesifik olarak bağlanan primer antikorlar kullanılarak, doku kesitlerinde antijenleri (örneğin, proteinler) tespit edilmesi için bir işlemdir. O antikorlar Büyük özgüllük 1 antijenleri lokalize olabilir tespit zaman İmmünohistokimya 1934 yılında JR Marrack öncülük ettiler. 1942 yılında başlayarak, immunohistokimyasal görselleştirmek için floresan antikorlar kullanılarak çalışmalar in vitro ilk bazı in vivo histokimyasal çalışmada ilk 4 basıldı sonra 2,3, yayınlandı. 1960 'li yıllarda, üç yıl immünohistokimyasal yöntemleri süre sonra, bir enzim-konjüge edilmiş antikor, ikincil reaktifler olarak kullanılmaya başlanmıştır. Bu yöntemler aynı anda ve birbirinden bağımsız Fransa ve ABD'de 5,6 geliştirilmiştir. Bugün, antikorların geniş bir dizi immunohistokimya çalışmaları 7 için sonsuz olanaklar sağlar.
"> Bu yazışmaların genel amacı immünohistokimyasal içine kısa bir tanıtım sağlamak, bu tekniğin kapsamlı ve ayrıntılı bir yorum olması anlamına gelmez özetlenen yöntemde, iki antijen için immünohistokimyasal teknikler mikroglia için (işaretçileri sunulmuş ve. perfüze paraformaldehit boyama nöronlar), sukroz cryoprotected cryosectioned sıçan beyni. immünohistokimyasal boyama, arka plan boyama azaltmak için spesifik olmayan antijen bloke ile başlar. Daha sonra, birincil antikor ile inkübasyon dokusunda özel bir antijene bağlanma sağlar. birincil antikor izlenerek, başka bir antikor, ikincil antikor olarak adlandırılan, bir konjüge görselleştirme sinyali 8 birincil antikor bağlantı uygulanır. ikincil antikor birincil antikora yükseltilmiş olan türlere özgü immünoglobulin G (IgG) alanı hedef alır. sekonder antikor sinyali güçlendirir Primer antikor t Fab bölgelerinde beriPrimer antikor IgG etki alanında birden fazla site için elinden ikincil antikor bağlama. Her iki durumda da, ikincil antikorun Fc bölgelerine konjüge enzimler ya da floresan moleküller görselleştirme sağlar. Örneğin, bir tavşan anti-Iba1 birincil antikor Iba1 için spesifik bir tavşan IgG molekülüdür. Eşek anti-tavşan IgG ikincil antikor olarak tatbik edildiği zaman, bu tanıma ve tavşan anti-Iba1 IgG birden fazla bölgeye (bakınız Şekil 1) bağlanacaktır. eşek antikor çeşitli yöntemlerle görülebilir. Bu yazışmalar floresan mikroskobu ile görselleştirme, primer antikor tanıyan sekonder antikor, konjuge bir floroforun tespiti üzerinde duruluyor. Floresan immünohistokimya, bu tür ajanlar Hoechst veya DAPI gibi bir nükleer boya bütün çekirdeklerinde görselleştirmek için kullanılabilmektedir.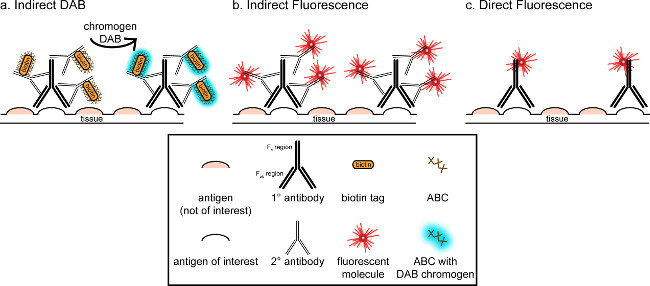
Şekil 1: SchDoğrudan ve dolaylı antikor etiketleme tekniklerinin ematic temsili. Antikorlar, ilgi alanındaki antijene bağlanan ve birincil antikor türleri karşı artan sekonder antikor ile amplifiye edilebilir. Bu teknik, görselleştirme (A) için amplifikasyon ve DAB için avidin-biyotin kompleksi (ABC) kullanılarak gerçekleştirilmiştir, ya da doğrudan konjüge edilmiş floresan ikincil antikor (B). Alternatif olarak, birincil antikorlar doğrudan biyotin veya bir fluorofor (C) dahil olmak üzere birçok farklı etiketler, konjuge edilebilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
(DAB; Şekiller 1 ve 2), immünohistokimyasal görselleştirilmesi için alternatif bir yöntem, 3,3'-diaminobenzidin tetrahidroklorür kullanır. Bu, bir biyotinile kullanılarak fluoresans farklıdır veyaparlak alan mikroskopisi altında algılanabilen bir çökelti DAB dönüştürmek için bir enzim içerir bayırturpu peroksidaz (HRP) konjüge edilmiş ikincil bir antikor. Tek bir antijen ilgi ya da boyama uzun ömürlü olması için gerekli olan durumlarda, DAB floresan boyama daha uygun olabilir. Bununla birlikte, DAB boyama iki nükleer antijen ilgi, özellikle, birden fazla belirteçleri arasında farklılaşması için çok uygundur değildir. DAB malzemeleri ve protokol değişiklikler hakkında bilgi için, Tablo 1 bakınız. Alternatif olarak, nitro mavi tetrazolyum klorür / 5-bromo-4-kloro-3-indolil fosfat (NBT / BCIP) orta konjüge bir alkalin fosfataz (AP) görselleştirmek için kullanılabilmektedir antikordur.

Şekil 2:. Nikel geliştirilmiş DAB tek etiketli sıçan beyin dokusu kesitlerinin Temsilcisi görüntüleri Sıçan beyin seTek başına mikroglia veya nöronların uzun süren analiz için Iba1 (A) ve Pan-nöronal (B) için nikel geliştirilmiş DAB ile etiketlenmiş olan seksiyonlar. Ölçek çubuğu 20 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Bir doku içinde ilgi antijenin tahmini bolluğu analiz ediliyor düşünmek gerekir. Dolaylı yöntemler (yukarıda anlatıldığı gibi) düşük yoğunlukta olan hedefler için yararlıdır. Ilgi, antijen yüksek bolluk olduğunda, direkt yöntemler uygulanabilir. Doğrudan yöntemler doğrudan görselleştirme sinyaline konjuge edilmiş bir birincil antikor içerir ve dolayısıyla ikincil antikor gereklidir. Bu yöntem boyama işlemini kolaylaştırır, ancak dolaylı yöntemlerle elde amplifikasyon ortadan kaldırır. Bir doğrudan konjüge edilmiş birincil antikor kullanarak da sekonder antikorların çapraz reaktivite ortadan kaldırırne zaman çift etiketleme.
Bu iletişim Iba1 ve Pan-nöronal (Tablo 1 ayrıntıları) ile çift etiketleme için protokol göstermektedir. Iba1 dallanmış, hiper-dallanmış, aktif, amoeboid ve çubuk dahil olmak üzere birçok aktivasyon devletler içinde mikroglia lekeler. Pan-nöronal lekeler nöronal akson, dendrit ve soma. Iba1 çoğu mikroglia ve Pan-nöronal olası hedefler nöron leke yana, lekeleri bu kombinasyon mikroglia-nöron etkileşimleri geniş bir anlayış kazanıyor yararlıdır.
Özetle, immünohistokimyasal antikorların dikkatli seçimi dayanmaktadır. Araştırma sorusu daha spesifik hale geldikçe, diğer antijenlere karşı üretilen antikorlar arzu edilebilir. Belirli bir mikrogliyal aktivasyon durumunu hedeflemek için, bir yerine Iba1 daha CD45 veya CD68 antikorları kullanmayı tercih edebilir. Dahası, fareler ile çalışma, F4 / 80 gerekli sonuçlar verebilir. Benzer şekilde, nöronal elemanlar özellikle antikorlar ra ile hedeflenebilirçekirdeğin karşı kili, sinaps (öncesi veya sonrası), akson ve büyüme konisinin. Ayrıca, nöron (Çift cortin, Neun) yaşını ayırt diğer belirteçler ve nöronal rejenerasyon (GAP-43) vardır.
Protokol
NOT: Tüm işlemler Arizona Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) uygun olarak yürütülmüştür. Tavsiye malzeme ve ekipman listesi Tablo 1'de bulunabilir.
1. Doku Hazırlanması
- Serpilme
- Sodyum pentobarbital (25 mg / kg, ip) bir fazla dozu ile kemirgen Euthanize ve 8 ml / dk'lık bir akış hızında tam kandan arındırıldı (3-5 dakika kadar) fosfat tamponlu tuzlu su (PBS) ile transkardiyal serpmek. Derinlemesine perfüzyon talimatlar için Gage ve ark 2012 9 bkz.
- Hemen / dak, 8 ml bir akış hızında 15-20 dakika boyunca PBS içinde% 4 paraformaldehit ile perfüze doku çözmek PBS gömme et.
- 4 ° C 'de, (tris tamponlu salin içinde hazırlanan sırayla% 15,% 30,% 30) kademeli sakaroz çözeltileri, ardından 24 saat için% 4 paraformaldehid beyin ve yer çıkarın. Sonraki sakaroz çözüm o beyin aktarınnly beynin sonra her çözeltide batırdı. Not: Genellikle, her çözümün 5 gün doku batmaya için yeterli bir süredir.
- Doku Dondurma ve Cryosectioning
- Örneğin Ekim bileşiği olarak, gömme orta beyin yerleştirin ve -35 ° C arasında bir sıcaklıkta, izopentan içinde daldırın. Beyin, 10 dakika içinde en az dondurma, ve daha sonra -80 ° C'de saklayın izin verin. Sıcaklık titizlik alınmadığı takdirde sorunlar ortaya çıkabilir; sorun giderme bilgileri için tartışma bakınız.
- 20 um kadar bir kalınlıkta ve -20 ° C arasında bir sıcaklıkta bir seri koronal kesitler halinde kesilmiştir. Pozitif yüklü slaytlar üzerine doku toplayın. Beyin kesitleri, -80 ° C'de, bir fermuar-top çantası ve depolanmış uzun vadede folyo ile sarılmış bir slayt kutuya yerleştirilmiş olabilir. Depolama Bu yöntem hava ve dona maruz kalmasını önlemek için bir çift sınır oluşturur.
2. Doku İşleme
NOT: Örnek ekipman ve materyaller rboyama için equired Şekil 3'te gösterilmiştir. Alternatifleri mevcut, ancak bu görüntülerin immünohistokimyasal yeni başlayanlar ön alım için uygun öğeleri görselleştirmek için yardımcı olacaktır.

Şekil 3: Örnek öğeler immünohistokimyasal için gerekli (A) gösterilen siyah kutu immünofloresan için ideal bir nem odası olan, slaytlar folyo kutuyu sarmak için gerek kalmadan ışıktan korunmalıdır gibidir.. Kesit sonrasında slaytlar, örneğin (B) 'de gösterildiği san bir kutu gibi bir kutu içinde depolanabilir. Folyo sıkıca kutuyu tamamlayan ve önceki dondurucu bir zip-top çantası yerleştirerek dondurucu yanık doku örnekleri korunmasına yardımcı olur. Slaytlar bir örneği D (çeşitli boyama (D) 'de gösterilen yemekler ile (C)' de verilmektedir ). Lameller ancak 1.2 kalınlığında lamelleri en dik ve konfokal mikroskoplar güzel görüntüleme sonuçlarını sağlamak, büyüklük ve kalınlıkta (F) değişebilir. Örneğin (G) 'de gösterildiği gibi bir kalem slaytlar etiketlemek için kullanılabilir. Mürekkep çalıştırabilirsiniz gibi kalıcı belirteçler boyama ve örnek ne olduğunu belirlemek için yeteneği hem etkileyen, kaçınılmalıdır. (H) 'de gösterildiği gibi bir Mini PAP kalemi bir itici sınır slaytlar üzerine çekilmesini mümkün kılar.
- Slayt hazırlama
- Oda sıcaklığında dondurucu ve çözülme slaytları çıkarın.
- İsteğe bağlı: bölümler, daha önce slaytlar süzülüyor varsa, slaytlar rahatsız yüzen doku kesitleri önlemeye yardımcı olmak için en fazla 4 saat süre ile 60 ° C'de bir fırın içinde çözülmüş slaytlar yerleştirin.
- Bir slayt raf ve ilgili tabak yerleştirin kayar.
- Yıkama yıkamalar arasında çözelti, değişen her biri 5 dakika süreyle PBS içinde üç kez kayar. Ileriye Bu adımdan itibaren, secti önlemekons uzun bir süre için sıvı olmadan. Not: bölümler kurumasına, arka plan boyama artar ve anlamlı veriler güvenilir elde edilemez.
- Oda sıcaklığında dondurucu ve çözülme slaytları çıkarın.
- Doku Boyama
- Bir ışık geçirmez boyama kutusunda, iyonu giderilmiş su ile ıslatılmış tüysüz bir doku ile bir "nem odası" oluşturur.
- Uzak doku kesitlerinden, slayt çok kenarında bir sıvı itici sınır yapmak için mini bir pap kalem kullanın, tüysüz bir doku ile slayt kenarlarını kurutun. Bu sınır sıvı menisküs ve yüzey gerilimi boyama etkilemez, böylece doku kenarı arasında geniş bir alan temin etmelidir.
Not: ilgi antikorlar mikrodalga antijen alımı gerektirmeyen, PAP kalem kovucu sınır önce 2.1.3 uygulanabilir. PAP kalem PBS içinde yıkama öncesi uygulanmış ise, sıvı itici sınır bütünlüğü bu aşamada kontrol edilmelidir. Sınırda herhangi boşlukları doldurmak için bir mini-pap kalem kullanın. , blok nonspesifik antijen PBS (blok çözeltisi) içinde% 4 h / h serumu içinde inkübe edilerek bağlama. Pipet oda sıcaklığında 1 saat için slayt başına blok çözeltisi 300 ul. Emin blok çözüm slayt kenarında pap kalem uzanır ve tamamen dokuya yakın yüzey gerilimi nedeniyle düzensiz boyama önlemek için doku kapsar emin olun. - İkincil antikor yapıldığı aynı türden serum kullanın. Not: Bu prosedürde, ikincil antikorlar eşek yapılır, ve bu nedenle eşek serumu kullanılmıştır. İki veya daha fazla farklı türlerden ikincil antikorlar kullanıldığında, her türden serum içerir.
- Slaytlarınıza Pipet primer antikor. Not: Bu boyama için antikor konsantrasyonları 1'den optimize edilmiştir: 5,000 ve 1: sırasıyla Iba1 ve Pan-nöronal 500. Bu konsantrasyonlar, bir arka plan boyama yokluğu ile anlamlı bir lekeleme göstermek için tespit edilmiştir.
- Blok çözümü sulandırmak% 1 PBS içinde serum ve primer antikor ilave edin. Slayt başına% 1 serum içinde primer antikor çözeltisi 300 ul Pipet. Yine, sıvı pap kalem kenarına olduğundan emin olun. 4 ° C 'de bir gece boyunca inkübe edin.
- Iba1 ne Pan-nöronal ne antikorları içeren bir Pan-nöronal antikor olmadan Iba1 ile bir ve Iba1 olmadan Pan-nöronal antikor: biri üç kontrol slaytlar ekleyin. Bununla birlikte, ikincil antikor, spesifik olmayan bağlanmanın test etmek için, birincil antikor ihmal aynı çözeltiler için de aynı vadede bu slaytlar Leke.
- Ertesi sabah, yıkama yıkamalar arasında solüsyonu değişen her biri 5 dakika süreyle PBS içinde üç kez kayar.
- Floresan antikorlar ileri bu adımı, siyah veya karanlıkta inkübe ya olan yıkama kapları folyo ve melezleme kutularında sarılır sağlayarak ışık maruziyeti en aza indirmek, bu nedenle, ışığa duyarlı bulunmaktadır. Tüm slaytlarda uygun ikincil antikorlar pipet ve inkübe1 bir konsantrasyonda, oda sıcaklığında 60 dakika: blok çözeltisi içinde 250, bir ışık geçirmez "nem odası" (aşama 2.2.3) (adım 2.2.1).
- Farklı dalga boyları ikincil antikorlar kullanın. Burada, birincil antikor tavşan anti-Iba1 için uygun ikincil antikor olarak eşek anti tavşan 594 kullanın. Birincil antikor fare anti-pan-nöronal için, ilgili ikinci antikor olarak eşek anti-fare 488 kullanır. Alternatif olarak, anti-tavşan 488 ve anti-fare 594 kullanır.
- Yıkama her biri 5 dakika süreyle PBS içinde üç kez kayar.
- İsteğe bağlı: Nükleer boyama gerçekleştirin.
- Tam olarak 60 saniye boyunca iki kez damıtılmış H 2 0 içinde 0.03 ug / ml 'lik bir konsantrasyonda, Hoechst (ya da diğer nükleer leke)' de yer.
- Yıkama her biri 5 dakika süreyle PBS içinde üç kez kayar.
- GKD 2 0 yıkayın.
- Coverslipping
- Böyle Fluor gibi sulu montaj orta ile lamel slaytlar,omount-G ya da ProlongGold. Bir pamuk uçlu aplikatör kullanarak tüm kabarcıklarını çıkarmak için özen gösterin.
Not: Diğer montaj ajanlar kullanılabilir, ancak yüksek sızdırma-yoluyla boyalar arasındaki coverslipping gün içinde bazıları tarafından not edilmiştir. - , Kenarları mühür açık oje kullanın buharlaşma nedeniyle kurumasını engelleyen bölümleri. Slaytlar düz ve oda sıcaklığında devam ederken tırnak cilası bir ışık geçirmez bir kap içinde kurumasını bekleyin ve daha sonra 4 ° C'de folyo ile sarılmış bir ışık geçirmez bir kapta saklayın.
- Böyle Fluor gibi sulu montaj orta ile lamel slaytlar,omount-G ya da ProlongGold. Bir pamuk uçlu aplikatör kullanarak tüm kabarcıklarını çıkarmak için özen gösterin.
3. Lekeli Doku Görüntüleme
- Mikroskopla inceleme
- Oje karanlık bir odada yer alması gereken, mikroskopi başlamadan önce en az bir saat kurumasını bekleyin.
- Floresan ışık kaynağı ve bir dijital kamera eki olan bir konfokal veya araştırma mikroskobu kullanılarak fotomikrografları edinin. Ekteki yazılımı kullanarak, her dalga boyu için pozu ayarlamak - 405, 488, ve 594 - ayrı. Not: derinlemesine görüntüleme talimatları mikroskop üreticisinden online olmalıdır.
- Bölümleri hareketli ya da odak ayarlama yapmadan her kanalda fotomikrografları edinin. Renkli fotoğraf çekmek, ya da dönüşümlü olarak gri tonlu ve daha sonra renk dönüştürmek.
Not: Renk veya her kanaldan gri tonlu görüntüleri sonrası işleme harmanlanmış edilebilir. - Kesitlerin fotoğraf beyazlatma oluşacak şekilde, doku kesitleri uzun süre için ortam ışığı veya mikroskopik ışığa maruz kalmayacağı emin olun. Bunu önlemek için, artan ışık / lazer yoğunluğu yerine pozlama süresini artırın.
- Açıldıktan 30 dakika içinde floresan ışık kaynağı kapatmayın.
Not: hızlı bir şekilde açık ve kapalı kaynak geçiş floresan ampul ömrünü azaltabilir.
Sonuçlar
Bu boyama protokolü mikrogliya floresan 594 kanal (kırmızı) etiketli olan sıçan beyin dokusu kesitlerinde sonuçları ve 488 kanal etiketli nöronlar (yeşil, Şekil 4). Nükleer leke yapılmış ise, 405 kanalın (mavi) gösterilecektir. Çıkan farklı kanallar içine alınır ve üç kanalın doğrudan bir karşılaştırma için kaplanmış, ya da herhangi bir, iki kanal arasında olabilir. Birçok dijital kazanım yazılım suit, bu işlevselliği içerir. Burada gösterilen Iba1 ve Pan-nöronal işaretleyici ile çift etiketleme kortikal katmanlar arasında belirgin uzun ince nöronal projeksiyonlar çoğunlukla dallanmış mikroglia, göstermektedir.
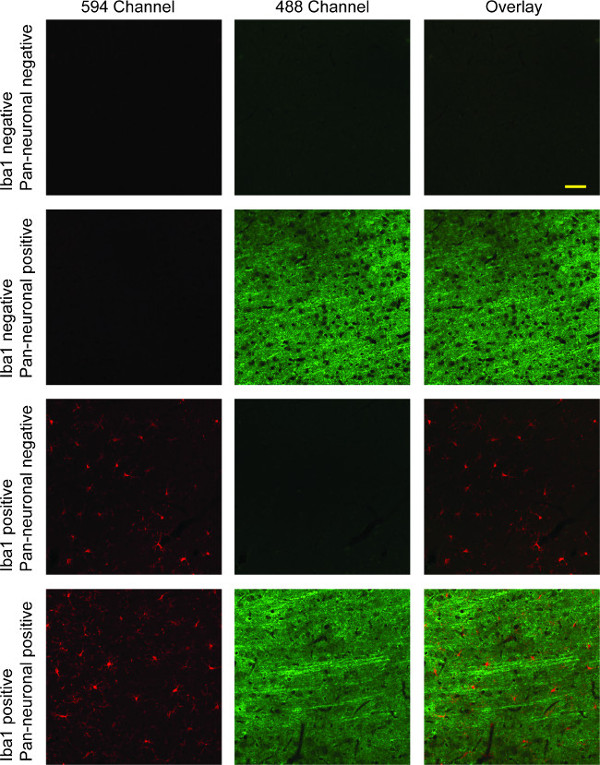
Şekil 4:. IBA-1 / pan-nöronal çift etiketleme sütun 1 Örnek konfokal fluoresan görüntüleri Iba1 (kırmızı) ile boyandı mikroglia gösterir. Nöronlar gösterilmiştirÜçüncü sütunda kırmızı ve yeşil kanallarını hem Kaplanmış görüntüsü ile yeşil ikinci sütunu. Birinci sırada nedeniyle hem birincil antikor bulunmadığı için özel olarak boyanması tam bir eksiklik vardır. üçüncü sıra mikroglia için Iba1 özgüllüğünü gösterir, oysa ikinci satır her iki durumda da, çapraz reaktivitesinin bir eksikliği ile, nöronal boyama Pan-nöronal primer antikorun özgünlüğünü tasvir etmektedir. Dördüncü satır mikrogliyal ve nöronal boyama hem gösteren iki kanalın bir bindirme ile çift etiketleme göstermektedir. Ölçek çubuğu 50 mikron.
Açık bir şekilde tanımlanmış hücre gövdeleri ve parçalanmış mikroglial / nöron olmaması ile kanıtlandığı gibi kötü boyama sonuçları, aynı zamanda, (Şekil 5) gösterilmiştir. Yüksek plan kalitesiz boyama göstergesidir ve antikor spesifik olmayan eş-lokalizasyonu (bakınız Şekil 5) tarafından görülebilir. Ayrıca, sinyal floresan bağlı streptavidi bir amplifikasyon aşaması, zayıfsan, dahil edilebilir. Bunun yerine aşama 2.2.6 doğrudan etiketli floresan ikincil antikoru kullanılarak ve bir biyotinile edilmiş ikincil uygulanır. PBS içinde yıkadıktan sonra, streptavidin (PBS içerisinde 1: 1000), 1 saat boyunca slaytlar üzerinde inkübe edilir. Slaytlar sonra yıkanır ve bir karşıt batırılmış veya kapak kaymış olan adım 2.2.7 de protokole dönün.
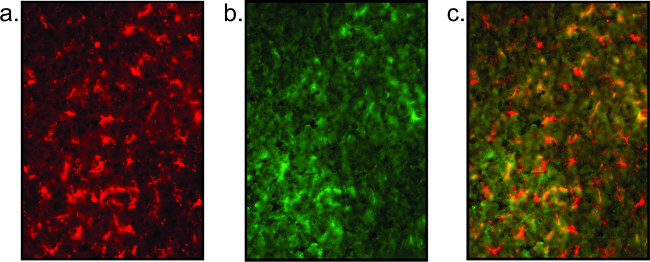
Şekil 5:. Kötü doku kalitesinin Örnek fluoresan görüntüleri burada gösterilen mikrogliyal boyama (a) ve nöronal boyama (b) 'nin tam olmaması açıklık eksikliği ile sonuçlanan zayıf dokuda boyanma bir örnektir. Bu nöronal boyama sadece yüksek arka plandır. Kaplanmış görüntüsü (c) anlamlı değildir.
| Malzeme / Ekipman Adı | Şirket | Katalog Numarası | Yorumlar / Açıklama |
| Fisherbrand Superfrost Plus cam sürgüler | Fisher Scientific | 22-034-979 | Montaj doku için kullanılır (1.2.2) |
| Fırın | Thermo Scientific | 51028112 | Doku kurutma için kullanılır (2.1.1) |
| Mini Pap kalem | Life Technologies | 00-8877 | Adım 2.2.2 Kullanılan |
| Bilimsel Doku-tek Slide Boyama Dish Andwin | Fisher Scientific | 22-149-429 | Hoechst adım yanı sıra, (2.2) boyama sırasında tüm yıkama için kullanılır (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Kurutma slaytlar için kullanılır (2.2) |
| Siyah Boyama Kutusu | Ted Pella | 21050 | Engelleme ve boyama aşamaları için (2.2) Kullanılmış |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Blok ve antikor inkübasyon (2.2) için kullanılır |
| Fare α-Pan-nöronal | Millipore | MAB2300 | Primer antikor (2.2.4) için kullanılır |
| Tavşan α-Iba1 | Wako Kimyasal | 019-19741 | Primer antikor (2.2.4) için kullanılır |
| Eşek α-Tavşan 594 | Jackson ImmunoResearch | 711-585-152 | Sekonder antikor (2.2.6) için kullanılır |
| Eşek α-fare 488 | Jackson ImmunoResearch | 715-545-150 | Sekonder antikor (2.2.6) için kullanılır |
| Yiyecek-içecek en folyo | Herhangi | N / A | Adımlar 1.2.2 ve 2.3.2 Kullanılan |
| Fluoromount-G | Güney Biyoteknoloji | 0100-01 | Coverslipping için kullanılır (2.2.8) |
| Lameller | Fisher Scientific | 12544E | Coverslipping için kullanılır (2.2.8) |
| Temizle Oje | Herhangi | N / A | Coverslipping için kullanılır (2.2.8) |
| Axio Observer.z1 ve LSM 710 (lazer tarama konfokal) | Carl Zeiss | N / A | Görüntüleme için kullanılır (3) |
| Axioskop A2 | Carl Zeiss | N / A | Görüntüleme için kullanılır (3) |
| CitriSolv | Fisher | DAB protokolü için | |
| ABC | Vector Laboratories | PK-6100 | DAB protokolü için |
| DAB Peroksidaz kiti | Vector Laboratories | SK-4100 | DAB protokolü için |
| Biyotinile edilmiş at α-tavşan IgG | Vector Laboratories | BA-1100 | DAB protokolü için |
| Biyotinile edilmiş at α-fare IgG | Vector Laboratories | BA-2001 | DAB protokolü için |
| % 30 hidrojen peroksit | Fisher | H325-500 | DAB protokolü için |
| Wheaton slayt rafları ve boyama yemekleri | TedPella | 21043 | DAB protokolü için |
| Masterflex perfüzyon pompa ve boru | Cole-Parmer | Perfüzyon (1.1.1 ve 1.1.2) için kullanılır | |
| Bilimsel doku-tek CRYO-Ekim bileşik Andwin (12 vaka) | Fisher Scientific | 14-373-65 | Doku dondurulması için kullanılır (1.2.1) |
| Termometre (-50 ila 50 ° C) | Fisher Scientific | 15-059-228 | Doku dondurulması için kullanılır (1.2.1) |
| Cryostat | Leica | CM3500S | Doku kesit için kullanılır (1.2.2) |
| 2 Kapaklı çanağı, Plastik Boyama | Grale Bilimsel | 353 | Antijen retrival için |
| 20 Place Boyama Rack, Slaytlar Yatay | Grale Bilimsel | 354 | Antijen retrival için |
| Mikrodalga | Herhangi | N / A | Antijen retrival için |
Tablo 1: Malzeme Listesi.
Tartışmalar
Bu iletişimin genel amacı okuyucuya immünhistokimya prosedürleri tanıtmak oldu. Bunun için, Iba1 ve Pan-nöronal antijenler ile çift etiketleme örneği mikroglia ve perfüze paraformaldehid nöronlar gözlemlemek, sükroz cryoprotected cryosectioned sıçan beyin kullanıldı.
Bu teknik, sonsuz amaçlara hizmet etmek için adapte edilebilir. Beyin, akciğer, karaciğer, böbrek ve bağırsak sınırlayıcı gibi, ancak doku tiplerinin, çeşitli farklı antijenlerin dizisi protokolü küçük ayarlamalar ile immünohistokimyasal görselleştirilebilir. İmmünohistokimya birden belirteçlerin doğrudan karşılaştırma için izin verir ve tek bir örnek dört farklı antikorları kadar kapsıyor olabilir. Bir örnekte kullanılan antikorların sayısı akmalarını, floresan dalga boylarının örtüşen tarif ile sınırlıdır. Dolayısıyla da içinde boyama kombinasyonları sınırlar sınırlı floresan ışık spektrumu vardıringle örneği (Şekil 6).
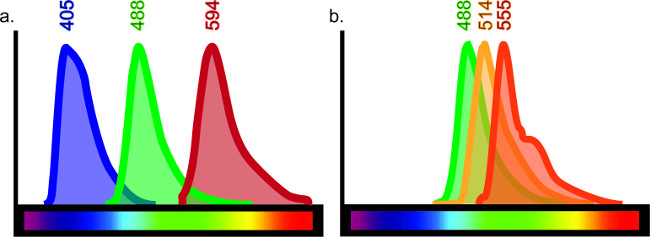
Şekil 6:. Belirli bir lazer veya filtre tarafından uyarıldığı zaman Renk tayfı grafik Her fluoroforun ışık belirli bir dalga boyu yayar. Etkin bir şekilde, çok-etiketli doku üretmek için, antikorlara konjuge belirli bir florofor arasındaki üst üste binme minimumdur olmalıdır. Piyasada mevcut olan en az 10 farklı flüoroforlar olsa da, tüm 10 kullanılması durumunda net sonuçlar elde etmek mümkün değildir. Minimal örtüşme bu dalga boyları arasında, varsa, orada Örneğin, 405, 488 ve 594 (A) dalga boyu emisyonları ile üçlü etiketleme net etiketleme verecekti. 488, 514 ve 555 de dalga boyu emisyonları kullanılmış olsaydı her antikor (lazer ile heyecanlandım veya filtre diğer içindir olabilir Ancak, boyama kolayca yorumlanır olmaz B). Bu sahte ko-etiketleme sonuçlar verecekti. Fluorofor seçimi için online kılavuzlar "floresan spektrum görüntüleyici" için arama ulaşabilirsiniz.
Ne zaman çift etiketleme hem antikorlar aynı anda tatbik edilebilir, bu farklı türlerde yapılan birincil antikor seçmek en iyisidir. Aynı türden iki antikorları ile çift etiketleme, ancak teknik olarak zor mümkündür. Her iki primer antikorlar, aynı türler içinde yapıldığında, boyama önce ikinci bir antijen için boyama tamamlayarak, ardışık olarak yapılmalıdır. Aynı türden primer antikorlar farklı Ig sınıfları (yani fare IgG ve fare IgM veya farklı alt sınıfları IgG1 ve IgG2a) varsa daha az sorunlar ortaya çıkacaktır. Daha fazla ayrıntı için ek referanslar 10,11 danışın. Bu protokol, tavşan anti-Iba1 ve fare anti-pan-nöronal kullanır. Uygun negatif kontroller için de gereklidir. Ib ile çift-etiketleme içina1 ve Pan-nöronal bir slayt birincil antikor içeren bir slayt anti-Iba1 sadece ve tek slayt sadece anti-Pan-nöronal içerir (bakınız Şekil 4) içerir. Bu negatif kontroller çapraz reaksiyon ve yanlış boyama yokluğu onaylayın. Diğer tüm slaytlar iki primer antikorlar içerir. Bu çapraz-reaksiyona girebilir ikincil antikorlar kullanılarak önlemek için de önemlidir. Örneğin, tavşan anti-Iba1 primer antikor ve eşek anti-tavşan 594 anti-fare 488 ikincil antikor, her iki bağlanma eşek anti-tavşan 594 neden olur eşek anti-tavşan 594 ve tavşan anti-fare 488 kullanılarak. Bu sahte ko-etiketleme yaratacak.
Belirli bir protein (antijen) için antikorlar, her zaman aynı değildir. Diğer parafine gömme işlemi sırasında değiştirilmiş bir antijen tanıyacak ise, örneğin, bazı antikorlar, dondurulmuş doku içinde mevcut olan antijenlere karşı yetiştirilir. Bu nedenle, özel dikkat t dikkat edilmelidirO satın almak için önce şartname sayfasını antikor. Antikor amaçlanan uygulama listede yoksa, sorun giderme boyama elde etmek için gerekli olabilir, ya da boyama hiç çalışmayabilir. Buna ek olarak, daha önce yayınlanmış veriler boyama elde etmek için "ticaretin püf noktalarını" sunabilir. Dikkat etmek önem ince farklar antikorların farklı gruplar halinde görülebilir olmasıdır; hafif modifikasyonları, bir antikor, her yeniden sırası ile yapılabilir gerekebilir.
Çoğu antikorlar alındığı tarihten itibaren 12 ay için iyidir. Ürün özellikleri sayfasındaki geliş tarihini belirtmek için emin olun. Antikor boyama gözlenmez ise, antikor çok eski veya yanlış depolanmış olabilir. Bu doğru depolama için her antikorun şartname sayfasını kontrol etmek bu nedenle de önemlidir.
Buna ek olarak, pek çok antikorlar, farklı klonları kullanılabilir. Farklı klonların ilgi antijenin farklı parçalarını tanır. BirVerilen klon farklı işleme teknikleri maruz doku için daha iyi olabilir (balmumu gömülü / dondurulmuş), doku türü veya hedef hedef türlere. Antikor büyüdü hangi türlerin özellikle dikkat edin. Antikor analizi için doku ile aynı türlerde yükseltildiğinde, yüksek bir zemin gözlenebilir. Fare kit üzerinde bir fare gibi ticari olarak temin edilebilir kitler bu, ek engelleme mücadele etmek için, boyama için gerekli olabilir. Bu teknik aynı zamanda hücre kültürüne adapte edilebilir. Hücreler, klon ve spesifite Fiksasyon uygulamaları için şartname kağıda kontrol edilmesi gerekir.
Bazı koşullarda antijen bağlanma siteleri gizlemek olabilir paraformaldehit çapraz bağlantılar proteinler ile Fixation. Antijen alımı protein çapraz bağlantıları kırmak ve bağlayıcı siteleri açığa çıkarabilir. Plastik boyama çanak kullanarak ve (Tablo 1), mikrodalga slaytlar eklemek: antijen alma gerekiyorsa, adım 2.1.3 sonra aşağıdaki protokolü eklemektitizlikle çözüm kaynamaya izin vermeyin özen 10 dakika için düşük güç ayarı sitrat tamponu, (özel güç seviyeleri nedeniyle mikrodalgalar arasındaki ortamlarda değişkenlik dahil değildir). Alternatif olarak, daha sonra 10 dakika boyunca slaytları, bir fırın içinde cam bir boyama kabına 80 ° C sitrat tamponu getir.
Kötü doku kalitesi de boyama (Şekil 5) ile sorunlara neden olabilir. Tek doku kalitesinden ödün önlemek için alabileceğiniz önlemler vardır. İlk başta dondurma işleminden önce doku su yer değiştirmesi amacıyla, sükroz değişiklikler hasta ve gayretli. Donma zaman sıcaklık sabit tutmak. Doku çok yavaş donuyor, onlar dondurma gibi su molekülleri dokuda delik yaratarak genişleyecektir. Alternatif olarak, çok düşük bir sıcaklıkta dondurma doku çatlamasına neden olur.
Protokoller ilgi her antikor için biraz değişecektir. Yeni antikorun alınması üzerine, tek bir seçmelidirbuna göre protokol imize. Arka plan (Şekil 5) yüksek ise, daha uzun bir süre için engelleme deneyin. Alternatif olarak, blok çözeltisinin serum konsantrasyonunu artırmak veya birden fazla farklı türler gibi keçi ve tavşan serumdan serumu ekleyin. Buna ek olarak, kasein spesifik olmayan bağlanma azaltmak için kullanılabilir. (Kuru toz yapılan) Yağsız süt kazeini içerir ve bir konsantrasyon aralığında kullanılabilir (tipik haliyle, 1-5% w / v). Süt, tek başına kullanıldığında, ya da serum ile bağlantılı olabilir. Ilgilenilen bir antijenin hücre içi bir marker olması durumunda, örneğin Triton® X-100 veya Tween-20, deterjanlar, hücre zarlarını permeabilize bloke çözeltisine ilave edilebilir. Daha kalın doku bölümleri kuyu doku bölümleri kayan yerine slaytlar üzerine monte edilerek Benzer işlenebilir. Parafine gömülmüş doku da benzer işlem, ancak engelleyen önce bir de-ağda aşamasını gerektirir. Feldengut ve ark., 12 adresleri, bu yöntemlerin her ikisi de.
, bu floresan antikorlar karanlık kaplarda saklanan ve sekonder antikor inkübasyon aşağıdaki ışık maruz kalmaktan kaçınmak olduğunu önemlidir. Gelişmekte olan bir ajan olarak DAB kullanırken aksine, ışığa maruz kalma zararlı değildir. Floresan boyama onun uzun ömürlü sınırlıdır. Floresan-lekeli slaytlar, 4 ° C'de, ışık geçirmez bir kutu içinde muhafaza edilmelidir. Görüntüler boyanma bir ay içinde ele alınmalıdır. Acil görüntüleme mümkün değilse görüntüleme mümkün olana kadar, DAB veya diğer alternatif boyama yöntemleri veya gecikme boyama düşünün. Floresan çift- ve üçlü-etiketlemesi için mümkündür, öte yandan DAB ile boyama, genellikle, tek bir hedef antijeni lekeleme ile sınırlıdır. Çift ve üçlü etiketleme DAB ancak bu teknik komplikasyonlar ve spesifik antijen boyama izole zorluk eğilimli kullanılarak elde edilebilir. DAB boyama floresan s görüntüleme ise parlak bir alan mikroskobu altında görüntülendi olabilirronyum floresan mikroskop gerektirir.
DAB boyama ile dikkate alınması gereken bir başka faktör hücreleri doku çok katmanlı yayılan olmasıdır. Böyle yayılan süreçleri mikroglia olarak hücrelerin net görüntüler elde etmek zordur. Bu sorunu aşmak için, bazı araştırmacılar, 8-12 mikron kendi bölümleri ince kesti.
Floresan etiketli doku Görüntüleme iyi bir konfokal mikroskop elde edilir. Konfokal mikroskoplar izole ve örnek içinde odak tek bir uçağı yakalayarak normalde bir araştırma floresan mikroskop ile görülen pus ortadan kaldırır. Konfokal mikroskobu ile, ince ayrıntılar net ve kanama-through floresan boyalar arasında azalır vardır. Kalın örnekler gerçek eş-lokalizasyon göstermek için bir süre (z-yığın) az bir uçağı görüntülü olabilir. Konfokal mikroskop erişim mevcut olmadığında, bir araştırma mikroskop görüntüleme mümkündür, ancak maruz kalma süresi ve ışık yoğunluğu loc olması gerekirgörüntüler arasında ked.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
Referanslar
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l'Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira's basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır