Method Article
التمهيدي لالمناعية على نسيج Cryosectioned دماغ الفئران: مثال تلطيخ لالدبقية الصغيرة والخلايا العصبية
In This Article
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
المناعية هو أسلوب يستخدم على نطاق واسع للكشف عن وجود، والموقع، والوفرة النسبية للمستضدات في الموقع. يصف هذا البروتوكول المستوى التمهيدي الكواشف والمعدات والتقنيات اللازمة لاستكمال تلطيخ المناعى أنسجة الدماغ القوارض، وذلك باستخدام علامات لالخلايا الدبقية الصغيرة والعناصر العصبية كمثال على ذلك. على وجه التحديد، فإن هذه الورقة هي بروتوكول خطوة بخطوة لرؤية فلوري من الخلايا الدبقية الصغيرة والخلايا العصبية عن طريق المناعية للIba1 وعموم العصبية، على التوالي. مضان مزدوج وضع العلامات مفيد بشكل خاص للتوطين بروتينات متعددة داخل نفس العينة، وتوفير الفرصة لمراقبة بدقة التفاعلات بين أنواع الخلايا، والمستقبلات، بروابط، و / أو المصفوفة خارج الخلية في علاقتها ببعضها البعض وكذلك البروتين المشارك توطين داخل خلية واحدة. على عكس تقنيات التصوير الأخرى، مضان المناعية كثافة تلطيخ قد ينخفض فيمن أسابيع إلى أشهر التالية تلطيخ، ما لم تتخذ الاحتياطات المناسبة. على الرغم من هذا القيد، في العديد من التطبيقات ويفضل مضان مزدوج وضع العلامات على بدائل مثل tetrahydrochloride 3،3'-diaminobenzidine (DAB) أو الفوسفاتيز القلوية (AP)، ومضان هو المزيد من الوقت الفعال ويسمح للتمايز أكثر دقة بين دولتين أو أكثر علامات. وتشمل المناقشة نصائح استكشاف الأخطاء وإصلاحها والمشورة لتعزيز النجاح.
Introduction
المناعية هي عملية للكشف عن المستضدات (أي البروتينات) في أقسام الأنسجة باستخدام الأجسام المضادة الأولية التي تربط خصيصا لمولدات المضادات من الفائدة. كان رائدا المناعية التي كتبها JR ماراك في عام 1934 عندما قرر أن الأجسام المضادة يمكن أن توطين مستضدات مع خصوصية كبيرة 1. ابتداء من عام 1942، ونشرت بعض من أولى الدراسات في المختبر باستخدام الأجسام المضادة فلوري لتصور المناعية 2،3، وبعد ذلك لأول مرة في الجسم الحي الدراسة النسيجية تم نشره 4. خلال عام 1960، بعد ثلاثة عقود من إنشائها أساليب المناعى، بدأت الأجسام المضادة انزيم مترافق لاستخدامها الكواشف الثانوية. تم في وقت واحد وبشكل مستقل وضعت هذه الأساليب في فرنسا والولايات المتحدة 5،6. اليوم، مجموعة واسعة من الأجسام المضادة تقدم احتمالات لا نهاية لها للدراسات المناعية 7.
"> ويتمثل الهدف العام من هذه المراسلات هو توفير مقدمة موجزة إلى تلطيخ المناعى، وليس المقصود أن يكون استعراضا شاملا وكاملا لهذه التقنية في الأسلوب المبين، وتعرض تقنيات المناعى لمدة المستضدات (علامات على الخلايا الدبقية الصغيرة و. الخلايا العصبية) لتلطيخ من امتصاص العرق perfused ل، السكروز cryoprotected، cryosectioned الدماغ الفئران. تلطيخ المناعى يبدأ حجب المستضد غير محددة ملزمة للحد من تلوين الخلفية. بعد ذلك، الحضانة مع الأجسام المضادة الأولية تسمح للربط لمستضد معين في الأنسجة. وبعد الأجسام المضادة الأولية، الأجسام المضادة آخر، وصف الأجسام المضادة الثانوية، يتم تطبيقها على ربط الأجسام المضادة الأولية إلى إشارة التصور مترافق 8. والضد الثانوية يستهدف المناعي G (مفتش) مجال معين إلى الأنواع التي أثيرت الأجسام المضادة الأولية. يضخم الجسم المضاد الثانوي إشارة من الأجسام المضادة الأولية منذ المناطق فاب رانه الثانوي ربط الأجسام المضادة لمواقع متعددة في المجال مفتش من الأجسام المضادة الأولية. إما الإنزيمات أو جزيئات فلوري مترافق إلى ج مناطق F من الأجسام المضادة الثانوية تمكن التصور. على سبيل المثال، أرنب الأجسام المضادة الأولية مكافحة Iba1 هو أرنب جزيء مفتش محددة لIba1. عندما يتم تطبيق حمار المضادة للأرنب مفتش بمثابة الضد الثانوية، انها لن تعترف وربط مناطق متعددة من الأرانب مكافحة Iba1 مفتش (انظر الشكل 1). الأجسام المضادة حمار يمكن تصور بطرق مختلفة. وتركز هذه المراسلات على الكشف عن fluorophore مترافق الأجسام المضادة الثانوية، الذي يعترف الأجسام المضادة الأولية، لتصور بواسطة المجهر الفلورسنت. في المناعية الفلورسنت، وصمة عار النووية مثل هويشت أو دابي يمكن استخدامها لتصور كل نواة.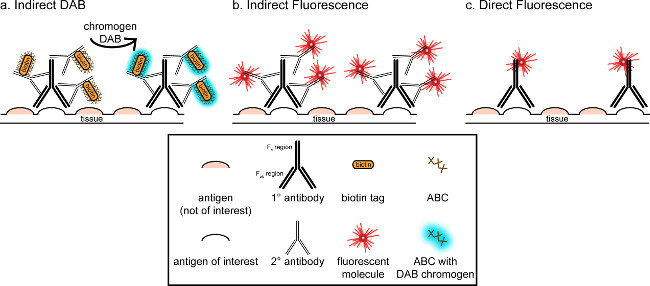
الشكل 1: شوبتمثيل ematic من مقابل المباشر تقنيات وضع العلامات الأجسام المضادة غير المباشر. الأجسام المضادة ربط المستضد من الفائدة ويمكن تضخيمها من قبل الأجسام المضادة الثانوية التي أثيرت ضد أنواع من الأجسام المضادة الأولية. هذه التقنية يمكن القيام بها باستخدام مجمع أفيدين البيوتين (ABC) لتضخيم وDAB التصور (A) أو الأجسام المضادة الثانوية فلوري مترافق مباشرة (B). بدلا من ذلك، الأجسام المضادة الأولية يمكن مترافق مباشرة مع العديد من العلامات المختلفة، بما في ذلك البيوتين أو fluorophore (C). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
طريقة بديلة لرؤية تلطيخ المناعى يستخدم 3،3'-diaminobenzidine tetrahydrochloride (DAB؛ انظر الشكلين 1 و 2). هذا يختلف عن مضان باستخدام البيروكسيديز أوالغلوثانيون الحصان الفجل (HRP) الأجسام المضادة الثانوية مترافق، التي تنص على انزيم تحويل DAB إلى راسب التي مرئيا تحت مشرق المجهري الميدان. في الحالات التي تكون فيها مستضد واحد هو من مصلحة أو مطلوب تلطيخ أن تكون طويلة الأمد، قد يكون DAB أكثر ملاءمة من تلطيخ الفلورسنت. ومع ذلك، لا مناسبة تماما DAB تلطيخ للتمايز بين علامات متعددة، لا سيما إذا كان اثنان من المستضدات النووية المثيرة للاهتمام. للحصول على معلومات عن المواد DAB وتعديلات بروتوكول، راجع الجدول 1. بالتناوب، نيترو الأزرق كلوريد نتروبلو / 5-برومو-4-كلورو-3-indolyl الفوسفات (NBT / BCIP) يمكن استخدامها لتصور والفوسفاتيز القلوية (ا ف ب) مترافق الثانوية الأجسام المضادة.

الشكل 2: صور الممثل DAB الفئران أقسام محسنة النيكل أنسجة المخ واحدة وصفت حد ذاتها دماغ الفئرانctions التي وصفت مع محسنة النيكل DAB لIba1 (A) وعموم العصبية (B) يسمح للتحليل طويل الأمد من الخلايا الدبقية الصغيرة أو الخلايا العصبية وحدها. مقياس شريط 20 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
يجب على المرء أن ينظر في وفرة المقدرة للمستضد المصالح داخل الأنسجة التي يجري تحليلها. وسائل غير مباشرة (كما هو موضح أعلاه) هي مفيدة للأهداف مع وفرة منخفضة. عندما مستضد من الفائدة في وفرة عالية، ويمكن تطبيقها الأساليب المباشرة. طرق المباشرة تنطوي على الأجسام المضادة الأولية التي مترافق مباشرة إلى إشارة التصور، وبالتالي لا يلزم الضد الثانوية. هذه الطريقة يبسط عملية التلوين، ولكن يلغي التضخيم من قبل وسائل غير مباشرة تحقيقها. باستخدام الأجسام المضادة الأولية مترافق مباشرة كما يلغي عبر التفاعل من الأجسام المضادة الثانويةعند النقر المزدوج وضع العلامات.
هذا التواصل تفاصيل بروتوكول لمضاعفة وضع العلامات مع Iba1 وعموم العصبية (التفاصيل في الجدول 1). Iba1 بقع الخلايا الدبقية الصغيرة في العديد من الدول التنشيط، بما في ذلك متشعب، فرط متشعب، تنشيط، أميبية، وقضيب. البقع عموم العصبية محاور الخلايا العصبية، التشعبات، وسوما. منذ Iba1 البقع معظم الخلايا الدبقية الصغيرة والأهداف عموم العصبية في الخلايا العصبية، وهذا مزيج من البقع مفيد في الحصول على فهم واسع من التفاعلات الخلايا الدبقية الصغيرة الخلايا العصبية.
باختصار، يعتمد تلطيخ المناعى على الاختيار الدقيق للأجسام. كما يصبح السؤال البحثي أكثر تحديدا، قد يكون المطلوب الأجسام المضادة التي أثيرت لمستضدات بديلة. استهداف دولة تفعيل دبقية محددة، يمكن للمرء أن يختار استخدام CD45 CD68 أو الأجسام المضادة، بدلا من Iba1. وعلاوة على ذلك، في العمل مع الفئران، F4 / 80 قد توفر النتائج اللازمة. وبالمثل، عناصر الخلايا العصبية يمكن أن تستهدف على وجه التحديد مع الأجسام المضادة راISED ضد النواة، المشبك (قبل أو ما بعد)، المحور، ومخروط النمو. بالإضافة إلى ذلك، هناك علامات أخرى والتي تفرق عمر الخلايا العصبية (انقر نقرا مزدوجا كورتين، NeuN)، وتجديد الخلايا العصبية (GAP-43).
Protocol
ملاحظة: تم تنفيذ جميع الإجراءات في الامتثال مع اللجنة المؤسسية رعاية الحيوان واستخدام (IACUC) من جامعة ولاية اريزونا. ويمكن الاطلاع على قائمة المواد والمعدات الموصى بها في الجدول 1.
1. إعداد الأنسجة
- نضح
- الموت ببطء القوارض مع جرعة زائدة من الصوديوم بنتوباربيتال (25 ملغ / كغ، IP)، ويروي transcardially مع الفوسفات مخزنة المالحة (PBS) حتى exsanguinated تماما (3-5 دقيقة) بمعدل تدفق 8 مل / دقيقة. للحصول على تعليمات نضح في العمق، انظر غيج وآخرون 2012 9.
- مباشرة بعد PBS دافق، وإصلاح الأنسجة عن طريق perfusing مع بارافورمالدهيد 4٪ في برنامج تلفزيوني لمدة 15-20 دقيقة بمعدل تدفق 8 مل / دقيقة.
- إزالة الدماغ ووضعه في 4٪ امتصاص العرق لمدة 24 ساعة، تليها حلول السكروز متدرج (15٪، 30٪، 30٪، في التسلسل؛ أعدت في تريس مخزنة المالحة) في 4 ° C. نقل الدماغ لاحقا السكروز حل سنلي بعد الدماغ قد غرقت في كل حل. ملاحظة: عادة، 5 أيام في كل حل هو الوقت الكافي للأنسجة لتغرق.
- تجميد الأنسجة وCryosectioning
- وضع الدماغ في تضمين المتوسطة، مثل أكتوبر المجمع ويغرق في isopentane عند درجة حرارة -35 درجة مئوية. السماح للدماغ لتجميد مدة لا تقل عن 10 دقيقة، ومن ثم تخزين في -80 ° C. مشاكل يمكن أن تنشأ إذا لم يتم اتخاذ الحرص على درجة الحرارة؛ الرجاء انظر المناقشة لاستكشاف المعلومات.
- قطع أقسام الاكليلية التسلسلية في سمك 20 ميكرون ودرجة حرارة -20 درجة مئوية. جمع الأنسجة على الشرائح ذات شحنة موجبة. قد تكون وضعت أقسام الدماغ في مربع الشريحة ملفوفة في احباط في كيس الرمز البريدي أعلى وتخزينها على المدى الطويل في -80 ° C. هذه الطريقة في التخزين يخلق الحدود مزدوجة لمنع التعرض للهواء والصقيع.
2. معالجة الأنسجة
ملاحظة: المعدات والمواد مثال صequired لتلطيخ في الشكل 3. هي البدائل المتاحة، ومع ذلك، فإن هذه الصور تساعد أولئك جديدة لتلطيخ المناعى لتصور العناصر المناسبة قبل الشراء.

الرقم 3: مثال العناصر المطلوبة لتلطيخ المناعى مربع أسود هو مبين في (A) هو غرفة الرطوبة مثالية لالمناعي، كما يتم حماية الشرائح من الضوء دون الحاجة إلى التفاف مربع على احباط. بعد باجتزاء، والشرائح يمكن تخزينها في صندوق مثل المربع الأصفر هو مبين في (B). التفاف مربع بإحكام في احباط ووضع في كيس الرمز البريدي أعلى قبل الثلاجة يساعد على حماية عينات الأنسجة من حرق المجمد. تم اعطاء مثال من الشرائح في (C)، مع أطباق تلطيخ مختلفة صورت في (D) و (E ). يمكن Coverslips تختلف في الحجم والسمك (F)، ومع ذلك توفر 1.2 coverslips سميكة نتائج التصوير لطيفة على معظم المجاهر تستقيم ومتحد البؤر. قلم رصاص مثل تلك المبينة في (G) يمكن استخدامها لتسمية الشرائح. وينبغي تجنب علامات دائمة مثل الحبر يمكن تشغيل، مما يؤثر على تلطيخ والقدرة على تحديد ما هي العينة. قلم حلمة الثدي صغيرة مثل تلك التي تظهر في (H) تمكن الحدود طارد التي يمكن استخلاصها على الشرائح.
- إعداد الشريحة
- إزالة الشرائح من الفريزر وذوبان الجليد في درجة حرارة الغرفة.
- اختياري: إذا أقسام قد طرحت في وقت سابق من الشرائح، ووضع الشرائح إذابة في فرن عند 60 درجة مئوية لمدة لا تزيد على 4 ساعات للمساعدة في منع المقاطع النسيجية من عائمة قبالة الشرائح.
- مكان الشرائح في رفوف الشريحة وطبق المقابلة.
- غسل الشرائح ثلاث مرات في برنامج تلفزيوني لمدة 5 دقائق لكل منهما، وتغيير الحل بين يغسل. من هذه الخطوة إلى الأمام، وتجنب وجود sectiإضافات دون السائل لفترات طويلة من الزمن. ملاحظة: إذا أقسام تجف، يتم زيادة تلوين الخلفية، ولا يمكن أن يعتمد عليه الحصول على بيانات ذات مغزى.
- إزالة الشرائح من الفريزر وذوبان الجليد في درجة حرارة الغرفة.
- الأنسجة تلطيخ
- في مربع تلطيخ ضوء محكم، إنشاء "غرفة الرطوبة" مع الأنسجة خالية من الوبر ينقع بالماء منزوع الأيونات.
- تجف حواف الشريحة بمنديل خالية من الوبر، واستخدام PAP القلم مصغرة لجعل الحدود طارد السائل على حافة جدا من الشرائح، بعيدا عن أقسام الأنسجة. وينبغي أن تكفل هذه الحدود حيزا واسعا بين الغضروف المفصلي للسائل وحافة النسيج بحيث التوتر السطحي لا يؤثر تلطيخ.
ملاحظة: يمكن تطبيق الحدود طارد حلمة الثدي من ركلة جزاء قبل 2.1.3 إذا كانت الأجسام المضادة التي تهم لا تتطلب الميكروويف استرجاع مستضد. إذا تم تطبيق القلم حلمة الثدي قبل الغسيل في برنامج تلفزيوني، يجب أن يتم التحقق من سلامة الحدود السائل طارد في هذه الخطوة. استخدام قلم مصغرة حلمة الثدي لملء أي ثغرات في الحدود. - مع الشرائح وضعت أفقيا، كتلة المستضد غير محددة ملزمة التي يحتضنها في 4٪ ت / ت مصل في برنامج تلفزيوني (حل كتلة). ماصة 300 ميكرولتر من حل كتلة لكل شريحة ل1hr في درجة حرارة الغرفة. تأكد من حل كتلة يمتد إلى القلم حلمة الثدي عند حافة الشريحة ويغطي تماما الأنسجة لتجنب تلطيخ متفاوتة الناجمة عن التوتر السطحي بالقرب من الأنسجة.
- استخدام المصل من نفس الأنواع التي يتم فيها الأجسام المضادة الثانوية. ملاحظة: في هذا الإجراء، يتم إجراء الأجسام المضادة الثانوية في الحمار، وبالتالي يستخدم المصل حمار. إذا تم استخدام الأجسام المضادة الثانوية من اثنين أو أكثر من الأنواع المختلفة، وتشمل المصل من كل الأنواع.
- ماصة الأجسام المضادة الأولية على الشرائح. ملاحظة: لقد تم تحسين تركيز الأجسام المضادة لهذا تلطيخ في 1: 5000 و 1: 500 للIba1 وعموم العصبية، على التوالي. تم العثور على هذه التركيزات لإظهار تلطيخ هادف مع غياب تلوين الخلفية.
- تمييع الحل كتلة ل1٪ مصل في برنامج تلفزيوني وإضافة الأجسام المضادة الأولية. ماصة 300 ميكرولتر من محلول الأجسام المضادة الأولية في 1٪ مصل لكل شريحة. مرة أخرى، وضمان السائل إلى حافة القلم حلمة الثدي. احتضان بين عشية وضحاها في 4 درجات مئوية.
- تشمل ثلاث شرائح التحكم: واحد يحتوي على لا Iba1 ولا عموم العصبية الأجسام المضادة، واحدة مع Iba1 دون الأجسام المضادة عموم العصبية، واحدة مع الأجسام المضادة عموم العصبية دون Iba1. وصمة عار هذه الشرائح في نفس المدى مع نفس الحلول، ولكن حذفت الأجسام المضادة الأولية لاختبار ملزمة من الأجسام المضادة الثانوية غير محددة.
- في صباح اليوم التالي، وغسل الشرائح ثلاث مرات في برنامج تلفزيوني لمدة 5 دقائق لكل منهما، وتغيير الحل بين يغسل.
- الأجسام المضادة الفلورسنت هي حساسة للضوء، وبالتالي، من هذه الخطوة إلى الأمام، والحد من التعرض للضوء عن طريق ضمان يتم تغليف الحاويات غسل في احباط والتهجين صناديق إما أسود أو المحتضنة في الظلام. ماصة الأجسام المضادة الثانوية المناسبة على كافة الشرائح واحتضان ل60 دقيقة في درجة حرارة الغرفة بتركيز 1: 250 في حل كتلة (راجع الخطوة 2.2.3) في "غرفة الرطوبة" الخفيفة محكم (راجع الخطوة 2.2.1).
- استخدام الأجسام المضادة الثانوية من أطوال موجية مختلفة. هنا، للأرنب الأجسام المضادة الأولية ومكافحة Iba1، استخدم الحمار أرنب مكافحة 594 كما الأجسام المضادة الثانوية المناسب. الماوس الأجسام المضادة الأولية مكافحة عموم العصبية، استخدم الحمار مكافحة فأر 488 كما الأجسام المضادة الثانوية المناسب. بالتناوب، استخدم المضادة للأرنب 488 ومكافحة فأر 594.
- غسل الشرائح ثلاث مرات في برنامج تلفزيوني لمدة 5 دقائق لكل منهما.
- اختياري: أداء تلطيخ النووي.
- مكان في هويشت (أو وصمة عار النووية الأخرى) بتركيز 0.03 ميكروغرام / مل في ضعف H المقطر 2 0 بالضبط 60 ثانية.
- غسل الشرائح ثلاث مرات في برنامج تلفزيوني لمدة 5 دقائق لكل منهما.
- يغسل في ده 2 0.
- Coverslipping
- شرائح ساترة مع وسط مائي التركيب، مثل فلورomount-G أو ProlongGold. الحرص على إزالة جميع الفقاعات باستخدام قضيب من القطن ذات الرؤوس.
ملاحظة: يمكن أن تستخدم عوامل أخرى تصاعد مستمر، وقد لوحظ مع ذلك عالية تنزف من خلال بين الأصباغ من قبل بعض غضون أيام من coverslipping. - استخدام طلاء الأظافر واضحة لختم الحواف، ومنع المقاطع من الجفاف بسبب التبخر. السماح طلاء الأظافر لتجف في وعاء محكم الخفيفة في حين تبقى الشرائح مسطحة وعند درجة حرارة الغرفة، ومن ثم تخزينها في حاوية للضوء ضيق ملفوفة في احباط في 4 ° C.
- شرائح ساترة مع وسط مائي التركيب، مثل فلورomount-G أو ProlongGold. الحرص على إزالة جميع الفقاعات باستخدام قضيب من القطن ذات الرؤوس.
3. تصوير الأنسجة الملون
- المجهر
- السماح للطلاء الأظافر لتجف لمدة ساعة واحدة على الأقل قبل البدء المجهري، والتي ينبغي أن تتم في غرفة مظلمة.
- الحصول photomicrographs باستخدام متحد البؤر أو المجهر البحث مع مصدر ضوء الفلورسنت ومرفق الكاميرا الرقمية. استخدام البرمجيات المصاحبة لها، تعيين التعرض لكل طول موجي - 405، 488، و 594 - على حدة. ملاحظة: في عمق ينبغي أن تكون تعليمات التصوير على شبكة الإنترنت من الشركة المصنعة المجهر.
- الحصول photomicrographs في كل قناة دون تحريك الفروع أو ضبط التركيز البؤري. التقاط صور في اللون، أو بالتناوب في الرمادي وتحويله إلى اللون بعد ذلك.
ملاحظة: اللون أو الصور الرمادية من كل قناة يمكن ترتيبها في مرحلة ما بعد المعالجة. - ضمان عدم تعرض تلك المقاطع النسيجية للضوء المحيط أو ضوء المجهري لفترات طويلة من الزمن، كما قدم صورة تبيض الأقسام سيحدث. لتجنب هذا، وزيادة التعرض الوقت بدلا من زيادة شدة الضوء / ليزر.
- لا إيقاف مصدر ضوء الفلورسنت غضون 30 دقيقة من التعرض للتشغيل.
ملاحظة: التبديل المصدر وإيقاف في تتابع سريع قد يقلل من العمر الافتراضي للمصباح الفلورسنت.
النتائج
هذه النتائج بروتوكول تلطيخ في أقسام الأنسجة دماغ الفئران التي الخلايا الدبقية الصغيرة fluorescently المسمى في 594 قناة (الحمراء)، والخلايا العصبية المسماة في 488 قناة (الأخضر؛ انظر الشكل 4). إذا كان قد تم القيام به وصمة عار النووية، وسوف تظهر في القناة 405 (أزرق). يمكن التقاط صور في قنوات مختلفة ومضافين للمقارنة مباشرة للقنوات الثلاث، أو بين أي قناتين. وتشمل العديد من الأجنحة الرقمية برنامج الحصول على هذه الوظيفة. المزدوج وضع العلامات مع Iba1 وعموم العصبية علامة هو موضح هنا يوضح الخلايا الدبقية الصغيرة في الغالب متشعبة، مع طويلة التوقعات العصبية الجميلة واضحة عبر الطبقات القشرية.
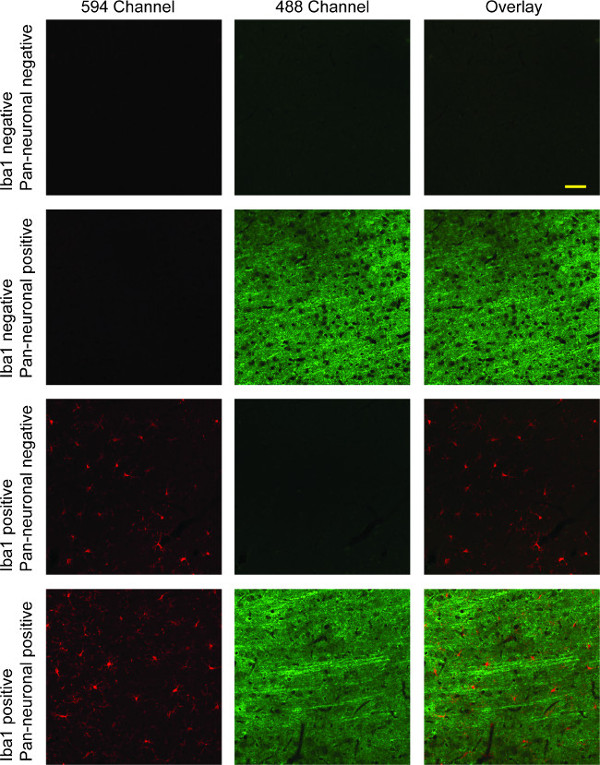
ويظهر الصور الفلورسنت مبائر التمثيلية للإيبا-1 / عموم العصبية انقر نقرا مزدوجا وضع العلامات العمود 1 الخلايا الدبقية الصغيرة ملطخة Iba1 (الأحمر): الشكل 4. وتظهر الخلايا العصبية فيالعمود الثاني باللون الأخضر، مع صورة متراكبة من كلتا القناتين الحمراء والخضراء في العمود الثالث. في الصف الأول، هناك انعدام تام للتلطيخ محددة بسبب غياب كل من الأجسام المضادة الأولية. الصف الثاني يصور خصوصية الأجسام المضادة الأولية عموم العصبية لتلطيخ الخلايا العصبية، في حين يبين الصف الثالث خصوصية Iba1 عن الخلايا الدبقية الصغيرة، مع انعدام تام للعبر التفاعل في كلتا الحالتين. يوضح الصف الرابع المزدوج وضع العلامات مع تراكب للقناتين تظهر كلا دبيقي وتلطيخ الخلايا العصبية. شريط نطاق 50 ميكرون.
وأظهرت النتائج تلطيخ الفقيرة أيضا (الشكل 5)، كما يتضح من عدم وجود أجسام الخلايا واضحة المعالم والعمليات العصبية / دبقية صغيرة مجزأة. ارتفاع الخلفية الإرشادية للفقراء تلطيخ الجودة، ويمكن أن ينظر إليه من قبل غير محددة المشارك توطين الأجسام المضادة (انظر الشكل 5). وعلاوة على ذلك، إذا كانت الإشارة ضعيفة، وهي خطوة التضخيم مع streptavidi ملزمة fluorescentlyويمكن إدراج ن. بدلا من استخدام الأجسام المضادة الثانوية فلوري الموسومة مباشرة في خطوة 2.2.6، يتم تطبيق البيروكسيديز الثانوية. بعد الغسيل في برنامج تلفزيوني، ستربتافيدين: يتم تحضين (1 1000 في PBS) على الشرائح لمدة 1 ساعة. العودة إلى البروتوكول في خطوة 2.2.7 حيث يتم غسلها بعد ذلك الشرائح وانخفض في مباين أو تراجع الغطاء.
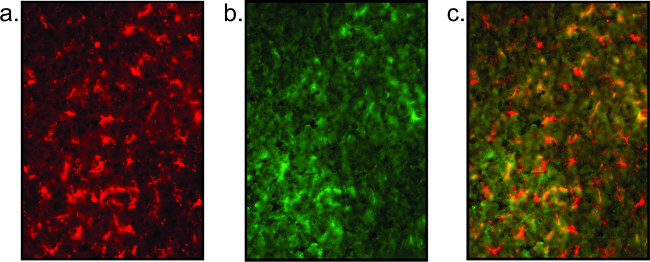
الشكل 5: صور الممثل الفلورسنت ذات نوعية رديئة الأنسجة يظهر هنا هو مثال على تلطيخ في ضعف الأنسجة مما يؤدي إلى عدم وضوح تلطيخ دبقية (أ) و انعدام تام للالخلايا العصبية تلطيخ (ب). هذا تلطيخ الخلايا العصبية هو مجرد خلفية عالية. الصورة مضافين (ج) ليست ذات مغزى.
| اسم المادة / معدات | شركة | عدد كتالوج | تعليقات / الوصف |
| Fisherbrand Superfrost زائد الشرائح الزجاجية | فيشر العلمية | 22-034-979 | تستخدم لأنسجة تركيب (1.2.2) |
| فرن | الحرارية العلمية | 51028112 | تستخدم لتجفيف الأنسجة (2.1.1) |
| مصغرة عنق الرحم القلم | تكنولوجيا الحياة | 00-8877 | المستخدمة في الخطوة 2.2.2 |
| Andwin العلمي الأنسجة تيك تلطيخ الشريحة الصحن | فيشر العلمية | 22-149-429 | تستخدم لجميع يغسل خلال تلطيخ (2.2)، وكذلك خطوة هويشت (2.2.8) |
| Kimwipes | فيشر العلمية | 06-666-A | تستخدم لتجفيف الشرائح (2.2) |
| أسود يلطخ صندوق | تيد بيلا | 21050 | تستخدم لمنع وتلطيخ الخطوات (2.2) |
| طبيعي حمار المصل | فيشر العلمية | 50-413-253 | تستخدم لكتلة والأجسام المضادة الحضانة (2.2) |
| الماوس α-عموم العصبية | ميليبور | MAB2300 | تستخدم لالأجسام المضادة الأولية (2.2.4) |
| أرنب α-Iba1 | اكو الكيميائية | 019-19741 | تستخدم لالأجسام المضادة الأولية (2.2.4) |
| حمار α الأرنب 594 | جاكسون ImmunoResearch | 711-585-152 | تستخدم لالضد الثانوية (2.2.6) |
| حمار α الفأر 488 | جاكسون ImmunoResearch | 715-545-150 | تستخدم لالضد الثانوية (2.2.6) |
| احباط الممون ل | أي | N / A | يستخدم في خطوات 1.2.2 و 2.3.2 |
| Fluoromount-G | التكنولوجيا الحيوية الجنوبي | 0100-01 | تستخدم لcoverslipping (2.2.8) |
| Coverslips | فيشر العلمية | 12544E | تستخدم لcoverslipping (2.2.8) |
| واضح طلاء الأظافر | أي | N / A | تستخدم لcoverslipping (2.2.8) |
| محوري Observer.Z1 وLSM 710 (المسح بالليزر، متحد البؤر) | كارل زييس | N / A | تستخدم للتصوير (3) |
| Axioskop A2 | كارل زييس | N / A | تستخدم للتصوير (3) |
| CitriSolv | FisherScientific | لبروتوكول DAB | |
| أ ب ج | مختبرات ناقلات | PK-6100 | لبروتوكول DAB |
| DAB البيروكسيد عدة | مختبرات ناقلات | SK-4100 | لبروتوكول DAB |
| الحصان المعقدة البيروكسيديز α الأرنب مفتش | مختبرات ناقلات | BA-1100 | لبروتوكول DAB |
| α الفأر الحصان المعقدة البيروكسيديز مفتش | مختبرات ناقلات | BA-2001 | لبروتوكول DAB |
| 30٪ بيروكسيد الهيدروجين | FisherScientific | H325-500 | لبروتوكول DAB |
| رفوف الشريحة ويتون وأطباق تلطيخ | TedPella | 21043 | لبروتوكول DAB |
| MASTERFLEX مضخة نضح وأنابيب | كول-Parmer | تستخدم لنضح (1.1.1 و 1.1.2) | |
| Andwin العلمي الأنسجة تك CRYO-OCT مجمع (حالة 12) | فيشر العلمية | 14-373-65 | تستخدم لتجميد الأنسجة (1.2.1) |
| مقياس الحرارة (-50 إلى 50 درجة مئوية) | فيشر العلمية | 15-059-228 | تستخدم لتجميد الأنسجة (1.2.1) |
| ناظم البرد | لايكا | CM3500S | تستخدم لباجتزاء الأنسجة (1.2.2) |
| تلطيخ الصحن، البلاستيك مع 2 اغطية | يبلغ عددها العلمي | 353 | للمستضد retrival |
| 20 مكان تلطيخ الرف، والشرائح الأفقية | يبلغ عددها العلمي | 354 | للمستضد retrival |
| الميكروويف | أي | N / A | للمستضد retrival |
الجدول 1: قائمة المواد.
Discussion
وكان الهدف العام من هذه الاتصالات لإدخال إجراءات المناعية للقارئ. لهذا، مثال مزدوج وضع العلامات مع Iba1 ومولدات المضادات عموم العصبية لمراقبة الخلايا الدبقية الصغيرة والخلايا العصبية في امتصاص العرق perfused ل، تم استخدام السكروز الدماغ cryoprotected، الفئران cryosectioned.
هذه التقنية يمكن تكييفها لخدمة أغراض لا نهاية لها. مجموعة من مستضدات مختلفة في مجموعة متنوعة من أنواع الأنسجة مثل، ولكن لا تقتصر على الدماغ والرئة والكبد والكلى والأمعاء ويمكن تصور immunohistochemically مع تعديلات طفيفة على البروتوكول. المناعية يسمح للمقارنة مباشرة من علامات متعددة، ويمكن أن تشمل ما يصل إلى أربعة أجسام مختلفة في عينة واحدة. عدد الأجسام المضادة المستخدمة في عينة واحدة يقتصر كل تنزف من خلال، الذي يصف تداخل موجات الفلورسنت. هناك عدد محدود من طيف الضوء الفلورسنت، الأمر الذي يحد بالتالي تركيبات تلطيخ داخل كماعينة إنجل (انظر الشكل 6).
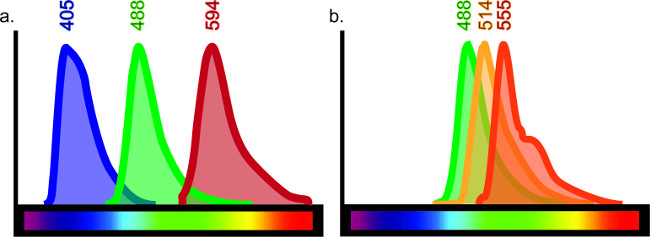
الرقم 6: اللون الطيف الرسم البياني تنبعث كل fluorophore طول موجي معين للضوء عند اثارته ليزر أو مرشح معين. من أجل إنتاج الأنسجة بشكل فعال المسمى متعددة، يجب أن يكون هناك الحد الأدنى من التداخل بين fluorophores محددة مترافق إلى الأجسام المضادة. على الرغم من أن هناك على الأقل 10 fluorophores المختلفة المتاحة في السوق، فإنه ليس من الممكن الحصول على نتائج واضحة في حالة استخدام كل 10. على سبيل المثال، فإن الثلاثي وضع العلامات مع انبعاثات الطول الموجي في 405، 488 و 594 (A) تعطي العلامات واضحة كما أن هناك الحد الأدنى من التداخل، إن وجدت، بين هذه الأطوال الموجية. ومع ذلك، إذا استخدمت الانبعاثات الطول الموجي في 488، 514 و 555، وتلطيخ لن تفسيرها بسهولة حيث أن كل الأجسام المضادة قد يكون متحمس بواسطة الليزر أو يعني تصفية الآخر ( B). هذا من شأنه أن يعطي نتائج شارك في وضع العلامات كاذبة. تتوفر من خلال البحث عن "المشاهد الطيف الفلورسنت" أدلة على الانترنت لاختيار fluorophore.
عند النقر المزدوج وضع العلامات، فمن الأفضل لاختيار الأجسام المضادة الأولية المحرز في الأنواع المختلفة، كما يمكن تطبيقها على حد سواء الأجسام المضادة في وقت واحد. المزدوج وضع العلامات مع اثنين من الأجسام المضادة من نفس النوع هو ممكن، على الرغم من صعوبة من الناحية الفنية. عند إجراء كل من الأجسام المضادة الأولية في نفس النوع، ويجب أن يتم تلطيخ بالتتابع، من خلال استكمال تلطيخ للمستضد واحد قبل الثانية. وعدد أقل من القضايا تنشأ إذا كانت الأجسام المضادة الأولية من نفس الأنواع والطبقات IG مختلفة (أي مفتش الفار الفار والغلوبولين المناعي أو فرعية مختلفة IgG1 وIgG2a). لمزيد من التفاصيل استشارة المراجع 10،11. يستخدم هذا البروتوكول أرنب مكافحة Iba1 والماوس المضادة للعموم العصبية. ومن الضروري أيضا أن تشمل ضوابط السلبية المناسبة. لالمزدوج وضع العلامات مع إيبA1 وعموم العصبية، شريحة واحدة لا تحتوي على الأجسام المضادة الأولية، شريحة واحدة تحتوي على مكافحة Iba1 فقط وشريحة واحدة تحتوي على مضادة للعموم العصبية فقط (انظر الشكل 4). وتؤكد هذه الضوابط السلبية غياب عبر التفاعل وتلطيخ كاذبة. كافة الشرائح الأخرى تحتوي على كل الأجسام المضادة الأولية. ومن المهم أيضا تجنب استخدام الأجسام المضادة الثانوية التي قد تعبر في رد الفعل. على سبيل المثال، وذلك باستخدام حمار المضادة للأرنب أرنب 594 ومكافحة فأر 488 شأنه أن يؤدي إلى حمار المضادة للأرنب 594 ملزمة لكلا أرنب الأجسام المضادة الأولية مكافحة Iba1 وحمار المضادة للأرنب 594 المضادة للماوس 488 الضد الثانوية. وهذا من شأنه خلق كاذبة شارك في وضع العلامات.
الأجسام المضادة لبروتين معين (المستضد) ليست دائما هي نفسها. على سبيل المثال، تثار بعض الأجسام المضادة ضد المستضدات التي هي موجودة في الأنسجة المجمدة، في حين أن الآخرين سوف تتعرف على المستضد الذي تم تغيير أثناء عملية البارافين التضمين. لهذا السبب، ينبغي إيلاء اهتمام خاص إلى tانه الأضداد ورقة المواصفات قبل الشراء. إذا لم يتم سرد التطبيق المقصود للأجسام المضادة، قد تكون هناك حاجة إصلاح الأعطال للحصول على تلطيخ، أو تلطيخ قد لا تعمل على الإطلاق. بالإضافة إلى ذلك، قد البيانات المنشورة سابقا تقدم "الحيل للتجارة" للحصول على تلطيخ. أهمية هو أن نلاحظ أن الفروق الدقيقة يمكن أن ينظر إليها على دفعات مختلفة من الأجسام المضادة. قد تحتاج تعديلات طفيفة ليكون مع كل إعادة ترتيب للجسم.
معظم الأجسام المضادة جيدة لمدة 12 شهرا من تاريخ الاستلام. ومن المؤكد أن تشير إلى تاريخ وصوله على ورقة مواصفات المنتج. إن لم يكن لوحظ تلوين الأجسام المضادة، قد تكون الأجسام المضادة قديمة جدا أو تخزينها بشكل غير صحيح. ولذلك فمن المهم أيضا أن تحقق ورقة مواصفات كل الأجسام المضادة للتخزين السليم.
بالإضافة إلى ذلك، بالنسبة لكثير من الأجسام المضادة، تتوفر استنساخ مختلفة. استنساخ المختلفة الاعتراف أجزاء مختلفة من المستضد من الفائدة. Aقد يكون استنساخ تعطى أفضل للأنسجة يتعرضون لتقنيات معالجة مختلفة (/ المجمدة جزءا لا يتجزأ من الشمع)، الهدف نوع الأنسجة، أو الأنواع المستهدفة. إيلاء اهتمام خاص إلى الأنواع التي أثيرت الأجسام المضادة. عند رفع الأجسام المضادة في نفس الأنواع الأنسجة للتحليل، يمكن ملاحظة خلفية عالية. لمكافحة هذه، حجب إضافي مع مجموعات المتاحة تجاريا مثل الماوس على عدة الماوس، قد تكون هناك حاجة لتلطيخ. ويمكن أيضا أن هذا الأسلوب يمكن تكييفها لزراعة الخلايا. تثبيت الخلايا، استنساخ وخصوصية تحتاج إلى أن يتم التحقق على ورقة مواصفات التطبيقات.
تثبيت مع امتصاص العرق عبر الروابط البروتينات، والتي يمكن أن تخفي مستضد مواقع ربط في بعض الظروف. استرجاع مستضد قد تكسر البروتينات عبر وصلات ويعرض مواقع الربط. إذا كنت بحاجة استرجاع مستضد، إدراج بروتوكول التالية بعد الخطوة 2.1.3: باستخدام طبق تلطيخ البلاستيك وإدراج (انظر الجدول 1)، والشرائح الميكروويففي المخزن سيترات على إعداد منخفض الطاقة لمدة 10 دقيقة، مع الحرص على عدم السماح لليغلي حل صارم (مستويات طاقة محددة غير المدرجة بسبب التباين في إعدادات بين الموجات الدقيقة). بالتناوب، وجلب عازلة سيترات إلى 80 درجة مئوية في طبق زجاج تلطيخ في الفرن، ثم تضاف شرائح لمدة 10 دقيقة.
سوء نوعية الأنسجة ويمكن أيضا أن يسبب مشاكل مع تلطيخ (انظر الشكل 5). هناك عدد من الاحتياطات واحد يمكن اتخاذها لتجنب المساومة على جودة الأنسجة. أولا، والتحلي بالصبر والمثابرة مع التغييرات السكروز من أجل تهجير بدقة الماء في الأنسجة قبل التجميد. عندما تجميد، والحفاظ على درجة حرارة ثابتة. إذا تجمد الأنسجة ببطء شديد، فإن جزيئات الماء توسيع لأنها تجمد، وخلق ثقوب في الأنسجة. بالتناوب، وتجميد بأسعار منخفضة جدا في درجة الحرارة سيتسبب في الأنسجة للقضاء.
وبروتوكولات تختلف قليلا عن كل الأجسام المضادة من الفائدة. عند استلام الضد الجديد، يجب على المرء أن يختار imize البروتوكول وفقا لذلك. إذا خلفية عالية (الشكل 5)، حاول عرقلة لفترة أطول من الزمن. بالتناوب، وزيادة تركيز مصل الدم من حل كتلة أو إضافة مصل من عدة مختلفة مثل أنواع الماعز والأرانب المصل. بالإضافة إلى ذلك، يمكن استخدام الكازين للحد غير محددة وملزمة. الحليب الخالي من الدسم (مصنوعة من مسحوق جاف) يحتوي على الكازين ويمكن استخدامها في مجموعة من تركيزات (عادة 1-5٪ ث / ت). الحليب يمكن أن تستخدم وحدها أو بالاشتراك مع المصل. إذا كان المستضد من الفائدة هو علامة داخل الخلايا، مثل المنظفات في TritonX-100 أو توين-20 يمكن أن تضاف إلى عرقلة الحل لpermeabilize أغشية الخلايا. أقسام الأنسجة سمكا يمكن معالجتها مماثل العائمة أقسام الأنسجة في الآبار بدلا من تصاعد لهم على الشرائح. ويمكن أيضا أن تتم معالجة الأنسجة جزءا لا يتجزأ من البارافين بالمثل، ولكن يتطلب خطوة الصبح دي السابقة للحجب. Feldengut وآخرون. 12 عناوين كل من هذه الأساليب.
"jove_content"> نظرا لطبيعة الحساسة للضوء من الأجسام المضادة الفلورسنت، فمن الأهمية بمكان أن الأجسام المضادة الفلورسنت يتم تخزينها في حاويات المظلمة وتجنب التعرض للضوء التالية حضانة الأجسام المضادة الثانوية. في المقابل، عند استخدام DAB كعامل النامية، التعرض للضوء ليست ضارة. تلطيخ الفلورسنت محدودة في طول العمر. يجب أن يتم تخزين الشرائح الفلورسنت الملون في مربع ضيق خفيف في 4 ° C. وينبغي أن الصور الملتقطة في غضون شهر من تلطيخ. إذا التصوير الفوري غير ممكن، والنظر DAB أو أساليب تلطيخ بديلة أخرى أو تأخير تلطيخ حتى من الممكن التصوير. تلطيخ مع DAB عادة ما يقتصر على تلطيخ واحد المستضد الهدف، في حين مضان يسمح مزدوج وثلاثي وضع العلامات. لا يمكن أن يتحقق مزدوج وثلاثي وضع العلامات باستخدام DAB ولكن هذا الأسلوب هو عرضة للمضاعفات وصعوبة في عزل تلطيخ مستضد معين. ويمكن تصوير DAB تلطيخ تحت المجهر مشرق الميدان، في حين أن التصوير الفلورسنت الصورةيتطلب taining المجهر الفلورسنت.
عامل آخر أن يأخذ في الاعتبار مع DAB تلطيخ هو أن خلايا تمتد طبقات متعددة من الأنسجة. ولذلك فمن الصعب الحصول على صور واضحة من الخلايا مثل الخلايا الدبقية الصغيرة التي لديها عمليات الممتدة. للتغلب على هذه المشكلة، وقطع بعض المحققين أقسامها أرق في 8-12 ميكرون.
وأفضل طريقة لتحقيق التصوير من الأنسجة fluorescently المسمى على المجهر متحد البؤر. المجاهر مبائر القضاء على ضباب ينظر عادة مع المجهر الفلورسنت البحث من خلال عزل والاستيلاء على طائرة واحدة من التركيز داخل العينة. مع المجهر متحد البؤر، التفاصيل الدقيقة هي أكثر وضوحا وخفضت تنزف من خلال بين الأصباغ الفلورية. عينات سمكا ولا يمكن تصوير طائرة في وقت واحد (ض المكدس) لإثبات حقيقي شارك في التعريب. عندما الوصول إلى مجهر متحد البؤر غير متوفر، والتصوير على المجهر البحث هو ممكن، ولكن التعرض الوقت وشدة الضوء بحاجة إلى أن تكون في الموضعرطة بين الصور.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l'Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira's basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved