Method Article
ミクログリアとニューロンのための例染色:凍結切片ラット脳組織の免疫組織化学のためのプライマー
要約
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
要約
免疫組織化学は、 その場での抗原の存在、位置、および相対的な存在量を検出するために広く用いられている技術です。この入門レベルのプロトコルは、試薬、装置、一例として、ミクログリアおよび神経要素のためのマーカーを用いて、げっ歯類の脳組織の免疫組織化学的染色を完了するために必要な技術を記載しています。具体的には、本論文では、それぞれIBA1と汎神経、免疫組織化学のために介してミクログリアと神経細胞の蛍光可視化するためのステップバイステップのプロトコルです。蛍光二重標識は、正確な細胞型、受容体、リガンドの間の相互作用を観察する機会を提供し、同じ試料中の複数のタンパク質の局在化のために特に有用であり、及び/又は互いにならびにタンパク質共に関連する細胞外マトリックス単一細胞内の局在。他の可視化技術とは異なり、蛍光免疫組織化学染色の強度が低下することがで適切な予防措置が取られない限り、染色後数週間から数ヶ月。蛍光はより多くの時間が効率的であり、2つ以上の間でより正確な区別を可能にするように、この制限にもかかわらず、多くの用途において蛍光二重標識は、3,3'-ジアミノベンジジン四塩酸塩(DAB)またはアルカリホスファターゼ(AP)などの選択肢よりも好ましいですマーカー。議論は成功を促進するために、トラブルシューティングのヒントやアドバイスが含まれています。
概要
免疫組織化学は、目的の抗原に特異的に結合する一次抗体を用いて、組織切片中の抗原( すなわち、タンパク質)を検出するための処理です。免疫組織化学は、彼は抗体が大きな特異性1と抗原を局所化できることを決定し1934年にJR Marrackによって開拓されました。 1942年に始まって、免疫組織化学を可視化する蛍光抗体を用いた研究in vitroでの最初の一部は、 生体組織化学的研究では 、まず、4を発表した後の2,3を 、発表されました。 1960年代の間に、三十年免疫組織化学的方法の開始後に、酵素標識抗体を二次試薬として使用されるようになりました。これらの方法は、同時に独立し、フランスと米国の5,6に開発されました。今日では、抗体の広い配列は、免疫組織化学研究の7のための無限の可能性を提供します。
">この対応の全体的な目標は、免疫組織染色への簡単な紹介を提供することにある。それは、この技術の包括的かつ徹底的な見直しとなるものではありません概説した方法では、2つの抗原のための免疫組織化学的技術は、ミクログリアのために(マーカーを提示しています。パラホルムアルデヒド灌流、スクロース凍結保護、凍結切片ラットの脳の染色のためのニューロン)。免疫組織化学染色は、バックグラウンド染色を低減するために非特異的抗原を遮断することから始まる。次に、一次抗体とのインキュベーションは、組織内の特定の抗原に結合することができます。一次抗体に続いて、別の抗体、二次抗体と呼ばれる、共役可視化信号8に一次抗体をリンクするために適用される。二次抗体は、一次抗体が発生された種に特異的な免疫グロブリンG(IgG)ドメインを標的とする。二次抗体は、シグナルを増幅します一次抗体のTののFab領域のため、彼一次抗体のIgGのドメイン上の複数のサイトへの二次抗体に結合します。二次抗体のF C領域に結合させ、酵素または蛍光分子は、可視化を可能にします。例えば、ウサギ抗IBA1一次抗体はIBA1に特異的なウサギIgG分子です。ロバ抗ウサギIgGを二次抗体として適用した場合、それを認識し、ウサギ抗IBA1 IgGの複数の領域( 図1参照)に結合します。ロバ抗体は、種々の方法によって可視化することができます。この対応は、蛍光顕微鏡により可視化するために、一次抗体を認識する二次抗体にコンジュゲート蛍光団の検出に焦点を当てています。蛍光免疫組織化学では、例えば、ヘキスト又はDAPIなどの核染色はすべての核を可視化するために使用することができます。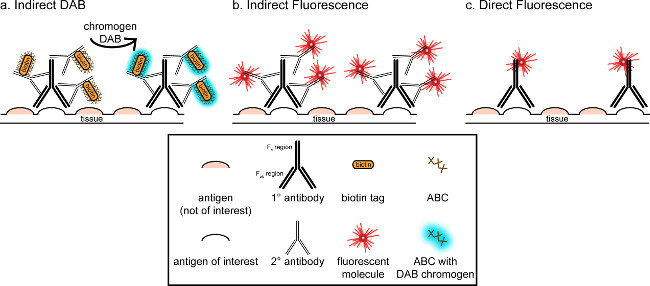
図1:のSch直接対間接的な抗体の標識技術のematic表現抗体は、目的の抗原に結合し、一次抗体の種に対して惹起二次抗体によって増幅することができます。この技術は、増幅およびDAB可視化のための(A)、または直接結合蛍光二次抗体(B)は、アビジン-ビオチン複合体(ABC)を用いて行うことができます。あるいは、一次抗体を直接ビオチンまたは蛍光団(C)を含む多くの異なるタグを用いて結合させることができる。 この図の拡大版を表示するには、こちらをクリックしてください。
免疫組織化学的染色を視覚化するための別の方法は、(DAB、 図1および図2を参照)3,3'-ジアミノベンジジンテトラヒドロクロライドを使用しています。これは、ビオチン化を用いて、蛍光とは異なる、または明視野顕微鏡下に表示されている沈殿物にDABを変換する酵素を提供するホースラディッシュペルオキシダーゼ(HRP)結合二次抗体。単一の抗原に関心があるか、染色が長く持続することが要求される事例では、DABは、蛍光染色よりも適切な場合があります。しかし、DAB染色は、2つの核抗原が注目されている場合は特に、複数のマーカーの間の区別には適していません。 DAB材料およびプロトコルの変更については、 表1を参照してください。代わりに、ニトロブルーテトラゾリウムクロリド/ 5-ブロモ-4-クロロ-3-インドリルホスフェート(NBT / BCIP)は、アルカリホスファターゼ(AP)を可視化するために用いることができる共役二抗体。

図2:ニッケル強化DAB単一標識ラット脳組織切片の代表的な画像ラット脳SEIBA1用ニッケル強化DAB(A)で標識し、汎神経されctions(B)は、単独でミクログリアまたは神経細胞の長期的な分析を可能にします。スケールバーは20μm。 この図の拡大版を表示するには、こちらをクリックしてください。
一つは、分析されている組織内の目的の抗原の推定豊かさを考慮する必要があります。間接的な方法には、(上記のように)低量と目標のために有用です。目的の抗原が多量である場合、直接法を適用することができます。直接法は、直接可視化信号に結合している一次抗体を伴う、したがって、二次抗体は必要ありません。この方法は、染色プロセスを簡略化するが、間接的な方法によって達成増幅を排除します。直接結合一次抗体を使用すると、二次抗体の交差反応性を排除しますときに二重標識。
この通信は、IBA1とパンニューロン( 表1の詳細)で二重標識のためのプロトコルの詳細について説明します。 IBA1は分岐し、ハイパー分岐し、活性化され、アメーバ状、及びロッドを含む多くの活性化状態において、ミクログリアを染色します。汎神経汚れ神経の軸索、樹状突起、およびソーマ。 IBA1が最もミクログリアとパン神経標的ニューロンを染色するので、汚れのこの組み合わせは、ミクログリア - ニューロン相互作用の広範な理解を得るのに有用です。
要するに、免疫組織化学染色は、抗体の慎重な選択に依存しています。調査の質問は、より具体的になるように、代替の抗原に対して惹起された抗体が所望され得ます。特定のミクログリアの活性化状態をターゲットとするためには、むしろIBA1よりも、CD45またはCD68抗体を使用することを選択することができます。また、マウスでの作業中に、F4 / 80は、必要な結果を提供することができます。同様に、神経細胞の要素は、具体的には、抗体のRAで標的とすることができます核に対するised、シナプス(前または後)、軸索と成長円錐。さらに、ニューロン(ダブルコルチン、のNeuN)の年齢を区別する他のマーカー、および神経再生(GAP-43)があります。
プロトコル
注:すべての手順は、アリゾナ大学の施設内動物管理使用委員会(IACUC)に準拠して実施しました。推奨される材料および機器のリストを 、 表1に見ることができます。
1.組織標本
- かん流
- ペントバルビタールナトリウム(25mgの/ kgのIP)の過剰摂取と齧歯類を安楽死させる、8 ml /分の流速で完全に放血(3-5分)まで、リン酸緩衝生理食塩水(PBS)で経灌流。徹底的灌流手順については、ゲージら2012 9を参照してください。
- 即時/分で8ミリリットルの流速で15〜20分間、PBS中の4%パラホルムアルデヒドで灌流することにより、組織を固定する、PBSフラッシュを以下。
- (順番に、15%、30%、30%と、生理食塩水緩衝トリスで調製した)傾斜スクロース溶液、続いて、24時間、4%パラホルムアルデヒド中で脳と場所を削除4℃。その後のスクロース溶液Oに脳を転送NLY脳の後、各溶液中に沈めました。注:通常、各溶液中の5日は、シンクする組織のために十分な時間です。
- 組織の凍結および凍結切片化
- このようなOCT化合物として、メディアを埋め込むには、脳を置き、-35℃の温度でイソペンタンに沈めます。脳は最低10分間凍結し、次いで-80℃で保存することができます。温度に勤勉が取られていない問題が発生する場合があります。トラブルシューティング情報を説明を参照してください。
- 20μmの厚さ、-20℃の温度で連続冠状断面をカットします。正に荷電したスライド上に組織を収集します。脳切片を-80℃でジップトップバッグと格納されている長期的に箔に包まれたスライドボックス内に配置することができます。ストレージのこの方法は、空気や霜への暴露を防止するために、二重の境界線を作成します。
2.組織処理
注:例の機器や材料R染色のためにequiredは、図3に示されている。代替が利用可能である、しかしながら、これらの画像は、免疫組織化学的染色に新しいものの前に適切な購買アイテムを可視化するために役立ちます。

図3:スライドは、箔のボックスをラップする必要がなく、光から保護されているように、免疫組織化学染色のために必要な例の項目(A)に示したブラックボックスは、免疫蛍光のための理想的な湿度室です。切片化後、スライドは、(B)に示すように黄色のボックスのボックスに保存することができます。ホイルでしっかり箱を包む前冷凍庫にジップトップバッグに配置すると、冷凍焼けから組織サンプルを保護するのに役立ちます。スライドの例は、E(異なる染色皿(D)に示されていると、(C)に示され)。カバーガラスの厚さが1.2カバースリップは、ほとんど直立共焦点顕微鏡で撮影素晴らしい結果を提供する、大きさ及び厚さ(F)に変化することができます。このような(G)に示すような鉛筆スライドを標識するために使用することができます。インクを実行できるように恒久的なマーカーは、染色およびサンプルが何であるかを決定する能力の両方に影響を与え、避けるべきです。それは(H)に示すようなミニPAPペンは撥境界がスライド上に描画することが可能になります。
- スライドの準備
- 室温で冷凍庫と解凍からスライドを削除します。
- オプション:セクションは、以前はスライドから浮いている場合は、スライドをオフに浮遊からの組織切片を防ぐためにこれ以上の4以上時間60℃のオーブン中で解凍したスライドを配置します。
- スライドラックとそれに対応する皿にスライドを配置します。
- 洗浄は、洗浄の間に溶液を変え、5分ごとに、PBSで3回スライドします。前進このステップから、sectiを回避長期間のための液体を取り付けずにONS。注意:セクションが乾燥した場合、バックグラウンド染色が増加し、意味のあるデータを確実に得ることができません。
- 室温で冷凍庫と解凍からスライドを削除します。
- 組織染色
- 光を通さない染色ボックスで、脱イオン水で浸したリントフリー組織と「湿度室」を作成。
- 離れた組織切片から、スライドの非常にエッジに撥液性の境界線を作るためのミニPAPペンを使用し、糸くずの出ない組織とスライドの端を乾燥させます。この境界線は、液体のメニスカスと、その表面張力は染色に影響を与えないように、組織の縁部との間に十分なスペースを確保する必要があります。
注:目的の抗体は、マイクロ波抗原検索を必要としない場合は、PAPペン撥ボーダー前2.1.3に適用することができます。 PAPペンをPBS中で洗浄する前に適用されている場合は、撥液性の境界の整合性は、この段階でチェックする必要があります。国境のギャップを埋めるためにミニPAPペンを使用してください。 、ブロック非特異的抗原は、PBS(ブロッキング溶液)中の4%(v / v)の血清中でインキュベートすることにより結合します。室温で1時間のために、スライド当たりブロック溶液をピペットを300μl。ブロック·ソリューションは、スライドの端のPAPのペンに延びており、完全に組織の近くに表面張力によって引き起こされる不均一な染色を避けるために、組織をカバーしていることを確認します。 - 二次抗体が作られているのと同じ種からの血清を使用してください。注:この手順では、二次抗体は、ロバで行われ、したがって、ロバ血清が使用されます。二つ以上の異なる種に由来する二次抗体を使用する場合は、それぞれの種からの血清を含みます。
- スライド上に一次抗体をピペット。注:この染色のための抗体の濃度が1で最適化されています:5000および1:それぞれIBA1とパン神経500、。これらの濃度は、バックグラウンド染色が存在しないと意味のある染色を示すことが見出されています。
- にブロック溶液を希釈1%のPBS中の血清および一次抗体を追加します。スライドごとに1%の血清中の一次抗体溶液を300μlをピペット。ここでも、流体は、PAPペンの端にあることを確認してください。 4℃で一晩インキュベートします。
- IBA1も汎神経も抗体を含有するもの、汎神経抗体なしIBA1と1、およびIBA1なしの汎神経抗体と1:3つの制御スライドを含めます。しかし、二次抗体の非特異的結合をテストするために、一次抗体を省略し、同じソリューションと同じ実行中にこれらのスライドを染色します。
- 翌朝、洗浄は洗浄の間に溶液を変更し、5分ごとに、PBSで3回スライドさせます。
- 蛍光抗体は前進このステップから、黒や暗所でインキュベートされているか、洗浄容器が箔とのハイブリダイゼーションボックスに包まれて保証することにより、露光量を最小限に抑えるため、光に敏感です。すべてのスライドに適切な二次抗体をピペットインキュベート光を通さない「湿度室」のブロック溶液中の250(ステップ2.2.3を参照)(ステップ2.2.1を参照してください):1の濃度で室温で60分。
- 波長の異なる二次抗体を使用してください。ここでは、一次抗体ウサギ抗IBA1ために、適切な二次抗体としてロバ抗ウサギ594を使用しています。一次抗体マウス抗パン神経については、適切な二次抗体としてロバ抗マウス488を使用しています。あるいは、抗ウサギ488及び抗マウス594を使用しています。
- 洗浄は、5分ごとに、PBSで3回スライドします。
- オプション:核染色を行います。
- 正確に60秒間の二重蒸留H 2 0で0.03μg/ mlの濃度でヘキストに入れ(または他の核染色)。
- 洗浄は、5分ごとに、PBSで3回スライドします。
- のddH 2 0で洗浄します。
- カバースリップ
- このようなフルーア水性マウント媒体とカバーガラススライド、omount-GまたはProlongGold。綿棒を使用して、すべての気泡を除去するように注意してください。
注:他の取り付け剤を使用することができた、しかし高ブリードスルー色素間は、カバースリップの日以内に、いくつかのことで注目されています。 - 蒸発による乾燥からセクションを防止、エッジをシールするために透明なマニキュアを使用してください。スライドは平坦では室温に放置し、その後、4℃でホイルで包み遮光容器に保管しながらマニキュアは遮光容器に乾燥することができます。
- このようなフルーア水性マウント媒体とカバーガラススライド、omount-GまたはProlongGold。綿棒を使用して、すべての気泡を除去するように注意してください。
3.ステンド組織を画像
- 顕微鏡検査
- 暗い部屋で行われるべき、マニキュアは、顕微鏡検査を開始する前に少なくとも1時間乾燥することができます。
- 蛍光光源とデジタルカメラアタッチメントと共焦点や研究顕微鏡を用いて顕微鏡写真を取得します。付属のソフトウェアを使用して、各波長の露光設定 - 405、488、594 - 別途。注:徹底的イメージング命令は顕微鏡メーカーからオンラインで利用可能であるべきです。
- セクションを移動したり、フォーカスを調整することなく、各チャネルの顕微鏡写真を取得します。カラーの画像を取るか、または交互にグレースケールで、その後色に変換します。
注意:色または各チャンネルからグレースケール画像を後処理にまとめることができます。 - セクションの光退色が発生するように、組織切片を長時間、周囲光や顕微鏡の光にさらされないことを確認してください。これを避けるために、増大する光/レーザー強度ではなく、露光時間を増加させます。
- オンされてから30分以内に蛍光光源をオフにしないでください。
注:立て続けにオンとオフのソースを切り替えるには、蛍光灯の寿命が低下することがあります。
結果
この染色プロトコルミクログリア蛍光594チャネル(赤)で標識されているラット脳組織切片をもたらし、488チャンネルで標識されたニューロン(緑は、 図4を参照します)。核染色が行われた場合には、チャネル405(青)で表示されます。画像は、異なるチャネルに取り、3つのチャネルの直接比較のために重ね、または2つのチャンネル間ことができます。多くのデジタル取得ソフトウェアスイートは、この機能が含まれます。 IBA1とここに示されている汎神経マーカーで二重標識は、皮質層全体で明らかに長い細かい神経突起を、主に分岐したミクログリアを示しています。
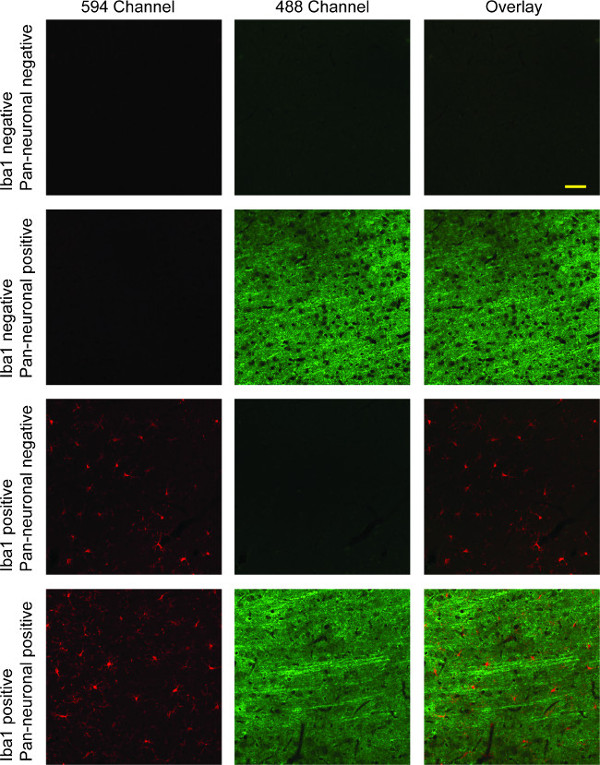
図4:伊庭-1 /パン神経二重標識柱1 の代表的な共焦点蛍光画像は IBA1(赤)で染色したミクログリアを示しています。ニューロンはに示されています3列目の赤と緑のチャネルの両方のオーバーレイ画像と緑の2番目の列、。最初の行では、両方の一次抗体の非存在に起因する特異的染色の完全な欠如があります。 3行目は、どちらの場合も、交差反応性の完全な欠如と、ミクログリアのためIBA1の特異性を示しているのに対し、2行目には、神経細胞の染色のための汎神経一次抗体の特異性を示しています。 4行目は、ミクログリアおよび神経染色の両方を示す2つのチャネルのオーバーレイで二重標識を示しています。スケールバーは50μm。
悪い染色結果は、明確に定義された細胞体および断片化ミクログリア/神経突起の欠如によって証明されるように、( 図5)に示されています。高バックグラウンドは低品質の染色を示し、および抗体の非特異的な共局在( 図5参照)で見ることができます。また、信号は、蛍光バウンドstreptavidiと増幅工程、弱い場合nが組み込まれ得ます。代わりに、ステップ2.2.6で直接タグ付けされた蛍光二次抗体を使用するのではなく、ビオチン化二次が適用されます。 PBSで洗浄後、ストレプトアビジン(PBS中1:1000)を1時間スライド上でインキュベートします。次いで、スライドを、対比やカバー滑っで洗浄し、浸漬するステップ2.2.7でプロトコルに戻ります。
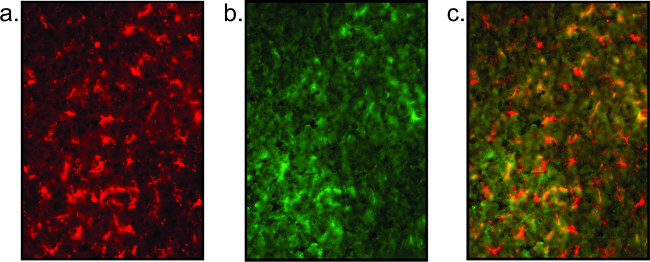
図5:悪い組織の質の代表的な蛍光画像ここに示されているが、ミクログリアの染色(a)および神経染色(B)の完全な欠如を明確性の欠如をもたらす悪い組織における染色の一例です。この神経細胞の染色は、単純に高いバックグラウンドです。オーバーレイされた画像(c)は、意味がありません。
| 材料/機器の名称 | 会社 | カタログ番号 | コメント/説明 |
| FisherbrandをSuperfrostプラススライドガラス | フィッシャーサイエンティフィック | 22-034-979 | 取付組織(1.2.2)の中古 |
| オーブン | サーモサイエンティフィック | 51028112 | 組織乾燥のために使用される(2.1.1) |
| ミニパップペン | ライフテクノロジーズ | 00から8877 | ステップ2.2.2で使用 |
| Andwin科学組織-TEKスライド染色ディッシュ | フィッシャーサイエンティフィック | 22-149-429 | ヘキストステップと同様に、(2.2)染色中にすべての洗浄に使用される(2.2.8) |
| キムワイプ | フィッシャーサイエンティフィック | 06から666-A | 乾燥スライド(2.2)のために使用 |
| ブラック染色ボックス | テッド·ペラ | 21050 | (2.2)をブロックし、染色工程の中古 |
| 正常ロバ血清 | フィッシャーサイエンティフィック | 50-413-253 | (2.2)ブロックし、抗体インキュベーションのために使用 |
| マウスα-汎神経 | ミリポア | MAB2300 | 一次抗体(2.2.4)に使用されます |
| ウサギα-IBA1 | 和光ケミカル | 019から19741 | 一次抗体(2.2.4)に使用されます |
| αウサギ594ロバ | ジャクソンイムノリサーチ | 711-585-152 | 二次抗体(2.2.6)に使用されます |
| ロバαマウス488 | ジャクソンイムノリサーチ | 715-545-150 | 二次抗体(2.2.6)に使用されます |
| 仕出し屋の箔 | 任意の | N / A | ステップ1.2.2と2.3.2で使用されます |
| Fluoromount-G | サザンバイオテック | 0100-01 | カバーガラスに使用される(2.2.8) |
| カバーガラス | フィッシャーサイエンティフィック | 12544E | カバーガラスに使用される(2.2.8) |
| 透明マニキュア | 任意の | N / A | カバーガラスに使用される(2.2.8) |
| アクシオObserver.Z1とLSM 710(レーザー走査共焦点) | カールツァイス | N / A | (3)画像化のために使用 |
| AXIOSKOP A2 | カールツァイス | N / A | (3)画像化のために使用 |
| CitriSolv | FisherScientific | DABプロトコルの場合 | |
| ABC | ベクターラボラトリーズ | PK-6100 | DABプロトコルの場合 |
| DABペルオキシダーゼキット | ベクターラボラトリーズ | SK-4100 | DABプロトコルの場合 |
| ビオチン化ウマのαウサギIgG | ベクターラボラトリーズ | BA-1100 | DABプロトコルの場合 |
| ビオチン化ウマαマウスIgG | ベクターラボラトリーズ | BA-2001 | DABプロトコルの場合 |
| 30%過酸化水素 | FisherScientific | H325-500 | DABプロトコルの場合 |
| ウィートンスライドラックおよび染色料理 | TedPella | 21043 | DABプロトコルの場合 |
| マスターフレックス灌流ポンプとチューブ | コール - パーマー | 潅流(1.1.1および1.1.2)に使用 | |
| Andwin科学的組織-TEK CRYO-OCT化合物(12例) | フィッシャーサイエンティフィック | 14-373-65 | 凍結組織(1.2.1)の中古 |
| 温度計(-50〜50℃) | フィッシャーサイエンティフィック | 15-059-228 | 凍結組織(1.2.1)の中古 |
| クライオスタット | ライカ | CM3500S | 組織切片(1.2.2)に使用されます |
| 2蓋で皿、プラスチックを染色 | Grale科学 | 353 | 抗原retrival用 |
| 20プレイス染色ラック、スライドヨコ | Grale科学 | 354 | 抗原retrival用 |
| 電子レンジ | 任意の | N / A | 抗原retrival用 |
表1:材料リスト。
ディスカッション
この通信の全体的な目標は、読者に、免疫組織化学の手順を導入することでした。このため、IBA1とパン神経抗原と二重標識の例は、ミクログリアおよび灌流パラホルムアルデヒド中でニューロンを観察するために、スクロース凍結保護、凍結切片ラットの脳を使用しました。
この技術は、無限の目的を果たすように構成することができます。脳、肺、肝臓、腎臓および腸に限定さなどではなく、組織型の様々な異なる抗原の配列は、プロトコルを微調整して免疫組織化学的に可視化することができます。免疫組織化学は、複数のマーカーの直接比較を可能にし、単一のサンプル内の4つの異なる抗体まで包含することができます。一つのサンプルで使用される抗体の数は、ブリードスルー、蛍光波長の重複説明によって制限されます。その結果として内染色の組み合わせを制限する制限された蛍光の光スペクトルは、ありますイングルサンプル( 図6を参照)。
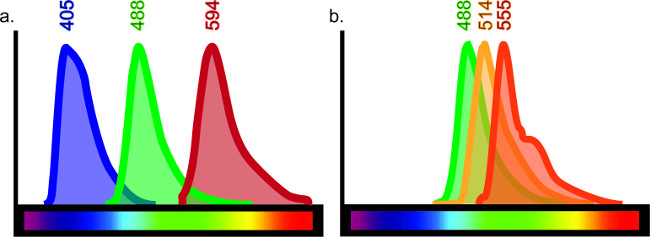
図6:カラースペクトルチャート特定のレーザーやフィルターによって励起されると、各フルオロフォアは、特定の波長の光を発します。効果的にマルチラベルされた組織を生成するために、抗体に結合特定のフルオロフォアの間の最小の重なりがあるはずです。市場で入手可能な、少なくとも10個の異なるフルオロフォアがあるが、それはすべての10を使用する場合明らかな結果を得ることができません。最小限の重複があるように、もしあれば例えば、405、488および594での波長の排出量(A)と三重標識はこれらの波長間に、明確な標識を与えるだろう。 488、514および555の波長の排出量を使用した場合は、各抗体は(レーザーによって励起またはフィルタは、他のために意味することができるようにしかし、染色が容易に解釈されません B)。これは、偽の同時標識の結果を与えるだろう。フルオロフォア選択のためのオンラインガイドは、「蛍光スペクトルビューアー」を検索してご利用いただけます。
ときに二重標識抗体の両方を同時に適用することができるように、それは、異なる種で行われた一次抗体を選択するのが最善です。技術的に困難であるが、同じ種から2抗体を用いた二重標識は、可能です。両方の一次抗体は、同じ種で作られていた場合、染色は、第二の前に一つの抗原のための染色を完了することによって、連続的に行わなければなりません。同じ種からの一次抗体が異なるのIgクラス( すなわち、マウスIgG、マウスIgMまたは異なるサブクラスのIgG1およびIgG2a)を持っている場合は、より少ない問題が発生します。詳細については、追加の参照10,11を参照してください。このプロトコルは、ウサギ抗IBA1およびマウス抗パンニューロンを使用しています。これは、適切な陰性対照を含めることも必要です。 IBに二重標識のためのa1と汎神経、1スライドには一次抗体を含まない、1のスライドは、抗IBA1だけと一つのスライドのみ抗汎神経含まれています( 図4を参照)が含まれています。これらのネガティブコントロールは、交差反応性と偽の染色がないことを確認します。他のすべてのスライドは、両方の一次抗体が含まれています。これは、交差反応することができる二次抗体を使用しないようにすることも重要です。例えば、ウサギ抗IBA1一次抗体とロバ抗ウサギ594抗マウス二次抗体488の両方に結合ロバ抗ウサギ594をもたらすロバ抗ウサギ594およびウサギ抗マウス488を使用して。これは、偽の同時標識を作成します。
特定のタンパク質(抗原)に対する抗体は必ずしも同じではありません。他のものは、パラフィン包埋処理中に変更された抗原を認識し、一方、例えば、いくつかの抗体は、凍結組織中に存在する抗原に対して産生されます。このため、特に注意をtに支払われるべきです彼は購入前に仕様書を抗体です。抗体のための意図された用途が表示されない場合は、トラブルシューティングには、染色を得るために必要とされてもよいし、染色は全く動作しない場合があります。また、以前に公開されたデータは、染色を得るために、「貿易のトリック」を提供することがあります。注意すべき重要なことは微妙な違いが、抗体の異なるバッチに見ることができるということです。わずかな変更は、抗体の各リオーダーで行うことが必要になる場合があります。
ほとんどの抗体は、受領した日から12ヶ月に適しています。製品仕様書の到着日を示すようにしてください。抗体染色は観察されない場合、抗体は、古すぎるか、正しく格納されてもよいです。これは、適切な保存のために各抗体の仕様書を確認することも重要です。
さらに、多くの抗体のために、異なるクローンが利用可能です。異なるクローンは、目的の抗原の異なる部分を認識する。 A指定されたクローンは、異なる処理技術を施した組織についての方が良いかもしれ(ワックス包埋/冷凍)、組織型、または標的種を対象としています。抗体が上昇した種には、特に注意してください。抗体は、分析のための組織と同じ種に発生した場合、高いバックグラウンドが観察され得ます。これに対抗するために、マウスキットのマウスのような市販のキットと追加のブロッキングは、染色のために必要となる場合があります。この技術は、細胞培養に適合させることができます。細胞の固定、クローンおよび特異性は、アプリケーションのための仕様書で確認する必要があります。
いくつかの条件で抗原結合部位を隠すことができるパラホルムアルデヒド架橋タンパク質、で固定。抗原回復は、タンパク質架橋を破壊し、結合部位を露出させることができます。抗原回復が必要な場合は、ステップ2.1.3の後に以下のプロトコルを挿入する:( 表1を参照)、プラスチック染色皿を使用して挿入し、マイクロ波スライド厳密解の沸騰をさせないように注意しながら10分間、低電力設定にクエン酸緩衝液で(特定の電力レベルが原因で、マイクロ波の間の設定の変動に含まれていません)。あるいは、その後10分間スライドを追加、オーブンでガラス染色皿に80℃にクエン酸緩衝液をもたらします。
悪い組織の品質も染色( 図5参照)で問題を引き起こす可能性があります。一つは、組織の品質を損なうことを避けるために取ることができる予防策がいくつかあります。まず、完全に凍結前組織内の水を置換するために、ショ糖変化と患者と勤勉です。凍結すると、温度を一定に保ちます。組織があまりにもゆっくりとフリーズする場合、彼らは凍結するように、水の分子は、組織内の穴を作成し、拡大していきます。代わりに、低すぎる温度で凍結する組織に亀裂が発生します。
プロトコルは、目的の各抗体について若干異なります。新規抗体を受信すると、一つ選ぶ必要がありますそれに応じてプロトコルをマイズ。背景が( 図5)が高い場合には、時間の長い期間のためにブロッキングしてみてください。代わりに、ブロック溶液の血清濃度を増やすか、複数の異なる種、例えばヤギとウサギ血清からの血清を追加します。また、カゼインは、非特異的結合を減少させるために使用することができます。 (乾燥粉末から作られる)、スキムミルク、カゼインが含まれており、(通常は、1〜5%w / v)の濃度範囲で使用することができます。ミルクは、単独で使用、または血清と一緒にすることができます。目的の抗原が細胞内マーカーである場合、例えば、トリトンX-100またはTween-20で洗浄剤には、細胞膜を透過性にするためにブロッキング溶液を添加することができます。より厚い組織切片は、ウェル中の組織切片をフローティングの代わりにスライド上にそれらを取り付けることにより、同様に処理することができます。パラフィン包埋組織も同様に処理するが、ブロッキングの前に脱ワックス工程を必要とすることができます。 Feldengut ら 12アドレスこれらのメソッドの両方。
、蛍光抗体が暗いコンテナに格納され、二次抗体のインキュベーション後の露光を回避することが重要です。現像剤としてDABを使用した場合は対照的に、光への曝露は有害ではありません。蛍光染色は、その寿命が限られています。蛍光染色したスライドを4℃で遮光ボックスに格納する必要があります。画像は、染色の月内に捕捉されるべきです。即時のイメージングが可能でない場合、撮像が可能になるまで、DABまたは他の代替染色法または遅延染色を検討してください。蛍光は二重および三重標識を可能にする一方、DABでの染色は、通常、一つの標的抗原の染色に限定されています。二重および三重標識しかし、この技術は、合併症と特異抗原染色を分離するのが困難にやすいDABを用いて達成することができます。 DAB染色は、蛍光Sを撮像する一方、明視野顕微鏡下で可視化することができますtainingは、蛍光顕微鏡を必要とします。
DAB染色で考慮に入れるべきもう一つの要因は、細胞が組織の複数の層にまたがることがあります。これは、プロセスにまたがるしているようなミクログリア細胞などの鮮明な画像を得ることは困難です。この問題を克服するために、いくつかの研究者は8〜12ミクロンで薄く、そのセクションをカット。
蛍光標識された組織のイメージングは、最高の共焦点顕微鏡で達成されます。共焦点顕微鏡は、通常、試料内の焦点の一つの面を分離し捕捉することにより、研究の蛍光顕微鏡で見られる曇りを解消します。共焦点顕微鏡を用いて、より細かい詳細がシャープであり、ブリードスルーの蛍光色素との間で低減されます。厚いサンプルは真の共局在を実証するための時間(zスタック)で一つの平面を撮像することができます。共焦点顕微鏡へのアクセスが利用できない場合には、研究用顕微鏡でイメージングが可能であるが、露光時間及び光量は、LOCである必要があります画像間のヒツジシラミバエ。
開示事項
The authors have nothing to disclose.
謝辞
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
資料
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
参考文献
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l'Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira's basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved