Method Article
引物对免疫冰冻切片大鼠脑组织:例为染色小胶质细胞和神经元
摘要
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
摘要
免疫组织化学是一种广泛使用的技术,用于检测的存在,位置和相对原位抗原的丰度。这个入门级协议说明了试剂,设备和完成啮齿动物的脑组织的免疫组织化学染色所需的技术,使用标记的小胶质细胞和神经元的元素作为一个例子。具体地,本文是一步一步的协议,用于小胶质细胞和神经元的通过免疫组织化学对Iba1和泛神经元,分别荧光可视化。荧光双标记是用于在同一样品中多种蛋白的定位是特别有用的,提供的机会,以准确地观察细胞类型,受体,配体之间的相互作用,和/或细胞外基质中相对于彼此以及蛋白质共单个细胞内的定位。不像其他的可视化技术,荧光免疫组化染色强度可能减小在几个星期到几个月之后染色,除非有适当的预防措施。尽管这种限制,在许多应用荧光双标记优于替代品,如3,3'-二氨基联苯胺四盐酸盐(DAB)或碱性磷酸酶(AP),由于荧光是更多的时间效率,并允许两个或更多个之间更加精确的分化标记。讨论包括故障排除提示和建议,以促进成功。
引言
免疫组织化学是用于通过使用特异性结合到感兴趣的抗原的第一抗体检测抗原( 即蛋白)的组织切片的方法。免疫组化法开创的JR马拉克在1934年,当他确定抗体可与很大的特殊性1本地化抗原。在1942年开始,一些先在体外用荧光抗体可视化免疫研究发表2,3,此后,第一体内组织化学研究发表4。在20世纪60年代,经过三十年的免疫组化方法以来,酶标记的抗体开始被用作辅助试剂。这些方法同时并独立开发了法国和美国5,6。如今,抗体的广泛提供了无限的可能性,免疫组化研究7。
">此对应的总体目标是提供一个简单的介绍到免疫组化染色;它并不意味着是该技术的全面和详尽的审查中列出的方法,免疫组化技术对两种抗原呈现(标记为小胶质细胞和。神经元),用于多聚甲醛的染色灌注,蔗糖冷冻保护,冰冻切片大鼠脑。免疫组织化学染色开始阻断非特异性抗原结合,以减少背景染色。接着,温育与初级抗体允许在组织结合到特定抗原。继第一抗体,另一种抗体,称为二次抗体,被施加到第一抗体链接到一个共轭可视信号8。二级抗体靶向免疫球蛋白G(IgG)的特定于其中初级抗体升高的物种域。二级抗体放大该信号第一抗体的自吨的Fab区他的第二抗体结合到多个站点上的第一抗体的抗体结构域。或者缀合到二级抗体的F c的区域的酶或荧光分子使可视化。例如,兔抗Iba1第一抗体是特异性针对Iba1兔IgG分子。当驴抗兔IgG被作为二次抗体施加,它会识别和结合的兔抗Iba1 IgG抗体的多个区域( 见图1)。驴抗体可通过各种方法来显示。这种对应着重于检测缀合到二级抗体,其识别第一抗体,用于可视化通过荧光显微镜荧光团。在荧光免疫组织化学,核染色剂如Hoechst的或DAPI可以用于可视化的所有核。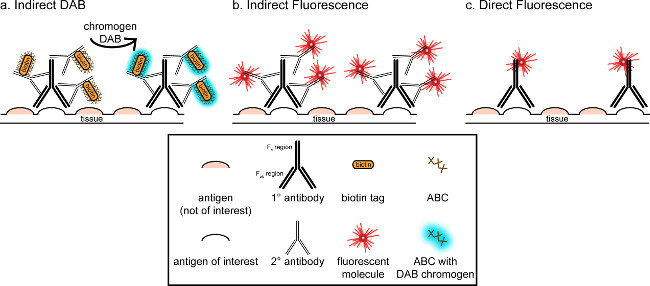
图1:SCH的直接与间接的抗体标记技术ematic表示。抗体结合到感兴趣的抗原,并且可以通过产生针对第一抗体的物种的二级抗体进行放大。这种技术可以使用抗生物素蛋白-生物素复合物(ABC)用于扩增和DAB进行可视化(A)中进行,或直接缀合的荧光第二抗体(B)。另外,主要的抗体可直接偶联与许多不同的标记,包括生物素或荧光团(C)。 请点击此处查看该图的放大版本。
对于免疫组织化学染色的可视化的另一种方法是使用3,3'-二氨基联苯胺四盐酸(DAB;参见图1和2)。这不同于荧光通过使用生物素化的或辣根过氧化物酶(HRP)缀合的第二抗体,其提供了一种酶的DAB转换为沉淀物是在亮视野显微镜可见。中的实例,其中一个单一的抗原是感兴趣或染色需要是持久的,DAB可能比荧光染色更合适。然而,DAB染色并不非常适合于多个标记之间的差异,特别是如果两个核抗原的兴趣。关于DAB材料和协议修改的信息,请参阅表1中 。另外,硝基蓝四唑氯化物/ 5-溴-4-氯-3-吲哚磷酸(NBT / BCIP)可以被用于可视化的碱性磷酸酶(AP)缀合的二抗体。

图2:镍增强的DAB单标记的大鼠脑组织切片的代表性图像大鼠脑瑟ctions其上标有镍增强DAB的Iba1(A)和泛神经元(B)允许单独或小胶质细胞神经元的长期分析。比例尺20微米。 请点击此处查看该图的放大版本。
必须考虑的组织内感兴趣的抗原的估计的丰度的分析处理。间接的方法(如上所述)可用于具有低丰度的目标是有用的。当感兴趣的抗原是在高丰度,直接的方法都可以应用。直接方法涉及一个直接缀合到一个可视信号的初级抗体,因此没有第二抗体是必需的。此方法简化了染色处理,但消除了间接的方法取得的扩增。使用直接缀合的初级抗体也消除交叉反应的第二抗体的当双标记。
该通信详细介绍了协议双标记与Iba1和泛神经元( 如表1的细节)。 Iba1小胶质细胞染成许多活化状态,包括分枝,超分枝,激活,变形虫,和杆。泛神经污渍神经轴突,树突和索玛。因为Iba1渍最小胶质细胞和泛神经元靶神经元,污渍的这种组合中获得的小胶质细胞 - 神经元相互作用的广泛了解。
总之,免疫组化染色依赖于精心挑选的抗体。随着研究的问题变得更加具体,提出的到备用抗原抗体可能不理想。要针对特定的小胶质细胞激活状态,可以选择使用CD45或CD68抗体,而不是Iba1。此外,与小鼠的工作,F4 / 80可提供必要的结果。同样地,神经元元件可特异性地与抗体ラ针对性反对核ISED,突触(前或后),轴突和生长锥。此外,还有其他的标志物区分神经元(双肾上腺皮质激素,的NeuN)的年龄和神经再生(GAP-43)。
研究方案
注:所有的程序,进行了符合亚利桑那大学的机构动物护理和使用委员会(IACUC)。推荐材料和设备的列表可以在表1中可以找到。
1.组织准备
- 灌注
- 安乐死啮齿类用戊巴比妥钠(25毫克/千克,IP)的过量,并用磷酸盐缓冲盐水(PBS),直到完全放血(3-5分钟)以8毫升/分钟的流速灌流transcardially。为深入灌注说明,请参阅量具等2012 9。
- 紧接的PBS冲洗,通过用在PBS中的4%多聚甲醛以8毫升/分钟的流速灌流15-20分钟修复组织。
- 除去脑并置于4%多聚甲醛24小时,随后经分级蔗糖溶液(15%,30%,30%,在序列;在Tris缓冲盐水中制备的)在4℃下。大脑转移到随后的蔗糖溶液0NLY大脑后已经沉没在每个解决方案。注意:通常,5天中的各溶液是足够的时间进行组织下沉。
- 组织冻结和Cryosectioning
- 将脑在包埋介质中,例如OCT化合物中,并在-35℃的温度下浸没在异戊烷。让大脑冻结为至少10分钟,然后储存在-80℃。可能会出现问题,如果不采取勤奋温度;请参阅讨论的故障排除信息。
- 切串行冠状切片,厚度为20μm和-20℃的温度下进行。收集到的组织正电荷的幻灯片。脑切片可以被放置在一个滑动箱用铝箔包裹在一个拉链袋中并存储长期在-80℃。存储此方法创建一个双重边界,以防止暴露于空气和霜冻。
2.组织处理
注:例如设备和材料研究equired染色示于图3中 。替代是可用的,然而,这些图像将有助于这些新的免疫组织化学染色,以在购买之前可视适当的项目。

需要实施例的物品为免疫组织化学染色的黑盒子中的 (A)示出的是一种理想的湿度室中进行免疫荧光,如载玻片避光,而不需要包裹上金属箔的框:图3。以下切片,幻灯片可以存储在一个盒子如黄箱中的(B)所示。紧紧包裹箱箔和冷冻前放置在一个拉链顶袋有助于保护组织样本从冷冻烧伤。幻灯片的示例(C)中,与(D)中示出不同的染色皿和给出(E )。盖玻片可以在尺寸和厚度(F)各不相同,但1.2厚的盖玻片提供最正直和共聚焦显微镜不错的成像效果。铅笔诸如在(G)中所示,可用于标记的幻灯片。永久标记应避免作为油墨可以运行,既影响染色,并确定所述样品是什么的能力。迷你笔PAP如在(H),使显示的幻灯片上要绘制的边界驱蚊。
- 幻灯片准备
- 在室温下删除冰柜和解冻的幻灯片。
- 可选:如果部分已经从幻灯片先前浮起,放置解冻载玻片在烘箱中在60℃下不超过4小时,以帮助防止组织切片从浮脱幻灯片。
- 地方幻灯片在幻灯片机架以及相应的菜。
- 洗涤滑入PBS洗3次,每次5分钟,改变洗涤之间溶液。从这一步,避免secti组件没有液体延长的时间周期。注意:如果切片干燥,背景染色增加并且有意义的数据不能可靠地获得。
- 在室温下删除冰柜和解冻的幻灯片。
- 组织染色
- 在一个不透光的盒子染色,营造"湿室"与浸泡用去离子水无绒毛组织。
- 干燥,不起毛的组织幻灯片的边缘,使用mini PAP笔做出拒液边框在幻灯片的边缘,远离组织切片。该边界应确保液体的弯液面,并在组织,使得表面张力不影响染色的边缘之间充足的空间。
注:巴氏笔驱蚊边框可以应用之前2.1.3如果感兴趣的抗体并不需要微波抗原修复。如果巴氏笔之前已经在PBS中洗涤应用,则疏液边界的完整性必须在此步骤进行检查。使用一个微型的PAP笔填写在边境的任何空白。 - 用幻灯片水平放置,阻断非特异性抗原孵育在4%V / V血清的PBS(块解决方案)的结合。吸管300微升,在室温下每滑块溶液1小时。确保块溶液延伸至巴氏笔在滑动的边缘,并完全覆盖所述组织,以避免造成邻近组织表面张力不均匀的染色。
- 从其中的二级抗体是由相同的物种使用血清。注意:在此过程中,二次抗体在驴制成,因而驴血清被使用。如果来自两个或更多不同物种的第二抗体的使用,包括血清来自每个物种。
- 吸取第一抗体在载玻片上。注:抗体浓度的这种染色进行了优化,以1:5000和1:500分别为Iba1和泛神经元。这些浓度已经被发现显示出有意义的染色用无背景染色。
- 稀释块解决方案在PBS 1%血清和添加第一抗体。吸取300微升的主要抗体溶液中每张幻灯片的1%血清。再次,确保流体的巴氏笔的边缘。孵育过夜,在4℃。
- 包括三个控制幻灯片:一个包含既不Iba1也不泛神经元抗体,其中一个Iba1不泛神经元抗体,和一个与泛神经元抗体没有Iba1。在相同的运行具有相同的溶液染色这些幻灯片,但是省略了初级抗体,以测试非特异性次级抗体的结合。
- 第二天早晨,洗涤滑入PBS洗3次,每次5分钟,改变洗涤之间溶液。
- 荧光抗体对光敏感,因此,从这个进步,最大限度地减少曝光,确保清洗容器包装在铝箔和杂交框是黑色或避光培养。吸取适当的二级抗体上的所有幻灯片和孵育60分钟在室温下以1:1的浓度:在方框溶液250(见步骤2.2.3)在一个不透光的"湿度箱"(见步骤2.2.1)。
- 使用不同波长的次级抗体。这里,对于第一抗体兔抗Iba1,用驴抗兔594作为相应的二次抗体。为第一抗体的小鼠抗泛神经元,使用驴抗小鼠488作为相应的二次抗体。或者,使用抗兔488和抗小鼠594。
- 洗涤滑入PBS洗3次,每次5分钟。
- 可选:执行核染色。
- 地方在赫斯特(或其他核染色)以0.03微克/毫升双蒸H 2 O中的浓度为恰好60秒。
- 洗涤滑入PBS洗3次,每次5分钟。
- 在双蒸2 0洗。
- 盖片
- 盖玻片载玻片用含水封固剂,如氟omount-G或ProlongGold。小心除去用棉签所有的泡沫。
注:其他的安装剂可以使用,但是高的渗透染料之间已注意到一些内盖片的天。 - 用透明指甲油密封边缘,防止部分变干,由于蒸发。允许指甲油干燥在一个不透光的容器中,同时滑动保持平坦,在室温下,然后存储在一个不透光的容器用铝箔包裹在4℃。
- 盖玻片载玻片用含水封固剂,如氟omount-G或ProlongGold。小心除去用棉签所有的泡沫。
3.影像学检查染色组织
- 显微镜
- 让指甲油开始显微镜,这应该发生在一个黑暗的房间前干燥至少一小时。
- 获得使用共焦或研究显微镜用荧光光源和数字照相机附件的显微照片。使用附带的软件,设置曝光每个波长 - 405,488,594 - 分开。注:深入成像指令应可在网上从显微镜制造商。
- 获得在每个通道中的显微照片,而无需移动部分或调整焦点。取的图像的颜色,或交替地以灰度,并转换为颜色之后。
注意:颜色或灰度图像的每个通道都可以在后期处理进行整理。 - 确保组织切片不暴露于环境光或显微镜光为长时间,如将发生光致漂白的部分。为了避免这种情况,增加曝光时间,而不是增加光/激光强度。
- 不内被接通30分钟关掉荧光光源。
注意:切换源通断在快速连续可能降低荧光灯泡的寿命。
结果
这在大鼠的脑组织切片染色方案的结果已小胶质细胞的荧光标记,在594通道(红色)和神经元标记中的488通道(绿色;参见图4)。如果一个核染色已经完成,它将显示在405通道(蓝色)。图像可以采取不同的通道和覆盖该三个信道的直接比较,或任何两个通道之间。许多数字采集软件套件包含此功能。双标记与这里显示Iba1和泛神经元标记表明大部分分枝小胶质细胞,长细神经元的预测跨皮质层明显。
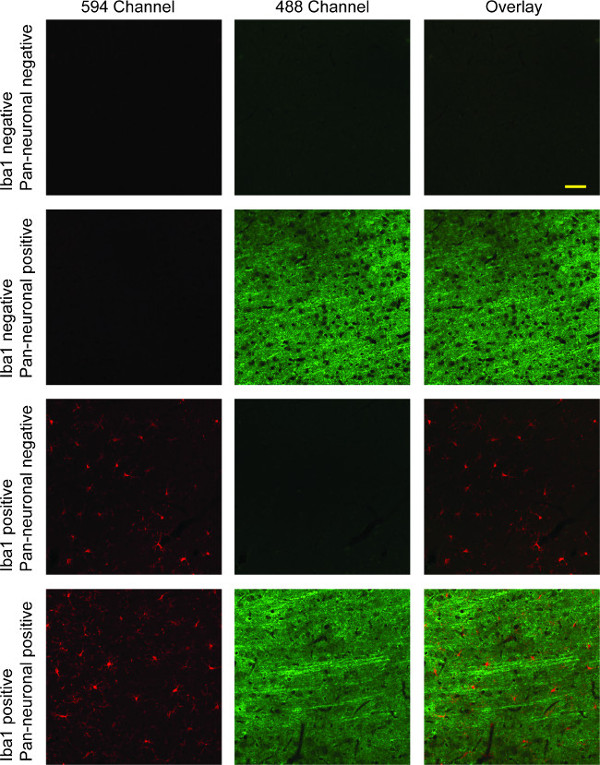
图4:伊巴-1 /泛神经元双标柱1 的代表性共聚焦荧光图像示出小神经胶质细胞染色Iba1(红色)。神经元中示出第二列中的绿色,与红色和绿色通道中的第三列的叠加图像。在第一行中,有一个完全缺乏特异性染色由于不存在两个主要的抗体。第二行示出了用于神经元染色泛神经元初级抗体的特异性,而第三行示出的特异性Iba1的小胶质细胞,用完全缺乏交叉反应性在这两种情况下。第四行示出了具有两个信道同时显示的小胶质细胞和神经元染色的重叠双标记。比例尺为50μm。
可怜的染色结果也显示( 图5),就证明了缺乏明确界定的胞体和小胶质细胞零散/神经元突起。高背景是表示质量染色差,并且可以通过非特异性的共定位的抗体(参见图5)中可以看出。此外,如果信号较弱,扩增步骤用荧光结合的streptavidin可以被并入。代替在步骤2.2.6使用直接标记的荧光第二抗体,生物素化的次级被应用。以下在PBS中洗涤,链霉(1:1000于PBS中)温育对载玻片1小时。回到协议步骤2.2.7幻灯片的地方,然后洗净,浸在染液或盖子滑落。
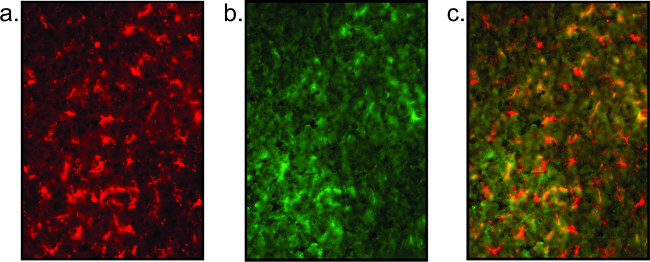
图5:组织质量差代表荧光图像这里展示的是染色不良的组织,这导致一个不明确小胶质细胞染色(a)和完全缺乏的神经元染色的(b)的一个例子。这种神经元染色简直是高背景。覆盖图像(c)是没有意义的。
| 材料/设备名称 | 公司 | 目录编号 | 评论/说明 |
| Fisherbrand Superfrost Plus或玻片 | Fisher Scientific公司 | 22-034-979 | 用于组织安装(1.2.2) |
| 烤箱 | Thermo Scientific的 | 51028112 | 用于组织干燥(2.1.1) |
| 迷你巴氏笔 | Life Technologies公司 | 00-8877 | 用于步骤2.2.2 |
| Andwin科学组织-TEK幻灯片染色菜 | Fisher Scientific公司 | 22-149-429 | 染色(2.2),以及Hoechst的步骤中用于所有洗涤(2.2.8) |
| 的Kimwipes | Fisher Scientific公司 | 06-666-A | 用于干燥载玻片(2.2) |
| 黑盒染色 | 特德佩拉 | 21050 | 用于阻止和染色步骤(2.2) |
| 正常驴血清 | Fisher Scientific公司 | 50-413-253 | 用于块和抗体孵育(2.2) |
| 鼠标α-泛神经元 | 密理博 | MAB2300 | 用于初级抗体(2.2.4) |
| 兔α-Iba1 | 三菱化学 | 019-19741 | 用于初级抗体(2.2.4) |
| 驴α-594兔 | 杰克逊免疫研究 | 711-585-152 | 用于二级抗体(2.2.6) |
| 驴α-488鼠标 | 杰克逊免疫研究 | 715-545-150 | 用于二级抗体(2.2.6) |
| 餐饮服务花剑 | 任何 | N / A | 在使用1.2.2步骤2.3.2和 |
| Fluoromount-G | 南方生物技术 | 0100-01 | 用于盖片(2.2.8) |
| 盖玻片 | Fisher Scientific公司 | 12544E | 用于盖片(2.2.8) |
| 清除指甲油 | 任何 | N / A | 用于盖片(2.2.8) |
| Axio上Observer.Z1和LSM 710(激光扫描共聚焦) | 卡尔蔡司 | N / A | 用于成像(3) |
| Axioskop A2 | 卡尔蔡司 | N / A | 用于成像(3) |
| CitriSolv | FisherScientific | 对于DAB协议 | |
| ABC | 矢量实验室 | PK-6100 | 对于DAB协议 |
| DAB过氧化物酶试剂盒 | 矢量实验室 | SK-4100 | 对于DAB协议 |
| 生物素化马α兔IgG | 矢量实验室 | BA-1100 | 对于DAB协议 |
| 生物素化马α鼠IgG | 矢量实验室 | BA-2001 | 对于DAB协议 |
| 30%过氧化氢 | FisherScientific | H325-500 | 对于DAB协议 |
| 惠顿滑动架和染色菜肴 | TedPella | 21043 | 对于DAB协议 |
| 的Masterflex灌注泵和管道 | 科尔 - 帕默 | 用于灌注(1.1.1和1.1.2) | |
| Andwin科学组织-TEK低温OCT化合物(12时) | Fisher Scientific公司 | 14-373-65 | 用于组织冻结(1.2.1) |
| 温度计(-50〜50℃) | Fisher Scientific公司 | 15-059-228 | 用于组织冻结(1.2.1) |
| 低温恒温器 | 徕卡 | CM3500S | 用于组织切片(1.2.2) |
| 染色皿中,用塑料盖2 | Grale科学 | 353 | 抗原retrival |
| 20将染色架,滑轨水平 | Grale科学 | 354 | 抗原retrival |
| 微波 | 任何 | N / A | 抗原retrival |
表1:材料清单。
讨论
这种沟通的总体目标是引进免疫程序给读者。为此,双标记与Iba1和泛神经元抗原的例子来观察小胶质细胞和多聚甲醛中的神经元灌注,蔗糖冷冻保护,冰冻切片大鼠脑使用。
这种技术可以适用于服务无休止的目的。不同抗原在多种组织类型,例如但不限于脑,肺,肝,肾和肠的阵列可以免疫组织化学与小幅调整协议被可视化。免疫组织化学允许的多个标记的直接比较,并且可以包含多达四个不同的抗体在一个单一的样品。在一个样品中使用的抗体的数目由渗出通过,其描述了重叠的荧光波长的限制。有一个有限的荧光光谱,其结果限制了染色组合内炉火样品(参见图6)。
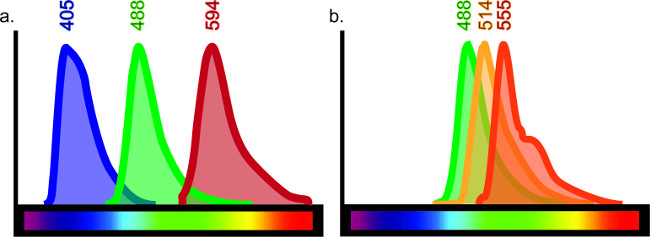
图6:彩色光谱图的每个荧光团发射的光的特定波长时由特定激光器或滤波器激发。为了有效地产生多重标记的组织,应该有缀合到抗体的特定荧光团之间的最小重叠。虽然有市场上可以得到的至少10种不同的荧光团,它是不可能的,如果所有10个被用于获得清晰的效果。例如,三重标记与波长发射在405,488和594( 一 )将得到明确的标签,因为这里的最小重叠,如果有的话,这些波长之间。然而,如果波长发射在488nm,514和555被使用,在染色不会被轻易解释为每个抗体可以通过激光激发或过滤器意味着为其他( B)。这将使假共同标记结果。可通过搜索"荧光光谱查看器"的在线指南,荧光选择。
当双标记,它最好是选择在不同物种制成初级抗体,两种抗体可同时施加。双标记与来自相同物种的两种抗体是可能的,虽然在技术上困难。当两个初级抗体在相同物种中取得,染色必须按顺序通过完成染色用于第二前一种抗原完成的,。会出现较少的问题,如果来自相同物种的主要抗体具有不同的Ig类( 即小鼠IgG和小鼠IgM或不同亚类的IgG1和IgG2a)。欲了解更多详情,请咨询其他参考10,11。该协议使用兔抗Iba1和小鼠抗泛神经元。它也有必要包括适当的阴性对照。对于双标记与磅a1和泛神经元,一个滑动不含有初级抗体,一个滑动仅包含与一个滑动只包含抗泛神经元抗Iba1( 见图4)。这些阴性对照确认不存在交叉反应,假染色。所有其他幻灯片包含两个主要的抗体。同样重要的是避免使用可能交叉反应的第二抗体。例如,使用驴抗兔594和兔抗小鼠488将导致的驴抗兔594结合到两个兔抗Iba1初级抗体和驴抗兔594抗小鼠488的第二抗体。这将产生错误的共同标签。
抗体对特定蛋白(抗原)不总是相同的。例如,一些抗体是提出对抗原是存在于冷冻组织,而其他人将认识到这已在石蜡包埋过程被改变的抗原。出于这个原因,特别要注意为t他抗体购买前规格表。如果预期应用抗体未列出,故障排除可能需要获得染色,染色或可能无法工作。此外,此前公布的数据可能会提供"招数贸易"获得染色。重要性要注意的是,细微的差别可在抗体的不同批次可以看出;可能需要轻微的修改与每个重新排列的抗体制成。
大多数抗体有利于自收到之日起12个月。务必注明到达的产品规格表的日期。如果抗体染色没有观察到,抗体可能太旧或存放不当。因此,同样重要的是检查每个抗体的规格表妥善存放。
此外,对于许多抗体,不同的克隆是可用的。不同的克隆识别目的抗原的不同部分。一个鉴于克隆可能对组织进行不同的处理技术更好(蜡嵌入式/冷冻),目标组织类型,或目标品种。要特别注意其中抗体升高的品种。当抗体被上调在相同物种中的组织进行分析,高背景可能被观察到。为了解决这个问题,附加阻挡用市售试剂盒如小鼠对小鼠试剂盒中,可能需要进行染色。这种技术也可以适用于细胞培养物。细胞,克隆和特异性的固定需要的规格表应用程序进行检查。
固定与多聚甲醛交联蛋白质,这可能隐藏在某些条件下抗原结合位点。抗原修复可以打破蛋白交联和暴露的结合位点。如果抗原修复需要,插入下面的协议步骤2.1.3后:用塑料染色菜和插入( 见表1),微波幻灯片在柠檬酸缓冲液在低功率设置10分钟,注意不要让解决方案沸腾严格(比功率水平不因变异之间的微波设置包括在内)。交替,使柠檬酸盐缓冲液至80℃,在一个玻璃染色皿中在烘箱中,再加入载玻片10分钟。
组织质量差也会造成问题用染色(参见图5)。有一些预防措施之一可以采取以避免损害组织质量。首先,要有耐心,勤奋与才能在组织冷冻前彻底取代蔗糖水的变化。当冷冻,保持温度恒定。如果组织冻结太慢,水分子会扩大,因为它们冻结,开创了组织洞。或者,在太低的温度下冻结将造成组织破裂。
协议将变化略微为每个感兴趣的抗体。在接收到一个新的抗体,必须选择据此imize的协议。如果背景是高( 图5),尝试阻断的时间较长。另外,增加了块解决方案的血清浓度或多个不同物种如羊和兔血清加血。此外,酪蛋白可用于降低非特异性结合。脱脂牛奶(由干粉制成)含有酪蛋白,并且可以在一浓度范围内被使用(通常是1-5%重量/体积)。牛奶可以单独使用,或与血清一起使用。如果感兴趣的抗原是一种细胞内标记物,清洁剂,例如在的TritonX-100或Tween-20的可以添加到封闭溶液通透细胞膜。较厚的组织切片可以类似地通过漂浮在孔中的组织切片,而不是将它们安装在载玻片上进行处理。石蜡包埋的组织,也可以类似地处理,但是需要之前阻断脱蜡步骤。 。Feldengut等 12个地址这两种方法。
由于荧光抗体的光敏性质,荧光抗体存储在黑暗的容器,并避免光线照射下的二级抗体孵育这一点至关重要。相比之下,使用DAB作为展开剂时,暴露于光不是有害的。荧光染色在其寿命有限。荧光染色的载玻片应在4℃下贮存在不透光的盒。图像应在一个月染色内被捕获。如果直接成像是不可能的,考虑的DAB或其他替代染色方法或延迟染色直到成像是可能的。用DAB染色,通常仅限于染色一个目标抗原,而荧光允许双和三标签。双链和三标记可使用的DAB然而这种技术很容易出现并发症,难以分离特异性抗原染色来实现。 DAB染色可以在明亮的视野显微镜进行可视化,而成像光S泰宁需要荧光显微镜。
另一个因素要考虑到与DAB染色是细胞跨越组织的多个层。因此,难以得到清晰的图像的细胞如具有跨越进程胶质。为了解决这个问题,一些研究者削减部分更薄8-12微米。
最好的共聚焦显微镜取得荧光标记组织的成像。共聚焦显微镜消除隔离和捕捉样本内重点的单一平面通常看到的一个研究荧光显微镜的阴霾。用共聚焦显微镜,更精细的细节是清晰和渗出通过荧光染料之间减小。较厚的样品可以被成像的一个平面在一个时间(Z堆栈)来证明真实的共定位。当获得了共焦显微镜不可用,成像在研究显微镜是可能的,但是曝光时间和光强度需要禄图像之间糟透了。
披露声明
The authors have nothing to disclose.
致谢
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
材料
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
参考文献
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l'Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira's basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。