Method Article
פריימר לאימונוהיסטוכימיה על רקמות Cryosectioned מוח חולדה: דוגמא להכתמת Microglia ונוירונים
In This Article
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
אימונוהיסטוכימיה היא טכניקה נפוצה לגילוי הנוכחות, המיקום, והשפע היחסי של אנטיגנים באתר. פרוטוקול ברמת מבוא זה מתאר את חומרים כימיים, ציוד, וטכניקות הנדרשות להשלמת מכתים immunohistochemical של רקמת המוח המכרסם, באמצעות סמנים למיקרוגלים ואלמנטים עצביים כדוגמא. באופן ספציפי, מאמר זה הוא פרוטוקול צעד-אחר-צעד להדמיה ניאון של מיקרוגליה ונוירונים באמצעות אימונוהיסטוכימיה לIba1 ופאן-עצבי, בהתאמה. הקרינה כפול תיוג הוא שימושי במיוחד עבור הלוקליזציה של חלבונים רבים בתוך המדגם זהה, מתן ההזדמנות להתבונן בצורה מדויקת יחסי גומלין בין סוגי תאים, הקולטנים, ligands, ו / או מטריקס ביחס ל, כמו גם אחד אחר שיתוף חלבון לוקליזציה בתוך תא בודד. שלא כמו טכניקות הדמיה אחרות, עוצמת מכתימה אימונוהיסטוכימיה הקרינה עלולה לגרום לירידה בהשבועות לחודשים הבאים מכתים, אלא אם אמצעי זהירות מתאימה נלקח. למרות מגבלה זו, ביישומים רבים הקרינה כפול תיוג עדיף על פני חלופות כגון tetrahydrochloride 3,3'-diaminobenzidine (DAB) או phosphatase אלקליין (AP), כקרינה היא יותר זמן יעיל ומאפשרת לבידול מדויק יותר בין שתיים או יותר סמנים. הדיון כולל עצות לפתרון בעיות וייעוץ לקידום הצלחה.
Introduction
אימונוהיסטוכימיה היא תהליך לאיתור אנטיגנים (כלומר חלבונים) בסעיפים רקמות באמצעות נוגדנים עיקריים שלהיקשר באופן ספציפי לאנטיגנים של עניין. אימונוהיסטוכימיה הייתה חלוץ ידי JR Marrack בשנת 1934 כאשר הוא קבע כי נוגדנים יכולים למקם אנטיגנים עם סגוליות גדולות 1. החל בשנת 1942, חלק בראשון מבחנה באמצעות נוגדני ניאון לדמיין אימונוהיסטוכימיה פורסם 2,3, לאחר שלראשונה במחקר histochemical vivo פורסם 4. במהלך 1960, שלושה עשורים לאחר הקמתה של שיטות immunohistochemical, נוגדני אנזים מצומדות- החלו לשמש כחומרים כימיים משניים. שיטות אלה בו-זמנית ובאופן עצמאי פותחו בצרפת ובארה"ב 5,6. היום, במגוון רחב של נוגדנים מספק אינספור אפשרויות ללימודי אימונוהיסטוכימיה 7.
"> המטרה הכללית של התכתבות זו היא לספק הקדמה קצרה למכתים immunohistochemical, זה לא אמור להיות סקירה מקיפה וממצה של טכניקה זו בשיטה שתוארה, טכניקות immunohistochemical לשני אנטיגנים מוצגות (סמנים למיקרוגלים ו. הנוירונים) להכתמה של paraformaldehyde perfused, מוח סוכרוז cryoprotected, cryosectioned חולדה. המכתים immunohistochemical מתחיל עם חסימת אנטיגן ספציפי מחייב להפחית מכתים רקע. בשלב הבא, דגירה עם נוגדן ראשוני מאפשרת לכריכה לאנטיגן ספציפי ברקמות. בעקבות הנוגדן הראשוני, נוגדן אחר, המכונה נוגדנים משני, מוחל על קישור הנוגדן הראשוני לאות הדמיה מצומדות 8. הנוגדנים משני מטרות אימונוגלובולין G תחום (IgG) הספציפי למין שבו הנוגדן הראשוני הועלה. הנוגדנים משני מגבירים את האות של הנוגדן הראשוני מאז אזורי Fab של tהוא לאגד נוגדנים משני לאתרים מרובים בתחום IgG של הנוגדן הראשוני. כך או אנזימים או מולקולות ניאון מצומדת לאזורי ג 'לנוגדנים משני תאפשר להדמיה. לדוגמא, נוגדן ראשוני אנטי-Iba1 ארנב הוא מולקולת IgG ארנב ספציפית לIba1. כאשר IgG נגד ארנב החמור מיושם כנוגדנים משני, זה יהיה לזהות ולהיקשר לאזורים המרובים של אנטי-Iba1 IgG הארנב (ראה איור 1). הנוגדן החמור ניתן דמיין בשיטות שונות. התכתבות זו מתמקדת בזיהוי של fluorophore מצומדת לנוגדנים משני, שמזהה את הנוגדן הראשוני, להדמיה על ידי מיקרוסקופ פלואורסצנטי. באימונוהיסטוכימיה ניאון, כתם גרעיני כגון Hoechst או DAPI יכול לשמש כדי לחזות את כל הגרעינים.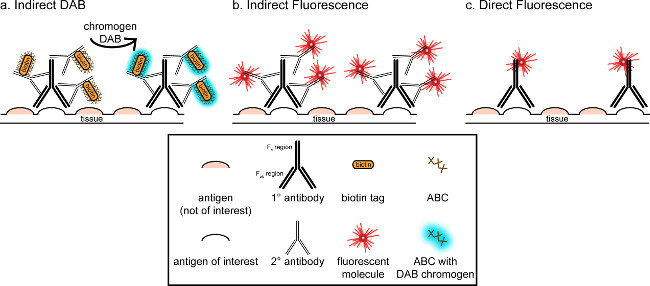
איור 1: Schייצוג ematic של טכניקות תיוג נוגדן עקיף מול ישיר. נוגדנים נקשרים לאנטיגן של עניין ויכולים להיות מוגבר על ידי נוגדנים משני הועלו נגד המינים של הנוגדנים הראשוניים. טכניקה זו יכולה להתבצע באמצעות מורכבת avidin ביוטין (ABC) להגברה וDAB להדמיה (), או נוגדנים מצומדות ישירות ניאון משניים (B). לחלופין, נוגדנים ראשוניים ניתן מצומדות ישירות עם תגים רבים ושונים, ובכלל זה ביוטין או fluorophore (C). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
שיטה חלופית להדמיה של מכתים immunohistochemical משתמשת 3,3'-diaminobenzidine tetrahydrochloride (DAB; ראה איורים 1 ו -2). זה שונה מקרינה באמצעות biotinylated אוperoxidase סוס-צנון (HRP) נוגדנים משני מצומדות, המספק אנזים להמיר DAB למשקע שנראה תחת מיקרוסקופ שדה הבהיר. במקרים שבם אנטיגן יחיד הוא של ריבית או הכתמה נדרשה להיות ארוך טווח, DAB יכול להיות יותר מתאים מאשר צביעת ניאון. עם זאת, מכתים DAB אינו מתאים היטב לבידול בין סמנים מרובים, במיוחד אם שני אנטיגנים גרעיניים הם עניין. לקבלת מידע על חומרי DAB ושינויי פרוטוקול, להתייעץ טבלת 1. לחלופין, כלוריד tetrazolium הכחול ניטרו / 5-Bromo-4-כלורו-3-indolyl פוספט (NBT / BCIP) יכול לשמש כדי לחזות phosphatase אלקליין (AP) מצומדות המשני נוגדן.

איור 2:. נציג תמונות של חלקים משופרים ניקל DAB שכותרת יחיד חולדה רקמת מוח מוח החולדה sections שכותרתו עם DAB משופר ניקל לIba1 () ופאן-עצבי (ב ') לאפשר לניתוח של מיקרוגליה או נוירונים לבד לטווח ארוך. בר סולם 20 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
יש לקחת בחשבון את השפע המשוער של אנטיגן של עניין בתוך הרקמה מנותחת. שיטות עקיפות (כמתואר לעיל) הן שימושיות למטרות עם שפע נמוך. כאשר אנטיגן של עניין הוא בשפע גבוה, יכולות להיות מיושמות שיטות ישירות. שיטות ישירים כרוכות נוגדן ראשוני שמצומדות ישירות לאות הדמיה, ובכך אין צורך בנוגדנים משני. שיטה זו מפשטת את תהליך הצביעה, אך מבטלת את ההגברה הושגה על ידי שיטות עקיפות. באמצעות נוגדן ראשוני מצומדות ישירות גם מבטל תגובה צולבת של נוגדנים משניכאשר כפול תיוג.
תקשורת זה מפרטת את הפרוטוקול לתיוג כפול עם Iba1 ו( פרטים בטבלה 1) פאן-עצביים. Iba1 כתמי מיקרוגלים במדינות הפעלה רבות, כוללים מסועף, היפר-מסועף, מופעל, אמבואידית, ומוט. כתמים פאן-עצביים האקסונים, דנדריטים, וסומה עצביות. מאז Iba1 מכתים ביותר המיקרוגלים ומטרות פאן-עצביות נוירון, זה שילוב של כתמים הוא שימושי בהשגת הבנה רחבה של אינטראקציות מיקרוגלים-נוירון.
לסיכום, מכתים immunohistochemical מסתמך על הבחירה זהירה של נוגדנים. כמו שאלת המחקר הופכת להיות יותר ספציפית, נוגדנים העלו לאנטיגנים חלופיים עשויים להיות רצויים. כדי למקד את מצב הפעלת microglial ספציפי, אחד יכול לבחור להשתמש נוגדני CD45 או CD68, ולא Iba1. יתר על כן, בעבודה עם עכברים, F4 / 80 עשוי לספק תוצאות הדרושות. כמו כן, גורמים עצביים יכולים להיות ממוקדים במיוחד עם דלקת מפרקים שגרונית נוגדניםised נגד הגרעין, סינפסה (מראש או שלאחר), האקסון, וחרוט צמיחה. בנוסף, יש סמנים אחרים שמבדילים גיל נוירון (פעמיים cortin, NeuN), והתחדשות עצבית (GAP-43).
Protocol
הערה: כל הנהלים בוצעו בעמידה בוועדה המוסדית הטיפול בבעלי חיים והשימוש (IACUC) מאוניברסיטת אריזונה. ניתן למצוא רשימה של חומרים וציוד מומלצים בטבלה 1.
1. רקמות הכנה
- זלוף
- להרדים מכרסם עם מנת יתר של נתרן pentobarbital (25 מ"ג / קילוגרם, IP), ותנקב transcardially עם מי מלח פוספט (PBS) עד exsanguinated לחלוטין (דקות 3-5) בקצב זרימה של 8 מיליליטר / דקה. לקבלת הוראות זלוף המעמיק, לראות גייג 'ואח' 2,012 9.
- מייד לאחר הדחת PBS, לתקן רקמות על ידי מרוסס עם paraformaldehyde 4% ב- PBS במשך 15-20 דקות בקצב זרימה של 8 מיליליטר / דקה.
- הסר מוח ומקום paraformaldehyde 4% למשך 24 שעות, ואחריו פתרונות סוכרוז מדורגים (15%, 30%, 30%, ברצף; הוכן בטריס שנאגרו מלוח) בשעה 4 מעלות צלזיוס. העבר את המוח לo פתרון סוכרוז הבאהnly אחרי המוח שקוע בכל פתרון. הערה: בדרך כלל, 5 ימים בכל פתרון הוא זמן מספיק לרקמה לשקוע.
- הקפאת רקמה וCryosectioning
- מניחים את המוח בהטבעה בינוני, כגון מתחם OCT ולצלול באיזופנטאן בטמפרטורה של -35 מעלות צלזיוס. לאפשר המוח להקפיא למינימום של 10 דקות, ולאחר מכן לאחסן ב -80 ° C. בעיות עלולים להתעורר אם בדיקה לטמפרטורה לא נלקחה; אנא ראה דיון למידע על פתרון בעיות.
- לחתוך קטעי עטרה סידוריים בעובי של 20 מיקרומטר וטמפרטורה של -20 ° C. לאסוף רקמה על גבי שקופיות טעונות חיובי. חלקים במוח עשויים להיות ממוקמים בתיבת שקופיות עטופות בנייר בתוך שקית עם רוכסן וטווח ארוך מאוחסן ב -80 ° C. שיטה זו של אחסון יוצרת גבול כפול כדי למנוע חשיפה לאוויר וכפור.
עיבוד 2. רקמות
הערה: r ציוד דוגמא וחומריםequired מכתים מוצג באיור 3. חלופות זמינות, לעומת זאת, תמונות אלה יסייעו אלה חדשים מכתים immunohistochemical לדמיין פריטים מתאימים לפני הרכישה.

איור 3: פריטים לדוגמא נדרשים למכתים immunohistochemical הקופסה השחורה שמוצגת ב() היא תא לחות אידיאלי לimmunofluorescence, כשקופיות מוגנות מפני אור ללא הצורך לעטוף את התיבה על נייר.. בעקבות חתך, ניתן לאחסן שקופיות בתיבה כגון התיבה הצהובה שמוצג (B). עטיפת הקופסה בחוזקה בנייר כסף ומניח בשקית עם רוכסן לפני המקפיא מסייעת להגן על דגימות רקמה מכוויות במקפיא. דוגמא של שקופיות ניתן ב( C), עם מנות שונות מכתימה מתוארות ב( ד) ו- (E ). Coverslips יכול להשתנות בגודל ובעובי (F), לעומת זאת 1.2 coverslips העבה לספק תוצאות הדמיה נחמדה ברוב המיקרוסקופים זקופים וconfocal. עיפרון כגון שמוצג ב( G) ניתן להשתמש בתווית שקופיות. יש להימנע סמנים קבע כדיו יכול לרוץ, המשפיעים על שני כתמים והיכולת לקבוע מה הוא המדגם. עט פאפ מיני כגון שמוצגים ב( H) מאפשר גבול דוחה להיגרר בשקופיות.
- הכנת שקופיות
- הסר שקופיות מהמקפיא ולהפשיר בטמפרטורת חדר.
- אופציונאלי: אם חלקים שרחפו בעבר משקופיות, שקופיות למקם מופשרים בתנור על 60 מעלות צלזיוס למשך לא יותר מ 4 שעות כדי למנוע קטעי רקמה מצף את שקופיות.
- שקופיות מקום במעמד שקופית ומנה מקבילה.
- לשטוף שקופיות שלוש פעמים PBS במשך 5 דקות כל אחד, שינוי פתרון בין שוטף. מהצעד הזה קדימה, להימנע מצורך sectiתוספות ללא נוזל לפרקי זמן ארוכים. הערה: אם חלקים להתייבש, מכתים רקע הוא גדל ולא יכול להיות מושגת באופן מהימן נתונים משמעותיים.
- הסר שקופיות מהמקפיא ולהפשיר בטמפרטורת חדר.
- מכתים רקמות
- בתיבה מכתימה אור חזק, ליצור "תא לחות" עם רקמות ונטולי מוך טבול במים ללא יונים.
- ייבש את הקצוות של השקופית עם רקמה ונטולת מוך, להשתמש בעט פאפ מיני להפוך גבול דוחה נוזלים בקצה מאוד של השקופית, מסעיפי רקמות. גבול זה צריך להבטיח שטח נרחב בין המניסקוס של הנוזל והקצה של רקמה, כך שמתח פנים אינו משפיעים על צביעה.
הערה: גבול דוחה עט פאפ יכול להיות מיושם לפני 2.1.3 אם הנוגדנים של עניין אינו דורשים אחזור אנטיגן מיקרוגל. אם עט פאפ כבר יושם עד לכביסה בPBS, השלמות של גבול נוזל דוחה חייבת להיבדק בשלב זה. השתמש בעט המיני-פאפ כדי למלא פערים בכל הגבול. - עם שקופיות הניחו אופקית, אנטיגן ספציפי בלוק הכריכה בדוגרי 4% בסרום V / V בPBS (פתרון בלוק). פיפטה 300 μl של פתרון לחסום לכל שקופית עבור 1 שעות בטמפרטורת חדר. ודא הפתרון לחסום משתרע על עט פאפ בקצה של השקופית ומכסה לחלוטין את הרקמה כדי למנוע הכתמה אחידה שנגרמה על ידי מתח ליד רקמת פני השטח.
- השתמש בסרום מאותו המין שבי נוגדנים משני נעשה. הערה: בהליך זה, נוגדנים משני נעשים בחמור, ובכך חמור בדם משמש. אם נוגדנים משני משניים או יותר מינים שונים משמשים, כולל סרום מכל מין.
- נוגדן ראשוני פיפטה על גבי שקופיות. הערה: ריכוזי נוגדן מכתים זה כבר מותאם ליום 1 ב: 5,000 ו 1: 500 לIba1 ופאן-עצבי, בהתאמה. ריכוזים אלה נמצאו להראות מכתים משמעותיים עם היעדר מכתים רקע.
- לדלל פתרון לחסום לסרום 1% ב- PBS ולהוסיף נוגדנים עיקריים. פיפטה 300 μl של פתרון נוגדן ראשוני בסרום 1% לכל שקופית. שוב, להבטיח את הנוזל הוא לקצה של עט פאפ. דגירה הלילה ב 4 מעלות צלזיוס.
- כולל שלוש שקופיות שליטה: אחד שמכיל נוגדנים לא Iba1 ולא פאן-עצביים, אחד עם Iba1 ללא נוגדנים פאן-עצביים, ואחד עם נוגדן פאן-עצבי ללא Iba1. כתם שקופיות אלה באותו הטווח עם אותו הפתרונות, אך להשמיט את הנוגדנים הראשוניים כדי לבדוק את הלא ספציפי מחייב של הנוגדנים משני.
- למחרת בבוקר, לשטוף שקופיות שלוש פעמים PBS במשך 5 דקות כל אחד, שינוי פתרון בין שוטף.
- נוגדני ניאון הם רגיש לאור, ולכן, מהצעד הזה קדימה, לצמצם את החשיפה לאור על ידי הבטחת מכולות לשטוף הם עטופים בנייר כסף ותיבות הכלאה הם או שחורים או מודגרות בחושך. פיפטה נוגדנים משני המתאימים בכל השקופיות ודגירה60 דקות בטמפרטורת חדר בריכוז של 1: 250 בפתרון בלוק (ראו שלב 2.2.3) ב" תא לחות "אור חזק (ראה שלב 2.2.1).
- השתמש נוגדנים משני של אורכי גל שונים. כאן, לארנב נוגדן הראשוני אנטי-Iba1, להשתמש ארנב אנטי חמור 594 כנוגדנים משני המתאימים. לעכבר נוגדן הראשוני אנטי-פאן-עצבי, להשתמש חמור אנטי עכבר 488 כשני הנוגדנים המתאימים. לחלופין, להשתמש נגד ארנב 488 ואנטי עכבר 594.
- לשטוף שקופיות שלוש פעמים PBS במשך 5 דקות כל אחד.
- אופציונאלי: לבצע מכתים גרעיני.
- מקום בHoechst (או כתם גרעיני אחר) בריכוז של 0.03 מיקרוגרם / מיליליטר בH מזוקק פעמיים 2 0 בדיוק 60 שניות.
- לשטוף שקופיות שלוש פעמים PBS במשך 5 דקות כל אחד.
- לשטוף בDDH 2 0.
- Coverslipping
- שקופיות coverslip עם הרכבה בינונית מימית, כגון פלואורידomount-G או ProlongGold. דואג להסיר את כל הבועות באמצעות מוליך כותנה שקצה.
הערה: ניתן להשתמש בסוכני הרכבה אחרים, גבוה עם זאת לדמם דרך בין הצבעים שצוין על ידי כמה בימים של coverslipping. - השתמש ברור לק כדי לאטום את הקצוות, מניעת החלקים מהתייבשות בשל התאדות. לאפשר לק להתייבש במכל אור חזק בעוד שקופיות להישאר שטוחות ובטמפרטורת חדר, ולאחר מכן לאחסן במכל אור חזק העטוף בנייר כסף על 4 מעלות צלזיוס.
- שקופיות coverslip עם הרכבה בינונית מימית, כגון פלואורידomount-G או ProlongGold. דואג להסיר את כל הבועות באמצעות מוליך כותנה שקצה.
3. הדמיה הרקמה הצבעונית
- מיקרוסקופית
- לאפשר לק להתייבש במשך שעה אחת לפחות לפני תחילת מיקרוסקופיה, שאמור להתקיים בחדר חשוך.
- לרכוש photomicrographs באמצעות confocal או מיקרוסקופ מחקר עם מקור אור ניאון וקובץ מצורף מצלמה דיגיטלית. שימוש בתוכנה הנלווית, להגדיר את החשיפה לכל אורך גל - 405, 488, ו -594 - בנפרד. הערה: במעמיק הוראות הדמיה צריכה להיות זמין באינטרנט מיצרן מיקרוסקופ.
- לרכוש photomicrographs בכל ערוץ מבלי להזיז את החלקים או התאמת המוקד. קח תמונות בצבע, או לחלופין בגוונים אפורים ולהמיר לצבע אחר.
הערה: צבע או תמונות בגווני אפור מכל ערוץ יכול להיות אסוף שבלאחר עיבוד. - ודא סעיפי רקמות שאינם חשופים לאור הסביבה או אור מיקרוסקופי לפרקי זמן ארוכים, כמו צילום הלבנת של החלקים תתרחש. כדי להימנע מכך, להגדיל את זמן חשיפה ולא עוצמת אור / לייזר הגדלת.
- אל תכבו את מקור אור הניאון בתוך 30 דקות של להיות מופעל.
הערה: החלפת המקור לסירוגין ברצף מהיר עלולה להפחית את תוחלת החיים של הנורה הניאון.
תוצאות
תוצאות זה פרוטוקול מכתים בסעיפים רקמות מוח חולדה שכותרתו fluorescently מיקרוגלים בערוץ 594 (אדום) ותאי עצב שהכותרת בערוץ 488 (הירוק; ראו איור 4). אם כתם גרעיני נעשה, זה ייראה בערוץ 405 (הכחול). ניתן לצלם תמונות בערוצים שונים ומעולף להשוואה ישירה של שלושה ערוצים, או בין כל שני ערוצים. חבילות תוכנת רכישה דיגיטליות רבות כוללות פונקציונליות זו. פעמיים תיוג עם סמן Iba1 ופאן-עצבי המוצג כאן מדגים מיקרוגלים בעיקר מסועפים, עם תחזיות עצביות עדינות ארוכות ניכרו על פני שכבות בקליפת המוח.
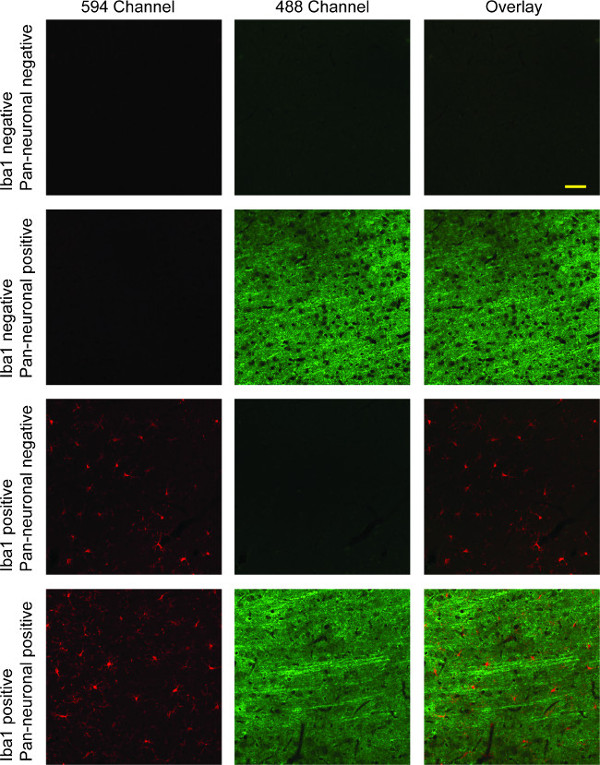
איור 4:. תמונות ניאון confocal נציג של איבא-1 / פאן-עצבי דו-תיוג טור 1 מראה מיקרוגלים מוכתמים בIba1 (אדום). נוירונים מוצגים בטור שני בירוק, עם תמונת כיסיו של שני ערוצים אדומים וירוקים בעמודה השלישית. בשורה הראשונה, יש חוסר של מכתים ספציפי מלא עקב היעדרות של שני נוגדנים הראשוניים. בשורה השנייה מתארת הספציפיות של נוגדן ראשוני פאן-עצבי לצביעה עצבית, ואילו השורה השלישית תערוכות ספציפיות של Iba1 למיקרוגלים, עם חוסר מוחלט של תגובה צולבת בשני המקרים. השורה הרביעית ממחישה כפול תיוג עם כיסוי של שני הערוצים המציגים שני microglial וצביעה עצבית. בר סולם 50 מיקרומטר.
תוצאות מכתימה עניות מוצגות גם (איור 5), כפי שמעידים חוסר גופי תא מוגדר באופן ברור ותהליכים עצביים / microglial מקוטעים. רקע גבוה מעיד על צביעה באיכות ירודה, וניתן לראות על ידי שיתוף לוקליזציה הלא ספציפית של נוגדנים (ראה איור 5). יתר על כן, אם האות חלש, צעד הגברה עם streptavidi כבול fluorescentlyניתן לשלב n. במקום להשתמש בנוגדנים משני ניאון מתויגים ישירות בשלב 2.2.6, biotinylated משנית מיושם. בעקבות שטיפה ב PBS, streptavidin (1: 1000 ב PBS) הוא מודגרות בשקופיות עבור שעה 1. חזור לפרוטוקול בשלב 2.2.7 בי שקופיות אז שטפו וטבלו בcounterstain או כיסוי החליק.
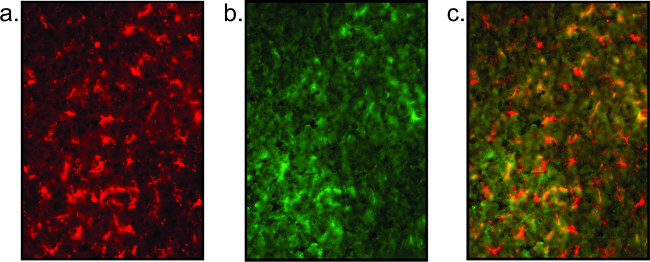
איור 5:. תמונות ניאון נציג של איכות רקמות עניה המוצג כאן הוא דוגמא לצביעה ברקמות עניות שתוצאת חוסר הבהירות של מכתים microglial (א) וחוסר הצביעה עצבית (ב) מלא. צביעה עצבית זה פשוט רקע גבוה. התמונה המעולפת (ג) היא לא משמעותית.
| שם חומר / ציוד | חברה | מספר קטלוגי | תגובות / תיאור |
| Fisherbrand שקופיות זכוכית פלוס Superfrost | פישר סיינטיפיק | 22-034-979 | משמש לרקמת הרכבה (1.2.2) |
| תנור | Thermo Scientific | 51028112 | משמש לייבוש רקמות (2.1.1) |
| Mini פאפ עט | חיים טכנולוגיות | 00-8877 | משמש בשלב 2.2.2 |
| Andwin צלחת מכתים שקופיות רקמות-Tek מדעי | פישר סיינטיפיק | 22-149-429 | משמש לכל שוטף במהלך מכתים (2.2), כמו גם את צעד Hoechst (2.2.8) |
| Kimwipes | פישר סיינטיפיק | 06-666- | משמש לייבוש שקופיות (2.2) |
| שחורה מכתים תיבה | טד פלה | 21,050 | משמש לפעולות חסימה וצביעה (2.2) |
| נורמלי חמור סרום | פישר סיינטיפיק | 50-413-253 | משמש לבלוק ודגירת נוגדן (2.2) |
| העכבר α-פאן-עצבי | Millipore | MAB2300 | משמש לנוגדן ראשוני (2.2.4) |
| ארנב α-Iba1 | Wako כימי | 019-19,741 | משמש לנוגדן ראשוני (2.2.4) |
| α-ארנב החמור 594 | ג'קסון ImmunoResearch | 711-585-152 | משמש לנוגדנים משני (2.2.6) |
| דונקי α-עכבר 488 | ג'קסון ImmunoResearch | 715-545-150 | משמש לנוגדנים משני (2.2.6) |
| הרדיד של הקייטרינג | כל | N / | משמש בצעדי 1.2.2 ו2.3.2 |
| Fluoromount-G | ביוטק דרום | 0100-01 | משמש לcoverslipping (2.2.8) |
| Coverslips | פישר סיינטיפיק | 12544E | משמש לcoverslipping (2.2.8) |
| לק ברור | כל | N / | משמש לcoverslipping (2.2.8) |
| Axio Observer.Z1 וLSM 710 (סריקת לייזר, confocal) | Carl Zeiss | N / | המשמש להדמיה (3) |
| Axioskop A2 | Carl Zeiss | N / | המשמש להדמיה (3) |
| CitriSolv | FisherScientific | לפרוטוקול DAB | |
| ABC | וקטור מעבדות | PK-6100 | לפרוטוקול DAB |
| ערכת DAB Peroxidase | וקטור מעבדות | SK-4100 | לפרוטוקול DAB |
| סוס Biotinylated α-ארנב IgG | וקטור מעבדות | תואר ראשון-1100 | לפרוטוקול DAB |
| α-עכבר הסוס Biotinylated IgG | וקטור מעבדות | תואר ראשון-2001 | לפרוטוקול DAB |
| 30% מי חמצן | FisherScientific | H325-500 | לפרוטוקול DAB |
| מדפי שקופיות ויטון ומנות מכתימה | TedPella | 21,043 | לפרוטוקול DAB |
| משאבת זלוף Masterflex וצינורות | קול-בן זוג | משמש לזלוף (1.1.1 ו1.1.2) | |
| Andwin רקמה-Tek קריו מתחם אוקטובר מדעי (מקרה של 12) | פישר סיינטיפיק | 14-373-65 | המשמש להקפאה רקמה (1.2.1) |
| מדחום (-50 עד 50 ג) | פישר סיינטיפיק | 15-059-228 | המשמש להקפאה רקמה (1.2.1) |
| Cryostat | לייקה | CM3500S | משמש לחתך רקמה (1.2.2) |
| מכתים צלחת, פלסטיק עם 2 מכסים | Grale מדעי | 353 | לretrival אנטיגן |
| 20 Rack מכתים מקום, שקופיות אופקית | Grale מדעי | 354 | לretrival אנטיגן |
| מיקרוגל | כל | N / | לretrival אנטיגן |
טבלת 1: רשימת חומרים.
Discussion
המטרה הכללית של תקשורת זו הייתה להציג נהלי אימונוהיסטוכימיה לקורא. לשם כך, את הדוגמא של דו-תיוג עם Iba1 ואנטיגנים פאן-עצביים להתבונן מיקרוגלים ונוירונים בparaformaldehyde perfused, שימש מוח החולדה cryoprotected, cryosectioned סוכרוז.
טכניקה זו יכולה להיות מותאמת לשרת מטרות אינסופיות. מערך של אנטיגנים שונים במגוון רחב של סוגי רקמות כגון, אך לא רק מוח, ריאות, כבד, כליות ומעיים יכול להיות דמיין immunohistochemically עם התאמות קלות לפרוטוקול. אימונוהיסטוכימיה מאפשרת השוואה הישירה של סמנים מרובים ויכולה להכיל עד ארבעה נוגדנים שונים במדגם יחיד. מספר הנוגדנים המשמשים במדגם אחד הוא מוגבל על ידי לדמם דרך, שמתאר חופף של אורכי גל ניאון. יש ספקטרום מוגבל ניאון אור, שכתוצאה מכך מגביל את שילובי הצביעה בתוך כמדגם Ingle (ראה איור 6).
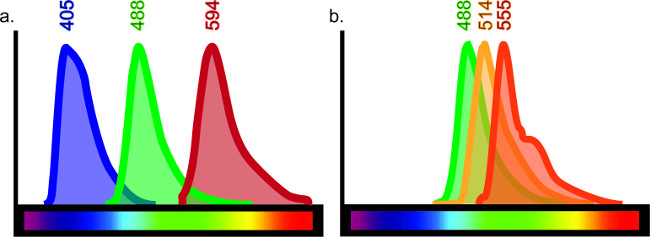
איור 6:. תרשים ספקטרום צבע כל fluorophore פולט גל ספציפי של אור כאשר נרגש לייזר או מסנן ספציפי. על מנת לייצר רקמות שכותרתו רבת ביעילות, צריכה להיות חפיפה מינימאלית בין fluorophores הספציפי מצומדת לנוגדנים. למרות שיש לפחות 10 fluorophores שונה קיים בשוק, לא ניתן להשיג תוצאות ברורות אם כל 10 משמשים. לדוגמא, משולש תיוג עם פליטת גל ב 405, 488 ו594 (א) היה נותן תיוג ברור שיש חפיפה מינימאלית, אם בכלל, בין אורכי גל אלה. עם זאת, אם פליטת גל ב 488, 514 ו 555 שימשה, מכתים לא יתפרש בקלות כמו כל נוגדן יכול להיות נרגש על ידי הלייזר או מסנן נועד לאחרים ( B). זה ייתן לי תוצאות שיתוף תיוג כוזבות. מדריכים מקוונים לבחירת fluorophore זמינים על ידי חיפוש "הצופה ספקטרום ניאון".
כאשר כפול תיוג, עדיף לבחור נוגדנים עיקריים שנעשו במינים שונים, כפי שניתן להחיל שני הנוגדנים בו זמנית. פעמיים תיוג עם שני נוגדנים מאותו המין הוא אפשרי, אם כי קשה מבחינה טכנית. כאשר שני הנוגדנים הראשוניים נעשים באותו המין, מכתים חייב להיעשות ברצף, על ידי השלמת הצביעה לאנטיגן אחד לפני השני. נושאים פחות יקומו אם יש נוגדנים העיקריים מאותו המין כיתות איג שונים (כלומר IgG עכבר והעכבר IgM או subclasses שונה IgG1 וIgG2a). לפרטים נוספים להתייעץ אזכור נוסף 10,11. פרוטוקול זה משתמש ארנב נגד Iba1 ועכבר אנטי-פאן-עצבי. כמו כן יש לכלול בקרות שליליות מתאימות. לתיוג כפול עם Ibא 1 ופאן-עצבי, שקופית אחת לא מכילה נוגדנים ראשוניים, שקופית אחת מכילה אנטי-Iba1 בלבד ושקופית אחת מכילה אנטי-פאן-עצבית בלבד (ראה איור 4). בקרות שליליות אלה מאשרים העדר התגובה צולבת והכתמת שווא. כל השקופיות אחרות מכילות את שני נוגדנים ראשוניים. כמו כן, חשוב להימנע משימוש בנוגדנים משני שעשויים לחצות-להגיב. לדוגמא, שימוש באנטי-ארנב חמור 594 וארנב אנטי עכבר 488 יביא חמור נגד הארנב 594 המחייב לשני נוגדני הארנב נגד Iba1 עיקריים ונגד הארנב החמור 594 אנטי עכבר 488 נוגדנים משני. זה היה ליצור שיתוף תיוג כוזב.
נוגדנים לחלבון מסוים (אנטיגן) הם לא תמיד זהה. לדוגמא, כמה נוגדנים שהועלו נגד אנטיגנים הנמצאים ברקמה קפוא, ואילו אחרים יכירו אנטיגן שהשתנה במהלך תהליך הטבעת פרפין. מסיבה זו, תשומת לב מיוחדת צריך להיות משולם על tהוא נוגדני גיליון מפרט לפני הרכישה. אם היישום המיועד לנוגדן אינו מופיע ברשימה, ייתכן שיידרשו לפתרון בעיות להשיג צביעה, צביעה או לא יכולה לעבוד בכלל. בנוסף, נתונים שפורסמו בעבר עשויים להציע "טריקים של המקצוע" כדי לקבל מכתים. חשיבות לציין כי הבדלים דקים שניתן לראות בקבוצות שונות של נוגדנים; שינויים קלים ייתכן שיהיו הצורך נעשה עם כל מחדש סדר נוגדן.
רוב הנוגדנים טובים במשך 12 חודשים ממועד הקבלה. הקפד לציין את מועד ההגעה בגיליון מפרט המוצר. אם מכתים נוגדן לא נצפה, הנוגדן יכול להיות ישן או מאוחסן בצורה לא נכונה מדי. לכן גם חשוב לבדוק גיליון המפרט של כל נוגדן לאחסון נאות.
בנוסף, לנוגדנים רבים, שיבוטים שונים זמינים. שיבוטים שונים להכיר חלקים שונים של אנטיגן של עניין.שיבוט נתון עשוי להיות טוב יותר לרקמה נתון לטכניקות עיבוד שונות (/ קפוא מוטבע שעווה), לכוון סוג רקמה, או מיני יעד. שים לב במיוחד למינים שבנוגדן הועלה. כאשר הנוגדן שהועלה באותו המין כמו הרקמה לניתוח, גבוה רקע אפשר לראות. כדי להילחם, חסימה נוספת זה עם ערכות זמינות מסחרי כגון עכבר על ערכת עכבר, עשוי להידרש לצביעה. טכניקה זו יכולה גם להיות מותאמת לתרבית תאים. קיבוע של תאים, שיבוט וסגוליות צריך להיבדק בגיליון המפרט עבור יישומים.
קיבוע עם חלבוני קישורים צולבים paraformaldehyde, אשר יכול להסתיר את אתרי אנטיגן מחייב בתנאים מסוימים. אחזור אנטיגן יכול לשבור קישורים צולבים חלבון ולחשוף אתרי קישור. אם נדרש אחזור אנטיגן, הכנס את הפרוטוקול הבא אחרי צעד 2.1.3: באמצעות צלחת צביעת פלסטיק ולהכניס (ראה טבלה 1), שקופיות מיקרוגלבמאגר ציטראט בכוח הגדרה נמוכה במשך 10 דקות, נזהר שלא לתת לרתיחת הפתרון בקפדנות (רמות הכח ספציפיות לא נכללו עקב השתנות בהגדרות בין מיקרוגל). לחלופין, להביא חיץ ציטראט 80 מעלות צלזיוס בצלחת צביעת זכוכית בתנור, ולאחר מכן להוסיף שקופיות במשך 10 דקות.
איכות רקמה עניה יכולה גם לגרום לבעיות עם כתמים (ראה איור 5). יש מספר אמצעי זהירות אחד יכול לנקוט כדי למנוע להתפשר על איכות רקמה. ראשון, להיות סבלני וחרוץ עם שינויי סוכרוז כדי לעקור יסודיות מים ברקמה לפני ההקפאה. כאשר הקפאה, לשמור על הטמפרטורה קבועה. אם הרקמה קופאת לאט מדי, מולקולות מים ירחיבו כפי שהם להקפיא, יצירת חורים ברקמה. לחלופין, הקפאה בטמפרטורה נמוכה מדי תגרום לרקמות לפיצוח.
פרוטוקולים ישתנו מעט עבור כל נוגדן של עניין. עם קבלת נוגדן חדש, יש לבחור imize הפרוטוקול בהתאם. אם הרקע הוא גבוה (איור 5), תנסה חסימה לתקופה ארוכה יותר של זמן. לחלופין, להגדיל את הריכוז בסרום של הפתרון לחסום או להוסיף סרום ממספר רב של עז למשל מינים שונים וסרום ארנבת. בנוסף, קזאין יכול לשמש כדי להפחית הלא ספציפי מחייב. חלב דל שומן (עשוי אבקה יבשה) מכיל קזאין וניתן להשתמש בו במגוון רחב של ריכוזים (בדרך כלל, 1-5% w / v). חלב יכול לשמש לבד, או בשילוב עם סרום. אם אנטיגן של עניין הוא סמן תאיים, ניתן להוסיף חומרי ניקוי כגון בTritonX-100 או Tween-20 לפתרון החסימה לpermeabilize קרום תא. יכולים להיות מעובד קטעי רקמה עבים יותר באופן דומה על ידי צף סעיפי רקמות בבארות במקום מקבעים אותם על גבי שקופיות. רקמות מוטבעות פרפין גם יכולות להיות מעובד באופן דומה, אך דורשת צעד השעווה-דה לפני החסימה. Feldengut et al. 12 כתובות שתי שיטות אלה.
"Jove_content"> בשל האופי רגיש לאור של נוגדני ניאון, זה קריטי, כי נוגדני ניאון מאוחסנים במיכלים כהים ולהימנע מחשיפה לאור הבא דגירה נוגדנים משני. לעומת זאת, בעת השימוש בDAB כסוכן פיתוח, חשיפה לאור היא לא מזיקה. כתמי ניאון מוגבלים בתוחלת החיים שלה. שקופיות מוכתמות פלורסנט יש לאחסן בקופסא הדוקה אור על 4 מעלות צלזיוס. תמונות צריכים להיות שנתפסו בתוך חודש של מכתים. אם הדמיה מיידית אינה אפשרית, לשקול DAB או שיטות צביעה חלופיות אחרות או הכתמת עיכוב עד ההדמיה אפשרית. צביעה עם DAB היא מוגבלת בדרך כלל למכתים אנטיגן מטרה אחת, ואילו הקרינה מאפשרת כפול ומשולש תיוג. ניתן להשיג כפול ומשולש תיוג באמצעות DAB עם זאת טכניקה זו היא נוטה לסיבוכים וקשיים בבידוד צביעת אנטיגן ספציפי. צביעת DAB ניתן דמיין תחת מיקרוסקופ שדה הבהיר, ואילו הדמיה ניאון שלtaining דורש מיקרוסקופ פלואורסצנטי.
גורם נוסף שיש לקחת בחשבון עם כתמי DAB הוא שתאי תוחלת מספר שכבות של רקמות. לכן קשה כדי להשיג תמונות ברורות של תאים כגון מיקרוגלים שיש תהליכים פורשים. כדי להתגבר על בעיה זו, כמה חוקרים לחתוך חלקיהם דקים יותר ב8-12 מיקרומטר.
הדמיה של רקמות שכותרתו fluorescently מושגת הטובה ביותר על מיקרוסקופ confocal. מיקרוסקופי confocal לחסל את האובך בדרך כלל ראה במיקרוסקופ פלואורסצנטי מחקר על ידי בידוד ולכידת מטוס אחד של פוקוס בתוך המדגם. עם מיקרוסקופיה confocal, פרטים עדינים הם חדים ולדמם דרך בין צבעי ניאון מצטמצם. ניתן הדמיה דגימות עבות מטוס אחד בכל פעם (Z- מחסנית) להפגין שיתוף לוקליזציה אמיתית. כאשר גישה למיקרוסקופ confocal אינה זמינה, הדמיה על מיקרוסקופ מחקר אפשרית, אולם זמן חשיפה ועוצמת אור צריכים להיות locked בין תמונות.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l'Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira's basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved