Method Article
미세 아교 세포와 신경 세포에 대한 예 염색 : 저온 절단 된 쥐의 뇌 조직에서 면역 조직 화학에 대한 입문서
요약
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
초록
면역 조직 화학은 동일계에서 항원의 존재, 위치 및 상대적인 풍부함을 검출하기위한 널리 이용되는 기술이다. 이 초급 프로토콜 및 미세 아교 예로서 신경 요소의 마커를 사용하여, 시약, 장비 및 설치류 뇌 조직의 면역 조직 화학 염색을 완료하기 위해 필요한 기술들을 설명한다. 특히,이 논문은 각각 Iba1과 팬의 연결에 대한 면역 조직 화학 염색을 통해 미세 아교 세포와 신경 세포의 형광 시각화를위한 단계별 프로토콜입니다. 형광 이중 라벨링 정확하게 세포 유형, 수용체, 리간드 사이의 상호 작용을 관찰 할 수있는 기회를 제공하고, 동일한 샘플 내의 다중 단백질의 위치 파악에 특히 유용하며, 및 / 또는 서로뿐만 아니라 단백질 공동과 관련된 세포 외 기질 하나의 셀 내에서 지역화. 다른 시각화 기술과는 달리, 형광 면역 조직 화학 염색의 강도가 감소 할 수있다적절한 예방 조치가되지 않는 한, 염색 다음 달에 주. 형광은 더 효율적이고, 두 개 이상의 사이보다 정확한 분화 가능으로 이러한 제한에도 불구하고, 많은 어플리케이션에서 형광 이중 표지, 예컨대 3,3'- 디아 미노 벤지딘의 tetrahydrochloride (DAB) 또는 알칼리성 포스파타제 (AP)와 같은 대안보다 선호 마커. 토론은 문제 해결 팁과 성공을 촉진하기 위해 조언을 포함한다.
서문
면역 관심 항원에 특이 적으로 결합하는 일차 항체를 사용하여 조직 절편에서 항원 (예 : 단백질)를 검출하기위한 공정이다. 그는 항체가 큰 특이성 1 항원을 지역화 할 수 있다고 판단 할 때 면역은 1934 년 JR Marrack에 의해 개척되었다. 1942 년부터, 면역 조직 화학 염색을 시각화하기 위해 형광 항체를 사용하여 연구를 체외에서 첫 번째의 일부는 생체 조직 화학적 연구에서 처음으로 4 발표 된 후 2,3, 출판되었다. 1960 년대, 삼십년 면역 조직 화학 방법의 개시 후, 효소 결합 된 항체는 보조 시약으로 사용되기 시작했다. 이 방법은 동시에 독립적으로 프랑스와 미국 5,6에서 개발되었다. 오늘, 항체의 다양한는 면역 조직 화학 연구 (7)에 대한 무한한 가능성을 제공합니다.
">이 대응의 전반적인 목표는 면역 조직 화학 염색에 대한 간략한 소개를 제공하는 것입니다, 그것은이 기술의 포괄적이고 철저한 검토하기위한 것이 아닙니다 설명 된 방법에있어서,이 항원에 대한 면역 조직 화학 기술은 미세 아교 세포에 대한 (마커를 제공하고 있습니다. 관류 파라 포름 알데히드의 염색 뉴런), 자당 cryoprotected, 저온 절단 된 쥐의 뇌. 면역 조직 화학 염색을 배경 염색을 줄이기 위해 결합 특이 항원을 차단 시작한다. 다음으로, 일차 항체와 배양이 조직의 특정 항원에 결합이 가능합니다. 차 항체에 따라, 다른 항체를 이차 항체로 명명 공액 시각화 신호 8 차 항체를 링크에 적용된다. 이차 항체 차 항체가 발생시킨 종에 특이적인 면역 글로불린 G (IgG의) 도메인을 대상. 이차 항체는 신호를 증폭 차 항체의 T의 팹 지역부터차 항체의 IgG의 도메인에 여러 사이트에 그가 차 항체 바인드. 어느 차 항체의 F C 영역에 결합 효소 또는 형광 분자 시각화를 가능하게한다. 예를 들어, 토끼 항 Iba1 일차 항체에 특이 Iba1 토끼의 IgG 분자이다. 당나귀 항 - 토끼 IgG를 이차 항체가로인가 될 때, 인식하고 토끼 항 Iba1의 IgG의 복수의 영역 (도 1 참조)에 결합된다. 당나귀 항체는 다양한 방법에 의해 시각화 될 수있다. 이 통신은 형광 현미경으로 시각화를위한, 차 항체를 인식하는 이차 항체에 결합 형광 검출에 초점을 맞추고있다. 형광 면역 조직 화학에서, 이러한 훽스트 또는 DAPI와 같은 핵 염색은 모든 핵을 시각화 할 수있다.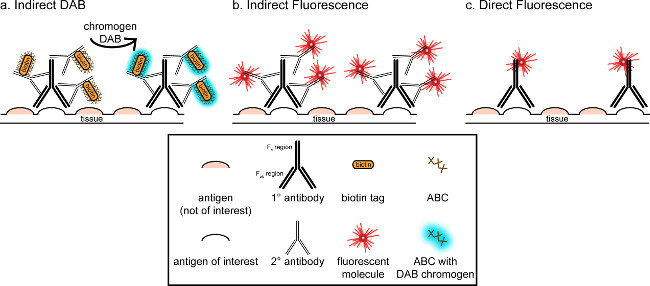
그림 1 :의 SCH직접 대 간접 항체 라벨링 기술 ematic 표현. 항체는 관심있는 항원에 결합하여 일차 항체 종에 대해 발생하는 이차 항체에 의해 증폭 될 수있다. 이 기술은 시각화 (A)에 대한 증폭 및 DAB 용 아비딘 - 바이오틴 복합체 (ABC)를 사용하여 수행 할 수있다 또는 형광 직접 접합 된 이차 항체 (B). 또한, 일차 항체가 직접 비오틴 또는 형광 (C) 등 다양한 태그와 결합 될 수있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
(DAB;도 1 및도 2 참조) 면역 조직 화학 염색의 시각화를위한 다른 방법은 3,3'- 디아 미노 벤지딘의 tetrahydrochloride를 이용한다. 이 비오틴 화를 사용하여 형광 또는 상이밝은 필드 현미경 아래에서 볼 수있는 침전물에 DAB를 변환하는 효소를 제공 말 무 퍼 옥시 다제 (HRP) 복합 이차 항체,. 단일 항원 관심 또는 염색이 오래 지속되는 것이 요구되는 경우에, DAB 형광 염색보다 더 적합 할 수있다. 그러나, DAB 염색은 두 개의 핵 항원이 관심있는 특히, 여러 마커 사이의 차별화에 적합하지 않습니다. DAB 재료 및 프로토콜 변경에 대한 자세한 내용은 표 1를 참조. 대안으로는, 니트로 블루 테트라 졸륨 클로라이드 / 5- 브로 모 -4- 클로로 -3- 인돌 릴 포스페이트 (NBT / BCIP)는 이차 공액 알칼리성 포스파타제 (AP)를 시각화하기 위해 사용될 수있다 항체.

그림 2 :. 니켈 강화 DAB 하나의 표지 쥐의 뇌 조직 섹션의 대표 이미지 쥐의 뇌는 SE는혼자 미세 아교 세포 또는 뉴런의 오래 지속되는 분석을 허용 Iba1 (A)와 팬의 연결 (B)을 위해 니켈이 강화 된 DAB로 표시되어 있습니다 ctions. 스케일 바 20 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
하나는 조직 내에서 관심있는 항원의 존재 량 추정 분석되는 것을 고려한다. 간접 방법은 위에서 설명한대로 낮은 풍부한 목표에 유용하다. 관심 항원 높은 풍부하게되면 직접 방법이 적용될 수있다. 직접 방법은 직접 시각화 신호에 결합되는 일차 항체를 포함하고, 따라서 어떤 차 항체가 필요하지 않습니다. 이 방법은 염색 공정을 단순화하지만, 간접적 인 방법에 의해 달성 증폭을 제거한다. 직접 복합 일차 항체를 사용하여 이차 항체의 교차 반응을 제거때 두 번 라벨.
이 통신은 Iba1과 팬의 연결 (표 1의 세부 사항)와 이중 라벨에 대한 프로토콜을 자세히 설명합니다. Iba1는 분지, 하이퍼 분지의 활성화, 아메바, 및로드 등 많은 활성화 상태에서 미세 아교 세포를 얼룩. 팬 신경 얼룩 신경 축삭 돌기, 그리고 소마. Iba1 대부분의 미세 아교 세포와 팬의 연결 대상에게 신경을 얼룩 때문에, 얼룩의 조합은 미세 아교 세포 - 신경 세포 상호 작용의 폭 넓은 이해를 얻는 데 유용합니다.
결론적으로, 면역 조직 화학 염색은 항체의 신중한 선택에 의존한다. 연구 문제는보다 구체적인 해짐에 따라, 다른 항원에 제기 항체는 바람직 할 수있다. 특정 소교 활성화 상태를 대상으로, 하나는 오히려 Iba1보다, CD45 또는 CD68 항체를 사용하도록 선택할 수 있습니다. 또한, 마우스를 작동에서 F4 / 80은 필요한 결과를 제공 할 수있다. 마찬가지로, 신경 요소는 특히 항체 류마티스 관절염의 대상이 될 수 있습니다핵에 대한에 다루지, 시냅스 (사전 또는 사후), 축삭, 성장 콘. 또한, 신경 세포 (더블 cortin, NeuN)의 나이를 구별 다른 마커 및 신경 재생 (GAP-43)이있다.
프로토콜
참고 : 모든 절차가 아리조나 대학의 기관 동물 관리 및 사용위원회 (IACUC)을 준수하여 수행 하였다. 추천 재료 및 장비의 목록은 표 1에서 찾을 수있다.
1. 조직 준비
- 관류
- 소듐 펜 토바 비탈 (25 ㎎ / ㎏, IP)의 과다와 설치류를 안락사, 8 ml / 분의 유속으로 완전히하여 죽인 (3-5 분)까지의 인산 완충 식염수 (PBS)을 관류로 transcardially. 깊이있는 관류 지침, 게이지 등 2012 9를 참조하십시오.
- 즉시 / 분 8 ㎖의 유속에서 15 ~ 20 분 동안 PBS에서 4 % 파라 포름 알데히드로 관류하여 조직을 고정, PBS 플러시 다음.
- 4 ℃에서 (트리스 완충 식염수를 제조 순서로, 15 %, 30 %, 30 %) 등급 자당 솔루션 다음 24 시간에 대해 4 % 파라 포름 알데히드의 두뇌와 장소를 제거합니다. 이후 자당 솔루션 O에 뇌 이동할수 있답니다 뇌 후 각 솔루션에 침몰했다. 참고 : 일반적으로, 각 솔루션에 오일이 조직이 싱크에 충분한 시간이다.
- 조직의 냉동 및 냉동 절편
- 등의 OCT 화합물로서 매체에 매립 뇌를 놓고 -35 ℃에서 펜탄으로 잠수함. 뇌가 10 분의 최소 동결 한 후 -80 ℃에서 저장할 수 있습니다. 온도 실사 촬영되지 않은 경우 문제가 발생할 수 있습니다; 문제 해결 정보에 대한 설명을 참조하시기 바랍니다.
- 20 ㎛의 두께 및 -20 ° C의 온도에서 직렬 관상 단면을 잘라. 양으로 대전 된 슬라이드에 조직을 수집합니다. 뇌 부분은 -80 ° C에서 지퍼 가기 가방과 저장 장기적으로 호일에 싸여 슬라이드 상자에 배치 될 수있다. 저장이 방법은 공기, 서리에 노출되는 것을 방지하기위한 이중 경계를 생성한다.
2. 조직 처리
참고 : 예 장비 및 재료 연구염색에 대한 equired은 그림 3과 같다. 대안을 사용할 수 있습니다, 그러나, 이러한 이미지는 면역 조직 화학 염색에 새로운 그 전에 구입에 적절한 항목을 시각화하는 데 도움이됩니다.

도 3 : 실시 예 항목이 면역 조직 화학 염색을 위해 요구 (A)에 도시 한 블랙 박스 면역 이상적인 습도 챔버 인, 슬라이드 호에 박스 포장을 필요로하지 않고 광으로부터 보호되어있다.. 단면 처리 후, 슬라이드 등의 (B)에 도시 한 바와 같이 상자 노란 박스에 저장 될 수있다. 호일로 단단히 상자를 포장 전에 냉장고에 지퍼 가기 가방에 배치하는 것은 냉동 화상에서 조직 샘플을 보호하는 데 도움이됩니다. 슬라이드의 예는 E (다른 염색 (D)에 도시 된 요리와 (C)에서 주어진다 ). 커버 슬립 그러나 1.2 두께 된 커버는 대부분의 수직 및 공 초점 현미경에 좋은 이미징 결과를 제공, 크기와 두께 (F)에 따라 다를 수 있습니다. 이러한 (G)에 나타낸 것과 연필 슬라이드 라벨을 사용할 수있다. 잉크가 실행할 수있는 영구 마커 염색 표본이 무엇인지를 결정하는 기능 모두에 영향을 피해야한다. 즉, (H)에 도시 된 바와 같이 미니 PAP 펜 구충제 테두리 슬라이드에 그려 질 수 있습니다.
- 슬라이드 준비
- 실온에서 냉동과 해동에서 슬라이드를 제거합니다.
- 옵션 : 섹션이 이전 슬라이드에서 부유 한 경우, 슬라이드를 떠에서 조직 섹션을 방지하기 위해 더 이상 4보다 시간 동안 60 ℃의 오븐에서 해동 슬라이드를 배치합니다.
- 슬라이드 랙 및 대응 접시에 놓고 슬라이드.
- 세척은 세척 용액 간의 변화, 5 분마다 PBS 세 번 슬라이드. 앞으로이 단계에서 섹션에 ì을 피하기기능 장시간 액체없이. 주 : 섹션 건조하면 배경 염색이 증가하고 의미있는 데이터를 확실하게 얻을 수 없다.
- 실온에서 냉동과 해동에서 슬라이드를 제거합니다.
- 조직 염색
- 빛을 꽉 염색 상자에서, 탈 이온수로 적신 보풀이없는 조직과 "습도 챔버를"만들 수 있습니다.
- 멀리 조직 섹션에서, 슬라이드의 맨 가장자리에 액체 구충제 테두리 만들기 위해 미니 아빠 펜을 사용, 보풀이없는 조직과 슬라이드의 가장자리를 건조. 이 경계선은 액체의 메 니스 커스 그 표면 장력이 염색에 영향을주지 않도록 조직의 가장자리 사이의 충분한 공간을 확보한다.
참고 : 관심의 항체가 전자 항원 검색을 필요로하지 않는 경우 PAP 펜 구충제 테두리 이전에 2.1.3에 적용 할 수 있습니다. PAP 펜 PBS로 세척하기 전에 적용된 경우 액성 테두리의 무결성은이 단계에서 체크한다. 경계에 틈을 채우기 위해 미니 자궁 펜을 사용합니다. , 블록 특이 항원은 PBS (블록 솔루션)에 4 % V / V의 혈청 배양에 의해 결합. 피펫 실온에서 1 시간을위한 슬라이드 당 블록 솔루션의 300 μL. 반드시 블록 용액 슬라이드의 가장자리 PAP 펜까지 연장 완전히 조직 근처 표면 장력에 의한 염색 얼룩을 방지하기 위해 조직을 포함합니다. - 이차 항체가 만들어지는 동일한 종에서 혈청을 사용합니다. 주 :이 절차에서는, 이차 항체는 당나귀에서 만들어진, 따라서 당나귀 혈청이 사용된다. 두 개 이상의 다른 종으로부터의 이차 항체가 사용되는 경우, 각각의 종으로부터 혈청을 포함한다.
- 슬라이드 위에 피펫 차 항체. 참고 :이 염색에 대한 항체 농도가 1에 최적화 된 5,000 및 1 : 각각 Iba1 및 팬 신경 500. 이러한 농도는 배경 염색의 결핍으로 의미있는 염색을 보여주는 것으로 밝혀졌다.
- 에 블록 솔루션을 희석1 % PBS에서 혈청 및 일차 항체를 추가합니다. 슬라이드 당 1 % 혈청 차 항체 용액 300 ㎕를 피펫. 다시 말하지만, 유체가 PAP 펜의 가장자리에 있는지 확인하십시오. 4 ℃에서 밤새 품어.
- Iba1도 팬의 연결도 항체를 포함하는 하나의, 팬 - 신경 세포의 항체가없는 Iba1 하나, 그리고 Iba1없이 팬의 연결 항체와 한 세 가지 제어 슬라이드를 포함합니다. 그러나 차 항체의 결합을 비 특정 테스트를 일차 항체를 생략 동일한 솔루션 같은 런 이러한 슬라이드 얼룩.
- 다음 날 아침, 세척은 세척과 솔루션을 변경, 5 분마다 PBS에 세 번 슬라이드.
- 형광 항체는 앞으로이 단계에서, 검은 색 또는 어두운 곳에서 배양 중 하나입니다 세척 용기가 박 및 하이브리드 상자에 포장되어 보장함으로써 빛의 노출을 최소화 따라서, 빛에 민감하다. 모든 슬라이드에 적절한 보조 항체를 피펫과 부화1의 농도로 실온에서 60 분 : 블록 용액 250 라이트 타이트 "습도 챔버"에 (단계 2.2.3 참조) (단계 2.2.1 참조).
- 서로 다른 파장의 이차 항체를 사용합니다. 여기서, 일차 항체 토끼 항 Iba1은 해당 이차 항체로서 당나귀 항 - 토끼 (594)를 사용한다. 일차 항체가 마우스 항 - 팬 신경은 해당 이차 항체로서 당나귀 항 마우스 (488)를 사용한다. 또는, 항 - 토끼 488 및 항 - 마우스 (594)를 사용합니다.
- 세척을 5 분마다 PBS 세 번 슬라이드.
- 옵션 : 핵 염색을 수행합니다.
- 정확히 60 초 동안 두 번 증류수 H 2 0에서 0.03 μg / ml의 농도 훽스트 (또는 다른 핵 얼룩)에 놓습니다.
- 세척을 5 분마다 PBS 세 번 슬라이드.
- DDH 2 0 씻으십시오.
- Coverslipping
- 같은 형석 등의 수성 장착 매체 커버 슬립 슬라이드,omount-G 또는 ProlongGold. 면봉을 사용하여 모든 거품을 제거하기 위해주의하십시오.
참고 : 다른 설치 에이전트를 사용할 수 그러나 높은 블리드을 통해 염료 사이는 coverslipping의 일 이내에 일부가 주목되고있다. - 가장자리를 밀봉 명확한 매니큐어를 사용하여 증발에 의한 건조되는 부분을 방지 할 수있다. 슬라이드는 평평하고 실온에서 유지하면서 매니큐어가 빛을 꽉 용기에 건조 할 수 있도록 허용 한 후 4 ℃에서 호일에 싸여 빛 기밀 용기에 저장합니다.
- 같은 형석 등의 수성 장착 매체 커버 슬립 슬라이드,omount-G 또는 ProlongGold. 면봉을 사용하여 모든 거품을 제거하기 위해주의하십시오.
3. 스테인드 조직 이미징
- 현미경 사용
- 매니큐어는 어두운 방에서 개최해야하는, 현미경을 시작하기 전에 한 시간 이상 건조시킵니다.
- 형광 광원과 디지털 카메라의 첨부 파일이있는 공 초점 또는 연구 현미경을 사용하여 현미경을 획득. 수반 소프트웨어를 사용하여 각 파장에 대한 노출 설정 - 405, 488, 및 594 - 별도. 참고 : 깊이있는 영상 지침은 현미경 제조 업체에서 온라인으로 사용할 수 있어야한다.
- 섹션을 이동하거나 초점을 조정하지 않고 각 채널에서 현미경을 획득. 컬러로 이미지를 가지고, 또는 교대로 그레이 스케일과 이후에 색상을 변환 할 수 있습니다.
참고 : 컬러 또는 각 채널에서 그레이 스케일 이미지 후 처리에 대조 할 수 있습니다. - 섹션의 사진 표백가 발생하므로, 그 조직 섹션은 오랜 기간 동안 주변 광 또는 미세한 빛에 노출되지 않도록. 이를 방지하기 위해, 증가 빛 / 레이저 강도보다는 노출 시간을 증가시킨다.
- 전원이 켜진 후 30 분 이내에 형광 광원의 전원을 끄지 마십시오.
참고 : 빠르게 연속 켜거나 소스를 전환 형광 전구의 수명을 감소시킬 수있다.
결과
이 염색 프로토콜 미세 아교 세포 형광 594 채널 (빨간색)에 표시 한 쥐의 뇌 조직 섹션에서 결과와 488 채널 레이블 뉴런 (녹색, 그림 4 참조). 핵 염색을 완료 한 경우, 채널 405 (블루)에 표시한다. 이미지는 서로 다른 채널에서의 촬영과 세 채널의 직접 비교를 위해 오버레이 또는 두 채널 사이에있을 수있다. 많은 디지털 수집 소프트웨어 스위트는이 기능을 포함한다. 여기에 표시된 Iba1 및 팬 신경 마커를 두 번 라벨은 대뇌 피질의 층에서 분명 긴 미세 신경 돌기 대부분 분지의 미세 아교 세포를 보여줍니다.
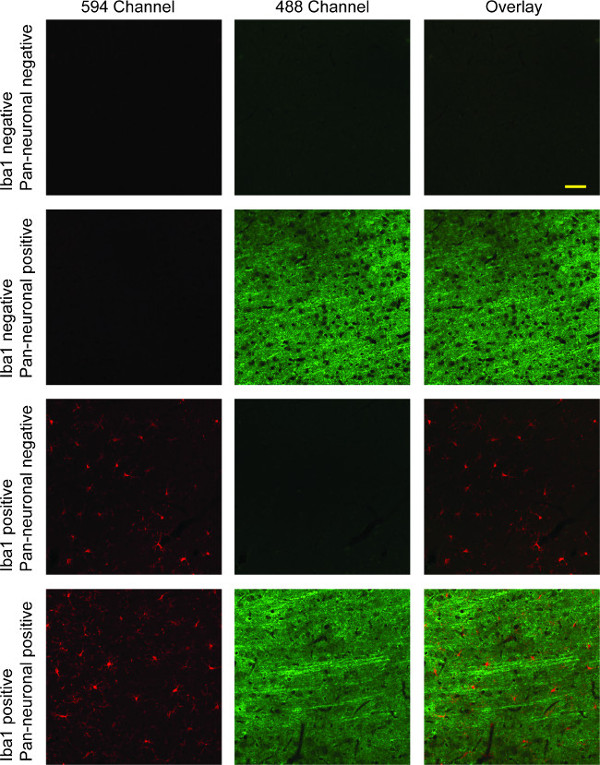
그림 4 :. 이바-1 / 팬 신경 이중 라벨 열 1의 대표 공 초점 형광 이미지 Iba1 (적색)로 염색 미세 아교 세포를 보여줍니다. 뉴런에 나타낸다세 번째 열에서 빨간색과 녹색 채널 모두의 중첩 된 이미지와 녹색에서 두 번째 열,. 첫 번째 행으로 인해 두 일차 항체의 부재에 특정 염색 완료 부족. 세 번째 행은 미세 아교 세포에 대한 Iba1의 특이성을 보여줍니다 반면, 두 번째 행은 두 경우 모두 교차 반응의 전체 부족, 신경 세포의 염색에 대한 범 신경 일차 항체의 특이성을 보여줍니다. 네 번째 행은 미세 아교 및 신경 세포 염색을 모두 보여주는 두 채널의 오버레이 이중 라벨을 보여줍니다. 스케일 바 50 μm의.
명확하게 정의 된 세포 기관 및 조각 소교 / 신경 프로세스의 부족에 의해 입증 불량 염색 결과는 (그림 5) 표시됩니다. 높은 배경 불량 염색 나타내는, 항체의 비특이적 공동 현지화 (도 5 참조)에 의해 알 수있다. 또한, 신호는 결합 된 형광 streptavidi와 증폭 단계, 약하면N이 혼입 될 수있다. 대신 단계 2.2.6에서 직접 태그 형광 차 항체를 사용, 바이오틴 보조가 적용됩니다. PBS에서 세척 후에, 스트렙 트 아비딘 (1 : PBS 1000)는 1 시간 동안 슬라이드에 배양한다. 슬라이드가 다음 세척하고 Counterstain과에 담근이나 덮개가 미끄러되는 단계 2.2.7에서 프로토콜로 돌아갑니다.
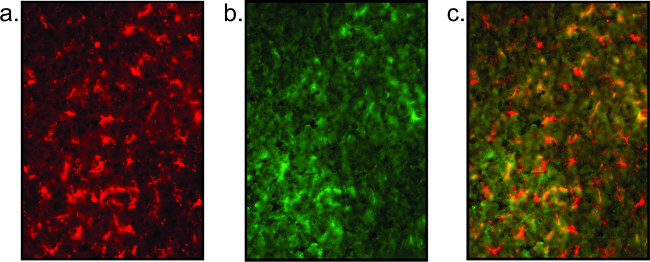
도 5 :. 불량한 조직의 품질의 대표적인 형광 이미지는 여기 표시됨 소교 염색 (a) 및 신경 세포 염색 (b)의 완전한 결핍의 선명도의 부족을 초래 불량한 조직 염색의 일례이다. 이 신경 세포 염색은 단순히 높은 배경입니다. 오버레이 이미지 (c)는 의미가 없습니다.
| 소재 / 장비의 이름 | 회사 | 카탈로그 번호 | 댓글 / 설명 |
| Fisherbrand Superfrost 플러스 유리 슬라이드 | 피셔 과학 | 22-034-979 | 장착 조직에 사용 (1.2.2) |
| 오븐 | 온도 과학 | 51028112 | 조직의 건조에 사용 (2.1.1) |
| 미니 자궁 펜 | Life 기술 | 00-8877 | 단계 2.2.2에서 사용 |
| 과학 조직 테크 슬라이드 염색 접시 Andwin | 피셔 과학 | 22-149-429 | 훽스트 단계뿐만 아니라, (2.2) 염색 동안 모든 세척에 사용 (2.2.8) |
| 매직 잉크를 킴 와이프 | 피셔 과학 | 06-666- | 건조 슬라이드에 사용 (2.2) |
| 블랙 염색 박스 | 테드 펠라 | 21050 | 차단 및 염색 단계는 (2.2)를 사용 |
| 정상 당나귀 혈청 | 피셔 과학 | 50-413-253 | 블록과 항체 배양 (2.2)에 사용 |
| 마우스 α - 팬 - 신경 | 밀리 포아 | MAB2300 | 일차 항체 (2.2.4)에 사용 |
| 토끼 α-Iba1 | 와코 화학 | 019-19741 | 일차 항체 (2.2.4)에 사용 |
| 당나귀 α-토끼 594 | 잭슨이 뮤노 | 711-585-152 | 이차 항체 (2.2.6)에 사용 |
| 당나귀 α-마우스 488 | 잭슨이 뮤노 | 715-545-150 | 이차 항체 (2.2.6)에 사용 |
| 출장 요리사의 호일 | 어떤 | N / A | 단계 1.2.2과 2.3.2에서 사용 |
| Fluoromount-G | 남부 생명 공학 | 0100-01 | coverslipping에 사용 (2.2.8) |
| 커버 슬립 | 피셔 과학 | 12544E | coverslipping에 사용 (2.2.8) |
| 클리어 매니큐어 | 어떤 | N / A | coverslipping에 사용 (2.2.8) |
| Axio Observer.Z1과 LSM 710 (레이저 스캐닝, 공 초점) | 칼 자이스 | N / A | 영상에 사용 (3) |
| Axioskop A2 | 칼 자이스 | N / A | 영상에 사용 (3) |
| CitriSolv | FisherScientific | DAB 프로토콜의 | |
| ABC | 벡터 연구소 | PK-6100 | DAB 프로토콜의 |
| DAB 퍼 옥시 다제 키트 | 벡터 연구소 | SK-4100 | DAB 프로토콜의 |
| 바이오틴 말 α - 토끼 IgG를 | 벡터 연구소 | BA-1100 | DAB 프로토콜의 |
| 바이오틴 말 (α) - 마우스 IgG | 벡터 연구소 | BA-2001 | DAB 프로토콜의 |
| 30 % 과산화수소 | FisherScientific | H325-500 | DAB 프로토콜의 |
| Wheaton의 슬라이드 랙 및 염색 요리 | TedPella | 21043 | DAB 프로토콜의 |
| MASTERFLEX 관류 펌프와 튜브 | 콜 - 파머 | 관류 (1.1.1과 1.1.2)에 사용 | |
| 과학 조직-TEK 곳을 알아내는 - 10월 화합물 Andwin (12시) | 피셔 과학 | 14-373-65 | 조직의 동결에 사용 (1.2.1) |
| 온도계 (-50 ~ 50 ℃) | 피셔 과학 | 15-059-228 | 조직의 동결에 사용 (1.2.1) |
| 저온 유지 | 라이카 | CM3500S | 조직 절편에 사용 (1.2.2) |
| 2 뚜껑 접시, 플라스틱 염색 | Grale 과학 | (353) | 항원 retrival 들어 |
| 20 장소 염색 랙, 슬라이드 가로 | Grale 과학 | (354) | 항원 retrival 들어 |
| 마이크로파 | 어떤 | N / A | 항원 retrival 들어 |
표 1 : 재료 목록.
토론
이 통신의 전반적인 목표는 독자에게 면역 조직 화학 절차를 소개했다. 이를 위해, Iba1 및 팬 신경 항원에 두 번 라벨의 예는 미세 아교 세포 및 관류 파라 포름 알데히드의 신경 세포를 관찰하기 위해, 자당 cryoprotected, 저온 절단 된 쥐의 뇌를 사용 하였다.
이 기술은 무단 목적을 제공하도록 구성 될 수있다. 뇌, 폐, 간, 신장, 소장에 제한 등 아니라 조직 유형의 다양한 상이한 항원 어레이 프로토콜에 약간의 조정으로 면역 가시화 될 수있다. 면역은 여러 마커의 직접 비교를 할 수 있으며 하나의 샘플에서 네 가지 항체까지 포함 할 수 있습니다. 하나의 샘플에 사용 된 항체의 수는 블리드 쓰루, 형광 파장의 중첩에 대해 설명에 의해 제한된다. 그 결과로서 내 염색 조합을 제한 제한된 형광 스펙트럼이 존재화롯불 샘플 (그림 6 참조).
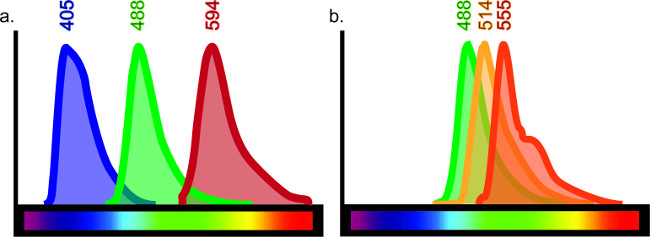
도 6 :. 특정 레이저 또는 필터에 의해 여기 된 때 색상 스펙트럼 차트 각 형광 물질은 특정 파장의 광을 방출한다. 효과적으로 멀티 - 표지 조직을 생산하기 위해, 항체에 접합 된 특정 형광체 간의 최소 오버랩이 있어야한다. 시판 적어도 10 개의 다른 형광체가 있지만, 모든 열이 사용되는 경우, 명확한 결과를 얻는 것이 불가능하다. 최소한의 중복이 파장 사이에있는 경우,이 예를 들어, 405, 488 및 594 (A)에서 파장 배출량 트리플 라벨은 명확한 표시를 줄 것이다. 488, 514 및 555에서 방출 파장이 사용 된 경우, 각각의 항체 (또는 레이저에 의해 여기 필터는 다른 의미 할 수있다 그러나, 염색을 용이하게 해석 할 수없는 것이라고 B). 이것은 거짓 공동 라벨 결과를 줄 것이다. 형광 선택을위한 온라인 가이드는 "형광 스펙트럼 뷰어"를 검색하실 수 있습니다.
경우 이중 표지 된 항체 모두가 동시에 적용될 수있는 바와 같이, 그것은 다른 종 이루어진 일차 항체를 선택하는 것이 최상이다. 같은 종의 두 항체를 두 번 라벨은 비록 기술적으로 어려운 가능합니다. 두 일차 항체는 같은 종에서 만들어진 경우, 염색은 두 번째 전에 하나의 항원에 대한 염색을 완료하여, 순차적으로 수행해야합니다. 같은 종의 일차 항체가 다른 IG 클래스 (즉, 마우스의 IgG와 마우스 IgM의 또는 다른 서브 클래스의 IgG1과의 IgG2a)가있는 경우 적은 문제가 발생합니다. 자세한 내용은 추가 참조 10, 11를 참조하십시오. 이 프로토콜은 토끼 반 Iba1와 마우스 안티 팬의 연결을 사용합니다. 그것은 적절한 음성 대조군을 포함 할 필요가있다. IB와 더블 라벨링A1과 팬의 연결, 하나의 슬라이드가 더 일차 항체가없는, 하나의 슬라이드 안티 Iba1는 하나의 슬라이드 만 안티 팬의 연결을 포함한다 (그림 4 참조)이 포함되어 있습니다. 이 음성 대조군은 교차 반응과 거짓 염색의 부재를 확인합니다. 다른 모든 슬라이드는 모두 일차 항체를 포함한다. 그것은 교차 반응 할 수있다 이차 항체를 사용하지 않도록하는 것도 중요하다. 예를 들어, 토끼 항 Iba1 차 항체와 당나귀 항 - 토끼 594 항 - 마우스 이차 항체 (488) 모두에 결합 당나귀 항 - 토끼 594 초래 당나귀 항 - 토끼 594 토끼 항 - 마우스를 사용하여 488. 이것은 거짓 공동 라벨을 만들 것입니다.
특정 단백질 (항원)에 대한 항체는 항상 동일하지 않습니다. 다른 파라핀 매립 공정 중에 변경되어 항원을 인식 할 수있는 반면, 예를 들어, 일부 항체, 냉동 조직에 존재하는 항원에 대해 발생된다. 이 때문에 특히주의가 T로 지불해야한다그는 구매에 앞서 사양서를 항체의. 항체의 의도 된 응용 프로그램이 목록에없는 경우, 문제 해결은 염색을 얻기 위해 요구 될 수있다, 또는 염색이 전혀 작동하지 않을 수 있습니다. 또한, 이전에 게시 된 데이터는 염색을 얻기 위해 "무역의 트릭을"제공 할 수 있습니다. 주목해야 할 중요한 것은 미묘한 차이는 항체의 다른 배치를 볼 수 있다는 것이다; 약간의 수정은 항체의 각 다시 주문을 할 필요가있다.
대부분의 항체는 접수 한 날로부터 12 개월에 좋다. 제품 사양서에 도착 날짜를 표시해야합니다. 항체 염색이 관찰되지 않는 경우, 항체는 너무 오래되거나 부정확하게 저장 될 수있다. 그것은 적절한 보관을 위해 각 항체의 사양서를 확인하는 것이 중요하다.
또한, 많은 항체, 다른 클론을 사용할 수 있습니다. 다른 클론 관심 항원의 다른 부분을 인식한다.주어진 복제는 다른 처리 기술 대상 조직에 대한 더있을 수 있습니다 (왁스 - 임베디드 / 냉동), 조직 유형, 또는 대상 종을 대상으로. 항체가 제기되었던 종에 특히주의를 기울이십시오. 항체 분석을위한 조직과 같은 종에서 제기되는 경우, 높은 배경을 관찰 할 수있다. 마우스 키트에 마우스로 시판 키트이 추가 차단에 대처하기 위해, 염색 필요할 수 있습니다. 이 기술은 세포 배양에 적응 될 수있다. 세포, 복제와 특이도의 고정은 응용 프로그램에 대한 사양서에서 확인해야합니다.
일부 조건에서 항원 결합 부위를 숨길 수있는 파라 포름 알데히드 가교 단백질과 고정. 항원 검색이 단백질 교차 결합을 끊고 결합 부위를 노출 할 수 있습니다. 염색 플라스틱 접시를 사용하고 (표 1 참조), 마이크로파 슬라이드 삽입 : 항원 검색이 필요한 경우, 단계 2.1.3 후 다음 프로토콜을 삽입엄격 솔루션 종기를 못하게주의하면서 10 분 동안 낮은 전원 설정에 구연산 버퍼에 (특정 전력 레벨로 인해 전자 레인지 사이의 설정에서 변화에 포함되지 않음). 대안으로, 다음 10 분간 슬라이드를 추가, 오븐에서 유리 염색 접시에 80 ° C에 구연산 완충액을 가져온다.
불량 조직 염색 품질도 (도 5 참조)에 문제를 일으킬 수있다. 한 조직의 품질을 손상시키지 않도록하기 위해 취할 수있는 조치들이있다. 첫째, 철저하게 동결하기 전에 조직에서 물을 대체하기 위해 자당의 변화와 환자와 부지런. 동결되면, 온도를 일정하게 유지한다. 조직이 너무 느리게 중지되면 그들이 동결로서, 물 분자는 조직에 구멍을 만드는 확장한다. 또는, 너무 낮은 온도에서 냉동하면 조직이 균열의 원인이됩니다.
프로토콜은 관심의 각 항체에 대한 약간 다를 수 있습니다. 새로운 항체를 수신하면, 하나는 선택해야따라서 프로토콜 imize. 배경은 (도 5) 높으면 긴 시간 동안 블로킹 시도. 선택적으로, 블록 용액의 혈중 농도를 증가 또는 상이한 종, 예를 들면 염소와 토끼 혈청으로부터 혈청을 추가한다. 또한 카제인은 비특이적 결합을 감소 시키는데 사용될 수있다. (건조 분말로부터 제조) 탈지 우유 카세인을 포함하고, 농도 범위에서 사용될 수있다 (전형적으로 1-5 중량 % / V). 우유는 단독으로 사용하거나, 혈청과 결합 될 수있다. 관심 항원이 세포 마커 인 경우, 예컨대 트리톤-100 트윈 20 세제 세포막 Permeabilize 하시려면하는 차단 용액에 첨가 될 수있다. 두꺼운 조직 섹션은 웰 조직 섹션 부동 대신 슬라이드 상들을 장착함으로써 유사하게 처리 될 수있다. 파라핀 조직은 또한 유사하게 처리하지만, 차단하기 전에 탈 왁싱하는 단계를 필요로 할 수있다. Feldengut 등. (12) 주소 이러한 방법 모두.
,이 형광 항체가 어두운 용기에 보관하고 이차 항체 배양 다음 빛 노출을 피해야되는 것이 중요합니다. 현상 제로서 DAB를 사용하는 경우는 대조적으로, 광에 대한 노출이 유해하지 않다. 형광 염색은 그 수명에 제한된다. 형광 염색 슬라이드는 4 ° C에서 빛을 꽉 상자에 보관해야합니다. 이미지는 염색 개월 이내에 촬영해야합니다. 직접 촬상 할 수없는 경우에는 촬상이 가능해질 때까지, 또는 다른 대안 DAB 염색 방법이나 지연 염색을 고려한다. 형광은 이중 및 삼중 라벨링을 허용하는 반면 DAB 염색은 보통 하나의 표적 항원 염색에 한정된다. 더블 및 트리플 라벨은 DAB 그러나이 기술은 합병증과 특이 항원 염색을 분리 어려움하는 경향이 사용하여 달성 될 수있다. DAB 염색은 형광의 촬상 반면, 명 시야 현미경 하에서 가시화 될 수있다이닝은 형광 현미경이 필요합니다.
DAB 염색으로 고려해야 할 또 다른 요인은 세포 조직의 여러 층에 걸쳐 있다는 점이다. 여기에는 스패닝 공정이 미세 아교 세포로 세포의 선명한 이미지를 얻기 어렵다. 이 문제를 극복하기 위해, 일부 연구자들은 8 ~ 12 μm의에서 자신의 섹션 얇게 잘라.
형광 표지 된 조직의 이미지에 가장 공 초점 현미경에 달성된다. 공 초점 현미경은 단리 및 샘플 내 단일 초점 평면을 캡처하여 정상적으로 연구 형광 현미경으로 볼 헤이즈를 제거한다. 공 초점 현미경으로 미세한 세부 사항은 선명하고 피를 통해 형광 염료 사이가 감소합니다. 두꺼운 샘플은 진정한 공동 현지화을 입증 할 수있는 시간 (Z-스택)에 하나의 평면을 이미지화 할 수 있습니다. 공 초점 현미경에 접속할 수없는 경우에 연구 현미경 촬영이 가능하지만, 노광 시간과 광량 LOC해야이미지 사이 KED.
공개
The authors have nothing to disclose.
감사의 말
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
자료
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
참고문헌
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l'Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira's basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유