Method Article
Primer para imunohistoquímica em tecido criosseccionada cérebro de um rato: Exemplo de coloração para Microglia e Neurônios
Neste Artigo
Resumo
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Resumo
A imuno-histoquímica é uma técnica amplamente utilizada para detectar a presença, localização e abundância relativa de antigénios in situ. Este protocolo nível introdutório descreve os reagentes, equipamentos e técnicas necessárias para concluir coloração imuno-histoquímica de tecido cerebral dos roedores, utilizando marcadores para microglia e elementos neuronais como um exemplo. Especificamente, este documento é um protocolo passo-a-passo para visualização fluorescente de microglia e neurônios via imunohistoquímica para Iba1 e pan-neuronal, respectivamente. Fluorescência-marcação dupla é particularmente útil para a localização de várias proteínas dentro da mesma amostra, proporcionando a oportunidade de observar com precisão interacções entre tipos de células, receptores, ligandos, e / ou a matriz extracelular em relação um ao outro, bem como co-proteína localização dentro de uma única célula. Ao contrário de outras técnicas de visualização, a intensidade da coloração imuno-histoquímica de fluorescência pode diminuir emas semanas a meses após a coloração, a menos que sejam tomadas precauções apropriadas. Apesar desta limitação, em muitas aplicações de rotulagem de fluorescência dupla é preferida em relação às alternativas tais como tetracloridrato de 3,3'-diaminobenzidina (DAB) ou fosfatase alcalina (AP), como fluorescência é mais eficaz do tempo e permite a diferenciação mais precisa entre dois ou mais marcadores. A discussão inclui dicas de solução de problemas e conselhos para promover o sucesso.
Introdução
A imuno-histoquímica é um processo para a detecção de antigénios (por exemplo, proteínas) em secções de tecido utilizando anticorpos primários que se ligam especificamente aos antigénios de interesse. A imuno-histoquímica foi lançada pela JR Marrack em 1934, quando ele determinou que os anticorpos poderiam localizar antígenos com grande especificidade 1. A partir de 1942, alguns dos primeiros estudos in vitro, utilizando anticorpos fluorescentes para visualizar imuno-histoquímica, foram publicadas 2,3, após o que o primeiro estudo in vivo histoquímica foi publicado em 4. Durante a década de 1960, três décadas após o início dos métodos imuno-histoquímica, os anticorpos conjugados com enzimas começou a ser usado como reagentes secundários. Estes métodos foram simultaneamente e independentemente desenvolvido na França e os EUA 5,6. Hoje, uma grande variedade de anticorpos oferece infinitas possibilidades para estudos de imunohistoquímica 7.
"> O objetivo geral desta correspondência é fornecer uma breve introdução sobre coloração imuno-histoquímica, não pretende ser uma análise abrangente e exaustiva desta técnica No método descrito, técnicas de imunohistoquímica para dois antígenos são apresentados (marcadores para microglia e. neurónios) para a coloração de paraformaldeído perfundido, sacarose crioprotegidos, criosseccionada cérebro de rato. coloração imuno-histoquímica começa com o bloqueio de ligação para reduzir a coloração de fundo não específica de antigénio. Em seguida, a incubação com anticorpo primário permite a ligação a um antigénio específico no tecido. Após o anticorpo primário, outro anticorpo, denominado anticorpo secundário, é aplicado para ligar o anticorpo primário a um sinal de visualização conjugado 8. O anticorpo secundário tem como alvo a imunoglobulina G (IgG) de domínio específico para as espécies em que o anticorpo primário foi levantadas. O anticorpo secundário amplifica o sinal do anticorpo primário, uma vez as regiões Fab de tque se ligam ao anticorpo secundário múltiplos locais no domínio de IgG do anticorpo primário. Enzimas ou moléculas fluorescentes conjugados com as regiões C F do anticorpo secundário permitir a visualização. Por exemplo, um anticorpo primário de coelho anti-Iba1 é uma molécula de IgG de coelho específico para Iba1. Quando burro anti-IgG de coelho é aplicado como anticorpo secundário, ele irá reconhecer e ligar-se a várias regiões do anticorpo anti-IgG de coelho Iba1 (ver Figura 1). O anticorpo de burro pode ser visualizado através de vários métodos. Esta correspondência se concentra na detecção de um fluoroforo conjugado com o anticorpo secundário, o qual reconhece o anticorpo primário, para a visualização por microscopia fluorescente. Em imuno fluorescente, um corante nuclear tal como Hoechst DAPI ou pode ser usado para visualizar todos os núcleos.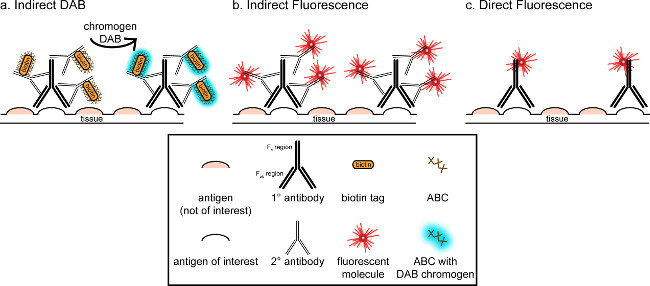
Figura 1: SchEmatic de representação directa vs. indirecta técnicas de marcação de anticorpos. Os anticorpos ligam-se ao antigénio de interesse e podem ser amplificados por anticorpos secundários dirigidos contra as espécies de os anticorpos primários. Esta técnica pode ser realizada utilizando complexo de avidina-biotina (ABC) para a amplificação e para a visualização DAB (A), ou um anticorpo secundário fluorescente directamente conjugado (B). Alternativamente, os anticorpos primários podem ser directamente conjugado com muitas marcas diferentes, incluindo biotina ou um fluoróforo (C). Por favor clique aqui para ver uma versão maior desta figura.
Um método alternativo para a visualização de coloração imuno-histoquímica utiliza 3,3'-diaminobenzidina (DAB; ver Figuras 1 e 2). Isso é diferente de fluorescência usando um biotinilado ouperoxidase de rábano (HRP) conjugado com anticorpo secundário, o qual fornece uma enzima para converter DAB a um precipitado que é visível sob microscopia de campo claro. Nos casos em que um único antígeno é de interesse ou coloração é necessário para ser duradouro, DAB pode ser mais apropriado do que a coloração fluorescente. No entanto, a coloração DAB não é bem adequada para a diferenciação entre vários marcadores, especialmente se dois antigénios nucleares são de interesse. Para obter informações sobre materiais DAB e modificações do protocolo, consultar Tabela 1. Em alternativa, cloreto de nitro azul de tetrazólio / 5-bromo-4-cloro-3-indolil fosfato (NBT / BCIP) pode ser usado para visualizar uma fosfatase alcalina (AP) secundário conjugado anticorpo.

Figura 2:. Imagens representativas de cortes de tecido cerebral de níquel reforçada DAB individuais marcado Rato Rato cérebro ifficções que são rotulados com DAB-níquel reforçada para Iba1 (A) e pan-neuronal (B) permitir a análise de longa duração da microglia ou neurônios sozinho. Barra de escala de 20 um. Por favor clique aqui para ver uma versão maior desta figura.
Deve-se considerar a abundância estimado do antigénio de interesse dentro do tecido a ser analisado. Os métodos indirectos (como descrito acima) são úteis para alvos com baixa abundância. Quando o antigénio de interesse é em grande abundância, métodos directos podem ser aplicados. Os métodos directos envolvem um anticorpo primário que é conjugado directamente a um sinal de visualização, e, portanto, não é necessária qualquer anticorpo secundário. Este método simplifica o processo de coloração, mas elimina a amplificação alcançado por métodos indirectos. Usando um anticorpo primário conjugado directamente elimina também a reactividade cruzada de anticorpos secundáriosquando a rotulagem dupla.
Esta comunicação detalha o protocolo para a rotulagem de casal com Iba1 e Pan-neuronais (detalhes na Tabela 1). Iba1 manchas microglia em muitos estados de ativação, incluindo ramificados, hiper-ramificado, ativado, amebóides, ea vara. Manchas Pan-neuronais neuronal axônios, dendritos, e Soma. Desde Iba1 manchas mais microglia e metas Pan-neuronais do neurônio, esta combinação de manchas é útil na obtenção de um amplo entendimento das interações microglia-neurônio.
Em suma, a coloração imuno-histoquímica conta com a seleção cuidadosa de anticorpos. Como a questão de pesquisa se torna mais específica, os anticorpos produzidos contra antígenos alternativas pode ser desejado. Para atingir um estado de ativação microglial específico, pode-se optar pelo uso de anticorpos CD45 ou CD68, ao invés de Iba1. Além disso, ao trabalhar com camundongos, F4 / 80 pode obter os resultados necessários. Da mesma forma, os elementos neuronais pode ser dirigida especificamente com anticorpos razada contra o núcleo, sinapse (pré ou pós), axônio, e crescimento cone. Além disso, há outros marcadores que distinguem a idade do neurónio (duas vezes Cotrin, NeuN), e a regeneração neuronal (GAP-43).
Protocolo
NOTA: Todos os procedimentos foram realizados em conformidade com o cuidado e uso de animais Comitê Institucional (IACUC) da Universidade do Arizona. Uma lista de materiais e equipamentos recomendados podem ser encontrados na Tabela 1.
1. Preparação do Tecido
- Perfusão
- Eutanásia roedor com uma overdose de pentobarbital de sódio (25 mg / kg, IP), e perfundir transcardíaca com solução salina tamponada com fosfato (PBS) antes de completamente sangrados (3-5 min) a um caudal de 8 ml / min. Para obter instruções de perfusão em profundidade, ver Gage et al 2012 9.
- Imediatamente após a descarga de PBS, fixar o tecido irrigando com paraformaldeído a 4% em PBS durante 15-20 min a um caudal de 8 ml / min.
- Remover cérebro e em lugar de 4% de paraformaldeído durante 24 horas, seguido de soluções de sacarose graduadas (15%, 30%, 30%, em sequência; preparado em solução salina tamponada com Tris) a 4 ° C. Transferir o cérebro para o subsequente solução de sacarose óomente depois que o cérebro tem afundado em cada solução. Nota: Normalmente, 5 dias em cada solução é tempo suficiente para que o tecido a afundar.
- Congelamento do tecido e cryosectioning
- Inserir o cérebro em meio de inclusão, tal como o composto outubro e submergir em isopentano a uma temperatura de -35 ° C. Permitir que o cérebro de congelamento por um período mínimo de 10 minutos, e, em seguida, armazena-se a -80 ° C. Problemas podem surgir se a diligência temperatura não é tomada; por favor, veja a discussão para solucionar problemas de informações.
- Os cortes coronais em série com uma espessura de 20 um e uma temperatura de -20 ° C. Recolha tecido em lâminas carregados positivamente. Secções do cérebro pode ser colocado em uma caixa corrediça envolvido em folha de um saco de correr superior e armazenada a longo prazo a -80 ° C. Este método de armazenamento cria um limite duplo para evitar a exposição ao ar e geada.
2. Processamento de Tecidos
NOTA: equipamentos e materiais Exemplo required para a coloração são mostrados na Figura 3. As alternativas estão disponíveis, no entanto, essas imagens vão ajudar aqueles novos para coloração imuno-histoquímica de visualizar itens apropriados antes de comprar.

Figura 3: Exemplo de itens necessários para coloração imuno-histoquímica A caixa preta mostrado em (A) é uma câmara de umidade ideal para imunofluorescência, como lâminas são protegidas da luz sem a necessidade de envolver a caixa na folha.. Após corte, as lâminas podem ser armazenadas numa caixa tal como a caixa de amarelo mostrado em (B). Envolvendo a caixa firmemente em papel alumínio e colocar em um saco zip-top antes do congelador ajuda a proteger as amostras de tecido do freezer queimar. Um exemplo de lâminas é dada em (C), com diferentes pratos de coloração descritos em (D) e (E ). As lamelas podem variar em tamanho e espessura (F), no entanto 1.2 lamelas grossas proporcionam bons resultados de imagem na maioria dos microscópios confocais e verticais. Um lápis tal como o representado em (G) pode ser utilizado para rotular os slides. Marcadores permanentes devem ser evitados como a tinta pode correr, afetando tanto a coloração ea capacidade de determinar que a amostra é. Uma caneta PAP de mini tal como o mostrado em (H) permite uma borda repelente para ser desenhada em lâminas.
- Preparação da lâmina
- Retirar as lâminas do congelador e descongelamento à temperatura ambiente.
- Opcional: Se as secções foram previamente flutuou de lâminas, colocar as lâminas descongeladas num forno a 60 ° C durante não mais de 4 horas para ajudar a prevenir a partir de secções de tecido flutuando lâminas.
- Colocar as lâminas em um rack de slides e correspondente prato.
- Lave as lâminas três vezes em PBS durante 5 min cada, solução entre lavagens mudando. A partir deste passo em frente, evite ter seçons sem líquido por longos períodos de tempo. Nota: Se seções secar, coloração de fundo é aumentada e dados significativos não pode ser obtida de forma confiável.
- Retirar as lâminas do congelador e descongelamento à temperatura ambiente.
- A coloração de tecidos
- Em uma caixa de coloração à prova de luz, criar uma "câmara de umidade", com tecidos sem fiapos umedecido com água deionizada.
- Seque as bordas do slide com um tecido que não solte fiapos, use um mini caneta pap para fazer uma fronteira repelente líquido bem na borda do slide, longe de cortes de tecido. Esta fronteira devem assegurar suficiente espaço entre o menisco do líquido e a borda do tecido de modo que a tensão superficial não afecta a coloração.
NOTA: O repelente fronteira caneta PAP pode ser aplicado antes 2.1.3 se os anticorpos de interesse não precisa de recuperação de antigénios microondas. Se a caneta pap tem sido aplicado antes da lavagem em PBS, a integridade da fronteira repelente de líquido deve ser verificado nesta etapa. Use uma caneta mini-pap para preencher eventuais lacunas na fronteira. - Com as lâminas colocado horizontalmente, a ligação não específica de antigénio bloco por incubação em 4% v / v de soro em PBS (solução bloqueadora). Pipetar 300 ul de solução de bloqueio, por lâmina, durante 1 hora à temperatura ambiente. Certifique-se a solução de bloqueio estende-se para a caneta PAP na borda da lâmina e cobre completamente o tecido para evitar a coloração desigual provocado por tensão superficial perto do tecido.
- Use soro da mesma espécie em que o anticorpo secundário é feito. Nota: Neste processo, os anticorpos secundários são feitos em burro, e, assim, é utilizado soro de burro. Se forem utilizados anticorpos secundários a partir de duas ou mais espécies diferentes, incluem soro de cada espécie.
- Pipeta anticorpo primário em lâminas. Nota: As concentrações de anticorpos para esta coloração foram otimizados em 1: 5.000 e 1: 500 para Iba1 e pan-neuronal, respectivamente. Estas concentrações foram encontrados para mostrar a coloração significativa com uma ausência de coloração de fundo.
- Solução diluída de bloco para1% de soro em PBS e adicionar anticorpos primários. Pipetar 300 ul de solução de anticorpo primário em 1% de soro, por lâmina. Mais uma vez, é assegurar que o fluido para a extremidade da caneta PAP. Incubar durante a noite a 4 ° C.
- Incluem três lâminas de controlo: uma que contém anticorpos nem Iba1 nem Pan-neuronais, um com Iba1 sem anticorpo pan-neuronal, e outro com anticorpos pan-neuronal sem Iba1. Mancha estas lâminas na mesma corrida com as mesmas soluções, no entanto omitir os anticorpos primários para testar a ligação não específica de anticorpos secundários.
- Na manhã seguinte, lavagem das lâminas três vezes em PBS durante 5 min cada, solução entre lavagens mudando.
- Anticorpos fluorescentes são sensíveis à luz, portanto, a partir deste passo em frente, minimizar a exposição à luz, garantindo recipientes de lavagem são envoltos em papel alumínio e caixas de hibridação são preto ou incubadas no escuro. Pipetar os anticorpos secundários apropriados em todos os slides e incubar por60 min à temperatura ambiente a uma concentração de 1: 250 em solução de bloqueio (ver o passo 2.2.3) em uma "câmara de humidade" à prova de luz (ver o passo 2.2.1).
- Use anticorpos secundários de diferentes comprimentos de onda. Aqui, para o anticorpo primário de coelho anti-Iba1, utilizar coelho de burro anti-594 como o anticorpo secundário adequado. Para o rato anticorpo primário anti-Pan-neuronal, utilizar de burro anti-ratinho de 488 como o anticorpo secundário adequado. Alternativamente, usam anti-coelho 488 e 594 anti-rato.
- Lave as lâminas três vezes em PBS durante 5 min cada.
- Opcional: executar coloração nuclear.
- Colocar em Hoechst (ou outro corante nuclear) a uma concentração de 0,03 ug / ml em H2O destilada dupla para 0 exactamente 60 segundos.
- Lave as lâminas três vezes em PBS durante 5 min cada.
- Lavar em DDH 2 0.
- Lamínula
- Lâminas lamela com um meio de montagem aquoso, tal como Fluoromount-G ou ProlongGold. Tome o cuidado de remover todas as bolhas usando um aplicador com ponta de algodão.
Nota: Outros agentes de montagem poderia ser usado, por mais alto bleed-through entre corantes tem sido observado por alguns poucos dias de lamínulas. - Use clara unha polonês para selar as bordas, evitando as seções de secar devido à evaporação. Permitir unha polonês para secar em um recipiente à prova de luz, enquanto desliza permanecer plana e à temperatura ambiente, e, em seguida, armazenar em um recipiente à prova de luz envolvido em folha a 4 ° C.
- Lâminas lamela com um meio de montagem aquoso, tal como Fluoromount-G ou ProlongGold. Tome o cuidado de remover todas as bolhas usando um aplicador com ponta de algodão.
3. Imaging o tecido manchado
- Microscopia
- Permitir a unha polonês para secar por pelo menos uma hora antes de começar microscopia, o que deve ocorrer em uma sala escura.
- Adquirir microfotografias usando um microscópio confocal ou pesquisa com uma fonte de luz fluorescente e um anexo de câmera digital. Usando o software que acompanha, definir a exposição para cada comprimento de onda - 405, 488, e 594 - separadamente. Nota: em profundidade instruções de imagem deve estar disponível on-line a partir do fabricante microscópio.
- Adquirir microfotografias em cada canal, sem mover as seções ou ajustar o foco. Tire fotos em cor, ou alternadamente em escala de cinza e converter para colorir depois.
Observação: As imagens em escala de cinza de cada canal de cor ou pode ser agrupada em pós-processamento. - Assegurar que as secções de tecidos não são expostas à luz ambiente ou luz de microscópio, para longos períodos de tempo, como foto-branqueamento das secções ocorrerá. Para evitar isso, aumentar o tempo de exposição, em vez de aumentar a intensidade de luz / laser.
- Não desligue a fonte de luz fluorescente dentro de 30 min de ser ligado.
Nota: Alterar a origem de ligar e desligar em rápida sucessão pode diminuir a vida útil da lâmpada fluorescente.
Resultados
Este protocolo de coloração resulta em cortes de tecido de cérebro de rato que microglia com marcação fluorescente no canal 594 (vermelho) e neurónios marcados no canal 488 (verde; ver Figura 4). Se uma mancha nuclear tem sido feito, ele irá mostrar no canal 405 (azul). As imagens podem ser tomadas em diferentes canais e sobrepostos para comparação directa dos três canais, ou entre quaisquer dois canais. Muitos pacotes de software de aquisição digitais incluir essa funcionalidade. Double-marcação com Iba1 e pan-neuronal marcador mostrado aqui demonstra principalmente microglia ramificada, com longas projeções neuronais finas evidentes através de camadas corticais.
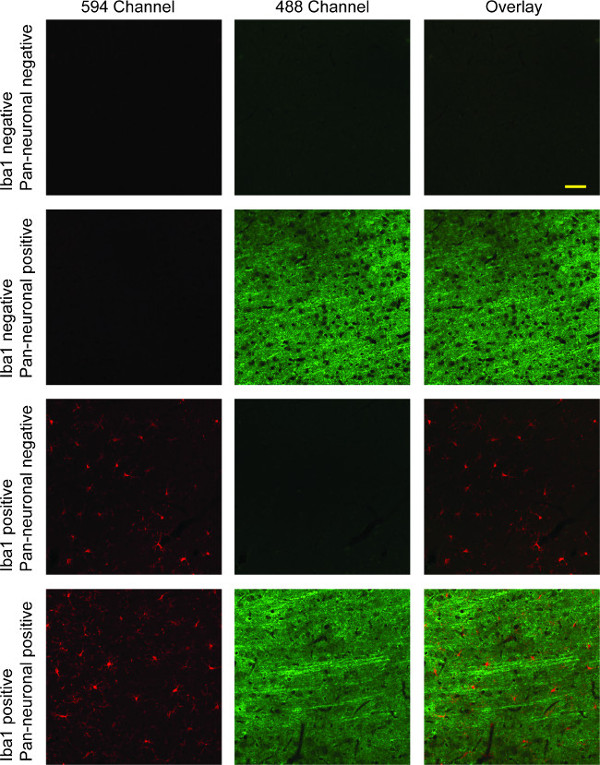
Figura 4:. Imagens fluorescentes confocal representativos de Iba-1 / Pan-neuronal dupla rotulagem Coluna 1 mostra microglia coradas com Iba1 (vermelho). Os neurónios são mostrados nasegunda coluna em verde, a imagem sobreposta de ambos os canais vermelho e verde na terceira coluna com. Na primeira linha, existe uma total ausência de coloração específica, devido à ausência de ambos os anticorpos primários. A segunda linha descreve a especificidade do anticorpo primário Pan-neuronal para a coloração neuronal, ao passo que a terceira linha mostra a especificidade de Iba1 para a microglia, com uma total ausência de reactividade cruzada em ambos os casos. A quarta linha ilustra a rotulagem de casal com uma sobreposição dos dois canais que mostram tanto microglial e coloração neuronal. Barra de escala 50? M.
Maus resultados de coloração são também mostrados (Figura 5), tal como evidenciado pela ausência de corpos celulares bem definidos e processos neuronais / microgliais fragmentados. Alta fundo é indicativa de coloração fraca qualidade, e pode ser visto por co-localização não específica de anticorpos (ver Figura 5). Além disso, se o sinal estiver fraco, um passo de amplificação com streptavidi limite fluorescenten pode ser incorporada. Em vez de usar um anticorpo secundário fluorescente etiquetado directamente no passo 2.2.6, um derivado biotinilado é aplicado. Após lavagem em PBS, a estreptavidina (1: 1000 em PBS) foi incubado sobre as lâminas durante 1 h. Retornar ao protocolo no passo 2.2.7 onde as lâminas são então lavadas e imersas em um counterstain ou a tampa escorregou.
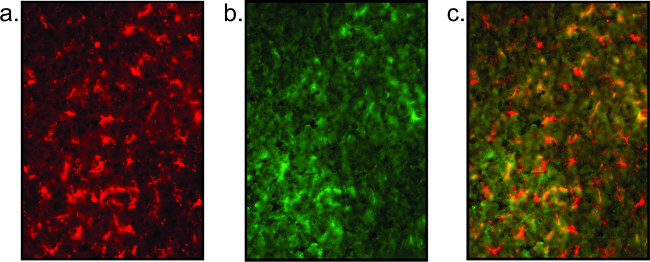
Figura 5:. Imagens fluorescentes representativo da qualidade do tecido pobre Aqui é mostrado um exemplo de coloração no tecido pobre o que resulta numa falta de clareza da coloração da microglia (a) e completa falta de coloração neuronal (b). Esta coloração neuronal é simplesmente elevada interferência de fundo. A imagem sobreposta (c) não é significativo.
| Nome de materiais / Equipamento | Companhia | Número de Catálogo | Comentários / Descrição |
| Fisherbrand Superfrost Mais de lâminas de vidro | Fisher Scientific | 22-034-979 | Usado para o tecido de montagem (1.2.2) |
| Forno | Thermo Scientific | 51028112 | Usado para a secagem de tecidos (2.1.1) |
| Mini Pap caneta | Life Technologies | 00-8877 | Usado na etapa 2.2.2 |
| Andwin Tissue-tek Deslize Coloração Dish Científica | Fisher Scientific | 22-149-429 | Usado para todas as lavagens durante a coloração (2.2), bem como o passo de Hoechst (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Usado para secar as lâminas (2.2) |
| Preto Coloração Box | Ted Pella | 21050 | Usado para bloqueio e de coloração etapas (2.2) |
| Donkey normal Serum | Fisher Scientific | 50-413-253 | Usado para o bloco e anticorpo incubação (2.2) |
| Rato α-Pan-neuronal | Millipore | MAB2300 | Usado para anticorpo primário (2.2.4) |
| Coelho α-Iba1 | Wako Chemical | 019-19741 | Usado para anticorpo primário (2.2.4) |
| Donkey α-coelho 594 | Jackson ImmunoResearch | 711-585-152 | Usado para anticorpo secundário (2.2.6) |
| Donkey α-rato 488 | Jackson ImmunoResearch | 715-545-150 | Usado para anticorpo secundário (2.2.6) |
| Folha de fornecedor | Qualquer | N / D | Usado em passos 1.2.2 e 2.3.2 |
| Fluoromount-G | Biotech Sul | 0100-01 | Usado para lamínulas (2.2.8) |
| Lamelas | Fisher Scientific | 12544E | Usado para lamínulas (2.2.8) |
| Limpar Nail Polish | Qualquer | N / D | Usado para lamínulas (2.2.8) |
| Axio Observer.Z1 e LSM 710 (de varredura a laser, confocal) | Carl Zeiss | N / D | Usado para geração de imagens (3) |
| Axioskop A2 | Carl Zeiss | N / D | Usado para geração de imagens (3) |
| CitriSolv | FisherScientific | Para o protocolo de DAB | |
| Abc | Vector Laboratories | PK-6100 | Para o protocolo de DAB |
| Kit DAB peroxidase | Vector Laboratories | SK-4100 | Para o protocolo de DAB |
| Cavalo Biotinylated α-coelho IgG | Vector Laboratories | BA-1100 | Para o protocolo de DAB |
| Α-rato de cavalo IgG biotinilada | Vector Laboratories | BA-2001 | Para o protocolo de DAB |
| 30% Peróxido de Hidrogênio | FisherScientific | H325-500 | Para o protocolo de DAB |
| Wheaton porta-lâminas e pratos de coloração | TedPella | 21043 | Para o protocolo de DAB |
| Bomba de perfusão Masterflex e tubos | Cole-Parmer | Usado para perfusão (1.1.1 e 1.1.2) | |
| Andwin CRIO-OCT composto Tissue-Tek científica (case of 12) | Fisher Scientific | 14-373-65 | Usado para congelamento do tecido (1.2.1) |
| Termómetro (-50 a 50 C) | Fisher Scientific | 15-059-228 | Usado para congelamento do tecido (1.2.1) |
| Criostato | Leica | CM3500S | Usado para corte de tecidos (1.2.2) |
| A coloração prato, de plástico com duas tampas | Grale Científica | 353 | Para antígeno retrival |
| 20 Lugar suporte de coloração, Slides Horizontal | Grale Científica | 354 | Para antígeno retrival |
| Microondas | Qualquer | N / D | Para antígeno retrival |
Tabela 1: Lista de Materiais.
Discussão
O objectivo global desta comunicação era introduzir procedimentos de imuno-histoquímica para o leitor. Para isso, o exemplo da rotulagem de casal com Iba1 e antígenos Pan-neuronais para observar microglia e neurônios em paraformaldeído perfusão, foi utilizado sacarose cérebro crioprotegidos, rato criosseccionada.
Esta técnica pode ser adaptado para servir finalidades infinitas. Uma matriz de antigénios diferentes numa variedade de tipos de tecidos tais como, mas não limitado para o cérebro, pulmão, fígado, rim e intestino pode ser visualizado de forma imunohistoquímica com pequenos ajustes ao protocolo. A imuno-histoquímica permite a comparação directa de vários marcadores e podem abranger até quatro anticorpos diferentes numa única amostra. O número de anticorpos utilizados em uma amostra é limitada pela purga-through, que descreve a sobreposição de comprimentos de onda fluorescentes. Há um limitado espectro de luz fluorescente, o que limita, por conseguinte, as combinações de coloração dentro comoingle amostra (veja a Figura 6).
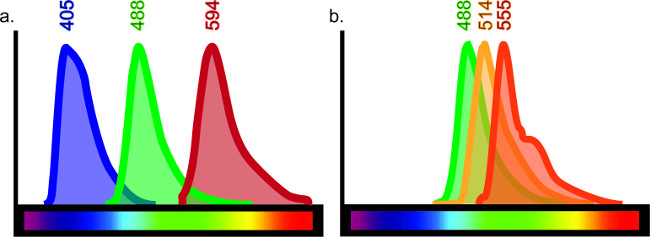
Figura 6:. Carta de cor de espectro Cada fluor�oro emite um comprimento de onda específico de luz quando animado por um laser ou filtro específico. A fim de produzir eficazmente o tecido multi-marcado, deve haver um mínimo de sobreposição entre os fluoróforos específicos conjugados com os anticorpos. Apesar de existirem, pelo menos, 10 fluoróforos diferentes disponíveis no mercado, não é possível obter resultados claros, se forem utilizadas todas as 10. Por exemplo, a rotulagem triplo com emissões de comprimento de onda a 405, 488 e 594 (A) daria uma rotulagem clara como há uma sobreposição mínima, se houver, entre estes comprimentos de onda. No entanto, se foram usadas as emissões de comprimento de onda a 488, 514 e 555, a coloração não seriam facilmente interpretados como cada anticorpo pode ser animado pelo laser ou filtro significou para o outro ( B). Isso daria falsos resultados co-rotulagem. Guias on-line para a seleção fluorophore estão disponíveis através da procura de "visualizador de espectro fluorescente".
Quando a rotulagem de casal, o melhor é escolher anticorpos primários feitos em diferentes espécies, como ambos os anticorpos podem ser aplicadas simultaneamente. Duplo-marcação com dois anticorpos das mesmas espécies é possível, embora tecnicamente difícil. Quando ambos os anticorpos primários são feitas nas mesmas espécies, a coloração deve ser feito sequencialmente, ao completar a coloração para um antigénio antes da segunda. Menos problemas surgirão se os anticorpos primários a partir da mesma espécie têm diferentes classes de Ig (ou seja, IgG de ratinho e IgM de ratinho ou diferentes subclasses IgG1 e IgG2a). Para mais detalhes consultar referências adicionais 10,11. Este protocolo usa coelho anti-Iba1 e rato anti-pan-neuronal. Também é necessário incluir controlos negativos adequados. Para a rotulagem de casal com Iba1 e pan-neuronal, um slide não contém anticorpos primários, um slide contém anti-Iba1 única e um slide contém apenas anti-pan-neuronal (veja a Figura 4). Esses controles negativos confirmar a ausência de reatividade cruzada e coloração falso. Todas as outras lâminas conter ambos os anticorpos primários. É também importante para evitar o uso de anticorpos secundários que podem reagir de forma cruzada. Por exemplo, usando de burro anti-coelho e 594 de coelho anti-ratinho 488 resultaria em burro anti-coelho de ligação 594 para ambos anticorpo primário de coelho anti-Iba1 eo de burro anti-coelho 594 anti-ratinho de 488 de anticorpo secundário. Isso criaria co-rotulagem falsa.
Os anticorpos para uma proteína particular (antigene) não são sempre os mesmos. Por exemplo, alguns anticorpos são criados contra os antigénios que estão presentes no tecido congelado, enquanto que os outros irão reconhecer um antigénio que foi alterado durante o processo de imersão em parafina. Por este motivo, uma atenção especial deve ser dada para tele anticorpo folha de especificações antes da compra. Se a aplicação pretendida para o anticorpo não estiver listado, resolução de problemas pode ser necessário para obter a coloração, ou coloração pode não funcionar em todos. Além disso, os dados anteriormente publicados podem oferecer "truques do comércio" para obter a coloração. Importante notar é que as diferenças subtis podem ser vistos em diferentes lotes de anticorpos; ligeiras modificações podem precisar de ser feita com cada re-fim de um anticorpo.
A maioria dos anticorpos são boas para 12 meses a partir da data de recebimento. Certifique-se de indicar a data de chegada na folha de especificação do produto. Se coloração de anticorpos não é observado, o anticorpo pode ser demasiado velho ou armazenados de forma incorreta. Por isso, é também importante verificar folha de especificações de cada anticorpo para o armazenamento adequado.
Além disso, para muitos anticorpos, diferentes clones estão disponíveis. Diferentes clones reconhecem diferentes partes do antigénio de interesse. UMAdeterminado clone pode ser melhor para o tecido submetido a diferentes técnicas de processamento (/ congelados embebidos em cera), tipo de tecido alvo, ou espécie-alvo. Preste especial atenção às espécies em que o anticorpo foi levantadas. Quando o anticorpo é gerado nas mesmas espécies como o tecido para análise, alta fundo podem ser observadas. Para combater isto, o bloqueio adicional com kits disponíveis comercialmente, tais como um rato no kit de rato, pode ser necessária para a coloração. Esta técnica também pode ser adaptado para cultura de células. Fixação de células, clone e especificidade precisam ser verificados na folha de especificações para as aplicações.
Fixação com ligações cruzadas proteínas paraformaldeído, o que poderia esconder locais de ligação de antigénio em algumas condições. Recuperação antigênica pode quebrar proteína ligações cruzadas e expor os locais de ligação. Se recuperação de antigénios é necessário, inserir o protocolo seguinte depois do passo 2.1.3: usando uma coloração prato plástico e inserir (ver Tabela 1), as corrediças de microondasem tampão citrato em uma configuração de baixa energia, durante 10 minutos, tendo o cuidado de não deixar ferver solução rigorosamente (níveis de potência específicos não incluídos devido à variabilidade nas definições entre microondas). Alternativamente, trazer tampão citrato a 80 ° C num prato de vidro para coloração num forno, em seguida, adicionar as lâminas durante 10 min.
Qualidade do tecido pobre também pode causar problemas com coloração (veja a Figura 5). Há uma série de precauções pode tomar para evitar comprometer a qualidade do tecido. Em primeiro lugar, ser paciente e diligente com mudanças de sacarose de modo a deslocar completamente a água no tecido antes de congelar. Quando congelar, manter a temperatura constante. Se o tecido congela muito devagar, as moléculas de água vai aumentando à medida que congelar, a criação de furos no tecido. Alternativamente, o congelamento a uma temperatura demasiado baixa fará com que o tecido a rachar.
Os protocolos variam ligeiramente para cada anticorpo de interesse. Após o recebimento de um novo anticorpo, deve-se optarimize o protocolo em conformidade. Se o fundo é alta (Figura 5), para tentar bloquear um longo período de tempo. Alternativamente, aumentar a concentração sérica da solução bloco ou adicionar soro de cabra por exemplo, múltiplos espécies diferentes e soro de coelho. Além disso, a caseína pode ser usada para reduzir a ligação não específica. O leite desnatado (feita a partir de pó seco) contém caseína e pode ser utilizado numa gama de concentrações (tipicamente, 1-5% w / v). O leite pode ser usado sozinho, ou em conjunto com o soro. Se um antigénio de interesse é um marcador intracelular, tais detergentes em Triton X-100 ou Tween-20 pode ser adicionada à solução de bloqueio para permeabilizar as membranas das células. Secções de tecido mais grossos podem ser processados de modo semelhante as secções de tecido por flutuação em poços em vez de montá-los em lâminas. Tecido embebido em parafina pode também ser processada de forma semelhante, mas requer um passo de depilação antes do bloqueio. Feldengut et al. 12 endereços de ambos os métodos.
Devido à natureza sensível à luz de anticorpos fluorescentes, é crítico que os anticorpos fluorescentes são armazenados em recipientes escuros e evitar a exposição à luz a seguir à incubação do anticorpo secundário. Em contraste, quando utilizando DAB como um agente de revelação, a exposição à luz não é prejudicial. Coloração fluorescente é limitado em sua longevidade. Lâminas fluorescentes coradas deve ser armazenado em uma caixa estanque a luz a 4 ° C. As imagens devem ser capturados dentro de um mês de coloração. Se de imagem imediata não for possível, considere DAB ou outros métodos de coloração alternativas ou coloração atraso até imaging é possível. A coloração com DAB é normalmente limitada a coloração de um antigénio alvo, ao passo que a fluorescência permite a dupla-marcação tripla e. Double-e-marcação tripla pode ser conseguida utilizando DAB contudo esta técnica é sujeito a complicações e a dificuldade em isolar coloração antigénio específico. Coloração DAB podem ser visualizados sob microscopia de campo claro, enquanto imagens fluorescentes staining requer um microscópio fluorescente.
Outro factor a ter em conta com coloração DAB é que as células abranger várias camadas de tecido. Por conseguinte, é difícil a obtenção de imagens claras de células, tais como a microglia que têm processos de expansão. Para superar este problema, alguns investigadores cortar suas seções mais finas no 8-12 pm.
Imagem de tecido marcado por fluorescência é melhor alcançada em um microscópio confocal. Microscópios confocal eliminar a neblina normalmente visto com um microscópio fluorescente pesquisa isolando e capturando um único plano de foco dentro da amostra. Com microscopia confocal, pequenos detalhes são mais nítidas e sangrar-through entre corantes fluorescentes é reduzida. As amostras mais espessas podem ser visualizados num plano de cada vez (z-pilha) para demonstrar verdadeiro co-localização. Quando o acesso a um microscópio confocal não está disponível, a imagem latente num microscópio de pesquisa é possível, no entanto, o tempo de exposição e a intensidade da luz precisa ser locked entre imagens.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materiais
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
Referências
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l'Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira's basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados