Method Article
Primer per immunoistochimica su Cryosectioned Rat tessuto cerebrale: Esempio colorazione per Microglia e neuroni
In questo articolo
Riepilogo
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
L'immunoistochimica è una tecnica largamente usata per rilevare la presenza, la posizione e l'abbondanza relativa di antigeni in situ. Questo protocollo di livello introduttivo descrive i reagenti, le attrezzature e le tecniche necessarie per completare immunoistochimica del tessuto cerebrale dei roditori, utilizzando marcatori per microglia e gli elementi neuronali come esempio. In particolare, questo documento è un protocollo step-by-step per la visualizzazione fluorescente della microglia e neuroni tramite immunoistochimica per Iba1 e Pan-neuronale, rispettivamente. Fluorescenza doppia etichettatura è particolarmente utile per la localizzazione di più proteine all'interno dello stesso campione, fornendo la possibilità di osservare accuratamente interazioni tra tipi cellulari, recettori, ligandi, e / o la matrice extracellulare in relazione l'uno all'altro così come proteina co localizzazione all'interno di una singola cellula. A differenza di altre tecniche di visualizzazione, la fluorescenza immunoistochimica intensità della colorazione può diminuire inle settimane a mesi seguenti la colorazione, se non si prendono le opportune precauzioni. Nonostante questa limitazione, in molte applicazioni di fluorescenza doppia etichettatura è preferito su alternative come 3,3'-diaminobenzidina tetraidrocloruro (DAB) o fosfatasi alcalina (AP), come fluorescenza è più tempo efficiente e permette di differenziare più precisa tra due o più marcatori. La discussione include la risoluzione dei problemi e consigli per promuovere il successo.
Introduzione
L'immunoistochimica è un processo per rilevare antigeni (cioè proteine) in sezioni di tessuto utilizzando anticorpi primari che si legano specificamente agli antigeni di interesse. L'immunoistochimica è stato lanciato da JR Marrack nel 1934, quando decise che gli anticorpi possano localizzare gli antigeni con grande specificità 1. A partire dal 1942, tra i primi studi in vitro con anticorpi fluorescenti per visualizzare immunoistochimica sono stati pubblicati 2,3, dopo di che il primo studio in vivo istochimico è stato pubblicato 4. Durante il 1960, tre decenni dopo l'inizio dei metodi di immunoistochimica, gli anticorpi enzima-coniugati cominciarono ad essere usati come reagenti secondari. Questi metodi sono stati contemporaneamente e indipendentemente sviluppate in Francia e negli Stati Uniti 5,6. Oggi, una vasta gamma di anticorpi fornisce infinite possibilità per gli studi di immunoistochimica 7.
"> L'obiettivo generale di questa corrispondenza è quello di fornire una breve introduzione in immunoistochimica, ma non vuole essere una rassegna completa ed esaustiva di questa tecnica Nel metodo descritto, tecniche di immunoistochimica per due antigeni sono presentati (marker di microglia e. neuroni) per la colorazione di paraformaldeide perfuso, saccarosio crioprotetti, cervello di ratto cryosectioned. La colorazione immunoistochimica inizia con il blocco vincolante per ridurre la colorazione di fondo aspecifica antigene. Successivamente, l'incubazione con l'anticorpo primario consente per il legame ad un antigene specifico nel tessuto. Dopo l'anticorpo primario, un altro anticorpo, chiamato anticorpo secondario, viene applicato per collegare l'anticorpo primario a un segnale di visualizzazione coniugato 8. L'anticorpo secondario obiettivi delle immunoglobuline G (IgG) dominio specifico per le specie in cui l'anticorpo primario è stato sollevato. L'anticorpo secondario amplifica il segnale dell'anticorpo primario poiché le regioni Fab di tegli anticorpi legano secondario a più siti sul dominio IgG dell'anticorpo primario. O enzimi o molecole fluorescenti coniugate alle regioni c F dell'anticorpo secondario consentono la visualizzazione. Per esempio, un anticorpo primario anti-Iba1 coniglio è un coniglio IgG molecola specifica per Iba1. Quando IgG anti-coniglio asino viene applicato come anticorpo secondario, sarà riconoscere e legarsi a più regioni dell'anti Iba1-IgG di coniglio (vedere Figura 1). L'anticorpo asino può essere visualizzata con vari metodi. Questa corrispondenza concentra sulla rilevazione di un fluoroforo coniugato con l'anticorpo secondario, che riconosce l'anticorpo primario, per la visualizzazione mediante microscopia a fluorescenza. In immunoistochimica fluorescente, una macchia nucleare come Hoechst o DAPI può essere utilizzato per visualizzare tutti i nuclei.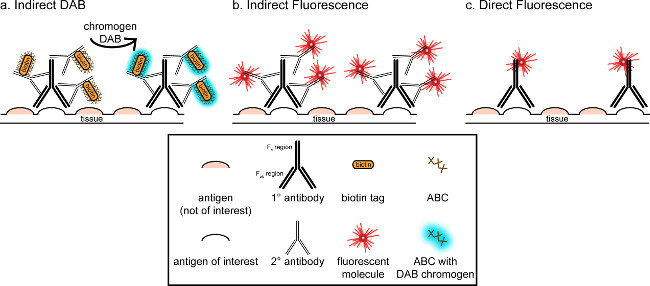
Figura 1: SchRappresentazione ematico di vs diretta tecniche di etichettatura di anticorpi indiretto. Gli anticorpi legano all'antigene di interesse e può essere amplificata da anticorpi secondari sollevate contro la specie degli anticorpi primari. Questa tecnica può essere eseguita utilizzando complesso avidina-biotina (ABC) per l'amplificazione e DAB per la visualizzazione (A), o di un anticorpo secondario fluorescente direttamente coniugato (B). In alternativa, gli anticorpi primari possono essere coniugati direttamente con molte etichette diverse, tra cui la biotina o un fluoroforo (C). Cliccate qui per vedere una versione più grande di questa figura.
Un metodo alternativo per la visualizzazione di colorazione immunoistochimica utilizza 3,3'-diaminobenzidina tetraidrocloruro (DAB; vedi figure 1 e 2). Ciò differisce dalla fluorescenza utilizzando un biotinilato orafano perossidasi (HRP) anticorpo secondario coniugato, che fornisce un enzima per convertire DAB ad un precipitato che è visibile al microscopio in campo chiaro. Nei casi in cui un unico antigene è di interesse o colorazione è tenuto ad essere di lunga durata, DAB può essere più adatto di colorazione fluorescente. Tuttavia, DAB colorazione non è molto adatto per la differenziazione tra più marcatori, soprattutto se due antigeni nucleari sono di interesse. Per informazioni sui materiali DAB e modifiche di protocollo, consultare Tabella 1. In alternativa, nitro blu tetrazolio cloruro / 5-Bromo-4-cloro-3-indolil fosfato (NBT / BCIP) può essere utilizzato per visualizzare una fosfatasi alcalina (AP) secondario coniugato anticorpo.

Figura 2:. Immagini rappresentative della DAB sezioni di tessuto cerebrale di ratto con etichetta singola nichel-enhanced cervello Rat sareZIONI che sono contrassegnati con DAB nichel-enhanced per Iba1 (A) e Pan-neuronale (B) consentire l'analisi di lunga durata della microglia o neuroni da soli. Bar Scala 20 micron. Cliccate qui per vedere una versione più grande di questa figura.
Si deve considerare l'abbondanza stimata dell'antigene di interesse all'interno del tessuto che viene analizzato. I metodi indiretti (come descritto sopra) sono utili per gli obiettivi a bassa abbondanza. Quando l'antigene di interesse è molto abbondante, metodi diretti possono essere applicati. Metodi diretti implicano un anticorpo primario che è direttamente coniugato ad un segnale di visualizzazione, e quindi non è richiesta anticorpo secondario. Questo metodo semplifica il processo di colorazione, ma elimina l'amplificazione ottenuti con metodi indiretti. Utilizzando un anticorpo primario direttamente coniugato elimina anche cross-reattività di anticorpi secondariquando doppia etichettatura.
Dettagli La presente comunicazione il protocollo per la doppia etichettatura con Iba1 e Pan-neuronali (dettagli nella tabella 1). Iba1 macchie microglia in molti stati di attivazione, tra cui ramificato, iper-ramificato, attivato, ameboidi, e l'asta. Macchie Pan-neuronali neuronale assoni, dendriti, e soma. Poiché Iba1 macchie più microglia e obiettivi Pan-neuronali del neurone, questa combinazione di macchie è utile ad acquisire una vasta comprensione delle interazioni microglia-neuroni.
In sintesi, immunoistochimica si basa sulla selezione accurata degli anticorpi. Poiché la domanda di ricerca diventa più specifica, anticorpi diretti contro antigeni alternativi possono desiderare. Per individuare un particolare stato di attivazione della microglia, si può scegliere di utilizzare anticorpi CD45 o CD68, piuttosto che Iba1. Inoltre, in collaborazione con i topi, F4 / 80 può fornire i risultati necessari. Allo stesso modo, gli elementi neuronali possono essere specificamente mirati con anticorpi razato contro il nucleo, sinapsi (pre o post), assone, e cono di crescita. Inoltre, ci sono altri indicatori che differenziano l'età del neurone (Double-Cortin, NeuN) e rigenerazione neuronale (GAP-43).
Protocollo
NOTA: Tutte le procedure sono state eseguite in conformità alla cura e l'uso degli animali Comitato Istituzionale (IACUC) della University of Arizona. Un elenco di materiali e attrezzature raccomandate possono essere trovate nella tabella 1.
1. Preparazione del tessuto
- Perfusion
- Euthanize roditore con una overdose di pentobarbital sodico (25 mg / kg, IP), e profumato transcardially con tampone fosfato salino (PBS) fino a completo dissanguato (3-5 min) a una velocità di flusso di 8 ml / min. Per le istruzioni di perfusione in profondità, vedi Gage et al 2012 9.
- Subito dopo PBS filo, fissare il tessuto mediante perfusione con paraformaldeide al 4% in PBS per 15-20 min ad una velocità di flusso di 8 ml / min.
- Rimuovere cervello e posto in paraformaldeide al 4% per 24 ore, seguita da soluzioni di saccarosio graduati (15%, 30%, 30%, in sequenza, preparata in soluzione salina tamponata con Tris) a 4 ° C. Trasferire il cervello per la successiva soluzione di saccarosio oolo dopo che il cervello ha affondato in ogni soluzione. Nota: Di solito, 5 giorni in ogni soluzione è un tempo sufficiente per il tessuto di affondare.
- Tissue Congelamento e criosezionamento
- Posizionare il cervello in mezzo di inclusione, quali OCT e immergere in isopentano a una temperatura di -35 ° C. Lasciare che il cervello di congelare per un minimo di 10 minuti, e poi conservare a -80 ° C. Possono sorgere problemi se diligenza a temperatura non è presa; si rimanda la discussione per la risoluzione dei problemi.
- Tagliare sezioni coronali seriali ad uno spessore di 20 um e una temperatura di -20 ° C. Raccogliere il tessuto su vetrini caricati positivamente. Sezioni del cervello possono essere collocati in una scatola di diapositive avvolto in un foglio in una busta zip-top e conservati a lungo termine a -80 ° C. Questo metodo di memorizzazione crea un doppio limite per evitare l'esposizione all'aria e al gelo.
2. Tissue Processing
NOTA: attrezzature e materiali Esempio r, facoltativo per la colorazione sono mostrati in figura 3. Le alternative sono disponibili, tuttavia, queste immagini aiuteranno chi è nuovo di immunoistochimica per visualizzare elementi del caso prima di procedere all'acquisto.

Figura 3: Esempio di oggetti necessari per la colorazione immunoistochimica La scatola nera mostrato in (A) è una camera di umidità ideale per immunofluorescenza, come diapositive sono protetti dalla luce, senza la necessità di avvolgere la scatola su un foglio.. Dopo sezionamento, vetrini possono essere memorizzati in una scatola quali la scatola gialla mostrato in (B). Avvolgere la scatola ermeticamente in un foglio e messa in un sacchetto di zip-top prima freezer aiuta a proteggere i campioni di tessuto da bruciature da freddo. Un esempio di diapositive è dato in (C), con diversi piatti di colorazione descritti in (D) e (E ). Coprioggetto può variare in termini di dimensioni e spessore (F), tuttavia 1.2 vetrini spessi di risultati di imaging belle sulla maggior parte microscopi diritti e confocale. Una matita come quello mostrato in (G) può essere utilizzato per etichettare diapositive. Marcatore permanente dovrebbe essere evitato come l'inchiostro può essere eseguito, che interessano sia la colorazione e la capacità di determinare ciò che il campione è. Un mini penna pap come quello mostrato in (H) permette un bordo repellenti da trarre su vetrini.
- Preparazione diapositive
- Estrarre i vetrini da freezer e scongelare a temperatura ambiente.
- Opzionale: Se le sezioni hanno già galleggiare da diapositive, collocare le diapositive scongelati in forno a 60 ° C per non più di 4 ore per evitare sezioni di tessuto da galleggiante al largo diapositive.
- Posizionare i vetrini in un rack scorrevole e piatto corrispondente.
- Lavare i vetrini tre volte in PBS per 5 minuti ciascuno, cambiando soluzione tra un lavaggio. Da questo punto in avanti, evitare di avere sectiComponenti senza liquidi per periodi di tempo prolungati. Nota: Se le sezioni asciugano, la colorazione di fondo è aumentata e dati significativi non può essere ottenuto in modo affidabile.
- Estrarre i vetrini da freezer e scongelare a temperatura ambiente.
- Tissue Colorazione
- In una scatola di colorazione a tenuta di luce, creare una "camera umida" con i tessuti privi di lanugine imbevuto con acqua deionizzata.
- Asciugare i bordi della slitta con un tessuto privo di lanugine, usare un mini penna pap per fare un bordo liquido repellente ai margini della diapositiva, lontano da sezioni di tessuto. Questo bordo dovrebbe garantire un ampio spazio fra il menisco del liquido e il bordo del tessuto in modo che la tensione superficiale non influisce colorazione.
NOTA: Il confine repellente penna pap può essere applicato prima del 2.1.3, se gli anticorpi di interesse non richiedono microonde recupero dell'antigene. Se la penna pap è stato applicato prima del lavaggio in PBS, l'integrità del confine liquido repellente deve essere controllato in questa fase. Utilizzare una penna mini-pap per colmare eventuali lacune nel confine. - Con diapositive disposti orizzontalmente, l'antigene non specifico blocco vincolante incubando nel 4% v / v siero in PBS (soluzione di blocco). Dispensare 300 ml di soluzione di blocco per vetrino per 1 ora a temperatura ambiente. Assicurarsi che la soluzione blocco estende alla penna pap al bordo della diapositiva e copre completamente il tessuto per evitare colorazione irregolare causato dalla tensione superficiale vicino al tessuto.
- Utilizzare siero dalla stessa specie in cui è fatto anticorpo secondario. Nota: In questa procedura, gli anticorpi secondari sono realizzati in asino, e quindi viene utilizzato siero asino. Se si utilizzano anticorpi secondari di due o più specie diverse, includere siero di ogni specie.
- Pipetta anticorpo primario su vetrini. Nota: le concentrazioni di anticorpi per questa colorazione sono stati ottimizzati a 1: 5.000 e 1: 500 per Iba1 e Pan-neuronale, rispettivamente. Queste concentrazioni sono stati trovati per mostrare colorazione significativo con l'assenza di colorazione di fondo.
- Diluire soluzione blocco1% di siero in PBS e aggiungere anticorpi primari. Dispensare 300 ml di soluzione di anticorpo primario in 1% di siero per vetrino. Ancora una volta, assicura il fluido è al bordo della penna pap. Incubare per una notte a 4 ° C.
- Include tre vetrini di controllo: uno che contiene anticorpi né Iba1 né Pan-neuronali, una con Iba1 senza anticorpi Pan-neuronale, e uno con l'anticorpo Pan-neuronale senza Iba1. Macchia queste diapositive nella stessa seduta con le stesse soluzioni, tuttavia omettere le anticorpi primari per verificare il legame degli anticorpi secondari non specifici.
- La mattina seguente, lavare i vetrini tre volte in PBS per 5 minuti ciascuno, cambiando soluzione tra un lavaggio.
- Gli anticorpi fluorescenti sono sensibili alla luce, quindi, da questo punto in avanti, ridurre al minimo l'esposizione alla luce garantendo contenitori lavaggio sono avvolti in fogli e ibridazione scatole sono nero o incubate al buio. Pipettare gli anticorpi secondari appropriati in tutte le diapositive e incubare per60 min a temperatura ambiente ad una concentrazione di 1: 250 in soluzione di blocco (vedere fase 2.2.3) in una "camera umida" a tenuta di luce (vedere fase 2.2.1).
- Utilizzare anticorpi secondari di differenti lunghezze d'onda. Qui, per il coniglio anticorpo primario anti-Iba1, utilizzare asino anti-coniglio 594 come l'anticorpo secondario appropriato. Per il mouse anticorpo primario anti-Pan-neuronale, utilizzare asino anti-topo 488 come l'anticorpo secondario appropriato. In alternativa, utilizzare anti-coniglio 488 e anti-topo 594.
- Lavare i vetrini tre volte in PBS per 5 minuti ciascuno.
- Opzionale: eseguire colorazione nucleare.
- Posto in Hoechst (o altro colorazione nucleare) ad una concentrazione di 0,03 mg / ml in doppia H 2 0 distillata per esattamente 60 sec.
- Lavare i vetrini tre volte in PBS per 5 minuti ciascuno.
- Lavare in DDH 2 0.
- Coprioggetto
- Vetrini coprioggetto con un mezzo di montaggio a base acquosa, come Fluoromount-G o ProlongGold. Fare attenzione a rimuovere tutte le bolle con un applicatore di cotone con punta.
Nota: Altri agenti di montaggio potrebbero essere utilizzati, per quanto alto sanguinare-through tra coloranti è stato notato da alcuni pochi giorni di copertura dei vetrini. - Utilizzare smalto trasparente per sigillare i bordi, impedendo sezioni si secchi a causa dell'evaporazione. Lasciare smalto si asciughi in un contenitore a tenuta di luce mentre scivoli resta piatta ea temperatura ambiente, e poi conservare in un contenitore a tenuta di luce avvolti in un foglio a 4 ° C.
- Vetrini coprioggetto con un mezzo di montaggio a base acquosa, come Fluoromount-G o ProlongGold. Fare attenzione a rimuovere tutte le bolle con un applicatore di cotone con punta.
3. Imaging Tissue Stained
- Microscopia
- Lasciare che il smalto ad asciugare per almeno un'ora prima di iniziare la microscopia, che dovrebbe avvenire in una stanza buia.
- Acquisire microfotografie usando un confocale o microscopio di ricerca con una sorgente di luce fluorescente e un attacco della telecamera digitale. Utilizzando il software di accompagnamento, impostare l'esposizione per ogni lunghezza d'onda - 405, 488, e 594 - separatamente. Nota: in modo approfondito le istruzioni di imaging dovrebbero essere disponibili on-line presso il produttore del microscopio.
- Acquisire microfotografie in ogni canale senza spostare le sezioni o la regolazione della messa a fuoco. Prendere immagini a colori, in scala di grigi o alternativamente e convertire in colore dopo.
Nota: Il colore o scala di grigi di ciascun canale possono essere raccolti in post-processing. - Assicurarsi che le sezioni di tessuto non siano esposti a luce ambiente o alla luce microscopica per lunghi periodi di tempo, come si verificherà fotometabolismo delle sezioni. Per evitare questo, aumentare il tempo di esposizione, piuttosto che aumentando l'intensità della luce / laser.
- Non spegnere la sorgente di luce fluorescente entro 30 minuti di essere stato acceso.
Nota: Modificare la sorgente e lo spegnimento in rapida successione, potrebbe diminuire la durata della vita della lampadina fluorescente.
Risultati
Questo protocollo di colorazione si traduce in sezioni di tessuto di cervello di ratto che hanno microglia fluorescente nel 594 canali (rosso) e neuroni marcati nel 488 canali (verde; vedi Figura 4). Se una colorazione nucleare è stato fatto, mostrerà nel canale 405 (blu). Le immagini possono essere prese in canali diversi e sovrapposti per confronto diretto dei tre canali, o tra due canali. Molte suite software di acquisizione digitale comprendono questa funzionalità. Doppia etichettatura con Iba1 e Pan-neuronale marcatore mostrato qui dimostra microglia soprattutto ramificata, con lunghe sottili proiezioni neuronali evidenti attraverso strati corticali.
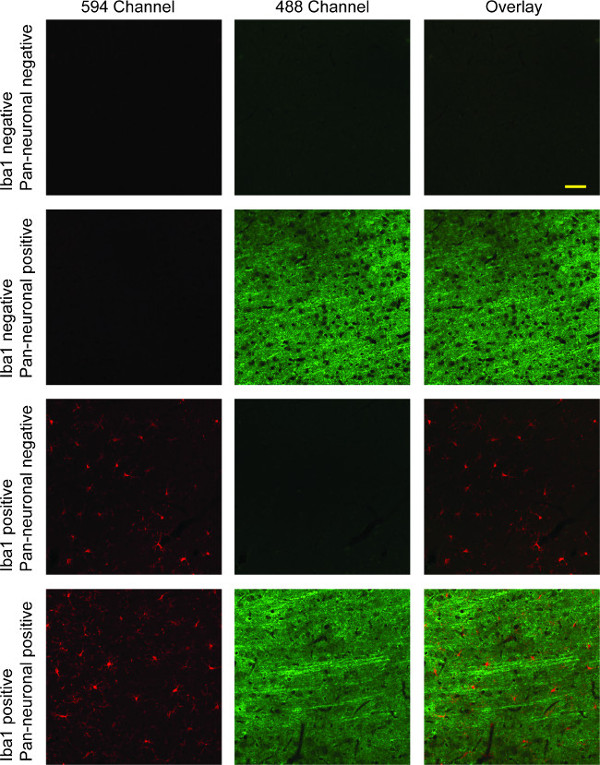
Figura 4:. Immagini a fluorescenza confocale rappresentative della Iba-1 / Pan-neuronale doppia etichettatura colonna 1 mostra microglia colorati con Iba1 (rosso). I neuroni sono mostrati inseconda colonna nel verde, l'immagine sovrapposta di entrambi i canali rosso e verde nella terza colonna con. Nella prima riga, vi è una totale mancanza di colorazione specifica per assenza di entrambi gli anticorpi primari. La seconda riga illustra la specificità dell'anticorpo primario Pan-neuronale per la colorazione neuronale, mentre la terza fila presenta specificità Iba1 per microglia, con una completa mancanza di cross-reattività in entrambi i casi. La quarta riga illustra doppia etichettatura con una sovrapposizione dei due canali che mostrano sia microglia e colorazione neuronale. Scala bar 50 micron.
Scarsi risultati di colorazione sono esposti anche (Figura 5), come evidenziato dalla mancanza di corpi cellulari chiaramente definiti e frammentati processi microglia / neuronali. Alta sfondo è indicativo di scarsa colorazione qualità, e può essere visto da non specifico co-localizzazione di anticorpi (vedi Figura 5). Inoltre, se il segnale è debole, un passo di amplificazione con fluorescenza streptavidi legaton può essere incorporato. Invece di utilizzare un anticorpo secondario fluorescente direttamente taggato in fase 2.2.6, viene applicato un secondario biotinilato. Dopo lavaggio in PBS, streptavidina (1: 1000 in PBS) viene incubata sui vetrini per 1 ora. Ritorno a protocollo al punto 2.2.7 in cui vetrino viene lavato e immersi in una di contrasto o di copertura scivolato.
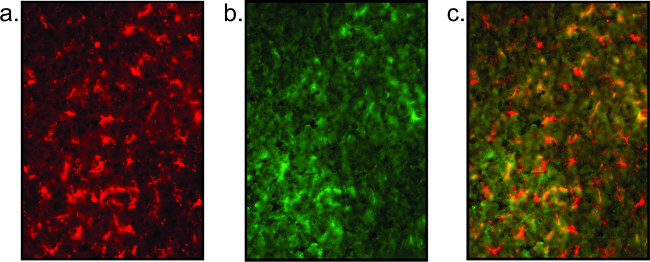
Figura 5:. Immagini fluorescenti rappresentativi di scarsa qualità del tessuto mostrato qui è un esempio di colorazione in tessuti poveri che si traduce in una mancanza di chiarezza di colorazione microglia (a) e completa assenza di colorazione neuronale (b). Questa colorazione neuronale è semplicemente fondo elevato. L'immagine sovrapposta (c) non è significativo.
| Nome del materiale / attrezzature | Azienda | Numero di catalogo | Commenti / Descrizione |
| Diapositive Fisherbrand Superfrost Plus Il vetro | Fisher Scientific | 22-034-979 | Utilizzato per il montaggio dei tessuti (1.2.2) |
| Forno | Thermo Scientific | 51028112 | Utilizzato per l'essiccazione dei tessuti (2.1.1) |
| Mini penna Pap | Life Technologies | 00-8877 | Utilizzato in fase 2.2.2 |
| Andwin scientifico Tissue-tek scorrevole colorazione Dish | Fisher Scientific | 22-149-429 | Usato per tutti i lavaggi durante la colorazione (2,2), così come il passo Hoechst (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Utilizzato per le diapositive di essiccazione (2.2) |
| Nero colorazione Box | Ted Pella | 21050 | Usato per blocco e colorazione gradini (2,2) |
| Normale Donkey Serum | Fisher Scientific | 50-413-253 | Utilizzato per il blocco e l'anticorpo di incubazione (2.2) |
| Mouse α-Pan-neuronale | Millipore | MAB2300 | Usato per anticorpo primario (2.2.4) |
| Coniglio α-Iba1 | Wako Chemical | 019-19741 | Usato per anticorpo primario (2.2.4) |
| Donkey α-coniglio 594 | Jackson ImmunoResearch | 711-585-152 | Usato per anticorpo secondario (2.2.6) |
| Donkey α-topo 488 | Jackson ImmunoResearch | 715-545-150 | Usato per anticorpo secondario (2.2.6) |
| Foglio di Caterer | Qualsiasi | N / A | Utilizzato in punti 1.2.2 e 2.3.2 |
| Fluoromount-G | Biotech meridionale | 0100-01 | Usato per vetrini (2.2.8) |
| Coprioggetto | Fisher Scientific | 12544E | Usato per vetrini (2.2.8) |
| Cancella Nail Polish | Qualsiasi | N / A | Usato per vetrini (2.2.8) |
| Axio Observer.Z1 e LSM 710 (scansione laser, confocale) | Carl Zeiss | N / A | Utilizzato per l'imaging (3) |
| Axioskop A2 | Carl Zeiss | N / A | Utilizzato per l'imaging (3) |
| CitriSolv | FisherScientific | Per il protocollo DAB | |
| ABC | Vector Laboratories | PK-6100 | Per il protocollo DAB |
| Kit DAB perossidasi | Vector Laboratories | SK-4100 | Per il protocollo DAB |
| Cavallo Biotinylated α-rabbit IgG | Vector Laboratories | BA-1100 | Per il protocollo DAB |
| Α-topo cavallo Biotinylated IgG | Vector Laboratories | BA-2001 | Per il protocollo DAB |
| 30% di perossido di idrogeno | FisherScientific | H325-500 | Per il protocollo DAB |
| Portavetrini Wheaton e piatti di colorazione | TedPella | 21043 | Per il protocollo DAB |
| Masterflex pompa di perfusione e la tubazione | Cole-Parmer | Usato per perfusione (1.1.1 e 1.1.2) | |
| Andwin tessuto-tek scientifico Cryo-ottobre composto (caso di 12) | Fisher Scientific | 14-373-65 | Usato per il congelamento dei tessuti (1.2.1) |
| Termometro (da -50 a 50 ° C) | Fisher Scientific | 15-059-228 | Usato per il congelamento dei tessuti (1.2.1) |
| Criostato | Leica | CM3500S | Usato per sezionamento dei tessuti (1.2.2) |
| Colorazione piatto, di plastica con 2 coperchi | Grale Scientific | 353 | Per antigene retrival |
| 20 Place colorazione Rack, diapositive orizzontale | Grale Scientific | 354 | Per antigene retrival |
| Microonde | Qualsiasi | N / A | Per antigene retrival |
Tabella 1: Lista dei materiali.
Discussione
L'obiettivo generale di questa comunicazione è stato quello di introdurre procedure immunoistochimiche al lettore. Per questo, l'esempio della doppia etichettatura con Iba1 e antigeni Pan-neuronali per osservare microglia e neuroni in paraformaldeide perfusione, è stato utilizzato il saccarosio cervello crioprotetti, ratto cryosectioned.
Questa tecnica può essere adattata per servire scopi infinite. Una serie di diversi antigeni in una varietà di tipi di tessuto, come, ma non limitati a cervello, polmoni, fegato, reni e intestino può essere visualizzato immunoistochimica con piccoli aggiustamenti al protocollo. Immunoistochimica consente il raffronto diretto dei marcatori multipli e può comprendere fino a quattro diversi anticorpi in un singolo campione. Il numero di anticorpi utilizzati in un campione è limitato da spurgo-through, che descrive sovrapposizione di lunghezze d'onda fluorescenti. Vi è un limitato spettro di luce fluorescente, che limita di conseguenza le combinazioni di colorazione all'interno comecampione ingle (vedi figura 6).
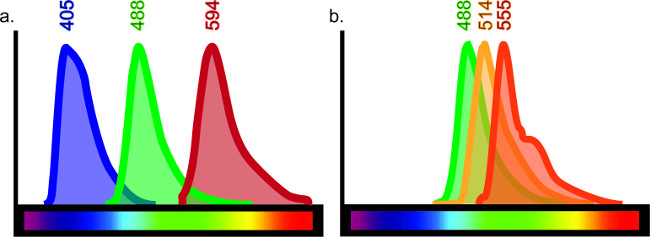
Figura 6:. Tabella di colore spettro Ogni fluoroforo emette una specifica lunghezza d'onda della luce quando eccitato da un laser o filtro specifico. Per produrre efficacemente tessuto multi-marcato, ci dovrebbe essere minima sovrapposizione tra fluorofori specifici coniugati agli anticorpi. Sebbene ci siano almeno 10 differenti fluorofori disponibili sul mercato, non è possibile ottenere risultati evidenti se vengono utilizzati tutti 10. Ad esempio, tripla marcatura con emissioni di lunghezza d'onda a 405, 488 e 594 (A) darebbe una chiara etichettatura in quanto vi è sovrapposizione minima, se del caso, tra queste lunghezze d'onda. Tuttavia, se sono stati usati emissioni lunghezza d'onda a 488, 514 e 555, la colorazione non sarebbe facilmente interpretato come ciascun anticorpo può essere eccitato dal laser o un filtro destinato per l'altro ( B). Questo darebbe risultati errati co-etichettatura. Guide in rete per la selezione fluorophore sono disponibili cercando "spettatore spettro fluorescente".
Quando doppia etichettatura, è meglio scegliere anticorpi primari realizzati in diverse specie, come entrambi gli anticorpi possono essere applicate contemporaneamente. Doppia etichettatura con due anticorpi della stessa specie è possibile, anche se tecnicamente difficile. Quando entrambi gli anticorpi primari sono realizzati nella stessa specie, colorazione deve essere fatta in modo sequenziale, completando la colorazione per un antigene prima della seconda. Sorgeranno meno problemi se gli anticorpi primari della stessa specie hanno differenti classi di Ig (cioè IgG mouse e il mouse IgM o diverse sottoclassi IgG1 e IgG2a). Per maggiori dettagli consultare ulteriori riferimenti 10,11. Questo protocollo utilizza coniglio anti-Iba1 e topo anti-Pan-neuronale. È inoltre necessario includere adeguate controlli negativi. Per doppia etichettatura con Iba1 e Pan-neuronale, una diapositiva non contiene anticorpi primari, una diapositiva contiene solo e una diapositiva contiene anti-Pan-neuronale solo anti-Iba1 (vedi figura 4). Questi controlli negativi confermano l'assenza di cross-reattività e falsa colorazione. Tutte le altre diapositive contengono entrambi gli anticorpi primari. E 'anche importante evitare usando anticorpi secondari che possono reazione crociata. Ad esempio, utilizzando asino anti-coniglio 594 e coniglio anti-topo 488 comporterebbe asino anti-coniglio 594 legame sia coniglio anti-Iba1 anticorpo primario e l'asino anti-coniglio anti-topo 594 488 anticorpo secondario. Ciò creerebbe falso co-etichettatura.
Anticorpi per una particolare proteina (antigene) non sono sempre la stessa. Ad esempio, alcuni anticorpi sono sollevate contro gli antigeni che sono presenti nel tessuto congelato, mentre altri riconoscono un antigene che è stato alterato durante il processo di paraffina. Per questo motivo, particolare attenzione deve essere rivolta alla tegli anticorpo scheda tecnica prima dell'acquisto. Se l'applicazione prevista per l'anticorpo non è presente nell'elenco, la risoluzione dei problemi può essere richiesto per ottenere la colorazione, o colorazione potrebbe non funzionare affatto. Inoltre, i dati precedentemente pubblicati possono offrire "trucchi del mestiere" per ottenere la colorazione. Di importanza da notare è che le sottili differenze possono essere visti in diversi lotti di anticorpi; lievi modifiche possono avere bisogno di essere fatta con ogni ordine ri di un anticorpo.
La maggior parte degli anticorpi sono buoni per 12 mesi dalla data di ricezione. Assicurarsi di indicare la data di arrivo sul foglio specifiche del prodotto. Se l'anticorpo colorazione non viene rispettato, l'anticorpo potrebbe essere troppo vecchio o conservati in modo non corretto. E 'quindi importante controllare scheda tecnica di ogni anticorpo per una corretta conservazione.
Inoltre, per molti anticorpi, diversi cloni sono disponibili. Diversi cloni riconoscono diverse parti del antigene di interesse. Ladato clone può essere meglio per il tessuto sottoposto a diverse tecniche di lavorazione (cera-embedded / surgelati), bersaglio tipo di tessuto, o specie bersaglio. Prestare particolare attenzione alle specie in cui l'anticorpo è stato sollevato. Quando l'anticorpo viene sollevata nella stessa specie del tessuto per l'analisi, alta sfondo può essere osservato. Per combattere questo, il blocco ulteriore con i kit disponibili in commercio, come un mouse su corredo del mouse, può essere richiesto per la colorazione. Questa tecnica può anche essere adattato per coltura cellulare. Fissazione delle cellule, clone e specificità devono essere controllate sul foglio specifiche per le applicazioni.
Fissaggio con paraformaldeide legami incrociati proteine, che potrebbero nascondere legame antigene siti in alcune condizioni. Recupero Antigen può rompere proteine cross-link ed esporre siti di legame. Se è necessario il recupero dell'antigene, inserire il seguente protocollo dopo passo 2.1.3: con un piatto di colorazione di plastica e inserire (vedi Tabella 1), diapositive a microondein tampone citrato in un ambiente a bassa potenza per 10 minuti, avendo cura di non lasciare bollire soluzione rigorosamente (livelli di potenza specifici non inclusi a causa della variabilità impostazioni tra microonde). In alternativa, portare tampone citrato a 80 ° C in un piatto di vetro di colorazione in un forno, quindi aggiungere vetrini per 10 min.
Qualità del tessuto scadente può anche causare problemi di colorazione (vedi Figura 5). Ci sono una serie di precauzioni si possono prendere per evitare di compromettere la qualità dei tessuti. In primo luogo, essere paziente e diligente con i cambiamenti di saccarosio per spostare accuratamente acqua nei tessuti prima del congelamento. Quando il congelamento, mantenere costante la temperatura. Se il tessuto blocca troppo lentamente, le molecole di acqua si espanderanno come congelare, creando fori nel tessuto. In alternativa, congelamento a una temperatura troppo bassa provoca il tessuto di crack.
I protocolli possono variare leggermente per ogni anticorpo di interesse. Al ricevimento di un nuovo anticorpo, si deve optareimize il protocollo di conseguenza. Se lo sfondo è elevato (figura 5), provare blocco per un periodo di tempo più lungo. In alternativa, aumentare la concentrazione sierica della soluzione blocco o aggiungere siero di più diverso specie ad esempio capra e siero di coniglio. Inoltre, la caseina può essere utilizzato per ridurre il legame non specifico. Latte scremato (a base di polvere secca) contiene caseina e può essere utilizzato in un intervallo di concentrazioni (tipicamente 1-5% w / v). Il latte può essere utilizzato da solo, o in combinazione con siero. Se un antigene di interesse è un marcatore intracellulare, detergenti tipo a TritonX-100 o Tween-20 possono essere aggiunti alla soluzione di blocco per permeabilize membrane cellulari. Sezioni di tessuto più spesse possono essere trattati allo stesso modo facendo galleggiare le sezioni di tessuto nei pozzi invece di montaggio su vetrini. Tessuto incluse in paraffina può anche essere trattati allo stesso modo, ma richiede un de-ceretta passo prima del blocco. Feldengut et al. 12 indirizzi entrambi di questi metodi.
A causa della natura sensibile alla luce anticorpi fluorescenti, è fondamentale che gli anticorpi fluorescenti vengano immagazzinati in contenitori scuri ed evitare l'esposizione alla luce dopo l'incubazione anticorpo secondario. Al contrario, quando si usa DAB come un agente di sviluppo, l'esposizione alla luce non è dannosa. Colorazione fluorescente è limitata nella sua longevità. Diapositive fluorescenti macchiate devono essere conservati in una scatola a tenuta di luce a 4 ° C. Le immagini devono essere catturate entro un mese di colorazione. Se l'imaging immediato non è possibile, considerare DAB o altri metodi di colorazione alternativi o ritardo colorazione fino imaging è possibile. Colorazione con DAB è generalmente limitata a macchiare un antigene bersaglio, mentre la fluorescenza permette di doppio e triplo etichettatura. Doppio e triplo etichettatura può essere realizzato utilizzando DAB però questa tecnica è soggetta a complicazioni e difficoltà di isolare colorazione specifica antigene. DAB colorazione può essere visualizzato al microscopio in campo chiaro, mentre l'imaging a fluorescenza sTaining richiede un microscopio a fluorescenza.
Un altro fattore da tenere in considerazione con DAB colorazione è che le cellule comprendono più strati di tessuto. È quindi difficile ottenere immagini nitide di cellule, come microglia che hanno processi che attraversa. Per ovviare a questo problema, alcuni ricercatori tagliano loro sezioni più sottili a 8-12 micron.
Imaging di tessuto marcato in fluorescenza è meglio realizzato su un microscopio confocale. Microscopi confocale eliminano la foschia normalmente visto con un microscopio a fluorescenza di ricerca isolando e l'acquisizione di un unico piano di messa a fuoco all'interno del campione. Con la microscopia confocale, dettagli più fini sono più nitide e sanguinare-through tra coloranti fluorescenti è ridotta. Campioni più spesse possono essere esposte un aereo alla volta (z-stack) per dimostrare la vera co-localizzazione. Quando l'accesso ad un microscopio confocale non è disponibile, imaging su un microscopio di ricerca è possibile, tuttavia il tempo di esposizione e l'intensità della luce devono essere locked tra le immagini.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materiali
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
Riferimenti
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l'Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira's basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon