Method Article
Rekombinant çekirdek histon nükleozomal Diziler ve Nükleozom Konumlandırma DNA Meclisi
Bu Makalede
Özet
Bir yöntem olup, yeniden birleştirici çekirdek histon ikinci modeli nükleozomal dizilerin sulandırma ve tandem tekrar nükleozom konumlandırma DNA için sunulmuştur. Biz de analitik ultrasantrifüjdeki sedimantasyon hızı deneyleri, ve atomik kuvvet mikroskobu (AFM) hazırlandıktan sonra nucleosomal dizi doygunluk düzeyini izlemek için nasıl kullanıldığını açıklar.
Özet
Burada tekrar tekrar bir DNA molekülü boyunca aralıklı olan Çekirdek histon octamers nükleozomal dizileri olarak adlandırılır. Nükleozomal diziler iki yoldan birinde elde edilmiştir: in vivo kaynaklardan saflaştırılması, yeniden birleştirici ya da çekirdek histon in vitro olarak yeniden oluşum ve tandem tekrar nükleozom konumlandırma DNA. Bu ikinci yöntem daha bileşim bakımından düzenli montajı ve kesin bir konuma sahip nükleozomal dizisi için izin verme avantajına sahiptir. Bu santrifüj kuvveti altında çözelti içinden geçiş hızını analiz ederek makro moleküllerin büyüklüğü ve şekli ile ilgili analitik ultrasantrifüj verim bilgilerde sedimantasyon hızının deneyleri. Bu teknik, atomik kuvvet mikroskopisi ile birlikte, DNA şablonları çoğunluğu sulandırıldıktan sonra nükleozom doymuş olmasının sağlanması, kalite kontrol için kullanılabilir. Burada uzunluğu miligram miktarları yeniden yapılandırmak için gerekli ve bileşim açısından tarif d protokollerikromatin yapısı ve fonksiyonu biyokimyasal ve biyofiziksel çalışmalar için uygun efined nucleosomal diziler.
Giriş
Ökaryotik genomları gibi çıplak DNA yoktur, ama yerine sıkıştırılmış ve bağlı proteinler tarafından organize edilir. DNA ve protein Bu kompleksler, kromatin olarak bilinir. Kromatinlerin temel tekrarlanan ünite nucleosome olduğunu. Bir nucleosome histon oktamer ve yaklaşık 1,6 kat 1 oktamer histona sarılı DNA 146 baz çiftinden oluşmuştur. Histon oktamer iki kopya çekirdek histon H2A, H2B, H3 ve H4 her oluşmaktadır. Burada tekrar tekrar bir DNA molekülü boyunca aralıklı olan Çekirdek histon octamers nükleozomal dizileri olarak adlandırılır. Nükleozomal dizilerinin yapısı, uzatılmış bir yapı "ipe dizili boncuklar" 10 nm ya da lif olarak adlandırılır ve düşük tuz koşulları altında 2, in vitro olarak mevcut olmuştur. 10 nm fiber içi dizi sıkıştırma ve / veya arası dizi oligomerizasyonu 2 vasıtasıyla daha yüksek düzeyde yapılar içine yoğunlaştırma yeteneğine sahip olduğunu. Bu yüksek sıralanmaları, tuzların mevcudiyetinde indüklenebilirveya nükleozomal dizi 3,4 kromatin mimari proteinlerin bağlanma yoluyla etkilenebilir. Kromatin sıkıştırma düzeyleri ters vivo 5,6 transkripsiyon oranı ile ilişkilidir. Son araştırmalar, farklılaşma, kanser gelişimi ve diğerleri 7,8 gibi süreçlerde Genomların yapısal kuruluşun önemini vurgulamaktadır. Kromatin yapısını ve işlevini incelemek için nucleosomal dizilerin kullanımı yaygın hale gelmiştir. Burada rekombinant çekirdek histon ve nucleosome konumlandırma DNA'dan nucleosomal dizilerin montajı için bir yöntem açıklanmaktadır.
Nükleozom konumlandırma dizilerin tandem tekrarı ile rekombinant DNA kullanarak düzenli olarak aralıklı nükleozom içeren dizilerin yeniden oluşturulması için izin verir. Daha popüler konumlandırma dizilerin iki 5S rRNA gen sekansı ve "601" sekans 9,10 bulunmaktadır. 601 dizisi SELEX deneyler ve mor elde edildie güçlü 5S dizisi 11 daha nükleozom konumlandırır. Sonuç olarak, 601 dizilerinin, bağlayıcı DNA uzunluğu daha homojendir. Tandem tekrar nükleozom konumlandırma DNA jel filtrasyonu 4,12 ile elde edilir. Rekombinant E. histonlar saflaştınlır denatüre edici koşullar altında 13 coli. Rekombinant histonların kullanımı bir dikkatle nucleosomal dizilerin histon kompozisyonunu kontrol etmenizi sağlar. Örneğin, çekirdek 15,16 yabani tip çekirdek histon ikame edilebilir spesifik mutasyonlar 14 ya da post-translasyonel modifikasyonlar taşıyan histonlar.
Çökeltme hız deneyleri uygulanan santrifüj kuvveti altında 17 çözeltisi içinde makromoleküllerin sedimantasyon hızını izler. Bu, bir numunede makromoleküllerin büyüklüğü ve şekli hakkında bilgi verir. Sedimantasyon hızı deneyleri böylece kromatin lif çözüm durum değişiklikleri incelemek için uygun bir araçtırkromatin yoğunlaşması 18 yapısı nedeniyle. Önemlisi, nucleosomal dizi sulandırma bir kalite kontrol adım olarak sedimantasyon hızı deneyleri kullanmak için ilk gerekli olan. DNA ve nükleozom uygun mol oranında birleştirilir değilseniz, diziler altında veya aşırı doymuş bir çekirdek histon sahip olabilir. Böylece, sedimantasyon hızının deneylerden elde edilen bilgiler, DNA uygun bir şekilde nükleozom ile doymuş olduğunu sağlamak için kullanılır. Bu, daha önce karakterize edilmemiş DNA şablonu ile çalışan, özellikle nükleozom ile DNA'nın doygunluk tahmin etmek için alternatif yöntemler kullanmak önemlidir. Bu nedenle, daha da atomik kuvvet mikroskopisi (AFM) ile nükleozomal dizilerin analizi için bir yöntem tarif eder. AFM sağlayan güçlü bir tekniktir bu doyma seviyesi, histon varyantlarının varlığı etkisi ya da MgCI2 19,20 etkileri gibi parametreler, bir dizi etkilerinin görselleştirilmesi. AFM da başvurunun olmuştured zaman atlamalı görüntüleme 21 kullanılarak nucleosome dinamiklerini incelemek için. In vitro onlar AFM görüntüleme 22 için doğru boyut aralığındaki ait çünkü nucleosomal 12-mer diziler AFM çalışmalara özellikle yatkındır toplandı. Bu çalışmada, bir kalite kontrol gibi ("Görmek inanmaktır") AUC verileri onaylayan bir aracı olarak nucleosomal dizilerin AFM kullandık. Basit bir görselleştirme ek olarak, AFM ek bir ölçüt olarak numune yüksekliği profilleri ölçülmesini sağlar.
Protokol
1.. Octamers içine Rekombinant çekirdek histon Meclisi
Gerekçe: nucleosomal dizi sulandırma içinde ilk adım Liyofilize rekombinant çekirdek histon adlı doğal çekirdek histon octamers hazırlamaktır. Histon proteinler eşit molar miktarlarda bir araya getirilmiş ve tekrar katlama tampon maddesi içine bir denatüre edici tampon üzerinden örnekleri diyaliz ile histon octamers içine monte edilir.
- Arındırmak ve 13, tarif edildiği gibi (H2A, H2B, H3, H4) yeniden birleştirici çekirdek histon liyofilize edilir.
- Açılımı tamponu (6 M guanidinyum HCI, 20 mM Tris pH 7.5, 5 mM DTT) içinde, 3 ml, her liyofilize çekirdek histon yaklaşık olarak 5 mg çözülür. Her eş pay, en az bir saat boyunca eritmek için izin verin. Herhangi bir protein, kabın iki kalmasını sağlayın.
- Bir referans olarak açılımı tamponu kullanılarak 276 nm'de her bir histon absorbansı ölçülür.
- Bunların yok olma katsayıları kullanılarak her bir histon molaritesini hesaplayın (bakınız Tablo 1 Xenopus histon sönme katsayıları için). Proteininin büyük bir kısmı çözülür ise, liyofilize kuru ağırlığı ve tahmine histonun absorbans belirlenmiştir konsantrasyonu karşılaştır.
- Bu tüm histonlanm mol sınırlayıcı sayısı olacak gibi, sen az mol sahip olan histon belirleyin.
- Eşit molar miktarlarda histonları birleştirin ve 1 mg / ml 'lik nihai bir konsantrasyona kadar tampon açılımı ile seyreltin.
- 6-8 kDa MWCO diyaliz tüp içine örneği yerleştir. Boru Seal ve soğuk katlama tamponu, 2 L içine koyun (2 M NaCl, 10 mM Tris pH 7.5, 1 mM EDTA, 5 mM β-merkaptoetanol).
- Karıştırılarak 4 ° C'de 18 saat için örnek Dialyze. Emin diyaliz boru serbestçe ve şiddetle dönebilir, ya da başka histon hızlandırabilir.
- Iki kere 18 saatlik bir süre (örneğin, her tamamlanan kadar 6 saat ilgili katlama tampon değiştirme) 'de diyaliz tampon değiştirin. Çökelti meydana bile atmak yokverim azaltılabilir rağmen, numune, bir oktamer geri kazanılabilir.
Not: Bir sonraki gün için sütun dengeye hazırlamak için adım 2.1-2.2 bakın.
2. Boyut Dışlama Kromatografisi ile Histone Octamers saflaştırılması
Gerekçe: Bölüm 1 ile tamamladıktan sonra, numuneler histon octamers yanı sıra, agrega, H3/H4 tetramerleri ve H2A/H2B dimerler gibi histon kompleksleri içerir. Histon octamers uzak boyut dışlama kromatografisi (SEC) ile bu komplekslerden arıtıldı olacaktır.
- Bir Hiload bir FPLC sistemi 16/60 Superdex-200 16/60 (S200) kolonu bağlayın. Hava kabarcıkları sisteme girmeyin emin olun.
- 0.2 um filtre edildi, su ile S200 sütunu temizleyin. 0.3 ml / dk 'lık bir akış hızı kullanarak, 0.5 MPa bir geri basınç sınırını belirler. Eğer yeterli su sağlanması ve sütun gecede temizlemek için izin.
- F S200 kolon ve örnek döngü dengelePLC yeniden katlama tamponu kullanılarak. 0.2 um filtre edildi tekrar katlama tampon maddesi 1 L kullanın. 1 ml / dk 'lik bir oranda ve yaklaşık 2 saat boyunca 0.5 MPa bir azami basınçla kolonundan katlama tampon akış.
- Yeniden katlama tamponu içinde 1 ml bir Vivaspin santrifüj konsantratör (50 kDa MWCO) dengelenmesi. Diyaliz tüpünden alınan numuneyi çıkarın ve çökeltileri uzaklaştırmak üzere, 4 ° C de bir örnek santrifüj. Konsantratör içine örnek süpernatant pipetle. Yaklaşık 500 ul'lik bir hacme kadar konsantre örneği.
- Yeni bir kaba üzere, konsantre oktamer numuneyi çıkarın ve 1 ml tampon ile tekrar katlama konsantratör yıkayın. 500 ul durulama aşağı Konsantre ve oktamer örnek ekleyin. Bu durum, bir deriştirme aygıtı içinde kalan oktameri kurtarmak için yardımcı olur.
- 4 ° C'de 10,000 rpm'de 5 dakika boyunca bir 1.5 ml mikrofüj tüpüne örnek Spin Süpernatan toplamak ve yeni bir tüpe aktarılır. Bu, FPL ile ilgili örnek yüklemeden önce herhangi bir çökeltiyi uzaklaştırmak için yardımcı olurC.
- S200 kolonuna örnek yükleyin. Tek bir saflaştırma 1.5 ml toplam hacmi veya 15 mg oktamer maksimum yükleyin.
- Taze yapılmış yeniden katlama tamponu kullanılarak örnek Zehir. 1 ml / dk 'lık bir akış hızı ve 0.5 MPa arasında bir geri basınç sınırı kullanın. Yeniden katlama tamponu, iki kolon hacmi (400 mi) kullanarak ve 2 ml fraksiyonlar toplar. Elüsyon süresince, 280 nm'de absorbansı izleyin. Farklı türlerin boyutunu azalan Zehir olacaktır. Histon agrega genellikle yaklaşık 84 ml (Şekil 1) en az yaklaşık 45 ml, yaklaşık 65 ml oktamer de ve dimer elute.
- Bir 18-20% SDS-PAGE üzerinde örnekleri çalıştırarak ilgi tepelerinden elüsyon fraksiyonları analiz edin. Saflaştırılmış octamers ihtiva eden fraksiyonlar dört çekirdek histon proteinleri eşit molar miktarda (Şekil 1) sahip olmalıdır.
- Saflaştırılmış octamers içeren kesirler havuzu ve bir Vivaspin santrifüj filtre ile 15 mg / ml ≤ için konsantre. Sulandırmak bırakılırsa, octamers kesmek olabilir iNto H2A/H2B dimerleri ve H3/H4 tetramerler.
- 280 nm'de absorbansı ölçerek oktamer konsantrasyonunu belirleyin ve Tablo 1 sönüm katsayısı kullanarak hesaplar.
- Histon octamers 4 ° C'de tekrar katlama tampon maddesi içinde kısa süreli tutulabilir Uzun süreli depolamada halinde, octamers -20 ° C'de ve bir% 50 gliserol çözeltisi içinde daha kararlı olacaktır. Gliserol içinde depolanmıştır Octamers absorbans ölçümleri yapılmadan önce taze yeniden katlama tamponuna karşı dializ edilmiş ve nükleozomal dizi reconstitutions olarak kullanmak gerekir.
3. DNA dizileri ve nükleozomal Saflaştırılmış Octamers Sulandırılması
Gerekçe: nükleozomal dizilerin Sulandırma histon octamers ve şablon DNA spesifik mol oranlarında bir araya gerektirir. 2 M NaCI içinde DNA ve histon octamers karışımları iyonik mukavemeti azalan tampon içine dialize adımdır. Düşük tuz kademeli değişim Uygun nucleosome oluşumunu sağlar. N eldeşablon DNA histon oktamer doygunluk istenen düzeyde ucleosomal diziler büyük ölçekli bir hazırlayıcı yeniden oluşturulması, ardından küçük ölçekli bir test reconstitutions gerektirir. Küçük ölçekli reconstitutions tarafından tanımlanan uygun koşullar hazırlayıcı yeniden oluşturma yönlendirmek için kullanılır.
- 4,12 anlatıldığı gibi tandem tekrar nükleozom konumlandırma DNA arındırın. Kısaca, bir Qiagen GigaPrep kiti ya da benzeri bir ürün kullanılarak plazmid DNA izole eder. Set-up bir kısıtlama enzim şablon DNA'yı serbest bırakmak ve daha küçük boyutlarda (≤ 700 bp) için plazmid DNA sindirmek için sindirmek. Şablon DNA daha sonra uzak boyut dışlama kromatografisi (SEC) kullanılarak küçük bir plazmid DNA kalıntılarından saflaştırılabilir. A ağırlık Sephacryl S-1000 boncuklarla doludur yaklaşık 115 cm'lik bir yüksekliğe sahip bir sütun beslenen 207bp 601 x 12 mer DNA saflaştırılması için yeterlidir.
Notlar: plazmid DNA azalma pahasına arınma ancak artan eff içinort, bir E. plasmid DNA izole etmek için fenol / kloroform DNA saflaştırma ile alkalin liziz kullanabilir coli 23,24. Plazmid DNA şablon DNA'nın ayrılması için Stratejiler şablon DNA boyut değişiklikleri ile farklılık gösterebilir. SEC için bu kısıtlama enzimi şablonu ve plasmid DNA arasındaki büyüklüğü farkı maksimuma bir şekilde, sindirimi kurmak için önemlidir.
- Molar oranları (r) reconstitutions için hangi belirler. R DNA tekrarının mol oktamer mol oranına eşittir. Niyet doymuş nucleosomal diziler elde etmek ise ilk küçük ölçekli araştırmalar için, 0.9, 1, 1.1 ve r değerleri uygundur.
- Test edilecek her bir mol oranı için yaklaşık olarak 18 ug DNA eklemek için oktamer miktarının hesaplanması ile küçük çaplı numune hazırlayın. DNA ve histon octamers karıştırın. Örnekteki NaCI nihai konsantrasyon 2 M ≥ ve D nihai konsantrasyonu olmalıdırNA yaklaşık 0,3 mg / ml olmalıdır. Son numune tamponu koşulları da 10 mM Tris, pH 7.8 ve 1 mM EDTA içermelidir.
- Numuneler artık diyaliz için hazırız. 12k-14k MWCO diyaliz tüp içine örnekleri yükleyin. Aşağıdaki gibi iyonik mukavemetini azaltır tampon 2L karşı örnekleri Dialyze.
10 mM Tris pH 7.8, 1 mM EDTA: Bütün tamponlar içerisinde Bileşenleri. Tampon 1 5-6 saat boyunca (1 M NaCl, 1 mM DTT ekleyin). Tampon 2, gece boyunca (0.75 M NaCl, 1 mM DTT ekleyin). Tampon 3 saat boyunca, 5-6 (2.5 mM NaCI, 1 mM DTT ekleyin). Tampon 4 gece boyunca (2.5 mM NaCI, 0.1 mM PMSF ekleniyor).
- Diyaliz borudan örnekleri çıkarın ve bölümlere 4-6 geçin. Küçük ölçekli örnekler istenen sonuçları ise, büyük ölçekte bölümler 3-6 adımları tekrarlayın.
Not: bilgi muhafaza etmek için, küçük ölçekli örnekler alt tarama deneyleri için yeterli için gerekli olan minimum hacme sahip olmalıdır. E sahip amacıylanough 0.3 mg / ml DNA da burada listelenen çökelme hızı ve AFM deneyler, 50 ul örnekler için örnek uygundur. Büyük ölçekli büyüklüğü, hazırlayıcı örnekler amaçlanan kullanıma bağlıdır. Büyük ölçekli bir numunesi, küçük ölçekli örneklerle aynı şekilde hazırlanmalıdır.
4. Sulandırılmış nucleosomal Dizilerin sedimantasyon hızı analizi
Gerekçe: çözelti içinde moleküllerin büyüklüğü ve şekli ile ilgili en Beckman XL-A / I Analitik ultrasantrifüj verim bilgilerde sedimantasyon hızının deneyleri. Düşük tuz koşulları altında, sedimantasyon hızının deneyler yeniden dizileri nükleozom doymuş hangi ölçüde belirlemek için kullanılır.
- TEN tamponu (10 mM Tris pH 7.8, 1 mM EDTA, 2.5 mM NaCl) kullanılarak, 260 nm'de 0.5 bir soğurma için örnek seyreltin. Bir tarafta ve numune referen ile, iki sektör merkez ile bir hücreye örnek 400 ul yükDiğer 25 ce (TEN tampon). (Yani 420 ul referans çözümü eklemek) numune menisküsün daha yüksek referans menisküs tutun.
- Rotor içine hücreleri yükleyin ve düzgün hücre ve rotorun 25 alt kısmında karma işaretleri kullanarak hücreleri hizalayın. Yavaşça basınçlı hava ile hücrelerin lensler toz.
- , XL-A/XL-I santrifüj açmak rotor takın ve eklemek ve kılavuzunda anlatıldığı gibi optik sabitleyin. Yeni: Proteom Lab yazılımı seçin ve dosyayı açın.
- 3,000 rpm ve 25 ° C sıcaklıkta, tek bir tarama çalıştırmak kurmak Seçenekleri altında seçin son taramadan sonra durma ve çalışma radyal kalibrasyon (rotor EAA kullanılan son rotor ise radyal kalibrasyon gerekli değildir).
- Her bir hücre için, numune adı bir dalga boyu (260 nm) seçin, absorbans seçin ve bilgisayarınıza bir dosyayı kaydetmek konumu seçin. Tek bir tarama çalıştırmak başlayın.
- Uygun ra belirlemek için tek tarama kullanınTarama uzunluğu (Şekil 2A) çevirin. Taranır hücrenin uzunluğunun azaltılması kullanım süresini azaltır. Ancak örnek menisküs içerir ve çok yakın ya da hücrenin altındaki doğru uzanır ve emin olun.
Not: Tek taramalar ölçüm alanı sadece örnek menisküs (Şekil 2A) önce başlayarak ölçümler kısaltılmış izin verir. AUC çalışması sırasında üretilen taramasından en menisküs gibi istikrarlı platolar (Şekil 2B) geçen sınır fraksiyonlar olmalıdır. EAA hücreleri üzerinde kirli lensler büyük sivri taramalar üretebilir, bu verilerin analizini etkileyebilir. UltraScan yazılım analitik ultrasantrifügasyon verilerin 26 analizi ile ilgili bilgi için büyük bir kaynaktır bir kılavuzu içerir.
- XL-A/XL-I kontrol panelini kullanarak, bir 0 hız ve basın başlangıç girin. Bu, bir vakum ve çekmek için santrifüj haznesi isteyecektirow odasının sıcaklığı dengelenmeye. Bir çalışma başlamadan önce sıcaklık dengesini sağlamak için 1 saat bekleyin.
- İstenilen hız ve tarama sayısı için çalışma yukarı ayarlamak için yazılımını kullanın. Daha yüksek hızlar çözünürlüğünü artırabilir, ancak numune hücresinin alt tortulaşmış önce bir adet en azından 20 taramalar (tercihen daha fazlası) toplamalıdır. Bu çalıştırmak ilerlemeyi izlemek ve bu sızıntı hücreleri gibi olası sorunları kontrol etmek için (seçenekler menüsünden gerçekleştirilir) son birkaç taramaları kaplanması uygundur. Düzgün çalışmasını sağlamak için taramalar ilk çift izleyin.
5. Sedimentasyon Hızı Veri düzenleme ve Analizi
Gerekçe: Ham sedimantasyon hızı verileri, difüzyon-düzeltilmiş sedimantasyon katsayısı dağılımını veren bir program tarafından analiz edilmelidir. Sırayla Bu bilgi, belirli bir doygunluk düzeyini içeren bir yeniden numunenin kısmını gösterir, örn 12-mer DNA şablonu kullanarak eğer 10, 11, 12 ve nükleozom / DNA yeniden sahip dizilerin fraksiyonunu belirlemek mümkün olacaktır.
- Verileri 26 düzenlemek için bu tür UltraScan gibi AUC veri analiz yazılımı kullanın. Tarama verilerinin düzenleme her bir hücre için yapılır ve sonraki analiz için bir veri kümesi oluşturur gerekir. Taramaları doğru düzenleme, örnek menisküs tanımlayan ilgi bölgeye verileri azaltarak ve taban çizgisini yanı sıra yayla bölgeleri (Şekil 2) tanımlamayı kapsar. İstenmeyen taramaları da bu noktada belirlenen verilerden çıkarılabilir. Bu analiz sırasında istenmeyen taramalar kaldırmak mümkündür Bununla birlikte, bu tarama, tüm bu noktada tutulması önerilir.
- Önemle gelişmiş van Holde-Weischet yöntemi veriler 27 analiz etmek için kullanılır öneririz. Bu analiz yöntemi çalıştırmak boyunca difüzyon etkileri için düzeltir ve sedimentasyon katsayıları tamamlayıcı dağılımı elde edilir. Özellikle, Gelişmiş van Holde-Weischet yöntemi (UltraScan uygulandığı gibi) kararlı yaylaları eksikliği, ya da analiz 28 menisküs temizlenmiş değil sınır kesirler içerdiğini taramalarının dahil edilmesine izin verir.
- Monte diziler için sedimantasyon katsayılarının dağılımını belirlemek. 601-12 (207bp, 12-mer) nükleozomal diziler için Örnek sonuçlar Şekil 3'te gösterilmiştir.
- Küçük ölçekli örneklerinden biri sedimantasyon katsayıları arzu edilen dizi dizileri içeriyorsa, o zaman bölümü 3 başlayarak artan bir ölçekte işlemini tekrarlayın. Küçük ölçekli örneklerin hiçbiri sedimantasyon katsayılarının uygun dağılımına sahip ise 3. bölümde başlayan yeni bir r dizi küçük ölçekli testleri tekrarlayın.
6. Atomik Kuvvet Mikroskobu kullanarak nucleosomal Dizileri görselleştirme (AFM)
Gerekçe: AFM sağlar: nucleosoma doyma seviyesinin görselleştirmel diziler. Bu teknik, bir kalite kontrol deneyi olarak AUC ve sınır enzimi sindirimi ile sedimantasyon hızını tamamlar.
- Yukarıda tarif edilen yöntemler kullanılarak, ve doygun nükleozom dizisi (Şekil 5A) elde edilmiştir.
- Hazırlama APTES yerleştirerek mika slaytlar ~ 30 ul muamele edilmiş, 30 dakika için 0.22 um filtre nanopure su içinde ticari (Sigma-Aldrich (3-Aminopropil)-trietoksisilan A3648 100 mi) içinde 1:1000 seyreltme.
- 30 dakika sonra filtre edildi, su ile APTES durulayın ve yavaşça azot gazı akışı içinde kurutun.
- Slayt üzerinde uygun şekilde seyreltilmiş nükleozom dizisi örneği (~ 1.5 ng / ml) yerleştirin ve 15 dakika için oda sıcaklığında kapalı inkübe edin.
- Süzüldü, numune tamponu ile kapalı gibi örnek önce kurumasını ve AFM (bu durumda bir Sığınma Araştırma MFP-3D Atomik Kuvvet Mikroskobu) ve sahnede yer slayt durulayın.
- 512 tarama hattı ile 2 x 2 mikron taramaları görüntüleme başlayın. Sa seviyesini tespit etmek nükleozomlann sayısınıturation (Şekil 5B).
- İdeal gerektiği de ayrı nucleosome dizilerle slaytta görüntü alanları.
- Daha yüksek çözünürlüklü görüntüler, 500 x 500 nm tarama (Şekil 5C) elde edilebilir.
- Görüntüler basık ve İltica tarafından sağlanan MFP-3D yazılımı kullanılarak analiz edilebilir.
- Her görüntü dört parçaya bölünür ve nükleozomlann (Şekil 5C, sağ panel-yükseklik izleme için elde edilen diziler ve yükseklik profilleri üzerinden çizilebilir iyi ayrılmış diziler ve çoklu serbest el çizgileri net bir görünüm elde etmek için dijital zoomlanabilir ve 5D).
- Birkaç tür görüntüler nükleozomlann yüzlerce kapsayan dizinin her bir türü için analiz edilmelidir. Yükseklik profilleri, kaydedilmiş kategorize ve MS Excel çizilmiştir.
Sonuçlar
Protokolünü göstermek için biz 12 tandem 601 konumlandırma dizisine (601 207 x 12) 207 bp tekrarlarını kapsayan yeniden birleştirici Xenopus çekirdek histon ve DNA dizileri, nükleozomal yeniden. İlk liyofilize çekirdek histon ikinci yerel octamers monte edilmiş ve daha sonra bir S200 sütunu (Şekil 1A) kullanılarak FPLC ile octamers arıtıldı. Daha büyük kompleksler S200 kolonundan önce elüte. Histonlar genellikle bu sırayla Zehir: non-spesifik histon agrega, histon oktamer, H3/H4 tetramer ve H2A/H2B dimer (Şekil 1A). S200 kolonundan tepe SDS-PAGE ile analiz edildi. Saflaştınldı oktamer fraksiyonlarının jeller dört histon proteinleri (Şekil 1B) eşit molar miktarlarda belirtmelidir. Xenopus H2A ve H2B sadece yaklaşık 200 Da kadar farklılık gösterir ve bu nedenle SDS jelleri üzerinde tek bir bant olarak görünür moleküler ağırlığa sahip olduğuna dikkat edin. H3/H4 tetramerler ve H2A/H2B dimerleri ver sonra Zehir, ancakhiston oktamer zirvesine y yakındır. Tutmak için hangi kesirler seçerken kromatogramda oktamer tepe sonuna doğru görünen kesirler atmak için isabetli olmuştur. Bu fraksiyonlar olmayan oktamerik histon komplekslerinin artan bir miktarda olabilir. Bu durumda, 64-67 nükleozomal sulandırma dizisi (Şekil 1) için bir araya toplanmış ve kaydedilmiş olan fraksiyonlar.
UltraScan içinde gelişmiş van Holde-Weischet analizinden elde edilen sedimantasyon katsayılarının difüzyon düzeltilmiş dağılımını inceleyen iki farklı yolu vardır. Kırmızı çizgi, sedimantasyon katsayılarının integral dağılımını temsil eder. Grafikteki herhangi bir nokta için, y-ekseni eşit ya da x-ekseni üzerinde belirtilen değerden daha düşük bir çökme katsayısına sahip numunenin kısmını gösterir. Heterojen bir numune de pozitif olarak eğimli bir eğri olacak Böylece, bir dikey çizgi, homojen bir örnek göstergesidir. Yeşil çizgi de olduğunuintegral dağılımının rivative. Bir tepe noktasının altındaki alan bu çökelme katsayısına sahip numunenin fraksiyonu ile orantılıdır. Tamamen doymuş 601 207 x 12 nükleozomal dizileri 29S 29 bir çökme katsayısına sahiptir. Şekil 3 'de gösterilen örnek için, veri dizileri yaklaşık% 70 ve% 30 doymuş, doymuş üzerinde olan olduğunu göstermektedir.
Atomik kuvvet mikroskobu in vitro kromatin organizasyonu incelemek için popüler bir tamamlayıcı bir yaklaşım, yeni bir teknik gitti. Burada sulandırıldıktan sonra şablon doygunluk derecesini kurmak için analitik ultrasantrifüj yanında AFM kullandık. Şekil 6'da görüntüleme için kullanılan ~ 27S dizileri (Şekil 4A), çoğunluğu AFM ve AUC sonuçları arasında iyi bir anlaşma gösteren, 10-11 nükleozom (Şekil 4B) ihtiva etmiştir. Burada elde AFM sonuçlar nedenle bu doğrularyaklaşım ve nucleosomal dizileri karakterize etmek için güvenilir bir tekniktir yapmak.
| Histon Protein | Σ276, gelişeceğini Proteinler cm -1 M -1 | Moleküler ağırlık Da |
| H2A | 4.350 | 13960 |
| H2B | 7.250 | 13774 |
| H3 | 4.640 | 15273 |
| H4 | 5.800 | 11236 |
| Oktamer | 44080 | 108486 |
Tablo 1. Extinction katsayıları ve Xenopus laevis çekirdek histon ve histon renatüre oktamer moleküler ağırlıkları.
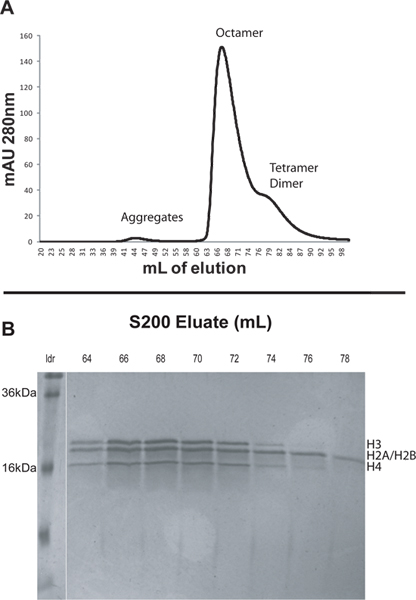
Şekil 1. Bölüm 2'de tarif edildiği gibi S200 kolondan A. elüsyon profili. Yaklaşık 44 ml 'de küçük tepe büyük bir histon agrega kaynaklanmaktadır. 67 ml belirgin zirve histon octamers olduğunu. 76-90 ml'den geniş omuz H3/H4 tetramerleri ve H2A/H2B dimerler S200 sütunu seçilen fraksiyonların. B.% 20 SDS-PAGE içerir. Onlar olmayan oktamerik histon kompleksleri ile kontamine olması en muhtemel olarak oktamer zirveden erken fraksiyonlar toplandı edilmelidir. Bu durumda 64-67 toplanmış ve nucleosomal dizi sulandırma için kaydedilmiş olan fraksiyonlar. büyük rakam görmek için buraya tıklayın .

Şekil 2. La ile 3,000 rpm'de toplanan tek bir tarama A. ProteomeLab ekran yakalama yazılımı (bel) eklendi. örnek bu düşük hızda tortu değil unutmayın. Tek bir tarama AUC hücre tarama için ölçüm aralığı (adım 4.6) UltraScan programı (eklenen etiketler ile) 26 kullanılarak elde edilen sedimantasyon hızı taramaları bir dizi. B. Ekran yakalama ayarlamak için kullanılır. Taramaları bu dizi analizi için bir veri seti (bkz: adım 5.1) oluşturmak için düzenlenir.
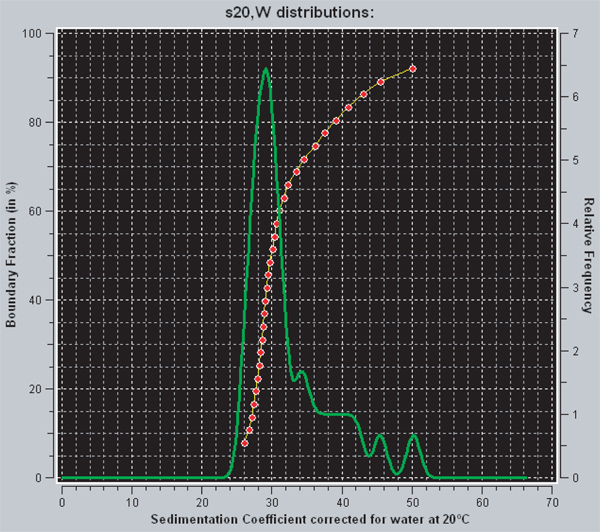
Şekil 3. UltraScanII bir ekran yakalama., Kırmızı ve yeşil çizgiler UltraScan sedimantasyon katsayılarının dağılımını görüntülemek için iki farklı yöntem vardır. Yeşil türevi ise kırmızı çizgi, sedimentasyon katsayıları integral dağılımıdır. Yorumuna Ekstra bilgiler sonuç bölümünde bulunabilir.
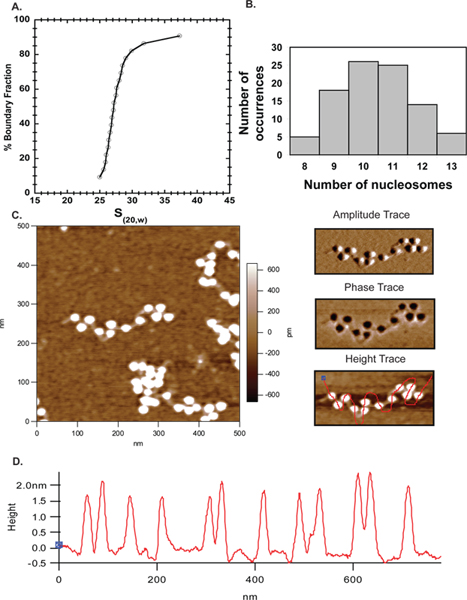
Şekil 4.. AFM. Ortalama sedimantasyon katsayısını gösteren fare oktamer monte 601 207 x 12 dizileri için A. Çökeltme hız profili 27S olduğunu. B. A aynı dizileri AFM ile görüntülendi ve çeşitli görüntülerde sayılır nükleozom sayısı MS Excel çizilmiştir. Arsa diziler bir çoğunluğu. C. 500 x 500 bağlayıcı DNA ile 601 207 x 12 nucleosome dizilerin nm tarama açıkça görünür AUC verileri doğrulayan 10-11 nükleozom olduğunu belirtti. Sağ üst paneli genlik iz ve orta sağ panel C'de gösterilen dizi için faz izidir. Sağ panel alt solda, ancak nükleozom yüksekliğinin profilini belirlemek için, nükleozom boyunca çekilen bir serbest el çizgi ile gösterilen aynı yükseklikte izidirs. yukarıdaki resimde nükleozomların D. Yükseklik profilleri daha önce 40 rapor gibi tüm nukleosomlar 1.5-2.5 nm yüksekliği içinde aralığında olduğunu göstermektedir.
Tartışmalar
Model nucleosomal diziler kromatin yapısı ve fonksiyonu in vitro çalışma için çok yararlı bir araçtır. Örneğin, yaygın olarak çözelti 30-34 kromatin fiber yoğuşma mekanizmasını incelemek için kullanılan ve mümkün bir tetranucleosome 35 bir x-ışını yapı elde etmek için yapılmıştır. Daha yakın zamanlarda bu, belirli çekirdek histon varyantları, mutantlan ve posttranslasyonel modifikasyonlar 14-16,36 yapısal etkileri çözmekte yararlı olduğu kanıtlanmıştır. Burada nucleosome konumlandırma DNA ve rekombinant çekirdek histon adlı modeli nucleosomal dizilerin montajı için genel bir yöntem açıklanmaktadır.
Arıtıldı octamers ve 601 207 x 12 DNA'dan nükleozomal dizilerin yeniden oluşturma ardışık 2 M ila 2.5 mM arasındaki NaCl konsantrasyonunu düşürmek çok diyaliz adımları içeren, basittir. Protokolün en zor kısmı istenen tem veren bir r-değer kullanmak içinplaka doygunluk seviyesi. Uygun r-değeri ilk olarak küçük çaplı bir şekilde ampirik olarak belirlenir ve daha sonra deneyler için kullanılan nükleozomal dizileri oluşturmak için daha büyük bir ölçekte tekrar edilir. Bizim durumumuzda, biz çoğunlukla DNA başına 12 nükleozomlann ile doymuş 601 207 x 12 DNA şablonları elde etmek için çalışıyorlardı. Bir tam doymuş 601 207 x 12 nükleozomal dizisinin çökelme katsayısı 29 S, 27S ~ 29 de DNA sediment başına sadece 11 nükleozom ile aynı DNA şablonu ise. Bu nedenle, analitik ultrasantrifüjdeki sedimantasyon hızının sulandırıldıktan sonra nükleozom doygunluk düzeyini belirlemek için bir çok hassas bir yöntem sağlar. Biz bir difüzyon-düzeltilmiş sedimantasyon katsayısı dağılımı verir gelişmiş van Holde-Weischet yöntemi kullanılarak değerlendirdik. Homojen veya heterojen örnek sulandırıldıktan sonra nasıl bir söyler, çünkü bu bilgiler önemlidir. Diğer bir deyişle, bir 601 x 207 12 DNA şablonu, buŞekil 3, geliştirilmiş van 1,1 'lik bir r yeniden 601 207 x 12 nükleozomal dizilerinin Holde-Weischet analiz sonuçlarını göstermektedir DNA başına 12 nükleozom, DNA başına 11 nükleozom vb sahip numunenin kısmını gösterir kabaca Dizilerin 30% doymuş bitti. Numunenin programı genellikle, doymuş dizilerin yüzdesine bağlı, fakat bazı uygulamalar, çok homojen ve / veya doymuş dizileri gerekebilir içeri diziler kullanılacak deney bağlıdır edilir. Yöntem bir dizi nükleozomal dizilerin homojenliğinin ve doygunluk geliştirmek için mevcuttur.
Bu durumda, doygun diziler MgCI2 37'nin ilave edilmesi üzerine seçici çökeltme kaldırılır. Daha homojen diziler aynı zamanda sukroz gradyanlı santrifüj preparatif jel elektroforezi ve iyon değişim kromatografisi 10,13 kullanarak örnek saflaştırılması ile elde edilebilir. Modifiye edilmiş bir nucleosomal dizi sulandırma yöntemi tuz diyaliz 38,39 ile hazırlandıktan önce numunelerin kısa rakip DNA ekleyerek için çağırır. Bu, bir DNA şablonu üzerinde doyurmaksızın histon oktamer fazlası ile nükleozomal dizileri birleştirmek için olanak sağlar. Nükleozomal diziler büyük olasılıkla rakip DNA ve ilave histonların çıkarılması için bir arıtma adımı gerektirir rakip DNA kullanılarak yeniden.
Hatta küçük ölçekli pilot dizisi meclisleri sonra, büyük bir ölçekte yeniden nucleosomal diziler düzgün doymuş olmayacak mümkündür. Örnekteki şablon DNA ve histon oktameri kaybını önlemek için, bu fazla veya doymuş diziler altında düzeltmek mümkündür. Diziler, doymuş üzerinde ise, ilave DNA numuneye ilave edilebilir. Diziler doymuş altında iseniz, ekstra oktamer düzeltmek için eklenebilir. Ancak, zaten düşük tuz diyalize diziler oktamer ekleyerek ayrışma oktamer neden olabilir. Ekstra o ekleniyorsactamer veya DNA, diziler toplu numune için ekstra oktameri veya DNA ekleyerek önce geri 2 M NaCl içine diziler diyalize. Adım 3.4 yılda düşük tuz yüksek gelen sabit örnekleri için adım diyaliz tekrarlayın. Diziler düzeltmek için eklemek oktamer miktarı doymuş diziler 29 altında sedimantasyon katsayıları tahmin edilebilir. Nükleozomal Dizilerin örnek ayarladıktan sonra, satürasyon düzeyi ölçümleri tekrar yapılmalıdır.
AFM nucleosomal dizileri tanımlamak için güçlü bir yöntem olsa da, karmaşık ve emek yoğun bir süreçtir. Bu küçük ölçekli reconstitutions tarama için kötü bir tekniktir, ancak büyük ölçekli numunelerin karakterizasyonu ve kromatin örgütün çalışma için mükemmel bir tekniktir yapar. Daha önce "hiper-duyarlı" hatta düşük MgCl2 konsantrasyonları için bir macroH2A silme yapı tarafından oluşturulan "makro" parçacıklar görselleştirmek için AFM kullandık. Likewise, Montel et al. (2009) H2A BBD varyant nükleozom dizileri vahşi tip dizileri ile karşılaştırıldığında daha "açık" olduğu yol açtığını göstermiştir. Bu nedenle, AFM güvenilir kalite kontrol için bir teknik, hem de genel olarak fiber kromatin yapısının çalışma içindir.
Açıklamalar
Yazarlar çıkar çatışmaları var.
Teşekkürler
Bu çalışma NIH hibe GM45916 ve GM66834 Hi'de ve bu işi Ak Uluslararası Rett Sendromu Vakfı bir burs ile desteklenmiştir da NIH GM088409 ve Howard Hughes Tıp Enstitüsü KL katkıları hibe tarafından desteklenen
Malzemeler
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Sigma-Aldrich | A3648-100ML | |
| 6-8 kDa MWCO Dialysis Tubing | Fisher | 21-152-5 | |
| HiLoad Superdex 200 16/60 Column | GE | 17-1069-01 | |
| Vivaspin 50 kDa MWCO Centrifugal Concentrator | Sartorius | VS2031 | |
| 12-14 kDa MWCO Dialysis Tubing | Fisher | 08-667A | |
| Illustra Sephacryl S-1000 Superfine | GE | 17-0476-01 | |
| XL-A/I Analytical Ultracentrifuge | Beckman-Coulter |
Referanslar
- Luger, K., Mader, A., Richmond, R., Crystal Sargent, D. structure of the nucleosome core particle at 2.8 A resolution. Nature. 7, (1997).
- Hansen, J. C. Conformational dynamics of the chromatin fiber in solution: determinants, mechanisms, and functions. Annual Review of Biophysics and Biomolecular Structure. 31, 361-392 (2002).
- McBryant, S., Adams, V., Hansen, J. Chromatin architectural proteins. Chromosome Research. 14 (1), 39-51 (2006).
- Hansen, J. C., Ausio, J., Stanik, V. H., van Holde, K. E. Homogeneous reconstituted oligonucleosomes, evidence for salt-dependent folding in the absence of histone H1. Biochemistry. 28 (23), 9129-9136 (1989).
- Szerlong, H. J., Prenni, J. E., Nyborg, J. K., Hansen, J. C. Activator-dependent p300 acetylation of chromatin in vitro: enhancement of transcription by disruption of repressive nucleosome-nucleosome interactions. The Journal of Biological Chemistry. 285 (42), 31954-31964 (2010).
- Cirillo, L. A., Lin, F. R., Cuesta, I., Friedman, D., Jarnik, M., Zaret, K. S. Opening of compacted chromatin by early developmental transcription factors HNF3 (FoxA) and GATA-4. Molecular Cell. 9 (2), 279-289 (2002).
- Nguyen, C., Gonzales, F. chromatin structure associated with methylation-induced gene silencing in cancer cells: correlation of accessibility, methylation, MeCP2 binding and acetylation. Nucleic Acids Research. 29 (22), 4598-4606 (2001).
- Cuesta, I., Zaret, K. S., Santisteban, P. The forkhead factor FoxE1 binds to the thyroperoxidase promoter during thyroid cell differentiation and modifies compacted chromatin structure. Molecular and Cellular Biology. 27 (20), 7302-7314 (2007).
- Simpson, R. T., Stafford, D. W. Structural features of a phased nucleosome core particle. Proceedings of the National Academy of Sciences of the U S A. 80 (1), 51-55 (1983).
- Lowary, P. T., Widom, J. New DNA sequence rules for high affinity binding to histone octamer and sequence-directed nucleosome positioning. Journal of Molecular Biology. 276 (1), 19-42 (1998).
- Lowary, P., Widlund, H., Cao, H. Sequence motifs and free energies of selected natural and non-natural nucleosome positioning DNA sequences. Journal of Molecular Biology. 288, 213-229 (1999).
- Gordon, F., Luger, K., Hansen, J. C. The Core Histone N-terminal Tail Domains Function Independently and Additively during Salt-dependent Oligomerization of Nucleosomal Arrays *. The Journal of Biological Chemistry. 280 (40), 33701-33706 (2005).
- Luger, K., Rechsteiner, T. J., Richmond, T. J. Expression and purification of recombinant histones and nucleosome reconstitution. Methods in Molecular Biology (Clifton, N.J.). 119 (4), 1-16 (1999).
- McBryant, S. J., Klonoski, J., et al. Determinants of histone H4 N-terminal domain function during nucleosomal array oligomerization: roles of amino acid sequence, domain length, and charge density. The Journal of Biological Chemistry. 284 (25), 16716-16722 (2009).
- Ma Shogren-Knaak, ., Fry, C. J., Peterson, C. L. A native peptide ligation strategy for deciphering nucleosomal histone modifications. The Journal of Biological Chemistry. 278 (18), 15744-158 (2003).
- Lu, X., Simon, M. The effect of H3K79 dimethylation and H4K20 trimethylation on nucleosome and chromatin structure. Nat Struct Mol Biol. 15 (10), 1122-1124 (2008).
- Ausio, J. Analytical Ultracentrifugation for the Analysis of Chromatin Structure. Biophysical Chemistry. 86 (2-3), 141-153 (2000).
- Hansen, J., Kreider, J., Demeler, B., Fletcher, T. Analytical ultracentrifugation and agarose gel electrophoresis as tools for studying chromatin folding in solution. Methods. 12 (1), 62-72 (1997).
- Montel, F., Menoni, H., et al. The dynamics of individual nucleosomes controls the chromatin condensation pathway: direct atomic force microscopy visualization of variant chromatin. Biophysical Journal. 97 (2), 544-5453 (2009).
- Muthurajan, U. M., McBryant, S. J., Lu, X., Hansen, J. C., Luger, K. The linker region of macroH2A promotes self-association of nucleosomal arrays. The Journal of Biological Chemistry. 286 (27), 23852-23864 (2011).
- Shlyakhtenko, L. S., Lushnikov, A. Y., Lyubchenko, Y. L. Dynamics of nucleosomes revealed by time-lapse atomic force microscopy. Biochemistry. 48 (33), 7842-7848 (2009).
- Lohr, D., Bash, R., Wang, H., Yodh, J., Lindsay, S. Using atomic force microscopy to study chromatin structure and nucleosome remodeling. Methods (San Diego, Calif). 41 (3), 333-341 (2007).
- Dyer, P. N., Edayathumangalam, R. S., et al. Reconstitution of nucleosome core particles from recombinant histones and DNA. Methods in Enzymology. 375, 23-44 (2004).
- Sambrook, J., Russell, D. . Molecular cloning: a laboratory manual. , (2001).
- Balbo, A., Zhao, H., Brown, P. H., Schuck, P. Assembly, loading, and alignment of an analytical ultracentrifuge sample cell. J. Vis. Exp. (33), e1530 (2009).
- Demeler, B. UltraScan: a comprehensive data analysis software package for analytical ultracentrifugation experiments. Modern Analytical Ultracentrifugation: Techniques. , 210-230 (2005).
- Holde, K. V., Weischet, W. Boundary analysis of sedimentation velocity experiments with monodisperse and paucidisperse solutes. Biopolymers. 17 (6), 1387-1403 (1978).
- Demeler, B., van Holde, K. E. Sedimentation velocity analysis of highly heterogeneous systems. Analytical Biochemistry. 335, 279-288 (2004).
- Hansen, J., Lohr, D. Assembly and structural properties of subsaturated chromatin arrays. Journal of Biological Chemistry. 8, 5840-5848 (1993).
- Routh, A., Sandin, S., Rhodes, D. Nucleosome repeat length and linker histone stoichiometry determine chromatin fiber structure. Proceedings of the National Academy of Sciences of the U S A. 105 (26), 8872-8877 (2008).
- Zhou, J., Fan, J. Y., Rangasamy, D., Tremethick, D. J. The nucleosome surface regulates chromatin compaction and couples it with transcriptional repression. Nature Structural & Molecular Biology. 14 (11), 1070-1076 (2007).
- Dorigo, B., Schalch, T., Kulangara, A., Duda, S., Schroeder, R. R., Richmond, T. J. Nucleosome arrays reveal the two-start organization of the chromatin fiber. Science (New York, N.Y.). 306 (5701), 1571-1573 (2004).
- Correll, S. J., Schubert, M. H., Grigoryev, S. a Short nucleosome repeats impose rotational modulations on chromatin fibre folding. The EMBO Journal. 31 (10), 2416-2426 (2012).
- Mcbryant, S. J., Krause, C., Woodcock, C. L., Hansen, J. C. The Silent Information Regulator 3 Protein , SIR3p , Binds to Chromatin Fibers and Assembles a Hypercondensed Chromatin Architecture in the Presence of Salt. Molecular and Cellular Biology. 28 (11), 3563-3572 (2008).
- Schalch, T., Duda, S., Sargent, D. F., Richmond, T. J. X-ray structure of a tetranucleosome and its implications for the chromatin fibre. Nature. 436 (7047), 138-1341 (2005).
- Fan, J. Y., Gordon, F., Luger, K., Hansen, J. C., Tremethick, D. J. The essential histone variant H2A.Z regulates the equilibrium between different chromatin conformational states. Nature Structural Biology. 9 (3), 172-176 (2002).
- Carruthers, L. M., Bednar, J., Woodcock, C. L., Hansen, J. C. Linker histones stabilize the intrinsic salt-dependent folding of nucleosomal arrays: mechanistic ramifications for higher-order chromatin folding. Biochemistry. 37 (42), 14776-14787 (1998).
- Huynh, V. A. T., Robinson, P. J. J., Rhodes, D. A Method for the In Vitro Reconstitution of a Defined "30 nm" Chromatin Fibre Containing Stoichiometric Amounts of the Linker Histone. Journal of Molecular Biology. 345 (5), 957-968 (2005).
- Dorigo, B., Schalch, T. Chromatin fiber folding: requirement for the histone H4 N-terminal tail. J. Mol. Biol. 2836 (03), 85-96 (2003).
- Qian, R. L., Liu, Z. X., et al. Visualization of chromatin folding patterns in chicken erythrocytes by atomic force microscopy (AFM. Cell Research. 7 (2), 143-150 (1997).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır