Method Article
Ассамблея нуклеосомной массивов из рекомбинантных стержневых гистонов и позиционированием нуклеосом ДНК
В этой статье
Резюме
Представлен метод для восстановления модельных нуклеосомных массивов из рекомбинантных стержневых гистонов и тандемно повторного ДНК нуклеосом позиционирования. Мы также описать, как эксперименты скорости оседания в аналитической ультрацентрифуге и атомно-силовой микроскопии (АСМ) используются для мониторинга масштабов нуклеосомной насыщения массива после восстановления.
Аннотация
Основные гистонов октамеры, которые повторно расположенных вдоль молекулы ДНК называют нуклеосомной массивы. Нуклеосомной массивы, полученные в одном из двух способов: очищение от естественных условиях источников в, или восстановление в пробирке из рекомбинантных стержневых гистонов и тандемно повторил ДНК нуклеосом позиционирования. Последний метод имеет то преимущество, что позволяет для сборки более композиционно форме и точно позиционируется нуклеосомной массива. Эксперименты скорости седиментации в аналитической информации текучести ультрацентрифуге о размере и форме макромолекул путем анализа скорости, с которой они мигрируют через раствора под действием центробежной силы. Этот метод, а также атомно-силовой микроскопии, могут быть использованы для контроля качества, гарантируя, что большинство ДНК-матриц насыщены нуклеосом после восстановления. Здесь мы опишем протоколы, необходимые для восстановления миллиграмм количества длину и композиционно Defined нуклеосомной массивы, пригодные для биохимических и биофизических исследований структуры хроматина и функции.
Введение
Геномах эукариот не существуют как чистую ДНК, а уплотняются и организован связанных белков. Эти комплексы ДНК и белка известны как хроматина. Основная повторяющееся звено хроматина является нуклеосома. Нуклеосом состоит из гистона октамера и 146 пар оснований ДНК, обернутой вокруг гистона октамер примерно в 1,6 раза 1. Гистон октамер состоит из двух копий каждого из стержневых гистонов H2A, H2B, H3 и H4,. Основные гистонов октамеры, которые повторно расположенных вдоль молекулы ДНК называют нуклеосомной массивы. Расширенная структура нуклеосомных массивов был передан в качестве 10 нм волокна или "бусины на нитке" структуры и присутствует в пробирке в условиях низких соли 2. 10 нм волокна способен конденсации в высших порядков структур через внутри массива уплотнения и / или между массива олигомеризации 2. Эти структуры более высокого порядка может быть индуцирован в присутствии солей,или может быть под влиянием через связывание хроматина архитектурных белков в нуклеосомной массива 3,4. Уровни хроматина уплотнения являются обратно коррелирует со скоростью транскрипции в естественных условиях 5,6. Недавние исследования подчеркивает важность структурной организации геномов в таких процессах, как дифференциации, развитию рака и других 7,8. Использование нуклеосомных массивов изучать структуру хроматина и функции стала широко распространенной. Здесь мы опишем метод для сборки нуклеосомных массивов из рекомбинантных стержневых гистонов и ДНК нуклеосом позиционирования.
Использование рекомбинантной ДНК с тандемных повторов нуклеосомных последовательностей позиционирования позволяет восстановления массивов, которые содержат регулярно расположенных нуклеосом. Два из наиболее популярных последовательностей позиционирования являются последовательность гена 5S рРНК и "601" последовательность 9,10. Последовательность 601 была получена из SELEX экспериментов и море сильно позиционирует нуклеосом, чем последовательности 5S 11. Следовательно, длина линкера ДНК из 601 массивов является более однородным. Тандемно повтор ющиес нуклеосом ДНК позиционирование полученный с помощью гель-фильтрации 4,12. Рекомбинантные гистоны очищенный от E. палочка в условиях денатурирующих 13. Использование рекомбинантных гистонов позволяет тщательно контролировать гистонов состав нуклеосомных массивов. Например, стержневых гистонов принимая специфические мутации 14 или пост-трансляционные модификации 15,16 может быть заменен на дикого типа стержневых гистонов.
Эксперименты скорости оседания контролировать скорость осаждения макромолекул в растворе при приложенном центробежной силы 17. Это дает информацию о размере и форме макромолекул в образце. Таким образом, эксперименты скорости оседания являются подходящим инструментом для изучения изменения состояния решения в хроматина волокнаСтруктура из-за конденсации хроматина 18. Важно отметить, что в первую очередь необходимо использовать эксперименты седиментации скорости как шаг контроля качества в нуклеосомной восстановления массива. Если ДНК и нуклеосомы не объединяются в надлежащее молярном соотношении, массивы могут быть недо-или перенасыщен стержневых гистонов. Таким образом, информация, полученная из экспериментов седиментации скорости используется для того, чтобы должным образом ДНК нуклеосомы насыщен. Важно использовать альтернативные методы оценки насыщенности ДНК с нуклеосом, особенно при работе с ранее неохарактеризованной ДНК-матрицы. Таким образом, мы также описывают способ анализа нуклеосомных массивах, используя атомно-силовой микроскопии (АСМ). АСМ является мощная техника, которая позволяет визуализация эффектов ряда параметров, таких как уровень насыщенности, эффекта присутствия вариантов гистонов или последствий MgCl 2 19,20. АСМ также был Appliред изучать динамику нуклеосом используя промежуток времени визуализации 21. Экстракорпоральное собраны нуклеосомной массивы 12-мерные особенно поддаются АСМ исследований, потому что они принадлежат в правильном диапазоне размеров для АСМ-изображений 22. В настоящем исследовании мы использовали АСМ из нуклеосомных массивов как контроль качества, а также средства утверждения данные из AUC ("увижу, не поверю»). В дополнение к простой визуализации, АСМ позволяет измерять профилей высоты образцов в качестве дополнительного показателя.
протокол
1. Ассамблея рекомбинантных стержневых гистонов в октамеры
Обоснование: Первый шаг в нуклеосомной восстановления массива является подготовка собственных основных гистонов октамеры из лиофилизированных рекомбинантных стержневых гистонов. Гистоновых белков объединены в равных мольных количествах и собраны в гистонов октамеры диализом образцы из буфера повторной укладки в денатурирующего буфера.
- Очищают и лиофилизуют рекомбинантных стержневых гистонов (H2A, H2B, H3, H4), как описано 13.
- Растворить примерно 5 мг каждого лиофилизированного основной гистона в 3 мл разворачивается буфера (6 М гуанидин HCl, 20 мМ Трис, рН 7,5, 5 мМ DTT). Разрешить каждая аликвота распустить в течение не менее одного часа. Убедитесь, что белок не остается на сторонах контейнера.
- Измерить абсорбцию каждого гистона при 276 нм с использованием разворачивается буфер в качестве эталона.
- Рассчитайте молярность каждого гистона используя свои коэффициенты экстинкции (см. таблицу 1 для Xenopus коэффициентов гистонов вымирания). Сравнение абсорбции определяется концентрацию гистона в лиофилизированного сухого веса, а также оценки, если большинство белков растворяется.
- Определите, какие гистонов у вас есть наименьшее количество молей, так как это будет предельное количество молей для всех гистонов.
- Объедините гистоны в равных молярных количествах и разбавляют разворачивается буфер для конечной концентрации 1 мг / мл.
- Поместите образец в 6-8 кДа MWCO диализа. Уплотнение трубки и поместить в 2 л холодного буфера повторной укладки (2 М NaCl, 10 мМ Трис рН 7,5, 1 мМ ЭДТА, 5 мМ β-меркаптоэтанол).
- Диализировать образца в течение 18 ч при 4 ° С при перемешивании. Убедитесь, что трубка для диализа может свободно вращаться и энергично, иначе гистоны могут выпадать в осадок.
- Измените буфер диализа два раза в 18 час периода (т.е. изменить буфер повторной укладки о каждом 6 часов до готовности). Даже если осадок не отбрасыватьобразец, некоторые октамер может быть выделен хотя выход будет уменьшена.
Примечание: См. шаг 2.1-2.2 подготовить столбца уравновешивание в течение следующего дня.
2. Очистка гистона октамеры эксклюзионной хроматографией
Обоснование: После заключения с разделом 1, образцы будут содержать гистонов октамеры, а также другие гистонов комплексы, такие как агрегаты, H3/H4 тетрамеров и H2A/H2B димеров. Гистоновые октамеры будет очищен от этих других комплексов с использованием эксклюзионной хроматографии (SEC).
- Подключите HiLoad 16/60 Superdex200 16/60 колонка (S200) на FPLC системе. Убедитесь, что пузырьки воздуха не зашли в систему.
- Очистите столбец S200 с 0,2 мкм фильтрованной воды. Использование скорости потока 0,3 мл / мин и установить предел обратное давление 0,5 МПа. Убедитесь, что у вас достаточно воды и позволяют колонна для очистки ночь.
- Уравновешивают столбца и образец петлю S200 от FПЛК с использованием рефолдинга буфер. Используйте 1 л 0,2 мкм фильтрованной буфера повторной укладки. Расход рефолдинга буфер через колонку со скоростью 1 мл / мин и максимальным давлением 0,5 МПа в течение примерно 2 часов.
- Равновесие центробежного концентратора Vivaspin (50 кДа MWCO) с 1 мл буфера повторной укладки. Извлеките образец из диализной трубке и центрифугировать образец при 4 ° С для удаления любых осадок. Внесите образец супернатанта в концентратора. Концентрат образца до объема примерно 500 мкл.
- Снимите концентрированный образец октамера в новый контейнер и промыть концентратор с 1 мл рефолдинга буфер. Концентрат промыть до 500 мкл, и добавить его в октамера образца. Это помогает спасти хоть октамер оставшиеся в концентратора.
- Спин образец в 1,5 мл пробирке в течение 5 мин при 10000 оборотах в минуту при 4 ° С. Сбор супернатант и передачи в новую пробирку. Это помогает удалить любой осадок перед загрузкой образца на FPLС.
- Загрузить образец в колонку S200. Нагрузка максимум 1,5 мл общего объема или 15 мг октамера в одном очистки.
- Элюции примера с использованием свежеприготовленный рефолдинга буфер. Используйте скорость потока 1 мл / мин и предел обратное давление 0,5 МПа. Использование двух объемов колонки (400 мл) буфера повторной укладки и собирать 2 мл фракции. Монитор оптической плотности при 280 нм в течение элюирования. Различные виды будут элюирования в порядке убывания размера. Гистоновые агрегаты обычно элюируются на примерно 45 мл, октамера около 65 мл и димер на отметке 84 мл (рис. 1).
- Проанализировать элюированных фракций из пиков, представляющих интерес, выполнив образцы на 18-20% ДСН-ПААГ. Фракции, содержащие очищенные октамеры должны иметь равные молярные количества четырех основных белков гистонов (рис. 1).
- Объединяют фракции, содержащие очищенные октамеры, и концентрируют до ≤ 15 мг / мл с центробежным фильтром Vivaspin. Если не разбавленной, октамеры может дистанцироваться яНТО H2A/H2B димеры и H3/H4 тетрамерами.
- Определить концентрацию октамера путем измерения оптической плотности при 280 нм и рассчитывают с использованием коэффициента экстинкции от таблице 1.
- Гистоновые октамеры может храниться короткий срок в рефолдинга буфера при 4 ° С. Если хранится длительный срок, октамеры будет более стабильным при -20 ° С и в 50% раствора глицерина. Октамеры хранящиеся в глицерине следует диализу в свежем буфере повторной укладки перед измерениями поглощения и использования в нуклеосомных reconstitutions массива.
3. Восстановление из нуклеосомной массивов из ДНК и очищают октамеры
Обоснование: Восстановление из нуклеосомных массивов требует, чтобы гистонов октамеры и матричной ДНК быть объединены в определенных молярных соотношениях. Смеси ДНК и гистонов октамеры в 2 М NaCl являются шагом диализу в буферы уменьшением ионной силы. Постепенное изменение к снижению соли обеспечивает правильное формирование нуклеосом. Получение пucleosomal массивы с желаемым уровнем гистон октамера насыщения матричной ДНК требует малого масштаба испытаний reconstitutions с последующим крупномасштабной препаративной восстановления. Соответствующие условия, определяемые мелкомасштабных reconstitutions используются для руководства препаративной воссоздания.
- Очищают тандемно повтор ющиес позиционированием нуклеосом ДНК, как описано 4,12. Вкратце, изолировать ДНК плазмиды, используя набор Qiagen GigaPrep или аналогичный продукт. Настройка ограничение фермент переварить, чтобы освободить шаблона ДНК и переварить ДНК плазмиды в меньших размерах (≤ 700bp). Матричной ДНК может быть затем очищен от мелких остатков плазмиды ДНК с использованием эксклюзионной хроматографии (SEC). Гравитация колонки подается, с высоты около 115 см, заполненных Sephacryl S-1000 шариков достаточно для очистки 601 207bp х 12mer ДНК.
Примечания: Для очистки плазмидной ДНК при пониженной стоимости, но повышенной эфОРТ, можно использовать щелочную лизис с фенолом / хлороформом очистки ДНК для того, чтобы изолировать ДНК плазмиды из Е. палочка 23,24. Стратегии разделения шаблона ДНК из плазмидной ДНК может изменяться при изменении шаблона размера ДНК. Для SEC важно настроить ограничение фермент переваривания в моде, чтобы обеспечить максимальную разницу в размерах между шаблоном и ДНК плазмиды.
- Определите, какие молярные соотношения (г) использовать для reconstitutions. Г равно отношение молей октамера к молей повтор ДНК. Для начальных мелкомасштабных испытаний, г значения 0,9, 1 и 1,1 подходят, если целью является получить насыщенные нуклеосомной массивы.
- Подготовьте мелкомасштабных образцов, вычисляя количество октамера добавление примерно 18 мкг ДНК для каждого молярном соотношении к тестированию. Смешайте ДНК и гистонов октамеры. Конечная концентрация NaCl в образце должна быть ≥ 2 м, а конечная концентрация DН.А. должна быть около 0,3 мкг / мкл. Окончательные условия буфере для образцов также должны включать 10 мМ Трис рН 7,8, и 1 мМ ЭДТА.
- Образцы теперь готовы для диализа. Загрузите образцы в 12k-14k MWCO диализа. Диализировать образцы против 2 л буфера уменьшения ионной силы следующим образом.
Компоненты всех буферов: 10 мМ Трис рН 7,8, 1 мМ ЭДТА. Буфер 1 (добавить 1 М NaCl, 1 мМ DTT) в течение 5-6 часов. Буфер 2 (добавить 0,75 М NaCl, 1 мМ DTT) в течение ночи. Буфер 3 (добавить 2,5 мМ NaCl, 1 мМ DTT) в течение 5-6 часов. Буфер 4 (добавить 2,5 мМ NaCl, 0,1 мМ PMSF) в течение ночи.
- Удалите образцы из диализной трубки и перейти к разделам 4-6. Если мелкомасштабные образцы дали желаемых результатов, повторите действия, описанные в разделах 3-6 на больших масштабах.
Примечание: В целях экономии ресурсов, мелкомасштабные образцы должны иметь минимальный объем, необходимый хватать для последующих скрининга. Для того чтобы иметь еnough образец для экспериментов скорости седиментации и АСМ, перечисленных здесь, 50 мкл образцов в дозе 0,3 мг / мл ДНК могут быть применены. Размер больших масштабах, подготовительные образцы зависят от их предполагаемого использования. Крупномасштабное образец должен быть приготовлен таким же образом, как и мелкомасштабных образцов.
4. Седиментация Velocity Analysis восстановленного нуклеосомной массивов
Обоснование: эксперименты скорости седиментации в аналитической информации текучести ультрацентрифуга Beckman Xl-A / I на размер и форму молекул в растворе. Эксперименты, проведенные скорости осаждения в условиях низкой соли используются для определения, в какой степени восстановленные массивы насыщенный нуклеосом.
- Разбавить образец к оптической плотности примерно 0,5 при 260 нм с использованием TEN буфера (10 мМ Трис рН 7,8, 1 мМ ЭДТА, 2,5 мМ NaCl). Загрузить 400 мкл образца в камеру с центральным два сектора, с образцом, с одной стороны, и Референтнаясе (TEN буфер), с другой 25. Сохранить ссылку мениск выше, чем образца мениска (т.е. добавить 420 эталонного мкл решение).
- Загрузить клеток в ротор, и выровнять клетки должным образом с помощью хэш-меток на дне клетки и ротором 25. Аккуратно пыль объективы клеток с использованием сжатого воздуха.
- Включите центрифуги XL-A/XL-I, вставить ротор, и приложить и зафиксировать оптику, как описано в руководстве. Откройте программу Протеом Lab и выберите файл: новое.
- Настройте один проход сканирования при 3000 оборотах в минуту и температуре 25 ° С. В разделе Параметры выберите остановка после последней проверки, и запустить радиальная калибровки (радиальная калибровка не требуется, если ротор был последним ротора используется в AUC).
- Для каждой ячейки, назвать образцы, выберите длину волны (260 нм), выберите абсорбцию, и выберите файл сохранения местоположение на компьютере. Начните один проход сканирования.
- Используйте одно сканирование, чтобы определить соответствующий ранабрать длину сканирования (рис. 2а). Уменьшение длины клетки, предназначенного для сканирования уменьшает время выполнения. Тем не менее, не забудьте включить образец мениск и продлить конец очень близко к месту или в нижней части клетки.
Примечание: Холост сканирование позволит область измерения быть сокращен, начиная измерений непосредственно перед образца мениска (рис. 2А). Большинство сканирований, созданных во время AUC перспективе должны иметь граничные фракции прошлые мениска, а также стабильного плато (рис. 2В). Грязные линзы на AUC клеток может генерировать сканирование с большими шипами, они могут повлиять на анализ данных. Программное обеспечение UltraScan включает в себя руководство, которое является большой ресурс для получения информации о анализа аналитических данных ультрацентрифугирования 26.
- С помощью панели управления XL-A/XL-I введите скорость 0 и нажать старт. Это подскажет центрифуги камеру тянуть вакуума и всевл температура в камере для уравновешивания. Подождите 1 час, чтобы позволить уравновешивания температуры перед началом перспективе.
- Используйте программное обеспечение для установки преддверии для желаемой скорости и числа сканирований. Более высокие скорости увеличить разрешение, но следует собирать по крайней мере 20 сканирования (желательно больше) до того, как образец осаждали на дно электролизера. Это удобно для наложения последние несколько сканов (для этого необходимо в меню настроек) в целях мониторинга за ходом пробега и проверки на наличие потенциальных проблем, таких как утечки клеток. Следить за первые пару сканирований для обеспечения правильной работы.
5. Редактирование и анализ седиментации Velocity данных
Обоснование: данные скорости сырье осаждения должны быть проанализированы с помощью программы, которая дает диффузионного коррекцией распределение коэффициента оседания. Эта информация, в свою очередь указывает на долю восстановленного образца, который содержит определенный уровень насыщения, например при использовании шаблона ДНК 12-мерный можно будет определить долю восстановленных массивов, которые имеет 10, 11 и 12 нуклеосом / ДНК.
- Использование программного обеспечения для анализа данных AUC таких как UltraScan редактировать данные 26. Редактирование данных сканирования должно быть сделано для каждой ячейки и создает набор данных для последующего анализа. Правильное редактирование сканирования включает в себя определение образцов мениска, уменьшая данные в области, представляющей интерес, и определение базовой линии, а также участки плато (рис. 2). Нежелательные сканирования также могут быть удалены из установленных в этой точке данных. Однако, поскольку можно удалить нежелательные сканирования во время анализа, рекомендуется, чтобы все сканирует храниться в этой точке.
- Мы настоятельно рекомендуем, что повышенная ван метод Holde-Weischet быть использованы для анализа данных 27. Этот метод анализа корректирует эффектов диффузии более ходе перспективе и дает интегральное распределение коэффициентами седиментации. В частности, Повышенная ван метод Holde-Weischet (как это реализовано в UltraScan) позволит за включение сканирования в которых отсутствует стабильные плато, или которые содержат граничные фракции, которые не очистили мениск в анализе 28.
- Определить распределение коэффициентов седиментации для собравшихся массивов. Представитель результаты 601-12 (207bp, 12-мер) нуклеосомных массивов показано на рисунке 3.
- Если один из мелкомасштабных образцов содержит массивы с желаемым диапазоном коэффициентов седиментации, затем повторите процесс в увеличенном масштабе, начиная с разделом 3. Если ни один из мелкомасштабных образцов не имеет правильное распределение коэффициентами седиментации затем повторите небольшой промышленные испытания с новым г диапазоне, начиная с разделом 3.
6. Визуализация нуклеосомной массивов при помощи атомно-силовой микроскопии (АСМ)
Обоснование: АСМ позволяет визуализация уровня насыщения nucleosomaл массивы. Этот метод дополняет скорость оседания по AUC и рестриктазой как контроля качества анализа.
- Используя методы, описанные выше, также получить насыщенный массив нуклеосом (фиг.5А).
- Подготовка APTES лечение слюды слайдов, помещая ~ 30 мкл 1:1000 разбавление коммерческой (Sigma-Aldrich (3-аминопропил) триэтоксисилана A3648-100 мл) в 0,22 мкм фильтрованной воды NanoPure течение 30 мин.
- Через 30 мин промыть APTES с фильтрованной водой и осторожно высушить их в потоке азота.
- Поместите соответствующим образом разбавленного образца нуклеосом массива (~ 1,5 нг / мкл) на слайде, и инкубировать покрыты при комнатной температуре в течение 15 мин.
- Промыть образец с фильтрованной буфера для образца, сухой, как и прежде, и место слайд на сцене АСМ (в данном случае Asylum Research МФУ-3D атомно-силового микроскопа).
- Начните с визуализации 2 х 2 мкм сканирования с 512 строк развертки. Подсчитайте количество нуклеосом выяснить уровень саturation (фиг. 5В).
- В идеале вы должны изображений области на слайде с хорошо разделенными массивов нуклеосомных.
- Для изображений с большим разрешением, нм сканирования 500 х 500 можно получить (рис. 5, в).
- Изображения могут быть плоские и проанализированы с помощью MFP-3D программное обеспечение, предоставленное убежище.
- Каждое изображение можно разделить на четыре квадранта и увеличено цифровой получить более четкое представление о хорошо разделенных массивов и нескольких свободной рукой линии могут быть проведены по массивам и профилей по высоте получаются для нуклеосом (рис. 5С, правая панель-высота следовых и 5D).
- Несколько таких изображения должны быть проанализированы для каждого типа массива, охватывающей несколько сотен нуклеосом. Профили Высота записываются, категории и приведены на MS Excel.
Результаты
Для иллюстрации протокол мы восстанавливали нуклеосомной массивы из рекомбинантных Xenopus стержневых гистонов и ДНК, состоящих из 12 тандеме 207 б.п. повторы последовательности 601 позиционирования (601 207 х 12). Мы впервые собрался родные октамеры из лиофилизированных стержневых гистонов, а затем очистили октамеры на FPLC с использованием колонки S200 (рис. 1А). Большие комплексы элюироваться ранее из колонки S200. Гистоны правило элюирования в следующем порядке: неспецифические гистонов агрегаты, гистонов октамер, H3/H4 тетрамером и H2A/H2B Димер (рис. 1А). Пики из колонки S200 анализировали с помощью SDS-PAGE. Гели очищенных фракций октамера следует указать эквимолярных количеств четырех гистоновых белков (рис. 1b). Следует отметить, что Xenopus H2A и H2B имеют молекулярные массы, которые отличаются лишь около 200 дальтон и, следовательно, они появляются в виде одной полосы на SDS геле. H3/H4 тетрамерами и H2A/H2B димеры будет элюирования после, но веру близка к пику гистонов октамера. При выборе, какие фракции держать это разумно, чтобы отменить фракции, появляющиеся в конце пика октамера на хроматограмме. Эти фракции могут иметь повышенное количество не-октамерных гистонов комплексов. В этом случае фракции 64-67 объединяли и сохранены для нуклеосомной массива восстановления (рис. 1).
В UltraScan есть два различных способа просмотра диффузии коррекцией распределение коэффициентами седиментации, которая получена от усиливается ван Holde-Weischet анализа. Красная линия представляет собой интегральное распределение коэффициентами седиментации. Для любой заданной точки на графике, ось у обозначает долю образца, который имеет коэффициент седиментации, равную или меньшую, чем сумма, указанного на оси абсцисс. Таким образом, вертикальная линия указывает однородной образца, в то время как гетерогенный образец будет иметь кривую с положительным наклоном. Зеленая линия является депроизводная от интеграла распределения. Площадь под пиком пропорциональна фракции образца, который имеет что коэффициент седиментации. Полностью насыщенные 601 207 х 12 нуклеосомной массивы имеют коэффициент седиментации 29S 29. Для образца, показанного на фиг.3, данные показывают, что примерно 70% из массивов насыщены и 30% в течение насыщенным.
Атомно-силовая микроскопия превратилась из развивающегося техники к популярной дополнительной подхода к изучению организации хроматина в пробирке. Здесь мы использовали АСМ наряду аналитического ультрацентрифугирования установить степень насыщения шаблона после восстановления. На фиг.6 большинство ~ 27S массивы (фиг.4А), используемого для формирования изображения, содержащиеся 10-11 нуклеосомы (фиг.4В), демонстрируя отличную соглашение между АСМ и AUC результатов. Результаты АСМ полученные здесь, таким образом, подтвердить этоподойти и сделать его надежным методом для характеристики нуклеосомной массивы.
| Белка-гистона | Σ276, развернутые белки см -1 М -1 | Молекулярный вес Da |
| H2A | 4350 | 13960 |
| H2B | 7250 | 13774 |
| H3 | 4640 | 15273 |
| H4 | 5800 | 11236 |
| Октамера | 44080 | 108486 |
Таблица 1. Коэффициенты поглощения и молекулярные массы Xenopus Laevis стержневых гистонов и ренатурировали гистонового октамера.
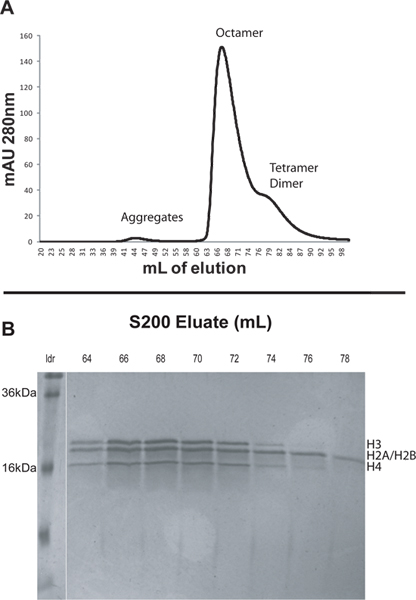
Рисунок 1. А. Элюция профиль из колонки S200, как описано в разделе 2. Небольшой пик около 44 мл связано с большими гистонов агрегатов. Известный пик при 67 мл является гистонов октамеры. Широкое плечо от 76-90 мл содержит H3/H4 тетрамеров и H2A/H2B димеры. Б. 20% SDS-странице отдельных фракций из колонки S200. Ранние фракции из пике октамера должны быть собраны, как они, в наименьшей степени быть загрязнены не-октамерных гистонов комплексов. В этом случае фракции 64-67 объединяли и сохранены для нуклеосомной восстановления массива. Нажмите здесь, чтобы увеличить рисунок .

Рисунок 2. А. ProteomeLab захвата экрана программного обеспечения одного сканирования, собранной в 3000 оборотов в минуту (с Л.бел добавлен). Обратите внимание, что образец не осадок при этой низкой скорости. Сингл сканирования используется для установки диапазона измерений для проверки AUC клеток (шаг 4.6). Захвата Б. экрана из серии сканирований скорости осаждения полученного с помощью программы UltraScan (с этикетками добавленных) 26. Эта серия сканирований редактируется для создания набора данных для анализа (см. шаг 5.1).
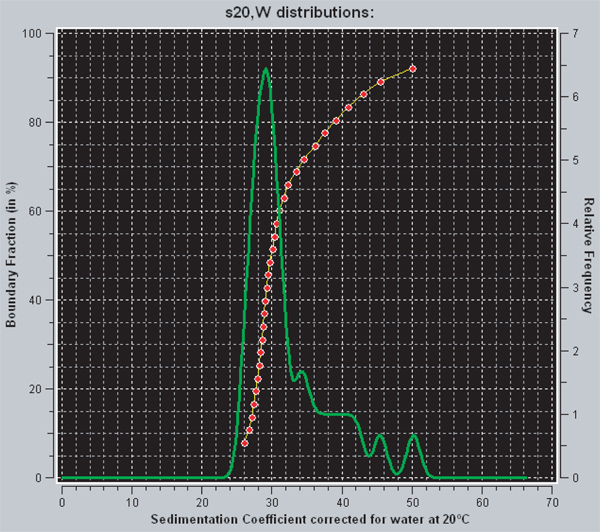
Рисунок 3. Захвата экрана от UltraScanII. Красные и зеленые линии два различных метода для просмотра распределение коэффициентами седиментации в UltraScan. Красная линия является неотъемлемой распределение коэффициентами седиментации, в то время как зеленый является производной. Дополнительная информация по интерпретации можно найти в разделе результатов.
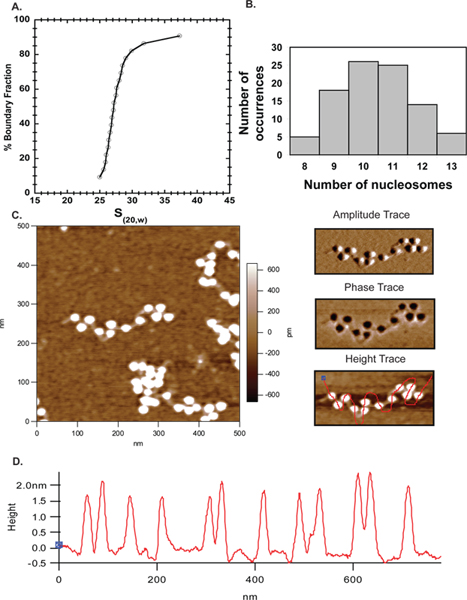
Рисунок 4. АСМ. Профиль скорости A. Осаждение на 601 207 х 12, соединенных с массивами мыши октамера, указывающих на средний коэффициент седиментации 27S. B. Те же массивы в были обследованы с помощью АСМ, а количество подсчитанных нуклеосом в нескольких изображений были нанесены в MS Excel. Сюжет показали, что большинство массивов было 10-11 нуклеосом подтверждающие АУК данные. С. 500 х 500 нм сканирования 601 207 х 12 нуклеосомных массивов с линкерной ДНК четко видны. В правом верхнем углу панели амплитуда след и середина правой панели является фаза трассировки для массива, показанного на C. Нижняя правая панель такая же высота след показано на рисунке слева, но со свободной стороны линией, проходящей через нуклеосом определения профиля по высоте нуклеосомес. D. Высота профили нуклеосом в картинке продемонстрировать, что все нуклеосомы варьируются в пределах 1,5-2,5 высоты нм, как сообщалось ранее 40.
Обсуждение
Модель массивы нуклеосомной являются очень полезным инструментом для изучения в пробирке структуры хроматина и функции. Например, они широко используются для изучения механизма образования конденсата хроматина волокна в растворе 30-34, и позволило получить структуру рентгеновского из tetranucleosome 35. Совсем недавно они доказали свою полезность в расшифровке структурных последствий вариантов конкретных ядро гистонов, мутантов и посттрансляционных модификаций 14-16,36. Здесь мы опишем общий метод сборки модели нуклеосомных массивов из нуклеосом ДНК позиционирования и рекомбинантных стержневых гистонов.
Восстановление нуклеосомных массивов из очищенных октамеры и 601 207 х 12 ДНК является простым, с участием нескольких шагов диализа, что последовательно снижать концентрацию NaCl от 2 М до 2,5 мм. Самая трудная часть протокола является использование R-Value, который дает нужный ПЭМуровень насыщения пластины. Соответствующий R-значение первого определяют эмпирически в небольшом масштабе, а затем повторяется в более крупном масштабе, чтобы генерировать нуклеосомной массивы, используемые для экспериментов. В нашем случае, мы пытались получить 601 207 х 12 шаблонов ДНК в основном насыщенные с 12 нуклеосом на ДНК. Коэффициент осаждение полностью насыщенным 601 207 х 12 нуклеосомной массива составляет 29 S, в то время как тот же шаблон ДНК только с 11 нуклеосом в отложениях ДНК в ~ 27S 29. Таким образом, скорость седиментации в аналитической ультрацентрифуге обеспечивает очень чувствительный метод определения уровня насыщения нуклеосом после восстановления. Мы проанализировали наши данные с помощью усиливается ван метод Holde-Weischet, что дает диффузии коррекцией распределения коэффициент оседания. Эта информация необходима, потому что он говорит одно, как гомогенный или гетерогенный образец после восстановления. Другими словами, для шаблона 601 207 х 12 ДНК, этообозначает долю образца, который имеет 12 нуклеосом на ДНК, 11 нуклеосом на ДНК и т.д. Рисунок 3 показывает результаты расширенной ван Holde-Weischet анализ 601 207 х 12 нуклеосомных массивов восстановленных на г 1,1, в которой примерно 30% массивов над насыщенным. Полезность образца, как правило, связаны с процентом насыщенных массивов, но зависит от экспериментов массивы будут использованы дюйма некоторых приложений может потребоваться очень однородные и / или насыщенные массивов. Существует ряд методов существуют для улучшения однородности и насыщенность нуклеосомных массивов.
В этом случае пересыщенного массивы могут быть удалены селективным осаждением при добавлении MgCl 2 37. Более однородные массивы могут быть также получены путем очистки примера с использованием сахарозы, центрифугирование в градиенте препаративного гель-электрофореза и ионообменной хроматографии 10,13. Модифицированная нюcleosomal метод массива восстановление требует добавления короткий конкурента ДНК с образцами перед восстановления через соли диализа 38,39. Это позволяет собрать нуклеосомной массивы с избытком гистона октамера без насыщения над матричной ДНК. Нуклеосомной массивы разведен с использованием конкурента ДНК, вероятно, потребует стадию очистки для удаления конкурента ДНК и дополнительных гистонов.
Даже после собраний небольшие пилотные массива, вполне возможно, что нуклеосомной массивы восстановленные в больших масштабах не будут должным образом насыщенным. Для того чтобы не тратить матричной ДНК и гистонов октамер в образце, можно исправить над или под насыщенных массивов. Если массивы являются более насыщенный, дополнительные ДНК могут быть добавлены к пробе. Если массивы находятся под насыщенным, дополнительная октамер могут быть добавлены, чтобы исправить ее. Однако добавление октамер к массивам уже диализу в низким содержанием соли может привести октамер диссоциации. При добавлении дополнительных Octamer или ДНК к массивам, диализировать массивы обратно в 2 М NaCl, прежде чем добавлять дополнительную октамер или ДНК в объемном образце. Повторите шаг диализ для фиксированных образцов от высокой к низкой соли, как в шаге 3.4. Количество октамера добавить, чтобы исправить массивы можно оценить из коэффициентами седиментации для под насыщенных массивов 29. После регулировки образец нуклеосомных массивов, измерения уровня насыщения следует еще раз.
Хотя АСМ является мощным методом для характеристики нуклеосомной массивы, это сложный и трудоемкий процесс. Это делает его плохая техника для скрининга мелким reconstitutions, но отличной техникой для характеристики крупномасштабных образцов и для изучения организации хроматина. Ранее мы использовали АСМ визуализировать частицы «макро», порожденные удаления конструкции macroH2A, который был до даже низкие концентрации MgCl2 "гипер-реагировать". Likewiсебе, Монтель и др.. (2009) показали, что H2A Bbd вариант вызывает массивы нуклеосом быть более "открытым" по сравнению с дикими массивов типа. Таким образом, АСМ является надежным методом для контроля качества, а также для исследования структуры хроматина волокна в целом.
Раскрытие информации
Авторы не имеют конфликта интересов.
Благодарности
Эта работа была поддержана NIH гранты GM45916 и GM66834 к JCH и общения с Международной Ретта синдром Фонда AK Эта работа также была поддержана NIH грант GM088409 и Медицинского института Говарда Хьюза вклад в KL
Материалы
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Sigma-Aldrich | A3648-100ML | |
| 6-8 kDa MWCO Dialysis Tubing | Fisher | 21-152-5 | |
| HiLoad Superdex 200 16/60 Column | GE | 17-1069-01 | |
| Vivaspin 50 kDa MWCO Centrifugal Concentrator | Sartorius | VS2031 | |
| 12-14 kDa MWCO Dialysis Tubing | Fisher | 08-667A | |
| Illustra Sephacryl S-1000 Superfine | GE | 17-0476-01 | |
| XL-A/I Analytical Ultracentrifuge | Beckman-Coulter |
Ссылки
- Luger, K., Mader, A., Richmond, R., Crystal Sargent, D. structure of the nucleosome core particle at 2.8 A resolution. Nature. 7, (1997).
- Hansen, J. C. Conformational dynamics of the chromatin fiber in solution: determinants, mechanisms, and functions. Annual Review of Biophysics and Biomolecular Structure. 31, 361-392 (2002).
- McBryant, S., Adams, V., Hansen, J. Chromatin architectural proteins. Chromosome Research. 14 (1), 39-51 (2006).
- Hansen, J. C., Ausio, J., Stanik, V. H., van Holde, K. E. Homogeneous reconstituted oligonucleosomes, evidence for salt-dependent folding in the absence of histone H1. Biochemistry. 28 (23), 9129-9136 (1989).
- Szerlong, H. J., Prenni, J. E., Nyborg, J. K., Hansen, J. C. Activator-dependent p300 acetylation of chromatin in vitro: enhancement of transcription by disruption of repressive nucleosome-nucleosome interactions. The Journal of Biological Chemistry. 285 (42), 31954-31964 (2010).
- Cirillo, L. A., Lin, F. R., Cuesta, I., Friedman, D., Jarnik, M., Zaret, K. S. Opening of compacted chromatin by early developmental transcription factors HNF3 (FoxA) and GATA-4. Molecular Cell. 9 (2), 279-289 (2002).
- Nguyen, C., Gonzales, F. chromatin structure associated with methylation-induced gene silencing in cancer cells: correlation of accessibility, methylation, MeCP2 binding and acetylation. Nucleic Acids Research. 29 (22), 4598-4606 (2001).
- Cuesta, I., Zaret, K. S., Santisteban, P. The forkhead factor FoxE1 binds to the thyroperoxidase promoter during thyroid cell differentiation and modifies compacted chromatin structure. Molecular and Cellular Biology. 27 (20), 7302-7314 (2007).
- Simpson, R. T., Stafford, D. W. Structural features of a phased nucleosome core particle. Proceedings of the National Academy of Sciences of the U S A. 80 (1), 51-55 (1983).
- Lowary, P. T., Widom, J. New DNA sequence rules for high affinity binding to histone octamer and sequence-directed nucleosome positioning. Journal of Molecular Biology. 276 (1), 19-42 (1998).
- Lowary, P., Widlund, H., Cao, H. Sequence motifs and free energies of selected natural and non-natural nucleosome positioning DNA sequences. Journal of Molecular Biology. 288, 213-229 (1999).
- Gordon, F., Luger, K., Hansen, J. C. The Core Histone N-terminal Tail Domains Function Independently and Additively during Salt-dependent Oligomerization of Nucleosomal Arrays *. The Journal of Biological Chemistry. 280 (40), 33701-33706 (2005).
- Luger, K., Rechsteiner, T. J., Richmond, T. J. Expression and purification of recombinant histones and nucleosome reconstitution. Methods in Molecular Biology (Clifton, N.J.). 119 (4), 1-16 (1999).
- McBryant, S. J., Klonoski, J., et al. Determinants of histone H4 N-terminal domain function during nucleosomal array oligomerization: roles of amino acid sequence, domain length, and charge density. The Journal of Biological Chemistry. 284 (25), 16716-16722 (2009).
- Ma Shogren-Knaak, ., Fry, C. J., Peterson, C. L. A native peptide ligation strategy for deciphering nucleosomal histone modifications. The Journal of Biological Chemistry. 278 (18), 15744-158 (2003).
- Lu, X., Simon, M. The effect of H3K79 dimethylation and H4K20 trimethylation on nucleosome and chromatin structure. Nat Struct Mol Biol. 15 (10), 1122-1124 (2008).
- Ausio, J. Analytical Ultracentrifugation for the Analysis of Chromatin Structure. Biophysical Chemistry. 86 (2-3), 141-153 (2000).
- Hansen, J., Kreider, J., Demeler, B., Fletcher, T. Analytical ultracentrifugation and agarose gel electrophoresis as tools for studying chromatin folding in solution. Methods. 12 (1), 62-72 (1997).
- Montel, F., Menoni, H., et al. The dynamics of individual nucleosomes controls the chromatin condensation pathway: direct atomic force microscopy visualization of variant chromatin. Biophysical Journal. 97 (2), 544-5453 (2009).
- Muthurajan, U. M., McBryant, S. J., Lu, X., Hansen, J. C., Luger, K. The linker region of macroH2A promotes self-association of nucleosomal arrays. The Journal of Biological Chemistry. 286 (27), 23852-23864 (2011).
- Shlyakhtenko, L. S., Lushnikov, A. Y., Lyubchenko, Y. L. Dynamics of nucleosomes revealed by time-lapse atomic force microscopy. Biochemistry. 48 (33), 7842-7848 (2009).
- Lohr, D., Bash, R., Wang, H., Yodh, J., Lindsay, S. Using atomic force microscopy to study chromatin structure and nucleosome remodeling. Methods (San Diego, Calif). 41 (3), 333-341 (2007).
- Dyer, P. N., Edayathumangalam, R. S., et al. Reconstitution of nucleosome core particles from recombinant histones and DNA. Methods in Enzymology. 375, 23-44 (2004).
- Sambrook, J., Russell, D. . Molecular cloning: a laboratory manual. , (2001).
- Balbo, A., Zhao, H., Brown, P. H., Schuck, P. Assembly, loading, and alignment of an analytical ultracentrifuge sample cell. J. Vis. Exp. (33), e1530 (2009).
- Demeler, B. UltraScan: a comprehensive data analysis software package for analytical ultracentrifugation experiments. Modern Analytical Ultracentrifugation: Techniques. , 210-230 (2005).
- Holde, K. V., Weischet, W. Boundary analysis of sedimentation velocity experiments with monodisperse and paucidisperse solutes. Biopolymers. 17 (6), 1387-1403 (1978).
- Demeler, B., van Holde, K. E. Sedimentation velocity analysis of highly heterogeneous systems. Analytical Biochemistry. 335, 279-288 (2004).
- Hansen, J., Lohr, D. Assembly and structural properties of subsaturated chromatin arrays. Journal of Biological Chemistry. 8, 5840-5848 (1993).
- Routh, A., Sandin, S., Rhodes, D. Nucleosome repeat length and linker histone stoichiometry determine chromatin fiber structure. Proceedings of the National Academy of Sciences of the U S A. 105 (26), 8872-8877 (2008).
- Zhou, J., Fan, J. Y., Rangasamy, D., Tremethick, D. J. The nucleosome surface regulates chromatin compaction and couples it with transcriptional repression. Nature Structural & Molecular Biology. 14 (11), 1070-1076 (2007).
- Dorigo, B., Schalch, T., Kulangara, A., Duda, S., Schroeder, R. R., Richmond, T. J. Nucleosome arrays reveal the two-start organization of the chromatin fiber. Science (New York, N.Y.). 306 (5701), 1571-1573 (2004).
- Correll, S. J., Schubert, M. H., Grigoryev, S. a Short nucleosome repeats impose rotational modulations on chromatin fibre folding. The EMBO Journal. 31 (10), 2416-2426 (2012).
- Mcbryant, S. J., Krause, C., Woodcock, C. L., Hansen, J. C. The Silent Information Regulator 3 Protein , SIR3p , Binds to Chromatin Fibers and Assembles a Hypercondensed Chromatin Architecture in the Presence of Salt. Molecular and Cellular Biology. 28 (11), 3563-3572 (2008).
- Schalch, T., Duda, S., Sargent, D. F., Richmond, T. J. X-ray structure of a tetranucleosome and its implications for the chromatin fibre. Nature. 436 (7047), 138-1341 (2005).
- Fan, J. Y., Gordon, F., Luger, K., Hansen, J. C., Tremethick, D. J. The essential histone variant H2A.Z regulates the equilibrium between different chromatin conformational states. Nature Structural Biology. 9 (3), 172-176 (2002).
- Carruthers, L. M., Bednar, J., Woodcock, C. L., Hansen, J. C. Linker histones stabilize the intrinsic salt-dependent folding of nucleosomal arrays: mechanistic ramifications for higher-order chromatin folding. Biochemistry. 37 (42), 14776-14787 (1998).
- Huynh, V. A. T., Robinson, P. J. J., Rhodes, D. A Method for the In Vitro Reconstitution of a Defined "30 nm" Chromatin Fibre Containing Stoichiometric Amounts of the Linker Histone. Journal of Molecular Biology. 345 (5), 957-968 (2005).
- Dorigo, B., Schalch, T. Chromatin fiber folding: requirement for the histone H4 N-terminal tail. J. Mol. Biol. 2836 (03), 85-96 (2003).
- Qian, R. L., Liu, Z. X., et al. Visualization of chromatin folding patterns in chicken erythrocytes by atomic force microscopy (AFM. Cell Research. 7 (2), 143-150 (1997).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены