Method Article
Asamblea de Nucleosomal Arrays de recombinantes Core histonas y el ADN posicionamiento de nucleosomas
En este artículo
Resumen
Se presenta un método para la reconstitución del modelo nucleosomal arrays de histonas y el ADN recombinante posicionamiento de nucleosomas en tándem repetido. También describe cómo se utilizan los experimentos de velocidad de sedimentación en la ultracentrífuga analítica y microscopía de fuerza atómica (AFM) para supervisar el grado de saturación de gama nucleosomal después de la reconstitución.
Resumen
Octamers histonas centrales que son repetidamente espaciados a lo largo de una molécula de ADN se denominan matrices nucleosomal. Nucleosomal arrays se obtienen en una de dos maneras: la purificación a partir de fuentes in vivo, o la reconstitución in vitro de histonas del núcleo recombinantes y de ADN posicionamiento nucleosoma repetidas en tándem. El último método tiene la ventaja de permitir para el montaje de un uniforme más de composición y matriz nucleosomal posicionado con precisión. Experimentos de velocidad de sedimentación en la información de rendimiento ultracentrífuga analítica sobre el tamaño y la forma de las macromoléculas mediante el análisis de la tasa a la que migran a través de la solución bajo la fuerza centrífuga. Esta técnica, junto con microscopía de fuerza atómica, se puede utilizar para el control de calidad, garantizando que la mayoría de las plantillas de ADN están saturados con nucleosomas después de la reconstitución. Aquí se describen los protocolos necesarios para reconstituir cantidades de miligramos de longitud y compositivamente dnucleosomal arrays efined adecuados para los estudios bioquímicos y biofísicos de la estructura y función de la cromatina.
Introducción
Genomas eucariotas no existen como ADN desnudo, sino que más bien se compactan y organizados por proteínas unidas. Estos complejos de ADN y de proteínas se conocen como cromatina. La unidad de repetición básica de la cromatina es el nucleosoma. Un nucleosoma consta de octámero de histonas y 146 pares de bases de ADN enrollado alrededor del octámero de histonas alrededor de 1,6 veces 1. El octámero de histona se compone de dos copias de cada uno de la H2A histonas del núcleo, H2B, H3, y H4. Octamers histonas centrales que son repetidamente espaciados a lo largo de una molécula de ADN se denominan matrices nucleosomal. La estructura extendida de matrices nucleosomal se ha referido como la fibra de 10 nm o las "cuentas en una cadena" estructura y está presente in vitro bajo condiciones de poca sal 2. La fibra de 10 nm es capaz de condensar en estructuras de orden superior a través de la compactación dentro de la matriz y / o inter-array oligomerización 2. Estas estructuras de orden superior pueden ser inducidas en presencia de sales,o puede ser influenciada a través de la unión de las proteínas de arquitectura de la cromatina a la matriz nucleosomal 3,4. Los niveles de compactación de la cromatina se correlacionan inversamente con la tasa de transcripción en 5,6 vivo. La investigación reciente pone de relieve la importancia de la organización estructural de los genomas en procesos tales como la diferenciación, el desarrollo del cáncer, y otros 7,8. El uso de matrices nucleosomal para estudiar la estructura y función de la cromatina se ha generalizado. Aquí se describe un método para el montaje de matrices nucleosomal de histonas y el ADN recombinante posicionamiento de nucleosomas.
El uso de ADN recombinante con repeticiones en tándem de secuencias de posicionamiento de nucleosomas permite la reconstitución de matrices que contienen nucleosomas regularmente espaciados. Dos de las secuencias de posicionamiento más populares son la secuencia del gen 5S rRNA y el "601" secuencia de 9,10. La secuencia 601 se deriva a partir de experimentos de SELEX y More posiciona fuertemente nucleosomas que la secuencia 5S 11. En consecuencia, la longitud del ADN enlazador de las matrices 601 es más homogénea. El posicionamiento de nucleosomas ADN repetidas en tándem se obtiene por filtración en gel 4,12. Histonas recombinantes se purificaron a partir de E. coli en condiciones de desnaturalización 13. El uso de las histonas recombinantes permite controlar cuidadosamente la composición de la histona de las matrices nucleosomal. Por ejemplo, el núcleo de histonas teniendo mutaciones específicas 14 o las modificaciones posteriores a la traducción 15,16 puede ser sustituido por histonas de tipo salvaje.
Experimentos de velocidad de sedimentación supervisar la tasa de sedimentación de las macromoléculas en solución bajo una fuerza centrífuga aplicada 17. Esto produce información sobre el tamaño y la forma de las macromoléculas en una muestra. Experimentos de velocidad de sedimentación son, pues, un instrumento adecuado para el estudio de los cambios de estado de soluciones en fibra de cromatinaestructura debido a la condensación de la cromatina 18. Es importante destacar que, en primer lugar es necesario el uso de experimentos de velocidad de sedimentación como un paso de control de calidad en la reconstitución matriz nucleosomal. Si el ADN y nucleosomas no se combinan en la proporción molar adecuado, las formaciones pueden ser sub o sobre-saturado de histonas. Por lo tanto, la información obtenida a partir de experimentos de velocidad de sedimentación se utiliza para asegurar que el ADN está saturado correctamente con nucleosomas. Es importante utilizar métodos alternativos para estimar la saturación de ADN con nucleosomas, especialmente si se trabaja con una plantilla de ADN no caracterizado previamente. Por lo tanto, también se describe un método para el análisis de matrices nucleosomal utilizando microscopía de fuerza atómica (AFM). AFM es una técnica poderosa que permite la visualización de los efectos de una serie de parámetros, tales como el nivel de saturación, efecto de la presencia de variantes de histonas o los efectos de MgCl 2 19,20. AFM también ha sido aplied para estudiar la dinámica de nucleosomas utilizando imágenes de lapso de tiempo 21. In vitro reunidos nucleosomal arrays 12-mer son particularmente susceptibles a los estudios de AFM porque pertenecen en el rango de tamaño adecuado para imágenes de AFM 22. En el presente estudio hemos utilizado AFM de matrices nucleosomal como control de calidad, así como un medio de afirmación de los datos de AUC ("ver para creer"). Además de la visualización sencilla, AFM permite la medición de perfiles de altura de muestras como una métrica adicional.
Protocolo
1. Asamblea de recombinantes Core histonas en octamers
Justificación: El primer paso para la reconstitución array nucleosomal es preparar octamers histonas nativas de histonas recombinantes liofilizadas. Las proteínas histonas se combinan en cantidades molares iguales y se montan en octámeros histonas dializando las muestras de un tampón desnaturalizante en tampón de replegamiento.
- Purificar y liofilizar histonas del núcleo recombinantes (H2A, H2B, H3, H4) como se describe 13.
- Disolver aproximadamente 5 mg de cada núcleo de histonas liofilizado en 3 ml de tampón de desarrollo (6 M de guanidina HCl, 20 mM de Tris pH 7,5, DTT 5 mM). Permitir que cada alícuota para disolver durante al menos una hora. Asegúrese de que ninguna proteína permanece en los lados del recipiente.
- Medir la absorbancia de cada histona a 276 nm usando tampón de desplegamiento como una referencia.
- Calcular la molaridad de cada histona utilizando sus coeficientes de extinción (Ver Tabla 1 para Xenopus coeficientes de extinción de histonas). Comparar la concentración de absorbancia determinado de la histona al peso seco liofilizado, y estimación de si se disuelve la mayor parte de la proteína.
- Determine qué histona usted tiene los topos menor cantidad de, ya que este será el número limitante de moles de todos los histonas.
- Combinar las histonas en cantidades molares iguales y se diluye con tampón de desarrollo a una concentración final de 1 mg / ml.
- Colocar la muestra en un tubo de diálisis de 6-8 kDa MWCO. Sellar el tubo y colocar en 2 L de tampón de replegamiento frío (NaCl 2 M, Tris 10 mM pH 7,5, EDTA 1 mM, 5 mM β-mercaptoetanol).
- Se dializa la muestra durante 18 horas a 4 ° C con agitación. Asegúrese de que el tubo de diálisis puede girar libremente y vigorosamente, o bien las histonas puede precipitar.
- Cambiar el tampón de diálisis dos veces en el período de 18 horas (es decir, cambiar el tampón de replegamiento sobre cada 6 horas hasta que esté hecho). Incluso si se forma precipitado no descartanla muestra, algunos octámero se puede recuperar aunque el rendimiento se reducirá.
Nota: Consulte el paso 2.1-2.2 para preparar equilibrado de la columna para el día siguiente.
2. Purificación de histonas octamers por tamaño Cromatografía de exclusión
Justificación: Después de concluir con la sección 1, las muestras contendrán octamers histonas, así como otros complejos de histonas como agregados, tetrámeros H3/H4 y dímeros H2A/H2B. Octámeros histonas se pueden purificar lejos de estos otros complejos usando cromatografía de exclusión de tamaño (SEC).
- Conecte un HiLoad 16/60 Superdex200 16/60 (S200) la columna a un sistema de FPLC. Asegúrese de que las burbujas de aire no entran en el sistema.
- Limpie la columna de la S200 con 0,2 m de agua filtrada. Utilice una velocidad de flujo de 0,3 ml / min y establecer un límite de contrapresión de 0,5 MPa. Asegúrese de que tiene suficiente agua y permitir que la columna de limpiar toda la noche.
- Equilibrar la columna y de muestreo del lazo S200 de la FPLC mediante tampón de replegamiento. Utilice 1 L de 0,2 micras tampón de replegamiento filtrada. Flujo tampón de replegamiento a través de la columna a una velocidad de 1 ml / min y una presión máxima de 0,5 MPa durante aproximadamente 2 h.
- Equilibrar un concentrador centrífugo Vivaspin (50 kDa MWCO) con 1 ml de tampón de replegamiento. Sacar la prueba del tubo de diálisis y centrifugar la muestra a 4 ° C para eliminar cualquier precipitado. Pipetear el sobrenadante de la muestra en el concentrador. Concentrar la muestra hasta un volumen de aproximadamente 500 l.
- Retire la muestra octámero concentrada a un nuevo contenedor y enjuague el concentrador con 1 ml tampón de replegamiento. Se concentra el enjuague hasta 500 l, y agregarlo a la muestra octámero. Esto ayuda a salvar cualquier octámero restante en el concentrador.
- Haga girar la muestra en un tubo de microcentrífuga de 1,5 ml durante 5 minutos a 10.000 rpm a 4 ° C. Se recoge el sobrenadante y transferir a un tubo nuevo. Esto ayuda a eliminar cualquier precipitado antes de cargar la muestra en el FPLC.
- Cargue la muestra en la columna de la S200. Cargue un máximo de 1,5 ml de volumen total o 15 mg octámero en una sola purificación.
- Se eluye la muestra utilizando tampón de replegamiento recién hecho. Utilice una velocidad de flujo de 1 ml / min y un límite de presión de vuelta de 0,5 MPa. Utilice dos volúmenes de columna (400 ml) tampón de replegamiento y recoger fracciones de 2 ml. Supervisar la absorbancia a 280 nm durante la elución. Las diferentes especies se eluir en orden decreciente de tamaño. Agregados histonas generalmente eluyen a aproximadamente 45 ml, octamer en alrededor de 65 ml, y de dímero en alrededor de 84 ml (Figura 1).
- Analizar las fracciones de elución de los picos de interés mediante la ejecución de las muestras en un 18-20% de SDS-PAGE. Las fracciones que contienen octamers purificadas deben tener cantidades molares iguales de las cuatro proteínas histonas (Figura 1).
- Reunir las fracciones que contienen octámeros purificados, y concentrar a ≤ 15 mg / ml con un filtro centrífugo Vivaspin. Si diluida izquierda, octamers pueden disociar idímeros y tetrámeros nto H2A/H2B H3/H4.
- Determinar la concentración de octámero por la medición de la absorbancia a 280 nm y calcular utilizando el coeficiente de extinción de la Tabla 1.
- Octamers histonas pueden mantenerse a corto plazo en el tampón de replegamiento a 4 ° C. Si está almacenado a largo plazo, los octámeros serán más estables a -20 ° C y en una solución de glicerol al 50%. Octamers almacenados en glicerol deben dializaron en tampón de replegamiento fresco antes de las mediciones de absorbancia y uso en reconstrucciones de matriz nucleosomales.
3. Reconstitución de nucleosomal matrices de ADN y se purificó octamers
Justificación: La reconstitución de nucleosomal arrays requiere que octamers histonas y ADN molde se combinan en proporciones molares específicos. Las mezclas de ADN y las histonas octámeros en NaCl 2 M son paso dializaron en tampones de fuerza iónica decreciente. Un cambio gradual a la sal inferior asegura la formación de nucleosomas adecuada. La obtención de nmatrices ucleosomal con el nivel deseado de saturación de octámero de histona del ADN molde requiere pequeñas reconstituciones de prueba a escala seguido de una reconstitución preparativa a gran escala. Las condiciones apropiadas definidas por las reconstituciones pequeña escala se utilizan para guiar la reconstitución preparativa.
- Se purifica ADN de posicionamiento nucleosoma repetidas en tándem como se describe 4,12. Brevemente, aislar el ADN plásmido usando un kit de Qiagen GigaPrep o un producto similar. Establecer un enzima de restricción digerir con el fin de liberar el ADN plantilla y digerir el ADN plásmido a tamaños más pequeños (≤ 700 pb). La plantilla de ADN puede entonces ser purificado lejos de los pequeños restos de ADN plásmido utilizando cromatografía de exclusión de tamaño (SEC). Una columna por gravedad, con una altura de unos 115 cm llenas de perlas Sephacryl S-1000 es suficiente para la purificación de 601 x 207bp DNA 12mer.
Notas: Para la purificación de ADN plásmido a un costo disminuyó, pero aumentó efORT, uno puede utilizar lisis alcalina con la purificación de ADN con fenol / cloroformo con el fin de aislar el ADN plásmido a partir de E. coli 23,24. Estrategias para la separación de la plantilla de ADN de plásmido de ADN puede variar con cambios en la plantilla de tamaño de ADN. Para la SEC, es importante establecer la enzima de restricción digerir de una manera que maximiza la diferencia de tamaño entre la plantilla y el ADN plásmido.
- Determinar qué relaciones molares (r) a utilizar para la reconstitución. R es igual a la relación de moles de octámero a moles de repetición de ADN. Para los ensayos iniciales a pequeña escala, los valores de r de 0,9, 1 y 1,1 son apropiados si la intención es obtener matrices nucleosomal saturados.
- Preparar las muestras a pequeña escala mediante el cálculo de la cantidad de octámero añadir a aproximadamente 18 mg de ADN para cada relación molar a probar. Mezclar el ADN y las histonas octamers. La concentración final de NaCl en la muestra debe ser ≥ 2 M, y la concentración final de DNA debe estar alrededor de 0,3 mg / l. Las condiciones de tampón de muestra finales también deben incluir 10 mM de Tris pH 7,8, y EDTA 1 mM.
- Las muestras están ahora listas para la diálisis. Cargar las muestras en tubos de diálisis 12k-14k MWCO. Dializar las muestras contra 2 l de tampón de fuerza iónica decreciente de la siguiente manera.
Componentes en todos los búferes: 10 mM de Tris pH 7,8, EDTA 1 mM. Buffer 1 (añadir NaCl 1 M, DTT 1 mM) durante 5-6 horas. Buffer 2 (añadir NaCl 0,75 M, DTT 1 mM) durante la noche. Buffer 3 (añadir NaCl 2,5 mM, DTT 1 mM) durante 5-6 horas. Buffer 4 (añadir NaCl 2,5 mM, 0,1 mM PMSF) durante la noche.
- Retirar las muestras de los tubos de diálisis y proceder a secciones de 4-6. Si las muestras a pequeña escala producen los resultados deseados, repetir los pasos de las secciones 3-6 en la gran escala.
Nota: Con el fin de conservar los recursos, las muestras a pequeña escala deben tener el volumen mínimo necesario para ser suficiente para ensayos de selección de aguas abajo. Con el fin de tener correonough muestra para los experimentos de velocidad de sedimentación y AFM enumerados aquí, 50 l de muestras de ADN en 0.3 mg / ml son apropiados. El tamaño de gran escala, muestras preparativas dependen de su uso previsto. Una muestra a gran escala se debe preparar de la misma manera que las muestras a pequeña escala.
4. Análisis de la velocidad de sedimentación de reconstituido nucleosomal arrays
Justificación: Sedimentación experimentos de velocidad en la información de rendimiento ultracentrífuga analítica Beckman XL-A / I sobre el tamaño y la forma de las moléculas en solución. Experimentos de velocidad de sedimentación realizados en condiciones de baja sal se utilizan para determinar el grado en que las matrices reconstituidas se saturan con nucleosomas.
- Diluir la muestra a una absorbancia alrededor de 0,5 a 260 nm usando tampón TEN (Tris 10 mM pH 7,8, EDTA 1 mM, NaCl 2,5 mM). Carga de 400 l de muestra en una cubeta con una pieza central de dos sectores, con la muestra en un lado y la refeCe (tampón TEN) en el otro 25. Mantenga el menisco de referencia más altos que el menisco de la muestra (es decir, añadir la solución de referencia l 420).
- Cargar las células en el rotor, y alinear las células adecuadamente utilizando las marcas de hash en la parte inferior de las células y el rotor 25. El polvo con cuidado las lentes de las células por medio de aire comprimido.
- Encienda la centrífuga XL-A/XL-I, inserte el rotor, y fije y asegure la óptica como se describe en el manual. Abra el software proteoma Lab y seleccione el archivo: nuevo.
- Configurar una sola corrida de exploración en 3000 rpm y una temperatura de 25 ° C. En Opciones, seleccione la parada después de la última exploración, y la calibración de desviación radial (radial calibración no es necesaria si el rotor fue el último rotor utilizado en el AUC).
- Para cada celda, el nombre de las muestras, seleccione una longitud de onda (260 nm), seleccione absorbancia, y elija una ubicación para guardar el archivo en su computadora. Comience la única prueba de exploración.
- Utilice el ciclo individual para determinar el ra apropiadamarcar la longitud de análisis (Figura 2A). La disminución de la longitud de la célula que se digitalizará disminuye el tiempo de ejecución. Sin embargo, asegúrese de incluir el menisco de la muestra y se extienden al final muy cerca de, o en la parte inferior de la celda.
Nota: los análisis individuales permiten que el área de medición para ser acortado por mediciones comenzando justo antes de que el menisco de la muestra (Figura 2A). La mayoría de las exploraciones generadas durante la ejecución de la AUC debe tener fracciones de límites últimos del menisco, así como mesetas estable (Figura 2B). Lentes sucias en las células de las AUC pueden generar imágenes escaneadas con grandes picos, estos pueden afectar el análisis de los datos. El software UltraScan incluye un manual que es un gran recurso para obtener información sobre el análisis de los datos de ultracentrifugación analítica 26.
- Uso del panel de control XL-A/XL-I, introduzca una velocidad de 0 y pulse Iniciar. Esto hará que la cámara de centrífuga para tirar de un vacío y todoOW la temperatura de la cámara se equilibre. Espere 1 hora para permitir el equilibrio de temperatura antes de empezar a correr.
- Utilice el software para establecer el plazo para la velocidad y el número de análisis deseado. Las velocidades más altas aumentan la resolución, pero uno debe recoger al menos 20 exploraciones (preferiblemente más) antes de que la muestra ha sedimentado a la parte inferior de la celda. Es conveniente superponer las últimas exploraciones realizadas (en el menú de opciones) con el fin de monitorear el progreso de la carrera y ver si hay problemas potenciales, tales como las células con fugas. Monitorear el primer par de scans para garantizar un funcionamiento correcto.
5. Edición y análisis de datos de la velocidad de sedimentación
Justificación: datos de la velocidad de sedimentación Raw deben ser analizados por un programa que produce una distribución coeficiente de sedimentación de difusión corregido. Esta información, a su vez indica la fracción de una muestra reconstituida que contiene un nivel de saturación dada, por ejemplo, si el uso de una plantilla de ADN de 12-mer que será posible determinar la fracción de matrices reconstituidas que tiene 10, 11 y 12 nucleosomas / ADN.
- Utilice AUC software de análisis de datos, tales como UltraScan para editar los datos 26. Edición de los datos de exploración se debe hacer para cada celda y se crea un conjunto de datos para su posterior análisis. Edición adecuada de exploraciones implica la definición de los meniscos de la muestra, la reducción de los datos a una región de interés, y la definición de la línea de base, así como regiones de meseta (Figura 2). Análisis no deseados también se pueden eliminar de los datos que figuran en este punto. Sin embargo, ya que es posible eliminar las exploraciones no deseados durante el análisis, se recomienda que todos los análisis se mantendrán en este punto.
- Es muy recomendable que la furgoneta método Holde-Weischer mejorada puede utilizar para analizar los datos de 27. Este método de análisis corrige los efectos de la difusión en el transcurso de la carrera y se obtiene la distribución integral de los coeficientes de sedimentación. En particular, El método Holde-Weischer mejorado van (como se aplica en UltraScan) permitirá la inclusión de las exploraciones que carecen de mesetas estables, o que contienen fracciones de límites que no se han debitado el menisco en el análisis 28.
- Determinar la distribución de los coeficientes de sedimentación para las matrices de ensamblados. Los resultados representativos para 601-12 (207bp, 12-mer) nucleosomal arrays se muestran en la Figura 3.
- Si una de las muestras a pequeña escala contiene matrices con el rango deseado de coeficientes de sedimentación, a continuación, repita el proceso en mayor escala a partir de la sección 3. Entonces, si ninguna de las muestras a pequeña escala tiene una distribución adecuada de los coeficientes de sedimentación repetir las pruebas a pequeña escala con una nueva gama r a partir de la sección 3.
6. Visualizar Nucleosomal matrices mediante Microscopía de Fuerza Atómica (AFM)
Justificación: AFM permite la visualización del nivel de saturación del nucleosomal matrices. Esta técnica complementa la velocidad de sedimentación por el AUC y la digestión con enzimas de restricción como un ensayo de control de calidad.
- Usando métodos descritos anteriormente, obtener una matriz de nucleosoma bien saturado (Figura 5A).
- Preparar APTES tratados diapositivas de mica mediante la colocación de ~ 30 l de dilución 1:1.000 de comercial (Sigma-Aldrich (3-aminopropil) trietoxisilano A3648-100 ml) en 0,22 micras agua filtrada nanopura durante 30 min.
- Después de 30 min enjuagar los APTES con agua filtrada y secar suavemente en un flujo de nitrógeno.
- Coloque la muestra matriz nucleosoma apropiadamente diluido (~ 1,5 ng / l) en la diapositiva, e incubar cubierto a temperatura ambiente durante 15 min.
- Enjuagar la muestra con tampón de muestra filtrada, seca como antes, y el lugar de diapositivas en la etapa de la AFM (en este caso una investigación MFP-3D Microscopio de Fuerza Atómica de asilo).
- Comience por imágenes de 2 x 2 m exploraciones con 512 líneas de exploración. Cuente el número de nucleosomas para determinar el nivel de saturación (Figura 5B).
- Lo ideal es que las áreas de imagen en la diapositiva con matrices de nucleosomas bien separados.
- Para las imágenes de mayor resolución, una exploración de 500 x 500 nm se puede obtener (Figura 5C).
- Las imágenes pueden ser aplanadas y analizados utilizando el software de la impresora multifunción en 3D proporcionado por el Asilo.
- Cada imagen puede ser dividida en cuatro cuadrantes y el zoom digital para obtener una visión más clara de las matrices bien separados y múltiples líneas de mano libre se pueden extraer a través de las matrices y perfiles de altura se obtienen de los nucleosomas (Figura 5C, la derecha del panel de altura traza y 5D).
- Varias de estas imágenes deben ser analizados para cada tipo de matriz que abarca varios cientos de nucleosomas. Perfiles de altura se registran, clasifican y se representan gráficamente en MS Excel.
Resultados
Para ilustrar el protocolo que reconstituido nucleosomal arrays de histonas del núcleo de Xenopus recombinantes y ADN que consiste en 12 repeticiones tándem de 207 pb de la secuencia 601 de posicionamiento (601 207 x 12). En primer lugar, reunido octámeros nativos de histonas del núcleo liofilizadas y después se purificó los octámeros mediante FPLC utilizando una columna S200 (Figura 1A). Complejos más grandes eluyen antes de la columna de la S200. Las histonas se eluyen generalmente en este orden: los agregados de las histonas no específicos, octámero de histona, H3/H4 tetrámero, y H2A/H2B dímero (Figura 1A). Los picos de la columna de la S200 se analizaron por SDS-PAGE. Los geles de fracciones purificadas octamer deben indicar cantidades equimolares de las cuatro proteínas histonas (Figura 1B). Tenga en cuenta que Xenopus H2A y H2B tienen pesos moleculares que difieren en sólo aproximadamente 200 Da y por lo tanto, que aparecen como una única banda en geles de SDS. Tetrámeros H3/H4 y dímeros H2A/H2B eluirán después, pero very cerca del pico octámero de histonas. Al seleccionar qué fracciones de mantener es prudente descartar fracciones que aparecen hacia el final del pico octámero en el cromatograma. Estas fracciones pueden tener una mayor cantidad de complejos de histonas no octaméricas. En este caso las fracciones 64-67 se reunieron y se guarda para nucleosomal array reconstitución (Figura 1).
Dentro UltraScan hay dos maneras diferentes de ver la distribución de la difusión-corregida de coeficientes de sedimentación que se obtiene a partir de la mejora van análisis Holde-Weischer. La línea roja representa la distribución integral de coeficientes de sedimentación. Para cualquier punto dado en el gráfico, el eje y indica la fracción de la muestra que tiene un coeficiente de sedimentación igual a o menor que el valor indicado en el eje x. Por lo tanto, una línea vertical es indicativa de una muestra homogénea, mientras que una muestra heterogénea tendrá una curva con pendiente positiva. La línea verde es la deinstrumento derivado de la distribución integral. El área bajo un pico es proporcional a la fracción de la muestra que tiene que coeficiente de sedimentación. Totalmente saturado 601 207 x 12 nucleosomal arrays tienen un coeficiente de sedimentación de 29S 29. Para el ejemplo que se muestra en la Figura 3, los datos indican que aproximadamente el 70% de las matrices están saturados y 30% son mayores saturado.
Microscopía de fuerza atómica ha pasado de ser una técnica emergente para un enfoque complementario popular para estudiar la organización de la cromatina in vitro. Aquí hemos utilizado AFM junto de ultracentrifugación analítica para establecer el grado de saturación de la plantilla después de la reconstitución. En la Figura 6 la mayoría de la ~ 27S matrices (Figura 4A) utiliza para la imagen contenía 10-11 nucleosomas (Figura 4B), demostrando una excelente concordancia entre el AFM y resultados AUC. Los resultados obtenidos aquí AFM así validar estaacercarse y que sea una técnica fiable para la caracterización de las matrices nucleosomal.
| Histona Proteínas | Σ276, proteínas desplegadas cm -1 M -1 | Peso molecular Da |
| H2A | 4350 | 13960 |
| H2B | 7250 | 13774 |
| H3 | 4640 | 15273 |
| H4 | 5800 | 11236 |
| Octamer | 44080 | 108486 |
Tabla 1. Los coeficientes de extinción y los pesos moleculares de Xenopus laevis histonas y renaturalizado octámero de histonas.
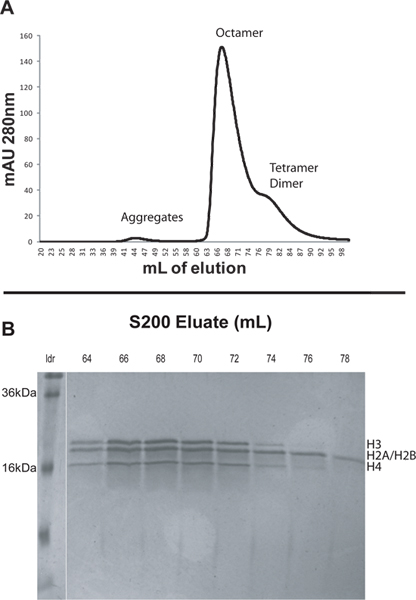
Figura 1. Perfil A. La elución de la columna de la S200 como se describe en la sección 2. El pequeño pico en alrededor de 44 ml se debe a los grandes agregados de las histonas. El pico más prominente en 67 ml es el octamers histonas. El ancho hombro 76-90 ml contiene los tetrámeros H3/H4 y H2A/H2B dímeros. B. 20% SDS-PAGE de las fracciones seleccionadas de la columna de la S200. Las primeras fracciones del pico octámero se deben recoger, ya que son menos propensos a estar contaminados por los complejos de histonas no octaméricas. En este caso las fracciones 64-67 se reunieron y se guarda para la reconstitución array nucleosomal. Haga clic aquí para ver más grande la figura .

Figura 2. A. ProteomeLab captura de pantalla del software de una sola exploración recogidos a 3.000 rpm (con labels añadido). Tenga en cuenta que la muestra no hace sedimentos a esta baja velocidad. El ciclo individual se utiliza para establecer el rango de mediciones para la exploración de células AUC (paso 4.6). Captura de B. Pantalla de una serie de exploraciones de la velocidad de sedimentación obtenido utilizando el programa UltraScan (con etiquetas de agregados) 26. Se edita Esta serie de análisis para generar un conjunto de datos para el análisis (véase el paso 5.1).
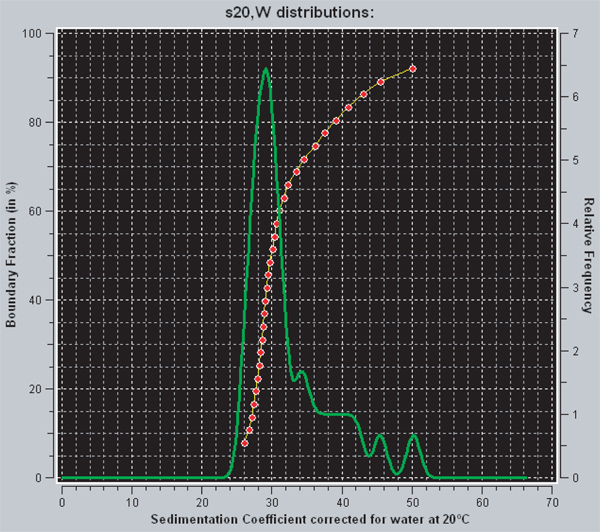
Figura 3. Una captura de pantalla de UltraScanII. Las líneas rojas y verdes son dos métodos diferentes para la visualización de la distribución de los coeficientes de sedimentación en UltraScan. La línea roja es la distribución integral de coeficientes de sedimentación, mientras que el verde es el derivado. Mas información en la interpretación puede encontrarse en la sección de resultados.
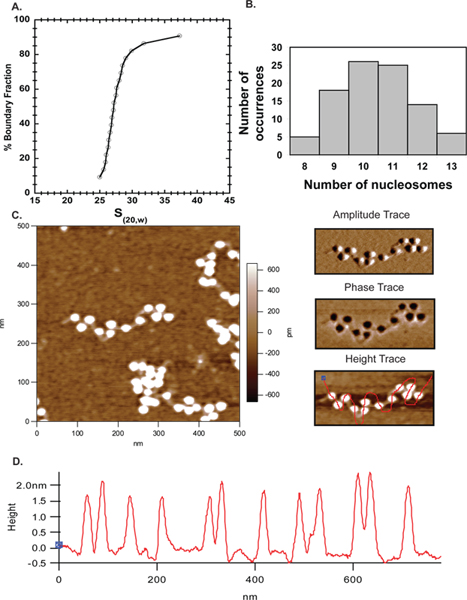
Figura 4. AFM. Perfil de la velocidad de sedimentación de 601 A. 207 x 12 conjuntos ensamblados con octámero ratón indican el promedio de coeficiente de sedimentación es 27S. B. Las mismas matrices en A fueron imágenes por AFM y se trazan el número de nucleosomas contados en varias imágenes en MS Excel. La trama se indica que la mayoría de las matrices tenía 10-11 nucleosomas que corroboran los datos de AUC. C. Un 500 x 500 nm de exploración 601 207 x 12 matrices de nucleosomas con el ADN enlazador claramente visible. El panel superior derecho es la huella de amplitud y el panel central derecha es la curva de fase para la matriz se muestra en la C. El panel de abajo a la derecha es la misma huella de altura muestra a la izquierda, pero con una línea de mano libre que pasa por los nucleosomas para determinar el perfil de altura del nucleosomas. D. perfiles de altura de los nucleosomas en la imagen de arriba demuestran que todos los nucleosomas se extienden dentro de 1.5 a 2.5 nm de altura como se informó anteriormente 40.
Discusión
Nucleosomal arrays modelo son una herramienta muy útil para el estudio in vitro de la estructura y función de la cromatina. Por ejemplo, han sido ampliamente usado para estudiar el mecanismo de la fibra de cromatina de condensación en solución 30-34, y hecho posible la obtención de una estructura de rayos x de un Tetranucleosome 35. Más recientemente han demostrado ser útiles en el desciframiento de los efectos estructurales de las variantes de las histonas núcleo específico, mutantes y modificaciones postraduccionales 14-16,36. Aquí se describe un método general para el conjunto de matrices nucleosomal modelo de ADN posicionamiento de nucleosomas y histonas recombinantes.
La reconstitución de nucleosomal arrays de octámeros purificada y 601 x 207 12 ADN es sencilla, que implica varias etapas de diálisis que secuencialmente reducen la concentración de NaCl de 2 M a 2,5 mM. La parte más difícil del protocolo es usar un valor r que produce la temperatura deseadanivel de saturación de la placa. El valor r correspondiente se determinará empíricamente primero a pequeña escala y luego se repitió en mayor escala para generar las matrices nucleosomal utilizados para experimentos. En nuestro caso, estábamos tratando de obtener 601 207 x 12 plantillas de ADN sobre todo saturadas con 12 nucleosomas por ADN. El coeficiente de sedimentación de una saturación completa 601 207 x 12 matriz nucleosomal es de 29 S, mientras que la misma plantilla de ADN con sólo 11 nucleosomas por sedimentos de ADN a ~ 27S 29. Por lo tanto, la velocidad de sedimentación en la ultracentrífuga analítica proporciona un método muy sensible para la determinación del nivel de saturación nucleosoma después de la reconstitución. Se analizaron los datos utilizando el método Holde-Weischer mejorado furgoneta, que produce una distribución coeficiente de sedimentación de difusión corregido. Esta información es esencial porque le dice a uno cómo homogénea o heterogénea que la muestra es después de la reconstitución. En otras palabras, para una plantilla de 601 x 207 12 ADN, seindica la fracción de la muestra que tiene 12 nucleosomas por ADN, 11 nucleosomas por ADN, etc Figura 3 muestra los resultados de la furgoneta mejorada análisis Holde-Weischer de 601 207 x 12 matrices nucleosomal reconstituidas en un R de 1,1, en el que más o menos 30% de las matrices están sobre saturado. La utilidad de la muestra está usualmente ligado a el porcentaje de matrices saturados, sino que depende de los experimentos de las matrices se utilizan in Algunas aplicaciones pueden requerir matrices muy homogéneas y / o saturados. Un número de métodos existen para mejorar la homogeneidad y la saturación de matrices nucleosomal.
En este caso las matrices sobresaturados pueden ser removidos por precipitación selectiva después de la adición de MgCl 2 37. Más matrices homogéneas también se pueden obtener mediante la purificación de la muestra usando centrifugación en gradiente de sacarosa, electroforesis en gel preparativa, y cromatografía de intercambio iónico 10,13. A nu modificadométodo de arreglos de reconstitución cleosomal requiere la adición de ADN competidor corto a las muestras antes de la reconstitución mediante diálisis sal 38,39. Esto le permite a uno para ensamblar los grupos nucleosomal con un exceso de octámero de histona sin más de la saturación de la plantilla de ADN. Matrices nucleosomal reconstituirse utilizando ADN competidor es probable que requiera una etapa de purificación para la eliminación del ADN competidor y las histonas adicionales.
Incluso después de las asambleas de matriz piloto a pequeña escala, es posible que las matrices nucleosomal reconstituidas a gran escala no se verán correctamente saturados. Con el fin de evitar el desperdicio de la plantilla de ADN y octámero de histona en la muestra, es posible fijar sobre o debajo de las matrices saturados. Si las matrices son más de saturada, ADN adicional se puede agregar a la muestra. Si las matrices están bajo saturado, octámero extra puede ser añadido para corregirlo. Sin embargo, la adición de octámero a matrices ya dializados en baja en sal puede resultar octámero disociación. Si agrega o adicionalctamer o ADN a las matrices, se dializan las matrices de nuevo en NaCl 2 M antes de añadir octámero o ADN extra para la muestra global. Repita etapa de diálisis para muestras fijas de alta a baja en sal como en el paso 3.4. La cantidad de octámero para añadir con el fin de corregir las matrices puede estimarse a partir de los coeficientes de sedimentación por menos de matrices saturados 29. Después de ajustar la muestra de matrices nucleosomal, mediciones de nivel de saturación se deben hacer una vez más.
Mientras AFM es un poderoso método para la caracterización de las matrices nucleosomal, es complicado y un proceso de trabajo intensivo. Esto hace que sea una mala técnica para el cribado de pequeñas reconstituciones escala, pero una técnica excelente para la caracterización de muestras a gran escala y para el estudio de la organización de la cromatina. Anteriormente hemos utilizado AFM para visualizar partículas "macro" generados por una construcción de deleción macroH2A que era incluso a concentraciones de MgCl2 bajos "hiper-sensible". LikewiSE, Montel et al. (2009) han demostrado que la variante H2A Bbd hace que las matrices de nucleosomas a ser más "abierto" en comparación con las matrices de tipo salvaje. Por lo tanto, AFM es una técnica fiable para el control de calidad, así como para el estudio de la estructura de la fibra de la cromatina en general.
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado por el NIH subvenciones GM45916 y GM66834 a JCH, y una beca de la Fundación Internacional del Síndrome de Rett a AK Este trabajo también fue apoyado por el NIH subvención GM088409 y el Instituto Médico Howard Hughes contribuciones a KL
Materiales
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Sigma-Aldrich | A3648-100ML | |
| 6-8 kDa MWCO Dialysis Tubing | Fisher | 21-152-5 | |
| HiLoad Superdex 200 16/60 Column | GE | 17-1069-01 | |
| Vivaspin 50 kDa MWCO Centrifugal Concentrator | Sartorius | VS2031 | |
| 12-14 kDa MWCO Dialysis Tubing | Fisher | 08-667A | |
| Illustra Sephacryl S-1000 Superfine | GE | 17-0476-01 | |
| XL-A/I Analytical Ultracentrifuge | Beckman-Coulter |
Referencias
- Luger, K., Mader, A., Richmond, R., Crystal Sargent, D. structure of the nucleosome core particle at 2.8 A resolution. Nature. 7, (1997).
- Hansen, J. C. Conformational dynamics of the chromatin fiber in solution: determinants, mechanisms, and functions. Annual Review of Biophysics and Biomolecular Structure. 31, 361-392 (2002).
- McBryant, S., Adams, V., Hansen, J. Chromatin architectural proteins. Chromosome Research. 14 (1), 39-51 (2006).
- Hansen, J. C., Ausio, J., Stanik, V. H., van Holde, K. E. Homogeneous reconstituted oligonucleosomes, evidence for salt-dependent folding in the absence of histone H1. Biochemistry. 28 (23), 9129-9136 (1989).
- Szerlong, H. J., Prenni, J. E., Nyborg, J. K., Hansen, J. C. Activator-dependent p300 acetylation of chromatin in vitro: enhancement of transcription by disruption of repressive nucleosome-nucleosome interactions. The Journal of Biological Chemistry. 285 (42), 31954-31964 (2010).
- Cirillo, L. A., Lin, F. R., Cuesta, I., Friedman, D., Jarnik, M., Zaret, K. S. Opening of compacted chromatin by early developmental transcription factors HNF3 (FoxA) and GATA-4. Molecular Cell. 9 (2), 279-289 (2002).
- Nguyen, C., Gonzales, F. chromatin structure associated with methylation-induced gene silencing in cancer cells: correlation of accessibility, methylation, MeCP2 binding and acetylation. Nucleic Acids Research. 29 (22), 4598-4606 (2001).
- Cuesta, I., Zaret, K. S., Santisteban, P. The forkhead factor FoxE1 binds to the thyroperoxidase promoter during thyroid cell differentiation and modifies compacted chromatin structure. Molecular and Cellular Biology. 27 (20), 7302-7314 (2007).
- Simpson, R. T., Stafford, D. W. Structural features of a phased nucleosome core particle. Proceedings of the National Academy of Sciences of the U S A. 80 (1), 51-55 (1983).
- Lowary, P. T., Widom, J. New DNA sequence rules for high affinity binding to histone octamer and sequence-directed nucleosome positioning. Journal of Molecular Biology. 276 (1), 19-42 (1998).
- Lowary, P., Widlund, H., Cao, H. Sequence motifs and free energies of selected natural and non-natural nucleosome positioning DNA sequences. Journal of Molecular Biology. 288, 213-229 (1999).
- Gordon, F., Luger, K., Hansen, J. C. The Core Histone N-terminal Tail Domains Function Independently and Additively during Salt-dependent Oligomerization of Nucleosomal Arrays *. The Journal of Biological Chemistry. 280 (40), 33701-33706 (2005).
- Luger, K., Rechsteiner, T. J., Richmond, T. J. Expression and purification of recombinant histones and nucleosome reconstitution. Methods in Molecular Biology (Clifton, N.J.). 119 (4), 1-16 (1999).
- McBryant, S. J., Klonoski, J., et al. Determinants of histone H4 N-terminal domain function during nucleosomal array oligomerization: roles of amino acid sequence, domain length, and charge density. The Journal of Biological Chemistry. 284 (25), 16716-16722 (2009).
- Ma Shogren-Knaak, ., Fry, C. J., Peterson, C. L. A native peptide ligation strategy for deciphering nucleosomal histone modifications. The Journal of Biological Chemistry. 278 (18), 15744-158 (2003).
- Lu, X., Simon, M. The effect of H3K79 dimethylation and H4K20 trimethylation on nucleosome and chromatin structure. Nat Struct Mol Biol. 15 (10), 1122-1124 (2008).
- Ausio, J. Analytical Ultracentrifugation for the Analysis of Chromatin Structure. Biophysical Chemistry. 86 (2-3), 141-153 (2000).
- Hansen, J., Kreider, J., Demeler, B., Fletcher, T. Analytical ultracentrifugation and agarose gel electrophoresis as tools for studying chromatin folding in solution. Methods. 12 (1), 62-72 (1997).
- Montel, F., Menoni, H., et al. The dynamics of individual nucleosomes controls the chromatin condensation pathway: direct atomic force microscopy visualization of variant chromatin. Biophysical Journal. 97 (2), 544-5453 (2009).
- Muthurajan, U. M., McBryant, S. J., Lu, X., Hansen, J. C., Luger, K. The linker region of macroH2A promotes self-association of nucleosomal arrays. The Journal of Biological Chemistry. 286 (27), 23852-23864 (2011).
- Shlyakhtenko, L. S., Lushnikov, A. Y., Lyubchenko, Y. L. Dynamics of nucleosomes revealed by time-lapse atomic force microscopy. Biochemistry. 48 (33), 7842-7848 (2009).
- Lohr, D., Bash, R., Wang, H., Yodh, J., Lindsay, S. Using atomic force microscopy to study chromatin structure and nucleosome remodeling. Methods (San Diego, Calif). 41 (3), 333-341 (2007).
- Dyer, P. N., Edayathumangalam, R. S., et al. Reconstitution of nucleosome core particles from recombinant histones and DNA. Methods in Enzymology. 375, 23-44 (2004).
- Sambrook, J., Russell, D. . Molecular cloning: a laboratory manual. , (2001).
- Balbo, A., Zhao, H., Brown, P. H., Schuck, P. Assembly, loading, and alignment of an analytical ultracentrifuge sample cell. J. Vis. Exp. (33), e1530 (2009).
- Demeler, B. UltraScan: a comprehensive data analysis software package for analytical ultracentrifugation experiments. Modern Analytical Ultracentrifugation: Techniques. , 210-230 (2005).
- Holde, K. V., Weischet, W. Boundary analysis of sedimentation velocity experiments with monodisperse and paucidisperse solutes. Biopolymers. 17 (6), 1387-1403 (1978).
- Demeler, B., van Holde, K. E. Sedimentation velocity analysis of highly heterogeneous systems. Analytical Biochemistry. 335, 279-288 (2004).
- Hansen, J., Lohr, D. Assembly and structural properties of subsaturated chromatin arrays. Journal of Biological Chemistry. 8, 5840-5848 (1993).
- Routh, A., Sandin, S., Rhodes, D. Nucleosome repeat length and linker histone stoichiometry determine chromatin fiber structure. Proceedings of the National Academy of Sciences of the U S A. 105 (26), 8872-8877 (2008).
- Zhou, J., Fan, J. Y., Rangasamy, D., Tremethick, D. J. The nucleosome surface regulates chromatin compaction and couples it with transcriptional repression. Nature Structural & Molecular Biology. 14 (11), 1070-1076 (2007).
- Dorigo, B., Schalch, T., Kulangara, A., Duda, S., Schroeder, R. R., Richmond, T. J. Nucleosome arrays reveal the two-start organization of the chromatin fiber. Science (New York, N.Y.). 306 (5701), 1571-1573 (2004).
- Correll, S. J., Schubert, M. H., Grigoryev, S. a Short nucleosome repeats impose rotational modulations on chromatin fibre folding. The EMBO Journal. 31 (10), 2416-2426 (2012).
- Mcbryant, S. J., Krause, C., Woodcock, C. L., Hansen, J. C. The Silent Information Regulator 3 Protein , SIR3p , Binds to Chromatin Fibers and Assembles a Hypercondensed Chromatin Architecture in the Presence of Salt. Molecular and Cellular Biology. 28 (11), 3563-3572 (2008).
- Schalch, T., Duda, S., Sargent, D. F., Richmond, T. J. X-ray structure of a tetranucleosome and its implications for the chromatin fibre. Nature. 436 (7047), 138-1341 (2005).
- Fan, J. Y., Gordon, F., Luger, K., Hansen, J. C., Tremethick, D. J. The essential histone variant H2A.Z regulates the equilibrium between different chromatin conformational states. Nature Structural Biology. 9 (3), 172-176 (2002).
- Carruthers, L. M., Bednar, J., Woodcock, C. L., Hansen, J. C. Linker histones stabilize the intrinsic salt-dependent folding of nucleosomal arrays: mechanistic ramifications for higher-order chromatin folding. Biochemistry. 37 (42), 14776-14787 (1998).
- Huynh, V. A. T., Robinson, P. J. J., Rhodes, D. A Method for the In Vitro Reconstitution of a Defined "30 nm" Chromatin Fibre Containing Stoichiometric Amounts of the Linker Histone. Journal of Molecular Biology. 345 (5), 957-968 (2005).
- Dorigo, B., Schalch, T. Chromatin fiber folding: requirement for the histone H4 N-terminal tail. J. Mol. Biol. 2836 (03), 85-96 (2003).
- Qian, R. L., Liu, Z. X., et al. Visualization of chromatin folding patterns in chicken erythrocytes by atomic force microscopy (AFM. Cell Research. 7 (2), 143-150 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados