Method Article
Hücre Döngüsü FRET oranlı metrik sayesinde Kinaz ve Fosfataz Aktiviteleri İzleme
Bu Makalede
Özet
FRET tabanlı gazetecilere giderek canlı hücre kinaz ve fosfataz aktiviteleri izlemek için kullanılır. Burada hedef fosforilasyon hücre döngüsü bağımlı değişiklikleri değerlendirmek için FRET tabanlı gazetecilere nasıl kullanılacağı hakkında bir metodu tanımlar.
Özet
Förster rezonans enerji transferi (FRET) tabanlı gazetecilere 1 canlı hücrelerde bulunan endojen kinaz ve fosfataz faaliyetlerinin değerlendirilmesine izin verir. Bu problar genellikle phosphorylatable dizisi ve fosfor bağlayıcı etki alanı tarafından müdahale, OBP ve YFP türevleri oluşur. Fosforilasyon üzerine bir değişikliğe yol OBP ve YFP arasındaki mesafe veya yön değişikliği prob değişiklikler konformasyon, verimliliği FRET (Şekil 1). Birkaç probları PKA 2, PKB 3, KZÇ 4, 5 PKD, ERK 6, JNK 7, Cdk 18, Aurora B 9 gazetecilere ve Plk1 9 dahil olmak üzere birden fazla kinazlar ve fosfatazların faaliyet dengesi, izleme, son on yıl içinde yayınlanmış olan . Modüler tasarımı göz önüne alındığında, ek problar, yakın bir gelecekte 10 ortaya çıkması muhtemeldir .
Hücre döngüsü boyunca ilerlemesi, stres signali etkilenirng 11 yolakları. Özellikle, hücre döngüsü, hücrelerin strese 12 kurtarma ile karşılaştırıldığında büyüme soğukkanlı sırasında farklı düzenlenir. Hücrelerinin hücre döngüsü boyunca Time-lapse görüntüleme, bu nedenle özel dikkat gerektirir. Oranlı metrik görüntüleme istihdam, özellikle yüksek sinyal gürültü oranı ile iki görüntü sonuçlarını doğru yorumlamak için gereklidir, çünkü bu bir sorun haline gelir. Oranlı metrik kinaz ve fosfataz aktiviteleri hücre döngüsü bağımlı değişiklikler görüntüleme ağırlıklı hücre döngüsü 8,9,13,14 alt bölümlerine sınırlı olmuştur FRET.
Burada, insan hücre döngüsü boyunca oranlı metrik görüntüleme kullanarak FRET tabanlı probları izlemek için bir yöntem tartışın. Bu yöntem, pek çok araştırmacı, yaşam bilimleri ve mikroskopi veya görüntü işleme uzman bilgisi gerektirmez ekipman dayanmaktadır.
Protokol
1. Probu hücrelere Tanıtımı
- FRET-temelli bir prob ve bir plazmid görüşmekte direnci ile birlikte transfect hücreleri. Ilgi hücre tipi verimli bir transfeksiyon yöntemi seçin. U2OS hücreler için, standart kalsiyum fosfat transfeksiyon yöntemler yeterli sonuç verir 15.
- En az yedi gün süreyle uygun antibiyotik hücreleri seçin. Bu zenginleştirir prob ve sınırları ciddi hücre döngüsünü etkileyen toksik ifade seviyeleri ya da ekspresyon düzeyleri ile hücrelerin miktarını ifade hücrelerin miktarı.
- (Isteğe bağlı) istikrarlı klonlar için seçin.
- Sabit veya canlı hücreler kullanarak, hem OBP ve YFP yaklaşık aynı oranda bütün hücrelerde mevcut olduğunu doğrulayın.
- Bazı hücreler sadece CFP veya YFP içeren durumunda, muhtemelen rekombinasyon meydana geldi. Rekombinasyon bakteriyel büyüme sırasında veya prob transfeksiyon sonra da ortaya çıkabilir ve ikinci durumda plazmid kalite bağlı olarak değişebilir. Plazmid p tekrarlayınonarım ve sorun devam ederse transfeksiyon önce plazmid linearize.
2. İzleme oranlı metrik FRET
- Tohum hücrelerinin bir oda montaj için cam alt yemekler, veya kapak fişleri. Tabaklar / kapak fişleri hiçbir 1.5 (170 mikron kalınlığında) olduğunu emin olun.
- 37 ° C'ye kadar sıcaklık kontrolü ile motorlu Epifloresans mikroskop fenol kırmızısı olmadan Mount besi hücreleri PH düzenleme, medya ya da CO 2 veya CO 2-bağımsız medya gibi Liebowitz-15 olarak kullanarak emin olun.
- Iletilen ışık kullanarak hücrelerin odaklanın. Floresan ışığı kullanarak hücreleri üzerinde bakmayın.
- YFP uyarma (YFPex) ve YFP emisyon (YFPem) filtreleri ve uygun bir dikroik ayna kullanarak 12 veya 16 bit görüntü satın alarak başlayın. Hala gerekli Subselüler çözünürlük izin maksimal binning kullanın. Maruz kalma süresi ya da şiddeti azaltmak için yüksek bir binning fototoksisite önlemek için çok önemlidir.
- Banaaşure veya hücrelerinden yoksun bir alanda kaba bir ortalama, minimum ve maksimum piksel değerleri ölçmek veya tahmin edilerek arka plan yoğunluğu ve yaklaşık gürültü tahmin. Değişim maruz kalma süresi ve nötral yoğunluk filtreleri hücre ortalama sinyal yaklaşık arka plan yoğunluğu artı 5-10 kez max ve min arka plan şiddetleri arasında fark olduğunu.
- Doymuş olan yakın olmadığını görüntüler doğrulayın. Görüntüde maksimum yoğunluğu hücrelerin mitoz girdiğinizde yoğunluk farkları için izin vermek için dinamik aralık (örneğin bir 12 bit görüntü max 2000) yarısından daha az olmalıdır.
- Adım 2,4-2,6 CFP uyarma ve YFP emisyon filtreleri ve uygun bir dikroik ayna kullanarak tekrarlayın.
- Transfekte hücreler ile 2.7 ila 2.4 için kullanılan bölgeler hariç, birden çok bölge seçin ve bu maksimum yoğunluğu sağlamak tüm hücrelerde dinamik aralık yarısından daha az.
- Iki görüntü her 4 edinme time-lapse Denemeyi başlatYFPex kullanarak 5 dakika - YFPem ve CFPex - YFPem filtre setleri.
3. Koşulları doğrulanıyor ve optimize
- Elde edilen görüntüleri açın ve mitoz transfekte sonda ifade hücrelerin mitoz hücre döngüsü süresi izlemek.
- Ölçülen hücre döngüsü süresi, kullanılan hücre tipi için yayınlanmış veriler karşılaştırın. Alternatif olarak, film, referans hücre döngüsü kez almak için sadece iletilen ışık bir görüntü (örneğin, DIC veya faz kontrast) her saat satın alarak hücreleri untransfected.
- Mitoz bölünme ile mitoz hücre döngüsü zamanlamaları referans karşılık durumda, 4. adıma geçin. Alternatif olarak, yeniden kazanmak zor maruz kullanarak görüntü, daha fazla zaman noktaları veya birden fazla z düzeyleri ve 3. adımı tekrarlayın.
- Hücre döngüsü zamanlamaları referans karşılık gelmez mitoz bölünme ile mitoz durumda, filmin sonunda sadece iletilen ışık bir görüntü (örneğin, DIC veya faz kontrast) her saat bir görüntü elde hücreleri transfektetransfekte hücreleri belirlemek için deney.
- Transfekte hücreler hala uzun bir hücre döngüsü kez göstermesi durumunda, 1. adımı tekrarlayın fakat daha az prob transfect veya prob çok düşük miktarda içeren kararlı klonlar için seçin.
- Transfekte hücreler floresan ışık yokluğunda normal hücre döngüsü kez göstermesi durumunda, görüntüleri arasında binning, nötral yoğunluk filtreleri, maruz kalma süresi ve zamanı değiştirerek adım 2 ancak düşük maruziyet tekrarlayın.
4. FRET analiz
- Mikroskopi için adanmış birçok yazılım tarafından analiz yapılabilir. Burada ücretsiz ImageJ (kullanarak analiz yapmak için nasıl tarif http://rsb.info.nih.gov/ij eklenti Oranı Plus (kullanan) http://imagej.nih.gov/ij/plugins/ratio-plus html ).
- ImageJ görüntüleri açın. Durumda da görüntüler çok renkli Stac formattak (örneğin Deltavision) ilk kez bir hyperstack onları dönüştürerek tek tek kanallarını da ayrı: hyperstack Görüntü hyperstack yığını ve daha sonra onları kullanarak tek kanal yığınlarını bölünmüş: boyutluluk Görüntü hyperstack azaltmak
- Bu adım sadece oranları, 0 ve 1 aralığında olmadığını sağlayarak görüntülerin görsel netlik artırmaya yönelik olarak, isteğe bağlı Süreç Matematik-çarpın: YFPem yığını - YFPex 3 ile çarpın .
- YFPex - YFPem yığını, hücrelerinden yoksun bir alana ilgi bir bölge (ROI) çizmek, ancak bu ölçülebilir bir hücreye yakındır. Aynı görüntünün farklı hücreler, arka plan ve sinyal yoğunluğu hem de tipik bir görüntünün merkezinde güçlü olarak farklı bölgelerde gerekebilir.
- ROI yöneticisi ROI ekle: Analiz-araçlar-ROI yöneticisi.
- Analiz-Tedbir: - YFPem ve CFPex YFPem yığını YFPex hem de yatırım getirisi ortalama yoğunluğu ölçün .
- Birden fazla timepoints tekrarlayın ve yakın ilgi hücre arka plan şiddetleri film boyunca benzer doğrulamak.
- Minimum yoğunluğu ölçümleri analiz-Set-Min ve Max gri değeri: ölçümleri ayarlayın.
- Ilgi bir hücrenin çoğunu kapsayan bir bölge çizin ve YFPex hem de en az yoğunluğu ölçmek - YFPem ve CFPex - YFPem yığını. 4.6 ölçülen minimum yoğunluğu ve arka plan yoğunluğu arasındaki fark atın ve ikiye bölün. Bu kırpma değeri için bir başlangıç tahmin sağlar.
- Açık Oranı Plus. CFPex ve YFPem - YFPem yığını YFPex seçin. Stack 1 olarak YFPem oranı seçin CFPex FRET - - yığını 1 olarak YFPem, ters fosforilasyon üzerine düşürür.Düzeltme FRET probları seçin YFPex görselleştirme oranı FRET için.
- Ölçülen arka plan yoğunlukları ve kırpma değerleri yerleştirin.
- Ölçekleme oranı yığını uygun bir göz u ayarlayın ve uygulayınp oranı değişiklikleri görmenizi tablosu (LUT).
5. Temsilcisi Sonuçlar
Plk1 faaliyet mitoz sırasında G2 faz ve zirveleri çekirdeğinde ilk görünür. Şekil 3, 2 numaralı bölümde açıklandığı gibi, minimal fototoksisite ayarları kullanarak bir deney gösterir. Lütfen bu temsili bir ilk sonucu olduğuna dikkat ve maruz kalma koşulları veya görüntüleri arasında zaman sinyal gürültü oranı ya da zamansal çözünürlüğü artırmak için modifiye edilebilir. Prob ifade eden hücrelerin büyük bir çoğunluğu, 20 ila 25 saat arasında bir hücre döngü süresi ile görüntüleme koşulları ve prob ekspresyon düzeyleri hücre döngüsü zamanlamaları etkilemez belirten çoğaldığını Şekil 3D gösterir. Önemli gürültü olmasına rağmen, Plk1 aktivite trendi artan G2 ve mitoz 14 pik açıkça görülebilir (Şekil 3A). Burada, ham verilerin işlenmesi anlamına gelir ortalama ters ra kymograph (Şekil 3B) veya miktar olarak sunulan filtreleme tio (Şekil 3C) netlik artırabilirsiniz.
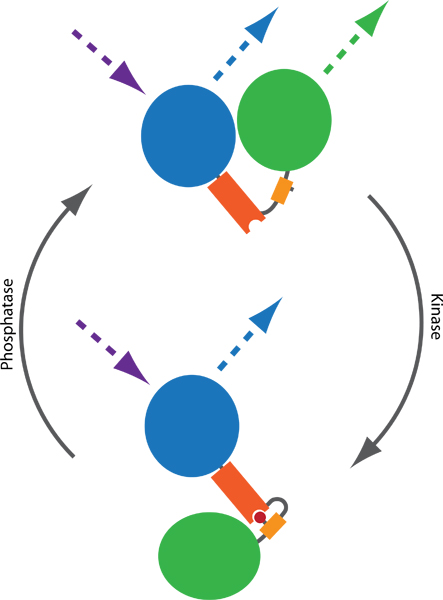
Şekil 1 FRET tabanlı prob Prensibi kinaz ve fosfataz faaliyetlerini izlemek için. İki fluorophores, genellikle CFP (mavi) ve YFP (yeşil), fosfor bağlayıcı bir etki alanı (turuncu) ve phosphorylatable dizisi (sarı) bağlanır. Böylece prob bir konformasyonel değişikliği indükleyen fosfor bağlayıcı etki alanı bağlayıcı Fosforilasyon (kırmızı) aracılık,. OBP ve YFP arasında FRET verimliliği etkileyen iki fluorophores arasındaki mesafe veya yönde bir fark konformasyonel değiştirme sonuçları. FRET, heyecan verici OBP ve izleme YFP emisyonu (noktalı çizgiler) tarafından görüntülenmiştir olabilir.

Şekil 2 deneysel işlemin şematik anahat.
p_upload/3410/3410fig3.jpg "/>
Şekil 3 Plk1 faaliyet mitoz sırasında G2 faz ve zirveleri çekirdeğinde ilk görünür. 20x NA 0.7 hava objektif ve cıva lambası ile donatılmış bir Deltavision Spectris Görüntüleme sistemi kullanılarak 60 saat süreyle bir FRET tabanlı prob izleme Plk1 aktivitesi 9,14 ifade U2OS hücreleri çekildi. Görüntüleme koşulları 4x binning ve nötral yoğunluk filtreleri kullanarak, 2. bölümünde belirtildiği gibi, minimal fototoksisite neden seçildi gelen ışığın% 99 blok. 4 bölünmelerin bir hücre ters FRET-oranı, yanlış renk gösterimi,. B, ortalama bir filtre uyguladıktan sonra A gösterilen hücre kymograph. C, ters ölçümü A. D hücresi, 50 kümülatif mitotik giriş oranı FRET kızı hücreleri bölümleri de dahil olmak üzere ifade hücreleri, prob FRET.
Tartışmalar
Hücre döngüsü boyunca FRET izlenmesi, kısa vadeli dış uyaranlara tepkilerin değerlendirilmesi daha az önemli olan hususlar gerektirir. İlk olarak, hücre döngüsünün ilerlemesi kolayca bu fototoksisite minimumda tutulması gerektiren stres sinyalizasyon tarafından rahatsız edilir. İkincisi, tüm gazetecilere potansiyel kinazlar, fosfatazlar veya etkileşim alanları titre edilerek hücresel süreçleri etkileyebilir. Deneysel koşullar yeterli olup olmadığını değerlendirmek için belki de en basit yolu, mitoz bölünme ile mitoz hücre döngüsü uzunluğu bir sonda floresan görüntüleme ve ifade bağımsız deneyler ölçmek ve karşılaştırmak için.
Izlemeye çok önemli bir faktör, hücre döngüsü boyunca oranları, yüksek çözünürlüğe sahip güzel görüntüler elde etmek için günaha dayanacak şekilde FRET. Tam ayarları mikroskop sistemi ve anlatım düzeyi ve özellikle sonda doğa hassasiyetine bağlı olsa da, kullanmak için önemlidir.ne karşılık gelen bir seviyeye binning görmek için kesinlikle gerekli. CFPex arasındaki süre olmasına rağmen - YFPem ve YFPex - YFPem görüntüleri elimizde hücre morfolojisi değişiklikleri önlemek için kısa olması gerekir 0,1 saniye fazla poz süreleri tutmak ve nötral yoğunluk filtreleri tarafından floresan ışık yoğunluğunu azaltmak için iyidir .
Fototoksisite nasıl etkiler hücre döngüsü, ifade seviyeleri ve prob lokalizasyonu büyük ölçüde bağlıdır. Kromatin lokalize bir prob, füzyon ile bir Histon, örneğin, floresan ışığı daha duyarlı hücreleri, fototoksik yan DNA çevresinde oluşturulan muhtemelen bu yana vermektedir. Gazetecilere nispeten düşük seviyelerde ifade hücreleri izlemek ve yeniden hücre döngüsü kontrol zamanlamaları prob farklı hücre içi yapılara lokalize eğer bu nedenle çok önemlidir.
Çeşitli kontrol deneyleri FRET mevcut olduğunu doğrulamak için gerekli olandeney düzeneği ve bu oran değişiklikleri gerçek bir prob fosforilasyon yansıtmaktadır. Böyle bir kinaz inhibisyonu veya tükenmesi gibi fonksiyonel kontrolleri dışında, biyokimyasal prob fosforile olduğunu doğrulamak için deneyler, olmayan bir phosphorylatable kalıntı prob içinde beklenen fosfor-alıcı sitesi mutasyon, photobleaching acceptor gerçekleştirmek için tavsiye edilir FRET, oluşumu kanıtlamak. Geniş bir doğrulama Örneğin, ref 14 ek şekil 3 bakın.
Bu kurulumları değişiklikler ve aydınlatma koşulları odaklanmak ve kolayca eserler yol açabilir, çok hassas OBP ve YFP emisyon izleme FRET değerlendirmek için teorik olarak tercih edilir olsa da. Değişiklikleri odaklamak Duyarlılık OBP ve YFP emisyon aynı noktaya odaklanmak renk sapmaları nedeniyle. Aydınlatma değişiklikler ışık yolu farklı uyumu büyük ölçüde bağlıdır. Içeren filtre küpleri kullanarak, bu özellikle belirgindirdikroik bir ayna. Focus ve aydınlatma değişikliği düzeltilmiş hedefleri ve itinal filtre küpler kullanılarak azaltılabilir. Ancak, deneyimlerimiz, emisyon filtre sabit tutarak, tercihen, uyarma ve emisyon filtreleri ayrı kontrolü ile bir kurulum ile üstün sonuçlar verir.
YFP CFP floresans emisyon filtre bleedthrough gözlenen FRET değişim büyüklüğü azalır. Bleedthrough durumda, ekstra bir CFPex büyüktür - YFPem resim - CFPem görüntü CFPex içine bleedthrough düzeltmek için elde edilebilir. Ancak, bu tür düzeltmeler farklılıkları odak çok hassastır ve eserleri tanıtmak. Buna ek olarak, ekstra bir görüntü, fototoksisite üretmek olabilir gerektirir.
Hücreler 24 saat boyunca bir odakta tutarak sadece izleme YFP emisyon + time-lapse deney zor olabilir zaman bir sorun daha az olsa da. Odak sürükleniyor önlemek için, emin olun, mikroskopve çanak önceden ısınmış ve oda sıcaklığı dalgalanma değildir ki. Alternatif olarak, transfekte prob görüntüleme dayalı bir otomatik odaklama sistemi kullanın.
Kullanmak için hangi objektif seçimi belirli bir uygulama bağlıdır. Bir yağ bazlı, yüksek NA amacı, daha fazla ışık toplar ve artan çözünürlük verir, ancak değişiklikleri odaklamak daha duyarlı ve yüksek içerik kurulumları olarak kullanışsız. Biz sitoplazmik veya nükleer FRET-oranları çalışma nispeten yüksek bir NA ile bir hava amacı kullanmayı tercih, yüksek hücre içi çözünürlük yalnızca gerekli olduğunda petrol hedefleri NA yüksek.
Bu kağıt, film, birçok yaşam bilimleri araştırmacıları için yaygın olarak mevcuttur ve sadece bazal mikroskopi ve görüntü işleme bilgisi gerektiren cihaz kullanan hücre döngüsü boyunca FRET-temelli probları için basit bir yöntem tartışır. Daha özelleşmiş alternatifler kiriş-bölücülerin kullanımı, Flüoresans Ömrü Microscopy (Flim) 1 ve nesne segmentasyon 16 ve hesaplama otomatikleştirmek için yazılım oranı 17 FRET.
Açıklamalar
Biz ifşa etmek başka bir şey var.
Teşekkürler
Yazarlar, İsveç araştırma konseyi, İsveç temel stratejik araştırma, İsveçli kanser toplum, İsveçli çocuk kanser toplumu, Åke WIBERGS vakıf ve Jeanssons vakıf tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif | Katalog Numarası | Şirket | |
| Leibovitz L-15, herhangi bir fenol kırmızısı | 21083-027 | Gibco, Yaşam Teknolojileri tarafından | |
| DMEM + Glutamax-I | 31966 | Gibco, Yaşam Teknolojileri tarafından | |
| Fetal sığır serumu (FBS) | SV30160.03 | HyClone | |
| % 0.05 tripsin EDTA | SH30236.01 | HyClone | |
| Penisilin-Streptomisin | SV30010 | HyClone | |
| DPBS | 14287 | Gibco, Yaşam Teknolojileri tarafından | |
| Puromycin | P8833 | Sigma-Aldrich |
Referanslar
- Sun, Y., Wallrabe, H., Seo, S. A., Periasamy, A. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth. Chemphyschem. 12, 462-474 (2011).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochem. Biophys. Res. Commun. 348, 716-721 (2006).
- Kunkel, M. T., Ni, Q., Tsien, R. Y., Zhang, J., Newton, A. C. Spatio-temporal dynamics of protein kinase B/Akt signaling revealed by a genetically encoded fluorescent reporter. J. Biol. Chem. 280, (2005).
- Violin, J. D., Zhang, J., Tsien, R. Y., Newton, A. C. A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase. C. J. Cell. Biol. 161, 899-909 (2003).
- Kunkel, M. T., Toker, A., Tsien, R. Y., Newton, A. C. Calcium-dependent regulation of protein kinase D revealed by a genetically encoded kinase activity reporter. Journal of Biological Chemistry. 282, 6733-6742 (2007).
- Harvey, C. D. A genetically encoded fluorescent sensor of ERK activity. Proc. Natl. Acad. Sci. U.S.A. 105, 19264-19269 (2008).
- Fosbrink, M., Aye-Han, N. N., Cheong, R., Levchenko, A., Zhang, J. Visualization of JNK activity dynamics with a genetically encoded fluorescent biosensor. Proc. Natl. Acad. Sci. U.S.A. 107, 5459-5464 (2010).
- Gavet, O., Pines, J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Dev. Cell. 18, 533-543 (2010).
- Fuller, B. G. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453, 1132-1136 (2008).
- Ni, Q., Titov, D. V., Zhang, J. Analyzing protein kinase dynamics in living cells with FRET reporters. Methods. 40, 279-286 .
- Morgan, D. O. . The cell cycle : principles of control. , (2007).
- Lindqvist, A., Rodriguez-Bravo, V., Medema, R. H. The decision to enter mitosis: feedback and redundancy in the mitotic entry network. J. Cell. Biol. 185, 193-202 (2009).
- Gavet, O., Pines, J. Activation of cyclin B1-Cdk1 synchronizes events in the nucleus and the cytoplasm at mitosis. J. Cell. Biol. 189, 247-259 (2010).
- Macurek, L. Polo-like kinase-1 is activated by aurora A to promote checkpoint recovery. Nature. 455, 119-123 (2008).
- van der Eb, A. J., Graham, F. L. Assay of transforming activity of tumor virus DNA. Methods. Enzymol. 65, 826-839 (1980).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. Biotechniques. 42, 71-75 (2007).
- Roszik, J., Lisboa, D., Szollosi, J., Vereb, G. Evaluation of intensity-based ratiometric FRET in image cytometry--approaches and a software solution. Cytometry A. 75, 761-767 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır