Method Article
FRETはレシオメトリックで細胞周期のキナーゼおよびホスファターゼの活動を監視
要約
FRETに基づく記者はますます、生細胞におけるキナーゼとホスファターゼの活動を監視するために使用されています。ここでは、ターゲットのリン酸化の細胞周期依存性の変化を評価するためのFRETに基づくレポーターを使用する方法の方法を説明します。
要約
フェルスター共鳴エネルギー移動(FRET)ベースの記者1は、生きた細胞中の内因性キナーゼとホスファターゼ活性の評価を可能にする。このようなプローブは、一般的にリン酸化可能なシーケンスとリン結合ドメインによる介入CFPとYFPの変異体、で構成されています。効率(図1)、FRETの変化につながる、CFPとYFPの間の距離や方向の変化をもたらすリン酸化の際、プローブの変更のコンフォメーション、。いくつかのプローブは、PKA 2、PKB 3、PKC 4、PKD 5、ERK 6、JNK 7、CDK 18、オーロラB 9の記者とPLK1 9を含む複数のキナーゼとホスファターゼの活性のバランスを、監視し、過去10年間の間に発表されている。モジュラー設計を考えると、追加のプローブは、近い将来10で出現するものと予想される。
細胞周期の進行は、ストレスsignaliによって影響されるngは11パスウェイ。特に、細胞周期が細胞周期を通じて細胞の細胞がストレスを12から回復している。タイムラプスイメージングでは、したがって、特に注意を必要とする場合に比べて成長を摂動の間に異なる規制されています。レシオメトリックイメージングを採用する場合は特に対ノイズ比の高い信号を持つ2つのイメージが正しく結果を解釈するために必要とされるので、これは、問題になります。キナーゼとホスファターゼ活性で細胞周期依存性変化のレシオメトリックFRETのイメージングは、主に細胞周期8,9,13,14のサブセクションに限定されています。
ここで、我々は、人間の細胞周期を通してレシオイメージングを用いたFRETに基づくプローブを監視する方法について説明します。方法は、ライフサイエンスにおける多くの研究者に利用可能であり、顕微鏡や画像処理の専門知識を必要としない機器に依存しています。
プロトコル
1。細胞にプローブを導入する
- FRETに基づくプローブとプラスミド耐性を付与するとの同時トランスフェクション細胞。目的の細胞型で効率的なトランスフェクションの方法を選択してください。 U2OS細胞の場合は、標準的なリン酸カルシウムトランスフェクション法では十分な結果が15を与える。
- 少なくとも7日間に適切な抗生物質でセルを選択します。これは豊かにプローブを発現する細胞の量をし、深刻な細胞周期に影響を与える毒性発現レベル、または発現レベルと細胞の量を制限します。
- (省略可能)安定したクローンを選択してください。
- 固定またはライブセルを使用して、CFPとYFPの両方がほぼ同じ比率ですべての細胞に存在することを確認してください。
- 一部の細胞だけCFPまたはYFPを含む場合には、組換えは可能性が発生しました。組換えは、細菌の増殖の間またはプローブのトランスフェクション後にどちらかが発生することができ、後者の場合にはプラスミドの品質に依存することがあります。プラスミドpを繰り返す償いと問題が解決しない場合はトランスフェクション前にプラスミドを線形化します。
2。レシオメトリックを監視すると、FRETの
- チャンバー内にマウントするためのガラスボトムディッシュ、またはカバースリップ上にシード細胞。食器/カバースリップがない1.5(170μm厚)がないことを確認してください。
- 37℃に設定した温度制御による電動落射蛍光顕微鏡でフェノールレッドを増殖培地で細胞をマウントします。 CO 2によってまたはそのようなリーボウィッツ- 15などのCO 2 -独立系メディアを使用するかのいずれか、培地のpHの調節を確認してください。
- 透過光を用いて細胞に焦点を当てる。蛍光灯を用いて細胞を直視しないでください。
- YFPの励起(YFPex)とYFPエミッション(YFPem)フィルタと、適切なダイクロイックミラーを使用して12または16ビットの画像を取得することから始めます。それでも、必要な細胞内解像度を可能にする使用可能な最大のビニングを使用してください。露光時間や強度を減少させる高ビニングを使用すると、光毒性を避けるために不可欠です。
- 私asureまたは細胞を欠いているエリアでラフ平均、最小値および最大ピクセル値を測定または推定することによりバックグラウンドの強度とおおよそのノイズを推定する。セル内の平均的な信号はおよそバックグラウンド強度に加え、最大および最小のバックグラウンド強度の間に5〜10倍の差になるように露光時間とNDフィルターを変更します。
- 飽和するために近くに配置されていないことのイメージを確認します。画像の最大強度は、細胞が有糸分裂を入力すると強度の違いを考慮してダイナミックレンジ(12ビットの画像で、例えば最大2000)の半分未満でなければなりません。
- CFPの励起とYFPの発光フィルターと、適切なダイクロイックミラーを使用して、ステップ2.4から2.6を繰り返します。
- 2.7ポイント2.4で使用される地域を除く、トランスフェクションされた細胞で複数の地域を選択し、その最大強度を確保するためには、すべてのセルのダイナミックレンジの半分以下です。
- すべての4つの画像を取得タイムラプス実験を開始YFPexを使用して5分 - YFPemとCFPex - YFPemフィルタセット。
3。条件の確認と最適化
- 取得した画像を開いて、有糸分裂から、トランスフェクトプローブを発現する細胞のための有糸分裂への細胞のサイクルタイムを監視します。
- 使用する細胞の種類の公開データに測定された細胞周期の時間を比較。また、フィルムは、参照セルのサイクルタイムを取得する唯一の透過光の1つのイメージ(例えば、DICまたは位相コントラスト)時間ごとに取得することにより細胞をトランスフェクトされていない。
- 有糸分裂から分裂までの時間は、細胞周期のタイミングを参照するために該当する場合においては、ステップ4に進みます。あるいは難しい露出を使用して、再取得の画像、より多くの時間がポイントまたは複数のz -レベルとステップ3を繰り返します。
- 細胞周期のタイミングを参照するには対応していない有糸分裂から分裂までの時間のケースでは、映画は最後にのみ透過光の1つのイメージ(例えば、DICまたは位相コントラスト)は、1つの画像に続いてすべての時間を獲得することで細胞をトランスフェトランスフェクションされた細胞を識別するための実験の。
- トランスフェクションされた細胞はまだ長く、細胞周期の時間を表示する場合、手順1を繰り返しますが、少ないプローブをトランスフェクトまたはプローブの非常に少量を含む安定版(stable)クローンを選択します。
- トランスフェクションされた細胞は、蛍光灯のない状態で正常な細胞周期の時間を表示する場合、画像間のビニング、NDフィルター、露光時間、および時間を変更することで、手順2が下側の露出を繰り返す。
4。 FRETはAnalysing
- 分析は、顕微鏡専用の多くのソフトウェアで実行することができます。ここでは、フリーウェアのImageJ(使用して分析を実行する方法について説明します。 http://rsb.info.nih.gov/ijをプラグイン比プラス(活用) http://imagej.nih.gov/ij/plugins/ratio-plusを。HTML )。
- ImageJの中の画像を開きます。ケースではあなたのイメージが多色のSTACの形式になっていますK(例:Deltavision)は、最初のhyperstackに変換することで、個々のチャネルを分離する:hyperstackするImage - hyperstack -スタックして、その後使用して単一のチャネルスタックにそれらを分割: 画像- hyperstack -減らす次元
- それが唯一の比率は0と1の間の範囲内にないことを保証することで、画像の視覚的な明瞭さを高めるために意図されているため、このステップは、オプションですプロセス-数学-乗算 :使用して3でYFPemスタック- YFPexを掛けます。
- YFPexに - YFPemスタック、細胞を欠いているが、それは測定しようとする細胞に近い地域に関心領域(ROI)を描く。バックグラウンドと信号強度の両方が一般的に画像の中心に最も強いのと同じイメージ内の別の細胞は、さまざまな地域が必要となる場合があります。
- ROIマネージャーにROIを追加: 分析-ツール- ROIマネージャー 。
- 分析-測定 : - YFPemとCFPex - YFPemスタックYFPex両方のROIの平均強度を測定。
- 複数のタイムポイントで繰り返すとその目的の細胞に近いバックグラウンド強度がフィルム全体に似ていることを確認します。
- 分析-セットの測定値- MinとMaxのグレー値 :最小の強度を含むように測定値を設定します。
- 細胞のほとんどをカバーする関心領域を描くとYFPex両方で最小限の強度を測定する - YFPemとCFPex - YFPemスタック。 4.6から測定された最小の強度とバックグラウンド強度の差を取ると2で割ります。これは、クリッピングの値の開始見積もりを提供します。
- オープン比プラス。 YFPemとCFPex - - YFPemスタックYFPexを選択します。比、選択CFPex FRETのために - スタック1としてYFPem - スタック1としてYFPemを、逆にリン酸化によって効率が低下するのFRETプローブ、選択YFPexを可視化比率をFRETのために。
- 測定されたバックグラウンド強度とクリッピングの値を挿入します。
- 結果として得られる比スタックのスケーリングを設定し、適切な外観のuを適用する比の変化を視覚化するpは、テーブル(LUT)。
5。代表的な結果
PLK1活動は、G2期および有糸分裂の間にピークに核内で最初に表示されているです。図3は、セクション2で説明したように最小限の光毒性の設定を使用して実験を示しています。これは代表的な初期の結果であることに注意し、画像間の露光条件や時間が雑音比や時間分解能の信号を増加するように変更することができますしてください。プローブを発現する細胞の大部分は、撮影条件やプローブの発現レベルが細胞周期のタイミングに影響しないことを示す、20〜25時間の細胞周期の時間で増殖することを図3に示す。かなりのノイズがあるが、PLK1活動の傾向G2で増加し、有糸分裂14にピークがはっきりと(図3A)表示されます。ここで、生データを処理するわけで平均的な倒立RAのカイモグラフ(図3B)、または定量化として提示フィルタリング酸化チタン(図3C)は、透明度を高めることができます。
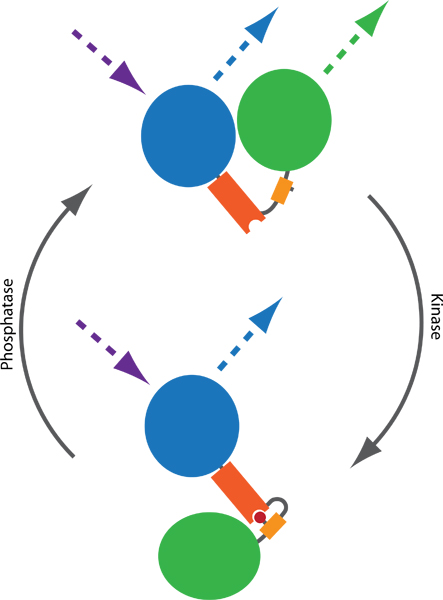
図1 FRETに基づくプローブの原理キナーゼとホスファターゼの活動を監視する。通常2つのフルオロフォア、CFP(青)とYFP(緑色)は、リン結合ドメイン(オレンジ)とリン酸化可能なシーケンス(黄色)で接続されています。これにより、プローブのコンフォメーション変化を誘導するリン結合ドメインに結合するリン酸化(赤)を仲介する、。 CFPとYFP間のFRET効率に影響を与えるtwoフルオロフォア間の距離や方向の違いにおけるコンフォメーション変化の結果。 FRETは、刺激的なCFPとYFPの監視の放出(点線)によって可視化することができる。

図2実験手順の概略図概略。
p_upload/3410/3410fig3.jpg"/>
図3。PLK1の活性は、G2期および有糸分裂の間にピークに核内で最初に表示されているです。 FRETに基づくプローブの監視PLK1活動9,14の発現U2OS細胞は20倍、NA 0.7空気の目標と水銀ランプを装備Deltavisionスペクトリスイメージングシステムを用いて60時間撮影されました。撮像条件は、4倍ビニングとNDフィルターを使用して、2章で概説したように、最小限の光毒性を引き起こすために選ばれたその入射光のブロック99%。 、逆の偽色の表現は、4部門を通じて1つのセルに続く、比のFRET。 B、平均値フィルタを適用した後に示すようにセルのキモグラフ。 C、反転の定量化は、A. D、娘細胞の分裂を含む50のFRETプローブを発現する細胞、の累積有糸分裂のエントリに示されている細胞の比率のFRET。
ディスカッション
細胞周期を通してFRETを監視することで外部からの刺激に短期的応答を評価する際には、あまり重要な考慮事項が必要です。最初に、細胞周期の進行が容易にその光毒性を最小限にとどめる必要、ストレスのシグナリングによって摂動されています。第二に、すべての記者たちが潜在的にキナーゼ、ホスファターゼまたは相互作用ドメインを滴定することによって細胞プロセスに影響を与える可能性があります。実験条件が適切かどうか見極め、おそらく最も簡単な方法は、有糸分裂から細胞分裂する細胞周期の長さを測定し、プローブの蛍光イメージングと表現の独立した実験と比較することです。
モニタリングの重要な要因は、高解像度で美しい画像を取得するために誘惑に耐えられるようになる細胞周期を通して比率のFRET。正確な設定は、顕微鏡システムや発現レベルの感度と特定のプローブの性質に依存するが、それは使用することが重要です。何に対応するビニングのレベルは確認することは絶対に必要です。 CFPex間の時間が - YFPemとYFPex - YFPemイメージは我々の手で、細胞の形態変化を避けるために短くする必要があるそれ以上の0.1秒で露光時間を維持し、中立的な密度のフィルタによって蛍光の強度を低減することをお勧めします。
光毒性がどのように影響する細胞周期の発現レベルとプローブの局在によって大きく異なります。クロマチンに局在しているプローブは、ヒストンとの融合により、例えば、光毒性副産物がDNAの近傍に作成されると推測されるので、蛍光灯に対してより敏感に、細胞を、レンダリング。それは、記者の比較的低レベルを発現する細胞を監視し、再チェック、細胞周期のタイミングの異なる細胞内構造にプローブをローカライズする場合にすることが重要です。
いくつかの対照実験は、FRETが存在することを確認する必要があります実験とその比率の変化は、プローブの実際のリン酸化を反映している。このようなキナーゼの阻害や枯渇などの機能的なコントロール、を除いて、それは生化学的プローブがリン酸化されていることを確認する実験、非リン酸化可能な残基にプローブ内で予想されるリン酸化受容部位の変異、およびに退色アクセプターを実行することをお勧めしますFRETの発生を証明する。豊富な検証の例については、文献14に補足図3を参照してください。
それは、CFPとYFPの排出量の両方を監視することによって変化をFRETを評価するために理論的には好ましいが、このような設定は、変更と照明条件を集中することが非常に敏感ですし、簡単に成果物につながることができます。変更内容を集中する感度は、CFPとYFP発光が同じポイントに集中していない色収差、によるものです。照明の変化は、光路の異なる位置合わせに大きく依存する。を含むフィルターキューブを使用する場合に特に顕著であるダイクロイックミラー。フォーカスと照度変化が補正された目標と慎重に整列フィルターキューブを使用して減らすことができます。しかし、我々の経験で、排出量のフィルタの定数を保つことが好ましく励起および発光フィルターを個別に制御でセットアップを使用することにより、優れた結果が得られます。
FRETの変化観測の大きさは、CFPの蛍光からYFP発光フィルターにbleedthroughによって削減されます。ケースではbleedthroughは、余分なCFPexかなりのものである - YFPem画像 - CFPemイメージがCFPexにbleedthroughを修正するために取得することができます。しかし、そのような訂正は、相違点を集中することが非常に敏感ですし、アーティファクトが生じる可能性があります。さらに、彼らは光毒性が生成される可能性が余分な画像を、必要とする。
24 +タイムラプス実験が困難なことができる全体の問題の少ないが、焦点に細胞を保持するときにのみ監視YFPの放射、。フォーカスドリフトを避けるために、顕微鏡のことを確認してください。そして皿はあらかじめ温め、部屋の温度が変動しないということです。また、トランスフェクトされたプローブのイメージングに基づいていないオートフォーカスシステムを使用してください。
目的に使用するの選択は、特定のアプリケーションに依存します。オイルベースの高NAの目的は、より多くの光を収集し、高い分解能が得られますが、変更を集中するより敏感であり、高含有量の設定で実用的でない。我々は、細胞質または核のFRETに比率を研究するために比較的高いNAで空気の目標を使用することを好む、そしてより高い細胞内分解能が必要なときだけオイルの目標NAを高くしてください。
本論文では、映画の多くの生命科学の研究者が共通して利用できると顕微鏡と画像処理の唯一の基礎知識を必要とする機器を使用して細胞周期のFRETに基づくプローブをする簡単な方法について説明します。より専門的な選択肢は、ビームスプリッタ、蛍光寿命Mの使用を含むicroscopy(FLIM)1とオブジェクトセグメンテーション16および比17 FRETの計算を自動化するソフトウェア。
開示事項
我々は、開示することは何もない。
謝辞
著者らは、スウェーデンの研究評議会、スウェーデン戦略研究財団、スウェーデン癌の社会、スウェーデンの小児がんの社会、オーケWibergs基盤とJeanssons基盤によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | カタログ番号 | 会社 | |
| リーボビッツL - 15、無フェノールレッド | 21083-027 | GIBCO、Life Technologies社によって | |
| DMEM +グルタミン- I | 31966 | GIBCO、Life Technologies社によって | |
| ウシ胎児血清(FBS) | SV30160.03 | HyClone | |
| 0.05%トリプシンEDTA | SH30236.01 | HyClone | |
| ペニシリン - ストレプトマイシン | SV30010 | HyClone | |
| DPBS | 14287 | GIBCO、Life Technologies社によって | |
| ピューロマイシン | P8833 | シグマアルドリッチ |
参考文献
- Sun, Y., Wallrabe, H., Seo, S. A., Periasamy, A. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth. Chemphyschem. 12, 462-474 (2011).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochem. Biophys. Res. Commun. 348, 716-721 (2006).
- Kunkel, M. T., Ni, Q., Tsien, R. Y., Zhang, J., Newton, A. C. Spatio-temporal dynamics of protein kinase B/Akt signaling revealed by a genetically encoded fluorescent reporter. J. Biol. Chem. 280, (2005).
- Violin, J. D., Zhang, J., Tsien, R. Y., Newton, A. C. A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase. C. J. Cell. Biol. 161, 899-909 (2003).
- Kunkel, M. T., Toker, A., Tsien, R. Y., Newton, A. C. Calcium-dependent regulation of protein kinase D revealed by a genetically encoded kinase activity reporter. Journal of Biological Chemistry. 282, 6733-6742 (2007).
- Harvey, C. D. A genetically encoded fluorescent sensor of ERK activity. Proc. Natl. Acad. Sci. U.S.A. 105, 19264-19269 (2008).
- Fosbrink, M., Aye-Han, N. N., Cheong, R., Levchenko, A., Zhang, J. Visualization of JNK activity dynamics with a genetically encoded fluorescent biosensor. Proc. Natl. Acad. Sci. U.S.A. 107, 5459-5464 (2010).
- Gavet, O., Pines, J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Dev. Cell. 18, 533-543 (2010).
- Fuller, B. G. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453, 1132-1136 (2008).
- Ni, Q., Titov, D. V., Zhang, J. Analyzing protein kinase dynamics in living cells with FRET reporters. Methods. 40, 279-286 .
- Morgan, D. O. . The cell cycle : principles of control. , (2007).
- Lindqvist, A., Rodriguez-Bravo, V., Medema, R. H. The decision to enter mitosis: feedback and redundancy in the mitotic entry network. J. Cell. Biol. 185, 193-202 (2009).
- Gavet, O., Pines, J. Activation of cyclin B1-Cdk1 synchronizes events in the nucleus and the cytoplasm at mitosis. J. Cell. Biol. 189, 247-259 (2010).
- Macurek, L. Polo-like kinase-1 is activated by aurora A to promote checkpoint recovery. Nature. 455, 119-123 (2008).
- van der Eb, A. J., Graham, F. L. Assay of transforming activity of tumor virus DNA. Methods. Enzymol. 65, 826-839 (1980).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. Biotechniques. 42, 71-75 (2007).
- Roszik, J., Lisboa, D., Szollosi, J., Vereb, G. Evaluation of intensity-based ratiometric FRET in image cytometry--approaches and a software solution. Cytometry A. 75, 761-767 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved