Method Article
Atividades de monitoramento quinases e fosfatases através do ciclo celular por raciométrica FRET
Neste Artigo
Resumo
FRET baseado jornalistas estão cada vez mais utilizados para monitorar atividades quinase e fosfatase em células vivas. Aqui nós descrevemos um método de como usar FRET baseado jornalistas para avaliar o ciclo de dependentes de células alterações na fosforilação alvo.
Resumo
Förster transferência de energia por ressonância (FRET) baseado em uma repórteres permitir a avaliação da quinase endógena e atividades da fosfatase em células vivas. Sondas tais tipicamente consistem de variantes do PCP e YFP, interveio por uma seqüência fosforilável e um domínio fosfo-binding. Após a fosforilação, a sonda conformação mudanças, o que resulta em uma mudança da distância ou da orientação entre PCP e YFP, levando a uma mudança na eficiência FRET (Fig. 1). Sondas de vários trabalhos foram publicados na última década, o monitoramento do equilíbrio atividade de quinases e fosfatases múltiplas, incluindo repórteres de PKA 2, PKB 3, PKC 4, PKD 5, 6 ERK, JNK 7, CDK 18, Aurora B 9 e 9 Plk1 . Dado o design modular, sondas adicionais é provável que surjam no futuro próximo 10.
Progressão do ciclo celular é afetada pelo estresse signaling caminhos 11. Notavelmente, o ciclo celular é regulado de forma diferente durante imperturbável crescimento em relação a quando as células estão se recuperando do estresse 12. Time-lapse de imagens de células através do ciclo celular, portanto, requer um cuidado especial. Isso se torna um problema particularmente quando se emprega imagens raciométrica, uma vez que duas imagens com uma alta relação sinal-ruído são obrigados a interpretar corretamente os resultados. Raciométrica FRET imagem das mudanças do ciclo celular dependentes em atividades quinase e fosfatase tem sido predominantemente restrita ao sub-seções do ciclo celular 8,9,13,14.
Aqui, discutimos um método para monitorar FRET baseado em sondas utilizando imagens raciométrica todo o ciclo celular humano. O método baseia-se em equipamento que está disponível para muitos pesquisadores em ciências da vida e não requer conhecimento especializado de microscopia ou processamento de imagem.
Protocolo
1. Introduzir a sonda para células
- Co-transfecção de células com uma sonda FRET-based e uma resistência plasmídeo conferir. Escolha um método de transfecção que seja eficiente na sua cela tipo de interesse. Para as células U2OS, padrão de cálcio métodos de transfecção fosfato dão resultados adequados 15.
- Selecione as células do antibiótico apropriado para pelo menos sete dias. Isso enriquece a quantidade de células que expressam a sonda e limita a quantidade de células com níveis de expressão tóxicos, ou níveis de expressão que afetam gravemente o ciclo celular.
- (Opcional) Selecione para clones estáveis.
- Usando células fixas ou viver, verifique se ambos PCP e YFP estão presentes em todas as células, aproximadamente a mesma proporção.
- No caso de algumas células contêm apenas PCP ou YFP, a recombinação tem provavelmente ocorreu. Recombinação pode ocorrer tanto durante o crescimento de bactérias ou após transfecção da sonda, podendo neste último caso dependem da qualidade plasmídeo. Repita p plasmídeoreparação e linearizar o plasmídeo antes de transfecção se o problema persiste.
2. Raciométrica monitoramento FRET
- Células de semente em pratos de vidro de fundo, ou lamínulas para montagem em uma câmara. Certifique-se que pratos / lamínulas há 1,5 (170 mm de espessura).
- Montar células em meio de crescimento sem vermelho de fenol em um microscópio de epifluorescência motorizada com controle de temperatura definida para 37 ° C. Garantir a regulação do pH dos meios de comunicação, seja por CO 2 ou usando CO 2 independente de mídia, como Liebowitz-15.
- Concentre-se em células usando luz transmitida. Não olhe nas células usando luz fluorescente.
- Comece por adquirir uma imagem de 12 bits ou 16 usando excitação YFP (YFPex) e YFP emissão (YFPem) filtros e um espelho adequado dicróicas. Use binning máxima disponível que ainda permite a resolução necessária subcelulares. Usando um binning alta para diminuir o tempo de exposição ou a intensidade é crucial para evitar fototoxicidade.
- Measure ou estimar a intensidade do ruído de fundo e aproximada, medindo ou estimando a média aproximada, valores mínimo e máximo de pixels em uma área desprovida de células. Alterar o tempo de exposição e filtros de densidade neutra para que o sinal média na célula é de aproximadamente a intensidade de fundo mais cinco a dez vezes a diferença entre Max e intensidades de fundo min.
- Verifique se as imagens não estão perto de ser saturado. A intensidade máxima na imagem deve ser inferior a metade da faixa dinâmica (por exemplo, max de 2000, em uma imagem de 12 bits) para permitir diferenças de intensidade quando as células entram mitose.
- Repita o passo 2,4-2,6 usando excitação PCP e filtros de emissão YFP e um espelho adequado dicróicas.
- Selecione várias regiões com células transfectadas, excluindo as regiões utilizadas para o ponto 2.4 a 2.7, e garantir que a intensidade máxima é inferior a metade da faixa dinâmica em todas as células.
- Iniciar uma experiência de lapso de tempo adquirir duas imagens a cada 45 min usando YFPex - YFPem e CFPex - define YFPem filtro.
3. Verificação e otimização das condições de
- Abra as imagens adquiridas e monitorar o tempo do ciclo celular da mitose a mitose de células que expressam a sonda transfectadas.
- Compare o tempo de ciclo celular medidos com os dados publicados para o tipo de célula utilizada. Alternativamente, o filme untransfected células através da aquisição de uma imagem de luz transmitida apenas (por exemplo, DIC ou de contraste de fase) a cada hora para obter tempos de referência do ciclo celular.
- No caso de o tempo de mitose a mitose corresponde à referência timings ciclo celular, vá para a etapa 4. Alternativamente, re-adquirir imagens usando mais difícil de exposição, mais tempo ou vários pontos de z-níveis e repita o passo 3.
- No caso de o tempo de mitose a mitose não corresponde à referência timings do ciclo celular, o filme transfectadas células através da aquisição de uma imagem de luz transmitida apenas (por exemplo, DIC ou de contraste de fase) a cada hora seguido por uma imagem no finaldo experimento para identificar células transfectadas.
- Se as células transfectadas ainda mostram os tempos de ciclo mais longo de células, repita o passo 1, mas transfectar menos sonda ou selecione para clones estáveis que contêm quantidades muito baixas de sonda.
- Se as células transfectadas mostram os tempos de ciclo celular normal, na ausência de luz fluorescente, repita o passo 2, mas menor exposição modificando binning, filtros de densidade neutra, tempo de exposição eo tempo entre as imagens.
4. Analisando FRET
- A análise pode ser realizada pela maioria dos software dedicado à microscopia. Aqui nós descrevemos como realizar a análise utilizando o ImageJ freeware ( http://rsb.info.nih.gov/ij ) utilizando o plugin Relação Plus ( http://imagej.nih.gov/ij/plugins/ratio-plus . html ).
- Abra as imagens no ImageJ. No caso suas imagens estão no formato de um Stac multicolork (por exemplo, Deltavision), separar os canais individuais pelo primeiro convertê-los para um hyperstack: Image-hyperstack-stack para hyperstack e posteriormente dividi-los com pilhas de canal único usando: Image-hyperstack-reduzir a dimensionalidade
- Multiplique o YFPex - pilha YFPem com 3 usando: Processo de Math-Multiply Este passo é opcional, pois se destina apenas a aumentar a clareza visual das imagens, garantindo que os rácios não estão na faixa entre 0 e 1.
- No YFPex - pilha YFPem, desenhe uma região de interesse (ROI) em uma área que é desprovida de células, mas que está perto de uma célula a ser medido. Células diferentes na mesma imagem pode exigir diferentes regiões, tanto como de fundo e intensidade do sinal normalmente é mais forte no centro de uma imagem.
- Adicione o ROI de ROI manager: Analise-tools-ROI gerente.
- Medir a intensidade média do ROI em ambos os YFPex - YFPem eo CFPex - pilha YFPem: Analisar-Medida .
- Repita em intervalo de tempo múltiplos e verificar que as intensidades de fundo perto da célula de interesse são semelhantes ao longo do filme.
- Definir medidas para incluir a intensidade mínima: Analise-Set medições-Min e Max valor de cinza.
- Desenhar uma região de interesse cobrindo a maior parte de uma célula e medir a intensidade mínima em ambos os YFPex - YFPem eo CFPex - pilha YFPem. Pegue a diferença entre a intensidade medida mínima e da intensidade de fundo de 4,6 e dividir por dois. Isso fornece uma estimativa de partida para um valor de corte.
- Além disso Relação aberta. Selecione o YFPex - YFPem eo CFPex - pilha YFPem. Para FRET relação, selecione CFPex - YFPem como a pilha 1, para invertida FRET relação visualizar sondas FRET onde diminui a eficiência sobre a fosforilação, selecione YFPex - YFPem como a pilha 1.
- Inserir as intensidades de fundo medida e os valores de corte.
- Definir o dimensionamento da pilha relação resultante e aplicar um olhar adequado up table (LUT) para visualizar mudanças de relação.
5. Resultados representante
Plk1 primeira atividade é visível no núcleo em fase G2 e picos durante a mitose. A Figura 3 mostra um experimento usando as configurações fototoxicidade mínima, conforme descrito na seção 2. Por favor note que este é um resultado representativo inicial e que as condições de exposição ou o tempo entre as imagens pode ser modificado para aumentar a relação sinal-ruído ou a resolução temporal. Mostra a figura 3D que a maioria das células que expressam a sonda proliferam com um tempo de ciclo celular entre 20 e 25 horas, indicando que as condições de imagem e níveis de expressão da sonda não afetam timings ciclo celular. Embora não haja ruído considerável, a tendência de Plk1 atividade crescente no G2 e mitose atingindo o pico em 14 é claramente visível (fig. 3A). Processamento dos dados brutos, aqui pela média filtragem apresentado como um quimógrafo (fig. 3B), ou quantificação do ra média invertida tio (fig. 3C) pode melhorar a clareza.
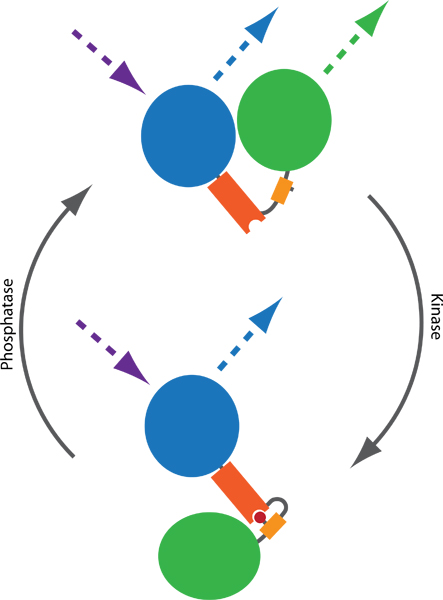
Figura 1. Princípio de uma sonda FRET baseado para monitorar as atividades quinase e fosfatase. Dois fluoróforos, tipicamente PCP (azul) e YFP (verde), são conectados por um domínio fosfo-binding (laranja) e uma seqüência fosforilável (amarelo). Fosforilação (vermelho) a mediação obrigatória para o domínio fosfo-binding, induzindo uma mudança conformacional na sonda. O conformacional alteração resulta em uma diferença na distância ou orientação entre os dois fluoróforos, que afeta o FRET eficiência entre PCP e YFP. FRET pode ser visualizado pelo PCP emocionante e de monitorização das emissões YFP (linhas pontilhadas).

Figura 2. Esboço esquemático do procedimento experimental.
p_upload/3410/3410fig3.jpg "/>
Figura 3. Plk1 atividade é o primeiro visível no núcleo em fase G2 e picos durante a mitose. U2OS células expressando um FRET baseado sonda de monitoramento de atividade Plk1 9,14 foram filmados por 60 horas usando um Deltavision Spectris Sistema de imagens equipado com um objetivo 20x de ar NA 0,7 e uma lâmpada de mercúrio. Condições imagens foram selecionadas para causar fototoxicidade mínima, conforme descrito na seção 2, usando binning 4x e filtros de densidade neutra que 99% de bloco da luz recebida. A, representação de cores falsas de FRET relação invertida, seguindo uma célula através de 4 divisões. B, quimógrafo da célula mostrada na A depois de aplicar um filtro de média. C, quantificação do invertida FRET relação entre a célula mostrada na A. D, entrada mitótica acumulado de 50 FRET-sonda células que expressam, incluindo divisões de células-filhas.
Discussão
Monitoramento FRET todo o ciclo celular requer considerações que são menos cruciais na avaliação de curto prazo respostas a estímulos externos. Primeiro, a progressão do ciclo celular é facilmente perturbado por sinalização stress, exigindo que fototoxicidade é reduzido ao mínimo. Segundo, todos os repórteres podem afetar os processos celulares pela titulação fora quinases, fosfatases ou domínios de interação. A maneira provavelmente mais simples de avaliar se as condições experimentais são adequados é medir a duração do ciclo celular da mitose de mitose e compará-la com experimentos independentes de imagens de fluorescência e de expressão de uma sonda.
Um fator crucial no acompanhamento FRET relações ao longo do ciclo celular é para resistir à tentação de adquirir belas imagens com alta resolução. Embora as configurações exatas dependem da sensibilidade do sistema de microscópio e nível de expressão e da natureza do teste específico, é importante usarum nível de binning que corresponde ao que é absolutamente necessário para ver. Embora o tempo entre CFPex - YFPem e YFPex - YFPem imagens precisam ser rápidas para evitar alterações na morfologia das células, em nossas mãos é melhor para manter os tempos de exposição em mais de 0,1 segundo e reduzir a intensidade da luz fluorescente por meio de filtros de densidade neutra .
Como fototoxicidade afeta o ciclo celular depende muito dos níveis de expressão e localização da sonda. A sonda que está localizada a cromatina, por exemplo, a fusão com uma Histone, torna as células mais sensíveis à luz fluorescente, presumivelmente desde subprodutos fototóxicas são criados na vizinhança do DNA. Assim, é fundamental para monitorar as células que expressam níveis relativamente baixos dos repórteres e re-check do ciclo celular timings se localizar a sonda para diferentes estruturas subcelulares.
Experimentos de controle são necessárias várias para verificar se FRET está presente noconfiguração experimental e que refletem mudanças de relação de fosforilação real de uma sonda. Exceto controles funcionais, tais como a inibição ou esgotamento de uma quinase, é aconselhável a realização de experimentos bioquímicos para verificar se a sonda está fosforilada, a mutação do esperado do site fosfo aceitador de dentro da sonda a um resíduo não-fosforilável e aceitador fotobranqueamento para provar a ocorrência de FRET. Para um exemplo de uma validação extensiva, ver figura complementar 3 em ref 14.
Embora seja teoricamente preferível avaliar FRET mudanças, monitorando tanto PCP e emissão YFP, tais configurações são muito sensíveis ao foco muda e as condições de iluminação e pode facilmente levar a artefatos. Sensibilidade a mudanças foco é devido a aberração cromática, onde PCP e YFP de emissão não incidir sobre o mesmo ponto. Mudanças de iluminação dependem em grande parte alinhamento diferente do caminho da luz. Isto é particularmente importante quando se utiliza cubos de filtros contendoum espelho dicróico. Foco e mudar a iluminação pode ser reduzida usando objetivos corrigido e cuidadosamente alinhados cubos de filtros. No entanto, em nossa experiência, mantendo a constante do filtro de emissões dá resultados superiores, de preferência usando uma configuração com controle separado de excitação e filtros de emissão.
A magnitude da mudança observada FRET é reduzida pelo sangramento do PCP fluorescência para a emissão YFP filtro. Em caso bleedthrough é substancial, uma CFPex extra - CFPem imagem pode ser adquirido para corrigir bleedthrough no CFPex - YFPem imagem. No entanto, tais correções são muito sensíveis às diferenças e se concentrar pode introduzir artefatos. Além disso, eles exigem uma imagem extra, que pode produzir fototoxicidade.
Embora menos de um problema quando somente monitoramento de emissões YFP, mantendo as células em foco durante a 24h + time-lapse experiência pode ser um desafio. Para evitar desvios de foco, certifique-se que o microscópioeo prato é pré-aquecido e que a temperatura na sala não flutua. Como alternativa, use um sistema de focagem automática que não é baseada em imagens da sonda transfectadas.
A escolha de qual objetivo usar depende da aplicação particular. Uma base de óleo objetivo NA alta recolhe mais luz e dá maior resolução, mas é mais sensível a mudanças e foco é impraticável em alta de conteúdo setups. Nós preferimos usar o objectivo de ar com um NA relativamente alta para estudar citoplasmática ou nuclear FRET-razões, e usar alto NA objetivos do petróleo apenas quando maior a resolução subcelulares é necessária.
Este artigo discute um método simples de filme baseado em sondas FRET através do ciclo celular que usa equipamentos que são comumente disponíveis para pesquisadores de ciências da vida e muitos exigem um conhecimento basal de microscopia e processamento de imagens. Alternativas mais especializadas incluem o uso de feixe de splitters, Lifetime Fluorescência Microscopy (FLIM) 1 e software para automatizar 16 objeto de segmentação e de cálculo da relação de FRET 17.
Divulgações
Não temos nada a revelar.
Agradecimentos
Os autores são apoiados pelo Conselho de Pesquisa sueco, a fundação sueca para pesquisas estratégicas, a sociedade de câncer sueco, a sociedade do câncer sueco criança, Wibergs Åke fundação e fundamento Jeanssons.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente | Número Catálogo | Companhia | |
| Leibovitz L-15, sem vermelho de fenol | 21083-027 | GIBCO, pela Life Technologies | |
| DMEM + Glutamax-I | 31966 | GIBCO, pela Life Technologies | |
| De soro fetal bovino (FBS) | SV30160.03 | HyClone | |
| 0,05% Tripsina EDTA | SH30236.01 | HyClone | |
| Penicilina-estreptomicina | SV30010 | HyClone | |
| DPBS | 14287 | GIBCO, pela Life Technologies | |
| Puromicina | P8833 | Sigma-Aldrich |
Referências
- Sun, Y., Wallrabe, H., Seo, S. A., Periasamy, A. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth. Chemphyschem. 12, 462-474 (2011).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochem. Biophys. Res. Commun. 348, 716-721 (2006).
- Kunkel, M. T., Ni, Q., Tsien, R. Y., Zhang, J., Newton, A. C. Spatio-temporal dynamics of protein kinase B/Akt signaling revealed by a genetically encoded fluorescent reporter. J. Biol. Chem. 280, (2005).
- Violin, J. D., Zhang, J., Tsien, R. Y., Newton, A. C. A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase. C. J. Cell. Biol. 161, 899-909 (2003).
- Kunkel, M. T., Toker, A., Tsien, R. Y., Newton, A. C. Calcium-dependent regulation of protein kinase D revealed by a genetically encoded kinase activity reporter. Journal of Biological Chemistry. 282, 6733-6742 (2007).
- Harvey, C. D. A genetically encoded fluorescent sensor of ERK activity. Proc. Natl. Acad. Sci. U.S.A. 105, 19264-19269 (2008).
- Fosbrink, M., Aye-Han, N. N., Cheong, R., Levchenko, A., Zhang, J. Visualization of JNK activity dynamics with a genetically encoded fluorescent biosensor. Proc. Natl. Acad. Sci. U.S.A. 107, 5459-5464 (2010).
- Gavet, O., Pines, J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Dev. Cell. 18, 533-543 (2010).
- Fuller, B. G. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453, 1132-1136 (2008).
- Ni, Q., Titov, D. V., Zhang, J. Analyzing protein kinase dynamics in living cells with FRET reporters. Methods. 40, 279-286 .
- Morgan, D. O. . The cell cycle : principles of control. , (2007).
- Lindqvist, A., Rodriguez-Bravo, V., Medema, R. H. The decision to enter mitosis: feedback and redundancy in the mitotic entry network. J. Cell. Biol. 185, 193-202 (2009).
- Gavet, O., Pines, J. Activation of cyclin B1-Cdk1 synchronizes events in the nucleus and the cytoplasm at mitosis. J. Cell. Biol. 189, 247-259 (2010).
- Macurek, L. Polo-like kinase-1 is activated by aurora A to promote checkpoint recovery. Nature. 455, 119-123 (2008).
- van der Eb, A. J., Graham, F. L. Assay of transforming activity of tumor virus DNA. Methods. Enzymol. 65, 826-839 (1980).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. Biotechniques. 42, 71-75 (2007).
- Roszik, J., Lisboa, D., Szollosi, J., Vereb, G. Evaluation of intensity-based ratiometric FRET in image cytometry--approaches and a software solution. Cytometry A. 75, 761-767 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados