Method Article
通过细胞周期激酶和磷酸酶活性成比例的FRET监测
摘要
基于FRET的记者越来越多地用于监测活细胞中的激酶和磷酸酶的活动。在这里,我们描述了如何使用基于FRET的记者,以评估目标磷酸化细胞周期依赖性变化的方法。
摘要
福斯特共振能量转移(FRET)为基础的记者1允许在活细胞中的内源性蛋白激酶和磷酸酶活性的评估。这种探头通常由CFP和YFP的变种,由phosphorylatable序列和磷酸结合结构域进行干预。磷酸化后,探头改变构象,CFP和YFP之间的距离或方向的变化,结果,导致在变化FRET效率(图1)。几个探头在过去十年中,已公布的监测多个激酶和磷酸酶的活性的平衡,其中包括,PKD的5 4 3 PKB,PKC,ERK的6,7 JNK 的 CDK 18, 极光B 9 2,PKA的记者和 PLK1 9 。鉴于模块化设计,额外的探头有可能出现在不久的将来10。
通过细胞周期的进展是受压力signali吴途径11。值得注意的是,不同的细胞周期调节在不受干扰的增长,而当细胞恢复应力 12。定时通过细胞周期的细胞成像,因此需要特别小心。这将成为一个问题,尤其是当用人比例成像,因为两个图像具有很高的信噪比,需要正确地解释结果。成比例的FRET成像细胞周期依赖激酶和磷酸酶活性的变化为主被限制在细胞周期 8,9,13,14分节。
在这里,我们讨论的方法来监视基于FRET的探头使用整个人类的细胞周期的比例成像。方法依赖于设备,是在生命科学领域的许多研究人员,并不需要显微镜或图像处理专业知识。
研究方案
1。探头引入到细胞
- 一个基于FRET的探头和质粒抗共转染的细胞。选择转染的方法,该方法是有效的,在你感兴趣的细胞类型。对于U2OS细胞,标准的磷酸钙转染方法给予足够的结果15。
- 选择适当的抗生素至少7天的细胞。这丰富的数额细胞表达探头和限制有毒的表达水平,表达水平,严重影响细胞周期的细胞量。
- (可选)选择稳定的克隆。
- 使用固定或活细胞,验证这两个CFP和YFP在大约相同比例的所有细胞中。
- 细胞的情况下,一些只包含CFP或YFP的,有可能发生重组。重组可以发生在细菌生长或转染后的探针,并可能在后一种情况下,依靠质粒质量。重复质粒p赔偿和线性质粒转染前,如果问题仍然存在。
2。监测比例的FRET
- 玻璃底菜,或安装在一腔盖玻片上的种子细胞。确保菜/盖玻片没有1.5(170微米厚)。
- 山无酚红机动epifluorescence显微镜设置为37 ° C温度控制细胞生长培养基确保媒体CO 2或使用CO 2独立的媒体,如利博维茨- 15,pH调节。
- 使用透射光细胞聚焦。别看在使用荧光灯细胞。
- 开始通过收购12位或16位图像YFP的激励(YFPex)和YFP的排放(YFPem)过滤器和一个合适的分色镜。使用最大分级,仍允许亚细胞所需的决议。使用高分级,以减少曝光时间或强度是至关重要的,以避免光毒性。
- 我通过测量或估计粗糙的平均,最小和最大像素值,在一个地区缺乏细胞asure或估计的背景强度和近似噪音。更改曝光时间和中性密度滤光片,在细胞内的平均的信号大约是背景强度加五到十倍的最大和最小的背景强度之间的差异。
- 检查图像不接近饱和。在图像的最大强度应小于允许强度的差异,当细胞进入有丝分裂的动态范围(例如最大2000)在12位图像的一半。
- 重复步骤2.4至2.6使用CFP激发和YFP排放过滤器和一个合适的分色镜。
- 选择与转染细胞的多个地区,不包括点2.4至2.7的地区,并确保最大强度是不到一半在所有细胞中的动态范围。
- 启动时间推移实验,获得两个图像,每45分钟使用YFPex - YFPem和CFPex - YFPem过滤器设置。
3。验证和优化条件
- 打开采集到的图像和监控探针转染的细胞表达有丝分裂有丝分裂的细胞周期时间。
- 测量的细胞周期时间比较公布的数据用的细胞类型。另外,电影未转染细胞获得一个图像只透射光(如DIC或相衬)每隔一小时,参考细胞周期时间。
- 在情况下,从有丝分裂有丝分裂的时间相对应的参考细胞周期的时间,继续步骤4。另外,重新获取图像更难曝光,更多的时间点或多个Z -水平并重复步骤3。
- 如果从有丝分裂有丝分裂的时间不符合参考细胞周期的时间,电影转染细胞在年底取得一个图像只透射光(如DIC或相衬),其次是一个图像的每一个小时实验,以确定转染细胞。
- 如果仍然显示转染细胞细胞周期较长时间,重复第1步,但转染少探头或选择包含探头的数量非常低的稳定的克隆。
- 如果转染的细胞显示正常的细胞周期时间,在荧光灯下,重复第2步,但降低风险,通过修改分级,中性密度滤镜,曝光时间,以及图像之间的时间。
4。分析的FRET
- 专门到显微镜的大多数软件,可以进行分析。在这里,我们描述了如何执行分析使用免费ImageJ( http://rsb.info.nih.gov/ij )利用插件比加( http://imagej.nih.gov/ij/plugins/ratio-plus 。HTML )。
- 打开ImageJ的图像。如果您的图片格式的多色STACK(例如Deltavision),首先将它们转换为一个hyperstack单独的个别通道: 图像hyperstack栈hyperstack,随后分裂单通道堆栈使用: 图像hyperstack减少维
- 乘以YFPex - 3使用YFPem栈: 过程数学乘法这一步是可选的,因为它是唯一旨在确保该比率在0和1之间的范围,增加图像的视觉清晰度。
- 在YFPex - YFPem栈,绘制细胞缺乏的区域(ROI)兴趣的地区,但接近到要测量的细胞。不同的细胞在相同的图像可能需要不同的地区,作为背景和信号强度通常是最强的,在图像的中心。
- 经理的投资回报率的投资回报率分析工具的投资回报率经理 。
- 测量都YFPex的投资回报率的平均强度- YFPem和CFPex - YFPem堆栈:分析测量。
- 在多个时间点重复和验证,背景强度接近细胞的利益是整个电影类似。
- 设置包括最小强度: 分析设置测量最小和最大灰度值的测量 。
- 画一个涵盖了细胞的大部分利益的地区和措施,在双方的YFPex最小强度 - YFPem和CFPex - YFPem堆栈。从4.6测得的最小强度和背景强度之间的差异和除以二。这提供了一个剪切值开始估计。
- 打开比加。选择YFPex - YFPem和CFPex - YFPem栈。 FRET的比例,选择CFPex - YFPem栈1,倒FRET的比例可视化探针FRET后磷酸化效率降低,选择YFPex - YFPem栈1。
- 将测得的背景强度和剪切值。
- 设置缩放比例栈和应用合适的外观üP表(LUT)的可视化比例的变化。
5。代表性的成果
PLK1活动是第一次在G2期和有丝分裂期间的峰细胞核中可见。图3显示了一个实验,用最小的光毒性设置在第2所述。请注意,这是一个有代表性的初步结果,并曝光条件或图像之间的时间可以进行修改,以提高信号的信噪比或时间分辨率。图3D显示,多数表达探头细胞增殖与细胞周期时间的20至25小时,表明探头成像条件和表达水平不影响细胞周期的时间。虽然有相当大的噪音,PLK1活动增加的趋势在G2和有丝分裂14调峰清晰可见(图3A)。加工的原始数据,这里所讲均值滤波作为一个kymograph(图3B),或量化的平均倒RA氧化钛(图3C)可以提高清晰度。
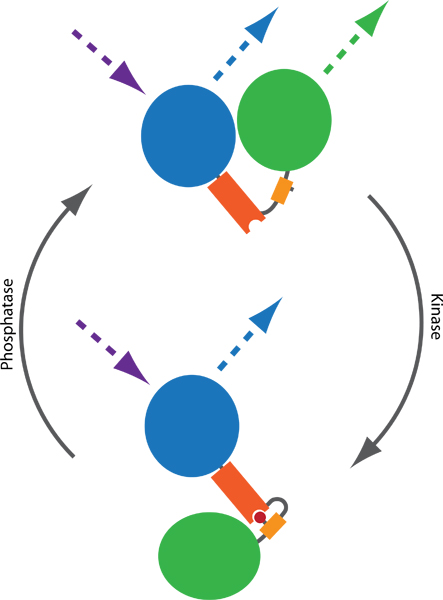
图1:一个基于FRET的探头原则,以监察激酶和磷酸酶的活动。两个荧光基团,通常CFP(蓝色)和YFP(绿色),是由一个磷酸结合结构域(橙色)和phosphorylatable序列(黄色)连接。磷酸化(红色)介导的磷酸化结合结构域结合,从而诱导在探头的构象变化。的两个荧光基团,从而影响了FRET CFP和YFP之间的效率之间的距离或方向不同的构象变化的结果。 FRET技术可以通过令人兴奋的CFP和监测YFP的发射(虚线)的可视化。

图2实验过程的示意图大纲。
p_upload/3410/3410fig3.jpg“/>
图3。PLK1活动首先在G2期和有丝分裂期间的峰细胞核中可见。 U2OS细胞表达一个基于FRET的探头监控PLK1活动9,14摄制60小时使用一个Deltavision百吉成像系统,配备了20倍不适用0.7空中目标和汞灯。成像条件造成最小的光毒性,在第2条所述,使用4X binning和中性密度滤光片块99%的入射光。倒的FRET比虚假的颜色表示,通过4个师的一个细胞。 B,在A所示的应用均值滤波后的细胞kymograph。 C,量化的倒FRET在A D所示的细胞的比例,累计有丝分裂条目50的FRET探针表达的细胞,包括子细胞的分裂。
讨论
监测苦恼整个细胞周期需要评估短期应对外部刺激时,是同样重要的的考虑。首先,细胞周期的进程很容易扰动压力信号,要求保持在最低限度,光毒性。其次,所有的记者可能影响滴定激酶,磷酸或相互作用域的细胞过程。可能是最简单的方法来评估,如果有足够的实验条件来衡量细胞周期的长度从有丝分裂有丝分裂和独立实验的荧光成像探针表达比较。
在监测的关键因素FRET整个细胞周期的比例是抵御诱惑,获取高分辨率的美丽图像。虽然确切的设置取决于显微镜系统和表达水平和性质的特殊探头的灵敏度,重要的是要使用一个级别的分级对应的是什么,看到的是绝对必要的。虽然CFPex之间的时间 - YFPem和YFPex - YFPem图像需要短,以避免在细胞形态变化,在我们手中,这是更好地保持在超过0.1秒的曝光时间,并降低中性密度滤光片强度荧光灯。
如何光毒性的细胞周期影响,在很大程度上取决于探头的表达水平和本地化。一个是局部染色质的探头,例如与组蛋白的融合,使细胞更敏感的日光灯,大概是因为光毒副产品在DNA附近创建。因此至关重要的是,来监测细胞表达水平相对较低的记者和细胞周期的时间重新检查,如果不同的亚细胞结构本地化探头。
需要几个控制实验来验证,FRET技术在目前实验装置和比例的变化反映了探针的实际磷酸化。除功能的控制,如抑制或激酶的枯竭,最好是进行生化实验来验证探头是磷酸,预期内磷酸化的受体探针现场非phosphorylatable残留的突变,受体漂白到证明FRET的发生。对于一个广泛的验证的例子,见补充图3参14。
虽然这在理论上是最好同时监控CFP和YFP的排放,这样的设置是非常敏感的焦点变化和光照条件,很容易导致以文物评估的FRET变化。灵敏度重点的变化是由于色差,CFP和YFP的排放不集中的相同点。光照变化在很大程度上取决于不同的对齐光路。使用含有过滤器的多维数据集时,这是尤为突出分色镜。对焦和光照变化可以减少使用纠正仔细对齐的目标和过滤器的多维数据集。然而,在我们的经验,保持排放滤波常数为优异的业绩,最好使用一个单独的控制与激发和发射滤波器设置。
观察FRET的变化幅度减少bleedthrough CFP荧光YFP的排放过滤器。案件bleedthrough是巨大的,额外的CFPex - CFPem图像可以获取正确bleedthrough到CFPex - YFPem形象。然而,这样的更正是非常敏感的的重点差异,可能会引入文物。此外,他们还需要一个额外的形象,这可能会产生光毒性。
虽然是一个问题,只监测YFP的排放,保持对焦在整个24小时的细胞+时间推移实验可以具有挑战性的这种服务的时。为了避免焦点漂移,确保在显微镜和菜是预先加热,并在房间内的温度不会波动。另外,使用不转探头成像自动对焦系统。
使用目标的选择取决于特定的应用。收集更多的光线,石油为基础的高NA目标,提供了更高的分辨率,但重点的变化更为敏感,高含量的设定不切实际。我们更喜欢使用一个相对高NA的空气的目标,研究细胞质或核FRET的比率,并使用高NA石油的目标,只有当需要更高的亚细胞分辨率。
本文讨论了一个简单的方法基于FRET的探头使用设备通常提供许多生命科学的研究人员,只需要一个显微镜和图像处理的基础知识,通过细胞周期的电影。更专业的替代品,包括束分离器的使用,荧光寿命中号icroscopy(FLIM)1,软件自动对象分割16和计算FRET比17。
披露声明
我们什么都没有透露。
致谢
作者支持由瑞典研究委员会,瑞典战略研究,瑞典癌症协会,瑞典的儿童癌症协会,阿克Wibergs基础和Jeanssons基础的基础。
材料
| Name | Company | Catalog Number | Comments |
| 试剂 | 目录编号 | 公司 | |
| 莱博维茨的L - 15,无酚红 | 21083-027 | GIBCO公司,生命科技 | |
| 的DMEM + Glutamax,我 | 31966 | GIBCO公司,生命科技 | |
| 胎牛血清(FBS) | SV30160.03 | Hyclone公司 | |
| 0.05%胰蛋白酶EDTA | SH30236.01 | Hyclone公司 | |
| 青霉素链霉素 | SV30010 | Hyclone公司 | |
| DPBS | 14287 | GIBCO公司,生命科技 | |
| 嘌呤霉素 | P8833 | Sigma - Aldrich公司 |
参考文献
- Sun, Y., Wallrabe, H., Seo, S. A., Periasamy, A. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth. Chemphyschem. 12, 462-474 (2011).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochem. Biophys. Res. Commun. 348, 716-721 (2006).
- Kunkel, M. T., Ni, Q., Tsien, R. Y., Zhang, J., Newton, A. C. Spatio-temporal dynamics of protein kinase B/Akt signaling revealed by a genetically encoded fluorescent reporter. J. Biol. Chem. 280, (2005).
- Violin, J. D., Zhang, J., Tsien, R. Y., Newton, A. C. A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase. C. J. Cell. Biol. 161, 899-909 (2003).
- Kunkel, M. T., Toker, A., Tsien, R. Y., Newton, A. C. Calcium-dependent regulation of protein kinase D revealed by a genetically encoded kinase activity reporter. Journal of Biological Chemistry. 282, 6733-6742 (2007).
- Harvey, C. D. A genetically encoded fluorescent sensor of ERK activity. Proc. Natl. Acad. Sci. U.S.A. 105, 19264-19269 (2008).
- Fosbrink, M., Aye-Han, N. N., Cheong, R., Levchenko, A., Zhang, J. Visualization of JNK activity dynamics with a genetically encoded fluorescent biosensor. Proc. Natl. Acad. Sci. U.S.A. 107, 5459-5464 (2010).
- Gavet, O., Pines, J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Dev. Cell. 18, 533-543 (2010).
- Fuller, B. G. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453, 1132-1136 (2008).
- Ni, Q., Titov, D. V., Zhang, J. Analyzing protein kinase dynamics in living cells with FRET reporters. Methods. 40, 279-286 .
- Morgan, D. O. . The cell cycle : principles of control. , (2007).
- Lindqvist, A., Rodriguez-Bravo, V., Medema, R. H. The decision to enter mitosis: feedback and redundancy in the mitotic entry network. J. Cell. Biol. 185, 193-202 (2009).
- Gavet, O., Pines, J. Activation of cyclin B1-Cdk1 synchronizes events in the nucleus and the cytoplasm at mitosis. J. Cell. Biol. 189, 247-259 (2010).
- Macurek, L. Polo-like kinase-1 is activated by aurora A to promote checkpoint recovery. Nature. 455, 119-123 (2008).
- van der Eb, A. J., Graham, F. L. Assay of transforming activity of tumor virus DNA. Methods. Enzymol. 65, 826-839 (1980).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. Biotechniques. 42, 71-75 (2007).
- Roszik, J., Lisboa, D., Szollosi, J., Vereb, G. Evaluation of intensity-based ratiometric FRET in image cytometry--approaches and a software solution. Cytometry A. 75, 761-767 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。