Method Article
Activités de surveillance kinase et la phosphatase dans le cycle cellulaire par Ratiométrique FRET
Dans cet article
Résumé
FRET basée sur les journalistes sont de plus en plus utilisées pour suivre les activités kinases et de phosphatases dans les cellules vivantes. Nous décrivons ici une méthode sur la façon d'utiliser FRET basé journalistes afin d'évaluer le cycle cellulaire dépendante des changements dans la phosphorylation cible.
Résumé
Förster résonance de transfert d'énergie (FRET) basé sur une reporters permettre l'évaluation de la kinase endogène et activités phosphatase dans des cellules vivantes. Ces sondes sont généralement constitués de variantes du CFP et YFP, est intervenu par une séquence phosphorylable et un domaine phospho-contraignant. Après phosphorylation, la conformation sonde change, ce qui entraîne un changement de la distance ou l'orientation entre le CFP et YFP, conduisant à un changement dans l'efficacité de FRET (Fig 1). Plusieurs sondes ont été publiés durant la dernière décennie, la surveillance de l'équilibre d'activité des kinases et phosphatases multiples, y compris les journalistes de la PKA 2, PKB 3, 4 PKC, PKD 5, 6 ERK, JNK 7, CDK 18, Aurora B 9 et 9 PLK1 . Compte tenu de la conception modulaire, les sondes supplémentaires sont susceptibles d'émerger dans le proche avenir 10.
La progression dans le cycle cellulaire est affectée par le stress signaling voies 11. Notamment, le cycle cellulaire est régulée différemment pendant imperturbable croissance par rapport à quand les cellules se remettent du stress 12. Imagerie time-lapse de cellules dans le cycle cellulaire nécessite donc des précautions particulières. Cela devient un problème particulier lors de l'utilisation d'imagerie ratiométrique, puisque deux images avec un signal élevé par rapport au bruit sont nécessaires pour interpréter correctement les résultats. Ratiométrique FRET imagerie des modifications du cycle cellulaire dépendante des activités kinase et phosphatase a essentiellement été limité à des sous-sections du cycle cellulaire 8,9,13,14.
Ici, nous discutons d'une méthode pour surveiller FRET basée sur des sondes à l'aide d'imagerie ratiométrique au long du cycle cellulaire humain. La méthode repose sur l'équipement qui est disponible pour de nombreux chercheurs en sciences de la vie et ne nécessite pas de connaissances d'experts de la microscopie ou de traitement d'image.
Protocole
1. Introduire la sonde à cellules
- Co-transfection de cellules avec une sonde FRET base et une résistance plasmidique conférant. Choisissez une méthode de transfection qui est efficace dans votre cellule-type d'intérêt. Pour les cellules U2OS, les méthodes classiques de transfection de phosphate de calcium donnent des résultats adéquats 15.
- Sélectionnez les cellules dans l'antibiotique approprié pendant au moins sept jours. Ceci enrichit la quantité de cellules exprimant la sonde et limite la quantité de cellules avec des niveaux d'expression toxiques, ou les niveaux d'expression qui affectent sévèrement le cycle cellulaire.
- (Facultatif) Sélectionnez des clones stables.
- En utilisant des cellules fixes ou en direct, vérifier que les deux CFP et YFP sont présents dans toutes les cellules à peu près le même ratio.
- Dans le cas de certaines cellules ne contiennent que des CFP ou YFP, la recombinaison a probablement eu lieu. La recombinaison peut se produire pendant la croissance bactérienne ou après transfection de la sonde et peut dans ce dernier cas dépendra de la qualité de plasmide. Répétez plasmide préparation et de linéariser le plasmide avant la transfection, si le problème persiste.
2. Ratiométrique surveillance FRET
- Cellules semences sur des plats à fond de verre, ou des lamelles pour le montage dans une chambre. Assurez-vous que les plats / lamelles sont pas 1.5 (170 um d'épaisseur).
- Mont cellules dans un milieu de croissance sans rouge de phénol sur un microscope à épifluorescence motorisée avec contrôle de température réglée sur 37 ° C. Assurer la régulation du pH des médias, soit par le CO 2 ou en utilisant le CO 2-médias indépendants tels que Liebowitz-15.
- Focus sur les cellules en utilisant la lumière transmise. Ne cherchez pas sur les cellules en utilisant la lumière fluorescente.
- Commencez par acquérir une image de 12 ou 16 bits en utilisant une excitation YFP (YFPex) et YFP émission (YFPem) filtres et d'un miroir dichroïque adaptée. Utilisez binning maximal disponible qui permet encore la résolution requise subcellulaire. L'utilisation d'un binning haute pour diminuer le temps d'exposition ou l'intensité est cruciale pour éviter la phototoxicité.
- MeAsure ou estimer l'intensité du bruit de fond et approximative en mesurant ou en estimant la moyenne approximative, les valeurs minimales et maximales des pixels dans une zone dépourvue de cellules. Changer le temps d'exposition et les filtres de densité neutre de sorte que la moyenne du signal dans la cellule est d'environ de l'intensité de fond et de cinq à dix fois la différence entre max et l'intensité de base min.
- Vérifiez que les images ne sont pas près d'être saturé. L'intensité maximale de l'image doit être inférieure à la moitié de la plage dynamique (par exemple max 2000 en une image 12 bits) pour permettre des différences d'intensité lorsque les cellules entrent mitose.
- Répétez l'étape 2.4 à 2.6 en utilisant une excitation PCP et filtres d'émission YFP et un miroir dichroïque adaptée.
- Sélectionner plusieurs régions avec des cellules transfectées, en excluant les régions utilisées pour le point 2.4 à 2.7, et de s'assurer que l'intensité maximale est inférieure à la moitié de la plage dynamique dans toutes les cellules.
- Démarrer une expérience time-lapse d'acquérir deux images toutes les 45 min à l'aide YFPex - YFPem et CFPex - YFPem jeux de filtres.
3. Vérification et optimisation des conditions
- Ouvrez les images acquises et de surveiller le temps du cycle cellulaire de la mitose à la mitose des cellules qui expriment la sonde transfectées.
- Comparez le temps cellulaire mesurée cycle à données publiées pour le type de cellules utilisées. Alternativement, le film non transfectées cellules par l'acquisition d'une image de la lumière transmise uniquement (DIC par exemple ou en contraste de phase) toutes les heures pour obtenir des temps de référence du cycle cellulaire.
- Dans le cas du temps de la mitose à la mitose correspond à la référence horaires du cycle cellulaire, passez à l'étape 4. Alternativement, ré-acquérir des images en utilisant davantage l'exposition, plus de temps-points ou de multiples niveaux et z répétez l'étape 3.
- Dans le cas du temps de la mitose à la mitose ne correspond pas à référencer les horaires du cycle cellulaire, le film de cellules transfectées par l'acquisition d'une image de la lumière transmise uniquement (par exemple, DIC ou à contraste de phase) toutes les heures suivies d'une image à la finde l'expérience pour identifier les cellules transfectées.
- Si les cellules transfectées montrent encore les temps de cycle plus long cellulaire, répétez l'étape 1, mais moins transfecter sonde ou de sélectionner des clones stables qui contiennent des quantités très faibles de la sonde.
- Si les cellules transfectées montrent les temps normaux du cycle cellulaire en l'absence de lumière fluorescente, répétez l'étape 2 mais inférieur à l'exposition en modifiant binning, les filtres de densité neutre, le temps d'exposition, et le temps entre les images.
4. L'analyse de FRET
- L'analyse peut être effectuée par la plupart des logiciels dédiés à la microscopie. Nous décrivons ici comment effectuer l'analyse en utilisant le logiciel gratuit ImageJ ( http://rsb.info.nih.gov/ij ) en utilisant le plug-in Ratio Plus ( http://imagej.nih.gov/ij/plugins/ratio-plus . html ).
- Ouvrez les images dans ImageJ. Dans le cas de vos images sont dans le format d'un STAC multicolork (par exemple DeltaVision), séparer les canaux individuels d'abord en les convertissant en une HyperStack: Image-HyperStack-pile pour HyperStack et ensuite les partager aux piles utilisant un seul canal: Image-HyperStack-réduire la dimensionnalité
- Multipliez le YFPex - pile YFPem avec 3 à l'aide: Processus de-Math-Multiply Cette étape est facultative, car elle est uniquement destinée à accroître la clarté visuelle des images en faisant en sorte que les ratios ne sont pas dans la gamme entre 0 et 1.
- Dans le YFPex - pile YFPem, dessiner une région d'intérêt (ROI) dans une zone qui est dépourvu de cellules, mais qui est proche d'une cellule pour être mesurée. Différentes cellules dans la même image peut nécessiter différentes régions, à la fois comme arrière-plan et de l'intensité du signal est plus fort en général au centre d'une image.
- Ajouter le ROI d'un retour sur investissement responsable: Analyser-tools-ROI gestionnaire.
- Mesurer l'intensité moyenne du ROI dans les deux YFPex - YFPem et le CFPex - pile YFPem: Analyser-Mesure .
- Répéter à dosages répétés et vérifier que l'intensité de base proche de la cellule d'intérêt sont similaires tout au long du film.
- Set mesures pour y inclure l'intensité minimale: Analyser Set mesures-Min et Max grise de valeur.
- Dessinez une zone d'intérêt couvrant la plupart d'une cellule et mesurer l'intensité minimale dans les deux YFPex - YFPem et le CFPex - pile YFPem. Prenez la différence entre l'intensité mesurée minimale et l'intensité de fond de 4,6 et le diviser par deux. Cela donne une estimation de départ pour une valeur d'écrêtage.
- Ratio plus ouvert. Sélectionnez le YFPex - YFPem et le CFPex - pile YFPem. Pour FRET rapport, sélectionnez CFPex - YFPem que la pile 1, pour le FRET inversé ratio de visualiser les sondes FRET où diminue l'efficacité lors de la phosphorylation, sélectionnez YFPex - YFPem que la pile 1.
- Insérer les intensités de fond mesurée et les valeurs d'écrêtage.
- Réglez la mise à l'échelle de la pile ratio qui en résulte et d'appliquer un u look adaptép table (LUT) pour visualiser changements de rapport.
5. Les résultats représentatifs
PLK1 l'activité est d'abord visible dans le noyau en phase G2 et les sommets lors de la mitose. La figure 3 montre une expérience en utilisant les paramètres de phototoxicité minimale telle que décrite dans la section 2. S'il vous plaît noter que ceci est un résultat représentatif initial et que les conditions d'exposition ou de temps entre les images peuvent être modifiées pour augmenter rapport signal-bruit ou de la résolution temporelle. La figure montre en 3D que la majorité des cellules exprimant la sonde prolifèrent avec un temps de cycle cellulaire entre 20 et 25 heures, indiquant que les conditions d'imagerie et de niveaux d'expression de la sonde n'affectent pas les horaires du cycle cellulaire. Bien qu'il y ait beaucoup de bruit, la tendance des PLK1 activité croissante dans G2 et un pic dans la mitose 14 est clairement visible (figure 3A). Traitement des données brutes, ici signifie filtrage présenté comme un kymographe (figure 3B), ou la quantification de la moyenne de la PR inversé tio (figure 3C) peut améliorer la clarté.
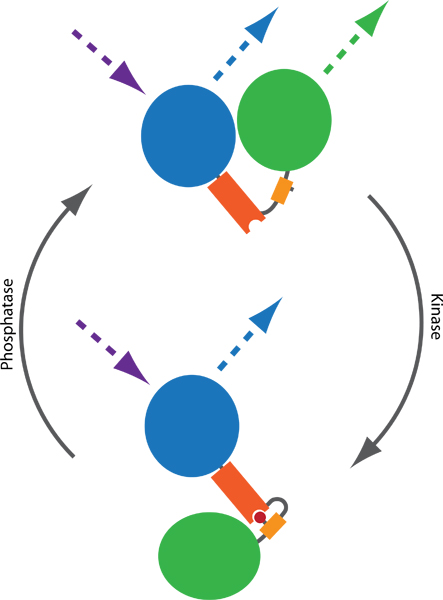
Figure 1. Principe d'une sonde FRET basée à surveiller les activités kinases et de phosphatases. Deux fluorophores, généralement CFP (bleu) et YFP (en vert), sont reliés par un domaine phospho-contraignante (orange) et une séquence phosphorylable (jaune). Phosphorylation (rouge) médie liant au domaine phospho-contraignante, ce qui induit un changement conformationnel dans la sonde. Les résultats changement conformationnel dans une différence dans la distance ou l'orientation entre les deux fluorophores, qui affecte le FRET efficacité entre CFP et YFP. FRET peut être visualisé par PCP excitante et la surveillance des émissions de YFP (lignes pointillées).

Figure 2. Aperçu schématique de la procédure expérimentale.
p_upload/3410/3410fig3.jpg "/>
Figure 3. PLK1 l'activité est d'abord visible dans le noyau en phase G2 et les sommets lors de la mitose. Cellules exprimant un U2OS FRET basée sur la surveillance de sonde PLK1 activités ont été filmées pour 9,14 60 h en utilisant un système d'imagerie DeltaVision Spectris équipé d'un objectif 20x NA air 0,7 et une lampe au mercure. Conditions d'imagerie ont été choisis pour provoquer la phototoxicité minime, tel que décrit dans l'article 2, en utilisant binning 4x et filtres à densité neutre qui bloquent 99% de la lumière entrante. Une représentation, en fausses couleurs de FRET-ratio inversé, à la suite d'une cellule à 4 divisions. B, kymographe de la cellule représentée en A après avoir appliqué un filtre moyenneur. C, la quantification de l'inversion de FRET rapport de la cellule représentée en A. D, l'entrée en mitose cumulé de 50 FRET sonde cellules exprimant, y compris les divisions des cellules filles.
Discussion
Surveillance de FRET au long du cycle cellulaire nécessite des considérations qui sont moins cruciales lors de l'évaluation à court terme des réponses à des stimuli externes. Tout d'abord, la progression du cycle cellulaire est facilement perturbée par la signalisation du stress, exigeant que la phototoxicité est maintenu à un minimum. Deuxièmement, tous les journalistes peuvent potentiellement affecter les processus cellulaires en titrant sur les kinases, les phosphatases ou des domaines d'interaction. La façon probablement la plus simple pour évaluer si les conditions expérimentales sont adéquats pour mesurer la longueur du cycle cellulaire de la mitose à la mitose et de la comparer aux expériences indépendants de l'imagerie de fluorescence et d'expression d'une sonde.
Un facteur crucial dans le suivi des ratios de FRET au long du cycle cellulaire est de résister à la tentation d'acquérir de belles images à haute résolution. Bien que les paramètres exacts dépendent de la sensibilité du système de microscope et le niveau d'expression et la nature de la sonde particulière, il est important d'utiliserun niveau de binning qui correspond à ce qui est absolument nécessaire de voir. Bien que le temps entre CFPex - YFPem et YFPex - images YFPem doivent être courts pour éviter des changements dans la morphologie des cellules, dans nos mains, il est préférable de garder le temps d'exposition à plus de 0,1 secondes et de réduire l'intensité de la lumière fluorescente par des filtres de densité neutre .
Comment phototoxicité affecte le cycle cellulaire dépend en grande partie sur les niveaux d'expression et la localisation de la sonde. Une sonde qui est localisée à la chromatine, par exemple par fusion avec une histone, rend les cellules plus sensibles à la lumière fluorescente, sans doute, depuis les sous-produits phototoxiques sont créés dans le voisinage de l'ADN. Il est donc crucial de surveiller les cellules qui expriment des niveaux relativement bas des journalistes et de re-vérifier les horaires du cycle cellulaire, si la localisation de la sonde à différentes structures subcellulaires.
Plusieurs expériences de contrôle sont nécessaires pour vérifier que le FRET est présent dans ledispositif expérimental et que des changements réels rapport reflètent la phosphorylation d'une sonde. Sauf contrôles fonctionnels, tels que l'inhibition ou l'épuisement d'une kinase, il est conseillé d'effectuer des expériences biochimiques afin de vérifier que la sonde est phosphorylée, la mutation de l's'attend phospho-accepteur site dans la sonde à un résidu non phosphorylable, et l'accepteur d'photoblanchiment prouver la survenance de FRET. Pour un exemple d'une validation complète, voir la figure 3 supplémentaires en ref 14.
Bien qu'il soit théoriquement préférable d'évaluer les changements de FRET en surveillant le PCP et l'émission de la YFP, les configurations sont très sensibles aux changements de focus et les conditions d'éclairage et peut facilement conduire à des artefacts. Sensibilité aux changements de focus est due à l'aberration chromatique, où CFP et YFP émission ne se concentre pas sur le même point. Changements d'illumination dépendent en grande partie sur l'alignement des différentes le trajet lumineux. Ceci est particulièrement important lors de l'utilisation des cubes de filtration contenant desun miroir dichroïque. Focus et le changement d'illumination peuvent être réduites en utilisant des objectifs corrigés et soigneusement alignés cubes filtre. Cependant, dans notre expérience, en gardant la constante de filtre d'émission donne des résultats supérieurs, de préférence en utilisant une configuration avec contrôle séparé de l'excitation et les filtres d'émission.
L'ampleur de la hausse observée FRET changement est réduite par bleedthrough du PCP de fluorescence pour le filtre YFP émission. En cas bleedthrough est considérable, une CFPex supplémentaires - l'image CFPem peuvent être acquises pour corriger les bleedthrough dans le CFPex - image YFPem. Toutefois, de telles corrections sont très sensibles à l'accent différences et peut introduire des artefacts. En outre, ils nécessitent une image supplémentaire, ce qui peut produire la phototoxicité.
Bien que moins d'un problème lorsque seule une surveillance YFP d'émission, en gardant les cellules d'orientation tout au long de 24h + time-lapse expérience peut être difficile. Pour éviter les dérives de discussion, assurez-vous que le microscopeet le plat est pré-chauffé et que la température dans la salle ne fluctue pas. Sinon, utilisez un système autofocus qui n'est pas basée sur l'imagerie de la sonde transfectées.
Le choix de l'objectif à utiliser dépend de l'application particulière. Une huile à base objective haute NA recueille plus de lumière et donne une résolution accrue, mais elle est plus sensible aux changements de focus et est peu pratique dans des configurations à haute teneur. Nous préférons utiliser un objectif de l'air avec un NA relativement élevé pour étudier cytoplasmique ou nucléaire FRET-ratios, et l'utilisation de haute NA objectifs huile que lorsque plus haute résolution subcellulaire est nécessaire.
Ce document examine une méthode simple de filmer FRET à base de sondes à travers le cycle cellulaire qui utilise des équipements qui sont couramment disponibles pour de nombreux chercheurs en sciences de la vie et ne nécessitent une connaissance basale de microscopie et de traitement d'image. Des alternatives plus spécialisés incluent l'utilisation de faisceaux répartiteurs, de vie de fluorescence Microscopy (FLIM) 1 et logiciels pour automatiser 16 segmentation d'objet et le calcul du ratio de 17 FRET.
Déclarations de divulgation
Nous n'avons rien à révéler.
Remerciements
Les auteurs sont soutenus par le Conseil de recherche suédois, la Fondation suédoise pour la recherche stratégique, la société du cancer suédois, la société suédoise de l'enfant le cancer, Wibergs Åke fondation et Jeanssons fondation.
matériels
| Name | Company | Catalog Number | Comments |
| Réactif | Numéro de catalogue | Société | |
| Leibovitz L-15, pas de rouge de phénol | 21083-027 | GIBCO, par Life Technologies | |
| DMEM + Glutamax-I | 31966 | GIBCO, par Life Technologies | |
| Sérum fœtal bovin (FBS) | SV30160.03 | HyClone | |
| 0,05% de trypsine EDTA | SH30236.01 | HyClone | |
| Pénicilline-streptomycine | SV30010 | HyClone | |
| DPBS | 14287 | GIBCO, par Life Technologies | |
| Puromycine | P8833 | Sigma-Aldrich |
Références
- Sun, Y., Wallrabe, H., Seo, S. A., Periasamy, A. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth. Chemphyschem. 12, 462-474 (2011).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochem. Biophys. Res. Commun. 348, 716-721 (2006).
- Kunkel, M. T., Ni, Q., Tsien, R. Y., Zhang, J., Newton, A. C. Spatio-temporal dynamics of protein kinase B/Akt signaling revealed by a genetically encoded fluorescent reporter. J. Biol. Chem. 280, (2005).
- Violin, J. D., Zhang, J., Tsien, R. Y., Newton, A. C. A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase. C. J. Cell. Biol. 161, 899-909 (2003).
- Kunkel, M. T., Toker, A., Tsien, R. Y., Newton, A. C. Calcium-dependent regulation of protein kinase D revealed by a genetically encoded kinase activity reporter. Journal of Biological Chemistry. 282, 6733-6742 (2007).
- Harvey, C. D. A genetically encoded fluorescent sensor of ERK activity. Proc. Natl. Acad. Sci. U.S.A. 105, 19264-19269 (2008).
- Fosbrink, M., Aye-Han, N. N., Cheong, R., Levchenko, A., Zhang, J. Visualization of JNK activity dynamics with a genetically encoded fluorescent biosensor. Proc. Natl. Acad. Sci. U.S.A. 107, 5459-5464 (2010).
- Gavet, O., Pines, J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Dev. Cell. 18, 533-543 (2010).
- Fuller, B. G. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453, 1132-1136 (2008).
- Ni, Q., Titov, D. V., Zhang, J. Analyzing protein kinase dynamics in living cells with FRET reporters. Methods. 40, 279-286 .
- Morgan, D. O. . The cell cycle : principles of control. , (2007).
- Lindqvist, A., Rodriguez-Bravo, V., Medema, R. H. The decision to enter mitosis: feedback and redundancy in the mitotic entry network. J. Cell. Biol. 185, 193-202 (2009).
- Gavet, O., Pines, J. Activation of cyclin B1-Cdk1 synchronizes events in the nucleus and the cytoplasm at mitosis. J. Cell. Biol. 189, 247-259 (2010).
- Macurek, L. Polo-like kinase-1 is activated by aurora A to promote checkpoint recovery. Nature. 455, 119-123 (2008).
- van der Eb, A. J., Graham, F. L. Assay of transforming activity of tumor virus DNA. Methods. Enzymol. 65, 826-839 (1980).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. Biotechniques. 42, 71-75 (2007).
- Roszik, J., Lisboa, D., Szollosi, J., Vereb, G. Evaluation of intensity-based ratiometric FRET in image cytometry--approaches and a software solution. Cytometry A. 75, 761-767 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon