Method Article
Мониторинг киназы и фосфатазы деятельности путем клеточного цикла Логометрический FRET
В этой статье
Резюме
FRET основе репортеры все чаще используются для контроля киназы и фосфатазы деятельность в живых клетках. Здесь мы опишем метод, как использовать FRET основе журналистам для оценки клеточного цикла зависит от изменений в целевую фосфорилирования.
Аннотация
Ферстер резонанс переноса энергии (FRET)-основанной журналистам 1 позволяют оценка эндогенной киназы и фосфатазы деятельность в живых клетках. Такие зонды обычно состоят из вариантов CFP и YFP, вмешался phosphorylatable последовательности и фосфорно-связывающий домен. После фосфорилирования, конформации зонд изменения, что приводит к изменению расстояния или ориентации между CFP и YFP, что приводит к изменению FRET эффективности (рис. 1). Несколько зондов были опубликованы в течение последнего десятилетия, мониторинг активности баланс нескольких киназ и фосфатаз, в том числе журналисты ПКА 2, ПКБ 3, РКС 4, PKD 5, 6 ERK, JNK 7, Cdk 18, Aurora B 9 и 9 Plk1 . С учетом модульной конструкции, дополнительными зондами, будут возникать и в ближайшем будущем 10.
Прогрессия через клеточный цикл влияет стресс signaliнг пути 11. Примечательно, что клеточный цикл регулируется по-разному в невозмущенной рост по сравнению с когда клетки восстанавливается после стресса 12. Покадровый изображений клеток через клеточный цикл, следовательно, требует особой осторожности. Это становится проблемой, особенно при использовании логометрических изображений, так как два изображения с высоким отношением сигнал-шум должны правильно интерпретировать результаты. Логометрический FRET изображений клеточного цикла зависимые изменения в киназы и фосфатазы деятельность имеет преимущественно ограничивалась подразделы клеточного цикла 8,9,13,14.
Здесь мы рассмотрим метод мониторинга FRET основе использования зондов логометрических изображения по всему человеческому клеточного цикла. Метод основан на оборудование, которое доступно для многих исследователей в области биологических наук и не требует специальных знаний микроскопии или обработки изображений.
протокол
1. Введение зонда в клетки
- Сотрудничество трансфекции клеток с FRET основе зонда и плазмиды присвоении сопротивления. Выберите трансфекции метод, который эффективен в вашей камерного типа, представляющих интерес. Для ячеек U2OS, стандартные методы фосфатом кальция трансфекции дают адекватные результаты 15.
- Выделите ячейки в соответствующий антибиотик, по крайней мере за семь дней. Это обогащает количество клеток, экспрессирующих зонда и ограничивает количество клеток с токсичного уровня выражения или выражения уровней, которые серьезно влияют на клеточный цикл.
- (Не обязательно) Выберете для стабильного клонов.
- Использование фиксированных или живых клеток, убедитесь, что оба CFP и YFP присутствуют во всех клетках примерно на том же соотношении.
- В случае, если некоторые клетки содержат только CFP или YFP, рекомбинации, скорее всего, произошло. Рекомбинация может происходить как во время роста бактерий или после трансфекции зонда и может, в последнем случае зависит от плазмиды качества. Повторите плазмиды рвозмещение ущерба и линеаризуем плазмиды перед трансфекцией, если проблема не устранена.
2. Мониторинг логометрических FRET
- Семенной клеток на стеклянным дном посуды, и не закрывайте скользит для монтажа в камере. Убедитесь, что посуда / крышка не скользит 1.5 (170 мкм).
- Горы клеток в питательной среде без фенола красного на моторном epifluorescence микроскоп с контролем температуры установлен в 37 ° C. Обеспечить рН регулирование средств массовой информации, либо по CO 2 или с помощью СО 2-независимые средства массовой информации, таких как Liebowitz-15.
- Сосредоточьтесь на клетки с использованием проходящего света. Не смотрите на клетки с помощью флуоресцентного света.
- Начнем с приобретения 12 или 16 бит изображения с помощью YFP возбуждения (YFPex) и YFP выбросов (YFPem) фильтры и подходящие дихроичных зеркал. Используйте максимальное биннинга доступны, что позволяет еще требуется субклеточных разрешения. Использование высоких биннинга уменьшить время экспозиции или интенсивности имеет решающее значение для предотвращения фототоксичности.
- Мнеуверяем или оценить интенсивность фона и приблизительный шума путем измерения или оценки грубые средние, минимальные и максимальные значения пиксела в области лишенный клеток. Изменить время экспозиции и фильтры нейтральной плотности, так что средняя сигнала в клетке примерно интенсивности фона плюс пять-десять раз разница между макс и мин интенсивности фона.
- Убедитесь, что изображения не близка к насыщенной. Максимальная интенсивность на изображении должно быть не менее половины динамического диапазона (например, максимальное 2000 года в 12-битное изображение), чтобы учесть интенсивность различия, когда клетки вступают в митоз.
- Повторите шаг 2,4 до 2,6 использованием возбуждения CFP и фильтры YFP выбросов и подходящие дихроичных зеркал.
- Выберите несколько регионов с трансфекции клеток, за исключением зон, используемых для точки 2,4 до 2,7, и гарантировать, что максимальная интенсивность составляет менее половины динамического диапазона во всех клетках.
- Начало покадровой эксперимент приобретении два изображения каждые 45 мин с использованием YFPex - YFPem и CFPex - YFPem наборы фильтров.
3. Проверка и оптимизация условий
- Открытое полученные изображения и монитора время клеточного цикла от митоза к митоза для клеток, которые выражают трансфицированных зонда.
- Сравнить измеренное время клеточного цикла опубликованным данным для типа клеток используются. Кроме того, фильм untransfected клетки захватывает один образ проходящем свете только (например, DIC или фазового контраста) каждый час, чтобы получить ссылку раз клеточного цикла.
- В случае, если время от митоза к митозу соответствует ссылкой таймингов клеточного цикла, перейдите к шагу 4. Кроме того, повторно приобрести изображения с помощью труднее экспозиции, больше времени, точки или нескольких Z-уровней и повторите шаг 3.
- В случае, если время от митоза к митозу не соответствует ссылкой таймингов клеточного цикла, кино трансфицированных клеток, приобретая одно изображение проходящем свете только (например, DIC или фазового контраста) каждый час следуют одно изображение в концеэксперимента для выявления трансфекции клеток.
- Если трансфекции клетки по-прежнему показывают больше клетка время цикла, повторите шаг 1, но меньше трансфекции зонда или выбрать для стабильных клонов, которые содержат очень небольшое количество зонда.
- Если трансфекции клетки показывают обычное время клеточного цикла при отсутствии дневного света, повторите шаг 2, но меньше воздействия, изменяя биннинга, фильтры нейтральной плотности, время экспозиции, а время между изображениями.
4. Анализ FRET
- Анализ может быть выполнен по большей части программного обеспечения посвященный микроскопии. Здесь мы опишем, как выполнять анализ с использованием бесплатной ImageJ ( http://rsb.info.nih.gov/ij ) с использованием плагина Отношение Plus ( http://imagej.nih.gov/ij/plugins/ratio-plus . HTML ).
- Откройте изображение в ImageJ. В случае, если ваши изображения в формате НТКК многоцветнаяк (например Deltavision), отдельные индивидуальные каналы сначала преобразовать их в HyperStack: Image-HyperStack-стек для HyperStack, а затем разделить их на один канал, используя стеки: Image-HyperStack-уменьшить размерность
- Умножить YFPex - YFPem стека с использованием 3: Process-Math-Multiply Этот шаг является необязательным, так как она предназначена только для увеличения четкости образов, гарантируя, что отношения не находятся в диапазоне между 0 и 1.
- В YFPex - стек YFPem, рисовать области интереса (ROI) в области, которая лишена клеток, но это близко к клетке должна быть измерена. Различные клетки в тот же образ может потребовать различных регионах, и как фон и интенсивность сигнала обычно является самым сильным в центре изображения.
- Добавить в рентабельность инвестиций ROI менеджер: Анализ-инструмент-ROI менеджера.
- Измеряется средняя интенсивность ROI в обоих YFPex - YFPem и CFPex - YFPem стека: Анализ-Measure .
- Повторите на нескольких timepoints и убедитесь, что фон интенсивности близки к ячейке интерес похожи на протяжении всего фильма.
- Установите измерения включают минимальную интенсивность: Анализ-Set-Min измерений и Макс серого.
- Нарисуйте область интереса, охватывающего большую часть клетки и мера минимальной интенсивности в обоих YFPex - YFPem и CFPex - YFPem стека. Возьмите разницу между измеренным минимальные интенсивности и интенсивность фона с 4,6 и делим его на две части. Это создает основу для оценки отсечения значение.
- Открытый Плюс Ratio. Выберите YFPex - YFPem и CFPex - YFPem стека. Для FRET отношение, выберите CFPex - YFPem как стек 1, для перевернутого FRET соотношение визуализации зонды, где FRET эффективность уменьшается при фосфорилирования, выберите YFPex - YFPem как стек 1.
- Вставьте измеряется интенсивность фона и обрезки значения.
- Установите масштабирование полученное соотношение стек и применять подходящие U смотретьр таблицы (LUT) для визуализации соотношение меняется.
5. Представитель Результаты
Plk1 деятельность первого видимого в ядре в G2 фазе и пики во время митоза. На рисунке 3 показан эксперимент с использованием минимальных настройках фототоксичности, как описано в разделе 2. Пожалуйста, обратите внимание, что это представитель первоначальный результат, и что воздействие условий или времени между снимками может быть изменена для увеличения сигнала к шуму или временное разрешение. Рис 3D показывает, что большинство клеток, экспрессирующих зонд размножаться со временем клеточного цикла от 20 до 25 часов, указав, что изображение условий и уровня экспрессии зонд не влияют тайминги клеточного цикла. Несмотря на значительный шум, тенденция Plk1 повышения активности в G2 и достигает пика в 14 митоза отчетливо видно (рис. 3А). Обработка первичных данных, здесь означает фильтрации представлена как кимограф (рис. 3В), или количественная оценка средней перевернутой ра TiO (рис. 3C) может повысить четкость.
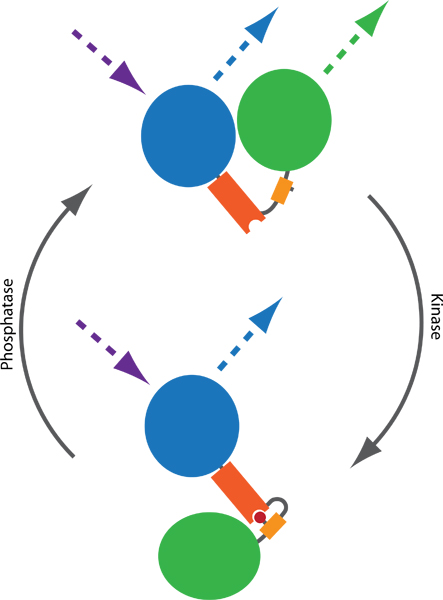
Рисунок 1. Принцип FRET основе датчика для контроля киназы и фосфатазы деятельности. Два флуорофоры, как правило, CFP (синий) и YFP (зеленый), связаны фосфо-связывающий домен (оранжевый) и phosphorylatable последовательности (желтый). Фосфорилирование (красный) опосредует связывание с фосфорно-связывающий домен, тем самым вызывая конформационные изменения в зонд. Результаты конформационного изменения разницы в расстоянии и ориентации между двумя флуорофоров, что влияет на эффективность FRET между CFP и YFP. FRET могут быть визуализированы, возбуждая CFP и мониторинга YFP выбросов (пунктирные линии).

Рисунок 2. Схематическом плане экспериментальной процедуры.
p_upload/3410/3410fig3.jpg "/>
Рисунок 3. Plk1 деятельность первого видимого в ядре в G2 фазе и пики во время митоза. U2OS клеток, экспрессирующих FRET основе датчика мониторинга деятельности Plk1 9,14 были сняты в течение 60 часов использования Deltavision Spectris Система визуализации оснащена 20-кратным Н. А. 0,7 объективный воздуха и ртутной лампы. Изображениями условия были выбраны вызывать минимальное фототоксичности, как указано в разделе 2, используя 4x биннинга и нейтральные фильтры, которые блокируют 99% входящего света. , Ложное представление цвета перевернутая FRET-коэффициент, после одной ячейки по 4 подразделения. B, кимограф ячейки показана на после применения фильтра означает. С количественной перевернутой FRET отношение ячейки показана на А. Д., кумулятивные вступления митотической из 50 FRET-зонд экспрессирующие клетки, в том числе подразделений дочерних клеток.
Обсуждение
Мониторинг FRET протяжении клеточного цикла требует соображения, которые являются менее важно при оценке краткосрочных ответов на внешние раздражители. Во-первых, прогрессию клеточного цикла легко возмущенного стресс сигнализации, требуя, чтобы фототоксичности сведено к минимуму. Во-вторых, все журналисты могут потенциально влиять на клеточные процессы титрованием из киназ, фосфатазы или взаимодействия доменов. Вероятно, самый простой способ оценить, если условия эксперимента адекватны заключается в измерении длины клеточного цикла от митоза к митозу и сравнить ее с экспериментами независимо от флуоресценции и выражение зонда.
Решающим фактором в мониторинге FRET отношения протяжении клеточного цикла, чтобы противостоять искушению приобрести красивые изображения с высоким разрешением. Хотя точные настройки зависят от чувствительности системы микроскопа и выражение уровня и характера конкретного датчика, важно использоватьУровень биннинга, что соответствует тому, что абсолютно необходимо, чтобы видеть. Хотя время между CFPex - YFPem и YFPex - YFPem изображения должны быть короткими, чтобы избежать изменения в морфологии клеток, в наших руках лучше держать экспозиции более чем на 0,1 секунды и снижают интенсивность флуоресцентного света нейтральные фильтры .
Как фототоксичности влияет на клеточный цикл во многом зависит от уровня экспрессии и локализации зонда. Зонда, который локализуется в хроматина, например, путем слияния с гистонов, делает клетки более чувствительны к флуоресцентный свет, предположительно, с фототоксических побочные продукты создаются в непосредственной близости от ДНК. Поэтому очень важно следить клетки, которые выражают относительно низкий уровень журналистов и перепроверить клеточного цикла, если тайминги локализации зонда для различных субклеточных структур.
Некоторые контрольные эксперименты должны убедиться, что FRET присутствует вЭкспериментальная установка и это соотношение изменения отражают фактические фосфорилирование зонда. Кроме функционального управления, такие как подавление или истощение киназы, желательно выполнять биохимических экспериментов проверить, что зонд фосфорилируется, мутация ожидается фосфо-акцепторного сайта в течение зонд для не-phosphorylatable остатка, и акцептора фотообесцвечивания к доказать возникновение FRET. Для примера тщательную проверку, см. рисунок 3 дополнительных в работе 14.
Хотя теоретически предпочтительнее для оценки FRET изменений путем мониторинга и CFP и YFP выбросов, таких установок очень чувствительны к смене фокуса и условий освещенности и может легко привести к артефактам. Чувствительность к смене фокуса происходит из-за хроматической аберрации, где CFP и YFP выбросов не фокусируются на одну точку. Освещение изменения зависят в основном от различных выравнивания светового луча. Это особенно заметно при использовании фильтра кубов, содержащихдихроичных зеркал. Фокусировка и изменение освещенности можно уменьшить, используя исправлены цели и тщательно выровнены светофильтров. Однако, по нашему опыту, сохраняя постоянное излучение фильтр дает превосходные результаты, желательно с помощью установки с отдельным регулятором возбуждения и испускания фильтров.
Величина наблюдается FRET изменения уменьшается на bleedthrough от CFP флуоресценции YFP выбросов фильтр. В случае bleedthrough является существенным, дополнительные CFPex - CFPem изображение может быть приобретена для исправления bleedthrough в CFPex - YFPem изображения. Тем не менее, эти поправки очень чувствительны к фокусе различия и может привести к артефактам. Кроме того, они требуют дополнительных изображений, которые могут производить фототоксичности.
Хотя менее важной проблемой, когда только мониторинг YFP выбросов, сохраняя клетки в центре внимания всей 24h + покадровой эксперимент может оказаться непростой задачей. Чтобы избежать внимания сугробы, убедитесь, что микроскопи блюдо предварительно нагревается и температура в помещении не колебаться. Вместо этого можно использовать систему автофокусировки, которая не основана на визуализации трансфицированных зонда.
Выбор которых цель использовать, зависит от конкретного приложения. На масляной основе высоких целей Н. А. собирает больше света и обеспечивает повышенное разрешение, но более чувствителен к смене фокуса и непрактичные высокого содержания установок. Мы предпочитаем использовать воздушные цели с относительно высокой числовой апертурой для изучения цитоплазматические или ядерных FRET-отношений, а также использовать высокий Н. А. нефти цели только тогда, когда высшее субклеточных разрешение не требуется.
В данной статье обсуждается простой способ снимать FRET основе зондов через клеточный цикл, который использует оборудование, которые обычно доступны для многих исследователей наук о жизни и требуют только базальные знание микроскопии и обработки изображений. Более специализированные варианты включают использование пучка разветвители, жизни флуоресценции Microscopy (FLIM) 1 и программное обеспечение для автоматизации объекта 16 сегментации и расчет FRET соотношение 17.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Авторы при поддержке Шведского исследовательского совета, Шведский фонд стратегических исследований, шведское общество рака, шведском обществе раком ребенка, Оке Wibergs фундамент и Jeanssons фундамент.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент | Номер по каталогу | Компания | |
| Лейбовиц L-15, без фенола красного | 21083-027 | GIBCO, по Life Technologies | |
| DMEM + Glutamax-I | 31966 | GIBCO, по Life Technologies | |
| Эмбриональной бычьей сыворотки (FBS) | SV30160.03 | Hyclone | |
| 0,05% трипсина ЭДТА | SH30236.01 | Hyclone | |
| Пенициллин-Стрептомицин | SV30010 | Hyclone | |
| DPBS | 14287 | GIBCO, по Life Technologies | |
| Пуромицин | P8833 | Sigma-Aldrich |
Ссылки
- Sun, Y., Wallrabe, H., Seo, S. A., Periasamy, A. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth. Chemphyschem. 12, 462-474 (2011).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochem. Biophys. Res. Commun. 348, 716-721 (2006).
- Kunkel, M. T., Ni, Q., Tsien, R. Y., Zhang, J., Newton, A. C. Spatio-temporal dynamics of protein kinase B/Akt signaling revealed by a genetically encoded fluorescent reporter. J. Biol. Chem. 280, (2005).
- Violin, J. D., Zhang, J., Tsien, R. Y., Newton, A. C. A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase. C. J. Cell. Biol. 161, 899-909 (2003).
- Kunkel, M. T., Toker, A., Tsien, R. Y., Newton, A. C. Calcium-dependent regulation of protein kinase D revealed by a genetically encoded kinase activity reporter. Journal of Biological Chemistry. 282, 6733-6742 (2007).
- Harvey, C. D. A genetically encoded fluorescent sensor of ERK activity. Proc. Natl. Acad. Sci. U.S.A. 105, 19264-19269 (2008).
- Fosbrink, M., Aye-Han, N. N., Cheong, R., Levchenko, A., Zhang, J. Visualization of JNK activity dynamics with a genetically encoded fluorescent biosensor. Proc. Natl. Acad. Sci. U.S.A. 107, 5459-5464 (2010).
- Gavet, O., Pines, J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Dev. Cell. 18, 533-543 (2010).
- Fuller, B. G. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453, 1132-1136 (2008).
- Ni, Q., Titov, D. V., Zhang, J. Analyzing protein kinase dynamics in living cells with FRET reporters. Methods. 40, 279-286 .
- Morgan, D. O. . The cell cycle : principles of control. , (2007).
- Lindqvist, A., Rodriguez-Bravo, V., Medema, R. H. The decision to enter mitosis: feedback and redundancy in the mitotic entry network. J. Cell. Biol. 185, 193-202 (2009).
- Gavet, O., Pines, J. Activation of cyclin B1-Cdk1 synchronizes events in the nucleus and the cytoplasm at mitosis. J. Cell. Biol. 189, 247-259 (2010).
- Macurek, L. Polo-like kinase-1 is activated by aurora A to promote checkpoint recovery. Nature. 455, 119-123 (2008).
- van der Eb, A. J., Graham, F. L. Assay of transforming activity of tumor virus DNA. Methods. Enzymol. 65, 826-839 (1980).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. Biotechniques. 42, 71-75 (2007).
- Roszik, J., Lisboa, D., Szollosi, J., Vereb, G. Evaluation of intensity-based ratiometric FRET in image cytometry--approaches and a software solution. Cytometry A. 75, 761-767 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены