Method Article
ניטור פעילות קינאז ו phosphatase דרך מחזור התא על ידי Ratiometric סריג
In This Article
Summary
סריג מבוססי הכתבים משמשים יותר ויותר לעקוב אחר פעילות קינאז ו phosphatase בתאים חיים. כאן אנו מתארים שיטה כיצד להשתמש סריג מבוססי עיתונאים כדי להעריך את מחזור התא תלויות שינויים זירחון היעד.
Abstract
פורסטר תהודה העברת אנרגיה (סריג) מבוסס לכתבים 1 לאפשר הערכה של קינאז אנדוגני ופעילויות phosphatase בתאים חיים. בדיקות אלו בדרך כלל מורכבות של וריאנטים של CFP ו YFP, התערב על ידי רצף phosphorylatable ואת תחום phospho מחייב. לאחר זירחון, השינויים בדיקה הקונפורמציה, שתוצאתה שינוי המרחק או נטייה בין CFP ו YFP, מוביל לשינוי סריג יעילות (איור 1). מספר בדיקות פורסמו בעשור האחרון, מעקב אחר יתרת הפעילות של קינאזות ו phosphatases מרובות, כולל כתבים של 2 PKA, PKB 3, 4 PKC, PKD 5, 6 ERK, JNK 7, CDK 18, אורורה B 9 ו 9 Plk1 . בהתחשב עיצוב מודולרי, בדיקות נוספות צפויות לצאת ב 10 בעתיד הקרוב.
התקדמות דרך מחזור התא מושפע מתח signaling 11 מסלולים. יש לציין, מחזור התא מוסדר באופן שונה במהלך שאנן צמיחה לעומת כאשר התאים הם מחלים מתח 12. זמן לשגות הדמיה של התאים דרך מחזור התא ולכן מחייב זהירות מיוחדת. זה הופך לבעיה במיוחד כאשר העסקת הדמיה ratiometric, שכן שתי תמונות עם האות גבוה יחס רעש נדרשים לפרש את התוצאות. Ratiometric סריג הדמיה של מחזור התא משתנה תלוי בפעילות קינאז ו phosphatase יש ברובה הוגבלה סעיפים קטנים של מחזור התא 8,9,13,14.
כאן, אנו דנים בשיטה כדי לפקח על סריג מבוססי בדיקות הדמיה באמצעות ratiometric לאורך מחזור התא האנושי. השיטה מסתמכת על הציוד העומד לרשות חוקרים רבים במדעי החיים ואינו דורש ידע מומחה של מיקרוסקופיה או עיבוד תמונה.
Protocol
1. הצגת בדיקה לתאי
- Co-transfect תאים עם סריג בדיקה מבוססות לבין פלסמיד המקנה עמידות. בחר שיטת transfection כי הוא יעיל בסוג התא העניין שלך. עבור תאים U2OS, רמת סידן פוספט שיטות transfection לתת תוצאות נאות 15.
- בחר תאים אנטיביוטיקה המתאימה לפחות שבעה ימים. זה מעשיר את כמות התאים המבטאים את בדיקה מגביל את כמות התאים עם רמות ביטוי רעיל, או רמות ביטוי חמור להשפיע על מחזור התא.
- (אופציונלי) בחר עבור שיבוטים יציב.
- שימוש בתאי קבוע או לחיות, ודא כי הן CFP ו YFP נמצאים בכל התאים ביחס בקירוב.
- במקרה תאים מסוימים מכילים רק CFP או YFP, רקומבינציה אירעה סביר. רקומבינציה יכולה להתרחש גם במהלך התפתחות חיידקים או אחרי transfection של החללית והוא רשאי במקרה האחרון תלוי באיכות פלסמיד. חזור p פלסמידפיצוי ו linearize הפלסמיד לפני transfection אם הבעיה נמשכת.
2. Ratiometric ניטור סריג
- זרעים תאים בתחתית צלחות זכוכית, או תלושי כיסוי הרכבה בתא. ודא כי מנות / תלושי לכסות אינם 1.5 (170 מיקרומטר עבה).
- הר תאים בינוני צמיחה ללא פנול אדום על מיקרוסקופ epifluorescence ממונע עם בקרת טמפרטורה מוגדר 37 ° C. ודא תקנה pH של התקשורת, או על ידי ה-CO 2 או באמצעות ה-CO 2 עצמאית מדיה כגון לייבוביץ-15.
- פוקוס על תאים באמצעות האור המועבר. אל תסתכל על תאים באמצעות אור ניאון.
- התחל על ידי רכישת תמונה 12 או 16 ביט באמצעות עירור YFP (YFPex) ו YFP פליטה (YFPem) מסננים מראה dichroic מתאים. השתמש binning מקסימלי זמין עדיין מאפשר רזולוציה subcellular הנדרש. שימוש binning גבוהה כדי להקטין זמן חשיפה או אינטנסיביות חיונית כדי למנוע phototoxicity.
- ליasure או להעריך את עוצמת רקע הרעש המשוער על ידי מדידת או הערכת ממוצע גס, מינימום ערכי הפיקסלים המרבית באזור נטול תאים. שינוי זמן החשיפה ומסננים צפיפות ניטרלי, כך האות הממוצע בתא הוא כ עוצמת הרקע פלוס חמש עד עשר פעמים את ההבדל בין מקס בעוצמות דקות רקע.
- ודא כי התמונות לא קרובים להיות רווי. העוצמה המקסימלית של התמונה צריך להיות פחות ממחצית של טווח דינמי (למשל מקסימום 2000 בתמונת 12 ביט), כדי לאפשר ההבדלים בעוצמה כאשר תאים להיכנס מיטוזה.
- חזור על שלב 2.4-2.6 באמצעות עירור ופליטה CFP מסננים YFP ומראה dichroic מתאים.
- בחר באזורים מרובים עם תאים transfected, למעט באזורים המשמשים נקודת 2.4-2.7, ולוודא כי העוצמה המקסימלית היא פחות ממחצית הטווח הדינמי בכל התאים.
- התחל ניסוי זמן לשגות רכישת שתי תמונות כל 45 דקות באמצעות YFPex - YFPem ו CFPex - YFPem קובע הסינון.
3. אימות וייעול התנאים
- פתח את התמונות רכשה ולנטר את מחזור התא בזמן מן מיטוזה כדי מיטוזה של תאים המבטאים את החללית transfected.
- השוואת מחזור נמדד זמן תא לנתונים שפורסמו עבור סוג תא בשימוש. לחילופין, סרט untransfected תאים באמצעות רכישת תמונה אחת של אור מועבר רק (DIC למשל או שלב בניגוד) בכל שעה כדי לקבל תא התייחסות זמני המחזור.
- במקרה של זמן עד מיטוזה מיטוזה מתאים התייחסות תזמוני מחזור התא, המשך לשלב 4. לחלופין, לרכוש מחדש תמונות באמצעות חשיפה קשה יותר, יותר זמן או נקודות מרובות Z-רמות וחזור על שלב 3.
- במקרה בזמן מן מיטוזה כדי מיטוזה לא מתאימות התייחסות מחזור תזמוני התא, הסרט transfected תאים באמצעות רכישת תמונה אחת של אור מועבר רק (DIC למשל או שלב בניגוד) כל שעה ואחריו תמונה אחת בסוףהניסוי כדי לזהות תאים transfected.
- אם התאים transfected עדיין להראות פעמים מחזור התא יותר, חזור על שלב 1 אבל transfect בדיקה פחות או לבחור עבור שיבוטים יציב המכילים כמויות נמוכות מאוד של בדיקה.
- אם התאים transfected להראות נורמלי מחזור התא פעמים בהעדר אור ניאון, חזור על שלב 2 אבל חשיפה נמוכה יותר על ידי שינוי binning, מסננים צפיפות ניטרלי, זמן חשיפה, זמן בין תמונות.
4. ניתוח סריג
- הניתוח יכול להתבצע על ידי רוב התוכנות המוקדש במיקרוסקופ. כאן אנו מתארים כיצד לבצע את הניתוח באמצעות ImageJ freeware ( http://rsb.info.nih.gov/ij ) ניצול יחס תוסף פלוס ( http://imagej.nih.gov/ij/plugins/ratio-plus . html ).
- פתח את התמונות ImageJ. בכל מקרה התמונות שלך הן בפורמט של stac ססגוניותk (למשל DeltaVision), להפריד את הערוצים הנפרדים על ידי הראשון הפיכתם hyperstack: Image-hyperstack מחסנית ל hyperstack ולאחר מכן לפצל אותם ערימות ערוץ אחד באמצעות: Image-hyperstack-להפחית ממדיות
- הכפלת YFPex - מחסנית YFPem עם 3 באמצעות: Process-Math-הכפל שלב זה הוא אופציונלי, שכן הוא נועד אך ורק כדי להגביר את בהירות הראייה של התמונות על ידי הקפדה יחסי אינם בטווח בין 0 ל -1.
- ב YFPex - מחסנית YFPem, צייר באזור של עניין (ROI) באזור כי הוא נטול תאים, אבל זה קרוב לתא כדי להימדד. תאים שונים באותה תמונה עשויה לדרוש באזורים שונים, כמו גם הרקע ועוצמת אות הוא בדרך כלל החזק במרכז התמונה.
- מוסיפים את ההחזר על ההשקעה ROI אל מנהל: Analyze-tools-ROI מנהל.
- למדוד את העוצמה הממוצעת של ההחזר על ההשקעה הן YFPex - YFPem ואת CFPex - מחסנית YFPem: Analyze-מדוד .
- חזור על timepoints מרובים לוודא כי בעוצמות רקע קרוב לתא עניין דומים לאורך כל הסרט.
- סט מדידות לכלול בעוצמה מינימלית: Analyze-Set-Min מידות וערך מקס אפור.
- צייר אזור של אינטרס המכסים את רוב התא ולמדוד את עוצמת מינימלי הן YFPex - YFPem ואת CFPex - מחסנית YFPem. קח את ההבדל בין עוצמת מינימלי נמדד עוצמת הרקע 4.6 ומחלקים אותו על ידי שני. זה מספק הערכה מוצא ערך גזיר.
- יחס פתוח פלוס. בחר את YFPex - YFPem ואת CFPex - מחסנית YFPem. עבור סריג יחס, בחר CFPex - YFPem כמו מחסנית 1, עבור סריג יחס הפוך בדיקות הדמיה שבו סריג פוחתת יעילות על זירחון, בחר YFPex - YFPem כמו ערימה 1.
- הכנס את עוצמות רקע נמדד בערכים גזיר.
- הגדר את קנה המידה של מחסנית יחס וכתוצאה מכך ולהחיל u נראים מתאימיםp טבלה (LUT) כדי לחזות שינויים יחס.
5. נציג תוצאות
Plk1 הפעילות הגלויה הראשונה בגרעין בשלב ופסגות G2 במהלך מיטוזה. איור 3 מציג ניסוי באמצעות הגדרות phototoxicity מינימלי כמתואר בסעיף 2. שים לב כי זוהי תוצאה ראשונית נציג וכי התנאים חשיפה או הזמן בין דמויות יכולות להיות משונות כדי להגדיל את יחס אות לרעש או רזולוציה טמפורלית. איור 3D מראה כי רוב התאים המבטאים את החללית להתרבות עם זמן מחזור של תא בין 20 ל 25 שעות, המציין את התנאים הדמיה רמות הביטוי של החללית אינם משפיעים על תזמון מחזור התא. למרות שיש רעש רב, את המגמה של הגדלת הפעילות Plk1 G2 ו peaking ב מיטוזה 14 נראה בבירור (איור 3A). עיבוד הנתונים הגולמיים, כאן על ידי מתכוון סינון כפי שהוצגו רשם גלים (איור 3B), או כימות של ra הפוך הממוצע טיו (תאנה 3C) יכול לשפר את הבהירות.
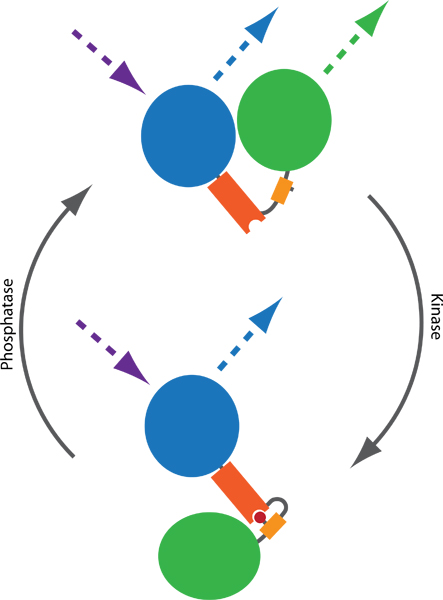
באיור 1. עקרון בדיקה סריג מבוסס לפקח פעילות קינאז ו phosphatase. שני fluorophores, בדרך כלל CFP (כחול) YFP (ירוק), מחוברים על ידי תחום phospho מחייבים (כתום) רצף phosphorylatable (צהוב). (אדום) זירחון מתווכת מחייב תחום phospho מחייב, ובכך גרימת שינוי קונפורמציה החללית. השינוי בתוצאות קונפורמציה הבדל במרחק או נטייה בין שני fluorophores, אשר משפיע על היעילות בין סריג CFP ו YFP. סריג ניתן דמיינו ידי CFP מרגש וניטור YFP פליטה (קווים מקווקווים).

באיור 2. המתאר סכמטי של הליך ניסיוני.
p_upload/3410/3410fig3.jpg "/>
באיור 3. Plk1 הפעילות הגלויה הראשונה בגרעין בשלב ופסגות G2 במהלך מיטוזה. תאים U2OS להביע סריג מבוססי ניטור בדיקה Plk1 פעילות 9,14 צולמו במשך 60 שעות באמצעות מערכת דימות Spectris DeltaVision מצויד מטרה 20x 0.7 אוויר NA ומנורת כספית. תנאי ההדמיה נבחרו כדי לגרום phototoxicity מינימלי, כפי שמתואר בסעיף 2, באמצעות binning 4x ומסננים צפיפות ניטרלי כי 99% בלוק של האור הנכנס. צבע, מצג שווא של יחס הפוך סריג, בעקבות תא אחד באמצעות 4 חטיבות. ב ', רשם גלים של התא מוצג לאחר החלת מסנן מתכוון. C, כימות של יחס הפוך סריג של התא מוצג א 'ד', כניסה mitotic מצטברת של 50 סריג, בדיקה תאים להביע, כולל חטיבות של לתאי הבת.
Discussion
ניטור סריג לאורך מחזור התא דורש השיקולים הם קריטיים פחות כאשר מעריכים לטווח קצר תגובות לגירויים חיצוניים. ראשית, התקדמות מחזור התא בקלות מוטרד איתות מתח, המחייב phototoxicity היא למינימום. שנית, כל הכתבים עלולה להשפיע על תהליכים תאיים על ידי titrating החוצה קינאזות, phosphatases או תחומים אינטראקציה. הדרך כנראה פשוטה ביותר על מנת להעריך אם תנאי הניסוי מספיקות היא למדוד את אורך מחזור התא מיטוזה כדי מיטוזה ולהשוות אותה ניסויים עצמאיים של הדמיה ביטוי הקרינה של בדיקה.
גורם מכריע ניטור סריג יחסי לאורך מחזור התא הוא לעמוד בפני הפיתוי לרכוש תמונות יפות עם רזולוציה גבוהה. למרות הגדרות המדויק תלוי רגישות של מערכת מיקרוסקופ ורמת הביטוי טבע החללית בפרט, חשוב להשתמשרמת binning שמתאים מה הכרחי כדי לראות. למרות הזמן בין CFPex - YFPem ו YFPex - תמונות YFPem צריך להיות קצר, כדי למנוע שינויים במורפולוגיה התא, בידיים שלנו עדיף לשמור על זמני חשיפה של יותר מ 0.1 שניות ולהפחית את עוצמת האור ניאון על ידי מסנני צפיפות ניטרלי .
איך phototoxicity משפיע על מחזור התא תלוי במידה רבה על רמות הביטוי לוקליזציה של החללית. בדיקה כי הוא מקומי אל הכרומטין, למשל על ידי איחוי עם היסטון, הופך תאים רגישים יותר אור ניאון, כנראה מאז לוואי phototoxic נוצרים באזור של ה-DNA. זה חיוני כדי לפקח ולכן התאים המבטאים רמות נמוכות יחסית של עיתונאים וכדי לבדוק מחדש תאים מחזור תזמונים אם בדיקה לאיתור מבנים subcellular שונים.
ניסויים לשלוט כמה נדרשים כדי לוודא כי סריג הוא נוכחהתקנה ניסיונית, וכי השינויים משקפים יחס זירחון בפועל של בדיקה. חוץ שולטת פונקציונלי, כגון עיכוב או דלדול של קינאז, רצוי לבצע ניסויים ביוכימיים כדי לוודא בדיקה הוא פוספורילציה, מוטציה של האתר phospho-acceptor צפוי בתוך החללית אל הלא שאריות phosphorylatable, ואת acceptor photobleaching ל להוכיח את המופע של סריג. לדוגמה של אימות נרחב, ראה דמות משלים 3 ב נ"צ 14.
אמנם עדיף באופן תיאורטי כדי להעריך סריג שינויים על ידי ניטור הן CFP ופליטה YFP, setups כגון רגישים מאוד להתמקד שינויים בתנאי תאורה והוא יכול בקלות להוביל חפצים. רגישות למקד את השינויים בשל אברציה כרומטית, שם CFP ו YFP פליטה לא להתמקד בנקודה אחת. שינויים תאורה תלויות במידה רבה יישור שונות של נתיב האור. זה בולט במיוחד בעת שימוש במסנן המכיל קוביותמראה dichroic. פוקוס ולשנות תאורה ניתן להפחית באמצעות מטרות תיקן קוביות לסנן מיושרים בקפידה. עם זאת, מניסיוננו, שמירה מתמדת מסנן פליטה נותן תוצאות משופרות, רצוי באמצעות התקנה עם שליטה נפרדת של עירור ומסננים פליטה.
גודל של נצפתה סריג לשינוי הוא מופחת על ידי bleedthrough מ CFP הקרינה של פליטת YFP הסינון. במקרה bleedthrough הוא משמעותי, CFPex נוסף - תמונה CFPem ניתן לרכוש לתקן bleedthrough לתוך CFPex - תמונה YFPem. עם זאת, תיקונים כאלה רגישים מאוד למקד את ההבדלים עשויים להציג את הממצאים. בנוסף, הם דורשים דימוי נוסף, אשר עשוי לייצר phototoxicity.
אמנם פחות בעיה רק כאשר ניטור YFP פליטה, תוך שמירה על תאים להתמקד לאורך 24 שעות + זמן לשגות הניסוי יכול להיות מאתגר. כדי להימנע מרחף להתמקד, לוודא כי מיקרוסקופואת המנה מראש וזה חימם את הטמפרטורה בחדר לא להשתנות. לחלופין, להשתמש במערכת פוקוס אוטומטי כי אינה מבוססת על הדמיה של החללית transfected.
הבחירה בו המטרה להשתמש תלוי ביישום מסוים. על בסיס שמן גבוהה אובייקטיבי NA אוספת יותר אור ונותנת ברזולוציה גדל, אך הוא רגיש יותר להתמקד שינויים, והוא חסר מעשיות גבוהה תוכן setups. אנחנו מעדיפים להשתמש אובייקטיבי האוויר NA גבוה יחסית ללמוד cytoplasmic או גרעיני סריג, יחס, ולהשתמש גבוהה NA מטרות שמן רק כאשר הרזולוציה גבוהה יותר subcellular נדרשת.
נייר זה דן שיטה פשוטה סריג הסרט מבוסס בדיקות באמצעות מחזור התא המשתמשת ציוד זמינים בדרך כלל חוקרים בתחום מדעי החיים רבים דורשים רק את הידע הבסיסי של מיקרוסקופיה ועיבוד תמונה. חלופות נוספות המקצועית לכלול את השימוש של הקורה מפצלי, Fluorescence Lifetime Microscopy (FLIM) 1 ותוכנות כדי להפוך פילוח אובייקט 16 וחישוב יחס סריג 17.
Disclosures
אין לנו שום דבר לגלות.
Acknowledgements
המחברים נתמכים על ידי המועצה למחקר השוודי, הבסיס שוודית למחקר אסטרטגי, החברה השוודית סרטן, החברה השוודית סרטן ילדים, האייק Wibergs הקרן Jeanssons הקרן.
Materials
| Name | Company | Catalog Number | Comments |
| מגיב | מספר קטלוגי | חברה | |
| ליבוביץ L-15, לא פנול אדום | 21083-027 | GIBCO, על ידי החיים טכנולוגיות | |
| DMEM + Glutamax-I | 31966 | GIBCO, על ידי החיים טכנולוגיות | |
| עוברית שור סרום (FBS) | SV30160.03 | HyClone | |
| 0.05% טריפסין EDTA | SH30236.01 | HyClone | |
| פניצילין, סטרפטומיצין | SV30010 | HyClone | |
| DPBS | 14287 | GIBCO, על ידי החיים טכנולוגיות | |
| Puromycin | P8833 | Sigma-Aldrich |
References
- Sun, Y., Wallrabe, H., Seo, S. A., Periasamy, A. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth. Chemphyschem. 12, 462-474 (2011).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochem. Biophys. Res. Commun. 348, 716-721 (2006).
- Kunkel, M. T., Ni, Q., Tsien, R. Y., Zhang, J., Newton, A. C. Spatio-temporal dynamics of protein kinase B/Akt signaling revealed by a genetically encoded fluorescent reporter. J. Biol. Chem. 280, (2005).
- Violin, J. D., Zhang, J., Tsien, R. Y., Newton, A. C. A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase. C. J. Cell. Biol. 161, 899-909 (2003).
- Kunkel, M. T., Toker, A., Tsien, R. Y., Newton, A. C. Calcium-dependent regulation of protein kinase D revealed by a genetically encoded kinase activity reporter. Journal of Biological Chemistry. 282, 6733-6742 (2007).
- Harvey, C. D. A genetically encoded fluorescent sensor of ERK activity. Proc. Natl. Acad. Sci. U.S.A. 105, 19264-19269 (2008).
- Fosbrink, M., Aye-Han, N. N., Cheong, R., Levchenko, A., Zhang, J. Visualization of JNK activity dynamics with a genetically encoded fluorescent biosensor. Proc. Natl. Acad. Sci. U.S.A. 107, 5459-5464 (2010).
- Gavet, O., Pines, J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Dev. Cell. 18, 533-543 (2010).
- Fuller, B. G. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453, 1132-1136 (2008).
- Ni, Q., Titov, D. V., Zhang, J. Analyzing protein kinase dynamics in living cells with FRET reporters. Methods. 40, 279-286 Forthcoming.
- Morgan, D. O. The cell cycle : principles of control. , New Science Press, in association with Oxford University Press. (2007).
- Lindqvist, A., Rodriguez-Bravo, V., Medema, R. H. The decision to enter mitosis: feedback and redundancy in the mitotic entry network. J. Cell. Biol. 185, 193-202 (2009).
- Gavet, O., Pines, J. Activation of cyclin B1-Cdk1 synchronizes events in the nucleus and the cytoplasm at mitosis. J. Cell. Biol. 189, 247-259 (2010).
- Macurek, L. Polo-like kinase-1 is activated by aurora A to promote checkpoint recovery. Nature. 455, 119-123 (2008).
- van der Eb, A. J., Graham, F. L. Assay of transforming activity of tumor virus DNA. Methods. Enzymol. 65, 826-839 (1980).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. Biotechniques. 42, 71-75 (2007).
- Roszik, J., Lisboa, D., Szollosi, J., Vereb, G. Evaluation of intensity-based ratiometric FRET in image cytometry--approaches and a software solution. Cytometry A. 75, 761-767 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.