Method Article
Ультразвуковая диафрагма у взрослых: получение и интерпретация изображений
В этой статье
Резюме
Ультразвуковое исследование в месте оказания медицинской помощи (POCUS) является важным методом скрининга диафрагмальной дисфункции благодаря своей портативности, неинвазивности и возможностям визуализации в режиме реального времени. Несмотря на то, что современные протоколы POCUS с диафрагмой существуют, они страдают от низкой межоператорской надежности и отсутствия согласованных рекомендаций. Здесь мы опишем технику, которая воспроизводима и проста в исполнении.
Аннотация
Дисфункция диафрагмы является широко признанной проблемой во многих медицинских специальностях и клинических условиях. Своевременная и точная оценка диафрагмы жизненно важна не только у пациентов в критическом состоянии, где она играет роль в отлучении от искусственной вентиляции легких и респираторных исходах, но и в периоперационной сфере в качестве диагностического инструмента для выявления функции диафрагмального нерва. При оценке диафрагмы традиционно используются рентгеноскопия и исследования нервов, которые являются трудоемкими, дорогостоящими и непортативными. Ультразвуковое исследование в месте оказания медицинской помощи (POCUS) преодолевает эти барьеры и может быть использовано в качестве инструмента для неинвазивного скрининга функции диафрагмы. Тем не менее, POCUS для диагностики диафрагмальной дисфункции в настоящее время страдает от нескольких проблем, таких как отсутствие консенсусных рекомендаций, множественность протоколов и плохая межоператорная надежность среди существующих протоколов, особенно с оценкой хода купола диафрагмы и утолщения диафрагмы. Для решения этих проблем в данной рукописи представлен обзор доступной литературы по диафрагмальному POCUS и определен метод получения изображений, который является одновременно простым в выполнении и имеет высокую межоператорную надежность. Этот метод сначала описывает качественную оценку экскурсии диафрагмы, а затем количественную оценку экскурсии зоны аппозиции. Методика описана поэтапно вместе со всеми следующими параметрами: позиционирование пациента, выбор датчика, размещение зонда, оптимизация изображения и интерпретация.
Введение
Диагностическое ультразвуковое исследование можно разделить на два подразделения: консультативное и точечное. Консультативное ультразвуковое исследование включает в себя обследование, выполняемое отдельной командой специалистов, в то время как POCUS выполняется и интерпретируется врачом, ухаживающим за пациентом, в режимереального времени.
За последние несколько десятилетий диагностический POCUS превратился в преобразующий инструмент в современной медицине, и его применение быстро расширяется во всех специальностях. Эти приложения POCUS обусловлены неинвазивным характером ультразвука, портативностью и возможностями визуализации в режиме реального времени. Кроме того, в рамках диагностического POCUS приложения, которые достигли наибольшего распространения в клинической медицине, как правило, имеют как достаточно высокую точность по сравнению с золотым стандартом, так и высокую межнаблюдательную надежность 2,3. Например, POCUS легкого хорошо зарекомендовал себя для сужения дифференциальной диагностики дыхательной недостаточности и имеет четкие научно обоснованные рекомендации, поддерживающие его стандартизированное использование4. Однако, несмотря на то, что POCUS легкого хорошо установлен, остается неудовлетворенной потребность в разработке воспроизводимой сонографической оценки диафрагмы.
Такой протокол неинвазивной диафрагмальной оценки принесет пользу многим специальностям и клиническим ситуациям, включая, помимо прочего, интенсивную терапию, пульмонологию, периоперационную помощь (включая как анестезию общего назначения, так и узкоспециализированную регионарную анестезию) и неврологию. В отделении интенсивной терапии дисфункция диафрагмы является распространенной проблемой, часто возникающей из-за множественных основных патологий, таких как нервно-мышечные заболевания, критическая миопатия, травмы и недостаточность питания5. Пациенты в критическом состоянии часто подвержены высокому риску как нарушения сужения диафрагмы, так и недостаточной распознаванности этого явления6. Кроме того, ранняя диагностика диафрагмальной дисфункции важна, так как она не только может помочь в стратегиях управления вентиляцией, но и может быть ранним индикатором инфекции и сепсиса 7,8. Кроме того, длительная интубация может привести к значительной заболеваемости, смертности и увеличению расходов на здравоохранение2. В этих сценариях неинвазивный, портативный протокол для оценки диафрагмы может быть полезен для оценки целесообразности отлучения от искусственной вентиляции легких, оценки работы дыхания и прогнозирования вероятности успешного или неудачного экстубации 6,8,9,10,11.
В рамках регионарной анестезии диафрагмальный POCUS может иметь значение для скрининга диафрагмального пареза, связанного с транзиторной дисфункцией диафрагмального нерва при блокаде плечевого сплетения. Несмотря на хорошую переносимость здоровыми пациентами, паралич диафрагмального нерва может привести к респираторному дистрессу у пациентов с ограниченным легочным резервом. Кроме того, в периоперационной сфере POCUS диафрагмы может служить диагностическим инструментом для пациентов в предоперационных, интраоперационных и послеоперационных условиях. Например, диафрагмальный POCUS может быть использован для выявления повреждения диафрагмального нерва, возникающего в результате широкого спектра процедур, включая, помимо прочего, аортокоронарное шунтирование с забором внутренней молочной артерии, абляцию фибрилляции предсердий,а также операции на шейном или грудном отделе 3,12.
Наконец, в рамках неврологии, POCUS может облегчить оценку диафрагмальной функции при неврологических заболеваниях, таких как миастения, мышечная дистрофия Дюшена, боковой амиотрофический склероз и нарушения мозгового кровообращения.
Точная оценка диафрагмы имеет важное значение из-за ее жизненно важной роли в восстановительной функции. Оксигенация и вентиляция зависят от создания отрицательного внутригрудного давления, создаваемого диафрагмой, куполообразной мышцей, разделяющей брюшную полость и грудную клетку, которая состоит из нескольких мышечных и сухожильных оболочек14,15. Диафрагма имеет как минимум два основных компонента, которые можно различить на ультразвуке: купол диафрагмы (DoD) и зона наложения (ZOA). DoD — это центральная сухожильная часть, которая на ультразвуке имеет гиперэхогенный и искривленный вид. ZOA представляет собой латеральную часть диафрагмы, которая прикрепляется к грудной клетке и состоит из мышечных волокон, проходящих параллельно и проксимальнее внутренней поверхности грудной стенки 3,15. ZOA тонкая (обычно <1 см в толщину), но она увеличивается в толщине во время вдоха по мере сжатия диафрагмы. В ЗОА диафрагма имеет характерный для УЗИ вид с тремя слоями, включая безэхогенный мышечный слой, который ограничен снаружи поверхностной гиперэхогенной теменной плеврой и внутренне глубокой гиперэхогенной брюшиной 3,13.
Для оценки диафрагмы было предложено несколько неинвазивных сонографических протоколов, включающих как качественный, так и количественный подходы. Качественная визуальная оценка, самый простой подход, включает в себя оценку движения диафрагмы двусторонним способом, во время дыхательного или витального дыхания, с использованием двумерного ультразвука, также известного как режим яркости (B-режим). В отличие от этого, количественные протоколы обычно начинаются с B-режима и добавляют одномерный ультразвук, также известный как режим движения (M-mode), для измерения одной из двух вещей: смещения купола диафрагмы (DoD) и/или утолщения диафрагмы 2,3,5,13. Измерение экскурсии DoD осуществляется с помощью низкочастотного преобразователя, при этом ультразвуковой луч направляется через заднюю треть гемидиафрагмы под перпендикулярным углом. Затем М-режим используется для измерения отклонения во время дыхания в жизненно важных емкостях легких.
В качестве альтернативы для измерения утолщения диафрагмы используется высокочастотный линейный преобразователь в два этапа. Сначала высокочастотный преобразователь размещается вдоль бока пациента над диафрагмой с В-модой для определения зоны аппозиции (ZOA)3. Во-вторых, оценка утолщения диафрагмы выполняется с помощью М-режима путем измерения толщины диафрагмы (в миллиметрах) от висцеральной до теменной плевры и вычисления изменения толщины по следующему уравнению 2,3,5,13:
Изменение толщины = (Толщина в конце вдоха - Толщина в конце экспирации) / Толщина в конце экспирации
Однако количественные методы (ход DoD и диафрагмальное сгущение) страдают от низкой межоператорной надежности. Межоператорская надежность при измерении хода МО низка по нескольким причинам. Во-первых, провайдеры испытывают трудности с поиском согласованного угла визуализации хода купола диафрагмы3. Во-вторых, оценка с левой стороны часто затруднена из-за небольшого акустического окна через селезенку 2,16. Например, в исследованиях указано, что идентификация левосторонней диафрагмальной экскурсии невозможна в 65-79% случаев17. В-третьих, внутрибрюшное содержимое и положение пациента могут влиять на диапазон экскурсиидиафрагмы2.
Аналогичным образом, измерение утолщения диафрагмы имеет низкую межоператорную надежность по крайней мере по двум причинам. Во-первых, естественная толщина мембраны приводит к миллиметровым погрешностям измерения. Во-вторых, изменчивость толщины диафрагмы в зависимости от межреберных промежутков и от латеральности пациента дополнительно обуславливает дисперсию измерений 2,3,17. Признавая эти многочисленные ограничения, в 2022 году эксперты пришли к консенсусу по ультразвуковой диагностике диафрагмы у пациентов в критическом состоянии, что существующие методы не стандартизированы и что многие из них требуют квалифицированного сонографиста18. Они отметили, что нет согласия по значениям пороговых значений для дисфункции диафрагмы, основанных на фракции утолщения, и что измерение фракции утолщения является сложным навыком с крутой кривой обучения13,18. Кроме того, использование в литературе множества различных сонографических протоколов усугубило неизбежные проблемы, затруднив сравнение исследований, что привело к гетерогенности исследований19.
Чтобы решить эти проблемы, в данной рукописи представлен обзор доступной литературы по диафрагмальному POCUS и определен метод получения изображений, который одновременно прост в выполнении и обладает высокой межоператорной надежностью. Этот осуществимый, но эффективный протокол начинается с качественной оценки диафрагмального вмешательства, за которым следует недавно валидированная количественная оценка экскурсии самой черепной точки ZOA17,19.
протокол
Все процедуры, выполненные в исследованиях с участием людей, соответствовали этическим стандартам институционального исследовательского комитета системы здравоохранения Университета Дьюка и Хельсинкской декларации 1964 года и ее более поздним поправкам или сопоставимым этическим стандартам. Информированное согласие было получено от всех участников. Дополнительный файл 1 содержит наиболее важные кадры из каждого видео.
1. Фаза 1: Качественная оценка диафрагмального экскурсии (визуальный скрининг на грубую гемидиафрагматическую дисфункцию)
- Настройка аппарата и позиционирование пациента
- Выбор пробника: Выберите низкочастотный (≤ 5 МГц) преобразователь (криволинейный или секторный массив [также известный как «фазированная решетка»]19.
- Нанесите на зонд гель для ультразвуковой связи.
- Настройки прибора: Выберите предустановку брюшной полости.
- Расположите пациента в полулежачем положении.
- Техника сканирования
- Оценка правой гемидафрагмы
- Расположите зонд на правом фланге,5-7-м межреберье, на средней подмышечной линии так, чтобы луч был выровнен по корональной плоскости тела, а индикатор зонда был направлен краниально (рис. 1 и рис. 2А).
- Отрегулируйте положение зонда (ползунок, веер, камень по мере необходимости) до тех пор, пока изображение не будет центрировано на диафрагме, при этом также будут видны следующие структуры: поддиафрагмальный орган (печень или селезенка), диафрагма, позвоночник и наддиафрагмальное пространство (т.е. плевральная полость)19 (рис. 2B, C).
- Попросите пациента сделать медленный вдох и медленный выдох.
- Нажмите «Получить » (или эквивалент), чтобы снять короткий клип во время дыхания пациента.
- Визуально оценивайте проходимость диафрагмы как одну из следующих: «Сильно не повреждена» (Видео 1 и Видео 2), «Сильно отсутствует» (Видео 3 и Видео 4) или «Неопределенная» (Видео 5 и Видео 6).
- Если требуется неопределенная или дополнительная количественная оценка, перейдите к разделу 2 (Фаза 2) протокола.
- Оценка левой гемидиафрагмы: повторите шаги 1.2.1.1-1.2.1.6 с левой стороны пациента.
- Оценка правой гемидафрагмы
2. Фаза 2: Количественная оценка экскурсии ZOA
- Настройка аппарата и позиционирование пациента
- Выбор пробника: Выберите высокочастотный (>10–13 МГц) линейный преобразователь.
- Нанесите на зонд гель для ультразвуковой связи.
- Настройки инструмента: Выберите предустановку для опорно-двигательного аппарата (MSK), если она доступна. Если предустановка MSK недоступна, выберите любую предустановку и используйте ту же предустановку для всех операций высокочастотного диафрагмального сканирования.
- Расположите пациента в полулежачем положении (повторите шаг 1.1.4).
- Техника сканирования
- Оценка правой гемидафрагмы
- Поместите зонд на среднюю подмышечную линию на уровне восьмого или девятого межреберья, индикатор зонда должен быть направлен цефаладой в сторону головы пациента (рисунок 3 и рисунок 4А).
- Наклоните луч перпендикулярно грудной стенке и центрируйте ось так, чтобы межреберное пространство было центрировано в экране, а краниальные и каудальные ребра были видны по краям экрана (рис. 4B).
- Установите глубину таким образом, чтобы плевральная линия или диафрагма была видна в средней трети экрана.
ПРИМЕЧАНИЕ: Как правило, это означает глубину 3-5 см, но может быть и больше, если есть дополнительная подкожная клетчатка. - Установите усиление таким образом, чтобы линия диафрагмы/плевры заметно отличалась от окружающих структур.
- Определите плевральную линию на экране.
- Измерьте конечно-инспираторное расположение ЗОА.
- Дайте пациенту следующие инструкции: «Вдохните полностью, а затем задержите дыхание на 4 секунды. Если вы не можете выдержать 4 секунды, то, пожалуйста, задержите дыхание на любое удобное для вас время».
- Во время задержки дыхания пациента следует за плевральной линией каудально до тех пор, пока не будет достигнуто место, где плевральная линия видна только в части промежутка ребер, а оставшаяся промежуток содержит диафрагму на той же глубине, что и плевральная линия (Видео 7 и Видео 8).
ПРИМЕЧАНИЕ: Это промежуток между ребрами, одновременно содержащий плевру и диафрагму, был назван зоной аппозиции (ZOA). - Отрегулируйте положение зонда (слайд, веер, камень по мере необходимости) до тех пор, пока изображение не будет центрировано на ZOA, при этом также будут видны следующие структуры: подкожная клетчатка над экраном и ребро на экране любого размера (рис. 4C).
- Используя непостоянный маркер кожи, нарисуйте на пациенте линию, которая перпендикулярна длинной оси ультразвукового датчика и делит зонд пополам, чтобы отметить промежуток между местами обнаружения ЗОА (рисунок 5A). Маркировка должна быть выровнена по ZOA, на переходе между плеврой и диафрагмой (рис. 4B, C).
- Попросите пациента выдохнуть, а затем «дышать нормально» (так называемое дыхательное дыхание).
- Если вы не уверены в том, что вы определили ЗОА, повторите шаги 2.2.1.6.1-2.2.1.6.3 и осмотрите предполагаемую диафрагму в этом ракурсе, чтобы увидеть ее изменения в течение дыхательного цикла.
ПРИМЕЧАНИЕ: Истинная диафрагма должна утолщаться во время вдоха и уменьшаться в толщине во время выдоха. - Повторите измерение один раз (т.е. шаги 2.2.1.6.1-2.2.1.6.5).
- Возьмите среднее значение двух измерений и используйте его для определения конечного положения ZOA на вдохе (рисунок 5B).
- Измерьте конечное местоположение выдоха ZOA.
- Дайте пациенту следующие инструкции: «Вдохните полностью, затем выдохните до упора, а затем задержите дыхание на 4 секунды. Если вы не можете выдержать 4 секунды, то, пожалуйста, задержите дыхание на любое удобное для вас время».
- Сдвиньте зонд краниально, чтобы найти место окончания выдоха ZOA.
- Повторите шаги 2.2.1.6.3-2.2.1.6.4.
- Попросите пациента «дышать нормально».
- Повторите измерение один раз (т.е. шаги 2.2.1.7.1-2.2.1.7.4).
- Возьмите среднее значение двух измерений и используйте его для окончательного значения местоположения ZOA в конце выдоха.
- Измерение отклонения ZOA
- Измерьте расстояние между усредненными отметинами кожи на конце вдоха и усредненными отметинами на коже на конце выдоха в см с помощью линейки. Расстояние между двумя внешними отметками на коже представляет собой максимальный ход диафрагмы (рис. 5C).
- Оценка левой гемидиафрагмы
- Повторите все подшаги, содержащиеся в шаге 2.2.1, на левой грудной клетке.
- Оценка правой гемидафрагмы
Результаты
Этот протокол диафрагмального ультразвукового исследования начинается с качественной оценки каждого гемиторакса во время дыхания с целью сортировки каждой гемидиафрагмы по одной из трех категорий: полностью неповрежденная экскурсия, сильно нарушенная экскурсия или неопределенная. Примеры совершенно нормального отклонения жизненной емкости правой и левой гемидиафрагмы показаны на видео 1 и видео 2 соответственно. Примеры грубо нарушенной экскурсии жизненной емкости правой и левой гемидиафрагм показаны на видео 3 и видео 4 соответственно. Примеры качественно неопределенного изменения жизненной емкости правой и левой гемидиафрагм показаны на видео 5 и видео 6 соответственно.
Качественной оценки, вероятно, будет достаточно, чтобы ответить на вопрос о том, имеет ли место грубая гемидиафрагматическая дисфункция в большинстве случаев. Однако, если либо качественное обследование дает неопределенные результаты, либо клиницисту требуются более подробные данные о гемидиафрагматической функции (например, для количественной оценки влияния регионарной блокады нерва на гемидиафрагматическую функцию в рамках научного исследования), то этот протокол требует количественного измерения перемещения самой черепной части ЗОА. В настоящее время нормальные значения отклонения ZOA имеют скудные данные для проверки.
Тем не менее, некоторые выводы могут быть сделаны из нормальных значений соответствующего измерения: хода купола диафрагмы (DoD). Было показано, что экскурсия Министерства обороны США имеет переменный диапазон, в зависимости от исследования. Например, повествовательный обзор, проведенный Boussuges et al., показал, что нормальное отклонение от Министерства обороны США варьируется в зависимости от пола и латеральности 3,13. В частности, нормальный диапазон отклонения дыхательного дыхания у мужчин колеблется от 1,4 см до 2,3 см справа и от 1,7 см до 2,4 см слева; У женщин он колеблется от 1,4 см до 2,7 см справа и от 1,6 до 2,4 см слева. Аналогичным образом, для дыхания с жизненно важными возможностями нормальное отклонение DOD у мужчин колеблется от 5,3 см до 7,8 см справа до 5,4 см до 7,8 см слева; Для женщин он колеблется от 4,7 см до 8,0 справа и от 4,8 см до 6,4 см слева 3,13.
Примечательно, что для количественного метода измерения отклонения ZOA, описанного в данной рукописи, абсолютные нормальные значения отклонения ZOA еще предстоит твердо установить. Кроме того, опубликованные нормальные значения для метода отклонения DoD также не должны использоваться для дифференциации нормальных и аномальных значений для метода отклонения ZOA, поскольку четкая формула, связывающая эти два значения, не была очерчена. Тем не менее, основным принципом оценки диафрагмы является внутрисубъектное сравнение: (а) левое и правое (б), до и после вмешательства, и (в) наблюдение за изменениями с течением времени. Такие сравнения допускаются методом отклонения ZOA даже при отсутствии опубликованных нормальных значений для данной методики.
Например, Kim et al. предложили использовать измерение экскурсии ZOA для сортировки пациентов по трем категориям диафрагмальной дисфункции путем сравнения гемидиафрагматической экскурсии до и после вмешательства по притуплению диафрагмального нерва20: i) полная дисфункция диафрагмального нерва: либо снижение на >75% экскурсии ZOA после вмешательства, либо парадоксальное движение диафрагмы; ii) частичная дисфункция диафрагмального нерва: снижение экскурсии ЗОА на 25–75% после вмешательства; iii) незначительные изменения диафрагмальной функции или их отсутствие: снижение экскурсии ZOA на 0–25% после вмешательства.

Рисунок 1: Представление протокола качественной оценки полного отклонения диафрагмы. Обратите внимание на анатомическое изображение диафрагмы (ярко-зеленая линия), расположенной над печенью (слева) и селезенкой (справа). Для визуализации диафрагмы для качественной оценки криволинейный зонд должен быть размещен на средней подмышечной линии так, чтобы луч был выровнен по корональной плоскости тела, а пациент находился в полулежачем положении. Перепечатано с разрешения masterthemachines.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Качественная оценка диафрагмального вмешательства. (А) Правильное позиционирование зонда с помощью низкочастотного преобразователя (криволинейного или секторного массива), расположенного на правом или левом фланге в 5–7-м межреберье, средней подмышечной линии, и индикатора зонда, направленного краниально. (В) Идентификация правой гемидиафрагмы в В-режиме при качественной оценке. Диафрагма видна в виде яркой гиперэхогенной полосы, расположенной над печенью. Для оптимального обзора должен быть виден поддиафрагмальный корешок. (В) Идентификация левой гемидиафрагмы в В-режиме при качественной оценке. Селезенка здесь видна на месте печени. После того, как диафрагма первоначально визуализирована, можно наблюдать за движением диафрагмы для оценки грубой гемидиафрагматической дисфункции. Обратитесь к Видео 1, Видео 2, Видео 3, Видео 4, Видео 5 и Видео 6 для примера или как вправо, так и влево нормальное, аномальное и неопределенное смещение диафрагмы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Представление протокола для количественной оценки экскурсии ZOA. Обратите внимание на анатомическое изображение диафрагмы с концом выдоха в виде темно-синей линии, а диафрагмы с концом вдоха — в виде светло-голубой линии. Для визуализации ЗОА для количественной оценки линейный зонд должен быть размещен на средней подмышечной линии так, чтобы луч был выровнен перпендикулярно туловищу и пациенту в полулежачем положении. Перепечатано с разрешения masterthemachines.com. Сокращение: ZOA = зона аппозиции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
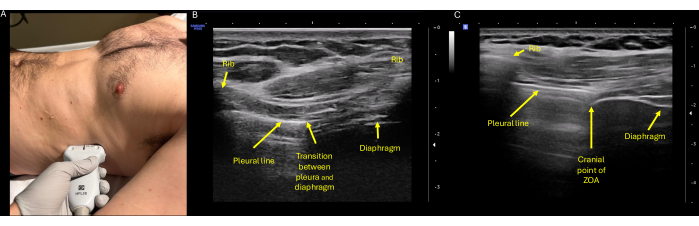
Рисунок 4: Ультразвуковая оценка экскурсии ЗОА. (А) Правильное позиционирование зонда с помощью высокочастотного (линейного) преобразователя, расположенного на правом или левом фланге по среднеподмышечной линии на уровне восьмого или девятого межреберья, при этом индикатор зонда должен быть направлен на голову пациента. (B) Идентификация ZOA, которая определяется как латеральная часть диафрагмы, которая прикрепляется к грудной клетке. На ультразвуковом исследовании его можно определить в точке перехода диафрагмы и плевры, показанной здесь, с центром между двумя ребристыми пространствами. (C) Самый головной сегмент ZOA, опять же соответствующий промежутку между ребрами, которое показывает одновременно аэрированное легкое и диафрагму. Здесь характерный трехслойный вид диафрагмы, с поверхностной гиперэхогенной теменной плеврой снаружи, средним безэхогенным мышечным слоем и глубокой гиперэхогенной брюшиной. Сокращение: ZOA = зона аппозиции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Маркировка и измерение хода ZOA. (А) После того, как ЗОА идентифицирована после полного выдоха после вдоха с жизненной емкостью, от центра зонда проводится перпендикулярная линия, чтобы отметить начальное местоположение ЗОА в конце выдоха. (Б) После того, как шаги повторяются и ЗОА снова идентифицируется после выдоха от второго вдоха жизненной емкости, от центра зонда проводится новая линия. Это вторая идентифицированная локализация ЗОА с концом выдоха. Затем расстояние между двумя измерениями усредняется, и средняя линия используется в качестве конечного значения местоположения ZOA в конце выдоха. Те же шаги повторяются для получения маркировки конца вдоха ZOA. Маркировка конца вдоха и конечного выдоха может быть получена в любом порядке. (В) Расстояние между усредненными отметинами кожи на конце выдоха и усредненными отметинами на коже в конце вдоха измеряется линейкой в сантиметрах. Это расстояние представляет собой количественный ход диафрагмы. Сокращение: ZOA = зона аппозиции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Рисунок 6: Маневр зонда для преодоления затенения ребер. Линейный преобразователь может вращаться между двумя ребрами для идентификации ZOA в случае, если ребро закрывает местоположение ZOA. Сокращение: ZOA = зона аппозиции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Видео 1: Корональный снимок, полученный с помощью низкочастотного преобразователя, центрированного на правой гемидиафрагме, показывает качественно нормальный ход диафрагмы при дыхании при жизненной емкости легких. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 2: Корональная проекция, полученная с помощью низкочастотного преобразователя, центрированного на левой гемидиафрагме, показывает качественно нормальную экскурсию диафрагмы при дыхании при жизненной емкости легких. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 3: Корональная проекция, полученная с помощью низкочастотного преобразователя с центром в правой гемидиафрагме, показывает полное отсутствие диафрагмального экскурсии во время попытки дыхания при жизненной емкости легких. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 4: Корональная проекция, полученная с помощью низкочастотного преобразователя, расположенного с центром в левой гемидиафрагме, показывает полное отсутствие диафрагмальной экскурсии при попытке дыхания при жизненной емкости легких. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 5: Корональная проекция, полученная с помощью низкочастотного преобразователя, центрированного на правой гемидиафрагме, показывает сильно субмаксимальный (неопределенный) уровень диафрагмального хода при попытке дыхания с жизненной емкостью. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 6: Корональный снимок, полученный с помощью низкочастотного преобразователя, центрированного на левой гемидиафрагме, показывает сильно субмаксимальный (неопределенный) уровень диафрагмального хода во время попытки дыхания с жизненно важной емкостью легких. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 7: Корональный снимок, полученный с помощью высокочастотного линейного преобразователя, показывающий нормальное движение самой краниальной части ЗОА во время дыхательного дыхания. Сокращение: ZOA = зона аппозиции. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 8: Корональный снимок, полученный с помощью высокочастотного линейного преобразователя, показывающий, как преобразователь скользит каудально, чтобы следовать нормальному движению самой краниальной части ЗОА во время вдоха с жизненной емкостью. Сокращение: ZOA = зона аппозиции. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 9: Корональный снимок, полученный с помощью высокочастотного линейного преобразователя, показывающий, как в конце вдоха самая черепная часть ZOA может быть скрыта тенью ребер. Сокращение: ZOA = зона аппозиции. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительный файл 1: Ссылка для просмотра наиболее важных фотографий из каждого видео. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
POCUS предлагает очевидные преимущества для оценки диафрагмы, включая портативность, неинвазивность и возможности визуализации в режиме реального времени. Эти сильные стороны могут быть использованы с помощью этого осуществимого и доступного протокола и могут быть применены в различных клинических условиях. Этот протокол начинается с качественной оценки диафрагмального вмешательства, чтобы ответить на вопрос о наличии грубой гемидиафрагмальной дисфункции. Если ответ неясен или если требуется более конкретная информация, на втором этапе протокола дается уточнение путем количественного измерения отклонения ZOA. Эти измерения могут помочь в принятии клинических решений за счет использования внутрисубъектного сравнения латеральности, до и после вмешательства или оценки изменений с течением времени.
Традиционно оценка диафрагмы основывалась на таких методах, как рентгенография грудной клетки, рентгеноскопия, компьютерная томография, исследования проводимости диафрагмального нерва и трансдиафрагмальные измерения давления. Несмотря на то, что эти методы предоставляют ценную информацию, они часто требуют много времени, дорого, не портативны и иногда предлагают только статическую визуализацию. Ультразвук имеет преимущества перед этими недостатками. Примечательно, что на горизонте появляются некоторые передовые ультразвуковые подходы для оценки диафрагмы, которые включают в себя двумерную визуализацию с отслеживанием спеклов и эластографию сдвиговой волны. Эти подходы оценивают тканевые механические свойства диафрагмы и имеют экспериментальные данные, подтверждающие их обоснованность3. Тем не менее, слежение за спеклами и эластография сдвиговой волны требуют передовых навыков и оборудования для сонографии, которые редко доступны обычному врачу.
В качестве альтернативы многие авторы выступают за использование количественного POCUS для оценки функции диафрагмы. Как объяснялось во введении, двумя методами, традиционно используемыми для этой цели, являются измерение хода DoD и утолщение диафрагмы. Эти протоколы хорошо описаны, и их клиническая корреляция продолжает изучаться 3,6,13,21. Недавно были опубликованы протоколы, упрощающие методы оценки толщины диафрагмы и фракции утолщения как у здоровых, так и у тяжелобольных пациентов, что делает эти протоколы доступными для клиницистов с базовыми знаниями в области ультразвука.
В последние годы оценка функции диафрагмы у пациентов в критическом состоянии привлекла к себе внимание, поскольку ее важная роль в оценке респираторных исходов становится все более очевидной. У пациентов, нуждающихся в искусственной вентиляции легких, может развиться атрофия неиспользования диафрагмы и снижение сократительной прочности, что было связано с повышенной смертностью 6,22. Гипотрофия диафрагмы может проявиться уже через 24 ч после начала искусственной вентиляции легких11. Таким образом, раннее распознавание дисфункции мышц диафрагмы с помощью неинвазивных инструментов, таких как POCUS, имеет жизненно важное значение. Исследование Goligher et al. показало, что у пациентов с искусственной вентиляцией легких оценка толщины правой полудиафрагмы по POCUS может быть как осуществимой, так и воспроизводимой23. Тем не менее, они обнаружили, что измерения толщины левого полушария и утолщения фракции на двустороннем уровне не были воспроизведены. Как утолщение диафрагмы, так и ход DoD ограничены низкой межоператорной надежностью и дисперсией измерений 2,15,16.
Кроме того, отсутствует консенсус экспертов относительно того, какой ультразвуковой режим лучше всего подходит для измерения толщины диафрагмы (В-режим против М-режима) и в какой точке дыхательного цикла оптимально выполнять измерение. В дополнение к проблемам оператора, сами пациенты также могут столкнуться с путаницей. У пациентов в критическом состоянии крайне важно учитывать как патологию, так и физиологию пациента. Например, хронические заболевания, такие как хроническая обструктивная болезнь легких, интерстициальная болезнь легких или нервно-мышечные расстройства, могут вызывать снижение подвижности диафрагмы, в то время как у пациентов с застойной недостаточностью здоровья и муковисцидозом может наблюдаться аномальное утолщение диафрагм 6,13. Кроме того, вентиляция с положительным давлением может влиять на сонографические измерения, вызывая уменьшение хода диафрагмы и уменьшение утолщения18.
Таким образом, существует неудовлетворенная потребность в простом, воспроизводимом протоколе получения изображений для диафрагмального ультразвука, который может быть выполнен в месте оказания медицинской помощи. Чтобы удовлетворить эту неудовлетворенную потребность, мы разработали научно обоснованный протокол, который проводит скрининг диафрагмальной дисфункции в два этапа: сначала качественно, а затем, при необходимости, количественно, причем последний этап выполняется с использованием недавно валидированного метода измерения перемещения самой черепной части ЗОА.
Качественная оценка движения диафрагмы является хорошо зарекомендовавшим себя методом, о котором сообщалось в литературе еще в 1970-х годах. Качественная оценка при ультразвуковом исследовании в B-режиме не требует расчетов и часто может дать двоичный ответ (да или нет на вопрос о том, имеет ли место совершенно нормальный ход диафрагмы). Вариации качественного подхода были проверены в многочисленных исследованиях и признаны полезными для оценки грубой асимметрии гемидиафрагматической функции 2,3,5,6,13,18,23.
В тех случаях, когда первоначальный качественный скрининг дает неубедительные данные о функции каждой гемидиафрагмы, предложенный нами протокол переходит к недавно валидированному количественному подходу: измерению экскурсии самой черепной части ЗОА. Этот метод был впервые описан в 2017 году Эль-Богдадли и впоследствии использован Kim et al. в 2019 году для скрининга диафрагмальной дисфункции после блокады верхнего стволового нерва19,20. Совсем недавно, в 2023 году, этот метод был протестирован и валидирован: Da Conceicao et al. сравнили этот новый метод с измерением как экскурсии DoD, так и фракции утолщения диафрагмы у 75 пациентов17. Авторы обнаружили, что измерение экскурсии самой краниальной части экскурсии ZOA имело значительно более высокий успех в измерении экскурсии обеих гемидиафрагм по сравнению с методом DoD. Метод ZOA имел 100% успешность на двусторонней основе, в то время как метод DoD смог измерить только 98,7% хода диафрагмы справа и 35% времени слева. В то время как метод утолщения продемонстрировал 100% успех в измерении обеих диафрагм, значения левой и правой фракции утолщения, полученные этим методом, не коррелировали у пациентов и не коррелировали с измерениями отклонения, полученными с использованием методов DoD и ZOA. Для метода фракции сгущения это отсутствие корреляции как с другими методами оценки функции диафрагмы, так и между левой и правой гемидиафрагмами у испытуемых, вызывает сомнения в общей валидности этого метода в качестве диагностического инструмента.
Поскольку метод экскурсии ZOA остается новым и незнакомым для большинства поставщиков, некоторые рекомендации по устранению неполадок могут помочь увеличить вероятность успеха. Во-первых, решающее значение имеет использование системного подхода, подобного тому, который изложен в этом протоколе. Во-вторых, поскольку первоначальная идентификация ZOA может быть сложной задачей, важно обеспечить правильное позиционирование зонда и определить известные анатомические ориентиры. Зонд должен находиться между передней и средней подмышечной линией, а реберные пространства должны быть центрированы на экране. ЗОА может быть идентифицирована по характерному трехслойному внешнему виду и обычно обнаруживается на глубине 1,5-3 см (в зависимости от ИМТ пациента) и часто обнаруживается ниже косфорренического угла при вдохе 2,16. Если ЗОА не идентифицирована, то есть две возможности: она скрыта за тенью ребер (Видео 9) или постоянно затемнена легким, движущимся в поле19. Первая возможность может быть устранена путем наклонного вращения преобразователя для выравнивания по межреберным промежуткам между ребрами (рис. 6). Вторая возможность может быть решена путем сползания в более каудальное межреберье.
Несмотря на многочисленные преимущества, этот протокол диафрагмального POCUS имеет ряд ограничений. Во-первых, протокол требует визуализации самой черепной части ЗОА, что может быть невозможно при наличии диффузной подкожной эмфиземы, повязок, дренажей, трубок или связующих веществ. Во-вторых, на сегодняшний день метод экскурсии ZOA был проверен на альтернативных подходах только водном исследовании. Несмотря на то, что это единственное исследование продемонстрировало относительное превосходство экскурсии ZOA над двумя традиционными количественными подходами к диафрагмальному POCUS, метод ZOA не был протестирован на соответствие такому золотому стандарту, как рентгеноскопическая оценка функции диафрагмы. Такое сравнение с золотым стандартом необходимо для лучшего определения нормальных и аномальных значений для экскурсионного подхода ZOA. Кроме того, учитывая его новизну, этот протокол до сих пор не коррелировал с клиническими исходами. Тем не менее, до тех пор, пока нормативные значения метода ZOA не будут твердо установлены, этот метод все еще может быть полезен для количественной оценки степени асимметрии в гемидиафрагматической функции в различных клинических ситуациях, где только качественная оценка не имеет значения. В-третьих, эта оценка дает обобщенную информацию о функции диафрагмы, но ей не хватает специфичности, чтобы предоставить информацию о болезненных состояниях, таких как фиброз или точные показатели сократимости. Наконец, для успешного применения этого протокола в клинической практике требуется базовый уровень знаний POCUS. Тем не менее, эти методы оказываются более простыми, чем предыдущие измерения дисфункции диафрагмы POCUS (ход DoD и утолщение диафрагмы), поскольку они требуют меньшего количества измерений и меньшего знакомства с кнобологией. Кроме того, владение этим методом может быть быстро достигнуто с помощью тренировок. Следуя описанному протоколу и стратегиям устранения неполадок, воспроизводимая оценка диафрагмы может стать возможной для среднего врача с использованием простого ультразвукового оборудования, доступного в месте оказания медицинской помощи.
Раскрытие информации
У нас нет соответствующих разглашений информации или конфликтов интересов.
Благодарности
Благодарим доктора Финтана Хьюза за помощь в фотосъемке.
Материалы
| Name | Company | Catalog Number | Comments |
| Medical Ruler | MediChoice | NA | We used Medichoice as that is what is readily available at our institution and it comes with the skin marker, however any medical ruler will work. The majority of skin markers come with a type of ruler or measurement system, but if not a separate ruler can be used. |
| Skin Marker | MediChoice | NA | We again used Medichoice as that is what is readily available at our institution and it comes with the ruler, however any standard skin marker will work. |
| Ultrasound Gel | Aquasonic | NA | Any standard gel will work. Sterile packs are not necessary but can be used on a case-by-case basis at the providers discretion. |
| Ultrasound Machine | Samsung and GE | NA | Any standard portable ultrasound machine will suffice. |
Ссылки
- Bronshteyn, Y. S., Blitz, J., Hashmi, N., Krishnan, S. Logistics of perioperative diagnostic point-of-care ultrasound: Nomenclature, scope of practice, training, credentialing/privileging, and billing. Int Anesthesiol Clin. 60 (3), 1-7 (2022).
- Osman Elew, A. N. E., Abd Alrahman, A. A. H., El Khayat, H. M. H. Diaphragmatic ultrasound: Review article. The Egyptian Journal of Hospital Medicine. 87 (1), 1006-1009 (2022).
- Boussuges, A., Rives, S., Finance, J., Bregeon, F. Assessment of diaphragmatic function by ultrasonography: Current approach and perspectives. World J Clin Cases. 8 (12), 2408-2424 (2020).
- Volpicelli, G., et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med. 38 (4), 577-591 (2012).
- Saad, M., et al. Ultrasonographic assessment of diaphragmatic function and its clinical application in the management of patients with acute respiratory failure. Diagnostics (Basel). 13 (3), 411 (2023).
- Santana, P. V., Cardenas, L. Z., Albuquerque, A. L. P. Diaphragm ultrasound in critically ill patients on mechanical ventilation-evolving concepts. Diagnostics (Basel). 13 (6), 1116 (2023).
- Petrof, B. J. Diaphragm weakness in the critically ill: Basic mechanisms reveal therapeutic opportunities. Chest. 154 (6), 1395-1403 (2018).
- Chu, S. E., et al. Point-of-care application of diaphragmatic ultrasonography in the emergency department for the prediction of development of respiratory failure in community-acquired pneumonia: A pilot study. Front Med. 9, 960847 (2022).
- Suttapanit, K., Wongkrasunt, S., Savatmongkorngul, S., Supatanakij, P. Ultrasonographic evaluation of the diaphragm in critically ill patients to predict invasive mechanical ventilation. J Intensive Care. 11 (1), 40 (2023).
- Vivier, E., et al. Diaphragm ultrasonography to estimate the work of breathing during non-invasive ventilation. Intensive Care Med. 38 (5), 796-803 (2012).
- Eduardo Garrido-Aguirre, S. a. N. S. Diaphragmatic ultrasonography, a novel approach in critical care. Ultrasound Q. 36, 54-58 (2020).
- Sferrazza Papa, G. F., et al. A review of the ultrasound assessment of diaphragmatic function in clinical practice. Respiration. 91 (5), 403-411 (2016).
- Santana, P. V., Cardenas, L. Z., Albuquerque, A. L. P., Carvalho, C. R. R., Caruso, P. Diaphragmatic ultrasound: A review of its methodological aspects and clinical uses. J Bras Pneumol. 46 (6), e20200064 (2020).
- Qian, Z., Yang, M., Li, L., Chen, Y. Ultrasound assessment of diaphragmatic dysfunction as a predictor of weaning outcome from mechanical ventilation: A systematic review and meta-analysis. BMJ Open. 8 (9), e021189 (2018).
- Kharma, N. Dysfunction of the diaphragm: Imaging as a diagnostic tool. Curr Opin Pulm Med. 19 (4), 394-398 (2013).
- Tsui, J. J., Tsui, B. C. A novel systematic abc approach to diaphragmatic evaluation (abcde). Can J Anaesth. 63 (5), 636-637 (2016).
- Da Conceicao, D., et al. Validation of a novel point-of-care ultrasound method to assess diaphragmatic excursion. Reg Anesth Pain Med. 49 (11), 800-804 (2023).
- Haaksma, M. E., et al. EXpert consensus on diaphragm ultrasonography in the critically ill (EXODUS): A delphi consensus statement on the measurement of diaphragm ultrasound-derived parameters in a critical care setting. Crit Care. 26 (1), 99 (2022).
- El-Boghdadly, K., Goffi, A., Chan, V. Point of care diaphragmatic ultrasound made easy. Can J Anaesth. 64 (3), 327-328 (2017).
- Kim, D. H., et al. Superior trunk block: A phrenic-sparing alternative to the interscalene block: A randomized controlled trial. Anesthesiology. 131 (3), 521-533 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431 (2023).
- Goligher, E. C., et al. Measuring diaphragm thickness with ultrasound in mechanically ventilated patients: feasibility, reproducibility and validity. Intensive Care Med. 41 (4), 642-649 (2015).
- Pereira, R. O. L., et al. Point-of-care lung ultrasound in adults: Image acquisition. J Vis Exp. (193), e64722 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены