Method Article
Ultrassonografia diafragmática em adultos: aquisição e interpretação de imagens
Neste Artigo
Resumo
O ultrassom point-of-care (POCUS) é uma técnica essencial para a triagem de disfunção diafragmática devido à sua portabilidade, não invasividade e recursos de imagem em tempo real. Embora existam protocolos POCUS diafragmáticos atuais, eles sofrem de baixa confiabilidade interoperadores e carecem de diretrizes de consenso. Aqui descrevemos uma técnica que é reprodutível e simples de executar.
Resumo
A disfunção do diafragma é uma preocupação amplamente reconhecida em várias especialidades médicas e ambientes clínicos. A avaliação oportuna e precisa do diafragma é vital não apenas em pacientes críticos, onde ele tem um papel no desmame da ventilação mecânica e nos resultados respiratórios, mas também na arena perioperatória como uma ferramenta diagnóstica para detectar a função do nervo frênico. A avaliação diafragmática tradicionalmente utiliza fluoroscopia e estudos nervosos que são demorados, caros e não portáteis. O ultrassom no local de atendimento (POCUS) supera essas barreiras e pode ser usado como uma ferramenta para triagem não invasiva da função diafragmática. No entanto, a POCUS para disfunção diafragmática atualmente sofre de vários problemas, como falta de diretrizes de consenso, multiplicidade de protocolos e baixa confiabilidade interoperador entre os protocolos existentes, principalmente com a avaliação da excursão da cúpula do diafragma e espessamento diafragmático. Para abordar essas questões, este manuscrito revisa a literatura disponível sobre POCUS diafragmática e identifica uma técnica de aquisição de imagens que é simples de executar e tem alta confiabilidade interoperador. Esta técnica descreve primeiro uma avaliação qualitativa da excursão do diafragma, seguida por uma avaliação quantitativa da excursão da zona de aposição. A técnica é descrita passo a passo, juntamente com todos os seguintes: posicionamento do paciente, seleção do transdutor, colocação da sonda, otimização da imagem e interpretação.
Introdução
O ultrassom diagnóstico pode ser separado em duas divisões: consultiva e no local de atendimento. A ultrassonografia consultiva incorpora um exame realizado por uma equipe especializada distinta, enquanto a POCUS é realizada e interpretada pelo clínico que cuida do paciente em tempo real1.
Nas últimas décadas, o POCUS diagnóstico emergiu como uma ferramenta transformadora na medicina moderna, com aplicações em rápida expansão em todas as especialidades. Essas aplicações de POCUS são impulsionadas pela natureza não invasiva do ultrassom, portabilidade e recursos de imagem em tempo real. Além disso, dentro do POCUS diagnóstico, os aplicativos que alcançaram a maior aceitação na medicina clínica tendem a ter precisão razoavelmente alta em comparação com um padrão-ouro e alta confiabilidade interobservador 2,3. Por exemplo, a POCUS do pulmão está bem estabelecida para restringir o diagnóstico diferencial de insuficiência respiratória e tem diretrizes claras baseadas em evidências que apoiam seu uso padronizado4. No entanto, embora a POCUS do pulmão esteja bem estabelecida, ainda há uma necessidade não atendida de desenvolver uma avaliação ultrassonográfica reprodutível do diafragma.
Esse protocolo de avaliação diafragmática não invasiva beneficiaria várias especialidades e situações clínicas, incluindo, mas não se limitando a, cuidados intensivos, pneumologia, cuidados perioperatórios (incluindo anestesia de uso geral e contextos de anestesia regional de subespecialidade) e neurologia. Na unidade de terapia intensiva, a disfunção diafragmática é uma preocupação comum, muitas vezes decorrente de múltiplas patologias subjacentes, como doenças neuromusculares, miopatia de doenças críticas, trauma e desnutrição5. Pacientes gravemente enfermos geralmente apresentam alto risco tanto para contração prejudicada do diafragma quanto para sub-reconhecimento desse fenômeno6. Além disso, o diagnóstico precoce da disfunção diafragmática é importante, pois não só pode auxiliar nas estratégias de manejo da ventilação, mas também a disfunção pode ser um indicador precoce de infecção e sepse 7,8. Além disso, a intubação prolongada pode levar a morbidade e mortalidade significativas e aumento dos gastos com saúde2. Nesses cenários, um protocolo portátil e não invasivo para avaliação diafragmática pode ser útil para avaliar a adequação para o desmame da ventilação mecânica, avaliar o trabalho respiratório e predizer a probabilidade de sucesso ou falha da extubação 6,8,9,10,11.
Dentro da anestesia regional, a POCUS diafragmática pode ter valor na triagem de paresia diafragmática relacionada à disfunção transitória do nervo frênico de bloqueios do plexo braquial. Embora bem toleradas por pacientes saudáveis, as paralisias do nervo frênico podem causar desconforto respiratório em pacientes com reserva pulmonar limitada. Além disso, na arena perioperatória, o POCUS do diafragma pode servir como uma ferramenta diagnóstica para pacientes no pré-operatório, intraoperatório e pós-operatório. Por exemplo, a POCUS diafragmática pode ser usada para detectar danos ao nervo frênico decorrentes de uma ampla gama de procedimentos, incluindo, mas não se limitando a, cirurgia de revascularização do miocárdio com retirada da artéria mamária interna, ablação de fibrilação atrial e cirurgias cervicais ou torácicas 3,12.
Por fim, dentro da especialidade de neurologia, o POCUS poderia facilitar a avaliação da função diafragmática em doenças neurológicas como miastenia gravis, distrofia muscular de Duchene, esclerose lateral amiotrófica e acidentes vascularescerebrais13.
A avaliação precisa do diafragma é essencial devido ao seu papel vital na função reparadora. A oxigenação e a ventilação dependem da geração de pressão intratorácica negativa criada pelo diafragma, um músculo em forma de cúpula que separa o abdome e o tórax e é composto por várias membranas musculares e tendíneas14,15. O diafragma tem pelo menos dois componentes principais que podem ser distinguidos no ultrassom: a cúpula do diafragma (DoD) e a zona de aposição (ZOA). O DoD é a porção tendínea central que exibe uma aparência hiperecogênica e curva na ultrassonografia. A ZOA é a porção lateral do diafragma que se liga à caixa torácica e consiste em fibras musculares que correm paralelas e proximais à superfície interna da parede torácica 3,15. O ZOA é fino (geralmente <1 cm de espessura), mas aumenta de espessura durante a inspiração à medida que o diafragma se contrai. Na ZOA, o diafragma tem uma aparência característica na ultrassonografia com três camadas, incluindo uma camada muscular anecoica que é delimitada externamente pelo pleural parietal hiperecoico superficial e internamente pelo peritônio hiperecoico profundo 3,13.
Vários protocolos ultrassonográficos não invasivos têm sido propostos para avaliação diafragmática, envolvendo abordagens qualitativas e quantitativas. A avaliação visual qualitativa, a abordagem mais simples, envolve a avaliação do movimento diafragmático bilateralmente, durante a respiração de capacidade corrente ou vital, usando ultrassom bidimensional, também conhecido como modo Brightness (modo B). Em contraste, os protocolos quantitativos normalmente começam com o modo B e adicionam ultrassom unidimensional - também conhecido como modo de movimento (modo M) - para medir uma de duas coisas: a excursão da cúpula do diafragma (DoD) e / ou espessamento diafragmático 2,3,5,13. A medição da excursão DoD é realizada com um transdutor de baixa frequência com o feixe de ultrassom direcionado através do terço posterior da cúpula diafragmática em um ângulo perpendicular. O modo M é então utilizado para medir a excursão durante a respiração da capacidade vital.
Alternativamente, a medição do espessamento diafragmático emprega um transdutor linear de alta frequência em duas etapas. Primeiro, o transdutor de alta frequência é colocado ao longo do flanco do paciente sobrejacente ao diafragma com modo B para identificar a zona de aposição (ZOA)3. Em segundo lugar, a estimativa do espessamento diafragmático é realizada usando o modo M, medindo a espessura diafragmática (em milímetros) da pleura visceral à parietal e calculando a mudança na espessura pela seguinte equação 2,3,5,13:
Mudança na espessura = (Espessura na inspiração final - Espessura na expiração final) / Espessura na expiração final
No entanto, os métodos quantitativos (excursão DoD e espessamento diafragmático) sofrem de baixa confiabilidade interoperador. A confiabilidade interoperador é baixa para a medição da excursão DoD por vários motivos. Primeiro, os provedores têm dificuldade em encontrar um ângulo consistente de visualização da excursão da cúpula do diafragma3. Em segundo lugar, a avaliação do lado esquerdo é frequentemente desafiadora devido à pequena janela acústica através do baço 2,16. Por exemplo, estudos citaram que a identificação da excursão diafragmática do lado esquerdo não é possível em até 65-79% dos casos17. Em terceiro lugar, o conteúdo intra-abdominal e o posicionamento do paciente podem influenciar a amplitude da excursão do diafragma2.
Da mesma forma, a medida do espessamento diafragmático tem baixa confiabilidade interoperador por pelo menos dois motivos. Primeiro, a espessura natural do diafragma faz com que erros milimétricos na medição sejam consequentes. Em segundo lugar, a variabilidade do diafragma na espessura entre os espaços das costelas e pela lateralidade do paciente causa ainda mais dispersão da medida 2,3,17. Em reconhecimento a essas muitas limitações, em 2022, um consenso de especialistas em ultrassonografia do diafragma em pacientes críticos concluiu que os métodos atuais não eram padronizados e que muitos exigiam um ultrassonografista qualificado18. Eles observaram que não houve concordância sobre os valores de corte para disfunção diafragmática com base na fração de espessamento e que a medição da fração de espessamento é uma habilidade difícil com uma curva de aprendizado acentuada13,18. Além disso, o uso de múltiplos protocolos ultrassonográficos diferentes na literatura aumentou os desafios inerentes, dificultando a comparação dos estudos, levando à heterogeneidade na pesquisa19.
Para resolver essas questões, este manuscrito revisa a literatura disponível sobre POCUS diafragmática e identifica uma técnica de aquisição de imagens que é simples de executar e demonstrou ter alta confiabilidade interoperador. Este protocolo viável, mas eficaz, começa com uma avaliação qualitativa da excursão diafragmática, seguida por uma avaliação quantitativa recentemente validada da excursão do ponto mais cranial da ZOA 17,19.
Protocolo
Todos os procedimentos realizados em estudos envolvendo participantes humanos estavam de acordo com os padrões éticos do comitê de pesquisa institucional do Duke University Health System e com a declaração de Helsinque de 1964 e suas alterações posteriores ou padrões éticos comparáveis. O consentimento informado foi obtido de todos os participantes. O Arquivo Suplementar 1 contém as imagens estáticas mais importantes de cada vídeo.
1. Fase 1: Avaliação qualitativa da excursão diafragmática (triagem visual para disfunção hemidiafragmática macroscópica)
- Configuração da máquina e posicionamento do paciente
- Seleção de sonda: Selecione um transdutor de baixa frequência (≤ 5 MHz) (curvilíneo ou matriz de setor [também conhecido como "phased-array"]19.
- Aplique gel de acoplamento de ultrassom na sonda.
- Configurações do instrumento: Selecione a predefinição abdominal.
- Posicione o paciente na posição semi-reclinada.
- Técnica de digitalização
- Avaliação da cúpula diafragmática direita
- Coloque a sonda no flanco direito, 5-7º espaço intercostal, linha axilar média com o feixe alinhado com o plano coronal do corpo e o indicador da sonda apontando cranialmente (Figura 1 e Figura 2A).
- Ajuste o posicionamento da sonda (slide, leque, rocha, conforme necessário) até que a visão esteja centralizada no diafragma com as seguintes estruturas também visíveis: órgão subdiafragmático (fígado ou baço), diafragma, coluna vertebral e espaço supradiafragmático (ou seja, espaço pleural)19 (Figura 2B,C).
- Peça ao paciente para inspirar e expirar lentamente.
- Clique em Adquirir (ou equivalente) para capturar um clipe curto durante a respiração do paciente.
- Avalie visualmente a excursão diafragmática como uma das seguintes: Grosseiramente intacta (Vídeo 1 e Vídeo 2), Grosseiramente ausente (Vídeo 3 e Vídeo 4) ou Indeterminada (Vídeo 5 e Vídeo 6).
- Se for necessária uma quantificação indeterminada ou adicional, prossiga para a seção 2 (Fase 2) do protocolo.
- Avaliação da cúpula diafragmática esquerda: repita os passos 1.2.1.1-1.2.1.6 no lado esquerdo do paciente.
- Avaliação da cúpula diafragmática direita
2. Fase 2: Avaliação quantitativa da excursão ZOA
- Configuração da máquina e posicionamento do paciente
- Seleção da sonda: Selecione um transdutor linear de alta frequência (>10-13 MHz).
- Aplique gel de acoplamento de ultrassom na sonda.
- Configurações do instrumento: Selecione a predefinição musculoesquelética (MSK), se disponível. Se a predefinição MSK não estiver disponível, selecione qualquer predefinição e use a mesma predefinição para todas as varreduras diafragmáticas de alta frequência.
- Posicione o paciente na posição semi-reclinada (repita a etapa 1.1.4).
- Técnica de digitalização
- Avaliação da cúpula diafragmática direita
- Colocar a sonda na linha axilar média, ao nível do oitavo ou nono espaços intercostais, com o indicador da sonda apontando para a cabeça do paciente (Figura 3 e Figura 4A).
- Incline o feixe perpendicularmente à parede torácica e centralize o eixo de modo que o espaço das costelas fique centralizado na tela com as costelas cranianas e caudais visíveis nas bordas da tela (Figura 4B).
- Defina a profundidade de forma que a linha pleural ou o diafragma fiquem visíveis no terço médio da tela.
NOTA: Normalmente, isso significa uma profundidade de 3-5 cm, mas pode ser maior se houver tecido subcutâneo adicional. - Defina o ganho de forma que o diafragma / linha pleural seja visivelmente distinto das estruturas circundantes.
- Identifique a linha pleural na tela.
- Meça a localização inspiratória final do ZOA.
- Dê ao paciente as seguintes instruções: "Inspire totalmente e prenda a respiração por 4 s. Se você não pode tolerar 4 s, por favor, prenda a respiração por qualquer período de tempo que você esteja confortável.
- Durante a apneia do paciente, siga a linha pleural caudalmente até atingir o local onde a linha pleural é visível em apenas uma parte do interespaço da costela, e o interespaço restante contém o diafragma em uma profundidade semelhante à linha pleural (Vídeo 7 e Vídeo 8).
NOTA: Este interespaço da costela contendo simultaneamente pleura e diafragma foi denominado Zona de Aposição (ZOA). - Ajuste o posicionamento da sonda (slide, leque, rocha, conforme necessário) até que a visão esteja centralizada no ZOA com as seguintes estruturas também visíveis: o tecido subcutâneo acima e uma costela em qualquer tamanho da tela (Figura 4C).
- Usando um marcador cutâneo não permanente, desenhe uma linha no paciente perpendicular ao eixo longo do transdutor de ultrassom e divida a sonda para marcar o espaço inter onde o ZOA foi encontrado (Figura 5A). A marcação deve estar alinhada com a ZOA, na transição entre a pleura e o diafragma (Figura 4B,C).
- Peça ao paciente para expirar e depois "respirar normalmente" (também conhecido como respiração corrente).
- Se não tiver certeza de que identificou o ZOA, repita as etapas 2.2.1.6.1-2.2.1.6.3 e examine o diafragma presumido nesta visão para ver suas alterações durante o ciclo respiratório.
NOTA: O diafragma verdadeiro deve engrossar durante a inspiração e diminuir de espessura durante a expiração. - Repita a medição uma vez (ou seja, etapas 2.2.1.6.1-2.2.1.6.5).
- Pegue a média das duas medidas e use-a para o valor final da localização inspiratória final do ZOA (Figura 5B).
- Meça a localização expiratória final do ZOA.
- Dê ao paciente as seguintes instruções: "Inspire totalmente, expire até o fim e prenda a respiração por 4 segundos. Se você não pode tolerar 4 s, por favor, prenda a respiração por qualquer período de tempo que você esteja confortável.
- Deslize a sonda cranialmente para encontrar a localização expiratória final do ZOA.
- Repita as etapas 2.2.1.6.3-2.2.1.6.4.
- Peça ao paciente para "respirar normalmente".
- Repita a medição uma vez (ou seja, etapas 2.2.1.7.1-2.2.1.7.4).
- Pegue a média das duas medições e use-a para o valor final da localização expiratória final do ZOA.
- Medição da excursão ZOA
- Meça a distância entre as marcações cutâneas inspiratórias finais e expiratórias finais médias em cm com uma régua. A distância entre as duas marcações externas da pele representa a excursão diafragmática máxima (Figura 5C).
- Avaliação da cúpula diafragmática esquerda
- Repita todas as subetapas contidas na etapa 2.2.1 no peito esquerdo.
- Avaliação da cúpula diafragmática direita
Resultados
Este protocolo de ultrassom diafragmático começa com a avaliação qualitativa de cada hemitórax durante uma respiração de capacidade vital para classificar cada hemidiafragma em uma das três categorias: excursão grosseiramente intacta, excursão grosseiramente prejudicada ou indeterminada. Exemplos de excursão da capacidade vital grosseiramente normal dos hemidiafragmas direito e esquerdo são mostrados no Vídeo 1 e no Vídeo 2, respectivamente. Exemplos de excursão da capacidade vital gravemente prejudicada dos hemidiafragmas direito e esquerdo são mostrados no Vídeo 3 e no Vídeo 4, respectivamente. Exemplos de excursão qualitativamente indeterminada da capacidade vital dos hemidiafragmas direito e esquerdo são mostrados no Vídeo 5 e no Vídeo 6, respectivamente.
A avaliação qualitativa provavelmente será suficiente para responder à questão de saber se há disfunção hemidiafragmática macroscópica na maioria dos casos. No entanto, se o exame qualitativo produzir resultados indeterminados ou se o clínico precisar de dados mais granulares sobre a função hemidiafragmática (por exemplo, para quantificar o efeito de um bloqueio nervoso regional na função hemidiafragmática como parte de um estudo de pesquisa), esse protocolo exige a medição quantitativa da excursão da porção mais cranial da ZOA. Atualmente, os valores normais de excursão ZOA têm uma escassez de dados de validação.
No entanto, algumas inferências podem ser tiradas de valores normais de uma medição relacionada: excursão da cúpula do diafragma (DoD). A excursão do DoD demonstrou ter um intervalo variável, dependendo do estudo. Por exemplo, uma revisão narrativa de Boussuges et al. descobriu que a excursão normal do DoD varia dependendo do sexo e da lateralidade 3,13. Especificamente, a faixa normal de excursão DoD para respiração corrente em homens varia de 1,4 cm a 2,3 cm à direita e de 1,7 cm a 2,4 cm à esquerda; para as mulheres, varia de 1,4 cm a 2,7 cm à direita e de 1,6 a 2,4 cm à esquerda. Da mesma forma, para respirações de capacidade vital, a excursão normal do DOD em homens varia de 5,3 cm a 7,8 cm à direita a 5,4 cm a 7,8 cm à esquerda; para as mulheres, varia de 4,7 cm a 8,0 à direita e de 4,8 cm a 6,4 cm à esquerda 3,13.
Notavelmente, para o método quantitativo de medição da excursão ZOA descrito neste manuscrito, os valores normais absolutos da excursão ZOA ainda não foram firmemente estabelecidos. Além disso, os valores normais publicados para o método de excursão DoD também não devem ser usados para diferenciar normal de anormal para o método de excursão ZOA porque uma fórmula clara relacionando esses dois valores não foi delineada. No entanto, um princípio importante da avaliação diafragmática é a comparação dentro do sujeito: (a) esquerda versus direita (b), pré versus pós-intervenção e (c) monitoramento da mudança ao longo do tempo. Tais comparações são permitidas pelo método de excursão ZOA, mesmo na ausência de valores normais publicados para esta técnica.
Por exemplo, Kim et al. propuseram o uso da medida da excursão ZOA para classificar os pacientes em três categorias de disfunção diafragmática, comparando a excursão hemidiafragmática pré e pós-intervenção de embotamento do nervo frênico20: i) disfunção completa do nervo frênico: diminuição de >75% na excursão ZOA após a intervenção ou movimento paradoxal do diafragma; ii) disfunção parcial do nervo frênico: diminuição de 25–75% na excursão do ZOA após a intervenção; iii) alteração menor ou nenhuma alteração na função diafragmática: diminuição de 0 a 25% na excursão ZOA após a intervenção.

Figura 1: Representação do protocolo de avaliação qualitativa da excursão diafragmática macroscópica. Observe a ilustração anatômica do diafragma (linha verde brilhante) sobrepondo o fígado (esquerda) e o baço (direita). Para visualizar o diafragma para avaliação qualitativa, a sonda curvilínea deve ser colocada na linha axilar média com feixe alinhado com o plano coronal do corpo e o paciente em posição semi-reclinada. Reproduzido com permissão de masterthemachines.com. Clique aqui para ver uma versão maior desta figura.

Figura 2: Avaliação qualitativa da excursão diafragmática. (A) Posicionamento adequado da sonda com o transdutor de baixa frequência (curvilíneo ou matriz de setor) colocado no flanco direito ou esquerdo no 5–7º espaço intercostal, linha axilar média e indicador da sonda apontando cranialmente. (B) Identificação do hemidiafragma direito no modo B durante a avaliação qualitativa. O diafragma é visível como uma faixa hiperecogênica brilhante sobreposta ao fígado. Para uma visão ideal, a coluna subdiafragmática deve estar visível. (C) Identificação do hemidiafragma esquerdo no modo B durante a avaliação qualitativa. O baço é visto aqui no lugar do fígado. Uma vez que o diafragma é inicialmente visualizado, o movimento do diafragma pode ser observado para avaliar a disfunção hemidiafragmática macroscópica. Consulte Vídeo 1, Vídeo 2, Vídeo 3, Vídeo 4, Vídeo 5 e Vídeo 6 para obter exemplos de excursão do diafragma normal, anormal e indeterminado à direita e à esquerda. Clique aqui para ver uma versão maior desta figura.

Figura 3: Representação do protocolo para avaliação quantitativa da excursão ZOA. Observe a ilustração anatômica do diafragma expiratório final como uma linha azul escura e o diafragma inspiratório final como uma linha azul clara. Para visualizar a OAVA para avaliação quantitativa, a sonda linear deve ser colocada na linha axilar média com o feixe alinhado perpendicularmente ao tronco e o paciente em posição semi-reclinada. Reproduzido com permissão de masterthemachines.com. Abreviatura: ZOA = zona de aposição. Clique aqui para ver uma versão maior desta figura.
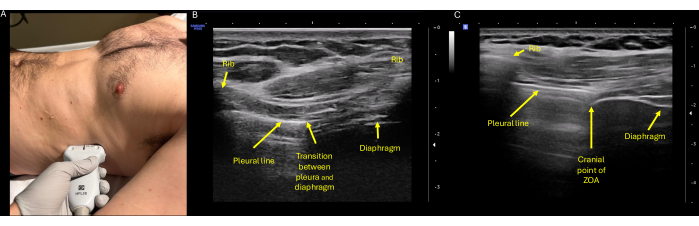
Figura 4: Avaliação ultrassonográfica da excursão ZOA. (A) Posicionamento adequado da sonda com o transdutor de alta frequência (linear) colocado no flanco direito ou esquerdo na linha axilar média ao nível do oitavo ou nono espaços intercostais, com o indicador da sonda apontando cefálico para a cabeça do paciente. (B) Identificação do ZOA, que é definido como a porção lateral do diafragma que se liga à caixa torácica. Na ultrassonografia, pode ser identificado no ponto de transição do diafragma e da pleura, aqui mostrado centralizado entre dois espaços costais. (C) O aspecto mais cefálico do ZOA, novamente correspondendo ao interespaço das costelas que mostra pulmão e diafragma aerados simultaneamente. Aqui está a aparência característica de três camadas do diafragma, com a pleura parietal hiperecoica superficial externamente, a camada muscular anecoica média e o peritônio hiperecoico profundo. Abreviatura: ZOA = zona de aposição. Clique aqui para ver uma versão maior desta figura.

Figura 5: Marcação e medição da excursão ZOA. (A) Uma vez que o ZOA é identificado após a expiração completa de uma respiração de capacidade vital, uma linha perpendicular é traçada a partir do centro da sonda para marcar a localização inicial do ZOA expiratório final. (B) Uma vez que os passos são repetidos e o ZOA é novamente identificado após a expiração de uma segunda respiração de capacidade vital, uma nova linha é traçada do centro da sonda. Isso marca a segunda localização identificada do ZOA expiratório final. Posteriormente, a distância entre as duas medições é calculada e a linha média é usada como o valor final da localização expiratória final do ZOA. Os mesmos passos são repetidos para obter as marcações inspiratórias finais da ZOA. As marcações inspiratórias e expiratórias finais podem ser obtidas em qualquer ordem. (C) A distância entre as marcações cutâneas expiratórias finais médias e inspiratórias finais médias é medida em centímetros com uma régua. Esta distância representa a excursão diafragmática quantificada. Abreviatura: ZOA = zona de aposição. Clique aqui para ver uma versão maior desta figura.
Figura 6: Manobra da sonda para superar o sombreamento das costelas. A sonda linear pode ser girada entre dois espaços de nervuras para identificação de ZOA no caso de uma nervura obscurecendo a localização do ZOA. Abreviatura: ZOA = zona de aposição. Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Visão coronal obtida com um transdutor de baixa frequência centrado na cúpula diafragmática direita mostrando excursão diafragmática qualitativamente normal durante a respiração da capacidade vital. Clique aqui para baixar este vídeo.
Vídeo 2: Visão coronal obtida com um transdutor de baixa frequência centrado na cúpula diafragmática esquerda mostrando excursão diafragmática qualitativamente normal durante a respiração de capacidade vital. Clique aqui para baixar este vídeo.
Vídeo 3: Visão coronal obtida com um transdutor de baixa frequência centrado na hemidiafragma direita mostrando ausência macroscópica de excursão diafragmática durante a tentativa de respiração com capacidade vital. Clique aqui para baixar este vídeo.
Vídeo 4: Visão coronal obtida com um transdutor de baixa frequência centrado na hemidiafragma esquerda mostrando ausência macroscópica de excursão diafragmática durante a tentativa de respiração de capacidade vital. Clique aqui para baixar este vídeo.
Vídeo 5: Visão coronal obtida com um transdutor de baixa frequência centrado na hemidiafragma direita mostrando um nível grosseiramente submáximo (indeterminado) de excursão diafragmática durante a tentativa de respiração com capacidade vital. Clique aqui para baixar este vídeo.
Vídeo 6: Visão coronal obtida com um transdutor de baixa frequência centrado na cúpula diafragmática esquerda mostrando um nível macroscópico submáximo (indeterminado) de excursão diafragmática durante a tentativa de respiração com capacidade vital. Clique aqui para baixar este vídeo.
Vídeo 7: Visão coronal obtida com um transdutor linear de alta frequência mostrando o movimento normal da porção mais cranial do ZOA durante a respiração corrente. Abreviatura: ZOA = zona de aposição. Clique aqui para baixar este vídeo.
Vídeo 8: Visão coronal obtida com um transdutor linear de alta frequência mostrando o transdutor deslizando caudal para seguir o movimento normal da porção mais cranial do ZOA durante uma respiração de capacidade vital. Abreviatura: ZOA = zona de aposição. Clique aqui para baixar este vídeo.
Vídeo 9: Visão coronal obtida com um transdutor linear de alta frequência mostrando como, no final da inspiração, a porção mais cranial do ZOA pode estar escondida por uma sombra de costela. Abreviatura: ZOA = zona de aposição. Clique aqui para baixar este vídeo.
Arquivo Suplementar 1: Referência para visualizar as imagens estáticas mais importantes de cada vídeo. Clique aqui para baixar este arquivo.
Discussão
O POCUS oferece vantagens claras para a avaliação diafragmática, incluindo portabilidade, não invasividade e recursos de imagem em tempo real. Esses pontos fortes podem ser aproveitados com este protocolo viável e acessível e podem ser aplicados em uma variedade de ambientes clínicos. Este protocolo começa com uma avaliação qualitativa da excursão diafragmática para responder à questão de saber se a disfunção hemidiafragmática macroscópica está presente. Se a resposta não for clara ou se forem necessárias informações mais específicas, a segunda etapa do protocolo fornece esclarecimentos por meio de medição quantitativa da excursão do ZOA. Essas medições podem ajudar na tomada de decisões clínicas, utilizando a comparação de lateralidade dentro do sujeito, pré vs. pós-intervenção ou avaliação da mudança ao longo do tempo.
Tradicionalmente, a avaliação diafragmática tem se baseado em métodos como radiografia de tórax, fluoroscopia, tomografia computadorizada, estudos de condução nervosa frênica e medições de pressão transdiafragmática. Embora essas técnicas forneçam informações valiosas, elas geralmente são demoradas, caras, carecem de portabilidade e, às vezes, oferecem apenas imagens estáticas2. O ultrassom oferece vantagens sobre essas deficiências. Notavelmente, existem algumas abordagens avançadas de ultrassom no horizonte para avaliação diafragmática que envolvem imagens bidimensionais de rastreamento de manchas e elastografia por ondas de cisalhamento. Essas abordagens avaliam as propriedades mecânicas do tecido do diafragma e têm evidências experimentais que suportam sua validade3. No entanto, o speckle-tracking e a elastografia por ondas de cisalhamento requerem habilidades e equipamentos avançados de ultrassonografia que raramente estão disponíveis para o clínico comum.
Alternativamente, muitos autores têm defendido o uso de POCUS quantitativo para avaliar a função diafragmática. Conforme explicado na introdução, as duas técnicas tradicionalmente utilizadas para esse fim são a medição da excursão DoD e o espessamento diafragmático. Esses protocolos são bem descritos e sua correlação clínica continua sendo pesquisada 3,6,13,21. Protocolos que simplificam os métodos de avaliação da espessura do diafragma e da fração de espessamento em pacientes saudáveis e críticos foram publicados recentemente, permitindo que esses protocolos sejam acessíveis a médicos com conhecimento básico de ultrassom21.
Nos últimos anos, a avaliação da função diafragmática em pacientes críticos tem ganhado atenção, pois seu papel essencial na avaliação dos desfechos respiratórios tem se tornado cada vez mais evidente. Pacientes que necessitam de ventilação mecânica podem desenvolver atrofia por desuso do diafragma e diminuição da força contrátil, o que tem sido associado ao aumento da mortalidade 6,22. A hipotrofia do diafragma pode se apresentar em até 24 h no início da ventilação mecânica11. Assim, o reconhecimento precoce da disfunção do músculo diafragma com ferramentas não invasivas, como o POCUS, é vital. Um estudo de Goligher et al. mostrou que, em pacientes ventilados mecanicamente, a avaliação da espessura da hemicúpula diafragmática direita pode ser viável e reprodutível23. No entanto, eles descobriram que as medidas da espessura da hemicúpula diafragmática esquerda e da fração de espessamento bilateralmente não eram reprodutíveis. Tanto o espessamento diafragmático quanto a excursão DoD são limitados pela baixa confiabilidade interoperador e dispersão da medição 2,15,16.
Além disso, falta consenso de especialistas sobre qual modo de ultrassom é melhor para medir a espessura do diafragma (modo B vs. modo M) e em qual ponto do ciclo respiratório é ideal para realizar a medição18. Além dos desafios do operador, os próprios pacientes também podem introduzir confusão. Em pacientes gravemente enfermos, é crucial considerar a patologia e a fisiologia do paciente. Por exemplo, doenças crônicas como doença pulmonar obstrutiva crônica, doença pulmonar intersticial ou distúrbios neuromusculares podem causar diminuição da mobilidade do diafragma, enquanto pacientes com insuficiência de saúde congestiva e fibrose cística podem ter diafragmas anormalmente espessados 6,13. Além disso, a ventilação com pressão positiva pode impactar as medidas ultrassonográficas, causando diminuição da excursão do diafragma e redução do espessamento18.
Assim, existe uma necessidade não atendida de um protocolo de aquisição de imagem simples e reprodutível para ultrassom diafragmático que possa ser realizado no local de atendimento. Para atender a essa necessidade não atendida, desenvolvemos um protocolo baseado em evidências que rastreia a disfunção diafragmática em um processo de duas etapas: primeiro qualitativamente e depois, se necessário, quantitativamente, com a última etapa realizada usando um método recém-validado de medir a excursão da porção mais craniana do ZOA.
A avaliação qualitativa do movimento do diafragma é uma técnica bem estabelecida e relatada na literatura já na década de 19703. A avaliação qualitativa na ultrassonografia modo B não requer cálculos e muitas vezes pode fornecer uma resposta binária (sim ou não para saber se há excursão diafragmática grosseiramente normal). Variações da abordagem qualitativa foram testadas em vários estudos e consideradas úteis para avaliar a assimetria grosseira da função hemidiafragmática 2,3,5,6,13,18,23.
Nos casos em que uma triagem qualitativa inicial fornece dados inconclusivos sobre a função de cada hemidiafragma, nosso protocolo proposto passa para uma abordagem quantitativa recentemente validada: medição da excursão da porção mais cranial do ZOA. Essa técnica foi descrita pela primeira vez em 2017 por El-Boghdadly e posteriormente utilizada por Kim et al. em 2019 para rastrear disfunção diafragmática após bloqueios do nervo do tronco superior19,20. Mais recentemente, essa técnica foi testada e validada em 2023: Da Conceição et al. compararam esse novo método tanto com a medição da excursão DoD quanto com a fração de espessamento diafragmático em 75 pacientes17. Os autores descobriram que medir a excursão da porção mais cranial da excursão ZOA teve um sucesso significativamente maior na medição da excursão de ambos os hemidiafragmas em comparação com o método DoD. O método ZOA teve uma taxa de sucesso de 100% bilateralmente, enquanto o método DoD só foi capaz de medir a excursão diafragmática 98,7% à direita e 35% das vezes à esquerda. Embora o método da fração de espessamento tenha demonstrado 100% de sucesso na capacidade de medir ambos os diafragmas, os valores das frações de espessamento esquerda e direita gerados por esse método não se correlacionaram entre os pacientes nem se correlacionaram com as medições de excursão obtidas usando os métodos DoD e ZOA. Para o método da fração de espessamento, essa falta de correlação com outros métodos de avaliação da função diafragmática e entre os hemidiafragmas esquerdo e direito dentro dos indivíduos levanta preocupações sobre a validade geral desse método como ferramenta diagnóstica.
Como o método de excursão ZOA permanece novo e desconhecido para a maioria dos provedores, algumas sugestões de solução de problemas podem ajudar a aumentar a probabilidade de sucesso. Primeiro, usar uma abordagem sistemática, como descrita neste protocolo, é fundamental. Em segundo lugar, como a identificação inicial do ZOA pode ser desafiadora, é importante garantir o posicionamento adequado da sonda e identificar pontos anatômicos conhecidos. A sonda deve estar entre a linha axilar anterior e média, e os espaços das costelas devem estar centralizados na tela. A ZOA pode ser identificada por sua aparência característica de três camadas e geralmente é encontrada a uma profundidade de 1,5-3 cm (dependendo do IMC do paciente) e é frequentemente encontrada abaixo do ângulo costofrênico com a inalação 2,16. Se o ZOA não for identificado, duas possibilidades são que ele esteja escondido atrás de uma sombra de costela (Vídeo 9) ou esteja sendo continuamente obscurecido pelo pulmão se movendo para o campo19. A primeira possibilidade pode ser corrigida girando o transdutor obliquamente para alinhar com os espaços intercostais entre as costelas (Figura 6). A segunda possibilidade pode ser abordada deslizando para um espaço intercostal mais caudal.
Apesar de suas inúmeras vantagens, esse protocolo diafragmático de POCUS tem várias limitações. Primeiro, o protocolo requer a visualização da porção mais cranial do ZOA, o que pode não ser possível na presença de enfisema subcutâneo difuso, curativos, drenos, tubos ou fichários. Em segundo lugar, até o momento, o método de excursão ZOA só foi testado contra abordagens alternativas em um único estudo15. Embora este único estudo tenha demonstrado a relativa superioridade da excursão ZOA sobre duas abordagens quantitativas tradicionais para POCUS diafragmática, o método ZOA não foi testado contra um padrão-ouro, como a avaliação fluoroscópica da função diafragmática. Essa comparação com um padrão-ouro é necessária para definir melhor os valores normais e anormais para a abordagem de excursão ZOA. Além disso, dada a sua novidade, esse protocolo ainda não foi correlacionado com os desfechos clínicos. No entanto, até que os valores normativos do método ZOA sejam firmemente estabelecidos, essa técnica ainda pode ser útil para quantificar a extensão da assimetria na função hemidiafragmática em uma variedade de situações clínicas em que a avaliação qualitativa isolada é indeterminada. Em terceiro lugar, essa avaliação fornece informações generalizadas sobre a função do diafragma, mas carece de especificidade para fornecer informações sobre estados de doença, como fibrose ou medidas precisas de contratilidade. Por fim, é necessário um nível básico de conhecimento do POCUS para poder aplicar com sucesso este protocolo na prática clínica. No entanto, esses métodos provam ser mais simples do que as medidas POCUS anteriores de disfunção diafragmática (excursão DoD e espessamento diafragmático), pois requerem menos medições e menos familiaridade com a knobologia. Além disso, a proficiência neste método pode ser alcançada rapidamente com treinamento. Seguindo o protocolo descrito e as estratégias de solução de problemas, a avaliação reprodutível do diafragma pode se tornar viável para o médico médio usando equipamentos de ultrassom simples disponíveis no local de atendimento.
Divulgações
Não temos divulgações relevantes ou conflitos de interesse.
Agradecimentos
Obrigado ao Dr. Fintan Hughes por ajudar na fotografia.
Materiais
| Name | Company | Catalog Number | Comments |
| Medical Ruler | MediChoice | NA | We used Medichoice as that is what is readily available at our institution and it comes with the skin marker, however any medical ruler will work. The majority of skin markers come with a type of ruler or measurement system, but if not a separate ruler can be used. |
| Skin Marker | MediChoice | NA | We again used Medichoice as that is what is readily available at our institution and it comes with the ruler, however any standard skin marker will work. |
| Ultrasound Gel | Aquasonic | NA | Any standard gel will work. Sterile packs are not necessary but can be used on a case-by-case basis at the providers discretion. |
| Ultrasound Machine | Samsung and GE | NA | Any standard portable ultrasound machine will suffice. |
Referências
- Bronshteyn, Y. S., Blitz, J., Hashmi, N., Krishnan, S. Logistics of perioperative diagnostic point-of-care ultrasound: Nomenclature, scope of practice, training, credentialing/privileging, and billing. Int Anesthesiol Clin. 60 (3), 1-7 (2022).
- Osman Elew, A. N. E., Abd Alrahman, A. A. H., El Khayat, H. M. H. Diaphragmatic ultrasound: Review article. The Egyptian Journal of Hospital Medicine. 87 (1), 1006-1009 (2022).
- Boussuges, A., Rives, S., Finance, J., Bregeon, F. Assessment of diaphragmatic function by ultrasonography: Current approach and perspectives. World J Clin Cases. 8 (12), 2408-2424 (2020).
- Volpicelli, G., et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med. 38 (4), 577-591 (2012).
- Saad, M., et al. Ultrasonographic assessment of diaphragmatic function and its clinical application in the management of patients with acute respiratory failure. Diagnostics (Basel). 13 (3), 411 (2023).
- Santana, P. V., Cardenas, L. Z., Albuquerque, A. L. P. Diaphragm ultrasound in critically ill patients on mechanical ventilation-evolving concepts. Diagnostics (Basel). 13 (6), 1116 (2023).
- Petrof, B. J. Diaphragm weakness in the critically ill: Basic mechanisms reveal therapeutic opportunities. Chest. 154 (6), 1395-1403 (2018).
- Chu, S. E., et al. Point-of-care application of diaphragmatic ultrasonography in the emergency department for the prediction of development of respiratory failure in community-acquired pneumonia: A pilot study. Front Med. 9, 960847 (2022).
- Suttapanit, K., Wongkrasunt, S., Savatmongkorngul, S., Supatanakij, P. Ultrasonographic evaluation of the diaphragm in critically ill patients to predict invasive mechanical ventilation. J Intensive Care. 11 (1), 40 (2023).
- Vivier, E., et al. Diaphragm ultrasonography to estimate the work of breathing during non-invasive ventilation. Intensive Care Med. 38 (5), 796-803 (2012).
- Eduardo Garrido-Aguirre, S. a. N. S. Diaphragmatic ultrasonography, a novel approach in critical care. Ultrasound Q. 36, 54-58 (2020).
- Sferrazza Papa, G. F., et al. A review of the ultrasound assessment of diaphragmatic function in clinical practice. Respiration. 91 (5), 403-411 (2016).
- Santana, P. V., Cardenas, L. Z., Albuquerque, A. L. P., Carvalho, C. R. R., Caruso, P. Diaphragmatic ultrasound: A review of its methodological aspects and clinical uses. J Bras Pneumol. 46 (6), e20200064 (2020).
- Qian, Z., Yang, M., Li, L., Chen, Y. Ultrasound assessment of diaphragmatic dysfunction as a predictor of weaning outcome from mechanical ventilation: A systematic review and meta-analysis. BMJ Open. 8 (9), e021189 (2018).
- Kharma, N. Dysfunction of the diaphragm: Imaging as a diagnostic tool. Curr Opin Pulm Med. 19 (4), 394-398 (2013).
- Tsui, J. J., Tsui, B. C. A novel systematic abc approach to diaphragmatic evaluation (abcde). Can J Anaesth. 63 (5), 636-637 (2016).
- Da Conceicao, D., et al. Validation of a novel point-of-care ultrasound method to assess diaphragmatic excursion. Reg Anesth Pain Med. 49 (11), 800-804 (2023).
- Haaksma, M. E., et al. EXpert consensus on diaphragm ultrasonography in the critically ill (EXODUS): A delphi consensus statement on the measurement of diaphragm ultrasound-derived parameters in a critical care setting. Crit Care. 26 (1), 99 (2022).
- El-Boghdadly, K., Goffi, A., Chan, V. Point of care diaphragmatic ultrasound made easy. Can J Anaesth. 64 (3), 327-328 (2017).
- Kim, D. H., et al. Superior trunk block: A phrenic-sparing alternative to the interscalene block: A randomized controlled trial. Anesthesiology. 131 (3), 521-533 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431 (2023).
- Goligher, E. C., et al. Measuring diaphragm thickness with ultrasound in mechanically ventilated patients: feasibility, reproducibility and validity. Intensive Care Med. 41 (4), 642-649 (2015).
- Pereira, R. O. L., et al. Point-of-care lung ultrasound in adults: Image acquisition. J Vis Exp. (193), e64722 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados