Method Article
Ecografia diaframmatica negli adulti: acquisizione e interpretazione delle immagini
In questo articolo
Riepilogo
L'ecografia point-of-care (POCUS) è una tecnica essenziale per lo screening della disfunzione diaframmatica grazie alla sua portabilità, non invasività e capacità di imaging in tempo reale. Sebbene esistano gli attuali protocolli POCUS diaframmatici, soffrono di scarsa affidabilità interoperatore e mancano di linee guida di consenso. Qui descriviamo una tecnica riproducibile e semplice da eseguire.
Abstract
La disfunzione del diaframma è un problema ampiamente riconosciuto in numerose specialità mediche e contesti clinici. Una valutazione tempestiva e accurata del diaframma è vitale non solo nei pazienti critici, dove ha un ruolo nello svezzamento dalla ventilazione meccanica e negli esiti respiratori, ma anche nell'arena perioperatoria come strumento diagnostico per rilevare la funzione del nervo frenico. La valutazione diaframmatica ha tradizionalmente utilizzato la fluoroscopia e gli studi sui nervi che richiedono tempo, sono costosi e non sono portatili. L'ecografia point-of-care (POCUS) supera queste barriere e può essere utilizzata come strumento per lo screening non invasivo della funzione del diaframma. Tuttavia, la POCUS per la disfunzione diaframmatica attualmente soffre di diversi problemi come la mancanza di linee guida di consenso, una molteplicità di protocolli e una scarsa affidabilità interoperatore tra i protocolli esistenti, in particolare con la valutazione dell'escursione della cupola del diaframma e dell'ispessimento diaframmatico. Per affrontare questi problemi, questo manoscritto esamina la letteratura disponibile sulla POCUS diaframmatica e identifica una tecnica di acquisizione delle immagini che è semplice da eseguire e ha un'elevata affidabilità interoperatoria. Questa tecnica descrive prima una valutazione qualitativa dell'escursione del diaframma, seguita da una valutazione quantitativa dell'escursione della zona di apposizione. La tecnica viene descritta in modo graduale insieme a tutti i seguenti elementi: posizionamento del paziente, selezione del trasduttore, posizionamento della sonda, ottimizzazione dell'immagine e interpretazione.
Introduzione
L'ecografia diagnostica può essere suddivisa in due divisioni: consultiva e point-of-care. L'ecografia consultiva incorpora un esame eseguito da un team di specialisti distinti, mentre il POCUS viene eseguito e interpretato dal medico che si prende cura del paziente in tempo reale1.
Negli ultimi decenni, la POCUS diagnostica è emersa come uno strumento di trasformazione nella medicina moderna, con applicazioni in rapida espansione in tutte le specialità. Queste applicazioni POCUS sono guidate dalla natura non invasiva, dalla portabilità e dalle capacità di imaging in tempo reale degli ultrasuoni. Inoltre, nell'ambito della POCUS diagnostica, le applicazioni che hanno raggiunto la massima diffusione in medicina clinica tendono ad avere sia un'accuratezza ragionevolmente elevata rispetto a un gold standard che un'elevata affidabilità interosservatore 2,3. Ad esempio, la POCUS del polmone è ben consolidata per restringere la diagnosi differenziale di insufficienza respiratoria e dispone di chiare linee guida basate sull'evidenza a sostegno del suo uso standardizzato4. Tuttavia, mentre la POCUS del polmone è ben consolidata, rimane un'esigenza insoddisfatta di sviluppare una valutazione ecografica riproducibile del diaframma.
Un tale protocollo di valutazione diaframmatica non invasivo andrebbe a beneficio di molteplici specialità e situazioni cliniche, tra cui, a titolo esemplificativo ma non esaustivo, terapia intensiva, pneumologia, assistenza perioperatoria (compresi i contesti di anestesia generale e anestesia regionale di sottospecialità) e neurologia. Nell'unità di terapia intensiva, la disfunzione diaframmatica è una preoccupazione comune, spesso derivante da molteplici patologie sottostanti come malattie neuromuscolari, miopatie da malattie critiche, traumi e malnutrizione5. I pazienti critici sono spesso ad alto rischio sia di compromissione della contrazione del diaframma che di sotto-riconoscimento di questo fenomeno6. Inoltre, la diagnosi precoce della disfunzione diaframmatica è importante, in quanto non solo può aiutare nelle strategie di gestione della ventilazione, ma anche la disfunzione può essere un indicatore precoce di infezione e sepsi 7,8. Inoltre, l'intubazione prolungata può portare a una significativa morbilità, mortalità e aumento delle spese sanitarie2. In questi scenari, un protocollo portatile non invasivo per la valutazione diaframmatica potrebbe essere utile per valutare l'adeguatezza per lo svezzamento dalla ventilazione meccanica, valutare il lavoro di respirazione e prevedere la probabilità di successo dell'estubazione rispetto al fallimento 6,8,9,10,11.
Nell'ambito dell'anestesia regionale, la POCUS diaframmatica potrebbe avere valore nello screening della paresi diaframmatica correlata alla disfunzione transitoria del nervo frenico da blocchi del plesso brachiale. Sebbene ben tollerate dai pazienti sani, le paralisi del nervo frenico possono portare a distress respiratorio nei pazienti con riserva polmonare limitata. Inoltre, in ambito perioperatorio, il POCUS del diaframma può fungere da strumento diagnostico per i pazienti in ambito preoperatorio, intraoperatorio e postoperatorio. Ad esempio, il POCUS diaframmatico potrebbe essere utilizzato per rilevare il danno al nervo frenico derivante da un'ampia gamma di procedure, tra cui, a titolo esemplificativo ma non esaustivo, l'innesto di bypass coronarico con prelievo interno dell'arteria mammaria, l'ablazione della fibrillazione atriale e gli interventi chirurgici cervicali o toracici 3,12.
Infine, all'interno della specialità della neurologia, POCUS potrebbe facilitare la valutazione della funzione diaframmatica in malattie neurologiche come la miastenia grave, la distrofia muscolare di Duchene, la sclerosi laterale amiotrofica e gli incidenti cerebrovascolari13.
Una valutazione accurata del diaframma è essenziale a causa del suo ruolo vitale nella funzione riparatrice. L'ossigenazione e la ventilazione dipendono dalla generazione di pressione intratoracica negativa creata dal diaframma, un muscolo a forma di cupola che separa l'addome e il torace che è composto da diverse membrane muscolari e tendinee14,15. Il diaframma ha almeno due componenti principali che possono essere distinti agli ultrasuoni: la cupola del diaframma (DoD) e la zona di apposizione (ZOA). Il DoD è la porzione tendinea centrale che mostra un aspetto iperecogeno e curvo agli ultrasuoni. La ZOA è la porzione laterale del diaframma che si attacca alla gabbia toracica ed è costituita da fibre muscolari che corrono parallele e prossimali alla superficie interna della parete toracica 3,15. Lo ZOA è sottile (di solito <1 cm di spessore), ma aumenta di spessore durante l'inspirazione quando il diaframma si contrae. Alla ZOA, il diaframma ha un aspetto caratteristico all'ecografia con tre strati, tra cui uno strato muscolare anecoico che è delimitato esternamente dalla pleura parietale iperecogena superficiale e internamente dal peritoneo iperecogeno profondo 3,13.
Sono stati proposti diversi protocolli ecografici non invasivi per la valutazione diaframmatica, che coinvolgono approcci sia qualitativi che quantitativi. La valutazione visiva qualitativa, l'approccio più semplice, comporta la valutazione del movimento diaframmatico bilateralmente, durante la respirazione corrente o della capacità vitale, utilizzando l'ecografia bidimensionale, nota anche come modalità di luminosità (B-mode). Al contrario, i protocolli quantitativi in genere iniziano con la modalità B e aggiungono ultrasuoni unidimensionali - noti anche come modalità di movimento (modalità M) - per misurare una delle due cose: l'escursione della cupola del diaframma (DoD) e / o l'ispessimento diaframmatico 2,3,5,13. La misurazione dell'escursione DoD viene eseguita con un trasduttore a bassa frequenza con il fascio di ultrasuoni diretto attraverso il terzo posteriore dell'emidiaframma con un angolo perpendicolare. La modalità M viene quindi utilizzata per misurare l'escursione durante la respirazione della capacità vitale.
In alternativa, la misura dell'ispessimento diaframmatico utilizza un trasduttore lineare ad alta frequenza in due fasi. Innanzitutto, il trasduttore ad alta frequenza viene posizionato lungo il fianco del paziente sovrastante il diaframma con modalità B per identificare la zona di apposizione (ZOA)3. In secondo luogo, la stima dell'ispessimento diaframmatico viene eseguita utilizzando la modalità M misurando lo spessore diaframmatico (in millimetri) dalla pleura viscerale a quella parietale e calcolando la variazione di spessore con la seguente equazione 2,3,5,13:
Variazione di spessore = (Spessore alla fine dell'inspirazione - Spessore alla fine della spirazione) / Spessore alla fine dell'espirazione
Tuttavia, i metodi quantitativi (escursione DoD e ispessimento diaframmatico) soffrono di scarsa affidabilità interoperatore. L'affidabilità interoperatore è bassa per la misurazione dell'escursione DoD per diversi motivi. In primo luogo, i fornitori hanno difficoltà a trovare un angolo di visualizzazione coerente dell'escursione della cupola del diaframma3. In secondo luogo, la valutazione sul lato sinistro è spesso impegnativa a causa della piccola finestra acustica attraverso la milza 2,16. Ad esempio, gli studi hanno citato che l'identificazione dell'escursione diaframmatica sinistra non è possibile fino al 65-79% dei casi17. In terzo luogo, il contenuto intraaddominale e il posizionamento del paziente possono influenzare l'intervallo di escursione del diaframma2.
Allo stesso modo, la misurazione dell'ispessimento diaframmatico ha una bassa affidabilità interoperatore per almeno due motivi. In primo luogo, la naturale sottigliezza del diaframma fa sì che gli errori millimetrici nella misurazione siano consequenziali. In secondo luogo, la variabilità dello spessore del diaframma attraverso gli spazi interstiziali delle costole e la lateralità del paziente provoca ulteriormente la dispersione della misurazione 2,3,17. Riconoscendo queste numerose limitazioni, nel 2022, un consenso di esperti sull'ecografia del diaframma nei pazienti critici ha concluso che i metodi attuali non erano standardizzati e che molti richiedevano un ecografista esperto18. Hanno notato che non c'era accordo sui valori di cutoff per la disfunzione del diaframma basata sulla frazione di ispessimento e che la misurazione della frazione di ispessimento è un'abilità difficile con una curva di apprendimento ripida13,18. Inoltre, l'uso di più protocolli ecografici diversi in letteratura ha aggiunto sfide intrinseche rendendo difficile il confronto degli studi, portando all'eterogeneità nella ricerca19.
Per affrontare questi problemi, questo manoscritto esamina la letteratura disponibile sulla POCUS diaframmatica e identifica una tecnica di acquisizione delle immagini che è semplice da eseguire e ha dimostrato di avere un'elevata affidabilità interoperatore. Questo protocollo, fattibile ma efficace, inizia con una valutazione qualitativa dell'escursione diaframmatica, seguita da una valutazione quantitativa recentemente convalidata dell'escursione del punto più craniale della ZOA17,19.
Protocollo
Tutte le procedure eseguite negli studi che hanno coinvolto partecipanti umani sono state conformi agli standard etici del comitato di ricerca istituzionale del Duke University Health System e alla dichiarazione di Helsinki del 1964 e ai suoi successivi emendamenti o standard etici comparabili. Il consenso informato è stato ottenuto da tutti i partecipanti. Il file supplementare 1 contiene le immagini fisse più importanti di ogni video.
1. Fase 1: Valutazione qualitativa dell'escursione diaframmatica (screening visivo per la disfunzione emidiaframmatica macroscopica)
- Messa a punto della macchina e posizionamento del paziente
- Selezione della sonda: selezionare un trasduttore a bassa frequenza (≤ 5 MHz) (curvilineo o a settori [noto anche come "phased-array"]19.
- Applicare il gel di accoppiamento a ultrasuoni sulla sonda.
- Impostazioni dello strumento: selezionare la preimpostazione addominale.
- Posizionare il paziente in posizione semisdraiata.
- Tecnica di scansione
- Valutazione dell'emidiaframma destro
- Posizionare la sonda sul fianco destro, 5-7°spazio intercostale , linea medio-ascellare con il raggio allineato con il piano coronale del corpo e indicatore della sonda rivolto cranialmente (Figura 1 e Figura 2A).
- Regolare il posizionamento della sonda (vetrino, ventaglio, roccia secondo necessità) fino a quando la vista non è centrata sul diaframma con le seguenti strutture visibili: organo sottodiaframmatico (fegato o milza), diaframma, colonna vertebrale e spazio sopradiaframmatico (cioè spazio pleurico)19 (Figura 2B, C).
- Chiedi al paziente di inspirare lentamente la capacità vitale e di espirare lentamente.
- Fare clic su Acquisisci (o equivalente) per acquisire una breve clip durante la respirazione del paziente.
- Valutare visivamente l'escursione diaframmatica come una delle seguenti: grossolanamente intatta (Video 1 e Video 2), grossolanamente assente (Video 3 e Video 4) o indeterminata (Video 5 e Video 6).
- Se è necessaria una quantificazione indeterminata o un'ulteriore quantificazione, procedere alla sezione 2 (Fase 2) del protocollo.
- Valutazione dell'emidiaframma sinistro: ripetere i passaggi 1.2.1.1-1.2.1.6 sul lato sinistro del paziente.
- Valutazione dell'emidiaframma destro
2. Fase 2: Valutazione quantitativa dell'escursione ZOA
- Messa a punto della macchina e posizionamento del paziente
- Selezione della sonda: selezionare un trasduttore lineare ad alta frequenza (>10-13 MHz).
- Applicare il gel di accoppiamento a ultrasuoni sulla sonda.
- Impostazioni dello strumento: selezionare il preset muscoloscheletrico (MSK), se disponibile. Se la preimpostazione MSK non è disponibile, selezionare una preimpostazione e utilizzare la stessa preimpostazione per tutte le scansioni diaframmatiche ad alta frequenza.
- Posizionare il paziente in posizione semisdraiata (ripetere il passaggio 1.1.4).
- Tecnica di scansione
- Valutazione dell'emidiaframma destro
- Posizionare la sonda sulla linea ascellare media a livello dell'ottavo o nono spazio intercostale, con l'indicatore della sonda rivolto cefalica verso la testa del paziente (Figura 3 e Figura 4A).
- Inclinare la trave perpendicolarmente alla parete toracica e centrare l'asse in modo che l'intercapedine delle costole sia centrata nello schermo con le costole craniche e caudali visibili sui bordi dello schermo (Figura 4B).
- Impostare la profondità in modo che la linea pleurica o il diaframma siano visibili nel terzo centrale dello schermo.
NOTA: In genere, ciò significa una profondità di 3-5 cm, ma può essere maggiore se c'è ulteriore tessuto sottocutaneo. - Impostare il guadagno in modo tale che il diaframma/linea pleurica sia visibilmente distinto dalle strutture circostanti.
- Identificare la linea pleurica sullo schermo.
- Misurare la posizione fine-inspiratoria della ZOA.
- Dare al paziente le seguenti istruzioni: "Inspirare completamente e poi trattenere il respiro per 4 s. Se non riesci a tollerare 4 secondi, trattieni il respiro per tutto il tempo che ti senti a tuo agio.
- Durante l'apnea del paziente, seguire la linea pleurica caudalmente fino a raggiungere la posizione in cui la linea pleurica è visibile solo in una porzione dell'interspazio costale e l'interspazio rimanente contiene il diaframma a una profondità simile a quella della linea pleurica (Video 7 e Video 8).
NOTA: Questo intercapedine delle costole contenente contemporaneamente pleura e diaframma è stato chiamato Zona di Apposizione (ZOA). - Regolare il posizionamento della sonda (slitta, ventola, roccia secondo necessità) fino a quando la vista non è centrata sulla ZOA con le seguenti strutture visibili: il tessuto sottocutaneo sopra e una nervatura su entrambe le dimensioni dello schermo (Figura 4C).
- Utilizzando un marcatore cutaneo non permanente, tracciare una linea sul paziente che sia perpendicolare all'asse lungo del trasduttore a ultrasuoni e dividere in due la sonda per contrassegnare l'intercapedine in cui è stata trovata la ZOA (Figura 5A). La marcatura deve essere allineata con la ZOA, nel punto di transizione tra la pleura e il diaframma (Figura 4B, C).
- Chiedi al paziente di espirare e poi "respirare normalmente" (alias respirazione di marea).
- Se non si è sicuri di aver identificato la ZOA, ripetere i passaggi 2.2.1.6.1-2.2.1.6.3 ed esaminare il presunto diaframma in questa vista per vedere i suoi cambiamenti durante il ciclo respiratorio.
NOTA: Il diaframma vero e proprio dovrebbe ispessirsi durante l'inspirazione e diminuire di spessore durante l'espirazione. - Ripetere la misurazione una volta (ad esempio, i passaggi 2.2.1.6.1-2.2.1.6.5).
- Prendi la media delle due misurazioni e usala per il valore finale della posizione fine-inspiratoria della ZOA (Figura 5B).
- Misurare la posizione di fine espiazione della ZOA.
- Dare al paziente le seguenti istruzioni: "Inspirare completamente, quindi espirare fino in fondo, quindi trattenere il respiro per 4 s. Se non riesci a tollerare 4 secondi, trattieni il respiro per tutto il tempo che ti senti a tuo agio.
- Far scorrere la sonda cranialmente per trovare la posizione di fine espirazione della ZOA.
- Ripetere i passaggi 2.2.1.6.3-2.2.1.6.4.
- Chiedi al paziente di "respirare normalmente".
- Ripetere la misurazione una volta (ad esempio, i passaggi 2.2.1.7.1-2.2.1.7.4).
- Prendi la media delle due misurazioni e usala per il valore finale della posizione di fine espirazione della ZOA.
- Misura dell'escursione ZOA
- Misurare la distanza tra i segni cutanei medi di fine inspirazione e di fine espirazione medi in cm con un righello. La distanza tra le due marcature cutanee esterne rappresenta la massima escursione diaframmatica (Figura 5C).
- Valutazione dell'emidiaframma sinistro
- Ripeti tutti i passaggi secondari contenuti nel passaggio 2.2.1 sul petto a sinistra.
- Valutazione dell'emidiaframma destro
Risultati
Questo protocollo ecografico diaframmatico inizia con la valutazione qualitativa di ciascun emitorace durante un respiro di capacità vitale per classificare ciascun emidiaframma in una delle tre categorie: escursione grossolanamente intatta, escursione gravemente compromessa o indeterminata. Esempi di escursione della capacità vitale grossolanamente normale degli emidiaframmi destro e sinistro sono mostrati rispettivamente nel Video 1 e nel Video 2. Esempi di escursione della capacità vitale gravemente compromessa degli emidiaframmi destro e sinistro sono mostrati rispettivamente nel Video 3 e nel Video 4. Esempi di escursione qualitativamente indeterminata della capacità vitale degli emidiaframmi destro e sinistro sono mostrati rispettivamente nel Video 5 e nel Video 6.
La valutazione qualitativa è probabilmente sufficiente per rispondere alla domanda se nella maggior parte dei casi vi sia una disfunzione emidiaframmatica macroscopica. Tuttavia, se l'esame qualitativo produce risultati indeterminati o il medico ha bisogno di dati più granulari sulla funzione emidiaframmatica (ad esempio, per quantificare l'effetto di un blocco nervoso regionale sulla funzione emidiaframmatica come parte di uno studio di ricerca), allora questo protocollo richiede la misurazione quantitativa dell'escursione della porzione più cranica della ZOA. Attualmente, i valori normali di escursione ZOA hanno una scarsità di dati di convalida.
Tuttavia, alcune deduzioni possono essere tratte dai valori normali di una misura correlata: l'escursione della cupola del diaframma (DoD). È stato dimostrato che l'escursione DoD ha un intervallo variabile, a seconda dello studio. Ad esempio, una revisione narrativa di Boussuges et al. ha rilevato che la normale escursione DoD varia a seconda del sesso e della lateralità 3,13. In particolare, l'intervallo normale di escursione DoD per la respirazione corrente negli uomini varia da 1,4 cm a 2,3 cm a destra e da 1,7 cm a 2,4 cm a sinistra; Per le donne, varia da 1,4 cm a 2,7 cm a destra e da 1,6 a 2,4 cm a sinistra. Allo stesso modo, per i respiri della capacità vitale, l'escursione DOD normale negli uomini varia da 5,3 cm a 7,8 cm a destra a 5,4 cm a 7,8 cm a sinistra; per le donne si va da 4,7 cm a 8,0 a destra e da 4,8 cm a 6,4 cm a sinistra 3,13.
In particolare, per il metodo quantitativo di misurazione dell'escursione ZOA descritto in questo manoscritto, i valori normali assoluti dell'escursione ZOA devono ancora essere stabiliti con certezza. Inoltre, i valori normali pubblicati per il metodo di escursione DoD non dovrebbero essere utilizzati per differenziare il normale dall'anormale per il metodo di escursione ZOA perché non è stata delineata una formula chiara che metta in relazione questi due valori. Tuttavia, uno dei principi principali della valutazione diaframmatica è il confronto all'interno del soggetto: (a) sinistra contro destra (b), prima e dopo l'intervento e (c) monitoraggio dei cambiamenti nel tempo. Tali confronti sono consentiti dal metodo dell'escursione ZOA anche in assenza di valori normali pubblicati per questa tecnica.
Ad esempio, Kim et al. hanno proposto di utilizzare la misurazione dell'escursione ZOA per classificare i pazienti in tre categorie di disfunzione diaframmatica confrontando l'escursione emidiaframmatica prima dell'intervento di ottundimento del nervo frenico rispetto a quello post20: i) disfunzione completa del nervo frenico: diminuzione del >75% dell'escursione ZOA dopo l'intervento o movimento paradossale del diaframma; ii) disfunzione parziale del nervo frenico: diminuzione del 25-75% dell'escursione della ZOA dopo l'intervento; iii) cambiamento minore o nullo nella funzione diaframmatica: diminuzione dello 0-25% dell'escursione ZOA dopo l'intervento.

Figura 1: Rappresentazione del protocollo di valutazione qualitativa dell'escursione grossolana del diaframma. Si noti l'illustrazione anatomica del diaframma (linea verde brillante) sovrastante il fegato (a sinistra) e la milza (a destra). Per visualizzare il diaframma per la valutazione qualitativa, la sonda curvilinea deve essere posizionata sulla linea medio-ascellare con il fascio allineato con il piano coronale del corpo e il paziente in posizione semisdraiata. Ristampato con il permesso di masterthemachines.com. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Valutazione qualitativa dell'escursione diaframmatica. (A) Posizionamento corretto della sonda con il trasduttore a bassa frequenza (curvilineo o a settori) posizionato sul fianco destro o sinistro al 5-7°spazio intercostale , la linea ascellare media e l'indicatore della sonda rivolto cranialmente. (B) Identificazione dell'emidiaframma destro in modalità B durante la valutazione qualitativa. Il diaframma è visibile come una banda iperecogena luminosa sovrastante il fegato. Per una visione ottimale, la colonna vertebrale sottodiaframmatica dovrebbe essere visibile. (C) Identificazione dell'emidiaframma sinistro in modalità B durante la valutazione qualitativa. La milza è qui vista al posto del fegato. Una volta che il diaframma è stato inizialmente visualizzato, il movimento del diaframma può essere osservato per valutare la disfunzione emidiaframmatica macroscopica. Fare riferimento a Video 1, Video 2, Video 3, Video 4, Video 5 e Video 6 per esample o escursione del diaframma normale, anormale e indeterminata sia a destra che a sinistra. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Rappresentazione del protocollo per la valutazione quantitativa dell'escursione ZOA. Si noti l'illustrazione anatomica del diaframma di fine espirazione come una linea blu scuro e del diaframma di fine inspirazione come una linea blu chiaro. Per visualizzare la ZOA per la valutazione quantitativa, la sonda lineare deve essere posizionata sulla linea medio-ascellare con il raggio allineato perpendicolarmente al tronco e il paziente in posizione semisdraiata. Ristampato con il permesso di masterthemachines.com. Abbreviazione: ZOA = zona di apposizione. Clicca qui per visualizzare una versione più grande di questa figura.
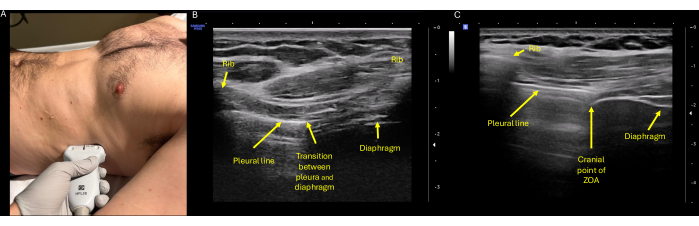
Figura 4: Valutazione ecografica dell'escursione ZOA. (A) Posizionamento corretto della sonda con il trasduttore ad alta frequenza (lineare) posizionato sul fianco destro o sinistro sulla linea medio-ascellare a livello dell'ottavo o nono spazio intercostale, con l'indicatore della sonda rivolto cefalica verso la testa del paziente. (B) Identificazione della ZOA, che è definita come la porzione laterale del diaframma che si attacca alla gabbia toracica. All'ecografia può essere identificato nel punto di transizione del diaframma e della pleura, mostrato qui centrato tra due spazi costali. (C) L'aspetto cefalico più ampio della ZOA, ancora una volta corrispondente all'interspazio costale che mostra contemporaneamente il polmone e il diaframma aerati. Ecco il caratteristico aspetto a tre strati del diaframma, con la pleura parietale iperecogena superficiale esternamente, lo strato muscolare anecoico medio e il peritoneo iperecogeno profondo. Abbreviazione: ZOA = zona di apposizione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Marcatura e misurazione dell'escursione ZOA. (A) Una volta identificata la ZOA dopo l'espirazione completa da un respiro di capacità vitale, viene tracciata una linea perpendicolare dal centro della sonda per segnare la posizione iniziale della ZOA di fine espirazione. (B) Una volta che i passaggi sono stati ripetuti e la ZOA è stata nuovamente identificata dopo l'espirazione da un secondo respiro di capacità vitale, una nuova linea viene tracciata dal centro della sonda. Questo segna la seconda posizione identificata della ZOA di fine espirazione. Successivamente, si calcola la media della distanza tra le due misurazioni e si utilizza la linea media come valore finale della posizione di fine espirazione della ZOA. Gli stessi passaggi vengono ripetuti per ottenere le marcature inspiratorie finali della ZOA. Le marcature di fine inspirazione e fine espirazione possono essere ottenute in entrambi gli ordini. (C) La distanza tra i segni cutanei medi di fine espirazione e di fine inspirazione media è misurata in centimetri con un righello. Questa distanza rappresenta l'escursione diaframmatica quantificata. Abbreviazione: ZOA = zona di apposizione. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 6: Manovra della sonda per superare l'ombreggiamento delle costole. La sonda lineare può essere ruotata tra due spazi delle nervature per l'identificazione della ZOA nel caso di una nervatura che oscura la posizione della ZOA. Abbreviazione: ZOA = zona di apposizione. Clicca qui per visualizzare una versione più grande di questa figura.
Video 1: Vista coronale ottenuta con un trasduttore a bassa frequenza centrato sull'emidiaframma destro che mostra un'escursione diaframmatica qualitativamente normale durante la respirazione della capacità vitale. Clicca qui per scaricare questo video.
Video 2: Vista coronale ottenuta con un trasduttore a bassa frequenza centrato sull'emidiaframma sinistro che mostra un'escursione diaframmatica qualitativamente normale durante la respirazione della capacità vitale. Clicca qui per scaricare questo video.
Video 3: Vista coronale ottenuta con un trasduttore a bassa frequenza centrato sull'emidiaframma destro che mostra una grossolana assenza di escursione diaframmatica durante il tentativo di respirazione della capacità vitale. Clicca qui per scaricare questo video.
Video 4: Vista coronale ottenuta con un trasduttore a bassa frequenza centrato sull'emidiaframma sinistro che mostra una grossolana assenza di escursione diaframmatica durante il tentativo di respirazione della capacità vitale. Clicca qui per scaricare questo video.
Video 5: Vista coronale ottenuta con un trasduttore a bassa frequenza centrato sull'emidiaframma destro che mostra un livello grossolanamente submassimale (indeterminato) di escursione diaframmatica durante il tentativo di respirazione della capacità vitale. Clicca qui per scaricare questo video.
Video 6: Vista coronale ottenuta con un trasduttore a bassa frequenza centrato sull'emidiaframma sinistro che mostra un livello grossolanamente submassimale (indeterminato) di escursione diaframmatica durante il tentativo di respirazione della capacità vitale. Clicca qui per scaricare questo video.
Video 7: Vista coronale ottenuta con un trasduttore lineare ad alta frequenza che mostra il moto normale della porzione più cranica della ZOA durante la respirazione di marea. Abbreviazione: ZOA = zona di apposizione. Clicca qui per scaricare questo video.
Video 8: Vista coronale ottenuta con un trasduttore lineare ad alta frequenza che mostra il trasduttore che scorre caudale per seguire il normale movimento della porzione più cranica della ZOA durante un respiro di capacità vitale. Abbreviazione: ZOA = zona di apposizione. Clicca qui per scaricare questo video.
Video 9: Vista coronale ottenuta con un trasduttore lineare ad alta frequenza che mostra come, all'inspirazione finale, la porzione più cranica della ZOA possa essere nascosta da un'ombra di costola. Abbreviazione: ZOA = zona di apposizione. Clicca qui per scaricare questo video.
File supplementare 1: Riferimento per visualizzare le immagini fisse più importanti di ciascun video. Clicca qui per scaricare questo file.
Discussione
POCUS offre chiari vantaggi per la valutazione diaframmatica, tra cui portabilità, non invasività e capacità di imaging in tempo reale. Questi punti di forza possono essere sfruttati con questo protocollo fattibile e accessibile e possono essere applicati in una varietà di contesti clinici. Questo protocollo inizia con una valutazione qualitativa dell'escursione diaframmatica per rispondere alla domanda se sia presente una disfunzione emidiaframmatica macroscopica. Se la risposta non è chiara o se sono necessarie informazioni più specifiche, la seconda fase del protocollo fornisce chiarimenti attraverso la misurazione quantitativa dell'escursione della ZOA. Queste misurazioni possono aiutare nel processo decisionale clinico utilizzando il confronto all'interno del soggetto della lateralità, pre e post intervento o la valutazione del cambiamento nel tempo.
Tradizionalmente, la valutazione diaframmatica si è basata su metodi come la radiografia del torace, la fluoroscopia, l'imaging TC, gli studi di conduzione del nervo frenico e le misurazioni della pressione transdiaframmatica. Sebbene queste tecniche forniscano informazioni preziose, sono spesso dispendiose in termini di tempo, costose, prive di portabilità e talvolta offrono solo l'imaging statico2. Gli ultrasuoni offrono vantaggi rispetto a queste carenze. In particolare, ci sono alcuni approcci ecografici avanzati all'orizzonte per la valutazione diaframmatica che coinvolgono l'imaging bidimensionale con tracciamento dello speckle e l'elastografia a onde di taglio. Questi approcci valutano le proprietà meccaniche tissutali del diaframma e hanno prove sperimentali a sostegno della loro validità3. Tuttavia, lo speckle-tracking e l'elastografia a onde di taglio richiedono competenze e apparecchiature ecografiche avanzate che raramente sono disponibili per il medico comune.
In alternativa, molti autori hanno sostenuto l'uso del POCUS quantitativo per valutare la funzione diaframmatica. Come spiegato nell'introduzione, le due tecniche tradizionalmente utilizzate a questo scopo sono la misurazione dell'escursione DoD e l'ispessimento diaframmatico. Questi protocolli sono ben descritti e la loro correlazione clinica continua ad essere studiata 3,6,13,21. Di recente sono stati pubblicati protocolli che semplificano i metodi di valutazione dello spessore del diaframma e della frazione di ispessimento sia in pazienti sani che in pazienti critici, consentendo a questi protocolli di essere accessibili ai medici con conoscenze ecografiche di base21.
Negli ultimi anni, la valutazione della funzione diaframmatica nei pazienti critici ha attirato l'attenzione poiché il suo ruolo essenziale nella valutazione degli esiti respiratori è diventato sempre più evidente. I pazienti che necessitano di ventilazione meccanica possono sviluppare atrofia da disuso del diaframma e diminuzione della forza contrattile, che è stata associata ad un aumento della mortalità 6,22. L'ipotrofia del diaframma può presentarsi già 24 ore prima dell'inizio della ventilazione meccanica11. Pertanto, il riconoscimento precoce della disfunzione del muscolo diaframma con strumenti non invasivi come il POCUS è fondamentale. Uno studio di Goligher et al. ha dimostrato che nei pazienti ventilati meccanicamente, la valutazione POCUS dello spessore dell'emidiaframma destro può essere sia fattibile che riproducibile23. Tuttavia, hanno scoperto che le misurazioni dello spessore dell'emidiaframma sinistro e della frazione di ispessimento bilateralmente non erano riproducibili. Sia l'ispessimento diaframmatico che l'escursione DoD sono limitati dalla scarsa affidabilità interoperatore e dalla dispersione di misura 2,15,16.
Inoltre, manca il consenso degli esperti su quale modalità ecografica sia la migliore per misurare lo spessore del diaframma (modalità B vs. modalità M) e in quale punto del ciclo respiratorio sia ottimale eseguire la misurazione18. Oltre alle sfide per gli operatori, anche i pazienti stessi possono creare confusione. Nei pazienti critici è fondamentale considerare sia la patologia che la fisiologia del paziente. Ad esempio, malattie croniche come la broncopneumopatia cronica ostruttiva, la malattia polmonare interstiziale o i disturbi neuromuscolari possono causare una ridotta mobilità del diaframma, mentre i pazienti con insufficienza di salute congestizia e fibrosi cistica possono avere diaframmi ispessiti in modo anomalo 6,13. Inoltre, la ventilazione a pressione positiva può influire sulle misurazioni ecografiche causando una diminuzione dell'escursione del diaframma e una riduzione dell'ispessimento18.
Pertanto, esiste un'esigenza insoddisfatta di un protocollo di acquisizione delle immagini semplice e riproducibile per l'ecografia diaframmatica che possa essere eseguito presso il punto di cura. Per rispondere a questa esigenza insoddisfatta, abbiamo sviluppato un protocollo basato sull'evidenza che esegue lo screening della disfunzione diaframmatica in un processo in due fasi: prima qualitativamente e poi, se necessario, quantitativamente con l'ultima fase eseguita utilizzando un metodo recentemente convalidato per misurare l'escursione della porzione cranica più grande della ZOA.
La valutazione qualitativa del movimento del diaframma è una tecnica ben consolidata che è stata riportata in letteratura già negli anni '703. La valutazione qualitativa nell'ecografia B-mode non richiede calcoli e spesso può fornire una risposta binaria (sì o no al fatto che ci sia un'escursione diaframmatica grossolanamente normale). Le variazioni dell'approccio qualitativo sono state testate in diversi studi e si sono rivelate utili per valutare l'asimmetria macroscopica della funzione emidiaframmatica 2,3,5,6,13,18,23.
Nei casi in cui uno screening qualitativo iniziale fornisca dati inconcludenti sulla funzione di ciascun emidiaframma, il nostro protocollo proposto passa a un approccio quantitativo recentemente validato: la misurazione dell'escursione della porzione cranica più grande della ZOA. Questa tecnica è stata descritta per la prima volta nel 2017 da El-Boghdadly e successivamente utilizzata da Kim et al. nel 2019 per lo screening della disfunzione diaframmatica dopo i blocchi nervosi del tronco superiore19,20. Più recentemente, questa tecnica è stata testata e convalidata nel 2023: Da Conceicao et al. hanno confrontato questo nuovo metodo sia con la misurazione dell'escursione DoD che della frazione di ispessimento diaframmatico in 75 pazienti17. Gli autori hanno scoperto che la misurazione dell'escursione della porzione più cranica dell'escursione ZOA ha avuto un successo significativamente più elevato nella misurazione dell'escursione di entrambi gli emidiaframmi rispetto al metodo DoD. Il metodo ZOA ha avuto un tasso di successo del 100% bilateralmente, mentre il metodo DoD è stato in grado di misurare l'escursione diaframmatica solo il 98,7% a destra e il 35% delle volte a sinistra. Mentre il metodo della frazione di ispessimento ha dimostrato un successo del 100% nell'essere in grado di misurare entrambi i diaframmi, i valori della frazione di ispessimento sinistro e destro generati da questo metodo non sono né correlati all'interno dei pazienti né correlati alle misurazioni dell'escursione ottenute utilizzando i metodi DoD e ZOA. Per il metodo della frazione di ispessimento, questa mancanza di correlazione sia con altri metodi di valutazione della funzione diaframmatica che tra gli emidiaframmi sinistro e destro all'interno dei soggetti, solleva preoccupazioni sulla validità complessiva di questo metodo come strumento diagnostico.
Poiché il metodo di escursione ZOA rimane nuovo e sconosciuto alla maggior parte dei fornitori, alcuni suggerimenti per la risoluzione dei problemi possono aiutare ad aumentare le probabilità di successo. In primo luogo, l'utilizzo di un approccio sistematico, come delineato in questo protocollo, è fondamentale. In secondo luogo, poiché l'identificazione iniziale della ZOA può essere impegnativa, è importante garantire il corretto posizionamento della sonda e identificare i punti di riferimento anatomici noti. La sonda deve trovarsi tra la linea ascellare anteriore e quella media e gli spazi delle costole devono essere centrati sullo schermo. La ZOA può essere identificata dal suo caratteristico aspetto a tre strati e di solito si trova a una profondità di 1,5-3 cm (a seconda del BMI del paziente) e si trova spesso al di sotto dell'angolo costofrenico con inalazionedi 2,16. Se la ZOA non viene identificata, due possibilità sono che sia nascosta dietro un'ombra di costole (Video 9) o che venga continuamente oscurata dal polmone che si muove nel campo19. La prima possibilità può essere risolta ruotando obliquamente il trasduttore per allinearlo con gli spazi intercostali tra le nervature (Figura 6). La seconda possibilità può essere affrontata scivolando in uno spazio intercostale più caudale.
Nonostante i suoi numerosi vantaggi, questo protocollo POCUS diaframmatico presenta diverse limitazioni. In primo luogo, il protocollo richiede la visualizzazione della porzione più cranica della ZOA, che potrebbe non essere possibile in presenza di enfisema sottocutaneo diffuso, medicazioni, drenaggi, tubi o leganti. In secondo luogo, ad oggi, il metodo di escursione ZOA è stato testato solo rispetto ad approcci alternativi in un singolo studio15. Sebbene questo singolo studio abbia dimostrato la relativa superiorità dell'escursione ZOA rispetto a due approcci quantitativi tradizionali al POCUS diaframmatico, il metodo ZOA non è stato testato rispetto a un gold standard come la valutazione fluoroscopica della funzione diaframmatica. Tale confronto con un gold standard è necessario per definire meglio i valori normali e anormali per l'approccio dell'escursione ZOA. Inoltre, data la sua novità, questo protocollo non è ancora stato correlato con gli esiti clinici. Tuttavia, fino a quando i valori normativi del metodo ZOA non saranno stabiliti con fermezza, questa tecnica può ancora essere utile per quantificare l'entità dell'asimmetria nella funzione emidiaframmatica in una varietà di situazioni cliniche in cui la sola valutazione qualitativa è indeterminata. In terzo luogo, questa valutazione fornisce informazioni generalizzate sulla funzione del diaframma, ma manca della specificità necessaria per fornire informazioni su stati patologici come la fibrosi o misure precise di contrattilità. Infine, è richiesto un livello base di conoscenza POCUS per essere in grado di applicare con successo questo protocollo nella pratica clinica. Tuttavia, questi metodi si rivelano più semplici rispetto alle precedenti misure POCUS della disfunzione del diaframma (escursione DoD e ispessimento diaframmatico) in quanto richiedono meno misurazioni e meno familiarità con la pomologia. Inoltre, la competenza in questo metodo può essere raggiunta rapidamente con l'allenamento. Seguendo il protocollo delineato e le strategie di risoluzione dei problemi, una valutazione riproducibile del diaframma può diventare fattibile per il medico medio utilizzando semplici apparecchiature a ultrasuoni disponibili presso il punto di cura.
Divulgazioni
Non abbiamo divulgazioni rilevanti o conflitti di interesse.
Riconoscimenti
Grazie al Dr. Fintan Hughes per l'assistenza fotografica.
Materiali
| Name | Company | Catalog Number | Comments |
| Medical Ruler | MediChoice | NA | We used Medichoice as that is what is readily available at our institution and it comes with the skin marker, however any medical ruler will work. The majority of skin markers come with a type of ruler or measurement system, but if not a separate ruler can be used. |
| Skin Marker | MediChoice | NA | We again used Medichoice as that is what is readily available at our institution and it comes with the ruler, however any standard skin marker will work. |
| Ultrasound Gel | Aquasonic | NA | Any standard gel will work. Sterile packs are not necessary but can be used on a case-by-case basis at the providers discretion. |
| Ultrasound Machine | Samsung and GE | NA | Any standard portable ultrasound machine will suffice. |
Riferimenti
- Bronshteyn, Y. S., Blitz, J., Hashmi, N., Krishnan, S. Logistics of perioperative diagnostic point-of-care ultrasound: Nomenclature, scope of practice, training, credentialing/privileging, and billing. Int Anesthesiol Clin. 60 (3), 1-7 (2022).
- Osman Elew, A. N. E., Abd Alrahman, A. A. H., El Khayat, H. M. H. Diaphragmatic ultrasound: Review article. The Egyptian Journal of Hospital Medicine. 87 (1), 1006-1009 (2022).
- Boussuges, A., Rives, S., Finance, J., Bregeon, F. Assessment of diaphragmatic function by ultrasonography: Current approach and perspectives. World J Clin Cases. 8 (12), 2408-2424 (2020).
- Volpicelli, G., et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med. 38 (4), 577-591 (2012).
- Saad, M., et al. Ultrasonographic assessment of diaphragmatic function and its clinical application in the management of patients with acute respiratory failure. Diagnostics (Basel). 13 (3), 411 (2023).
- Santana, P. V., Cardenas, L. Z., Albuquerque, A. L. P. Diaphragm ultrasound in critically ill patients on mechanical ventilation-evolving concepts. Diagnostics (Basel). 13 (6), 1116 (2023).
- Petrof, B. J. Diaphragm weakness in the critically ill: Basic mechanisms reveal therapeutic opportunities. Chest. 154 (6), 1395-1403 (2018).
- Chu, S. E., et al. Point-of-care application of diaphragmatic ultrasonography in the emergency department for the prediction of development of respiratory failure in community-acquired pneumonia: A pilot study. Front Med. 9, 960847 (2022).
- Suttapanit, K., Wongkrasunt, S., Savatmongkorngul, S., Supatanakij, P. Ultrasonographic evaluation of the diaphragm in critically ill patients to predict invasive mechanical ventilation. J Intensive Care. 11 (1), 40 (2023).
- Vivier, E., et al. Diaphragm ultrasonography to estimate the work of breathing during non-invasive ventilation. Intensive Care Med. 38 (5), 796-803 (2012).
- Eduardo Garrido-Aguirre, S. a. N. S. Diaphragmatic ultrasonography, a novel approach in critical care. Ultrasound Q. 36, 54-58 (2020).
- Sferrazza Papa, G. F., et al. A review of the ultrasound assessment of diaphragmatic function in clinical practice. Respiration. 91 (5), 403-411 (2016).
- Santana, P. V., Cardenas, L. Z., Albuquerque, A. L. P., Carvalho, C. R. R., Caruso, P. Diaphragmatic ultrasound: A review of its methodological aspects and clinical uses. J Bras Pneumol. 46 (6), e20200064 (2020).
- Qian, Z., Yang, M., Li, L., Chen, Y. Ultrasound assessment of diaphragmatic dysfunction as a predictor of weaning outcome from mechanical ventilation: A systematic review and meta-analysis. BMJ Open. 8 (9), e021189 (2018).
- Kharma, N. Dysfunction of the diaphragm: Imaging as a diagnostic tool. Curr Opin Pulm Med. 19 (4), 394-398 (2013).
- Tsui, J. J., Tsui, B. C. A novel systematic abc approach to diaphragmatic evaluation (abcde). Can J Anaesth. 63 (5), 636-637 (2016).
- Da Conceicao, D., et al. Validation of a novel point-of-care ultrasound method to assess diaphragmatic excursion. Reg Anesth Pain Med. 49 (11), 800-804 (2023).
- Haaksma, M. E., et al. EXpert consensus on diaphragm ultrasonography in the critically ill (EXODUS): A delphi consensus statement on the measurement of diaphragm ultrasound-derived parameters in a critical care setting. Crit Care. 26 (1), 99 (2022).
- El-Boghdadly, K., Goffi, A., Chan, V. Point of care diaphragmatic ultrasound made easy. Can J Anaesth. 64 (3), 327-328 (2017).
- Kim, D. H., et al. Superior trunk block: A phrenic-sparing alternative to the interscalene block: A randomized controlled trial. Anesthesiology. 131 (3), 521-533 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431 (2023).
- Goligher, E. C., et al. Measuring diaphragm thickness with ultrasound in mechanically ventilated patients: feasibility, reproducibility and validity. Intensive Care Med. 41 (4), 642-649 (2015).
- Pereira, R. O. L., et al. Point-of-care lung ultrasound in adults: Image acquisition. J Vis Exp. (193), e64722 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon