Method Article
Ecografía diafragmática en adultos: adquisición e interpretación de imágenes
En este artículo
Resumen
La ecografía en el punto de atención (POCUS) es una técnica esencial para el cribado de la disfunción diafragmática debido a su portabilidad, su carácter no invasivo y sus capacidades de obtención de imágenes en tiempo real. Aunque existen protocolos POCUS diafragmáticos actuales, adolecen de poca fiabilidad entre operadores y carecen de directrices consensuadas. Aquí describimos una técnica que es reproducible y fácil de realizar.
Resumen
La disfunción del diafragma es una preocupación ampliamente reconocida en numerosas especialidades médicas y entornos clínicos. La evaluación oportuna y precisa del diafragma es vital no solo en pacientes críticos, donde tiene un papel en el destete de la ventilación mecánica y los resultados respiratorios, sino también en el ámbito perioperatorio como herramienta diagnóstica para detectar la función del nervio frénico. La evaluación diafragmática ha utilizado tradicionalmente la fluoroscopia y los estudios nerviosos que requieren mucho tiempo, son costosos y no portátiles. La ecografía en el punto de atención (POCUS) supera estas barreras y puede utilizarse como herramienta para el cribado no invasivo de la función del diafragma. Sin embargo, el POCUS para la disfunción diafragmática sufre actualmente de varios problemas, como la falta de directrices de consenso, una multiplicidad de protocolos y una escasa fiabilidad entre operadores entre los protocolos existentes, sobre todo con la evaluación de la excursión de la cúpula del diafragma y el engrosamiento del diafragma. Para abordar estos problemas, este manuscrito revisa la literatura disponible sobre POCUS diafragmático e identifica una técnica de adquisición de imágenes que es fácil de realizar y tiene una alta confiabilidad entre operadores. Esta técnica describe primero una evaluación cualitativa de la excursión del diafragma, seguida de una evaluación cuantitativa de la excursión de la zona de aposición. La técnica se describe paso a paso junto con todo lo siguiente: posicionamiento del paciente, selección del transductor, colocación de la sonda, optimización de la imagen e interpretación.
Introducción
La ecografía diagnóstica se puede dividir en dos divisiones: consultiva y en el punto de atención. La ecografía consultiva incorpora un examen realizado por un equipo de especialistas distinto, mientras que el POCUS es realizado e interpretado por el clínico que atiende al paciente en tiempo real1.
En las últimas décadas, el diagnóstico POCUS se ha convertido en una herramienta transformadora en la medicina moderna, con aplicaciones que se expanden rápidamente en todas las especialidades. Estas aplicaciones de POCUS están impulsadas por la naturaleza no invasiva, la portabilidad y las capacidades de obtención de imágenes en tiempo real del ultrasonido. Además, dentro de la POCUS diagnóstica, las aplicaciones que han logrado la mayor aceptación en medicina clínica tienden a tener una precisión razonablemente alta en comparación con un estándar de oro y una alta confiabilidad interobservador 2,3. Por ejemplo, la POCUS del pulmón está bien establecida para reducir el diagnóstico diferencial de la insuficiencia respiratoria y cuenta con directrices claras basadas en la evidencia que respaldan su uso estandarizado4. Sin embargo, aunque la POCUS del pulmón está bien establecida, sigue existiendo una necesidad insatisfecha de desarrollar una evaluación ecográfica reproducible del diafragma.
Un protocolo de evaluación diafragmática no invasivo de este tipo beneficiaría a múltiples especialidades y situaciones clínicas, incluidas, entre otras, los cuidados intensivos, la neumología, la atención perioperatoria (incluidos los contextos de anestesia general y anestesia regional de subespecialidades) y neurología. En la unidad de cuidados intensivos, la disfunción diafragmática es una preocupación común, que a menudo surge de múltiples patologías subyacentes, como enfermedades neuromusculares, miopatías críticas, traumatismos y desnutrición5. Los pacientes críticos suelen tener un alto riesgo de alteración de la contracción del diafragma y de falta de reconocimiento de este fenómeno6. Además, el diagnóstico precoz de la disfunción diafragmática es importante, ya que no solo puede ayudar en las estrategias de manejo de la ventilación, sino que también la disfunción puede ser un indicador temprano de infección y sepsis 7,8. Además, la intubación prolongada puede provocar una importante morbilidad, mortalidad y un aumento de los gastos sanitarios2. En estos escenarios, un protocolo portátil y no invasivo para la evaluación diafragmática podría ser útil para evaluar la conveniencia del destete de la ventilación mecánica, evaluar el trabajo respiratorio y predecir la probabilidad de éxito de la extubación frente al fracaso 6,8,9,10,11.
Dentro de la anestesia regional, la POCUS diafragmática podría tener valor en la detección de la paresia diafragmática relacionada con la disfunción transitoria del nervio frénico por bloqueos del plexo braquial. Aunque son bien toleradas por pacientes sanos, las parálisis del nervio frénico pueden provocar dificultad respiratoria en pacientes con reserva pulmonar limitada. Además, en el ámbito perioperatorio, el POCUS del diafragma puede servir como herramienta diagnóstica para los pacientes en el entorno preoperatorio, intraoperatorio y postoperatorio. Por ejemplo, el POCUS diafragmático podría utilizarse para detectar el daño del nervio frénico derivado de una amplia gama de procedimientos, incluidos, entre otros, el injerto de derivación de la arteria coronaria con extracción de la arteria mamaria interna, la ablación de la fibrilación auricular y las cirugías cervicales o torácicas 3,12.
Finalmente, dentro de la especialidad de neurología, POCUS podría facilitar la evaluación de la función diafragmática en enfermedades neurológicas como la miastenia gravis, la distrofia muscular de Duchene, la esclerosis lateral amiotrófica y los accidentes cerebrovasculares13.
La evaluación precisa del diafragma es esencial debido a su papel vital en la función reparadora. La oxigenación y la ventilación dependen de la generación de presión intratorácica negativa creada por el diafragma, un músculo en forma de cúpula que separa el abdomen y el tórax y que está compuesto por varias membranas musculares y tendinosas14,15. El diafragma tiene al menos dos componentes principales que se pueden distinguir en la ecografía: la cúpula del diafragma (DoD) y la zona de aposición (ZOA). El DoD es la porción tendinosa central que exhibe una apariencia hiperecogénica y curvada en la ecografía. La ZOA es la porción lateral del diafragma que se une a la caja torácica y está formada por fibras musculares que corren paralelas y proximales a la superficie interna de la pared torácica 3,15. El ZOA es delgado (generalmente <1 cm de grosor), pero aumenta de grosor durante la inspiración a medida que el diafragma se contrae. En la ZOA, el diafragma tiene un aspecto característico en la ecografía con tres capas, incluyendo una capa muscular anecoica que está delimitada externamente por el pleural parietal hiperecoico superficial e internamente por el peritoneo hiperecoico profundo 3,13.
Se han propuesto varios protocolos ecográficos no invasivos para la evaluación diafragmática, que incluyen enfoques cualitativos y cuantitativos. La evaluación visual cualitativa, el enfoque más simple, implica la evaluación del movimiento diafragmático bilateralmente, durante la respiración de la marea o de la capacidad vital, utilizando ultrasonido bidimensional, también conocido como modo de brillo (modo B). Por el contrario, los protocolos cuantitativos generalmente comienzan con el modo B y agregan ultrasonido unidimensional, también conocido como modo de movimiento (modo M), para medir una de dos cosas: la excursión de la cúpula del diafragma (DoD) y / o el engrosamiento diafragmático 2,3,5,13. La medición de la excursión DoD se realiza con un transductor de baja frecuencia con el haz de ultrasonido dirigido a través del tercio posterior del hemidiafragma en un ángulo perpendicular. El modo M se utiliza para medir la excursión durante la respiración de la capacidad vital.
Alternativamente, la medición del engrosamiento diafragmático emplea un transductor lineal de alta frecuencia en dos pasos. En primer lugar, el transductor de alta frecuencia se coloca a lo largo del flanco del paciente sobre el diafragma con modo B para identificar la zona de aposición (ZOA)3. En segundo lugar, la estimación del engrosamiento diafragmático se realiza utilizando el modo M midiendo el espesor diafragmático (en milímetros) desde la pleura visceral hasta la parietal y calculando el cambio en el grosor mediante la siguiente ecuación 2,3,5,13:
Cambio en el espesor = (Espesor al final de la inspiración - Espesor al final de la caducidad) / Espesor al final de la caducidad
Sin embargo, los métodos cuantitativos (excursión DoD y engrosamiento diafragmático) adolecen de poca fiabilidad entre operadores. La fiabilidad entre operadores es baja para la medición de la excursión del DoD por varias razones. En primer lugar, los proveedores tienen dificultades para encontrar un ángulo consistente de visualización de la excursión de la cúpula del diafragma3. En segundo lugar, la evaluación en el lado izquierdo es frecuentemente un desafío debido a la pequeña ventana acústica a través del bazo 2,16. Por ejemplo, los estudios han citado que la identificación de la excursión diafragmática del lado izquierdo no es posible hasta en el 65-79% de los casos17. En tercer lugar, el contenido intraabdominal y la posición del paciente pueden influir en el rango de excursión del diafragma2.
Del mismo modo, la medición del engrosamiento diafragmático tiene una baja fiabilidad entre operadores por al menos dos razones. En primer lugar, la delgadez natural del diafragma hace que los errores milimétricos en la medición sean consecuentes. En segundo lugar, la variabilidad en el grosor del diafragma a través de los espacios intermedios de las costillas y por la lateralidad del paciente provoca además la dispersión de la medición 2,3,17. En reconocimiento de estas numerosas limitaciones, en 2022, un consenso de expertos sobre la ecografía de diafragma en pacientes críticos concluyó que los métodos actuales no estaban estandarizados y que muchos requerían un ecografista cualificado18. Observaron que no había acuerdo sobre los valores de corte para la disfunción del diafragma en función de la fracción de engrosamiento y que la medición de la fracción de engrosamiento es una habilidad difícil con una curva de aprendizaje pronunciada13,18. Además, el uso de múltiples protocolos sonográficos diferentes en la literatura se ha sumado a los desafíos inherentes al dificultar la comparación de estudios, lo que lleva a la heterogeneidad en la investigación19.
Para abordar estos problemas, este manuscrito revisa la literatura disponible sobre POCUS diafragmático e identifica una técnica de adquisición de imágenes que es fácil de realizar y que ha demostrado tener una alta confiabilidad entre operadores. Este protocolo factible pero efectivo comienza con una evaluación cualitativa de la excursión diafragmática, seguida de una evaluación cuantitativa recientemente validada de la excursión del punto más craneal de la ZOA 17,19.
Protocolo
Todos los procedimientos realizados en los estudios con participantes humanos se ajustaron a las normas éticas del comité de investigación institucional del Sistema de Salud de la Universidad de Duke y a la Declaración de Helsinki de 1964 y sus enmiendas posteriores o normas éticas comparables. Se obtuvo el consentimiento informado de todos los participantes. El archivo complementario 1 contiene las imágenes fijas más importantes de cada vídeo.
1. Fase 1: Evaluación cualitativa de la excursión diafragmática (Cribado visual de la disfunción hemidiafragmática macroscópica)
- Configuración de la máquina y posicionamiento del paciente
- Selección de la sonda: Seleccione un transductor de baja frecuencia (≤ 5 MHz) (curvilíneo o de matriz sectorial [también conocido como "matriz en fase"]19.
- Aplique gel de acoplamiento de ultrasonido a la sonda.
- Ajustes del instrumento: Seleccione el preajuste abdominal.
- Coloque al paciente en posición semirreclinada.
- Técnica de escaneo
- Valoración del hemidiafragma derecho
- Coloque la sonda en el flanco derecho,5-7º espacio intercostal, línea axilar media con el haz alineado con el plano coronal del cuerpo y el indicador de la sonda apuntando cranealmente (Figura 1 y Figura 2A).
- Ajuste la posición de la sonda (corredera, abanico, roca según sea necesario) hasta que la vista se centre en el diafragma con las siguientes estructuras también visibles: órgano subdiafragmático (hígado o bazo), diafragma, columna vertebral y espacio supradiafragmático (es decir, espacio pleural)19 (Figura 2B, C).
- Pida al paciente que inhale y exhale lentamente.
- Haga clic en Adquirir (o equivalente) para capturar un breve clip durante la respiración del paciente.
- Evalúe visualmente la excursión diafragmática como una de las siguientes: Macroscópicamente intacta (Video 1 y Video 2), Extremadamente ausente (Video 3 y Video 4) o Indeterminada (Video 5 y Video 6).
- Si se necesita una cuantificación indeterminada o adicional, proceda a la sección 2 (Fase 2) del protocolo.
- Evaluación del hemidiafragma izquierdo: repetir los pasos 1.2.1.1-1.2.1.6 en el lado izquierdo del paciente.
- Valoración del hemidiafragma derecho
2. Fase 2: Evaluación cuantitativa de la excursión de ZOA
- Configuración de la máquina y posicionamiento del paciente
- Selección de sonda: Seleccione un transductor lineal de alta frecuencia (>10-13 MHz).
- Aplique gel de acoplamiento de ultrasonido a la sonda.
- Ajustes del instrumento: Seleccione el preajuste musculoesquelético (MSK) si está disponible. Si el preajuste de MSK no está disponible, seleccione cualquier preajuste y utilice el mismo preajuste para todo el escaneo diafragmático de alta frecuencia.
- Coloque al paciente en posición semirreclinada (repita el paso 1.1.4).
- Técnica de escaneo
- Valoración del hemidiafragma derecho
- Coloque la sonda en la línea axilar media a nivel del octavo o noveno espacio intercostal, con el indicador de la sonda apuntando cefálicamente hacia la cabeza del paciente (Figura 3 y Figura 4A).
- Incline el haz perpendicular a la pared torácica y centre el eje de modo que el espacio intermedio de las costillas quede centrado en la pantalla con las costillas craneales y caudales visibles en los bordes de la pantalla (Figura 4B).
- Establezca la profundidad de modo que la línea pleural o el diafragma sea visible en el tercio central de la pantalla.
NOTA: Por lo general, esto significa una profundidad de 3-5 cm, pero puede ser mayor si hay tejido subcutáneo adicional. - Ajuste la ganancia de tal manera que el diafragma/línea pleural sean visiblemente distintos de las estructuras circundantes.
- Identifique la línea pleural en la pantalla.
- Mida la localización inspiratoria final de la ZOA.
- Dé al paciente las siguientes instrucciones: "Inhale completamente y luego contenga la respiración durante 4 segundos. Si no puedes tolerar 4 s, entonces por favor aguanta la respiración durante cualquier cantidad de tiempo que te sientas cómodo".
- Durante la retención de la respiración del paciente, siga la línea pleural caudalmente hasta llegar al lugar donde la línea pleural es visible solo en una parte del espacio intermedio de la costilla, y el espacio intermedio restante contiene el diafragma a una profundidad similar a la línea pleural (Video 7 y Video 8).
NOTA: Este espacio intermedio de la costilla que contiene simultáneamente pleura y diafragma se ha denominado Zona de Aposición (ZOA). - Ajuste la posición de la sonda (corredera, abanico, roca según sea necesario) hasta que la vista se centre en la ZOA con las siguientes estructuras también visibles: el tejido subcutáneo de arriba y una costilla en cada tamaño de la pantalla (Figura 4C).
- Con un marcador cutáneo no permanente, trace una línea perpendicular al eje largo del transductor de ultrasonido y divida la sonda para marcar el espacio intermedio donde se encontró la ZOA (Figura 5A). La marca debe estar alineada con la ZOA, en la transición entre la pleura y el diafragma (Figura 4B, C).
- Pídale al paciente que exhale y luego "respire normalmente" (también conocido como respiración marea).
- Si no está seguro de haber identificado la ZOA, repita los pasos 2.2.1.6.1-2.2.1.6.3 y examine el presunto diafragma en esta vista para ver sus cambios durante el ciclo respiratorio.
NOTA: El diafragma verdadero debe engrosarse durante la inspiración y disminuir su grosor durante la espiración. - Repita la medición una vez (es decir, pasos 2.2.1.6.1-2.2.1.6.5).
- Tome el promedio de las dos mediciones y utilícelo para el valor final de la ubicación inspiratoria final de la ZOA (Figura 5B).
- Mida la ubicación final de la expiatoria de la ZOA.
- Dé al paciente las siguientes instrucciones: "Inhale completamente, luego exhale completamente y luego aguante la respiración durante 4 segundos. Si no puedes tolerar 4 s, entonces por favor aguanta la respiración durante cualquier cantidad de tiempo que te sientas cómodo".
- Deslice la sonda cranealmente para encontrar la ubicación final de la espiración de la ZOA.
- Repita los pasos 2.2.1.6.3-2.2.1.6.4.
- Pídale al paciente que "respire normalmente".
- Repita la medición una vez (es decir, pasos 2.2.1.7.1-2.2.1.7.4).
- Tome el promedio de las dos mediciones y utilícelo para el valor final de la ubicación espiratoria de la ZOA.
- Medición de la excursión de ZOA
- Mida la distancia entre las marcas cutáneas promediadas al final de la inspiración y al final de la espiración promediadas en cm con una regla. La distancia entre las dos marcas cutáneas externas representa la máxima excursión diafragmática (Figura 5C).
- Valoración del hemidiafragma izquierdo
- Repita todos los subpasos contenidos en el paso 2.2.1 en el lado izquierdo del pecho.
- Valoración del hemidiafragma derecho
Resultados
Este protocolo de ecografía diafragmática comienza con la evaluación cualitativa de cada hemitórax durante una respiración con capacidad vital para clasificar cada hemidiafragma en una de tres categorías: excursión macroscópicamente intacta, excursión macroscópicamente deteriorada o indeterminada. En el vídeo 1 y en el vídeo 2, respectivamente, se muestran ejemplos de una excursión de la capacidad vital macroscópicamente normal de los hemidiafragmas derecho e izquierdo. En el Video 3 y en el Video 4, respectivamente, se muestran ejemplos de disminución de la capacidad vital de los hemidiafragmas derecho e izquierdo. En el Video 5 y en el Video 6, respectivamente, se muestran ejemplos de excursión de la capacidad vital cualitativamente indeterminada de los hemidiafragmas derecho e izquierdo.
Es probable que la evaluación cualitativa sea suficiente para responder a la pregunta de si existe disfunción hemidiafragmática macroscópica en la mayoría de los casos. Sin embargo, si el examen cualitativo arroja resultados indeterminados o el clínico necesita datos más granulares sobre la función hemidiafragmática (por ejemplo, para cuantificar el efecto de un bloqueo nervioso regional sobre la función hemidiafragmática como parte de un estudio de investigación), entonces este protocolo requiere la medición cuantitativa de la excursión de la porción más craneal de la ZOA. Actualmente, los valores normales de la excursión ZOA tienen una escasez de datos de validación.
Sin embargo, se pueden extraer algunas inferencias a partir de los valores normales de una medición relacionada: la excursión de la cúpula del diafragma (DoD). Se ha demostrado que la excursión del DoD tiene un rango variable, dependiendo del estudio. Por ejemplo, una revisión narrativa realizada por Boussuges et al. encontró que la excursión normal del DoD varía según el sexo y la lateralidad 3,13. En concreto, el rango normal de excursión del Departamento de Defensa para la respiración tidal en los hombres oscila entre 1,4 cm y 2,3 cm a la derecha y de 1,7 cm a 2,4 cm a la izquierda; Para las mujeres, oscila entre 1,4 cm y 2,7 cm a la derecha y de 1,6 a 2,4 cm a la izquierda. Del mismo modo, para las respiraciones de capacidad vital, la excursión normal de DOD en los hombres oscila entre 5,3 cm y 7,8 cm a la derecha y 5,4 cm a 7,8 cm a la izquierda; para las mujeres oscila entre 4,7 cm y 8,0 a la derecha y de 4,8 cm a 6,4 cm a la izquierda 3,13.
En particular, para el método cuantitativo de medición de la excursión ZOA descrito en este manuscrito, los valores normales absolutos de la excursión ZOA aún no se han establecido firmemente. Además, los valores normales publicados para el método de excursión del DoD tampoco deben utilizarse para diferenciar lo normal de lo anormal para el método de excursión ZOA porque no se ha delineado una fórmula clara que relacione estos dos valores. Sin embargo, un principio fundamental de la evaluación diafragmática es la comparación dentro del sujeto: (a) izquierda versus derecha (b), antes versus después de la intervención, y (c) monitoreo del cambio a lo largo del tiempo. Tales comparaciones están permitidas por el método de excursión ZOA incluso en ausencia de valores normales publicados para esta técnica.
Por ejemplo, Kim et al. han propuesto utilizar la medición de la excursión ZOA para clasificar a los pacientes en tres categorías de disfunción diafragmática comparando la excursión hemidiafragmática antes y después de la intervención de embotamiento del nervio frénico20: i) disfunción completa del nervio frénico: disminución del >75% en la excursión ZOA después de la intervención o movimiento paradójico del diafragma; ii) disfunción parcial del nervio frénico: disminución del 25-75% en la excursión de ZOA después de la intervención; iii) cambios menores o nulos en la función diafragmática: disminución del 0 al 25% en la excursión de ZOA después de la intervención.

Figura 1: Representación del protocolo de evaluación cualitativa de la excursión macroscópica del diafragma. Observe la ilustración anatómica del diafragma (línea verde brillante) que recubre el hígado (izquierda) y el bazo (derecha). Para visualizar el diafragma para la evaluación cualitativa, la sonda curvilínea debe colocarse en la línea axilar media con el haz alineado con el plano coronal del cuerpo y el paciente en posición semireclinada. Reimpreso con permiso de masterthemachines.com. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Evaluación cualitativa de la excursión diafragmática. (A) Posicionamiento adecuado de la sonda con el transductor de baja frecuencia (curvilínea o de matriz sectorial) colocado en el flanco derecho o izquierdo en el 5-7º espacio intercostal, línea axilar media y el indicador de la sonda apuntando cranealmente. (B) Identificación del hemidiafragma derecho en modo B durante la evaluación cualitativa. El diafragma es visible como una banda hiperecogénica brillante que recubre el hígado. Para una visión óptima, la columna subdiafragmática debe ser visible. (C) Identificación del hemidiafragma izquierdo en modo B durante la evaluación cualitativa. Aquí se ve el bazo en lugar del hígado. Una vez que se visualiza inicialmente el diafragma, se puede observar el movimiento del diafragma para evaluar la disfunción hemidiafragmática macroscópica. Consulte el Video 1, el Video 2, el Video 3, el Video 4, el Video 5 y el Video 6 para ver ejemplos de excursiones de diafragma normales, anormales e indeterminadas a la derecha y a la izquierda. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Representación del protocolo para la evaluación cuantitativa de la excursión de ZOA. Obsérvese la ilustración anatómica del diafragma final espiratorio como una línea azul oscura y el diafragma inspiratorio final como una línea azul claro. Para visualizar la ZOA para la evaluación cuantitativa, la sonda lineal debe colocarse en la línea axilar media con el haz alineado perpendicular al torso y el paciente en posición semireclinada. Reimpreso con permiso de masterthemachines.com. Abreviatura: ZOA = zona de aposición. Haga clic aquí para ver una versión más grande de esta figura.
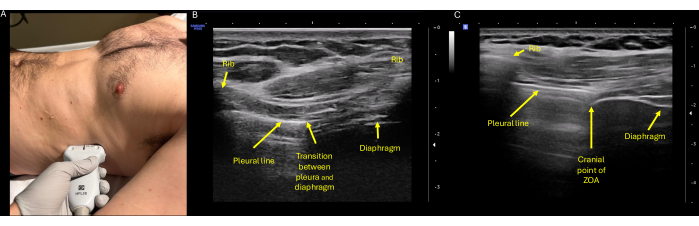
Figura 4: Evaluación ecográfica de la excursión de ZOA. (A) Posicionamiento adecuado de la sonda con el transductor de alta frecuencia (lineal) colocado en el flanco derecho o izquierdo en la línea axilar media al nivel del octavo o noveno espacio intercostal, con el indicador de la sonda apuntando cefálicamente hacia la cabeza del paciente. (B) Identificación de la ZOA, que se define como la porción lateral del diafragma que se une a la caja torácica. En la ecografía se puede identificar en el punto de transición del diafragma y la pleura, que se muestra aquí centrado entre dos espacios costales. (C) La cara más cefálica de la ZOA, que corresponde nuevamente al espacio intermedio de las costillas que muestra el pulmón y el diafragma aireados al mismo tiempo. Aquí se observa la apariencia característica de tres capas del diafragma, con la pleura parietal hiperecoica superficial externamente, la capa muscular anecoica media y el peritoneo hiperecoico profundo. Abreviatura: ZOA = zona de aposición. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Marcado y medición de la excursión de ZOA. (A) Una vez que se identifica la ZOA después de la exhalación completa de una respiración de capacidad vital, se traza una línea perpendicular desde el centro de la sonda para marcar la ubicación inicial de la ZOA al final de la espiración. (B) Una vez que se repiten los pasos y se identifica nuevamente el ZOA después de la exhalación de una segunda respiración de capacidad vital, se traza una nueva línea desde el centro de la sonda. Esto marca la segunda localización identificada de la ZOA final de la espiración. Posteriormente, se promedia la distancia entre las dos mediciones y se utiliza la línea media como valor final de la localización final de la ESPIRATORIA. Los mismos pasos se repiten para obtener las marcas inspiratorias finales de la ZOA. Las marcas de fin de inspiración y fin de espiración se pueden obtener en cualquier orden. (C) La distancia entre las marcas cutáneas promediadas al final de la espiración y al final de la inspiración promediadas se mide en centímetros con una regla. Esta distancia representa la excursión diafragmática cuantificada. Abreviatura: ZOA = zona de aposición. Haga clic aquí para ver una versión más grande de esta figura.
Figura 6: Maniobra de la sonda para superar el sombreado de las costillas. La sonda lineal se puede girar entre dos espacios de nervadura para la identificación de ZOA en el caso de una nervadura que oscurece la ubicación de la ZOA. Abreviatura: ZOA = zona de aposición. Haga clic aquí para ver una versión más grande de esta figura.
Video 1: Vista coronal obtenida con un transductor de baja frecuencia centrado en el hemidiafragma derecho que muestra una excursión diafragmática cualitativamente normal durante la respiración en capacidad vital. Haga clic aquí para descargar este video.
Video 2: Vista coronal obtenida con un transductor de baja frecuencia centrado en el hemidiafragma izquierdo que muestra una excursión diafragmática cualitativamente normal durante la respiración a capacidad vital. Haga clic aquí para descargar este video.
Video 3: Vista coronal obtenida con un transductor de baja frecuencia centrado en el hemidiafragma derecho que muestra ausencia macroscópica de excursión diafragmática durante el intento de respiración con capacidad vital. Haga clic aquí para descargar este video.
Video 4: Vista coronal obtenida con un transductor de baja frecuencia centrado en el hemidiafragma izquierdo que muestra ausencia macroscópica de excursión diafragmática durante el intento de respiración con capacidad vital. Haga clic aquí para descargar este video.
Video 5: Vista coronal obtenida con un transductor de baja frecuencia centrado en el hemidiafragma derecho que muestra un nivel macroscópicamente submáximo (indeterminado) de excursión diafragmática durante el intento de respiración con capacidad vital. Haga clic aquí para descargar este video.
Video 6: Vista coronal obtenida con un transductor de baja frecuencia centrado en el hemidiafragma izquierdo que muestra un nivel macroscópicamente submáximo (indeterminado) de excursión diafragmática durante el intento de respiración en capacidad vital. Haga clic aquí para descargar este video.
Video 7: Vista coronal obtenida con un transductor lineal de alta frecuencia que muestra el movimiento normal de la porción más craneal de la ZOA durante la respiración tidal. Abreviatura: ZOA = zona de aposición. Haga clic aquí para descargar este video.
Video 8: Vista coronal obtenida con un transductor lineal de alta frecuencia que muestra el transductor deslizándose caudalmente para seguir el movimiento normal de la porción más craneal de la ZOA durante una respiración de capacidad vital. Abreviatura: ZOA = zona de aposición. Haga clic aquí para descargar este video.
Video 9: Vista coronal obtenida con un transductor lineal de alta frecuencia que muestra cómo, al final de la inspiración, la porción más craneal de la ZOA puede quedar oculta por una sombra de costilla. Abreviatura: ZOA = zona de aposición. Haga clic aquí para descargar este video.
Archivo complementario 1: Referencia para ver las imágenes fijas más importantes de cada video. Haga clic aquí para descargar este archivo.
Discusión
POCUS ofrece claras ventajas para la evaluación diafragmática, incluida la portabilidad, la no invasividad y las capacidades de obtención de imágenes en tiempo real. Estas fortalezas se pueden aprovechar con este protocolo factible y accesible y se pueden aplicar en una variedad de entornos clínicos. Este protocolo comienza con una evaluación cualitativa de la excursión diafragmática para responder a la pregunta de si existe disfunción hemidiafragmática macroscópica. Si la respuesta no es clara o si se necesita información más específica, el segundo paso del protocolo proporciona una aclaración a través de la medición cuantitativa de la excursión de la ZOA. Estas mediciones pueden ayudar en la toma de decisiones clínicas mediante la utilización de la comparación dentro del sujeto de la lateralidad, antes frente a la intervención posterior o la evaluación del cambio a lo largo del tiempo.
Tradicionalmente, la evaluación diafragmática se ha basado en métodos como la radiografía de tórax, la fluoroscopia, la tomografía computarizada, los estudios de conducción del nervio frénico y las mediciones de presión transdiafragmática. Si bien estas técnicas proporcionan información valiosa, a menudo requieren mucho tiempo, son costosas, carecen de portabilidad y, a veces, solo ofrecen imágenes estáticas2. La ecografía ofrece ventajas frente a estas deficiencias. En particular, hay algunos enfoques avanzados de ultrasonido en el horizonte para la evaluación diafragmática que involucran imágenes bidimensionales de seguimiento de moteado y elastografía de onda de corte. Estos enfoques evalúan las propiedades mecánicas tisulares del diafragma y cuentan con evidencia experimental que apoya su validez3. Sin embargo, el seguimiento de manchas y la elastografía de ondas de corte requieren habilidades y equipos de sonografía avanzados que rara vez están disponibles para el médico común.
Por otra parte, muchos autores han abogado por el uso de POCUS cuantitativos para evaluar la función diafragmática. Como se explicó en la introducción, las dos técnicas tradicionalmente utilizadas para este propósito son la medición de la excursión DoD y el engrosamiento diafragmático. Estos protocolos están bien descritos y su correlación clínica continúa siendo investigada 3,6,13,21. Recientemente se han publicado protocolos que simplifican los métodos de evaluación del grosor del diafragma y la fracción de engrosamiento tanto en pacientes sanos como críticos, lo que permite que estos protocolos sean accesibles a los clínicos con conocimientos básicos de ecografía21.
En los últimos años, la evaluación de la función diafragmática en pacientes críticos ha ganado atención a medida que su papel esencial en la evaluación de los resultados respiratorios se ha vuelto cada vez más evidente. Los pacientes que requieren ventilación mecánica pueden desarrollar atrofia por desuso del diafragma y disminución de la fuerza contráctil, lo que se ha asociado con un aumento de la mortalidad 6,22. La hipotrofia del diafragma puede presentarse a las 24 h del inicio de la ventilación mecánica11. Por lo tanto, el reconocimiento temprano de la disfunción muscular del diafragma con herramientas no invasivas como POCUS es vital. Un estudio de Goligher et al. demostró que en pacientes con ventilación mecánica, la evaluación POCUS del grosor del hemidiafragma derecho puede ser factible y reproducible23. Sin embargo, encontraron que las mediciones del grosor del hemidiafragma izquierdo y de la fracción de engrosamiento bilateralmente no eran reproducibles. Tanto el engrosamiento del diafragma como la excursión DoD están limitados por la escasa fiabilidad entre operadores y la dispersión de las mediciones 2,15,16.
Además, no existe un consenso de expertos sobre qué modo de ultrasonido es el mejor para medir el grosor del diafragma (modo B vs. modo M) y en qué punto del ciclo respiratorio es óptimo realizar la medición18. Además de los desafíos del operador, los propios pacientes también pueden presentar factores de confusión. En los pacientes críticos, es crucial tener en cuenta tanto la patología como la fisiología del paciente. Por ejemplo, las enfermedades crónicas como la enfermedad pulmonar obstructiva crónica, la enfermedad pulmonar intersticial o los trastornos neuromusculares pueden causar una disminución de la movilidad del diafragma, mientras que los pacientes con insuficiencia de salud congestiva y fibrosis quística pueden tener diafragmas anormalmente engrosados 6,13. Además, la ventilación con presión positiva puede afectar las mediciones ecográficas al causar una disminución de la excursión del diafragma y una reducción del engrosamiento18.
Por lo tanto, existe una necesidad insatisfecha de un protocolo de adquisición de imágenes simple y reproducible para la ecografía diafragmática que se pueda realizar en el punto de atención. Para abordar esta necesidad insatisfecha, hemos desarrollado un protocolo basado en la evidencia que detecta la disfunción diafragmática en un proceso de dos pasos: primero cualitativamente y luego, si es necesario, cuantitativamente, con el último paso realizado utilizando un método recientemente validado para medir la excursión de la porción más craneal de la ZOA.
La evaluación cualitativa del movimiento del diafragma es una técnica bien establecida que ha sido reportada en la literatura desde la década de 19703. La evaluación cualitativa en ecografía en modo B no requiere cálculos y, a menudo, puede proporcionar una respuesta binaria (sí o no a la pregunta de si hay una excursión diafragmática macroscópicamente normal). Las variaciones del enfoque cualitativo han sido probadas en múltiples estudios y han resultado útiles para evaluar la asimetría macroscópica de la función hemidiafragmática 2,3,5,6,13,18,23.
En los casos en los que un cribado cualitativo inicial proporciona datos no concluyentes sobre la función de cada hemidiafragma, el protocolo propuesto pasa a un enfoque cuantitativo recientemente validado: la medición de la excursión de la porción más craneal de la ZOA. Esta técnica fue descrita por primera vez en 2017 por El-Boghdadly y posteriormente utilizada por Kim et al. en 2019 para detectar la disfunción diafragmática después de bloqueos del nervio superior del tronco19,20. Más recientemente, esta técnica fue probada y validada en 2023: Da Conceicao et al. compararon este novedoso método tanto con la medición de la excursión DoD como de la fracción de engrosamiento diafragmático en 75 pacientes17. Los autores encontraron que la medición de la excursión de la porción más craneal de la excursión ZOA tuvo un éxito significativamente mayor en la medición de la excursión de ambos hemidiafragmas en comparación con el método DoD. El método ZOA tuvo una tasa de éxito del 100% bilateralmente, mientras que el método DoD solo pudo medir la excursión diafragmática el 98,7% a la derecha y el 35% de las veces a la izquierda. Si bien el método de la fracción de espesamiento demostró un éxito del 100% al poder medir ambos diafragmas, los valores de la fracción de espesamiento izquierda y derecha generados por este método no se correlacionaron dentro de los pacientes ni se correlacionaron con las mediciones de excursión obtenidas mediante los métodos DoD y ZOA. Para el método de la fracción de engrosamiento, esta falta de correlación tanto con otros métodos de evaluación de la función diafragmática como entre los hemidiafragmas izquierdo y derecho dentro de los sujetos, plantea preocupaciones sobre la validez general de este método como herramienta diagnóstica.
Dado que el método de excursión ZOA sigue siendo nuevo y desconocido para la mayoría de los proveedores, algunas sugerencias de solución de problemas pueden ayudar a aumentar la probabilidad de éxito. En primer lugar, es fundamental utilizar un enfoque sistemático, como el que se describe en este protocolo. En segundo lugar, dado que la identificación inicial de la ZOA puede ser un desafío, es importante garantizar el posicionamiento adecuado de la sonda e identificar los puntos de referencia anatómicos conocidos. La sonda debe estar entre la línea axilar anterior y media, y los espacios costales deben estar centrados en la pantalla. La ZOA se puede identificar por su característica apariencia de tres capas y generalmente se encuentra a una profundidad de 1,5-3 cm (dependiendo del IMC del paciente) y a menudo se encuentra por debajo del ángulo costofrénico con inhalación 2,16. Si no se identifica la ZOA, hay dos posibilidades de que esté oculta detrás de la sombra de una costilla (Video 9) o que esté siendo oscurecida continuamente por el pulmón que se mueve hacia el campo19. La primera posibilidad se puede solucionar girando el transductor oblicuamente para alinearlo con los espacios intercostales entre las costillas (Figura 6). La segunda posibilidad se puede abordar deslizándose a un espacio intercostal más caudal.
A pesar de sus numerosas ventajas, este protocolo POCUS diafragmático tiene varias limitaciones. En primer lugar, el protocolo requiere la visualización de la porción más craneal de la ZOA, lo que puede no ser posible en presencia de enfisema subcutáneo difuso, apósitos, drenajes, tubos o fajas. En segundo lugar, hasta la fecha, el método de excursión ZOA solo se ha probado contra enfoques alternativos en un solo estudio15. A pesar de que este único estudio demostró la superioridad relativa de la excursión ZOA sobre dos enfoques cuantitativos tradicionales para el POCUS diafragmático, el método ZOA no se ha probado contra un estándar de oro como la evaluación fluoroscópica de la función diafragmática. Esta comparación con un estándar de oro es necesaria para definir mejor los valores normales y anormales para el enfoque de excursión ZOA. Además, dada su novedad, este protocolo aún no se ha correlacionado con los resultados clínicos. Sin embargo, hasta que los valores normativos del método ZOA estén firmemente establecidos, esta técnica aún puede ser útil para cuantificar el grado de asimetría en la función hemidiafragmática en una variedad de situaciones clínicas donde la evaluación cualitativa por sí sola es indeterminada. En tercer lugar, esta evaluación proporciona información generalizada de la función del diafragma, pero carece de la especificidad necesaria para proporcionar información sobre estados de enfermedad como la fibrosis o medidas precisas de la contractilidad. Por último, se requiere un nivel básico de conocimientos de POCUS para poder aplicar con éxito este protocolo en la práctica clínica. Sin embargo, estos métodos demuestran ser más simples que las medidas POCUS anteriores de disfunción del diafragma (excursión DoD y engrosamiento del diafragma), ya que requieren menos mediciones y menos familiaridad con la perología. Además, el dominio de este método se puede lograr rápidamente con capacitación. Al seguir el protocolo descrito y las estrategias de solución de problemas, la evaluación reproducible del diafragma puede ser factible para el médico promedio que utiliza un equipo de ultrasonido simple disponible en el punto de atención.
Divulgaciones
No tenemos divulgaciones relevantes ni conflictos de intereses.
Agradecimientos
Gracias al Dr. Fintan Hughes por ayudar con la fotografía.
Materiales
| Name | Company | Catalog Number | Comments |
| Medical Ruler | MediChoice | NA | We used Medichoice as that is what is readily available at our institution and it comes with the skin marker, however any medical ruler will work. The majority of skin markers come with a type of ruler or measurement system, but if not a separate ruler can be used. |
| Skin Marker | MediChoice | NA | We again used Medichoice as that is what is readily available at our institution and it comes with the ruler, however any standard skin marker will work. |
| Ultrasound Gel | Aquasonic | NA | Any standard gel will work. Sterile packs are not necessary but can be used on a case-by-case basis at the providers discretion. |
| Ultrasound Machine | Samsung and GE | NA | Any standard portable ultrasound machine will suffice. |
Referencias
- Bronshteyn, Y. S., Blitz, J., Hashmi, N., Krishnan, S. Logistics of perioperative diagnostic point-of-care ultrasound: Nomenclature, scope of practice, training, credentialing/privileging, and billing. Int Anesthesiol Clin. 60 (3), 1-7 (2022).
- Osman Elew, A. N. E., Abd Alrahman, A. A. H., El Khayat, H. M. H. Diaphragmatic ultrasound: Review article. The Egyptian Journal of Hospital Medicine. 87 (1), 1006-1009 (2022).
- Boussuges, A., Rives, S., Finance, J., Bregeon, F. Assessment of diaphragmatic function by ultrasonography: Current approach and perspectives. World J Clin Cases. 8 (12), 2408-2424 (2020).
- Volpicelli, G., et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med. 38 (4), 577-591 (2012).
- Saad, M., et al. Ultrasonographic assessment of diaphragmatic function and its clinical application in the management of patients with acute respiratory failure. Diagnostics (Basel). 13 (3), 411(2023).
- Santana, P. V., Cardenas, L. Z., Albuquerque, A. L. P. Diaphragm ultrasound in critically ill patients on mechanical ventilation-evolving concepts. Diagnostics (Basel). 13 (6), 1116(2023).
- Petrof, B. J. Diaphragm weakness in the critically ill: Basic mechanisms reveal therapeutic opportunities. Chest. 154 (6), 1395-1403 (2018).
- Chu, S. E., et al. Point-of-care application of diaphragmatic ultrasonography in the emergency department for the prediction of development of respiratory failure in community-acquired pneumonia: A pilot study. Front Med. 9, 960847(2022).
- Suttapanit, K., Wongkrasunt, S., Savatmongkorngul, S., Supatanakij, P. Ultrasonographic evaluation of the diaphragm in critically ill patients to predict invasive mechanical ventilation. J Intensive Care. 11 (1), 40(2023).
- Vivier, E., et al. Diaphragm ultrasonography to estimate the work of breathing during non-invasive ventilation. Intensive Care Med. 38 (5), 796-803 (2012).
- Eduardo Garrido-Aguirre, S. aN. S. Diaphragmatic ultrasonography, a novel approach in critical care. Ultrasound Q. 36, 54-58 (2020).
- Sferrazza Papa, G. F., et al. A review of the ultrasound assessment of diaphragmatic function in clinical practice. Respiration. 91 (5), 403-411 (2016).
- Santana, P. V., Cardenas, L. Z., Albuquerque, A. L. P., Carvalho, C. R. R., Caruso, P. Diaphragmatic ultrasound: A review of its methodological aspects and clinical uses. J Bras Pneumol. 46 (6), e20200064(2020).
- Qian, Z., Yang, M., Li, L., Chen, Y. Ultrasound assessment of diaphragmatic dysfunction as a predictor of weaning outcome from mechanical ventilation: A systematic review and meta-analysis. BMJ Open. 8 (9), e021189(2018).
- Kharma, N. Dysfunction of the diaphragm: Imaging as a diagnostic tool. Curr Opin Pulm Med. 19 (4), 394-398 (2013).
- Tsui, J. J., Tsui, B. C. A novel systematic abc approach to diaphragmatic evaluation (abcde). Can J Anaesth. 63 (5), 636-637 (2016).
- Da Conceicao, D., et al. Validation of a novel point-of-care ultrasound method to assess diaphragmatic excursion. Reg Anesth Pain Med. 49 (11), 800-804 (2023).
- Haaksma, M. E., et al. EXpert consensus on diaphragm ultrasonography in the critically ill (EXODUS): A delphi consensus statement on the measurement of diaphragm ultrasound-derived parameters in a critical care setting. Crit Care. 26 (1), 99(2022).
- El-Boghdadly, K., Goffi, A., Chan, V. Point of care diaphragmatic ultrasound made easy. Can J Anaesth. 64 (3), 327-328 (2017).
- Kim, D. H., et al. Superior trunk block: A phrenic-sparing alternative to the interscalene block: A randomized controlled trial. Anesthesiology. 131 (3), 521-533 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431(2023).
- Goligher, E. C., et al. Measuring diaphragm thickness with ultrasound in mechanically ventilated patients: feasibility, reproducibility and validity. Intensive Care Med. 41 (4), 642-649 (2015).
- Pereira, R. O. L., et al. Point-of-care lung ultrasound in adults: Image acquisition. J Vis Exp. (193), e64722(2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados