Method Article
L’échographie diaphragmatique chez l’adulte : acquisition et interprétation des images
Dans cet article
Résumé
L’échographie au point d’intervention (POCUS) est une technique essentielle pour le dépistage du dysfonctionnement diaphragmatique en raison de sa portabilité, de son caractère non invasif et de ses capacités d’imagerie en temps réel. Bien qu’il existe actuellement des protocoles POCUS diaphragmatiques, ils souffrent d’une faible fiabilité interopérateurs et de l’absence de directives consensuelles. Nous décrivons ici une technique reproductible et simple à réaliser.
Résumé
Le dysfonctionnement du diaphragme est une préoccupation largement reconnue dans de nombreuses spécialités médicales et milieux cliniques. Une évaluation rapide et précise du diaphragme est essentielle non seulement chez les patients gravement malades, où il joue un rôle dans le sevrage de la ventilation mécanique et les résultats respiratoires, mais aussi dans le domaine périopératoire en tant qu’outil de diagnostic pour détecter la fonction du nerf phrène. L’évaluation diaphragmatique a traditionnellement utilisé la fluoroscopie et les études nerveuses qui prennent du temps, sont coûteuses et ne sont pas portables. L’échographie au point d’intervention (POCUS) surmonte ces obstacles et peut être utilisée comme outil de dépistage non invasif de la fonction du diaphragme. Cependant, le POCUS pour le dysfonctionnement diaphragmatique souffre actuellement de plusieurs problèmes tels qu’un manque de directives consensuelles, une multiplicité de protocoles et une faible fiabilité interopérateur parmi les protocoles existants, notamment avec l’évaluation du dôme de l’excursion du diaphragme et de l’épaississement diaphragmatique. Pour répondre à ces questions, ce manuscrit passe en revue la littérature disponible sur les POCUS diaphragmatiques et identifie une technique d’acquisition d’images à la fois simple à réaliser et dotée d’une grande fiabilité interopérateur. Cette technique décrit d’abord une évaluation qualitative de l’excursion du diaphragme, suivie d’une évaluation quantitative de l’excursion de la zone d’apposition. La technique est décrite par étapes avec tous les éléments suivants : positionnement du patient, sélection du transducteur, placement de la sonde, optimisation de l’image et interprétation.
Introduction
L’échographie diagnostique peut être séparée en deux divisions : consultative et au point de service. L’échographie consultative intègre un examen effectué par une équipe de spécialistes distincte, tandis que le POCUS est à la fois réalisé et interprété par le clinicien qui s’occupe du patient en temps réel1.
Au cours des dernières décennies, le POCUS diagnostique est devenu un outil de transformation de la médecine moderne, avec des applications qui se sont rapidement étendues à toutes les spécialités. Ces applications POCUS sont pilotées par la nature non invasive de l’échographie, sa portabilité et ses capacités d’imagerie en temps réel. De plus, dans le cadre des POCUS diagnostiques, les applications qui ont atteint le plus d’adoption en médecine clinique ont tendance à avoir à la fois une précision raisonnablement élevée par rapport à un étalon-or et une fiabilité inter-observateur élevée 2,3. Par exemple, le POCUS du poumon est bien établi pour réduire le diagnostic différentiel de l’insuffisance respiratoire et dispose de directives claires fondées sur des preuves à l’appui de son utilisation standardisée4. Cependant, bien que le POCUS du poumon soit bien établi, il reste un besoin non satisfait de développer une évaluation échographique reproductible du diaphragme.
Un tel protocole d’évaluation diaphragmatique non invasif profiterait à de multiples spécialités et situations cliniques, y compris, mais sans s’y limiter, les soins intensifs, la pneumologie, les soins périopératoires (y compris l’anesthésie à usage général et les contextes d’anesthésie régionale de sous-spécialité) et la neurologie. Dans l’unité de soins intensifs, la dysfonction diaphragmatique est une préoccupation courante, résultant souvent de multiples pathologies sous-jacentes telles que les maladies neuromusculaires, la myopathie grave, les traumatismes et la malnutrition5. Les patients gravement malades courent souvent un risque élevé à la fois d’une contraction altérée du diaphragme et d’une sous-reconnaissance de ce phénomène6. De plus, il est important de diagnostiquer précocement le dysfonctionnement diaphragmatique, car non seulement il peut aider aux stratégies de gestion de la ventilation, mais aussi le dysfonctionnement peut être un indicateur précoce d’infection et de septicémie 7,8. De plus, une intubation prolongée peut entraîner une morbidité et une mortalité importantes et une augmentation des dépenses de santé2. Dans ces scénarios, un protocole non invasif et portable d’évaluation diaphragmique pourrait être utile pour évaluer la pertinence du sevrage de la ventilation mécanique, évaluer le travail respiratoire et prédire la probabilité de succès ou d’échec de l’extubation 6,8,9,10,11.
Dans le cadre de l’anesthésie régionale, le POCUS diaphragmatique pourrait avoir une valeur dans le dépistage de la parésie diaphragmatique liée à un dysfonctionnement transitoire du nerf phrène à partir de blocs du plexus brachial. Bien que bien tolérée par les patients en bonne santé, la paralysie du nerf phrénique peut entraîner une détresse respiratoire chez les patients ayant une réserve pulmonaire limitée. De plus, dans le domaine périopératoire, le POCUS du diaphragme peut servir d’outil de diagnostic pour les patients dans les contextes préopératoires, peropératoires et postopératoires. Par exemple, le POCUS diaphragmatique pourrait être utilisé pour détecter les lésions du nerf phrénique résultant d’un large éventail de procédures, y compris, mais sans s’y limiter, le pontage artériel coronarien avec prélèvement de l’artère mammaire interne, l’ablation de la fibrillation auriculaire et les chirurgies cervicales ou thoraciques 3,12.
Enfin, dans le domaine de la neurologie, le POCUS pourrait faciliter l’évaluation de la fonction diaphragmatique dans les maladies neurologiques telles que la myasthénie grave, la dystrophie musculaire de Duchene, la sclérose latérale amyotrophique et les accidents vasculaires cérébraux13.
Une évaluation précise du diaphragme est essentielle en raison de son rôle vital dans la fonction réparatrice. L’oxygénation et la ventilation dépendent de la génération d’une pression intrathoracique négative créée par le diaphragme, un muscle en forme de dôme séparant l’abdomen et le thorax composé de plusieurs membranes musculaires et tendineuses14,15. Le diaphragme comporte au moins deux composants majeurs que l’on peut distinguer à l’échographie : le dôme du diaphragme (DoD) et la zone d’apposition (ZOA). Le DoD est la partie tendineuse centrale qui présente un aspect hyperéchogène et incurvé à l’échographie. Le ZOA est la partie latérale du diaphragme qui se fixe à la cage thoracique et se compose de fibres musculaires parallèles et proximales à la surface interne de la paroi thoracique 3,15. Le ZOA est mince (généralement <1 cm d’épaisseur), mais il augmente en épaisseur pendant l’inspiration à mesure que le diaphragme se contracte. Au niveau de la ZOA, le diaphragme a un aspect caractéristique à l’échographie avec trois couches, dont une couche musculaire anéchoïque qui est délimitée à l’extérieur par la pleurale pariétale hyperéchogène superficielle superficielle et à l’intérieur par le péritoine hyperéchogène profond 3,13.
Plusieurs protocoles échographiques non invasifs ont été proposés pour l’évaluation diaphragmatique, impliquant des approches à la fois qualitatives et quantitatives. L’évaluation visuelle qualitative, l’approche la plus simple, implique l’évaluation du mouvement diaphragmatique bilatéralement, pendant la respiration marée ou vitale, à l’aide d’ultrasons bidimensionnels, également connus sous le nom de mode de luminosité (mode B). En revanche, les protocoles quantitatifs commencent généralement par le mode B et ajoutent des ultrasons unidimensionnels - également connus sous le nom de mode de mouvement (mode M) - pour mesurer l’une des deux choses suivantes : l’excursion du dôme du diaphragme (DoD) et / ou l’épaississement diaphragmatique 2,3,5,13. La mesure de l’excursion DoD est effectuée à l’aide d’un transducteur basse fréquence, le faisceau d’ultrasons étant dirigé à travers le tiers postérieur de l’hémidiaphragme selon un angle perpendiculaire. Le mode M est ensuite utilisé pour mesurer l’excursion pendant la respiration de la capacité vitale.
Alternativement, la mesure de l’épaississement diaphragmatique utilise un transducteur linéaire à haute fréquence en deux étapes. Tout d’abord, le transducteur haute fréquence est placé le long du flanc du patient recouvrant le diaphragme avec le mode B pour identifier la zone d’apposition (ZOA)3. Deuxièmement, l’estimation de l’épaississement diaphragmatique est effectuée à l’aide du mode M en mesurant l’épaisseur diaphragmatique (en millimètres) de la plèvre viscérale à la plèvre pariétale et en calculant la variation d’épaisseur par l’équationsuivante 2,3,5,13 :
Changement d’épaisseur = (Épaisseur à l’inspiration de fin - Épaisseur à l’expiration de la fin) / Épaisseur à l’expiration de la fin
Cependant, les méthodes quantitatives (excursion DoD et épaississement diaphragmatique) souffrent d’une faible fiabilité interopérateur. La fiabilité interopérateur est faible pour la mesure de l’excursion DoD pour plusieurs raisons. Tout d’abord, les fournisseurs ont du mal à trouver un angle de visualisation cohérent de l’excursion du dôme du diaphragme3. Deuxièmement, l’évaluation du côté gauche est souvent difficile en raison de la petite fenêtre acoustique à travers la rate 2,16. Par exemple, des études ont montré que l’identification de l’excursion diaphragmatique gauche n’est pas possible dans 65 à 79 % des cas17. Troisièmement, le contenu intraabdominal et le positionnement du patient peuvent influencer la plage d’excursion du diaphragme2.
De même, la mesure de l’épaississement diaphragmatique a une faible fiabilité interopérateur pour au moins deux raisons. Tout d’abord, la finesse naturelle de la membrane entraîne des erreurs de mesure millimétriques. Deuxièmement, la variabilité de l’épaisseur du diaphragme entre les interstices des côtes et la latéralité du patient provoquent une dispersion de mesure 2,3,17. Reconnaissant ces nombreuses limites, en 2022, un consensus d’experts sur l’échographie diaphragmale chez les patients gravement malades a conclu que les méthodes actuelles n’étaient pas standardisées et que beaucoup nécessitaient un échographiste qualifié18. Ils ont noté qu’il n’y avait pas d’accord sur les valeurs seuils pour le dysfonctionnement du diaphragme basées sur la fraction d’épaississement et que la mesure de la fraction d’épaississement est une compétence difficile avec une courbe d’apprentissage abrupte13,18. De plus, l’utilisation de plusieurs protocoles échographiques différents dans la littérature a ajouté aux défis inhérents en rendant difficile la comparaison des études, ce qui a conduit à l’hétérogénéité de la recherche19.
Pour résoudre ces problèmes, ce manuscrit passe en revue la littérature disponible sur les POCUS diaphragmatiques et identifie une technique d’acquisition d’images à la fois simple à réaliser et dont la fiabilité interopérateur a été démontrée. Ce protocole réalisable mais efficace commence par une évaluation qualitative de l’excursion diaphragmatique, suivie d’une évaluation quantitative récemment validée de l’excursion du point le plus crânien de la ZOA17,19.
Protocole
Toutes les procédures effectuées dans le cadre d’études impliquant des participants humains étaient conformes aux normes éthiques du comité de recherche institutionnel du système de santé de l’Université Duke, à la déclaration d’Helsinki de 1964 et à ses amendements ultérieurs ou à des normes éthiques comparables. Le consentement éclairé a été obtenu de tous les participants. Le fichier supplémentaire 1 contient les images fixes les plus importantes de chaque vidéo.
1. Phase 1 : Évaluation qualitative de l’excursion diaphragmatique (dépistage visuel de la dysfonction hémidiaphragmatique macroscopique)
- Configuration de la machine et positionnement du patient
- Sélection de la sonde : Choisissez une sonde basse fréquence (≤ 5 MHz) (curviligne ou réseau sectoriel [alias « réseau phasé »]19.
- Appliquez du gel de couplage à ultrasons sur la sonde.
- Paramètres de l’instrument : Sélectionnez le préréglage abdominal.
- Positionnez le patient en position semi-allongée.
- Technique de balayage
- Évaluation de l’hémidiaphragme droit
- Placez la sonde sur le flanc droit, espace intercostal 5-7e , ligne axillaire médiane avec le faisceau aligné avec le plan coronal du corps et l’indicateur de sonde pointant vers le crâne (Figure 1 et Figure 2A).
- Ajustez le positionnement de la sonde (glissière, ventilateur, bascule au besoin) jusqu’à ce que la vue soit centrée sur le diaphragme et que les structures suivantes soient également visibles : organe sous-diaphragmatique (foie ou rate), diaphragme, colonne vertébrale et espace supradiaphragmatique (c.-à-d. espace pleural)19 (figures 2B et C).
- Demandez au patient de prendre une inspiration lente et une expiration lente.
- Cliquez sur Acquérir (ou équivalent) pour capturer un court clip pendant la respiration du patient.
- Évaluez visuellement l’excursion diaphragmatique comme l’une des suivantes : Grossièrement intacte (Vidéo 1 et Vidéo 2), Grossièrement absente (Vidéo 3 et Vidéo 4) ou Indéterminée (Vidéo 5 et Vidéo 6).
- Si une quantification indéterminée ou plus poussée est nécessaire, passez à la section 2 (phase 2) du protocole.
- Évaluation de l’hémidiaphragme gauche : répéter les étapes 1.2.1.1-1.2.1.6 sur le côté gauche du patient.
- Évaluation de l’hémidiaphragme droit
2. Phase 2 : Évaluation quantitative de l’excursion ZOA
- Configuration de la machine et positionnement du patient
- Sélection de la sonde : Sélectionnez une sonde linéaire haute fréquence (>10-13 MHz).
- Appliquez du gel de couplage à ultrasons sur la sonde.
- Réglages de l’instrument : Sélectionnez le préréglage musculo-squelettique (MSK) si disponible. Si le préréglage MSK n’est pas disponible, sélectionnez un préréglage et utilisez le même préréglage pour tous les balayages diaphragmatiques à haute fréquence.
- Positionnez le patient en position semi-allongée (répétez l’étape 1.1.4).
- Technique de balayage
- Évaluation de l’hémidiaphragme droit
- Placez la sonde sur la ligne axillaire médiane au niveau du huitième ou du neuvième espace intercostal, avec l’indicateur de sonde pointant la céphalade vers la tête du patient (Figure 3 et Figure 4A).
- Inclinez le faisceau perpendiculairement à la paroi thoracique et centrez l’axe de sorte que l’espace intercalaire des côtes soit centré dans l’écran avec les côtes crâniennes et caudales visibles sur les bords de l’écran (Figure 4B).
- Réglez la profondeur de manière à ce que la ligne pleurale ou le diaphragme soit visible dans le tiers central de l’écran.
REMARQUE : En règle générale, cela signifie une profondeur de 3 à 5 cm, mais peut être plus grande s’il y a du tissu sous-cutané supplémentaire. - Réglez le gain de manière à ce que le diaphragme/la ligne pleurale soient visiblement distincts des structures environnantes.
- Identifiez la ligne pleurale à l’écran.
- Mesurez l’emplacement de l’extrémité inspiratoire de la ZOA.
- Donnez au patient les instructions suivantes : « Inspirez complètement, puis retenez votre respiration pendant 4 s. Si vous ne pouvez pas tolérer 4 secondes, alors retenez votre respiration pendant le temps où vous êtes à l’aise.
- Pendant l’apnée du patient, suivez la ligne pleurale vers la caudale jusqu’à ce que l’on atteigne l’endroit où la ligne pleurale n’est visible que dans une partie de l’espace intercalaire des côtes, et où l’espace intermédiaire restant contient le diaphragme à une profondeur similaire à celle de la ligne pleurale (Vidéo 7 et Vidéo 8).
REMARQUE : Cet espace intercalaire des côtes contenant simultanément la plèvre et le diaphragme a été appelé la zone d’apposition (ZOA). - Ajustez le positionnement de la sonde (glissière, ventilateur, bascule au besoin) jusqu’à ce que la vue soit centrée sur la ZOA avec les structures suivantes également visibles : le tissu sous-cutané au-dessus et une nervure sur l’une ou l’autre taille de l’écran (Figure 4C).
- À l’aide d’un marqueur cutané non permanent, tracez sur le patient une ligne perpendiculaire à l’axe long du transducteur à ultrasons et coupez la sonde en deux pour marquer l’espace interspatial où le ZOA a été trouvé (Figure 5A). Le marquage doit être aligné avec la ZOA, à la transition entre la plèvre et le diaphragme (Figure 4B,C).
- Demandez au patient d’expirer, puis de « respirer normalement » (c’est-à-dire la respiration de marée).
- Si vous n’êtes pas sûr d’avoir identifié la ZOA, répétez les étapes 2.2.1.6.1 à 2.2.1.6.3 et examinez le diaphragme présumé dans cette vue pour voir ses changements au cours du cycle respiratoire.
REMARQUE : Le diaphragme véritable doit s’épaissir pendant l’inspiration et diminuer en épaisseur pendant l’expiration. - Répétez la mesure une fois (c’est-à-dire les étapes 2.2.1.6.1 à 2.2.1.6.5).
- Prenez la moyenne des deux mesures et utilisez-la pour la valeur finale de la position inspiratoire finale de la ZOA (Figure 5B).
- Mesurez l’emplacement expiatoire final de la ZOA.
- Donnez au patient les instructions suivantes : « Inspirez complètement, puis expirez complètement, puis retenez votre respiration pendant 4 secondes. Si vous ne pouvez pas tolérer 4 secondes, alors retenez votre respiration pendant le temps où vous êtes à l’aise.
- Faites glisser la sonde vers le crâne pour trouver l’emplacement de fin d’expiration du ZOA.
- Répétez les étapes 2.2.1.6.3 à 2.2.1.6.4.
- Demandez au patient de « respirer normalement ».
- Répétez la mesure une fois (c’est-à-dire les étapes 2.2.1.7.1 à 2.2.1.7.4).
- Prenez la moyenne des deux mesures et utilisez-la pour la valeur finale de l’emplacement expiratoire final de la ZOA.
- Mesure de l’excursion ZOA
- Mesurez la distance entre les marques cutanées de fin d’inspiration et de fin d’expiration en cm avec une règle. La distance entre les deux marques de peau externe représente l’excursion diaphragmatique maximale (Figure 5C).
- Évaluation de l’hémidiaphragme gauche
- Répétez toutes les sous-étapes contenues dans l’étape 2.2.1 sur la poitrine gauche.
- Évaluation de l’hémidiaphragme droit
Résultats
Ce protocole d’échographie diaphragmatique commence par l’évaluation qualitative de chaque hémithorax au cours d’une respiration de capacité vitale afin de classer chaque hémidiaphragme dans l’une des trois catégories suivantes : excursion grossièrement intacte, excursion grossièrement altérée ou indéterminée. Des exemples d’excursion de capacité vitale grossièrement normale des hémidiaphragmes droit et gauche sont présentés dans les vidéos 1 et 2, respectivement. Des exemples d’excursion de capacité vitale grossièrement altérée des hémidiaphragmes droit et gauche sont présentés dans les vidéos 3 et 4, respectivement. Des exemples d’excursion de capacité vitale qualitativement indéterminée des hémidiaphragmes droit et gauche sont présentés dans les vidéos 5 et 6, respectivement.
L’évaluation qualitative est susceptible de suffire à répondre à la question de savoir s’il y a un dysfonctionnement hémidiaphragmatique macroscopique dans la plupart des cas. Cependant, si l’examen qualitatif donne des résultats indéterminés ou si le clinicien a besoin de données plus granulaires sur la fonction hémidiaphragmatique (par exemple, pour quantifier l’effet d’un bloc nerveux régional sur la fonction hémidiaphragmatique dans le cadre d’une étude de recherche), alors ce protocole nécessite une mesure quantitative de l’excursion de la partie la plus crânienne de la ZOA. À l’heure actuelle, les valeurs normales d’excursion de la ZOA sont limitées en données de validation.
Cependant, certaines inférences peuvent être tirées des valeurs normales d’une mesure connexe : l’excursion du dôme du diaphragme (DoD). Il a été démontré que l’excursion DoD a une portée variable, selon l’étude. Par exemple, une revue narrative réalisée par Boussuges et al. a révélé que l’excursion normale du DoD varie en fonction du sexe et de la latéralité 3,13. Plus précisément, la plage normale de l’excursion DoD pour la respiration des marées chez les hommes varie de 1,4 cm à 2,3 cm à droite et de 1,7 cm à 2,4 cm à gauche ; Pour les femmes, elle varie de 1,4 cm à 2,7 cm à droite et de 1,6 à 2,4 cm à gauche. De même, pour les respirations de capacité vitale, l’excursion normale de la DOD chez les hommes varie de 5,3 cm à 7,8 cm à droite à 5,4 cm à 7,8 cm à gauche ; Pour les femmes, il varie de 4,7 cm à 8,0 à droite et de 4,8 cm à 6,4 cm à gauche 3,13.
En particulier, pour la méthode quantitative de mesure de l’excursion ZOA décrite dans ce manuscrit, les valeurs normales absolues de l’excursion ZOA n’ont pas encore été fermement établies. De plus, les valeurs normales publiées pour la méthode d’excursion DoD ne devraient pas non plus être utilisées pour différencier les normales des normales pour la méthode d’excursion ZOA, car une formule claire reliant ces deux valeurs n’a pas été délimitée. Cependant, un principe majeur de l’évaluation diaphragmatique est la comparaison intra-sujet : (a) gauche contre droite, (b), avant ou après l’intervention, et (c) surveillance des changements au fil du temps. De telles comparaisons sont permises par la méthode d’excursion ZOA, même en l’absence de valeurs normales publiées pour cette technique.
Par exemple, Kim et al. ont proposé d’utiliser la mesure de l’excursion ZOA pour classer les patients en trois catégories de dysfonctionnement diaphragmatique en comparant l’excursion hémidiaphragmatique avant et après l’intervention d’émoussement du nerf phrénique20 : i) dysfonctionnement complet du nerf phrénique : soit une diminution de >75 % de l’excursion ZOA après l’intervention, soit un mouvement paradoxal du diaphragme ; ii) dysfonctionnement partiel du nerf phrénique : diminution de 25 à 75 % de l’excursion ZOA après l’intervention ; iii) modification mineure ou nulle de la fonction diaphragmatique : diminution de 0 à 25 % de l’excursion ZOA après l’intervention.

Figure 1 : Représentation du protocole d’évaluation qualitative de l’excursion globale du diaphragme. Notez l’illustration anatomique du diaphragme (ligne vert vif) recouvrant le foie (à gauche) et la rate (à droite). Pour visualiser le diaphragme à des fins d’évaluation qualitative, la sonde curviligne doit être placée sur la ligne axillaire médiane, le faisceau étant aligné avec le plan coronal du corps et le patient en position semi-allongée. Réimprimé avec la permission de masterthemachines.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Évaluation qualitative de l’excursion diaphragmatique. (A) Positionnement correct de la sonde avec le transducteur basse fréquence (curviligne ou réseau sectoriel) placé sur le flanc droit ou gauche au niveau de l’espace intercostal 5-7e , de la ligne axillaire médiane et de l’indicateur de sonde pointant vers le crâne. (B) Identification de l’hémidiaphragme droit en mode B lors de l’évaluation qualitative. Le diaphragme est visible sous la forme d’une bande hyperéchogène brillante recouvrant le foie. Pour une vue optimale, l’épine sous-diaphragmatique doit être visible. (C) Identification de l’hémidiaphragme gauche en mode B lors de l’évaluation qualitative. La rate est visible ici à la place du foie. Une fois que le diaphragme est initialement visualisé, le mouvement du diaphragme peut alors être observé pour évaluer la dysfonction hémidiaphragmatique macroscopique. Reportez-vous à la vidéo 1, à la vidéo 2, à la vidéo 3, à la vidéo 4, à la vidéo 5 et à la vidéo 6 pour des exemples d’excursion de diaphragme normale, anormale et indéterminée à droite et à gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Représentation du protocole d’évaluation quantitative de l’excursion ZOA. Notez l’illustration anatomique du diaphragme de fin d’expiration sous la forme d’une ligne bleu foncé et du diaphragme d’extrémité d’inspiration sous la forme d’une ligne bleu clair. Pour visualiser la ZOA pour l’évaluation quantitative, la sonde linéaire doit être placée sur la ligne axillaire médiane, le faisceau étant aligné perpendiculairement au torse et le patient en position semi-allongée. Réimprimé avec la permission de masterthemachines.com. Abréviation : ZOA = zone d’apposition. Veuillez cliquer ici pour voir une version agrandie de cette figure.
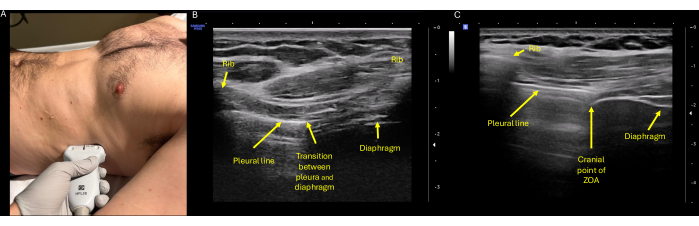
Figure 4 : Évaluation échographique de l’excursion ZOA. (A) Positionnement correct de la sonde à l’aide du transducteur haute fréquence (linéaire) placé sur le flanc droit ou gauche au niveau de la ligne axillaire médiane au niveau du huitième ou du neuvième espace intercostal, l’indicateur de sonde pointant les céphalades vers la tête du patient. (B) Identification de la ZOA, qui est définie comme la partie latérale du diaphragme qui se fixe à la cage thoracique. À l’échographie, il peut être identifié au point de transition du diaphragme et de la plèvre, représenté ici centré entre deux espaces thoraciques. (C) L’aspect le plus céphalique de la ZOA, correspondant à nouveau à l’espace intercalaire des côtes qui montre simultanément le poumon aéré et le diaphragme. Voici l’aspect caractéristique à trois couches du diaphragme, avec la plèvre pariétale hyperéchogène superficielle à l’extérieur, la couche musculaire anéchoïque moyenne et le péritoine hyperéchoïque profond. Abréviation : ZOA = zone d’apposition. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Marquage et mesure de l’excursion ZOA. (A) Une fois que la ZOA est identifiée après l’expiration complète d’une respiration de capacité vitale, une ligne perpendiculaire est tracée à partir du centre de la sonde pour marquer l’emplacement initial de la ZOA en fin d’expiration. (B) Une fois que les étapes sont répétées et que la ZOA est à nouveau identifiée après l’expiration d’une deuxième respiration de capacité vitale, une nouvelle ligne est tracée à partir du centre de la sonde. Il s’agit du deuxième emplacement identifié de la ZOA expiratoire en fin d’expiration. Par la suite, la distance entre les deux mesures est moyennée et la ligne moyenne est utilisée comme valeur finale de l’emplacement de fin d’expiration de la ZOA. Les mêmes étapes sont répétées pour obtenir les marques d’extrémité inspiratoire de la ZOA. Les marques de fin d’inspiration et de fin d’expiration peuvent être obtenues dans l’un ou l’autre ordre. (C) La distance entre les marques cutanées moyennes de fin d’expiration et de fin d’inspiration moyenne est mesurée en centimètres à l’aide d’une règle. Cette distance représente l’excursion diaphragmatique quantifiée. Abréviation : ZOA = zone d’apposition. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 6 : Manœuvre de la sonde pour surmonter l’ombrage des côtes. La sonde linéaire peut être tournée entre deux espaces de nervures pour l’identification de la ZOA dans le cas d’une nervure masquant l’emplacement de la ZOA. Abréviation : ZOA = zone d’apposition. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo 1 : Vue coronale obtenue avec un transducteur basse fréquence centré sur l’hémidiaphragme droit montrant une excursion diaphragmatique qualitativement normale pendant la respiration de la capacité vitale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 2 : Vue coronale obtenue avec un transducteur basse fréquence centré sur l’hémidiaphragme gauche montrant une excursion diaphragmatique qualitativement normale pendant la respiration de la capacité vitale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 3 : Vue coronale obtenue avec un transducteur basse fréquence centré sur l’hémidiaphragme droit montrant une absence grossière d’excursion diaphragmatique lors d’une tentative de respiration de la capacité vitale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 4 : Vue coronale obtenue avec un transducteur basse fréquence centré sur l’hémidiaphragme gauche montrant une absence flagrante d’excursion diaphragmatique lors d’une tentative de respiration de la capacité vitale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 5 : Vue coronale obtenue avec un transducteur basse fréquence centré sur l’hémidiaphragme droit montrant un niveau grossièrement sous-maximal (indéterminé) d’excursion diaphragmatique lors d’une tentative de respiration de capacité vitale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 6 : Vue coronale obtenue avec un transducteur basse fréquence centré sur l’hémidiaphragme gauche montrant un niveau grossièrement sous-maximal (indéterminé) d’excursion diaphragmatique lors d’une tentative de respiration de capacité vitale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 7 : Vue coronale obtenue avec un transducteur linéaire à haute fréquence montrant le mouvement normal de la partie la plus crânienne de la ZOA pendant la respiration des marées. Abréviation : ZOA = zone d’apposition. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 8 : Vue coronale obtenue avec un transducteur linéaire à haute fréquence montrant que le transducteur glisse caudale pour suivre le mouvement normal de la partie la plus crânienne de la ZOA pendant une respiration de capacité vitale. Abréviation : ZOA = zone d’apposition. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 9 : Vue coronale obtenue avec un transducteur linéaire à haute fréquence montrant comment, à la fin de l’inspiration, la partie la plus crânienne de la ZOA peut être cachée par une ombre de côte .Abréviation : ZOA = zone d’apposition. Veuillez cliquer ici pour télécharger cette vidéo.
Fichier supplémentaire 1 : Référence pour afficher les images fixes les plus importantes de chaque vidéo. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
POCUS offre des avantages évidents pour l’évaluation diaphragmatique, notamment la portabilité, le caractère non invasif et les capacités d’imagerie en temps réel. Ces forces peuvent être mises à profit avec ce protocole réalisable et accessible et peuvent être appliquées dans une variété de contextes cliniques. Ce protocole commence par une évaluation qualitative de l’excursion diaphragmatique pour répondre à la question de savoir si un dysfonctionnement hémi-diaphragmatique macroscopique est présent. Si la réponse n’est pas claire ou si des informations plus spécifiques sont nécessaires, la deuxième étape du protocole apporte des éclaircissements via une mesure quantitative de l’excursion de la ZOA. Ces mesures peuvent aider à la prise de décision clinique en utilisant la comparaison intra-sujet de la latéralité, avant et après l’intervention, ou l’évaluation de l’évolution au fil du temps.
Traditionnellement, l’évaluation diaphragmatique s’appuie sur des méthodes telles que la radiographie pulmonaire, la fluoroscopie, l’imagerie par tomodensitométrie, les études de conduction du nerf phrénique et les mesures de pression transdiaphragmatique. Bien que ces techniques fournissent des informations précieuses, elles sont souvent chronophages, coûteuses, manquent de portabilité et n’offrent parfois que l’imagerie statique2. L’échographie offre des avantages par rapport à ces lacunes. Notamment, il existe des approches ultrasonores avancées à l’horizon pour l’évaluation diaphragmatique qui impliquent l’imagerie bidimensionnelle de suivi du chatoiement et l’élastographie des ondes de cisaillement. Ces approches évaluent les propriétés mécaniques tissulaires du diaphragme et ont des preuves expérimentales à l’appui de leur validité3. Cependant, le suivi des taches et l’élastographie par ondes de cisaillement nécessitent des compétences et un équipement d’échographie avancés qui sont rarement disponibles pour le clinicien ordinaire.
Alternativement, de nombreux auteurs ont préconisé l’utilisation de POCUS quantitatifs pour évaluer la fonction diaphragmatique. Comme expliqué dans l’introduction, les deux techniques traditionnellement utilisées à cette fin sont la mesure de l’excursion DoD et l’épaississement diaphragmatique. Ces protocoles sont bien décrits et leur corrélation clinique continue d’être étudiée 3,6,13,21. Des protocoles simplifiant les méthodes d’évaluation de l’épaisseur du diaphragme et de la fraction d’épaississement chez les patients en bonne santé et gravement malades ont récemment été publiés, ce qui permet à ces protocoles d’être accessibles aux cliniciens ayant des connaissances de base en échographie21.
Au cours des dernières années, l’évaluation de la fonction diaphragmatique chez les patients gravement malades a attiré l’attention, car son rôle essentiel dans l’évaluation des résultats respiratoires est devenu de plus en plus évident. Les patients nécessitant une ventilation mécanique peuvent développer une atrophie de la désutilisation du diaphragme et une diminution de la force contractile, ce qui a été associé à une mortalité accrue 6,22. L’hypotrophie du diaphragme peut se manifester dès 24 h au début de la ventilation mécanique11. Ainsi, la reconnaissance précoce du dysfonctionnement musculaire du diaphragme avec des outils non invasifs tels que le POCUS est vitale. Une étude de Goligher et al. a montré que chez les patients sous ventilation mécanique, l’évaluation POCUS de l’épaisseur de l’hémidiaphragme droit peut être à la fois réalisable et reproductible23. Cependant, ils ont constaté que les mesures de l’épaisseur de l’hémidiaphragme gauche et de la fraction d’épaississement bilatéralement n’étaient pas reproductibles. L’épaississement diaphragmatique et l’excursion DoD sont limités par une faible fiabilité interopérateur et une dispersion de mesure 2,15,16.
De plus, il n’y a pas de consensus d’experts sur le mode d’échographie le mieux adapté pour mesurer l’épaisseur du diaphragme (mode B vs mode M) et sur le point du cycle respiratoire optimal pour effectuer la mesure18. En plus des défis de l’opérateur, les patients eux-mêmes peuvent également introduire des facteurs de confusion. Chez les patients gravement malades, il est crucial de tenir compte à la fois de la pathologie et de la physiologie du patient. Par exemple, les maladies chroniques telles que la bronchopneumopathie chronique obstructive, la maladie pulmonaire interstitielle ou les troubles neuromusculaires peuvent entraîner une diminution de la mobilité du diaphragme, tandis que les patients atteints d’insuffisance de santé congestive et de fibrose kystique peuvent avoir des diaphragmes anormalement épaissis 6,13. De plus, la ventilation à pression positive peut avoir un impact sur les mesures échographiques en entraînant une diminution de l’excursion du diaphragme et une réduction de l’épaississement18.
Il existe donc un besoin non satisfait d’un protocole d’acquisition d’images simple et reproductible pour l’échographie diaphragmatique qui puisse être effectué sur le lieu d’intervention. Pour répondre à ce besoin non satisfait, nous avons développé un protocole fondé sur des preuves qui permet de dépister la dysfonction diaphragmatique en deux étapes : d’abord qualitativement, puis, si nécessaire, quantitativement, la dernière étape étant réalisée à l’aide d’une méthode nouvellement validée de mesure de l’excursion de la partie la plus crânienne de la ZOA.
L’évaluation qualitative du mouvement du diaphragme est une technique bien établie qui a été rapportée dans la littérature dès les années 19703. L’évaluation qualitative en échographie en mode B ne nécessite aucun calcul et peut souvent fournir une réponse binaire (oui ou non à la question de savoir s’il y a une excursion diaphragmique grossièrement normale). Des variantes de l’approche qualitative ont été testées dans de multiples études et se sont avérées utiles pour évaluer l’asymétrie grossière de la fonction hémidiaphragmatique 2,3,5,6,13,18,23.
Dans les cas où un premier dépistage qualitatif fournit des données non concluantes sur la fonction de chaque hémidiaphragme, le protocole que nous proposons passe à une approche quantitative récemment validée : la mesure de l’excursion de la partie la plus crânienne de la ZOA. Cette technique a été décrite pour la première fois en 2017 par El-Boghdadly, puis utilisée par Kim et al. en 2019 pour dépister le dysfonctionnement diaphragmatique après des blocs nerveux supérieurs du tronc19,20. Plus récemment, cette technique a été testée et validée en 2023 : Da Conceicao et al. ont comparé cette nouvelle méthode à la mesure de l’excursion DoD et de la fraction d’épaississement diaphragmatique chez 75 patients17. Les auteurs ont constaté que la mesure de l’excursion de la partie la plus crânienne de l’excursion ZOA avait un succès significativement plus élevé dans la mesure de l’excursion des deux hémidiaphragmes par rapport à la méthode DoD. La méthode ZOA a eu un taux de réussite de 100 % bilatéralement alors que la méthode DoD n’a pu mesurer l’excursion diaphragmatique que 98,7 % à droite et 35 % du temps à gauche. Bien que la méthode de la fraction d’épaississement ait démontré un succès de 100 % dans la mesure des deux diaphragmes, les valeurs des fractions d’épaississement gauche et droite générées par cette méthode n’étaient pas corrélées chez les patients ni corrélées aux mesures d’excursion obtenues à l’aide des méthodes DoD et ZOA. Pour la méthode de la fraction d’épaississement, ce manque de corrélation à la fois avec d’autres méthodes d’évaluation de la fonction diaphragmatique et entre les hémidiaphragmes gauche et droit chez les sujets, soulève des inquiétudes quant à la validité globale de cette méthode en tant qu’outil de diagnostic.
Étant donné que la méthode d’excursion ZOA reste nouvelle et peu familière à la plupart des fournisseurs, certaines suggestions de dépannage peuvent aider à augmenter les chances de succès. Tout d’abord, il est essentiel d’utiliser une approche systématique, telle que décrite dans ce protocole. Deuxièmement, étant donné que l’identification initiale de la ZOA peut être difficile, il est important de s’assurer que la sonde est correctement positionnée et d’identifier les points de repère anatomiques connus. La sonde doit se trouver entre la ligne axillaire antérieure et la ligne axillaire médiane, et les espaces thoraciques doivent être centrés sur l’écran. La ZOA peut être identifiée par son aspect caractéristique à trois couches et se trouve généralement à une profondeur de 1,5 à 3 cm (en fonction de l’IMC du patient) et se trouve souvent en dessous de l’angle costophrénique avec l’inhalation 2,16. Si la ZOA n’est pas identifiée, deux possibilités sont qu’elle soit cachée derrière une ombre de côte (Vidéo 9) ou qu’elle soit continuellement obscurcie par le poumon qui se déplace dans le champ19. La première possibilité peut être résolue en tournant la sonde obliquement pour l’aligner avec les espaces intercostaux entre les nervures (Figure 6). La deuxième possibilité peut être abordée en glissant vers un espace intercostal plus caudal.
Malgré ses nombreux avantages, ce protocole POCUS diaphragmatique présente plusieurs limites. Tout d’abord, le protocole exige la visualisation de la partie la plus crânienne de la ZOA, ce qui peut ne pas être possible en présence d’emphysème sous-cutané diffus, de pansements, de drains, de tubes ou de liants. Deuxièmement, à ce jour, la méthode d’excursion ZOA n’a été testée par rapport à d’autres approches que dans le cadre d’une seule étude15. Bien que cette seule étude ait démontré la supériorité relative de l’excursion ZOA par rapport à deux approches quantitatives traditionnelles du POCUS diaphragmatique, la méthode ZOA n’a pas été testée par rapport à un étalon-or tel que l’évaluation fluoroscopique de la fonction diaphragmatique. Une telle comparaison avec un étalon-or est nécessaire pour mieux définir les valeurs normales et anormales pour l’approche d’excursion ZOA. De plus, compte tenu de sa nouveauté, ce protocole n’a pas encore été corrélé avec les résultats cliniques. Cependant, jusqu’à ce que les valeurs normatives de la méthode ZOA soient fermement établies, cette technique peut encore être utile pour quantifier l’étendue de l’asymétrie de la fonction hémidiaphragmatique dans une variété de situations cliniques où l’évaluation qualitative seule est indéterminée. Troisièmement, cette évaluation fournit des informations généralisées sur la fonction du diaphragme, mais n’a pas la spécificité nécessaire pour fournir des informations sur des états pathologiques tels que la fibrose ou des mesures précises de la contractilité. Enfin, un niveau de base de connaissances en POCUS est nécessaire pour pouvoir appliquer avec succès ce protocole dans la pratique clinique. Cependant, ces méthodes s’avèrent plus simples que les mesures POCUS précédentes du dysfonctionnement du diaphragme (excursion DoD et épaississement diaphragmatique) car elles nécessitent moins de mesures et moins de familiarité avec la knobologie. De plus, la maîtrise de cette méthode peut être rapidement atteinte avec de la formation. En suivant le protocole décrit et les stratégies de dépannage, l’évaluation reproductible du diaphragme peut devenir réalisable pour le clinicien moyen à l’aide d’un simple équipement à ultrasons disponible sur le lieu de soins.
Déclarations de divulgation
Nous n’avons aucune divulgation pertinente ou conflit d’intérêts.
Remerciements
Merci au Dr Fintan Hughes pour son aide en matière de photographie.
matériels
| Name | Company | Catalog Number | Comments |
| Medical Ruler | MediChoice | NA | We used Medichoice as that is what is readily available at our institution and it comes with the skin marker, however any medical ruler will work. The majority of skin markers come with a type of ruler or measurement system, but if not a separate ruler can be used. |
| Skin Marker | MediChoice | NA | We again used Medichoice as that is what is readily available at our institution and it comes with the ruler, however any standard skin marker will work. |
| Ultrasound Gel | Aquasonic | NA | Any standard gel will work. Sterile packs are not necessary but can be used on a case-by-case basis at the providers discretion. |
| Ultrasound Machine | Samsung and GE | NA | Any standard portable ultrasound machine will suffice. |
Références
- Bronshteyn, Y. S., Blitz, J., Hashmi, N., Krishnan, S. Logistics of perioperative diagnostic point-of-care ultrasound: Nomenclature, scope of practice, training, credentialing/privileging, and billing. Int Anesthesiol Clin. 60 (3), 1-7 (2022).
- Osman Elew, A. N. E., Abd Alrahman, A. A. H., El Khayat, H. M. H. Diaphragmatic ultrasound: Review article. The Egyptian Journal of Hospital Medicine. 87 (1), 1006-1009 (2022).
- Boussuges, A., Rives, S., Finance, J., Bregeon, F. Assessment of diaphragmatic function by ultrasonography: Current approach and perspectives. World J Clin Cases. 8 (12), 2408-2424 (2020).
- Volpicelli, G., et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med. 38 (4), 577-591 (2012).
- Saad, M., et al. Ultrasonographic assessment of diaphragmatic function and its clinical application in the management of patients with acute respiratory failure. Diagnostics (Basel). 13 (3), 411 (2023).
- Santana, P. V., Cardenas, L. Z., Albuquerque, A. L. P. Diaphragm ultrasound in critically ill patients on mechanical ventilation-evolving concepts. Diagnostics (Basel). 13 (6), 1116 (2023).
- Petrof, B. J. Diaphragm weakness in the critically ill: Basic mechanisms reveal therapeutic opportunities. Chest. 154 (6), 1395-1403 (2018).
- Chu, S. E., et al. Point-of-care application of diaphragmatic ultrasonography in the emergency department for the prediction of development of respiratory failure in community-acquired pneumonia: A pilot study. Front Med. 9, 960847 (2022).
- Suttapanit, K., Wongkrasunt, S., Savatmongkorngul, S., Supatanakij, P. Ultrasonographic evaluation of the diaphragm in critically ill patients to predict invasive mechanical ventilation. J Intensive Care. 11 (1), 40 (2023).
- Vivier, E., et al. Diaphragm ultrasonography to estimate the work of breathing during non-invasive ventilation. Intensive Care Med. 38 (5), 796-803 (2012).
- Eduardo Garrido-Aguirre, S. a. N. S. Diaphragmatic ultrasonography, a novel approach in critical care. Ultrasound Q. 36, 54-58 (2020).
- Sferrazza Papa, G. F., et al. A review of the ultrasound assessment of diaphragmatic function in clinical practice. Respiration. 91 (5), 403-411 (2016).
- Santana, P. V., Cardenas, L. Z., Albuquerque, A. L. P., Carvalho, C. R. R., Caruso, P. Diaphragmatic ultrasound: A review of its methodological aspects and clinical uses. J Bras Pneumol. 46 (6), e20200064 (2020).
- Qian, Z., Yang, M., Li, L., Chen, Y. Ultrasound assessment of diaphragmatic dysfunction as a predictor of weaning outcome from mechanical ventilation: A systematic review and meta-analysis. BMJ Open. 8 (9), e021189 (2018).
- Kharma, N. Dysfunction of the diaphragm: Imaging as a diagnostic tool. Curr Opin Pulm Med. 19 (4), 394-398 (2013).
- Tsui, J. J., Tsui, B. C. A novel systematic abc approach to diaphragmatic evaluation (abcde). Can J Anaesth. 63 (5), 636-637 (2016).
- Da Conceicao, D., et al. Validation of a novel point-of-care ultrasound method to assess diaphragmatic excursion. Reg Anesth Pain Med. 49 (11), 800-804 (2023).
- Haaksma, M. E., et al. EXpert consensus on diaphragm ultrasonography in the critically ill (EXODUS): A delphi consensus statement on the measurement of diaphragm ultrasound-derived parameters in a critical care setting. Crit Care. 26 (1), 99 (2022).
- El-Boghdadly, K., Goffi, A., Chan, V. Point of care diaphragmatic ultrasound made easy. Can J Anaesth. 64 (3), 327-328 (2017).
- Kim, D. H., et al. Superior trunk block: A phrenic-sparing alternative to the interscalene block: A randomized controlled trial. Anesthesiology. 131 (3), 521-533 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431 (2023).
- Goligher, E. C., et al. Measuring diaphragm thickness with ultrasound in mechanically ventilated patients: feasibility, reproducibility and validity. Intensive Care Med. 41 (4), 642-649 (2015).
- Pereira, R. O. L., et al. Point-of-care lung ultrasound in adults: Image acquisition. J Vis Exp. (193), e64722 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon