Method Article
Полная лапароскопическая радикальная резекция перихилярной холангиокарциномы типа IIIb
В этой статье
Резюме
Перихилярная холангиокарцинома (pCCA) является высокозлокачественной и агрессивной опухолью, единственным доступным методом лечения которой является радикальная резекция. Благодаря постоянному совершенствованию лапароскопических техник и инструментов, лапароскопическая радикальная хирургия при pCCA в настоящее время считается технически безопасной и осуществимой. Однако в связи с высокой сложностью операции и отсутствием доказательной клинической поддержки лапароскопическая радикальная хирургия при pCCA III типа выполняется только в нескольких крупных гепатобилиарных центрах. В современных рекомендациях рекомендуется левая гемигепатэктомия в сочетании с тотальной хвостатой лобэктомией и стандартизированной лимфаденэктомией при резектабельной pCCA III типа. Поэтому в данной статье мы подробно описываем хирургические этапы и технические моменты полной лапароскопической левой гемигепатэктомии в сочетании с тотальной хвостатой лобэктомией, регионарной лимфаденэктомией и анастомозом по Ру у пациентов с pCCA типа IIIb с использованием технологии флуоресцентной навигации для повышения хирургической точности и безопасности. Придерживаясь стандартизированных хирургических процедур и точных интраоперационных техник, мы предлагаем эффективные средства для улучшения результатов лечения пациентов.
Аннотация
Перихилярная холангиокарцинома (pCCA) является высокозлокачественной и агрессивной опухолью, единственным доступным методом лечения которой является радикальная резекция. Благодаря постоянному совершенствованию лапароскопических техник и инструментов, лапароскопическая радикальная хирургия при pCCA в настоящее время считается технически безопасной и осуществимой. Однако в связи с высокой сложностью операции и отсутствием доказательной клинической поддержки лапароскопическая радикальная хирургия при pCCA III типа выполняется только в нескольких крупных гепатобилиарных центрах. В современных рекомендациях рекомендуется левая гемигепатэктомия в сочетании с тотальной хвостатой лобэктомией и стандартизированной лимфаденэктомией при резектабельной pCCA III типа. Поэтому в данной статье мы подробно описываем хирургические этапы и технические моменты полной лапароскопической левой гемигепатэктомии в сочетании с тотальной хвостатой лобэктомией, регионарной лимфаденэктомией и анастомозом по Ру у пациентов с pCCA типа IIIb с использованием технологии флуоресцентной навигации для повышения хирургической точности и безопасности. Придерживаясь стандартизированных хирургических процедур и точных интраоперационных техник, мы предлагаем эффективные средства для улучшения результатов лечения пациентов.
Введение
Перихилярная холангиокарцинома (pCCA), также известная как опухоль Клатскина, была впервые описана Джеральдом Клатскином и представляет собой злокачественную опухоль, возникающую в эпителии желчных протоков в месте слияния правого и левого печеночных протоков1. Это заболевание является высокозлокачественным и агрессивным, часто проявляется желтухой и холангитом на поздних стадиях. Несмотря на достижения в диагностике и лечении, прогноз для pCCA остается плохим, при этом радикальная хирургическая резекция по-прежнему остается единственным потенциально излечивающим подходом. Такие операции обычно включают обширную гепатэктомию, резекцию желчных протоков и регионарную лимфаденэктомию2. Целью хирургического вмешательства является достижение резекции R0, которая значительно улучшает показатели выживаемости пациента 3,4. Тем не менее, сложная анатомия прикорневой области и близость опухоли к жизненно важным сосудистым структурам делают эти операции очень сложными.
В последние годы появление лапароскопических технологий произвело революцию в хирургической онкологии, предложив потенциальные преимущества, такие как снижение периоперационных осложнений, более короткое пребывание в больнице и болеебыстрое восстановление. Тем не менее, применение лапароскопической хирургии при pCCA, особенно в случаях типа IIIb, остается ограниченным, имеется лишь несколько сообщений 3,8. В первую очередь это связано с техническими трудностями в достижении адекватных краев и выполнении сложных лапароскопических реконструкций желчных и сосудистых путей9. В современных рекомендациях рекомендуется левая гемигепатэктомия в сочетании с тотальной хвостатой лобэктомией и стандартизированной лимфаденэктомией при резектабельном pCCA III типа 4,10,11,12. Тем не менее, доказательства, подтверждающие использование лапароскопических методов для этой обширной операции, все еще накапливаются.
В данном исследовании представлена полная лапароскопическая радикальная резекция pCCA типа IIIb. Мы стремимся подробно описать методы и ключевые этапы этой операции, включая левую гемигепатэктомию, тотальную хвостатую лобэктомию, регионарную лимфаденэктомию и гепатикоеюностомию по Ру. Делясь этим протоколом, мы надеемся внести свой вклад в доказательства, подтверждающие осуществимость и безопасность лапароскопических методов в лечении pCCA типа IIIb, что в конечном итоге улучшит результаты лечения пациентов.
протокол
Исследование проводится комитетом по этике исследований человека Второй аффилированной больницы Наньчанского университета. Перед операцией от пациента было получено письменное информированное согласие.
ПРИМЕЧАНИЕ: Пациентом был 65-летний мужчина с основной жалобой на «генерализованную желтуху и зуд в течение 2 недель». Компьютерная томография (КТ) в больнице за пределами больницы выявила образование перихилярного желчного протока с расширением внутрипеченочного желчного протока. Используемые хирургические инструменты и оборудование перечислены в Таблице материалов.
1. Предоперационная подготовка
- Перед операцией выполните рутинные анализы крови, включая общий анализ крови, функциональные пробы печени и почек, профиль свертываемости крови и сывороточные онкомаркеры.
- Возьмите образцы крови, отправьте их в лабораторию для различных анализов крови и сообщите о результатах.
ПРИМЕЧАНИЕ: Функциональные пробы печени показали повышенный уровень общего билирубина (230,8 мкмоль/л) и снижение альбумина (35,7 г/л). Анализы на сывороточные онкомаркеры показали повышенный уровень углеводного антигена углеводного антигена 199 (184,46 Ед/мл)4,12.
- Возьмите образцы крови, отправьте их в лабораторию для различных анализов крови и сообщите о результатах.
- Выполнение предоперационной электрокардиограммы (ЭКГ), КТ брюшной полости, магнитно-резонансной томографии (МРТ) брюшной полости, КТ органов грудной клетки и других соответствующих исследований 4,12.
ПРИМЕЧАНИЕ: В данном исследовании пациенту была проведена компьютерная томография брюшной полости с контрастом и без него в отделении радиологии. Сканирование показало образование в перихилярной области без вовлечения окружающих сосудов, что указывает на холангиокарциному с обструкцией (Рисунок 1). МРТ с контрастированием и магнитно-резонансной холангиопанкреатографией и без него показала образование в перихилярном желчном протоке и прилегающей паренхиме печени с расширением внутрипеченочных желчных протоков и увеличенными перихилярными лимфатическими узлами, что указывает на опухолевое поражение (рис. 1).
2. Хирургическое вмешательство
- Проводит общую анестезию с интубацией трахеи, внутривенными и ингаляционными средствами. Расположите пациента на спине, голову приподнято и ноги расставлены. Проведите плановую дезинфекцию с использованием раствора повидон-йода.
ПРИМЕЧАНИЕ: Основной хирург стоит с правой стороны пациента, ассистент — с левой, а держатель камеры находится между ног пациента (Рисунок 2). - Сделайте продольный разрез примерно на 1 см в области пупка, введите иглу Вересса и вдохните CO2 для поддержания внутрибрюшного давления 12 мм рт.ст. Вставьте троакар 10 мм и лапароскоп 30° . После подтверждения отсутствия отдаленных метастазов с помощью лапароскопии установите хирургические троакары, как показано на рисунке 2.
- Рассеките пузырную артерию и пузырный проток, затем приступайте к ретроградному удалению желчного пузыря. Используйте ультразвуковой скальпель для рассечения, мобилизации и подвешивания общей печеночной артерии (CHA), гастродуоденальной артерии (GDA), собственно печеночной артерии (PHA) и левых печеночных артерий (LHA) (выходящих за среднюю печеночную артерию (MHA)) и правой печеночной артерии (RHA). Перевязать и разделить правые желудочные артерии (РГА) и ЛГК (Рисунок 3).
- Пересеките общий желчный проток (КБД) на верхней границе поджелудочной железы и отправьте дистальный край для патологии замороженного среза для подтверждения отрицательных краев.
- Используйте ультразвуковой скальпель для рассечения, мобилизации и подвешивания воротной вены (ПВ). Удалите внепеченочный желчный проток и группы лимфатических узлов 8, 12 и 13 блоком вдоль ЛВ по направлению к воротам печени, достигая скелетизации гепатодуоденальной связки.
- Перевязать и разделить левую ветвь воротной вены (LPV) и хвостатую долевую ветвь воротной вены.
- Рассекают левую печеночную связку и разделяют короткие печеночные вены хвостатой доли, четко очерчивая линию демаркации (ишемическую линию) между правой и левой долями печени.
- После разметки демаркационной линии подтвердите, что граница флуоресценции совпала с ишемической линией с помощью флуоресцентной визуализации (Рисунок 4 и Рисунок 5).
ПРИМЕЧАНИЕ: Здесь используется метод негативного окрашивания, при котором индоцианин зеленый вводится через периферическое внутривенное введение в дозе 0,25 мг13,14.
- Периодически окклюзируйте основную ФВ с помощью маневра Pringle15. С помощью ультразвукового скальпеля пересеките паренхиму печени вдоль демаркационной линии, затем вдоль плоскости средней печеночной вены (MHV), обеспечивая разделение ее ветвей V4b и V4a.
Пациенты с положительным краем печени могут рассмотреть возможность проведения расширенной левой гепатэктомии (ЛГ), которая включает в себя полную резекцию основного ствола MHV и левых частей сегментов 5 и 8. Такой подход может улучшить показатели выживаемости16. - Пересеките правый печеночный проток примерно в 1 см от опухоли и отправьте проксимальный край для патологии замороженного среза для подтверждения отрицательных краев.
- Выполняйте анализ интраоперационного замороженного среза проксимального края печеночного протока несколько раз по мере необходимости, чтобы обеспечить резекцию R0. Если правый печеночный проток широко разделен, рассмотрите возможность реконструкции желчных протоков или двойной гепатикоеюностомии правого переднего и правого заднего желчных протоков.
- Пересеките левую печеночную вену (LHV) с помощью эндоскопического линейного режущего степлера (ENDO-GIA). Полностью иссеките левый гемиливер и всю хвостатую долю и поместите образец в сумку для извлечения (Рисунок 6).
- Пересеките тощую кишку примерно на 20 см дистальнее связки Трейца. Приподнимите дистальную петлю сзади к толстой кишке для анастомоза «конец в бок» с правым печеночным протоком, используя непрерывные швы для передней и задней стенок (рис. 7). Выполнить боковую еюногуюностомию примерно на 45 см дистальнее правого печеночного протока – тощий анастомоз.
- Орошайте брюшную полость стерильной дистиллированной водой. Внимательно осмотрите операционное поле на предмет активного кровотечения, утечки желчи и травм боковых ветвей желудочно-кишечного тракта. Поместите дренажные трубки в левую часть печени и отверстие Уинслоу.
- Удлините пупочный разрез примерно на 5 см и рассекайте брюшную стенку слой за слоем, чтобы извлечь образец. Проверьте количество хирургических инструментов и марли. Снимите троакары под прямым обзором. Закройте разрез брюшной стенки прерывистыми 2-0 рассасывающимися швами, чтобы завершить операцию.
3. Послеоперационный уход
- Безопасно транспортируйте пациента обратно в палату после того, как он придет в сознание.
- Внутривенное введение антибиотиков, омепразола и нутритивной поддержки после операции.
- Начните пить жидкую диету на третий послеоперационный день после того, как у пациента выйдут газы.
- Удаляют брюшные дренажные трубки на4-е и13-е сутки после операции.
Результаты
Операция протекала гладко, и патология интраоперационного замороженного сечения показала отрицательные края как в дистальном, так и в проксимальном отделе желчных протоков. На протяжении всей процедуры жизненные показатели пациента оставались стабильными, а анестезия была эффективной. Продолжительность операции составила 360 мин, при этом время окклюзии ЛВ составило 60 мин (15 мин + 5 мин × 4 раза). Интраоперационная кровопотеря составила 400 мл, пациент получал 2 единицы лейкоцитарных перитроцитов и 600 мл свежезамороженной плазмы. Послеоперационный метеоризм наблюдался через 72 ч после операции. Осложнений, таких как кровотечение из брюшной полости, подтекание желчи, инфекция брюшной полости или инфекция разреза, не было. Послеоперационное пребывание в стационаре составило 14 дней. Послеоперационный гистопатологический анализ с парафином показал умеренно дифференцированную билиарную аденокарциному, вовлекающую прилегающую ткань печени, без определенной сосудистой инвазии и с отрицательными краями печени. Шестнадцать лимфатических узлов были удалены, метастазирование не обнаружено. Опухоль была стадирована как pT2bN0M0, стадия II (табл. 1). Компьютерная томография через 1 месяц после операции показала успешную резекцию опухоли без явного рецидива или метастазирования (Рисунок 8).
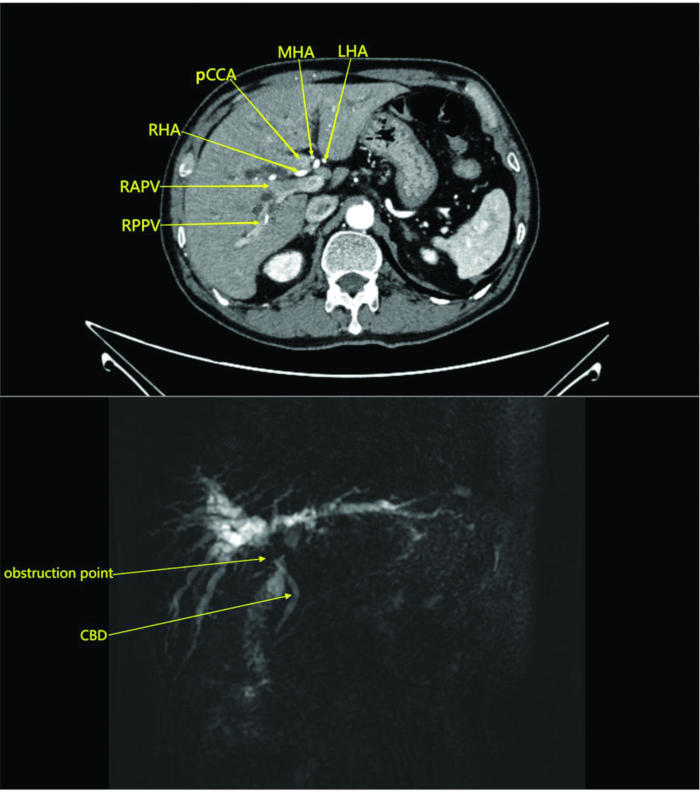
Рисунок 1: Компьютерная томография брюшной полости и изображения артериальной фазы пациента с контрастированием. На изображениях видно образование в воротах печени без инвазии окружающих кровеносных сосудов, что указывает на холангиокарциному с обструкцией. Сокращения: RAPV: правая передняя ветвь воротной вены; RPPV: правая задняя ветвь воротной вены; КБД: общий желчный проток; РГА: правая печеночная артерия; pCCA: Перихилярная холангиокарцинома; MHA: средняя печеночная артерия; LHA: левая печеночная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Положение хирурга и размещение троакара. Хирург стоит, как показано на рисунке, а троакары помещаются в брюшную полость в положениях, указанных на изображении. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
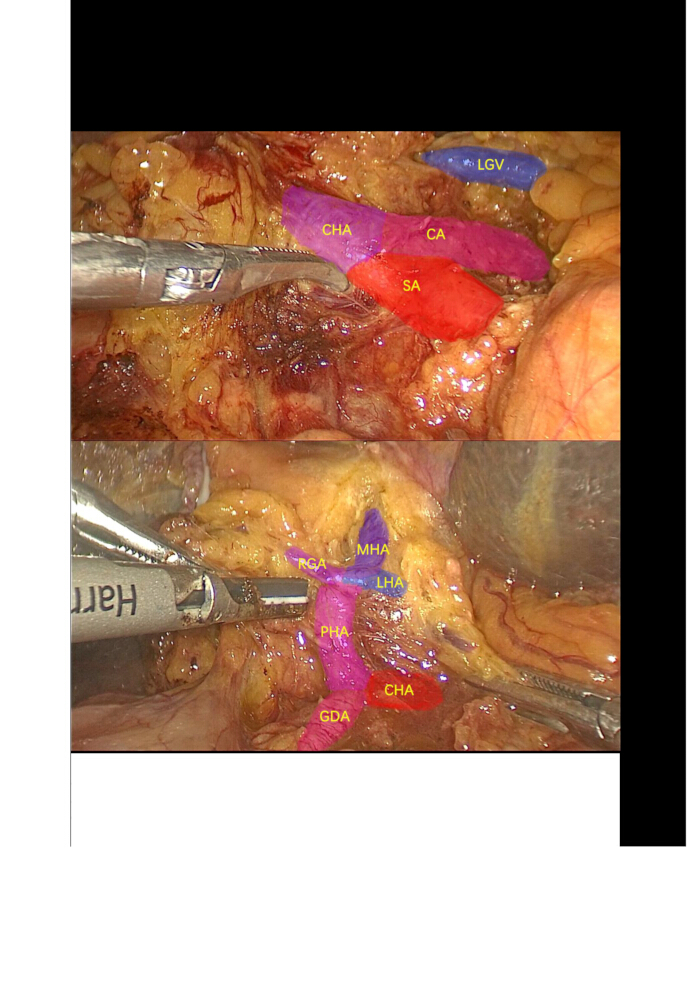
Рисунок 3: Диссекция лимфатических узлов. Рассечение и изоляция чревной артерии, селезеночной артерии, общей печеночной артерии, гастродуоденальной артерии, собственно печеночной артерии, правой желудочной артерии, левой печеночной артерии, средней печеночной артерии и окружающих лимфатических узлов. Сокращения: CA: целиакическая артерия; SA: Селезеночная артерия; LGV: Левая желудочная вена; CHA: общая печеночная артерия; GDA: гастродуоденальная артерия; PHA: собственная печеночная артерия; LHA: левая печеночная артерия; MHA: средняя печеночная артерия; РГА: правые желудочные артерии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Рассечение хвостатой доли. Хвостатую долю рассекали вдоль нижней полой вены (НПВ) от каудального к краниальному направлению и с левой стороны на правую. При достижении правой стороны НПВ левая печень была поднята, обнажив НПВ, паракавальную ветвь, отросток и долю Шпигеля слева направо. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
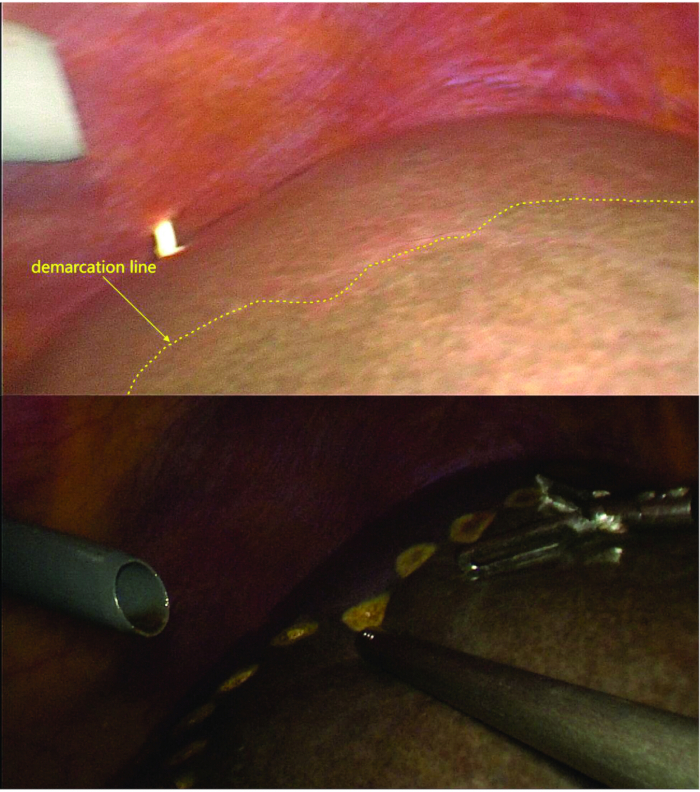
Рисунок 5: Обозначение линии разграничения. После лигирования и пересечения ветви LPV, хвостатой доли воротной ветви вены и коротких печеночных вен видна демаркационная линия между левым и правым полушариями. При рентгеноскопии наблюдаемая демаркационная линия совпадает с ишемизированной линией. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
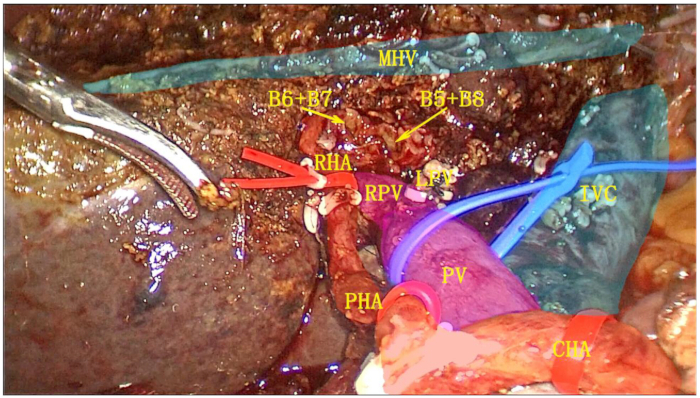
Рисунок 6: Послеоперационная поверхность разреза после левой гемигепатэктомии в сочетании с полной резекцией хвостатой доли. Желчный пузырь, гепатодуоденальная связка, левая полукровная печень и полная хвостатая доля были резецированы как единое целое. Сокращения: ДПВ: правая ветвь воротной вены; IVS: нижняя полая вена; MHV: средняя печеночная вена; РГА: правая печеночная артерия; PV: воротная вена; PHA: собственная печеночная артерия; CHA: общая печеночная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Послеоперационный вид резекции pCCA. MHV полностью обнажена, а задняя и передняя стенки правого печеночного протока анастомозированы до тощей кишки непрерывным образом. Сокращения: MHV: средняя печеночная вена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
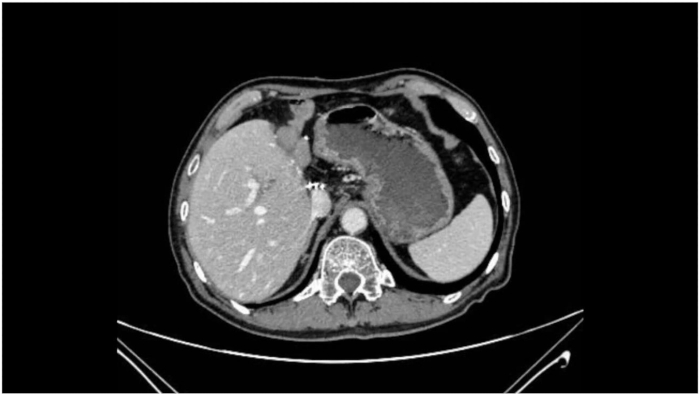
Рисунок 8: Послеоперационная компьютерная томография. Послеоперационная компьютерная томография демонстрирует успешную резекцию опухоли без явных рецидивов и метастазов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Время работы (мин) | 360 |
| Интраоперационная кровопотеря (мл) | 400 |
| Интраоперационное переливание крови (мл) | 1000 |
| Время окклюзии ПВ (мин) | 60 |
| Первый метеоризм (ч) | 72 |
| Первая послеоперационная лечебная лечебная диета (дней) | 3 |
| Послеоперационное пребывание в стационаре (дней) | 14 |
| Послеоперационные осложнения (да/нет) | Нет |
| Кровотечение (да/нет) | Нет |
| Подтекание желчи (да/нет) | Нет |
| Инфекция брюшной полости (да/нет) | Нет |
| Инфекция через разрез (да/нет) | Нет |
| Патологический результат | Аденокарцинома желчевыводящих путей |
| Дифференциация | Умеренный |
| Сцена TNM | пТ2бН0М0 |
| Этап AJCC | Глава II |
Таблица 1: Результаты хирургического вмешательства пациента.
Обсуждение
pCCA является распространенной злокачественной опухолью желчных протоков, при этом радикальная хирургическая резекция является единственным потенциальным лечением2. Традиционная радикальная хирургия при pCCA обычно требует разреза брюшной полости на 20–30 см, что приводит к значительной хирургической травме. Большие разрезы часто вызывают значительную послеоперационную боль, что влияет на комфорт пациента и восстановление, тем самым продлевая пребывание в больнице 5,6,7. За исключением некоторых видов pCCA I типа, при которых может быть проведена локальная резекция желчных протоков и желчно-кишечный анастомоз, другие типы требуют резекции печени, включая полную резекцию хвостатой доли11. Тем не менее, поле зрения в открытой хирургии в основном зависит от прямой визуализации хирургом, которая ограничена, особенно при работе с глубокими структурами. В отличие от этого, лапароскопическая технология обеспечивает прямую визуализацию с увеличением и переменными углами, облегчая идентификацию анатомических структур и обеспечивая более точные и безопасные операции. Кроме того, лапароскопическая технология позволяет проводить минимально инвазивные исследования, потенциально избегая ненужных лапаротомий у пациентов со скрытыми метастазами pCCA17.
Исследования показали, что лапароскопия при операциях на печени и желчевыводящих путях имеет потенциальные преимущества, такие как уменьшение периоперационных осложнений, более короткое пребывание в больнице и более быстрое восстановление18,19. С непрерывным развитием лапароскопических технологий и инструментов, лапароскопическая радикальная хирургия при pCCA постепенно внедряется в клиническую практику. В 2011 году Hong Yu et al. впервые сообщили о лапароскопической радикальной хирургии в 14 случаяхpCCA I и II типа. В 2020 году Ratti et al.21представили первые доказательства сопоставимости между открытой и минимально инвазивной хирургией (MIS) с помощью анализа сопоставления баллов склонности. В этом хорошо проведенном исследовании были продемонстрированы схожие результаты между открытыми и лапароскопическими операциями21. За последнее десятилетие поступали сообщения о лапароскопической радикальной хирургии при pCCA, но большинство из них являются ретроспективными исследованиями с недостаточными доказательствами. В современных рекомендациях рекомендуется лапароскопическое исследование и биопсия для некоторых pCCA17. Исследования не показали существенных различий в частоте резекции R0, общей выживаемости (ОВ), безрецидивной выживаемости (СДС) и осложнениях между открытой и лапароскопической радикальной хирургией при pCCA 22,23,24. Кроме того, внедрение технологии лапароскопической флуоресцентной визуализации еще больше повысило точность и безопасность операций. В этой технологии используются флуоресцентные красители, которые специально распределены в тканях, обеспечивая визуализацию в режиме реального времени с помощью системы флуоресцентных камер. Это помогает хирургам более четко различать границы между опухолевыми и нормальными тканями25,26. При анатомической резекции печени технология флуоресцентной визуализации помогает хирургам более точно очерчивать границы сегментов резекции печени. Он демонстрирует более высокую частоту выявления поверхностных поражений печени по сравнению с обычной визуализацией, тем самым увеличивая тщательность резекции и частоту резекции R0, что в конечном итоге повышает онкологическую радикальность операции27,28. Однако у пациентов с циррозом печени частота ложноположительных результатов выше, и может произойти окрашивание флуоресцентной границы. По мере того, как гепатобилиарные хирурги продолжают изучать и накапливать опыт в этой области, осуществимость и безопасность этого хирургического подхода были дополнительно подтверждены.
Традиционная радикальная хирургия pCCA типа IIIb включает левую гемигепатэктомию в сочетании с полной резекцией хвостатой доли и стандартизированной диссекцией лимфатических узлов. Подход обычно делится на левый и правосторонний. Левосторонний подход сначала включает в себя рассечение лимфатических узлов, прилегающих к общей печеночной артерии, за которыми следуют лимфатические узлы в гепатодуоденальной связке и заднем крае поджелудочной железы. Правосторонний подход начинается с лимфатических узлов на заднем крае поджелудочной железы, затем следуют лимфатические узлы гепатодуоденальной связки и лимфатические узлы, прилегающие к общей печеночной артерии. Последовательность диссекции может быть адаптирована к особенностям лапароскопической хирургии и привычкам хирурга, выбирая подходящую и стандартизированную последовательность диссекции регионарных лимфатических узлов и нервных сплетений на основе интраоперационных анатомических структур.
У этого пациента предоперационная визуализация не выявила каких-либо признаков метастазирования в лимфатические узлы. Поэтому мы приняли традиционный левосторонний подход, последовательно рассекая лимфатические узлы, прилегающие к общей печеночной артерии, гепатодуоденальной связке и заднему краю поджелудочной железы от каудальной стороны к краниальной. Дистальный край желчного протока был иссечен и направлен на интраоперационную патологию замороженного сечения, которая подтвердила отрицательные края. Затем мы выполнили левую гемигепатэктомию в сочетании с полной резекцией хвостатой доли и иссекли проксимальный край желчного протока, который также показал отрицательные края при патологии интраоперационного замороженного среза, достигнув резекции R0.
Исследования показали, что пациенты с pCCA, достигшие резекции R0, имеют значительно лучшие OS и DFS по сравнению с пациентами с резекцией R1. Современные рекомендации также указывают на то, что достижение резекции R0 с помощью сегментарной гепатэктомии в сочетании с полной резекцией хвостатой доли и стандартизированной диссекцией лимфатических узлов имеет решающее значение. Тем не менее, из-за технических трудностей и недостаточных доказательств, только несколько крупных гепатобилиарных центров в настоящее время выполняют лапароскопические радикальные операции по поводу pCCA, причем большинство сообщений поступает из восточныхстран22. Кроме того, на ранних стадиях разработки этой технологии требуется более длительное время работы и крутая кривая обучения, что является ограничениями этого метода. В настоящее время нет исследований, указывающих на необходимое время и количество операций для того, чтобы хирурги освоили эту сложную процедуру. Единственное руководство исходит от Экспертной группы по операционным нормам лапароскопической радикальной резекции перихилярной холангиокарциномы в Китае, которая предполагает, что кривая обучения для выполнения лапароскопической резекции печени и лапароскопической панкреатодуоденальной резекции должна включать более 50 случаев каждый. Существующих данных все еще недостаточно для демонстрации превосходства одного метода над другим или для сравнения результатов с открытыми методами. Поэтому мы рекомендуем специализированной команде малоинвазивных хирургов крупных гепатобилиарных центров, преодолев кривую обучения, избирательно выбирать подходящие случаи (без противопоказаний для стандартной лапароскопической или открытой радикальной резекции pCCA, а также без инвазии в воротную вену или печеночную артерию). Хирурги должны сначала попробовать лапароскопические радикальные операции при pCCA типа I и типа II, прежде чем переходить к лапароскопическим процедурам типа IIIb. Такой подход поможет обеспечить безопасные послеоперационные исходы, достаточную резекцию опухоли, а также надлежащую идентификацию и лечение потенциальных осложнений.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта статья была подготовлена при финансовой поддержке Национального фонда естественных наук Китая (82060454), ключевой программы исследований и разработок провинции Цзянси в Китае (20203BBGL73143) и проекта по подготовке высококвалифицированных и высококвалифицированных специалистов в провинции Цзянси (G/Y3035).
Материалы
| Name | Company | Catalog Number | Comments |
| 5-mm trocar | CANWELL MEDICAL Co., LTD | 179094F | Sterile, ethylene oxide sterilized, disposable |
| 12-mm trocar | CANWELL MEDICAL Co., LTD | NB12STF | Sterile, ethylene oxide sterilized, disposable |
| Absorbable Sutures | America Ethicon Medical Technology Co., LTD | W8557/W9109H/VCPB839D | Sterile, ethylene oxide sterilized, disposable |
| Alligaclip Absorbable Ligating Clip | Hangzhou Sunstone Technology Co., Ltd. | K12 | Sterile, ethylene oxide sterilized, disposable |
| Endoscopic linear cutting stapler | America Ethicon Medical Technology Co., LTD | ECR60W/PSEE60A | Sterile, ethylene oxide sterilized, disposable |
| Non-absorbable polymer ligature clip | Greiner Bio-One Shanghai Co., Ltd. | 0301-03M04/0301-03L04/0301-03ML02 | Sterile, ethylene oxide sterilized, disposable |
| NonAbsorbable Sutures | America Ethicon Medical Technology Co., LTD | EH7241H/EH7242H | Sterile, ethylene oxide sterilized, disposable |
| Ultrasonic scalpel | America Ethicon Medical Technology Co., LTD | HARH36 | Sterile, ethylene oxide sterilized, disposable |
Ссылки
- Klatskin, G. Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis: An unusual tumor with distinctive clinical and pathological features. Am J Med. 38 (2), 241-256 (1965).
- Cillo, U., et al. Surgery for cholangiocarcinoma. Liver Int. 39 Suppl 1 (Suppl Suppl 1), 143-155 (2019).
- Jingdong, L., et al. Minimally invasive surgery for hilar cholangiocarcinoma: A multicenter retrospective analysis of 158 patients. Surg Endosc. 35 (12), 6612-6622 (2021).
- Vogel, A., et al. Biliary tract cancer: Esmo clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 34 (2), 127-140 (2023).
- Giannini, A., et al. The great debate: Surgical outcomes of laparoscopic versus laparotomic myomectomy. A meta-analysis to critically evaluate current evidence and look over the horizon. Eur J Obstet Gynecol Reprod Biol. 297, 50-58 (2024).
- Hakkenbrak, N. A. G., Jansma, E. P., Van Der Wielen, N., Van Der Peet, D. L., Straatman, J. Laparoscopic versus open distal gastrectomy for gastric cancer: A review and meta-analysis. Surgery. 171 (6), 1552-1561 (2022).
- Macacari, R. L., et al. Laparoscopic vs. Open left lateral sectionectomy: An update meta-analysis of randomized and non-randomized controlled trials. Int J Surg. 61, 1-10 (2019).
- Zhou, Y., Cai, P., Zeng, N. Augmented reality navigation system makes laparoscopic radical resection of hilar cholangiocarcinoma type b more precise and safe. Gastrointest Surg. 28 (7), 1212-1213 (2024).
- Hu, H. J., et al. Hepatic artery resection for bismuth type iii and iv hilar cholangiocarcinoma: Is reconstruction always required. J Gastrointest Surg. 22 (7), 1204-1212 (2018).
- Rushbrook, S. M., et al. British Society of Gastroenterology guidelines for the diagnosis and management of cholangiocarcinoma. Gut. 73 (1), 16-46 (2023).
- Xiong, Y., Jingdong, L., Zhaohui, T., Lau, J. A consensus meeting on expert recommendations on operating specifications for laparoscopic radical resection of hilar cholangiocarcinoma. Front Surg. 8, 731448 (2021).
- Benson, A. B., et al. Hepatobiliary cancers, version 2.2021, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 19 (5), 541-565 (2021).
- Kokudo, N., Ishizawa, T. Clinical application of fluorescence imaging of liver cancer using indocyanine green. Liver Cancer. 1 (1), 15-21 (2012).
- Terasawa, M., et al. Applications of fusion-fluorescence imaging using indocyanine green in laparoscopic hepatectomy. Surg Endosc. 31 (12), 5111-5118 (2017).
- Pringle, J. H. V. Notes on the arrest of hepatic hemorrhage due to trauma. Ann Surg. 48 (4), 541-549 (1908).
- Otsuka, S., et al. Efficacy of extended modification in left hemihepatectomy for advanced perihilar cholangiocarcinoma: Comparison between H12345'8'-B-MHV and H1234-B. Ann Surg. 277 (3), e585-e591 (2023).
- Roth, G. S., et al. Biliary tract cancers: French national clinical practice guidelines for diagnosis, treatments and follow-up (TNCD, SNFGE, FFCD, UNICANCER, GERCOR, SFCD, SFED, AFEF, SFRO, SFP, SFR, ACABI, ACHBPT). Eur J Cancer. 202, 114000 (2024).
- Abu Hilal, M., et al. The Southampton consensus guidelines for laparoscopic liver surgery: From indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Tang, W., et al. Minimally invasive versus open radical resection surgery for hilar cholangiocarcinoma: Comparable outcomes associated with advantages of minimal invasiveness. PLoS One. 16 (3), e0248534 (2021).
- Yu, H., Wu, S. -. D., Chen, D. -. X., Zhu, G. Laparoscopic resection of bismuth type I and II hilar cholangiocarcinoma: An audit of 14 cases from two institutions. Dig Surg. 28 (1), 44-49 (2011).
- Ratti, F., et al. Perihilar cholangiocarcinoma: Are we ready to step towards minimally invasiveness. Updates Surg. 72 (2), 423-433 (2020).
- Berardi, G., et al. Minimally invasive surgery for perihilar cholangiocarcinoma: A systematic review of the short- and long-term results. Cancers (Basel). 15 (11), 3048 (2023).
- Xiong, F., Peng, F., Li, X., Chen, Y. Preliminary comparison of total laparoscopic and open radical resection for hepatic hilar cholangiocarcinoma a single-center cohort study. Asian J Surg. 46 (22), 856-862 (2023).
- Qin, T., et al. The long-term outcome of laparoscopic resection for perihilar cholangiocarcinoma compared with the open approach: A real-world multicentric analysis. Ann Surg Oncol. 30 (3), 1366-1378 (2023).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancers. 115 (11), 2491-2504 (2009).
- Xu, C., Cui, X., Jia, Z., Shen, X., Che, J. A meta-analysis of short-term and long-term effects of indocyanine green fluorescence imaging in hepatectomy for liver cancer. Photodiagnosis Photodyn Ther. 42, 103497 (2023).
- Tangsirapat, V., et al. Surgical margin status outcome of intraoperative indocyanine green fluorescence-guided laparoscopic hepatectomy in liver malignancy: A systematic review and meta-analysis. BMC Surg. 24 (1), 181 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены