Method Article
Vollständige laparoskopische radikale Resektion des perihilären Cholangiokarzinoms Typ IIIb
In diesem Artikel
Zusammenfassung
Das perihiläre Cholangiokarzinom (pCCA) ist ein hochgradig bösartiger und aggressiver Tumor, bei dem die radikale Resektion die einzige kurative Behandlung ist. Mit der kontinuierlichen Weiterentwicklung laparoskopischer Techniken und Instrumente gilt die laparoskopische radikalische Chirurgie bei pCCA heute als technisch sicher und durchführbar. Aufgrund der hohen Komplexität der Operation und des Mangels an evidenzbasierter klinischer Unterstützung wird die laparoskopische radikalische Operation bei Typ IIIb pCCA jedoch nur in wenigen großen hepatobiliären Zentren durchgeführt. Aktuelle Leitlinien empfehlen eine linke Hemihepatektomie in Kombination mit einer totalen Caudat-Lobektomie und einer standardisierten Lymphadenektomie bei resezierbarer pCCA vom Typ IIIb. Aus diesem Grund geben wir in diesem Artikel eine detaillierte Beschreibung der chirurgischen Schritte und technischen Punkte der vollständigen laparoskopischen linken Hemihepatektomie in Kombination mit der totalen Caudat-Lobektomie, der regionalen Lymphadenektomie und der Roux-en-Y-Anastomose des rechten Lebergangs-Jejunal-Roux-en-Y bei Patienten mit Typ IIIb pCCA, wobei die Fluoreszenznavigationstechnologie zur Verbesserung der chirurgischen Präzision und Sicherheit verwendet wird. Durch die Einhaltung standardisierter chirurgischer Verfahren und präziser intraoperativer Techniken bieten wir ein wirksames Mittel zur Verbesserung der Patientenergebnisse.
Zusammenfassung
Das perihiläre Cholangiokarzinom (pCCA) ist ein hochgradig bösartiger und aggressiver Tumor, bei dem die radikale Resektion die einzige kurative Behandlung ist. Mit der kontinuierlichen Weiterentwicklung laparoskopischer Techniken und Instrumente gilt die laparoskopische radikalische Chirurgie bei pCCA heute als technisch sicher und durchführbar. Aufgrund der hohen Komplexität der Operation und des Mangels an evidenzbasierter klinischer Unterstützung wird die laparoskopische radikalische Operation bei Typ IIIb pCCA jedoch nur in wenigen großen hepatobiliären Zentren durchgeführt. Aktuelle Leitlinien empfehlen eine linke Hemihepatektomie in Kombination mit einer totalen Caudat-Lobektomie und einer standardisierten Lymphadenektomie bei resezierbarer pCCA vom Typ IIIb. Aus diesem Grund geben wir in diesem Artikel eine detaillierte Beschreibung der chirurgischen Schritte und technischen Punkte der vollständigen laparoskopischen linken Hemihepatektomie in Kombination mit der totalen Caudat-Lobektomie, der regionalen Lymphadenektomie und der Roux-en-Y-Anastomose des rechten Lebergangs-Jejunal-Roux-en-Y bei Patienten mit Typ IIIb pCCA, wobei die Fluoreszenznavigationstechnologie zur Verbesserung der chirurgischen Präzision und Sicherheit verwendet wird. Durch die Einhaltung standardisierter chirurgischer Verfahren und präziser intraoperativer Techniken bieten wir ein wirksames Mittel zur Verbesserung der Patientenergebnisse.
Einleitung
Das perihiläre Cholangiokarzinom (pCCA), auch bekannt als Klatskin-Tumor, wurde erstmals von Gerald Klatskin beschrieben und ist ein bösartiger Tumor, der im Gallengangsepithel am Zusammenfluss des rechten und linken Lebergangs auftritt1. Diese Krankheit ist sehr bösartig und aggressiv und tritt in fortgeschrittenen Stadien häufig mit Gelbsucht und Cholangitis auf. Trotz Fortschritten in Diagnose und Behandlung ist die Prognose für pCCA nach wie vor schlecht, wobei die radikale chirurgische Resektion nach wie vor der einzige potenziell heilende Ansatz ist. Solche Operationen umfassen in der Regel eine ausgedehnte Hepatektomie, eine Gallengangsresektion und eine regionale Lymphadenektomie2. Ziel der Operation ist es, eine R0-Resektion zu erreichen, die die Überlebensraten der Patienten deutlich verbessert 3,4. Die komplexe Anatomie der hilären Region und die Nähe des Tumors zu lebenswichtigen Gefäßstrukturen machen diese Operationen jedoch zu einer hohen Herausforderung.
In den letzten Jahren hat das Aufkommen der laparoskopischen Technologie die chirurgische Onkologie revolutioniert und bietet potenzielle Vorteile wie reduzierte perioperative Komplikationen, kürzere Krankenhausaufenthalte und eine schnellere Genesung 5,6,7. Dennoch ist die Anwendung der laparoskopischen Chirurgie bei pCCA, insbesondere bei Typ-IIIb-Fällen, nach wie vor begrenzt, da nur wenige Berichte vorliegen 3,8. Dies ist in erster Linie auf die technische Schwierigkeit zurückzuführen, adäquate Ränder zu erreichen und komplexe Gallen- und Gefäßrekonstruktionen laparoskopisch durchzuführen9. Aktuelle Leitlinien empfehlen eine linkshemihepatektomische Operation in Kombination mit einer totalen Caudat-Lobektomie und einer standardisierten Lymphadenektomie für resezierbare Typ IIIb pCCA 4,10,11,12. Die Beweise für den Einsatz laparoskopischer Methoden für diese umfangreiche Operation häufen sich jedoch immer noch.
In dieser Studie wird die vollständige laparoskopische radikalische Resektion von Typ IIIb pCCA vorgestellt. Unser Ziel ist es, die Techniken und wichtigsten Schritte dieser Operation detailliert zu beschreiben, einschließlich der linken Hemihepatektomie, der totalen Caudat-Lobektomie, der regionalen Lymphadenektomie und der Roux-en-Y-Hepaticojejunostomie. Durch die Weitergabe dieses Protokolls hoffen wir, einen Beitrag zur Evidenz zu leisten, die die Machbarkeit und Sicherheit laparoskopischer Methoden bei der Behandlung von Typ IIIb pCCA unterstützt und letztendlich die Patientenergebnisse verbessert.
Protokoll
Die Studie folgt der Ethikkommission für die Humanforschung des Second Affiliated Hospital der Nanchang University. Vor der Operation wurde eine schriftliche Einverständniserklärung des Patienten eingeholt.
HINWEIS: Bei dem Patienten handelte es sich um einen 65-jährigen Mann, der sich mit einer Hauptbeschwerde von "generalisiertem Ikterus und Juckreiz für 2 Wochen" vorstellte. Eine Computertomographie (CT) in einem externen Krankenhaus ergab eine perihiläre Gallengangsmasse mit intrahepatischer Gallengangserweiterung. Die verwendeten chirurgischen Instrumente und Geräte sind in der Materialtabelle aufgeführt.
1. Präoperative Vorbereitung
- Führen Sie präoperativ routinemäßige Blutuntersuchungen durch, einschließlich vollständigem Blutbild, Leber- und Nierenfunktionstests, Gerinnungsprofil und Serumtumormarkern.
- Entnehmen Sie Blutproben, senden Sie sie für verschiedene Blutuntersuchungen ins Labor und berichten Sie über die Ergebnisse.
HINWEIS: Leberfunktionstests zeigten ein erhöhtes Gesamtbilirubin (230,8 μmol/L) und ein verringertes Albumin (35,7 g/L). Serumtumormarker-Tests zeigten einen erhöhten Kohlenhydrat-Antigen-Kohlenhydrat-Antigen 199 (184,46 U/ml)4,12.
- Entnehmen Sie Blutproben, senden Sie sie für verschiedene Blutuntersuchungen ins Labor und berichten Sie über die Ergebnisse.
- Führen Sie ein präoperatives Elektrokardiogramm (EKG), ein abdominales CT, eine Magnetresonanztomographie (MRT) des Bauchraums, ein Thorax-CT und andere relevante Untersuchungen durch 4,12.
HINWEIS: In dieser Studie wurde der Patient in der Radiologie einer abdominalen CT-Untersuchung mit und ohne Kontrastmittel unterzogen. Der Scan zeigte eine Masse in der perihilären Region ohne Beteiligung der umgebenden Gefäße, was auf ein Cholangiokarzinom mit Obstruktion hindeutet (Abbildung 1). Die MRT mit und ohne Kontrastmittel und die Magnetresonanz-Cholangiopankreatographie zeigten eine Raumforderung im perihilären Gallengang und im angrenzenden Leberparenchym mit intrahepatischer Gallengangserweiterung und vergrößerten perihilären Lymphknoten, was auf eine neoplastische Läsion hindeutet (Abbildung 1).
2. Chirurgischer Eingriff
- Verabreichen Sie eine Vollnarkose mit trachealer Intubation, intravenösen und inhalativen Mitteln. Positionieren Sie den Patienten in Rückenlage mit angehobenem Kopf und gespreizten Beinen. Führen Sie eine routinemäßige Desinfektion mit Povidon-Jod-Lösung durch.
HINWEIS: Der Primärchirurg steht auf der rechten Seite des Patienten, der Assistent auf der linken Seite und die Kamerahalterung zwischen den Beinen des Patienten (Abbildung 2). - Machen Sie einen Längsschnitt von ca. 1 cm am Nabel, führen Sie eine Veress-Nadel ein und insufflieren Sie CO2 , um einen intraabdominalen Druck von 12 mmHg aufrechtzuerhalten. Setzen Sie einen 10-mm-Trokar und ein 30° -Laparoskop ein. Nachdem durch die Laparoskopie bestätigt wurde, dass keine Fernmetastasen vorhanden sind, platzieren Sie die OP-Trokare wie in Abbildung 2 gezeigt.
- Präparieren Sie die Arteria cysticus und den Ductus cysticus und fahren Sie dann mit der retrograden Entfernung der Gallenblase fort. Verwenden Sie ein Ultraschallskalpell, um die Arteria hepatica communis (CHA), die Arteria gastroduodenalis (GDA), die Arteria hepatica proper (PHA) und die linken Leberarterien (LHA) (die die Arteria middle hepatica (MHA)) und die rechte Arteria hepatica (RHA) abgeben) zu präparieren, zu mobilisieren und zu suspendieren. Ligatieren und teilen Sie die rechten Magenarterien (RGA) und LHA (Abbildung 3).
- Durchschneiden Sie den gemeinsamen Gallengang (CBD) am oberen Rand der Bauchspeicheldrüse und senden Sie den distalen Rand für die Pathologie des Schnellschnitts, um die negativen Ränder zu bestätigen.
- Verwenden Sie ein Ultraschallskalpell, um die Pfortader (PV) zu präparieren, zu mobilisieren und zu suspendieren. Entfernen Sie den extrahepatischen Gallengang und die Lymphknotengruppen 8, 12 und 13 en bloc entlang des PV in Richtung des hepatischen Hilums, um eine Skelettierung des hepatoduodenalen Bandes zu erreichen.
- Ligate und dividieren Sie den linken Ast der Pfortader (LPV) und den Pfortaderästen des Schwanzlappens.
- Präparieren Sie die linken Leberbänder und teilen Sie die kurzen Lebervenen des Schwanzlappens, wobei Sie die Demarkationslinie (ischämische Linie) zwischen dem rechten und linken Leberlappen klar abgrenzen.
- Nachdem Sie die Demarkationslinie markiert haben, bestätigen Sie mithilfe der Fluoreszenzbildgebung, dass die Fluoreszenzgrenze mit der ischämischen Linie übereinstimmt (Abbildung 4 und Abbildung 5).
HINWEIS: Hier wird eine negative Färbemethode verwendet, bei der Indocyaningrün durch periphere intravenöse Injektion in einer Dosis von 0,25 mgverabreicht wird 13,14.
- Verschließen Sie zeitweise den Haupt-PV mit dem Pringle-Manöver15. Verwenden Sie ein Ultraschallskalpell, um das Leberparenchym entlang der Demarkationslinie und dann entlang der Ebene der mittleren Lebervene (MHV) zu durchschneiden, wobei Sie darauf achten, dass die V4b- und V4a-Äste geteilt werden.
HINWEIS: Patienten mit einem positiven Leberrand können eine erweiterte linke Hepatektomie (LH) in Betracht ziehen, die die vollständige Resektion des Hauptstamms des MHV und der linken Teile der Segmente 5 und 8 umfasst. Dieser Ansatz kann die Überlebensraten verbessern16. - Durchschneiden Sie den rechten Lebergang etwa 1 cm vom Tumor entfernt und senden Sie den proximalen Rand zur Pathologie des Schnellschnitts, um negative Ränder zu bestätigen.
- Führen Sie bei Bedarf mehrmals eine intraoperative Schnellschnittanalyse des proximalen Lebergangsrandes durch, um eine R0-Resektion zu gewährleisten. Wenn der rechte Lebergang großflächig geteilt ist, sollte eine Gallengangsrekonstruktion oder eine doppelte Hepaticojejunostomie des rechten vorderen und rechten hinteren Gallengangs in Betracht gezogen werden.
- Die linke Lebervene (LHV) wird mit einem endoskopischen Linearschneider (ENDO-GIA) durchtrennt. Die linke Hemileber und der gesamte Schwanzlappen werden vollständig reseziert und die Probe in einen Entnahmebeutel gelegt (Abbildung 6).
- Das Jejunum ca. 20 cm distal des Treitz-Bandes durchschneiden. Heben Sie die distale Schleife posterior zum Dickdarm an, um eine End-to-Side-Anastomose mit dem rechten Lebergang zu erreichen, wobei kontinuierliche Nähte für die Vorder- und Hinterwände verwendet werden (Abbildung 7). Führen Sie eine Jejunojejunostomie von Seite zu Seite etwa 45 cm distal des rechten Lebergang-Jejunalanastomose durch.
- Spülen Sie die Bauchhöhle mit sterilem destilliertem Wasser. Untersuchen Sie das Operationsfeld sorgfältig auf aktive Blutungen, Gallenlecks und Verletzungen der gastrointestinalen Seitenäste. Legen Sie Drainageschläuche in den linken Leberabschnitt und in das Foramen Winslow.
- Verlängern Sie den Nabelschnitt um ca. 5 cm und präparieren Sie die Bauchdecke Schicht für Schicht, um die Probe zu entnehmen. Überprüfen Sie die Anzahl der chirurgischen Instrumente und der Gaze. Entfernen Sie die Trokare unter direkter Sicht. Schließen Sie den Bauchwandschnitt mit unterbrochenen 2-0 resorbierbaren Nähten, um die Operation abzuschließen.
3. Nachsorge
- Transportieren Sie den Patienten sicher zurück auf die Station, nachdem der Patient wieder zu Bewusstsein gekommen ist.
- Verabreichen Sie postoperativ intravenöse Antibiotika, Omeprazol und Ernährungsunterstützung.
- Beginnen Sie am dritten postoperativen Tag nach dem Blähen des Patienten mit einer flüssigen Diät.
- Entfernen Sie die abdominalen Drainageschläuche am 4. und 13. postoperativen Tag.
Ergebnisse
Die Operation verlief reibungslos, und die intraoperative Schnellschnittpathologie zeigte negative Ränder sowohl an den distalen als auch an den proximalen Gallengängen. Während des gesamten Eingriffs blieben die Vitalparameter des Patienten stabil und die Anästhesie war wirksam. Die Operation dauerte 360 min, wobei die PV-Okklusionszeit insgesamt 60 min betrug (15 min + 5 min × 4 Mal). Der intraoperative Blutverlust betrug 400 ml, und der Patient erhielt 2 Einheiten leukozytenbelassende rote Blutkörperchen und 600 ml frisches gefrorenes Plasma. Ein postoperativer Flatus wurde 72 h nach der Operation beobachtet. Es gab keine Komplikationen wie Bauchblutungen, Gallenleckagen, Bauchinfektionen oder Inzisionsinfektionen. Der postoperative Krankenhausaufenthalt betrug 14 Tage. Die postoperative paraffineingebettete histopathologische Analyse zeigte ein mäßig differenziertes biliäres Adenokarzinom, an dem benachbartes Lebergewebe beteiligt war, ohne eindeutige Gefäßinvasion und negative Leberränder. Sechzehn Lymphknoten wurden entfernt, ohne dass Metastasen festgestellt wurden. Der Tumor wurde als pT2bN0M0, Stadium II eingestuft (Tabelle 1). Eine CT-Untersuchung 1 Monat postoperativ zeigte eine erfolgreiche Tumorresektion ohne offensichtliches Rezidiv oder Metastasierung (Abbildung 8).
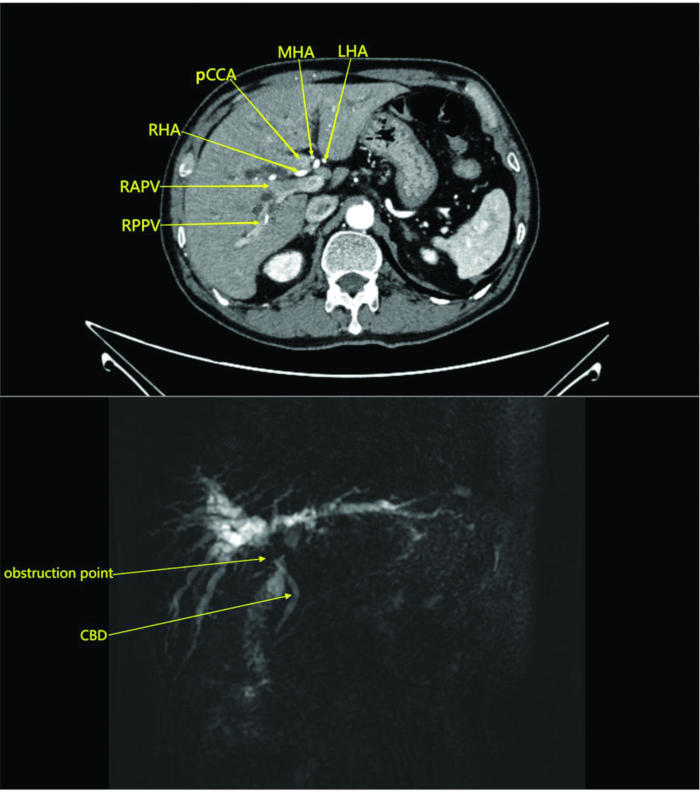
Abbildung 1: CT-Scan des Abdomens und kontrastmittelverstärkte Bilder der arteriellen Phase des Patienten. Die Bilder zeigen eine Raumforderung am hepatischen Hilum ohne Invasion der umgebenden Blutgefäße, was auf ein Cholangiokarzinom mit Obstruktion hindeutet. Abkürzungen: RAPV: rechter vorderer Ast der Pfortader; RPPV: rechter hinterer Ast der Pfortader; CBD: gemeinsamer Gallengang; RHA: rechte Leberarterie; pCCA: Perihiläres Cholangiokarzinom; MHA: mittlere Leberarterie; LHA: linke Leberarterie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Position des Chirurgen und Trokarplatzierung. Der Chirurg steht wie in der Abbildung gezeigt, wobei die Trokare in der Bauchhöhle an den im Bild angegebenen Positionen platziert sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
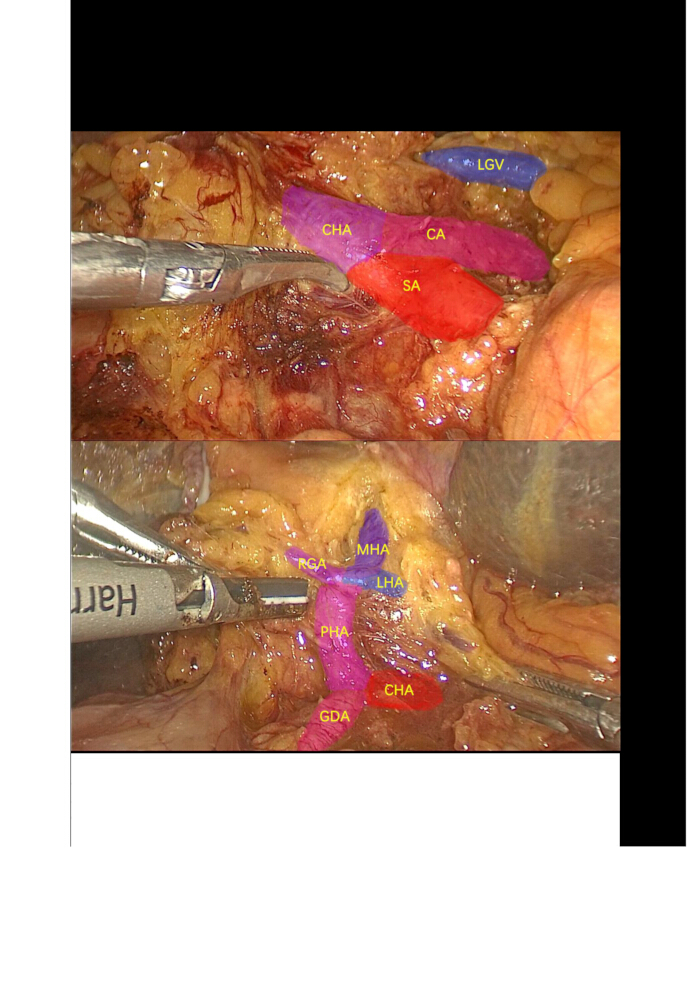
Abbildung 3: Lymphknotendissektion. Dissektion und Isolierung der Trunceria coeliacus, der Arteria milzica, der Arteria hepatica communis, der Arteria gastroduodenalis, der Arteria hepatica properties, der Arteria magrica right, der linken Arteria hepatia, der Arteria brepatica media und der umgebenden Lymphknoten. Abkürzungen: CA: Arteria coeliacus; SA: Milzarterie; LGV: Linke Magenvene; CHA: Arteria hepatica communis; GDA: Arteria gastroduodenalis; PHA: richtige Leberarterie; LHA: linke Leberarterie; MHA: mittlere Leberarterie; RGA: rechte Magenarterien. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Dissektion des Schwanzlappens. Der Schwanzlappen wurde entlang der Vena cava inferior (IVC) von kaudaler zu kranialer Richtung und von links nach rechts präpariert. Bei Erreichen der rechten Seite der IVC wurde die linke Leber angehoben, wobei die IVC, der paracavale Ast, der Prozessast und der Spiegellappen von links nach rechts zum Vorschein kamen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
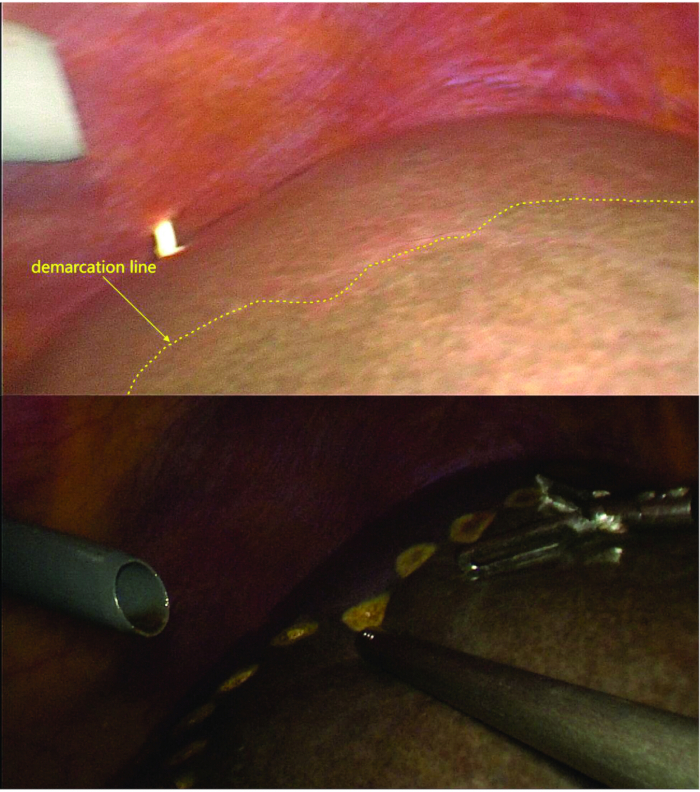
Abbildung 5: Markierung der Demarkationslinie. Nach der Ligatur und Durchtrennung des LPV-Astes, des Pfortaderastes des Schwanzlappens und der kurzen Lebervenen ist die Demarkationslinie zwischen dem linken und dem rechten Hemiliver sichtbar. Unter der Durchleuchtung stimmt die beobachtete Demarkationslinie mit der ischämischen Linie überein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
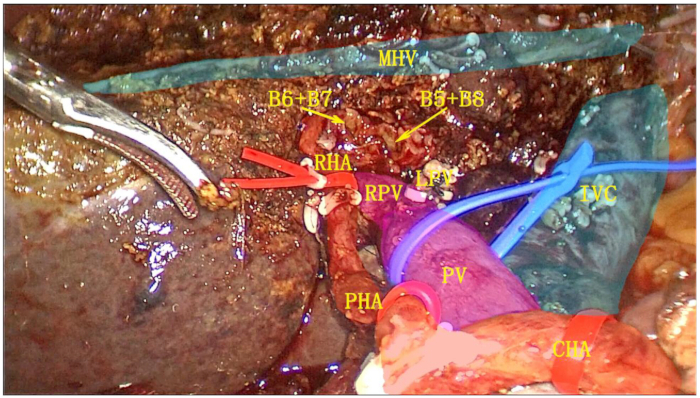
Abbildung 6: Postoperative Schnittfläche nach linker Hemihepatektomie in Kombination mit vollständiger Resektion des Schwanzlappens. Die Gallenblase, das Ligamentum hepatoduodenal, die linke Hemileber und der gesamte Schwanzlappen wurden als eine Einheit reseziert. Abkürzungen: RPV: rechter Ast der Pfortader; IVS: untere Hohlvene; MHV: mittlere Lebervene; RHA: rechte Leberarterie; PV: Pfortader; PHA: richtige Leberarterie; CHA: Arteria hepatica communis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Postoperative Ansicht der pCCA-Resektion. Das MHV ist vollständig freigelegt, und die hintere und vordere Wand des rechten Lebergangs werden kontinuierlich mit dem Jejunal anastomosiert. Abkürzungen: MHV: mittlere Lebervene. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
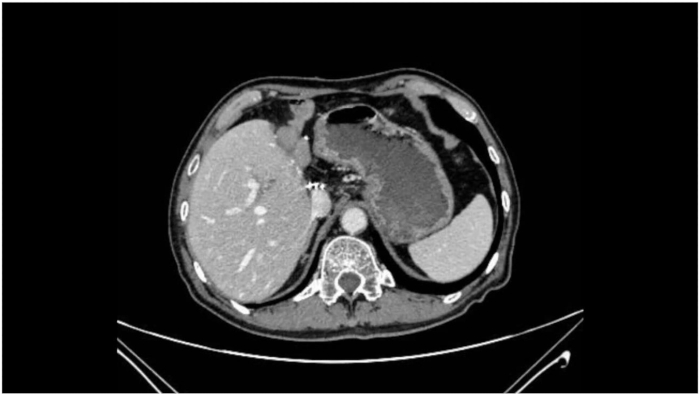
Abbildung 8: Postoperativer CT-Scan. Die postoperative CT-Untersuchung zeigt eine erfolgreiche Tumorresektion ohne offensichtliches Rezidiv oder Metastasierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Betriebszeit (min) | 360 |
| Intraoperativer Blutverlust (ml) | 400 |
| Intraoperative Bluttransfusion (ml) | 1000 |
| PV-Okklusionszeit (min) | 60 |
| Erster Flatus (h) | 72 |
| Erste postoperative Flüssigdiät (Tage) | 3 |
| Postoperativer Krankenhausaufenthalt (Tage) | 14 |
| Postoperative Komplikationen (ja/nein) | Nein |
| Blutungen (ja/nein) | Nein |
| Gallenleckage (ja/nein) | Nein |
| Bauchinfektion (ja/nein) | Nein |
| Inzisionsinfektion (ja/nein) | Nein |
| Pathologisches Ergebnis | Gallenseitiges Adenokarzinom |
| Differenzierung | Mäßig |
| TNM-Bühne | pT2bN0M0 |
| AJCC-Phase | II |
Tabelle 1: Die chirurgischen Ergebnisse des Patienten.
Diskussion
pCCA ist ein häufiger bösartiger Tumor der Gallenwege, wobei die radikale chirurgische Resektion die einzige mögliche kurative Behandlung ist2. Die traditionelle radikale Chirurgie bei pCCA erfordert in der Regel einen Bauchschnitt von 20 bis 30 cm, was zu einem erheblichen chirurgischen Trauma führt. Große Schnitte verursachen oft erhebliche postoperative Schmerzen, die den Patientenkomfort und die Genesung beeinträchtigen und dadurch den Krankenhausaufenthalt verlängern 5,6,7. Mit Ausnahme einiger Typ-I-pCCA, die einer lokalen Gallengangsresektion und einer biliär-enterischen Anastomose unterzogen werden können, ist bei anderen Typen eine Leberresektion erforderlich, einschließlich einer vollständigen Resektion des Schwanzlappens11. Das Gesichtsfeld in der offenen Chirurgie beruht jedoch hauptsächlich auf der direkten Visualisierung durch den Chirurgen, die insbesondere beim Umgang mit tiefen Strukturen eingeschränkt ist. Im Gegensatz dazu ermöglicht die laparoskopische Technologie eine direkte Visualisierung unter Vergrößerung und variablen Winkeln, was die Identifizierung anatomischer Strukturen erleichtert und präzisere und sicherere Operationen ermöglicht. Darüber hinaus ermöglicht die laparoskopische Technologie eine minimalinvasive Exploration, wodurch unnötige Laparotomien bei Patienten mit okkulten Metastasen von pCCA17 vermieden werden können.
Studien haben gezeigt, dass die Laparoskopie bei Leber- und Gallenoperationen potenzielle Vorteile bietet, wie z. B. weniger perioperative Komplikationen, kürzere Krankenhausaufenthalte und eine schnellere Genesung18,19. Mit der kontinuierlichen Weiterentwicklung der laparoskopischen Technologie und Instrumente wurde die laparoskopische radikale Chirurgie bei pCCA schrittweise klinisch umgesetzt. Im Jahr 2011 berichteten Hong Yu et al. erstmals über laparoskopische radikale Operationen bei 14 Fällen von Typ I und II pCCA20. Im Jahr 2020 lieferten Ratti et al.21den ersten Nachweis der Vergleichbarkeit zwischen offener und minimal-invasiver Chirurgie (MIS) durch eine Propensity-Score-Matching-Analyse. In dieser gut durchgeführten Studie zeigte die Studie ähnliche Ergebnisse zwischen offenen und laparoskopischen Operationen21. In den letzten zehn Jahren gab es Berichte über laparoskopische radikale Operationen bei pCCA, aber die meisten sind retrospektive Studien mit unzureichender Evidenz. Aktuelle Leitlinien empfehlen für einige pCCA17 eine laparoskopische Exploration und Biopsie. Studien haben keine signifikanten Unterschiede in den R0-Resektionsraten, dem Gesamtüberleben (OS), dem krankheitsfreien Überleben (DFS) und den Komplikationen zwischen offener und laparoskopischer radikaler Operation bei pCCAgezeigt 22,23,24. Darüber hinaus hat die Einführung der laparoskopischen Fluoreszenzbildgebungstechnologie die Präzision und Sicherheit von Operationen weiter verbessert. Bei dieser Technologie werden Fluoreszenzfarbstoffe verwendet, die spezifisch im Gewebe verteilt sind, und ermöglicht eine Echtzeit-Bildgebung durch ein Fluoreszenzkamerasystem. Dies hilft Chirurgen, die Grenzen zwischen Tumor- und Normalgewebe klarer zu unterscheiden25,26. Bei der anatomischen Leberresektion hilft die Fluoreszenzbildgebungstechnologie dem Chirurgen, die Grenzen der Leberresektionssegmente genauer abzugrenzen. Sie zeigt eine höhere Detektionsrate für oberflächliche Leberläsionen im Vergleich zur konventionellen Bildgebung, wodurch die Gründlichkeit der Resektion und die R0-Resektionsrate erhöht werden, was letztendlich die onkologische Radikalität der Operation erhöht27,28. Bei Patienten mit Zirrhose ist die Falsch-Positiv-Rate jedoch höher, und es kann zu einer Fluoreszenzgrenzfärbung kommen. Da hepatobiliäre Chirurgen weiterhin Erfahrungen in diesem Bereich sammeln und diese weiter erforschen, wurden die Machbarkeit und Sicherheit dieses chirurgischen Ansatzes weiter validiert.
Die traditionelle radikale Chirurgie bei pCCA Typ IIIb umfasst die linke Hemihepatektomie in Kombination mit einer vollständigen Resektion des Schwanzlappens und einer standardisierten Lymphknotendissektion. Der Ansatz wird in der Regel in Links- und Rechtsansätze unterteilt. Beim linksseitigen Zugang werden zunächst die Lymphknoten in der Nähe der Arteria hepatica communis dissektioniert, gefolgt von den Lymphknoten im Ligamentum hepatoduodenalis und dem hinteren Rand der Bauchspeicheldrüse. Der rechtsseitige Zugang beginnt mit den Lymphknoten im hinteren Rand der Bauchspeicheldrüse, gefolgt von den Lymphknoten des hepatoduodenalen Bandes und den Lymphknoten, die an die Arteria hepatica communis angrenzen. Die Dissektionssequenz kann auf die Merkmale der laparoskopischen Chirurgie und die Gewohnheiten des Chirurgen abgestimmt werden, indem die geeignete und standardisierte regionale Dissektionssequenz für Lymphknoten und Nervenplexus auf der Grundlage intraoperativer anatomischer Strukturen ausgewählt wird.
Bei diesem Patienten zeigte die präoperative Bildgebung keine Anzeichen von Lymphknotenmetastasen. Daher wählten wir den konventionellen linksseitigen Ansatz, bei dem die Lymphknoten in der Nähe der Arteria hepatica communis, das Ligamentum hepatoduodenalis und der hintere Rand der Bauchspeicheldrüse von der kaudalen Seite zur kranialen Seite sequentiell präpariert wurden. Der distale Gallengangsrand wurde exzidiert und zur intraoperativen Schnellschnittpathologie geschickt, die negative Ränder bestätigte. Anschließend führten wir eine linke Hemihepatektomie in Kombination mit einer vollständigen Resektion des Schwanzlappens durch und exzidierten den proximalen Gallengangsrand, der auch bei der intraoperativen Pathologie des Schnellschnitts negative Ränder aufwies, wodurch eine R0-Resektion erreicht wurde.
Studien haben gezeigt, dass Patienten mit pCCA, die eine R0-Resektion erreichen, im Vergleich zu Patienten mit R1-Resektion ein signifikant besseres OS und DFS haben. Aktuelle Leitlinien weisen auch darauf hin, dass das Erreichen einer R0-Resektion durch segmentale Hepatektomie in Kombination mit einer vollständigen Schwanzlappenresektion und einer standardisierten Lymphknotendissektion von entscheidender Bedeutung ist. Aufgrund technischer Schwierigkeiten und unzureichender Evidenz führen derzeit jedoch nur wenige hepatobiliäre Zentren mit hohem Volumen laparoskopische radikale Operationen bei pCCA durch, wobei die meisten Berichte aus östlichen Ländern stammen22. Darüber hinaus sind in den frühen Phasen der Entwicklung dieser Technologie längere Betriebszeiten und eine steile Lernkurve erforderlich, was Einschränkungen bei dieser Technik darstellt. Derzeit gibt es keine Studien, die angeben, wie lange und wie viele Operationen Chirurgen benötigen, um dieses komplexe Verfahren zu beherrschen. Die einzige Anleitung stammt von der Expertengruppe für operative Normen der laparoskopischen radikalen Resektion des perihilären Cholangiokarzinoms in China, die darauf hindeutet, dass die Lernkurve für die Durchführung einer laparoskopischen Leberresektion und einer laparoskopischen Pankreatikoduodenektomie jeweils mehr als 50 Fälle umfassen sollte. Die vorhandenen Daten reichen immer noch nicht aus, um die Überlegenheit einer Technik gegenüber einer anderen zu belegen oder die Ergebnisse mit offenen Methoden zu vergleichen. Daher empfehlen wir, dass ein spezialisiertes Team von minimal-invasiven Chirurgen an großen hepatobiliären Zentren nach Überwindung der Lernkurve selektiv geeignete Fälle auswählt (ohne Kontraindikationen für die standardmäßige laparoskopische oder offene radikale Resektion von pCCA und ohne Invasion der Pfortader oder Leberarterie). Die Chirurgen sollten zunächst laparoskopische radikalische Operationen bei Typ I und Typ II pCCA versuchen, bevor sie zu laparoskopischen Eingriffen vom Typ IIIb übergehen. Dieser Ansatz trägt dazu bei, sichere postoperative Ergebnisse, eine ausreichende Tumorresektion und eine angemessene Identifizierung und Behandlung potenzieller Komplikationen zu gewährleisten.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Dieses Papier wurde mit Mitteln der National Natural Science Foundation of China (82060454), dem wichtigen Forschungs- und Entwicklungsprogramm der chinesischen Provinz Jiangxi (20203BBGL73143) und dem Jiangxi Province High-Level and High-Skill Leading Talent Training Project (G/Y3035) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 5-mm trocar | CANWELL MEDICAL Co., LTD | 179094F | Sterile, ethylene oxide sterilized, disposable |
| 12-mm trocar | CANWELL MEDICAL Co., LTD | NB12STF | Sterile, ethylene oxide sterilized, disposable |
| Absorbable Sutures | America Ethicon Medical Technology Co., LTD | W8557/W9109H/VCPB839D | Sterile, ethylene oxide sterilized, disposable |
| Alligaclip Absorbable Ligating Clip | Hangzhou Sunstone Technology Co., Ltd. | K12 | Sterile, ethylene oxide sterilized, disposable |
| Endoscopic linear cutting stapler | America Ethicon Medical Technology Co., LTD | ECR60W/PSEE60A | Sterile, ethylene oxide sterilized, disposable |
| Non-absorbable polymer ligature clip | Greiner Bio-One Shanghai Co., Ltd. | 0301-03M04/0301-03L04/0301-03ML02 | Sterile, ethylene oxide sterilized, disposable |
| NonAbsorbable Sutures | America Ethicon Medical Technology Co., LTD | EH7241H/EH7242H | Sterile, ethylene oxide sterilized, disposable |
| Ultrasonic scalpel | America Ethicon Medical Technology Co., LTD | HARH36 | Sterile, ethylene oxide sterilized, disposable |
Referenzen
- Klatskin, G. Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis: An unusual tumor with distinctive clinical and pathological features. Am J Med. 38 (2), 241-256 (1965).
- Cillo, U., et al. Surgery for cholangiocarcinoma. Liver Int. 39 Suppl 1 (Suppl Suppl 1), 143-155 (2019).
- Jingdong, L., et al. Minimally invasive surgery for hilar cholangiocarcinoma: A multicenter retrospective analysis of 158 patients. Surg Endosc. 35 (12), 6612-6622 (2021).
- Vogel, A., et al. Biliary tract cancer: Esmo clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 34 (2), 127-140 (2023).
- Giannini, A., et al. The great debate: Surgical outcomes of laparoscopic versus laparotomic myomectomy. A meta-analysis to critically evaluate current evidence and look over the horizon. Eur J Obstet Gynecol Reprod Biol. 297, 50-58 (2024).
- Hakkenbrak, N. A. G., Jansma, E. P., Van Der Wielen, N., Van Der Peet, D. L., Straatman, J. Laparoscopic versus open distal gastrectomy for gastric cancer: A review and meta-analysis. Surgery. 171 (6), 1552-1561 (2022).
- Macacari, R. L., et al. Laparoscopic vs. Open left lateral sectionectomy: An update meta-analysis of randomized and non-randomized controlled trials. Int J Surg. 61, 1-10 (2019).
- Zhou, Y., Cai, P., Zeng, N. Augmented reality navigation system makes laparoscopic radical resection of hilar cholangiocarcinoma type b more precise and safe. Gastrointest Surg. 28 (7), 1212-1213 (2024).
- Hu, H. J., et al. Hepatic artery resection for bismuth type iii and iv hilar cholangiocarcinoma: Is reconstruction always required. J Gastrointest Surg. 22 (7), 1204-1212 (2018).
- Rushbrook, S. M., et al. British Society of Gastroenterology guidelines for the diagnosis and management of cholangiocarcinoma. Gut. 73 (1), 16-46 (2023).
- Xiong, Y., Jingdong, L., Zhaohui, T., Lau, J. A consensus meeting on expert recommendations on operating specifications for laparoscopic radical resection of hilar cholangiocarcinoma. Front Surg. 8, 731448(2021).
- Benson, A. B., et al. Hepatobiliary cancers, version 2.2021, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 19 (5), 541-565 (2021).
- Kokudo, N., Ishizawa, T. Clinical application of fluorescence imaging of liver cancer using indocyanine green. Liver Cancer. 1 (1), 15-21 (2012).
- Terasawa, M., et al. Applications of fusion-fluorescence imaging using indocyanine green in laparoscopic hepatectomy. Surg Endosc. 31 (12), 5111-5118 (2017).
- Pringle, J. H. V. Notes on the arrest of hepatic hemorrhage due to trauma. Ann Surg. 48 (4), 541-549 (1908).
- Otsuka, S., et al. Efficacy of extended modification in left hemihepatectomy for advanced perihilar cholangiocarcinoma: Comparison between H12345'8'-B-MHV and H1234-B. Ann Surg. 277 (3), e585-e591 (2023).
- Roth, G. S., et al. Biliary tract cancers: French national clinical practice guidelines for diagnosis, treatments and follow-up (TNCD, SNFGE, FFCD, UNICANCER, GERCOR, SFCD, SFED, AFEF, SFRO, SFP, SFR, ACABI, ACHBPT). Eur J Cancer. 202, 114000(2024).
- Abu Hilal, M., et al. The Southampton consensus guidelines for laparoscopic liver surgery: From indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Tang, W., et al. Minimally invasive versus open radical resection surgery for hilar cholangiocarcinoma: Comparable outcomes associated with advantages of minimal invasiveness. PLoS One. 16 (3), e0248534(2021).
- Yu, H., Wu, S. -D., Chen, D. -X., Zhu, G. Laparoscopic resection of bismuth type I and II hilar cholangiocarcinoma: An audit of 14 cases from two institutions. Dig Surg. 28 (1), 44-49 (2011).
- Ratti, F., et al. Perihilar cholangiocarcinoma: Are we ready to step towards minimally invasiveness. Updates Surg. 72 (2), 423-433 (2020).
- Berardi, G., et al. Minimally invasive surgery for perihilar cholangiocarcinoma: A systematic review of the short- and long-term results. Cancers (Basel). 15 (11), 3048(2023).
- Xiong, F., Peng, F., Li, X., Chen, Y. Preliminary comparison of total laparoscopic and open radical resection for hepatic hilar cholangiocarcinoma a single-center cohort study. Asian J Surg. 46 (22), 856-862 (2023).
- Qin, T., et al. The long-term outcome of laparoscopic resection for perihilar cholangiocarcinoma compared with the open approach: A real-world multicentric analysis. Ann Surg Oncol. 30 (3), 1366-1378 (2023).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancers. 115 (11), 2491-2504 (2009).
- Xu, C., Cui, X., Jia, Z., Shen, X., Che, J. A meta-analysis of short-term and long-term effects of indocyanine green fluorescence imaging in hepatectomy for liver cancer. Photodiagnosis Photodyn Ther. 42, 103497(2023).
- Tangsirapat, V., et al. Surgical margin status outcome of intraoperative indocyanine green fluorescence-guided laparoscopic hepatectomy in liver malignancy: A systematic review and meta-analysis. BMC Surg. 24 (1), 181(2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten