Method Article
Perihilar 담관암종 IIIb형의 완전한 복강경 근치적 절제술
요약
주위 담관암종(perihilar cholangiocarcinoma, pCCA)은 매우 악성적이고 공격적인 종양으로, 근치적 절제술만이 유일하게 이용 가능한 치료법입니다. 복강경 기법과 기구의 지속적인 발전으로 pCCA에 대한 복강경 근치적 수술은 이제 기술적으로 안전하고 실현 가능한 것으로 간주됩니다. 그러나 수술의 복잡성이 높고 근거에 기반한 임상적 지원이 부족하기 때문에 IIIb형 pCCA에 대한 복강경 근치적 수술은 소수의 대형 간담도 센터에서만 시행됩니다. 현재 가이드라인에서는 절제 가능한 IIIb형 pCCA에 대해 전체 미상 엽절제술 및 표준화된 림프절 절제술과 병행한 좌측 편간절제술을 권장하고 있다. 따라서 본 글에서는 IIIb형 pCCA 환자에서 전미상엽절제술, 국소 림프절 절제술, 우측 간관-제주날 Roux-en-Y 문합술과 병행한 완전한 복강경 좌반절제술의 수술 단계와 기술적 요점에 대한 자세한 설명을 제공하며, 형광 항법 기술을 사용하여 수술의 정밀도와 안전성을 향상시킵니다. 표준화된 수술 절차와 정확한 수술 중 기술을 준수함으로써 환자의 결과를 개선할 수 있는 효과적인 수단을 제공합니다.
초록
주위 담관암종(perihilar cholangiocarcinoma, pCCA)은 매우 악성적이고 공격적인 종양으로, 근치적 절제술만이 유일하게 이용 가능한 치료법입니다. 복강경 기법과 기구의 지속적인 발전으로 pCCA에 대한 복강경 근치적 수술은 이제 기술적으로 안전하고 실현 가능한 것으로 간주됩니다. 그러나 수술의 복잡성이 높고 근거에 기반한 임상적 지원이 부족하기 때문에 IIIb형 pCCA에 대한 복강경 근치적 수술은 소수의 대형 간담도 센터에서만 시행됩니다. 현재 가이드라인에서는 절제 가능한 IIIb형 pCCA에 대해 전체 미상 엽절제술 및 표준화된 림프절 절제술과 병행한 좌측 편간절제술을 권장하고 있다. 따라서 본 글에서는 IIIb형 pCCA 환자에서 전미상엽절제술, 국소 림프절 절제술, 우측 간관-제주날 Roux-en-Y 문합술과 병행한 완전한 복강경 좌반절제술의 수술 단계와 기술적 요점에 대한 자세한 설명을 제공하며, 형광 항법 기술을 사용하여 수술의 정밀도와 안전성을 향상시킵니다. 표준화된 수술 절차와 정확한 수술 중 기술을 준수함으로써 환자의 결과를 개선할 수 있는 효과적인 수단을 제공합니다.
서문
클랫스킨 종양으로도 알려진 주위 담관암종(perihilar cholangiocarcinoma, pCCA)은 제럴드 클랫스킨(Gerald Klatskin)에 의해 처음 기술되었으며, 좌우 간관이 합류하는 담관 상피에서 발생하는 악성 종양이다1. 이 질병은 매우 악성이고 공격적이며, 종종 진행된 단계에서 황달과 담관염을 동반합니다. 진단과 치료의 발전에도 불구하고 pCCA의 예후는 여전히 좋지 않으며, 근치적 외과적 절제술이 여전히 유일하게 잠재적으로 치료할 수 있는 방법이다. 이러한 수술에는 일반적으로 광범위한 간절제술, 담관 절제술, 국소 림프절 절제술2가 포함된다. 수술의 목표는 R0 절제술을 통해 환자의 생존율을 현저히 향상시키는 것이다 3,4. 그러나 문턱 영역의 복잡한 해부학적 구조와 종양이 중요한 혈관 구조에 근접해 있기 때문에 이러한 수술은 매우 어렵습니다.
최근 몇 년 동안 복강경 기술의 출현은 외과 종양학에 혁명을 일으켜 수술 전후 합병증 감소, 입원 기간 단축, 빠른 회복과 같은 잠재적인 이점을 제공했습니다 5,6,7. 그럼에도 불구하고, pCCA에서 복강경 수술의 적용, 특히 IIIb형 사례에 대한 적용은 여전히 제한적이며, 이용 가능한 보고는 소수에 불과하다 3,8. 이는 주로 적절한 마진을 달성하고 복강경으로 복잡한 담도 및 혈관 재건을 수행하는 데 기술적인 어려움이 있기 때문입니다9. 현재 지침에서는 절제 가능한 IIIb형 pCCA에 대해 전체 미상 엽 절제술 및 표준화된 림프절 절제술과 병행한 좌측 반간 절제술을 권장하고 있습니다 4,10,11,12. 그러나 이 광범위한 수술에 복강경 방법을 사용하는 것을 뒷받침하는 증거는 여전히 축적되고 있습니다.
이 연구는 IIIb형 pCCA의 완전한 복강경 근치 절제술을 제시합니다. 우리는 좌측 편간절제술, 전체 미상 엽 절제술, 국소 림프절 절제술 및 Roux-en-Y 간절제술을 포함하여 이 수술의 기술과 주요 단계를 자세히 설명하는 것을 목표로 합니다. 이 프로토콜을 공유함으로써 우리는 IIIb형 pCCA 치료에서 복강경 방법의 타당성과 안전성을 뒷받침하는 증거에 기여하여 궁극적으로 환자 결과를 개선할 수 있기를 희망합니다.
프로토콜
이 연구는 난창대학교 제2부속병원의 인간연구윤리위원회에 따른 것이다. 수술 전에 환자로부터 서면 동의서를 받았습니다.
참고: 환자는 65세 남성으로 "2주 동안 전신 황달 및 소양증"을 주로 호소했습니다. 외부 병원에서 컴퓨터 단층촬영(CT) 스캔을 한 결과 간내 담관 확장과 함께 담관 주위 종괴가 발견되었습니다. 사용된 수술 기구 및 장비는 재료 표에 나열되어 있습니다.
1. 수술 전 준비
- 전체 혈구 수, 간 및 신장 기능 검사, 응고 프로파일, 혈청 종양 표지자를 포함한 수술 전 정기적인 혈액 검사를 수행합니다.
- 혈액 샘플을 채취하여 다양한 혈액 검사를 위해 실험실로 보내고 결과를 보고합니다.
참고: 간 기능 검사에서 총 빌리루빈(230.8μmol/L) 증가와 알부민(35.7g/L) 감소가 나타났습니다. 혈청 종양 마커 검사에서 탄수화물 항원 탄수화물 항원 199 (184.46 U/mL) 4,12 상승이 나타났습니다.
- 혈액 샘플을 채취하여 다양한 혈액 검사를 위해 실험실로 보내고 결과를 보고합니다.
- 수술 전 심전도(ECG), 복부 CT, 복부 자기공명영상(MRI), 흉부 CT 및 기타 관련 검사를 실시한다 4,12.
참고: 이 연구에서 환자는 방사선과에서 조영제 유무에 관계없이 복부 CT 스캔을 받았습니다. 스캔 결과 주변 혈관의 침범 없이 perihilar 영역에 종괴가 있는 것으로 나타났으며, 이는 폐색이 있는 담관암종을 시사합니다(그림 1). 조영제가 있거나 없는 MRI와 자기공명(MR) 담췌췌장 조영술은 간내 담관 확장 및 주위 림프절 비대와 함께 주위 담관과 인접한 간 실질의 종괴를 보여주었으며, 이는 종양 병변을 나타냅니다(그림 1).
2. 수술 절차
- 기관 삽관, 정맥 주사 및 흡입제로 전신 마취를 시행합니다. 환자를 누운 자세로 머리를 들고 다리를 벌립니다. 포비돈-요오드 용액을 사용하여 일상적인 소독을 수행합니다.
참고: 주치의는 환자의 오른쪽에, 보조자는 왼쪽에, 카메라 홀더는 환자의 다리 사이에 서 있습니다(그림 2). - 배꼽을 약 1cm 세로로 절개하고 Veress 바늘을 삽입하고 CO2 를 주입하여 12mmHg의 복강 내 압력을 유지합니다. 10mm 투관침과 30° 복강경을 삽입합니다. 복강경을 통해 원격 전이가 없음을 확인한 후 그림 2와 같이 수술용 투관침을 배치합니다.
- 낭포성 동맥과 낭포성 관을 절개한 다음 담낭의 역행성 제거를 진행합니다. 초음파 메스를 사용하여 총간동맥(CHA), 위십이지장 동맥(GDA), 정간동맥(PHA) 및 좌측 간동맥(LHA)(중간동맥(MHA)) 및 우측 간동맥(RHA)을 절개, 동원 및 매달아 놓습니다. 올바른 위동맥(RGA)과 LHA를 접합하고 분할합니다(그림 3).
- 췌장의 상경계에서 총담관(CBD)을 절제하고 동결 절편 병리학을 위해 원위 가장자리를 보내 음성 가장자리를 확인합니다.
- 초음파 메스를 사용하여 문맥(PV)을 절개, 동원 및 매달아 놓습니다. PV를 따라 간외 담관과 림프절 그룹 8, 12, 13을 일제히 제거하여 간십이지장 인대의 골격화를 달성합니다.
- 문맥(LPV)의 왼쪽 가지와 미상엽 문맥 가지를 접합하고 나눕니다.
- 좌측 간인대를 절개하고 미상엽의 짧은 간정맥을 나누어 좌우 간엽 사이의 경계선(허혈선)을 명확하게 표시합니다.
- 경계선을 표시한 후 형광 이미징을 사용하여 형광 경계가 허혈선과 일치하는지 확인합니다(그림 4 및 그림 5).
참고 : 여기에는 음성 염색 방법이 사용되며, 인도 시아닌 녹색은 0.25 mg13,14의 용량으로 말초 정맥 주사를 통해 투여됩니다.
- Pringle maneuver15를 사용하여 메인 PV를 간헐적으로 가립니다. 초음파 메스를 사용하여 경계선을 따라 간 실질을 절제한 다음 중간 간 정맥(MHV)의 평면을 따라 V4b 및 V4a 가지를 분할합니다.
참고: 간 가장자리가 양성인 환자는 MHV의 주요 몸통과 세그먼트 5 및 8의 왼쪽 부분을 완전히 절제하는 확장된 좌측 간 절제술(LH)을 고려할 수 있습니다. 이 접근법은 생존율을 향상시킬 수 있다16. - 종양에서 약 1cm 떨어진 우측 간관을 절제하고 동결 절편 병리학을 위해 근위 가장자리를 보내 음성 가장자리를 확인합니다.
- R0 절제를 보장하기 위해 필요에 따라 근위 간관 가장자리의 수술 중 동결 절제 분석을 여러 번 수행합니다. 우측 간관이 광범위하게 분리되어 있는 경우, 담관 재건술 또는 우측 전방 및 우측 후방 담관의 이중 간절개술을 고려한다.
- 내시경 선형 절단기 스테이플러(ENDO-GIA)를 사용하여 좌측 간정맥(LHV)을 절제합니다. 왼쪽 반쪽과 전체 미상엽을 완전히 절제하고 표본을 회수 백에 넣습니다(그림 6).
- Treitz의 인대에서 원위부로 약 20cm 떨어진 곳에서 jejunum을 절제합니다. 전방 및 후방 벽에 대한 연속 봉합사를 사용하여 오른쪽 간관으로 종단 간 문합을 위해 원위 고리를 결장으로 후방으로 들어 올립니다(그림 7). 우측 간관 원위부 약 45cm에서 좌우 제주노제주루-제주날 문합을 수행합니다.
- 멸균 증류수로 복강을 세척합니다. 수술 부위에 활동성 출혈, 담즙 누출 및 위장 곁가지 손상이 있는지 주의 깊게 검사하십시오. 왼쪽 간 섹션과 윈슬로 구멍에 배액관을 놓습니다.
- 탯줄 절개 부위를 약 5cm 연장하고 복벽을 층별로 절개하여 표본을 채취합니다. 수술 기구와 거즈의 수를 확인하십시오. 직접적인 시야 아래에서 투관침을 제거하십시오. 중단된 2-0 흡수성 봉합사로 복벽 절개 부위를 봉합하여 수술을 마칩니다.
3. 수술 후 관리
- 환자가 의식을 회복한 후 환자를 병동으로 안전하게 다시 이송합니다.
- 수술 후 항생제, 오메프라졸 및 영양 지원을 정맥 주사합니다.
- 환자가 가스를 배출한 후 수술 후 3일째부터 유동식을 시작하십시오.
- 수술후 4일과 13일에 복부 배액관을 제거합니다.
결과
수술은 순조롭게 진행되었고, 수술 중 동결 절편 병리학은 원위 및 근위 담관 모두에서 음의 마진을 보였습니다. 시술 내내 환자의 활력 징후는 안정적으로 유지되었으며 마취는 효과적이었습니다. 작업은 360분 동안 진행되었으며 PV 폐색 시간은 총 60분(15분 + 5분 × 4회)이었습니다. 수술 중 출혈은 400mL였으며, 환자는 백혈구 전용 적혈구 2단위와 신선 냉동 혈장 600mL를 투여받았습니다. 수술 후 편평회는 수술 후 72시간 후에 관찰되었습니다. 복부 출혈, 담즙 누출, 복부 감염, 절개 감염과 같은 합병증은 없었다. 수술 후 입원 기간은 14일이었습니다. 수술 후 파라핀 포매 조직병리학적 분석에서는 인접한 간 조직을 포함하는 적당히 분화된 담즙 선암종(biliary adenocarcinoma)이 확인되었으며, 명확한 혈관 침범은 없었고 간 가장자리는 음음이었다. 16개의 림프절이 제거되었으며 전이는 감지되지 않았습니다. 종양은 pT2b,N0,M0, II기로서 병기화하였다(표 1). 수술 1개월 후 CT 스캔에서 뚜렷한 재발이나 전이 없이 성공적인 종양 절제술이 나타났습니다(그림 8).
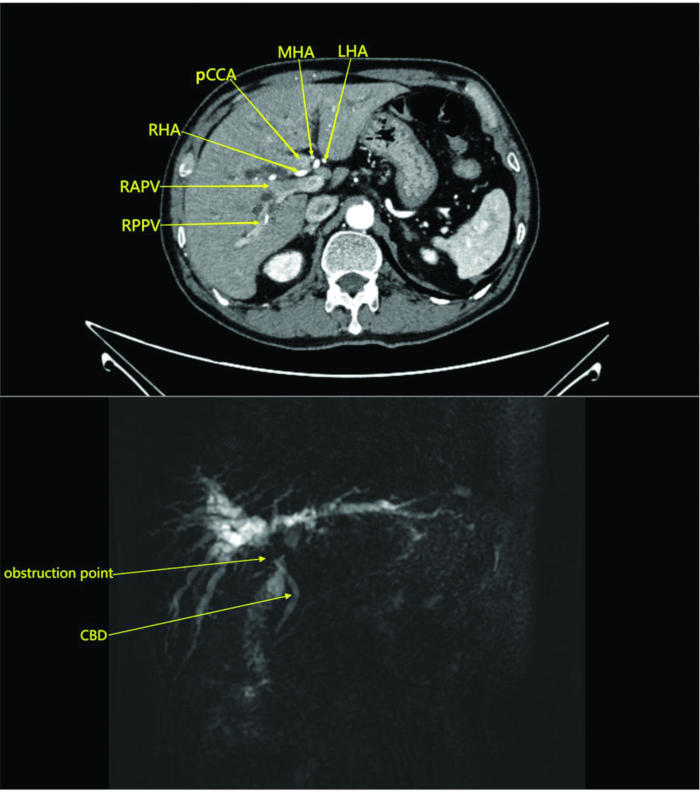
그림 1: 환자의 복부 CT 스캔 및 조영제 강화 동맥기 이미지. 이미지는 주변 혈관의 침범 없이 간문에 종괴가 있음을 보여주며, 이는 폐쇄된 담관암을 암시합니다. 약어: RAPV : 문맥의 오른쪽 전방 가지; RPPV: 문맥의 오른쪽 후방 가지; CBD : 총담관; RHA: 오른쪽 간 동맥; pCCA: 주위 담관암; MHA: 중간 간 동맥; LHA: 좌측 간 동맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 외과 의사의 위치 및 투관침 배치. 외과의는 그림과 같이 서 있으며, 투관침은 이미지에 표시된 위치에서 복막강에 배치됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
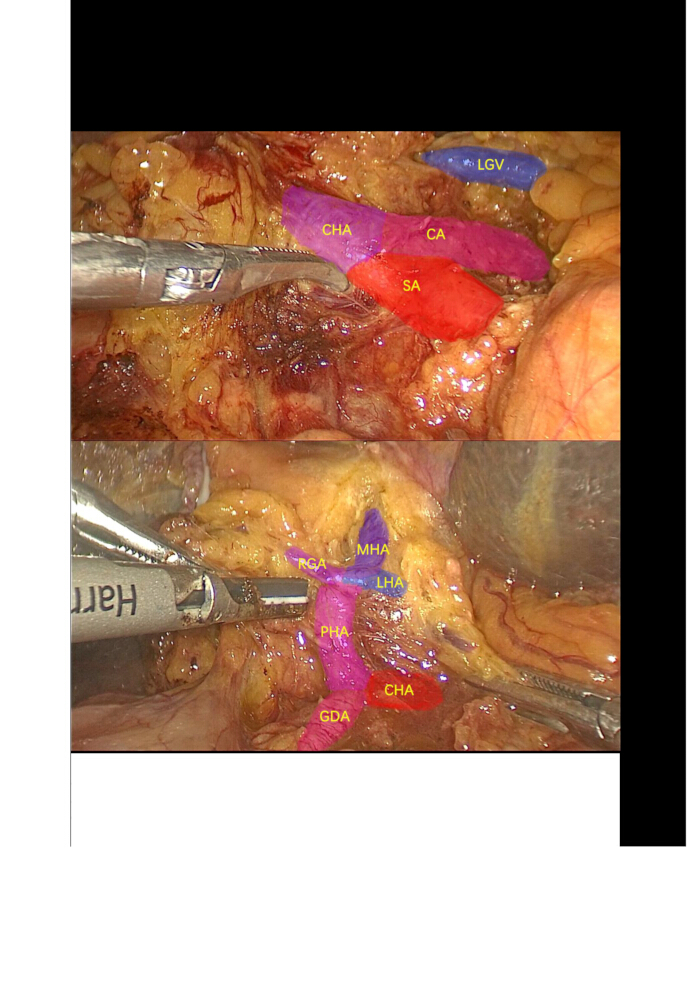
그림 3: 림프절 절제술. 체강 몸통 동맥, 비장 동맥, 총간 동맥, 위십이지장 동맥, 적절한 간 동맥, 오른쪽 위 동맥, 왼쪽 간 동맥, 중간 간 동맥 및 주변 림프절의 해부 및 격리. 약어: CA: 체강 동맥; SA: 비장 동맥; LGV: 좌측 위 정맥; CHA: 총간동맥; GDA: 위십이지장 동맥; PHA: 적절한 간 동맥; LHA: 좌측 간 동맥; MHA: 중간 간 동맥; RGA: 오른쪽 위 동맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 미상엽(caudate lobe)의 해부. 미상엽은 하대정맥(IVC)을 따라 꼬리에서 두개골 방향으로, 왼쪽에서 오른쪽으로 절개되었습니다. IVC의 오른쪽에 도달하자 왼쪽 간이 들어 올려져 IVC, paracaval branch, process branch, and Spiegel lobe가 왼쪽에서 오른쪽으로 드러났습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
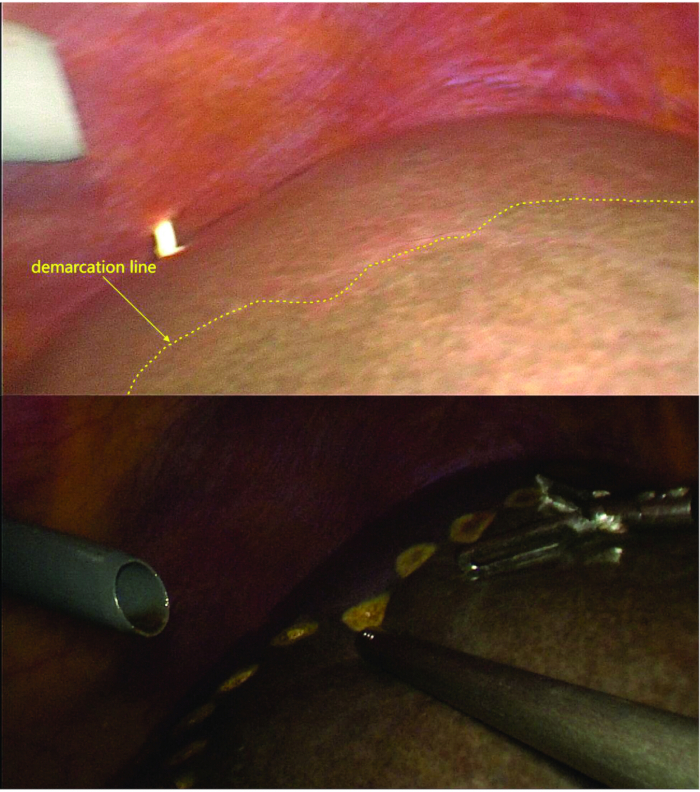
그림 5: 경계선 표시. LPV 분지, 미상엽 문맥 분지 및 짧은 간 정맥의 결찰 및 절개 후 왼쪽과 오른쪽 반쪽 사이의 경계선이 보입니다. 형광투시법에서 관찰된 경계선은 허혈선과 정렬됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
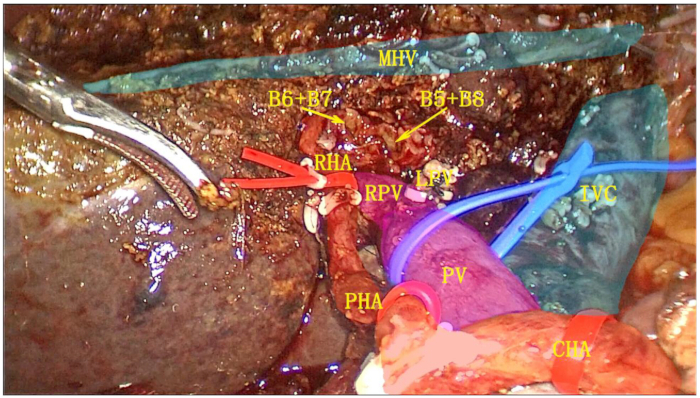
그림 6: 완전한 미상엽 절제술과 결합된 좌측 반쪽 절제술 후 수술 후 절단면. 담낭, 간십이지장 인대, 좌측 반간, 완전한 미상엽을 하나의 단위로 절제하였다. 약어: RPV: 문맥의 오른쪽 가지; IVS: 하대정맥; MHV: 중간 간 정맥; RHA: 오른쪽 간 동맥; PV: 문맥; PHA: 적절한 간 동맥; CHA: 총간동맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: pCCA 절제술의 수술 후 모습. MHV는 완전히 노출되고 오른쪽 간관의 후벽과 전방벽이 연속적인 방식으로 jejunal에 문합됩니다. 약어: MHV: 중간 간 정맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
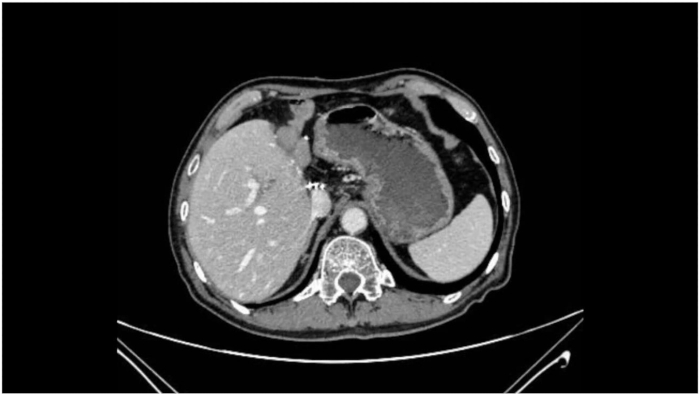
그림 8: 수술 후 CT 스캔. 수술 후 CT 스캔은 뚜렷한 재발이나 전이 없이 성공적인 종양 절제를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 작동 시간(분) | 360 |
| 수술 중 출혈(mL) | 400 |
| 수술 중 수혈(mL) | 1000 |
| PV 폐색 시간(분) | 60 |
| 첫 번째 flatus (h) | 72 |
| 첫 번째 수술 후 유동식이(일수) | 3 |
| 수술 후 입원 기간(일수) | 14 |
| 수술 후 합병증(예/아니오) | 아니요 |
| 출혈(예/아니오) | 아니요 |
| 담즙 누출(예/아니오) | 아니요 |
| 복부 감염 (예/아니오) | 아니요 |
| 절개 감염 (예/아니오) | 아니요 |
| 병리학적 결과 | 담즙 선암(活食) |
| 분화 | 온화한 |
| TNM 스테이지 | pT2bN0M0 |
| AJCC 스테이지 | 제2장 |
표 1: 환자의 수술 결과.
토론
pCCA는 담관에서 흔히 발생하는 악성 종양으로, 근치적 외과적 절제술이 유일하게 잠재적인 치료법이다2. pCCA에 대한 전통적인 근치적 수술은 일반적으로 20-30cm의 복부 절개가 필요하므로 심각한 외과적 외상이 발생합니다. 절개 부위가 크면 수술 후 상당한 통증이 발생하여 환자의 편안함과 회복에 영향을 미쳐 입원 기간이 연장되는 경우가 많다 5,6,7. 국소 담관 절제술과 담도-장 문합술을 받을 수 있는 일부 I형 pCCA를 제외하고, 완전한 미상엽 절제술을 포함한 다른 유형의 pCCA는 간 절제가 필요합니다11. 그러나 개복 수술의 시야는 주로 외과의의 직접적인 시각화에 의존하며, 이는 특히 깊은 구조를 다룰 때 제한적입니다. 대조적으로, 복강경 기술은 배율 및 다양한 각도에서 직접 시각화를 가능하게 하여 해부학적 구조를 쉽게 식별하고 보다 정확하고 안전한 작업을 가능하게 합니다. 또한 복강경 기술은 최소 침습적 탐색을 가능하게 하여 pCCA17의 잠재성 전이가 있는 환자에서 불필요한 복강절개술을 피할 수 있습니다.
연구에 따르면 간 및 담도 수술에서 복강경 검사는 수술 전후 합병증 감소, 입원 기간 단축, 빠른 회복과 같은 잠재적인 이점을 제공합니다18,19. 복강경 기술과 기구의 지속적인 발전으로 pCCA에 대한 복강경 근치적 수술이 점차 임상적으로 시행되고 있습니다. 2011년, Hong Yu 등은 14건의 I형 및 II형 pCCA20 사례에 대한 복강경 근치적 수술을 처음으로 보고했습니다. 2020년, Ratti 등[21]은 성향 점수 매칭 분석을 통해 개복 수술과 최소 침습 수술(MIS) 간의 비교 가능성에 대한 최초의 증거를 제공했습니다. 잘 수행된 이 연구에서 이 연구는 개복 수술과 복강경 수술 간에 유사한 결과를 보여주었다21. 지난 10년 동안 pCCA에 대한 복강경 근치적 수술에 대한 보고가 있었지만 대부분은 근거가 불충분한 후향적 연구였습니다. 현재 지침에서는 일부 pCCA에 대해 복강경 검사와 생검을 권장하고 있다17. 연구에 따르면 pCCA에 대한 R0 절제율, 전체 생존율(OS), 무병 생존율(DFS) 및 개복 및 복강경 근치적 수술 간의 합병증에 유의한 차이가 없는 것으로 나타났습니다 22,23,24. 또한 복강경 형광 이미징 기술의 도입으로 수술의 정밀도와 안전성이 더욱 향상되었습니다. 이 기술은 조직에 특이적으로 분포된 형광 염료를 사용하여 형광 카메라 시스템을 통해 실시간 이미징을 제공합니다. 이를 통해 외과의는 종양과 정상 조직의 경계를 보다 명확하게 구분할 수 있다25,26. 해부학적 간 절제술에서 형광 이미징 기술은 외과의가 간 절제 절제술의 경계를 보다 정확하게 묘사하는 데 도움이 됩니다. 이는 기존 영상에 비해 표재성 간 병변에 대한 더 높은 검출률을 보여주며, 이에 따라 절제의 철저성과 R0 절제율을 증가시켜 궁극적으로 수술의 종양학적 근치성을 향상시킵니다27,28. 그러나 간경변 환자에서는 위양성 비율이 더 높고 형광 경계 염색이 발생할 수 있습니다. 간담도 외과 의사들이 이 분야에 대한 연구를 계속하고 경험을 쌓으면서 이 수술 접근법의 타당성과 안전성이 더욱 검증되었습니다.
IIIb형 pCCA에 대한 전통적인 근치적 수술은 완전한 미상엽 절제술 및 표준화된 림프절 절제술과 결합된 좌측 편간 절제술을 포함합니다. 접근 방식은 일반적으로 왼쪽 및 오른쪽 접근 방식으로 나뉩니다. 좌측 접근법은 먼저 총간동맥에 인접한 림프절을 절제하고, 그 다음에는 간십이지장 인대와 췌장의 뒤쪽 가장자리에 있는 림프절을 절제하는 것입니다. 우측 접근법은 췌장 뒤쪽 가장자리에 있는 림프절에서 시작하여 간십이지장 인대 림프절과 총간동맥에 인접한 림프절이 뒤따릅니다. 절제 순서는 복강경 수술의 특성과 외과 의사의 습관에 맞게 조정할 수 있으며, 수술 중 해부학적 구조를 기반으로 적절하고 표준화된 국소 림프절 및 신경총 절제 순서를 선택할 수 있습니다.
이 환자의 경우, 수술 전 영상에서 림프절 전이의 징후가 나타나지 않았습니다. 따라서, 우리는 기존의 좌측 접근법을 채택하여, 총간동맥에 인접한 림프절, 간십이지장 인대, 그리고 췌장의 뒤쪽 가장자리를 꼬리 쪽에서 두개골 쪽으로 순차적으로 절개했다. 원위 담관 가장자리를 절제하여 수술 중 동결 절편 병리를 위해 보냈고, 그 결과 음성 가장자리가 확인되었습니다. 그런 다음 완전한 미상엽 절제술과 함께 좌측 편절제술을 시행하고 근위 담관 가장자리를 절제했는데, 이는 수술 중 동결 절제 병리학에서도 음의 마진을 보여 R0 절제를 달성했습니다.
연구에 따르면 R0 절제술을 받은 pCCA 환자는 R1 절제술을 받은 환자에 비해 OS와 DFS가 유의하게 우수합니다. 현재 지침에서는 또한 완전한 미상엽 절제술 및 표준화된 림프절 절제술과 결합된 분절 간 절제술을 통해 R0 절제를 달성하는 것이 중요하다고 지적합니다. 그러나 기술적 어려움과 근거 불충분으로 인해 현재 소수의 대규모 간담도 센터에서만 pCCA에 대한 복강경 근치적 수술을 시행하고 있으며, 대부분의 보고는 동부 국가에서 나왔다22. 또한 이 기술을 개발하는 초기 단계에서는 더 긴 작동 시간과 가파른 학습 곡선이 필요한데, 이는 이 기술의 한계입니다. 현재로서는 외과의가 이 복잡한 절차를 마스터하는 데 필요한 시간과 수술 횟수를 나타내는 연구는 없습니다. 유일한 지침은 중국의 복강경 담관암의 복강경 근치적 절제술의 운영 규범에 관한 전문가 그룹(Expert Group on Operational Norms of Laparoscopic Radical Resection of Perihilar Cholangiocarcinoma)에서 나온 것으로, 복강경 간 절제술과 복강경 췌장 십이지장 절제술을 수행하기 위한 학습 곡선에는 각각 50건 이상의 사례가 포함되어야 한다고 제안합니다. 기존 데이터는 한 기법이 다른 기법보다 우수하다는 것을 입증하거나 결과를 개방형 기법과 비교하기에는 여전히 불충분합니다. 그러므로, 주요 간담도 센터의 최소 침습 외과 전문의로 구성된 전문 팀이 학습 곡선을 극복한 후 적합한 증례를 선택적으로 선택할 것을 권장합니다(pCCA의 표준 복강경 또는 개방 근치적 절제술에 대한 금기 사항이 없고 문맥 또는 간동맥의 침범이 없음). 외과의는 IIIb형 복강경 시술로 진행하기 전에 먼저 I형 및 II형 pCCA에 대한 복강경 근치적 수술을 시도해야 합니다. 이 접근법은 안전한 수술 후 결과, 충분한 종양 절제술, 잠재적 합병증의 적절한 식별 및 관리를 보장하는 데 도움이 됩니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 논문은 중국 국가자연과학재단(82060454), 중국 장시성의 핵심 연구 개발 프로그램(20203BBGL73143), 장시성 고수준 및 고기술 선도 인재 양성 프로젝트(G/Y3035)의 자금 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 5-mm trocar | CANWELL MEDICAL Co., LTD | 179094F | Sterile, ethylene oxide sterilized, disposable |
| 12-mm trocar | CANWELL MEDICAL Co., LTD | NB12STF | Sterile, ethylene oxide sterilized, disposable |
| Absorbable Sutures | America Ethicon Medical Technology Co., LTD | W8557/W9109H/VCPB839D | Sterile, ethylene oxide sterilized, disposable |
| Alligaclip Absorbable Ligating Clip | Hangzhou Sunstone Technology Co., Ltd. | K12 | Sterile, ethylene oxide sterilized, disposable |
| Endoscopic linear cutting stapler | America Ethicon Medical Technology Co., LTD | ECR60W/PSEE60A | Sterile, ethylene oxide sterilized, disposable |
| Non-absorbable polymer ligature clip | Greiner Bio-One Shanghai Co., Ltd. | 0301-03M04/0301-03L04/0301-03ML02 | Sterile, ethylene oxide sterilized, disposable |
| NonAbsorbable Sutures | America Ethicon Medical Technology Co., LTD | EH7241H/EH7242H | Sterile, ethylene oxide sterilized, disposable |
| Ultrasonic scalpel | America Ethicon Medical Technology Co., LTD | HARH36 | Sterile, ethylene oxide sterilized, disposable |
참고문헌
- Klatskin, G. Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis: An unusual tumor with distinctive clinical and pathological features. Am J Med. 38 (2), 241-256 (1965).
- Cillo, U., et al. Surgery for cholangiocarcinoma. Liver Int. 39 Suppl 1 (Suppl Suppl 1), 143-155 (2019).
- Jingdong, L., et al. Minimally invasive surgery for hilar cholangiocarcinoma: A multicenter retrospective analysis of 158 patients. Surg Endosc. 35 (12), 6612-6622 (2021).
- Vogel, A., et al. Biliary tract cancer: Esmo clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 34 (2), 127-140 (2023).
- Giannini, A., et al. The great debate: Surgical outcomes of laparoscopic versus laparotomic myomectomy. A meta-analysis to critically evaluate current evidence and look over the horizon. Eur J Obstet Gynecol Reprod Biol. 297, 50-58 (2024).
- Hakkenbrak, N. A. G., Jansma, E. P., Van Der Wielen, N., Van Der Peet, D. L., Straatman, J. Laparoscopic versus open distal gastrectomy for gastric cancer: A review and meta-analysis. Surgery. 171 (6), 1552-1561 (2022).
- Macacari, R. L., et al. Laparoscopic vs. Open left lateral sectionectomy: An update meta-analysis of randomized and non-randomized controlled trials. Int J Surg. 61, 1-10 (2019).
- Zhou, Y., Cai, P., Zeng, N. Augmented reality navigation system makes laparoscopic radical resection of hilar cholangiocarcinoma type b more precise and safe. Gastrointest Surg. 28 (7), 1212-1213 (2024).
- Hu, H. J., et al. Hepatic artery resection for bismuth type iii and iv hilar cholangiocarcinoma: Is reconstruction always required. J Gastrointest Surg. 22 (7), 1204-1212 (2018).
- Rushbrook, S. M., et al. British Society of Gastroenterology guidelines for the diagnosis and management of cholangiocarcinoma. Gut. 73 (1), 16-46 (2023).
- Xiong, Y., Jingdong, L., Zhaohui, T., Lau, J. A consensus meeting on expert recommendations on operating specifications for laparoscopic radical resection of hilar cholangiocarcinoma. Front Surg. 8, 731448(2021).
- Benson, A. B., et al. Hepatobiliary cancers, version 2.2021, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 19 (5), 541-565 (2021).
- Kokudo, N., Ishizawa, T. Clinical application of fluorescence imaging of liver cancer using indocyanine green. Liver Cancer. 1 (1), 15-21 (2012).
- Terasawa, M., et al. Applications of fusion-fluorescence imaging using indocyanine green in laparoscopic hepatectomy. Surg Endosc. 31 (12), 5111-5118 (2017).
- Pringle, J. H. V. Notes on the arrest of hepatic hemorrhage due to trauma. Ann Surg. 48 (4), 541-549 (1908).
- Otsuka, S., et al. Efficacy of extended modification in left hemihepatectomy for advanced perihilar cholangiocarcinoma: Comparison between H12345'8'-B-MHV and H1234-B. Ann Surg. 277 (3), e585-e591 (2023).
- Roth, G. S., et al. Biliary tract cancers: French national clinical practice guidelines for diagnosis, treatments and follow-up (TNCD, SNFGE, FFCD, UNICANCER, GERCOR, SFCD, SFED, AFEF, SFRO, SFP, SFR, ACABI, ACHBPT). Eur J Cancer. 202, 114000(2024).
- Abu Hilal, M., et al. The Southampton consensus guidelines for laparoscopic liver surgery: From indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Tang, W., et al. Minimally invasive versus open radical resection surgery for hilar cholangiocarcinoma: Comparable outcomes associated with advantages of minimal invasiveness. PLoS One. 16 (3), e0248534(2021).
- Yu, H., Wu, S. -D., Chen, D. -X., Zhu, G. Laparoscopic resection of bismuth type I and II hilar cholangiocarcinoma: An audit of 14 cases from two institutions. Dig Surg. 28 (1), 44-49 (2011).
- Ratti, F., et al. Perihilar cholangiocarcinoma: Are we ready to step towards minimally invasiveness. Updates Surg. 72 (2), 423-433 (2020).
- Berardi, G., et al. Minimally invasive surgery for perihilar cholangiocarcinoma: A systematic review of the short- and long-term results. Cancers (Basel). 15 (11), 3048(2023).
- Xiong, F., Peng, F., Li, X., Chen, Y. Preliminary comparison of total laparoscopic and open radical resection for hepatic hilar cholangiocarcinoma a single-center cohort study. Asian J Surg. 46 (22), 856-862 (2023).
- Qin, T., et al. The long-term outcome of laparoscopic resection for perihilar cholangiocarcinoma compared with the open approach: A real-world multicentric analysis. Ann Surg Oncol. 30 (3), 1366-1378 (2023).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancers. 115 (11), 2491-2504 (2009).
- Xu, C., Cui, X., Jia, Z., Shen, X., Che, J. A meta-analysis of short-term and long-term effects of indocyanine green fluorescence imaging in hepatectomy for liver cancer. Photodiagnosis Photodyn Ther. 42, 103497(2023).
- Tangsirapat, V., et al. Surgical margin status outcome of intraoperative indocyanine green fluorescence-guided laparoscopic hepatectomy in liver malignancy: A systematic review and meta-analysis. BMC Surg. 24 (1), 181(2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유