Method Article
الاستئصال الجذري الكامل بالمنظار لسرطان القنوات الصفراوية الحوائقي من النوع IIIb
In This Article
Summary
سرطان القنوات الصفراوية الحضيضي (pCCA) هو ورم شديد الخبيث والعدوانية ، مع كون الاستئصال الجذري هو العلاج العلاجي الوحيد المتاح. مع التقدم المستمر في تقنيات وأدوات التنظير البطني ، تعتبر الجراحة الجذرية بالمنظار ل pCCA آمنة ومجدية من الناحية الفنية. ومع ذلك ، نظرا للتعقيد العالي للجراحة ونقص الدعم السريري القائم على الأدلة ، يتم إجراء الجراحة الجذرية بالمنظار للنوع IIIb pCCA فقط في عدد قليل من مراكز الكبد الصفراوية الكبيرة. توصي الإرشادات الحالية باستئصال نصف العظم الأيسر جنبا إلى جنب مع استئصال الفص المذنبي الكلي واستئصال العقد اللمفية المعياري من النوع IIIb pCCA القابل للاستئصال. لذلك ، في هذه المقالة ، نقدم وصفا مفصلا للخطوات الجراحية والنقاط الفنية لاستئصال نصف الصدر الأيسر الكامل بالمنظار جنبا إلى جنب مع استئصال الفص المذنب الكلي ، واستئصال العقد اللمفاوية الإقليمية ، ومفاغرة القناة الكبدية اليمنى في المرضى الذين يعانون من النوع IIIb pCCA ، باستخدام تقنية الملاحة الفلورية لتعزيز الدقة والسلامة الجراحية. من خلال الالتزام بالإجراءات الجراحية الموحدة والتقنيات الدقيقة أثناء الجراحة ، نقدم وسيلة فعالة لتحسين نتائج المرضى.
Abstract
سرطان القنوات الصفراوية الحضيضي (pCCA) هو ورم شديد الخبيث والعدوانية ، مع كون الاستئصال الجذري هو العلاج العلاجي الوحيد المتاح. مع التقدم المستمر في تقنيات وأدوات التنظير البطني ، تعتبر الجراحة الجذرية بالمنظار ل pCCA آمنة ومجدية من الناحية الفنية. ومع ذلك ، نظرا للتعقيد العالي للجراحة ونقص الدعم السريري القائم على الأدلة ، يتم إجراء الجراحة الجذرية بالمنظار للنوع IIIb pCCA فقط في عدد قليل من مراكز الكبد الصفراوية الكبيرة. توصي الإرشادات الحالية باستئصال نصف العظم الأيسر جنبا إلى جنب مع استئصال الفص المذنبي الكلي واستئصال العقد اللمفية المعياري من النوع IIIb pCCA القابل للاستئصال. لذلك ، في هذه المقالة ، نقدم وصفا مفصلا للخطوات الجراحية والنقاط الفنية لاستئصال نصف الصدر الأيسر الكامل بالمنظار جنبا إلى جنب مع استئصال الفص المذنب الكلي ، واستئصال العقد اللمفاوية الإقليمية ، ومفاغرة القناة الكبدية اليمنى في المرضى الذين يعانون من النوع IIIb pCCA ، باستخدام تقنية الملاحة الفلورية لتعزيز الدقة والسلامة الجراحية. من خلال الالتزام بالإجراءات الجراحية الموحدة والتقنيات الدقيقة أثناء الجراحة ، نقدم وسيلة فعالة لتحسين نتائج المرضى.
Introduction
سرطان القنوات الصفراوية حول الحضجة (pCCA) ، المعروف أيضا باسم ورم كلاتسكين ، تم وصفه لأول مرة بواسطة جيرالد كلاتسكين وهو ورم خبيث يحدث في ظهارة القناة الصفراوية عند التقاء القنوات الكبدية اليمنى واليسرى1. هذا المرض شديد الخبيث والعدوانية ، وغالبا ما يظهر مع اليرقان والتهاب الأقنية الصفراوية في مراحل متقدمة. على الرغم من التقدم في التشخيص والعلاج ، لا يزال تشخيص pCCA ضعيفا ، مع استمرار الاستئصال الجراحي الجذري هو النهج الوحيد المحتمل. تتضمن هذه العمليات الجراحية عادة استئصال الكبد على نطاق واسع واستئصال القناة الصفراوية واستئصال العقد اللمفيةالموضعية 2. الهدف من الجراحة هو تحقيق استئصال R0 ، مما يحسن بشكل كبير معدلات بقاء المريضعلى قيد الحياة 3،4. ومع ذلك ، فإن التشريح المعقد لمنطقة النقير وقرب الورم من هياكل الأوعية الدموية الحيوية يجعل هذه العمليات الجراحية صعبة للغاية.
في السنوات الأخيرة ، أحدث ظهور تقنية التنظير البطني ثورة في جراحة الأورام ، مما يوفر مزايا محتملة مثل تقليل المضاعفات المحيطة بالجراحة ، والإقامة القصيرة في المستشفى ، والتعافي الأسرع5،6،7. ومع ذلك ، فإن تطبيق الجراحة بالمنظار في pcca ، خاصة بالنسبة لحالات النوع IIIb ، لا يزال محدودا ، مع توفر عدد قليل فقط من التقارير3،8. ويرجع ذلك في المقام الأول إلى الصعوبة الفنية في تحقيق هوامش كافية وإجراء عمليات إعادة بناء معقدة للقنوات الصفراوية والأوعية الدموية بالمنظار9. توصي الإرشادات الحالية باستئصال نصف العظم الأيسر جنبا إلى جنب مع استئصال الفص المذنب الكلي واستئصال العقد اللمفية المعياري للنوع IIIb pCCA4،10،11،12. ومع ذلك ، لا تزال الأدلة التي تدعم استخدام طرق التنظير البطني لهذه الجراحة الواسعة النطاق تتراكم.
تقدم هذه الدراسة الاستئصال الجذري بالمنظار الكامل للنوع IIIb pCCA. نهدف إلى تفصيل تقنيات هذه الجراحة وخطواتها الرئيسية ، بما في ذلك استئصال نصف الكبد الأيسر ، واستئصال الفص المذنب الكلي ، واستئصال العقد اللمفية الإقليمية ، وفغر الكبد الصائمي Roux-en-Y. من خلال مشاركة هذا البروتوكول ، نأمل أن نساهم في الأدلة التي تدعم جدوى وسلامة طرق التنظير البطني في علاج النوع IIIb pCCA ، مما يؤدي في النهاية إلى تحسين نتائج المرضى.
Protocol
تتبع الدراسة لجنة أخلاقيات البحث البشري في المستشفى الثاني التابع لجامعة نانتشانغ. تم الحصول على موافقة خطية مستنيرة من المريض قبل الجراحة.
ملاحظة: كان المريض رجلا يبلغ من العمر 65 عاما يعاني من شكوى رئيسية من "اليرقان العام والحكة لمدة أسبوعين". كشف فحص التصوير المقطعي المحوسب (CT) في مستشفى خارجي عن كتلة القناة الصفراوية المحيطة بالكبد مع تمدد القناة الصفراوية داخل الكبد. الأدوات والمعدات الجراحية المستخدمة مدرجة في جدول المواد.
1. التحضير قبل الجراحة
- إجراء اختبارات الدم الروتينية قبل الجراحة ، بما في ذلك تعداد الدم الكامل ، واختبارات وظائف الكبد والكلى ، وملف التخثر ، وعلامات الورم في المصل.
- اسحب عينات الدم وأرسلها إلى المختبر لإجراء اختبارات الدم المختلفة والإبلاغ عن النتائج.
ملاحظة: أظهرت اختبارات وظائف الكبد ارتفاعا في البيليروبين الكلي (230.8 ميكرولتر / لتر) وانخفاضا في الألبومين (35.7 جم / لتر). كشفت اختبارات علامات الورم في المصل عن ارتفاع مستضد الكربوهيدرات المستضد الكربوهيدرات 199 (184.46 وحدة / مل) 4،12.
- اسحب عينات الدم وأرسلها إلى المختبر لإجراء اختبارات الدم المختلفة والإبلاغ عن النتائج.
- إجراء مخطط كهربية القلب قبل الجراحة (ECG) ، والتصوير المقطعي المحوسب للبطن ، والتصوير بالرنين المغناطيسي (MRI) للبطن ، والتصوير المقطعي المحوسب للصدر ، والفحوصات الأخرى ذات الصلة4،12.
ملاحظة: في هذه الدراسة ، خضع المريض لفحص بالأشعة المقطعية للبطن مع وبدون تباين في قسم الأشعة. أظهر الفحص كتلة في المنطقة الحضيضية دون تورط الأوعية المحيطة ، مما يشير إلى سرطان القنوات الصفراوية مع انسداد (الشكل 1). أظهر التصوير بالرنين المغناطيسي مع وبدون تباين وتصوير البنكرياس والقنوات الصفراوية بالرنين المغناطيسي كتلة في القناة الصفراوية المحيطة وحمة الكبد المجاورة مع توسع القناة الصفراوية داخل الكبد وتضخم الغدد الليمفاوية المحيطة ، مما يشير إلى آفة ورمية (الشكل 1).
2. الإجراء الجراحي
- إدارة التخدير العام مع التنبيب الرغامي والعوامل الوريدية والاستنشاقية. ضع المريض مستلقا مع رفع الرأس والساقين متباعدتين. إجراء التطهير الروتيني باستخدام محلول بوفيدون اليود.
ملاحظة: يقف الجراح الأساسي على الجانب الأيمن للمريض ، والمساعد على الجانب الأيسر ، وحامل الكاميرا بين ساقي المريض (الشكل 2). - قم بعمل شق طولي بطول 1 سم تقريبا عند السرة ، وأدخل إبرة Veress ، وقم بنفخ ثاني أكسيد الكربون2 للحفاظ على ضغط داخل البطن يبلغ 12 مم زئبق. أدخل مبزل 10 مم ومنظار البطن 30 درجة . بعد التأكد من عدم وجود ورم خبيث بعيد عن طريق تنظير البطن ، ضع المبازل الجراحية كما هو موضح في الشكل 2.
- قم بتشريح الشريان الكيسي والقناة الكيسية ، ثم تابع الإزالة الرجعية للمرارة. استخدم مشرطا بالموجات فوق الصوتية لتشريح وتعبئة وتعليق الشريان الكبدي المشترك (CHA) والشريان المعدي والاثني عشر (GDA) والشريان الكبدي السليم (PHA) والشرايين الكبدية اليسرى (LHA) (إعطاء الشريان الكبدي الأوسط (MHA)) والشرايين الكبدية اليمنى (RHA). ربط وتقسيم الشرايين المعدية اليمنى (RGA) و LHA (الشكل 3).
- قم بعبور القناة الصفراوية المشتركة (CBD) عند الحد العلوي للبنكرياس وأرسل الهامش البعيد لأمراض القسم المجمد لتأكيد الهوامش السلبية.
- استخدم مشرطا بالموجات فوق الصوتية لتشريح الوريد البابي (PV) وتعبئته وتعليقه. قم بإزالة القناة الصفراوية خارج الكبد ومجموعات العقدة الليمفاوية 8 و 12 و 13 على طول الكتلة الكهروضوئية باتجاه النقير الكبدي ، مما يحقق الهيكل العظمي للرباط الكبدي والاثني عشر.
- ربط وتقسيم الفرع الأيسر من الوريد البابي (LPV) وفروع الوريد البابي للفص المذنب.
- قم بتشريح الأربطة الكبدية اليسرى وتقسيم الأوردة الكبدية القصيرة للفص المذنبة ، مع تحديد خط الترسيم (الخط الإقفاري) بوضوح بين فص الكبد الأيمن والأيسر.
- بعد تحديد خط الترسيم ، تأكد من أن حدود التألق تتطابق مع الخط الإقفاري باستخدام التصوير الفلوري (الشكل 4 والشكل 5).
ملاحظة: يتم استخدام طريقة تلطيخ سلبية هنا ، مع إعطاء الإندوسيانين الأخضر عن طريق الحقن الوريدي المحيطي بجرعة 0.25 مجم13،14.
- قم بإغلاق الكهروضوئية الرئيسية بشكل متقطع باستخدام مناورة برينجل15. استخدم مشرطا بالموجات فوق الصوتية لتمرير حمة الكبد على طول خط الترسيم ، ثم على طول مستوى الوريد الكبدي الأوسط (MHV) ، مما يضمن تقسيم فروعها V4b و V4a.
ملاحظة: قد يفكر المرضى الذين يعانون من هامش كبد إيجابي في الخضوع لاستئصال الكبد الأيسر الموسع (LH) ، والذي يتضمن استئصال كامل للجذع الرئيسي لمشغل المفاصل الكبير والأجزاء اليسرى من الجزأين 5 و 8. قد يحسن هذا النهج معدلات البقاءعلى قيد الحياة 16. - قم بعبور القناة الكبدية اليمنى على بعد حوالي 1 سم من الورم وأرسل الهامش القريب لأمراض القسم المجمد لتأكيد الهوامش السلبية.
- إجراء تحليل القسم المجمد أثناء الجراحة لهامش القناة الكبدية القريبة عدة مرات حسب الحاجة لضمان استئصال R0. إذا كانت القناة الكبدية اليمنى مقسمة على نطاق واسع ، ففكر في إعادة بناء القناة الصفراوية أو فغر الكبد الصائمي المزدوج للقنوات الصفراوية الأمامية اليمنى والخلفية اليمنى.
- قم بتحويل الوريد الكبدي الأيسر (LHV) باستخدام دباسة القاطع الخطي بالمنظار (ENDO-GIA). قم باستئصال نصف الكبد الأيسر بالكامل والفص المذنبي بالكامل ، وضع العينة في كيس استرجاع (الشكل 6).
- معبر الصائم حوالي 20 سم بعيدا عن رباط Treitz. ارفع الحلقة البعيدة الخلفية إلى القولون للحصول على مفاغرة من طرف إلى آخر مع القناة الكبدية اليمنى ، باستخدام خيوط مستمرة للجدران الأمامية والخلفية (الشكل 7). إجراء فغر الصائم الصائمي جنبا إلى جنب على بعد حوالي 45 سم من القناة الكبدية اليمنى.
- ري تجويف البطن بالماء المقطر المعقم. افحص المجال الجراحي بعناية بحثا عن النزيف النشط وتسربات الصفراء وإصابات الفرع الجانبي المعدي المعوي. ضع أنابيب التصريف في قسم الكبد الأيسر وثقبة وينسلو.
- قم بتمديد الشق السري بحوالي 5 سم وقم بتشريح جدار البطن طبقة تلو الأخرى لاسترداد العينة. تحقق من عدد الأدوات الجراحية والشاش. قم بإزالة المبازل تحت الرؤية المباشرة. أغلق شق جدار البطن بخيوط قابلة للامتصاص 2-0 لإكمال الجراحة.
3. رعاية ما بعد الجراحة
- نقل المريض بأمان إلى الجناح بعد استعادة المريض للوعي.
- تطبيق المضادات الحيوية عن طريق الوريد والأوميبرازول والدعم الغذائي بعد الجراحة.
- ابدأ نظاما غذائيا سائلا في اليوم الثالث بعد الجراحة بعد خروج المريض للغازات.
- قم بإزالة أنابيب تصريف البطن في الأيام4 و 13بعد الجراحة .
النتائج
تقدمت الجراحة بسلاسة ، وأظهر علم أمراض القسم المجمد أثناء الجراحة هوامش سلبية في كل من القنوات الصفراوية البعيدة والقريبة. طوال العملية ، ظلت العلامات الحيوية للمريض مستقرة ، وكان التخدير فعالا. استمرت العملية 360 دقيقة ، مع وقت انسداد PV يبلغ إجماليه 60 دقيقة (15 دقيقة + 5 دقائق × 4 مرات). كان فقدان الدم أثناء الجراحة 400 مل ، وتلقى المريض وحدتين من خلايا الدم الحمراء المحرومة للكريات البيض و 600 مل من البلازما المجمدة الطازجة. لوحظ انتفاخ انتفاخ بعد الجراحة بعد 72 ساعة من الجراحة. لم تكن هناك مضاعفات ، مثل نزيف البطن أو تسرب الصفراء أو عدوى البطن أو عدوى الشق. كانت الإقامة في المستشفى بعد الجراحة 14 يوما. أظهر التحليل النسيجي المرضي المضمن في البارافين بعد الجراحة سرطان غدي صفراوي متمايز بشكل معتدل يشمل أنسجة الكبد المجاورة ، مع عدم وجود غزو وعائي محدد وهوامش سلبية للكبد. تمت إزالة ستة عشر عقدة ليمفاوية ، مع عدم اكتشاف ورم خبيث. تم تنظيم الورم على أنه pT2bN0M0 ، المرحلة الثانية (الجدول 1). أظهر الفحص المقطعي المحوسب بعد شهر واحد من الجراحة استئصال الورم الناجح مع عدم وجود تكرار واضح أو ورم خبيث (الشكل 8).
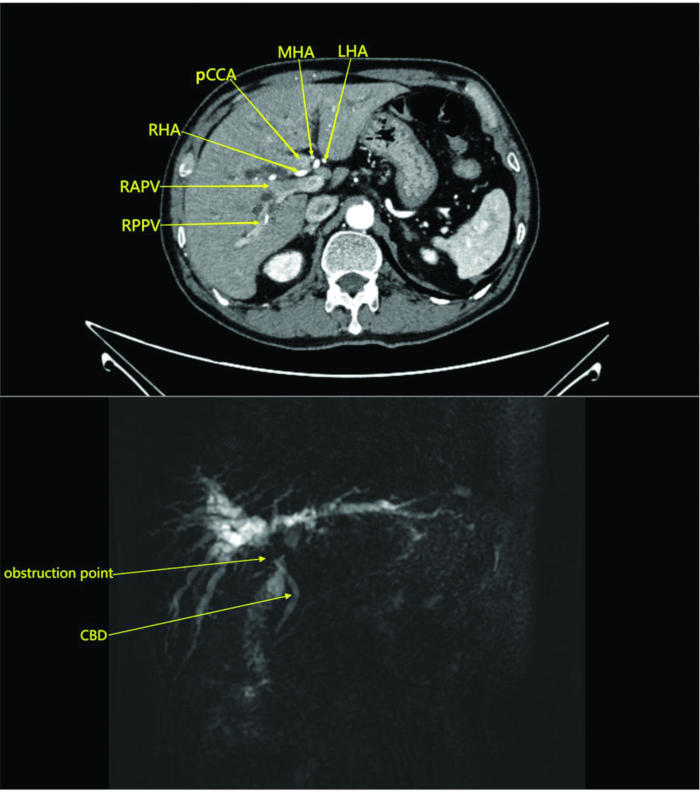
الشكل 1: التصوير المقطعي المحوسب للبطن وصور المرحلة الشريانية المحسنة بالتباين للمريض. تكشف الصور عن كتلة في نقير الكبد دون غزو الأوعية الدموية المحيطة ، مما يشير إلى سرطان القنوات الصفراوية مع انسداد. الاختصارات: RAPV: الفرع الأمامي الأيمن من الوريد البابي. RPPV: الفرع الخلفي الأيمن للوريد البابي. اتفاقية التنوع البيولوجي: القناة الصفراوية المشتركة. RHA: الشريان الكبدي الأيمن. pCCA: سرطان القنوات الصفراوية المحيط الأزعج; MHA: الشريان الكبدي الأوسط. LHA: الشريان الكبدي الأيسر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: وضع الجراح ووضع المبزل. يقف الجراح كما هو موضح في الشكل ، مع وضع المبازل في التجويف البريتوني في المواضع الموضحة في الصورة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
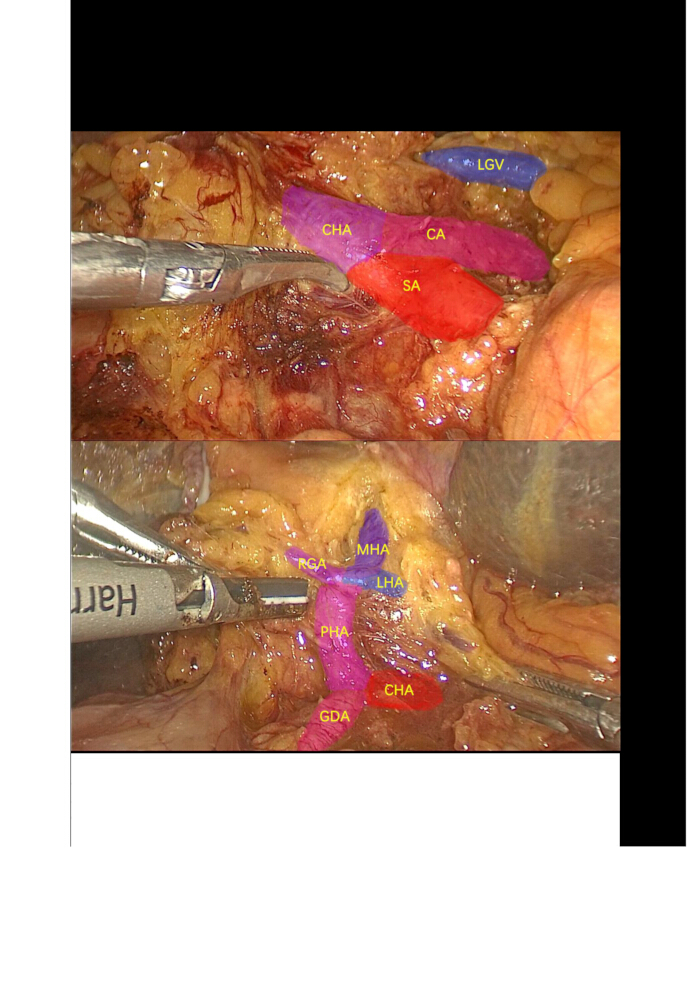
الشكل 3: تشريح العقدة الليمفاوية. تشريح وعزل الشريان الجذعي البطني ، والشريان الطحال ، والشريان الكبدي المشترك ، والشريان المعدي والاثني عشر ، والشريان الكبدي الصحيح ، والشريان المعدي الأيمن ، والشريان الكبدي الأيسر ، والشريان الكبدي الأوسط ، والغدد الليمفاوية المحيطة. الاختصارات: CA: الشريان الاضطرابات الهضمية. SA: الشريان الطحالي. LGV: الوريد المعدي الأيسر. CHA: الشريان الكبدي المشترك; GDA: الشريان المعدي والاثني عشر; PHA: الشريان الكبدي الصحيح. LHA: الشريان الكبدي الأيسر. MHA: الشريان الكبدي الأوسط. RGA: الشرايين المعدية اليمنى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تشريح الفص المذنب. تم تشريح الفص المذنبي على طول الوريد الأجوف السفلي (IVC) من الذيلية إلى اتجاه الجمجمة ومن الجانب الأيسر إلى الجانب الأيمن. عند الوصول إلى الجانب الأيمن من IVC ، تم رفع الكبد الأيسر ، مما كشف عن IVC ، وفرع paracaval ، وفرع العملية ، وفص Spiegel من اليسار إلى اليمين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
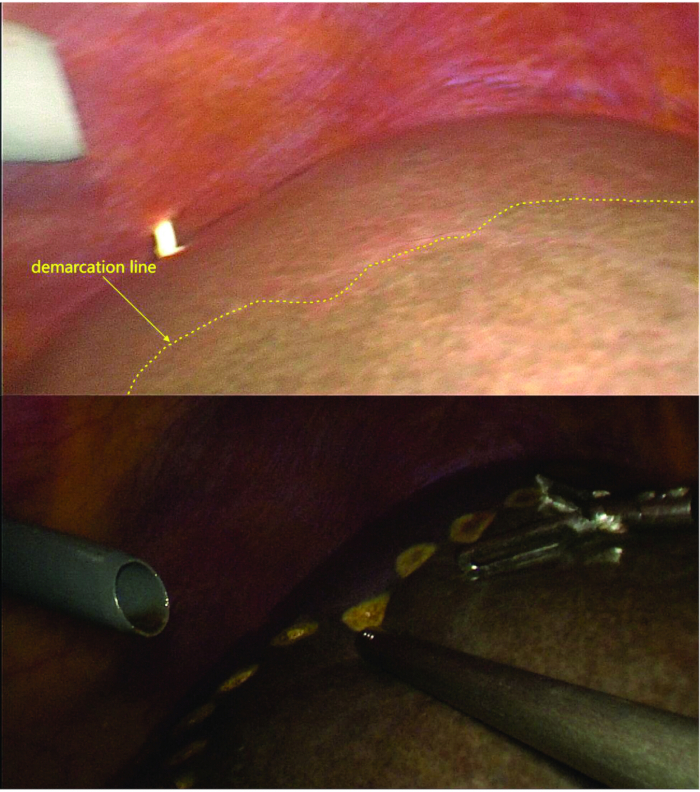
الشكل 5: وضع علامات على خط الترسيم. بعد ربط وقطع فرع LPV ، وفرع الوريد البابي للفص المذنبي ، والأوردة الكبدية القصيرة ، يكون خط الترسيم بين النصف الأيمن والأيسر مرئيا. تحت التنظير الفلوري ، يتماشى خط الترسيم الذي لوحظ مع الخط الإقفاري. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
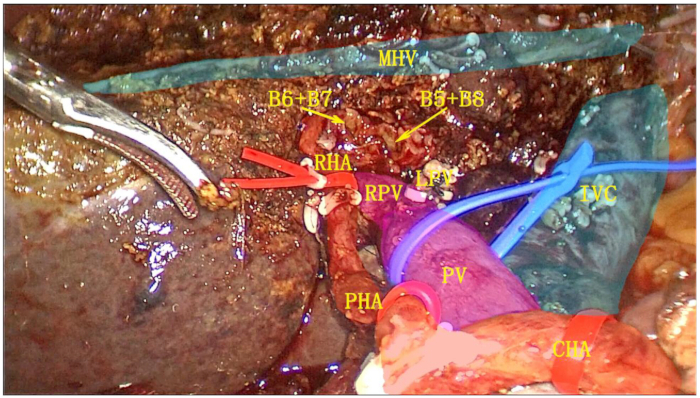
الشكل 6: سطح القطع بعد الجراحة بعد استئصال نصف النصف الأيسر جنبا إلى جنب مع استئصال الفص المذنبي الكامل. تم استئصال المرارة ، والرباط الكبدي والاثني عشر ، والكبد الأيسر ، والفص المذنبي الكامل كوحدة واحدة. الاختصارات: RPV: الفرع الأيمن من الوريد البوابي. IVS: الوريد الأجوف السفلي; MHV: الوريد الكبدي الأوسط. RHA: الشريان الكبدي الأيمن. الكهروضوئية: الوريد البوابي. PHA: الشريان الكبدي الصحيح. CHA: الشريان الكبدي المشترك. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: عرض ما بعد الجراحة لاستئصال pCCA. يتم كشف MHV بالكامل ، ويتم مفاغرة الجدران الخلفية والأمامية للقناة الكبدية اليمنى إلى الصائم بطريقة مستمرة. الاختصارات: MHV: الوريد الكبدي الأوسط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
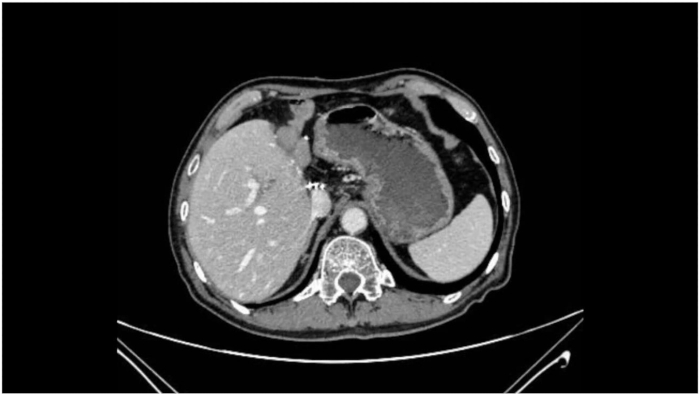
الشكل 8: التصوير المقطعي المحوسب بعد الجراحة. يوضح التصوير المقطعي المحوسب بعد الجراحة استئصال الورم بنجاح مع عدم وجود تكرار أو ورم خبيث واضح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| وقت التشغيل (دقيقة) | 360 |
| فقدان الدم أثناء الجراحة (مل) | 400 |
| نقل الدم أثناء الجراحة (مل) | 1000 |
| وقت الانسداد الكهروضوئي (دقيقة) | 60 |
| انتفاخ البطن الأول (ح) | 72 |
| أول نظام غذائي سائل بعد الجراحة (أيام) | 3 |
| الإقامة في المستشفى بعد الجراحة (أيام) | 14 |
| مضاعفات ما بعد الجراحة (نعم / لا) | لا |
| نزيف (نعم / لا) | لا |
| تسرب الصفراء (نعم / لا) | لا |
| عدوى البطن (نعم / لا) | لا |
| عدوى الشق (نعم / لا) | لا |
| النتيجة المرضية | السرطان الغدي الصفراوي |
| التمايز | المعتدل |
| مرحلة TNM | ص2 بن0م0 |
| مرحلة AJCC | الثاني |
الجدول 1: النتائج الجراحية للمريض.
Discussion
pCCA هو ورم خبيث شائع في القنوات الصفراوية ، مع كون الاستئصال الجراحي الجذري هو العلاج العلاجي الوحيد المحتمل2. تتطلب الجراحة الجذرية التقليدية ل pCCA عادة شقا في البطن من 20 إلى 30 سم ، مما يؤدي إلى صدمة جراحية كبيرة. غالبا ما تسبب الشقوق الكبيرة ألما كبيرا بعد الجراحة ، مما يؤثر على راحة المريض وتعافيه ، وبالتالي يطيل الإقامة في المستشفى5،6،7. باستثناء بعض النوع الأول من pCCA التي يمكن أن تخضع لاستئصال القناة الصفراوية الموضعية ومفاغرة القناة الصفراوية المعوية ، تتطلب الأنواع الأخرى استئصال الكبد ، بما في ذلك استئصال الفص المذنبي الكامل11. ومع ذلك ، فإن المجال البصري في الجراحة المفتوحة يعتمد بشكل أساسي على التصور المباشر من قبل الجراح ، وهو محدود ، خاصة عند التعامل مع الهياكل العميقة. في المقابل ، تسمح تقنية التنظير البطني بالتصور المباشر تحت التكبير والزوايا المتغيرة ، مما يسهل تحديد الهياكل التشريحية وتمكين عمليات أكثر دقة وأمانا. بالإضافة إلى ذلك ، تتيح تقنية التنظير البطني الاستكشاف طفيف التوغل ، مما قد يؤدي إلى تجنب استئصال البطن غير الضروري في المرضى الذين يعانون من النقائل الغامضة ل pCCA17.
أظهرت الدراسات أن تنظير البطن في جراحات الكبد والقنوات الصفراوية يوفر مزايا محتملة مثل تقليل المضاعفات المحيطة بالجراحة ، والإقامة في المستشفى لفترة أقصر ، والتعافي بشكل أسرع18،19. مع التقدم المستمر لتكنولوجيا وأدوات التنظير البطني ، تم تنفيذ الجراحة الجذرية بالمنظار ل pcca تدريجيا سريريا. في عام 2011 ، أبلغ هونغ يو وآخرون لأول مرة عن جراحة جذرية بالمنظار ل 14 حالة من النوع الأول والثاني pCCA20. في عام 2020 ، قدم Ratti et al.21أول دليل على المقارنة بين الجراحة المفتوحة والجراحة طفيفة التوغل (MIS) من خلال تحليل مطابقة درجة الميل. في هذه الدراسة التي أجريت بشكل جيد، أظهرت الدراسة نتائج مماثلة بين العمليات الجراحية المفتوحة والجراحية بالمنظار21. على مدى العقد الماضي ، كانت هناك تقارير عن الجراحة الجذرية بالمنظار ل pcca ، ولكن معظمها دراسات بأثر رجعي مع عدم كفاية الأدلة. توصي الإرشادات الحالية بالاستكشاف بالمنظار والخزعة لبعض pCCA17. أظهرت الدراسات عدم وجود فروق ذات دلالة إحصائية في معدلات استئصال R0 ، والبقاء على قيد الحياة بشكل عام (OS) ، والبقاء على قيد الحياة الخالي من الأمراض (DFS) ، والمضاعفات بين الجراحة الجذرية المفتوحة والمناظير ل pCCA22،23،24. علاوة على ذلك ، أدى إدخال تقنية التصوير الفلوري بالمنظار إلى تعزيز دقة وسلامة العمليات الجراحية. تستخدم هذه التقنية أصباغ الفلورسنت الموزعة على وجه التحديد في الأنسجة ، مما يوفر تصويرا في الوقت الفعلي من خلال نظام كاميرا فلورية. يساعد هذا الجراحين على تمييز الحدود بين الورم والأنسجة الطبيعية بشكل أكثر وضوحا25،26. في استئصال الكبد التشريحي ، تساعد تقنية التصوير الفلوري الجراحين في تحديد حدود أجزاء استئصال الكبد بشكل أكثر دقة. يوضح معدل كشف أعلى لآفات الكبد السطحية مقارنة بالتصوير التقليدي ، وبالتالي زيادة دقة الاستئصال ومعدل استئصال R0 ، مما يعزز في النهاية راديكالية الأورام للجراحة27،28. ومع ذلك ، في المرضى الذين يعانون من تليف الكبد ، يكون المعدل الإيجابي الكاذب أعلى ، ويمكن أن يحدث تلطيخ حدود التألق. مع استمرار جراحي الكبد الصفراويين في استكشاف واكتساب الخبرة في هذا المجال ، تم التحقق من جدوى وسلامة هذا النهج الجراحي.
تتضمن الجراحة الجذرية التقليدية للنوع IIIb pCCA استئصال نصف الكبد الأيسر جنبا إلى جنب مع استئصال الفص المذنبي الكامل وتشريح العقدة الليمفاوية الموحد. ينقسم النهج بشكل عام إلى نهج الجانب الأيسر والأيمن. يتضمن نهج الجانب الأيسر أولا تشريح الغدد الليمفاوية المجاورة للشريان الكبدي المشترك ، تليها الغدد الليمفاوية في الرباط الكبدي والاثني عشر والهامش الخلفي للبنكرياس. يبدأ نهج الجانب الأيمن بالغدد الليمفاوية في الحافة الخلفية للبنكرياس ، تليها الغدد الليمفاوية في الرباط الكبدي والاثني عشر والغدد الليمفاوية المجاورة للشريان الكبدي المشترك. يمكن تصميم تسلسل التشريح وفقا لخصائص الجراحة بالمنظار وعادات الجراح ، واختيار تسلسل العقدة الليمفاوية الإقليمية المناسبة والموحدة وتسلخ الضفيرة العصبية بناء على الهياكل التشريحية أثناء الجراحة.
بالنسبة لهذا المريض ، لم يكشف التصوير قبل الجراحة عن أي علامات على ورم خبيث في العقدة الليمفاوية. لذلك ، اعتمدنا نهج الجانب الأيسر التقليدي ، حيث قمنا بتشريح الغدد الليمفاوية المجاورة للشريان الكبدي المشترك ، والرباط الكبدي والاثني عشر ، والهامش الخلفي للبنكرياس من الجانب الذيلي إلى الجانب الذيلي. تم استئصال هامش القناة الصفراوية البعيدة وإرسالها إلى أمراض المقطع المجمد أثناء الجراحة ، مما أكد هوامش سلبية. ثم أجرينا استئصال نصف الكبد الأيسر جنبا إلى جنب مع استئصال الفص المذنبي الكامل واستئصال هامش القناة الصفراوية القريبة ، والذي أظهر أيضا هوامش سلبية في أمراض المقطع المجمد أثناء الجراحة ، مما أدى إلى استئصال R0.
أظهرت الدراسات أن المرضى الذين يعانون من pCCA الذين يحققون استئصال R0 لديهم نظام تشغيل و DFS أفضل بكثير مقارنة بأولئك الذين يعانون من استئصال R1. تشير الإرشادات الحالية أيضا إلى أن تحقيق استئصال R0 من خلال استئصال الكبد القطعي جنبا إلى جنب مع استئصال الفص المذنبي الكامل وتشريح العقدة الليمفاوية الموحد أمر بالغ الأهمية. ومع ذلك ، نظرا للصعوبات الفنية والأدلة غير الكافية ، فإن عددا قليلا فقط من مراكز الكبد الصفراوية ذات الحجم الكبير تقوم حاليا بإجراء جراحة جذرية بالمنظار ل pcca ، حيث تأتي معظم التقارير من البلدان الشرقية22. بالإضافة إلى ذلك ، في المراحل الأولى من تطوير هذه التكنولوجيا ، يلزم وجود أوقات تشغيل أطول ومنحنى تعليمي حاد ، وهي قيود على هذه التقنية. حاليا ، لا توجد دراسات تشير إلى الوقت المطلوب وعدد العمليات الجراحية للجراحين لإتقان هذا الإجراء المعقد. يأتي التوجيه الوحيد من فريق الخبراء المعني بالمعايير التشغيلية للاستئصال الجذري بالمنظار لسرطان القنوات الصفراوية الحضيضي في الصين ، والذي يشير إلى أن منحنى التعلم لإجراء استئصال الكبد بالمنظار واستئصال البنكرياس والثنائي عشر بالمنظار يجب أن يشمل أكثر من 50 حالة لكل منهما. لا تزال البيانات الحالية غير كافية لإثبات تفوق تقنية على أخرى أو لمقارنة النتائج بالطرق المفتوحة. لذلك ، نوصي فريق متخصص من الجراحين طفيفة التوغل في مراكز الكبد الصفراوية الرئيسية ، بعد التغلب على منحنى التعلم ، باختيار الحالات المناسبة بشكل انتقائي (مع عدم وجود موانع لاستئصال الجذري القياسي بالمنظار أو المفتوح ل pCCA ، وعدم غزو الوريد البابي أو الشريان الكبدي). يجب على الجراحين أولا محاولة العمليات الجراحية الجذرية بالمنظار للنوع الأول والنوع الثاني pCCA قبل التقدم إلى إجراءات تنظير البطن من النوع IIIb. سيساعد هذا النهج في ضمان نتائج آمنة بعد الجراحة ، واستئصال الورم بشكل كاف ، وتحديد وإدارة المضاعفات المحتملة بشكل مناسب.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذه الورقة بتمويل من المؤسسة الوطنية للعلوم الطبيعية في الصين (82060454) ، وبرنامج البحث والتطوير الرئيسي لمقاطعة جيانغشي الصينية (20203BBGL73143) ، ومشروع تدريب المواهب الرائدة رفيع المستوى وعالي المهارات في مقاطعة جيانغشي (G / Y3035).
Materials
| Name | Company | Catalog Number | Comments |
| 5-mm trocar | CANWELL MEDICAL Co., LTD | 179094F | Sterile, ethylene oxide sterilized, disposable |
| 12-mm trocar | CANWELL MEDICAL Co., LTD | NB12STF | Sterile, ethylene oxide sterilized, disposable |
| Absorbable Sutures | America Ethicon Medical Technology Co., LTD | W8557/W9109H/VCPB839D | Sterile, ethylene oxide sterilized, disposable |
| Alligaclip Absorbable Ligating Clip | Hangzhou Sunstone Technology Co., Ltd. | K12 | Sterile, ethylene oxide sterilized, disposable |
| Endoscopic linear cutting stapler | America Ethicon Medical Technology Co., LTD | ECR60W/PSEE60A | Sterile, ethylene oxide sterilized, disposable |
| Non-absorbable polymer ligature clip | Greiner Bio-One Shanghai Co., Ltd. | 0301-03M04/0301-03L04/0301-03ML02 | Sterile, ethylene oxide sterilized, disposable |
| NonAbsorbable Sutures | America Ethicon Medical Technology Co., LTD | EH7241H/EH7242H | Sterile, ethylene oxide sterilized, disposable |
| Ultrasonic scalpel | America Ethicon Medical Technology Co., LTD | HARH36 | Sterile, ethylene oxide sterilized, disposable |
References
- Klatskin, G. Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis: An unusual tumor with distinctive clinical and pathological features. Am J Med. 38 (2), 241-256 (1965).
- Cillo, U., et al. Surgery for cholangiocarcinoma. Liver Int. 39 Suppl 1 (Suppl Suppl 1), 143-155 (2019).
- Jingdong, L., et al. Minimally invasive surgery for hilar cholangiocarcinoma: A multicenter retrospective analysis of 158 patients. Surg Endosc. 35 (12), 6612-6622 (2021).
- Vogel, A., et al. Biliary tract cancer: Esmo clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 34 (2), 127-140 (2023).
- Giannini, A., et al. The great debate: Surgical outcomes of laparoscopic versus laparotomic myomectomy. A meta-analysis to critically evaluate current evidence and look over the horizon. Eur J Obstet Gynecol Reprod Biol. 297, 50-58 (2024).
- Hakkenbrak, N. A. G., Jansma, E. P., Van Der Wielen, N., Van Der Peet, D. L., Straatman, J. Laparoscopic versus open distal gastrectomy for gastric cancer: A review and meta-analysis. Surgery. 171 (6), 1552-1561 (2022).
- Macacari, R. L., et al. Laparoscopic vs. Open left lateral sectionectomy: An update meta-analysis of randomized and non-randomized controlled trials. Int J Surg. 61, 1-10 (2019).
- Zhou, Y., Cai, P., Zeng, N. Augmented reality navigation system makes laparoscopic radical resection of hilar cholangiocarcinoma type b more precise and safe. Gastrointest Surg. 28 (7), 1212-1213 (2024).
- Hu, H. J., et al. Hepatic artery resection for bismuth type iii and iv hilar cholangiocarcinoma: Is reconstruction always required. J Gastrointest Surg. 22 (7), 1204-1212 (2018).
- Rushbrook, S. M., et al. British Society of Gastroenterology guidelines for the diagnosis and management of cholangiocarcinoma. Gut. 73 (1), 16-46 (2023).
- Xiong, Y., Jingdong, L., Zhaohui, T., Lau, J. A consensus meeting on expert recommendations on operating specifications for laparoscopic radical resection of hilar cholangiocarcinoma. Front Surg. 8, 731448(2021).
- Benson, A. B., et al. Hepatobiliary cancers, version 2.2021, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 19 (5), 541-565 (2021).
- Kokudo, N., Ishizawa, T. Clinical application of fluorescence imaging of liver cancer using indocyanine green. Liver Cancer. 1 (1), 15-21 (2012).
- Terasawa, M., et al. Applications of fusion-fluorescence imaging using indocyanine green in laparoscopic hepatectomy. Surg Endosc. 31 (12), 5111-5118 (2017).
- Pringle, J. H. V. Notes on the arrest of hepatic hemorrhage due to trauma. Ann Surg. 48 (4), 541-549 (1908).
- Otsuka, S., et al. Efficacy of extended modification in left hemihepatectomy for advanced perihilar cholangiocarcinoma: Comparison between H12345'8'-B-MHV and H1234-B. Ann Surg. 277 (3), e585-e591 (2023).
- Roth, G. S., et al. Biliary tract cancers: French national clinical practice guidelines for diagnosis, treatments and follow-up (TNCD, SNFGE, FFCD, UNICANCER, GERCOR, SFCD, SFED, AFEF, SFRO, SFP, SFR, ACABI, ACHBPT). Eur J Cancer. 202, 114000(2024).
- Abu Hilal, M., et al. The Southampton consensus guidelines for laparoscopic liver surgery: From indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Tang, W., et al. Minimally invasive versus open radical resection surgery for hilar cholangiocarcinoma: Comparable outcomes associated with advantages of minimal invasiveness. PLoS One. 16 (3), e0248534(2021).
- Yu, H., Wu, S. -D., Chen, D. -X., Zhu, G. Laparoscopic resection of bismuth type I and II hilar cholangiocarcinoma: An audit of 14 cases from two institutions. Dig Surg. 28 (1), 44-49 (2011).
- Ratti, F., et al. Perihilar cholangiocarcinoma: Are we ready to step towards minimally invasiveness. Updates Surg. 72 (2), 423-433 (2020).
- Berardi, G., et al. Minimally invasive surgery for perihilar cholangiocarcinoma: A systematic review of the short- and long-term results. Cancers (Basel). 15 (11), 3048(2023).
- Xiong, F., Peng, F., Li, X., Chen, Y. Preliminary comparison of total laparoscopic and open radical resection for hepatic hilar cholangiocarcinoma a single-center cohort study. Asian J Surg. 46 (22), 856-862 (2023).
- Qin, T., et al. The long-term outcome of laparoscopic resection for perihilar cholangiocarcinoma compared with the open approach: A real-world multicentric analysis. Ann Surg Oncol. 30 (3), 1366-1378 (2023).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancers. 115 (11), 2491-2504 (2009).
- Xu, C., Cui, X., Jia, Z., Shen, X., Che, J. A meta-analysis of short-term and long-term effects of indocyanine green fluorescence imaging in hepatectomy for liver cancer. Photodiagnosis Photodyn Ther. 42, 103497(2023).
- Tangsirapat, V., et al. Surgical margin status outcome of intraoperative indocyanine green fluorescence-guided laparoscopic hepatectomy in liver malignancy: A systematic review and meta-analysis. BMC Surg. 24 (1), 181(2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved