Method Article
Resección radical laparoscópica completa del colangiocarcinoma perihiliar tipo IIIb
En este artículo
Resumen
El colangiocarcinoma perihiliar (CCAC) es un tumor altamente maligno y agresivo, siendo la resección radical el único tratamiento curativo disponible. Con los continuos avances en las técnicas e instrumentos laparoscópicos, la cirugía radical laparoscópica para la pCCA ahora se considera técnicamente segura y factible. Sin embargo, debido a la alta complejidad de la cirugía y a la falta de apoyo clínico basado en la evidencia, la cirugía radical laparoscópica para la PCCa tipo IIIb se realiza solo en unos pocos centros hepatobiliares grandes. Las guías actuales recomiendan la hemihepatectomía izquierda combinada con lobectomía caudada total y linfadenectomía estandarizada para el pCCA resecable tipo IIIb. Por lo tanto, en este artículo, proporcionamos una descripción detallada de los pasos quirúrgicos y los puntos técnicos de la hemihepatectomía izquierda laparoscópica completa combinada con lobectomía caudada total, linfadenectomía regional y anastomosis en Y de Roux del conducto hepático yeyunal derecho en pacientes con pCCA tipo IIIb, utilizando la tecnología de navegación por fluorescencia para mejorar la precisión y seguridad quirúrgica. Al adherirnos a procedimientos quirúrgicos estandarizados y técnicas intraoperatorias precisas, ofrecemos un medio eficaz para mejorar los resultados de los pacientes.
Resumen
El colangiocarcinoma perihiliar (CCAC) es un tumor altamente maligno y agresivo, siendo la resección radical el único tratamiento curativo disponible. Con los continuos avances en las técnicas e instrumentos laparoscópicos, la cirugía radical laparoscópica para la pCCA ahora se considera técnicamente segura y factible. Sin embargo, debido a la alta complejidad de la cirugía y a la falta de apoyo clínico basado en la evidencia, la cirugía radical laparoscópica para la PCCa tipo IIIb se realiza solo en unos pocos centros hepatobiliares grandes. Las guías actuales recomiendan la hemihepatectomía izquierda combinada con lobectomía caudada total y linfadenectomía estandarizada para el pCCA resecable tipo IIIb. Por lo tanto, en este artículo, proporcionamos una descripción detallada de los pasos quirúrgicos y los puntos técnicos de la hemihepatectomía izquierda laparoscópica completa combinada con lobectomía caudada total, linfadenectomía regional y anastomosis en Y de Roux del conducto hepático yeyunal derecho en pacientes con pCCA tipo IIIb, utilizando la tecnología de navegación por fluorescencia para mejorar la precisión y seguridad quirúrgica. Al adherirnos a procedimientos quirúrgicos estandarizados y técnicas intraoperatorias precisas, ofrecemos un medio eficaz para mejorar los resultados de los pacientes.
Introducción
El colangiocarcinoma perihiliar (pCCA), también conocido como tumor de Klatskin, fue descrito por primera vez por Gerald Klatskin y es un tumor maligno que se presenta en el epitelio del conducto biliar en la confluencia de los conductos hepáticos derecho e izquierdo1. Esta enfermedad es altamente maligna y agresiva, a menudo se presenta con ictericia y colangitis en etapas avanzadas. A pesar de los avances en el diagnóstico y el tratamiento, el pronóstico de la PCCa sigue siendo malo, y la resección quirúrgica radical sigue siendo el único enfoque potencialmente curativo. Dichas cirugías suelen implicar hepatectomía extensa, resección del conducto biliar y linfadenectomía regional2. El objetivo de la cirugía es lograr una resección R0, que mejora significativamente las tasas de supervivencia de los pacientes 3,4. Sin embargo, la compleja anatomía de la región hiliar y la proximidad del tumor a las estructuras vasculares vitales hacen que estas cirugías sean muy desafiantes.
En los últimos años, el advenimiento de la tecnología laparoscópica ha revolucionado la oncología quirúrgica, ofreciendo ventajas potenciales como la reducción de las complicaciones perioperatorias, la reducción de las estancias hospitalarias y la recuperación más rápida 5,6,7. Sin embargo, la aplicación de la cirugía laparoscópica en el CCAC, especialmente en los casos tipo IIIb, sigue siendo limitada, con pocos reportes disponibles 3,8. Esto se debe, principalmente, a la dificultad técnica para lograr márgenes adecuados y realizar reconstrucciones biliares y vasculares complejas por vía laparoscópica9. Las guías actuales recomiendan la hemihepatectomía izquierda combinada con lobectomía caudada total y linfadenectomía estandarizada para el PCCp resecable tipo IIIb 4,10,11,12. Sin embargo, la evidencia que apoya el uso de métodos laparoscópicos para esta cirugía extensa aún se está acumulando.
En este trabajo se presenta la resección radical laparoscópica completa del PCCp tipo IIIb. Nuestro objetivo es detallar las técnicas y los pasos clave de esta cirugía, incluyendo la hemihepatectomía izquierda, la lobectomía caudada total, la linfadenectomía regional y la hepaticoyeyunostomía en Y de Roux. Al compartir este protocolo, esperamos contribuir a la evidencia que respalda la viabilidad y seguridad de los métodos laparoscópicos en el tratamiento del PCCp tipo IIIb, mejorando en última instancia los resultados de los pacientes.
Protocolo
El estudio sigue al comité de ética de investigación en humanos del Segundo Hospital Afiliado de la Universidad de Nanchang. Se obtuvo el consentimiento informado por escrito del paciente antes de la cirugía.
NOTA: El paciente era un hombre de 65 años que se presentó con una queja principal de "ictericia generalizada y prurito durante 2 semanas". Una tomografía computarizada (TC) realizada en un hospital externo reveló una masa del conducto biliar perihiliar con dilatación del conducto biliar intrahepático. Los instrumentos y equipos quirúrgicos utilizados se enumeran en la Tabla de Materiales.
1. Preparación preoperatoria
- Realizar análisis de sangre de rutina antes de la operación, que incluyen hemograma completo, pruebas de función hepática y renal, perfil de coagulación y marcadores tumorales séricos.
- Extraiga muestras de sangre, envíelas al laboratorio para realizar varios análisis de sangre e informe los resultados.
NOTA: Las pruebas de función hepática mostraron niveles elevados de bilirrubina total (230,8 μmol/L) y disminución de la albúmina (35,7 g/L). Las pruebas de marcadores tumorales séricos revelaron elevación del antígeno carbohidrato antígeno carbohidrato 199 (184,46 U/mL)4,12.
- Extraiga muestras de sangre, envíelas al laboratorio para realizar varios análisis de sangre e informe los resultados.
- Realizar electrocardiograma (ECG) preoperatorio, TC abdominal, resonancia magnética (RMN) de abdomen, TC de tórax y otros exámenes relevantes 4,12.
NOTA: En este estudio, el paciente se sometió a una tomografía computarizada abdominal con y sin contraste en el servicio de radiología. La gammagrafía mostró una masa en la región perihiliar sin afectación de los vasos circundantes, lo que sugiere colangiocarcinoma con obstrucción (Figura 1). La resonancia magnética con y sin contraste y colangiopancreatografía por resonancia magnética mostró una masa en la vía biliar perihiliar y en el parénquima hepático adyacente con dilatación de la vía biliar intrahepática y ganglios linfáticos perihiliares agrandados, lo que indica una lesión neoplásica (Figura 1).
2. Procedimiento quirúrgico
- Administrar anestesia general con intubación traqueal, agentes intravenosos e inhalatorios. Coloque al paciente en decúbito supino con la cabeza elevada y las piernas separadas. Realice la desinfección de rutina con una solución de povidona yodada.
NOTA: El cirujano primario se coloca en el lado derecho del paciente, el asistente en el lado izquierdo y el soporte de la cámara entre las piernas del paciente (Figura 2). - Realizar una incisión longitudinal de aproximadamente 1 cm en el ombligo, insertar una aguja de Veress e inhalar CO2 para mantener una presión intraabdominal de 12 mmHg. Inserte un trocar de 10 mm y un laparoscopio de 30° . Después de confirmar que no hay metástasis a distancia por laparoscopia, coloque los trócamos quirúrgicos como se muestra en la Figura 2.
- Diseccionar la arteria cística y el conducto cístico, luego proceder con la extirpación retrógrada de la vesícula biliar. Utilice un bisturí ultrasónico para diseccionar, movilizar y suspender la arteria hepática común (ACH), la arteria gastroduodenal (AGD), la arteria hepática adecuada (PHA) y las arterias hepáticas izquierdas (LHA) (que emiten la arteria hepática media (MHA)) y las arterias hepáticas derechas (RHA). Ligue y divida las arterias gástricas derechas (RGA) y LHA (Figura 3).
- Transectar el conducto biliar común (CDB) en el borde superior del páncreas y enviar el margen distal para la patología de sección congelada para confirmar los márgenes negativos.
- Utilice un bisturí ultrasónico para diseccionar, movilizar y suspender la vena porta (PV). Extirpar la vía biliar extrahepática y los grupos de ganglios linfáticos 8, 12 y 13 en bloque a lo largo de la VP hacia el hilio hepático, logrando la esqueletización del ligamento hepatoduodenal.
- Libar y dividir la rama izquierda de la vena porta (LPV) y las ramas de la vena porta del lóbulo caudado.
- Diseccionar los ligamentos hepáticos izquierdos y dividir las venas hepáticas cortas del lóbulo caudado, delineando claramente la línea de demarcación (línea isquémica) entre los lóbulos hepáticos derecho e izquierdo.
- Después de marcar la línea de demarcación, confirme que el límite de fluorescencia coincidió con la línea isquémica mediante imágenes de fluorescencia (Figura 4 y Figura 5).
NOTA: Aquí se utiliza un método de tinción negativo, con verde de indocianina administrado mediante inyección intravenosa periférica a una dosis de 0,25 mg13,14.
- Ocluir intermitentemente el PV principal utilizando la maniobra de Pringle15. Utilice un bisturí ultrasónico para seccionar el parénquima hepático a lo largo de la línea de demarcación, luego a lo largo del plano de la vena hepática media (MHV), asegurándose de dividir sus ramas V4b y V4a.
NOTA: Los pacientes con un margen hepático positivo pueden considerar someterse a una hepatectomía izquierda (LH) expandida, que implica la resección completa del tronco principal del MHV y las porciones izquierdas de los segmentos 5 y 8. Este enfoque puede mejorar las tasas de supervivencia16. - Transectar el conducto hepático derecho aproximadamente a 1 cm del tumor y enviar el margen proximal para la patología de sección congelada para confirmar los márgenes negativos.
- Realizar un análisis de sección congelada intraoperatoria del margen del conducto hepático proximal varias veces según sea necesario para garantizar una resección R0. Si el conducto hepático derecho está ampliamente dividido, considere la reconstrucción del conducto biliar o la hepaticoyeyunostomía doble de los conductos biliares anterior y posterior derecho.
- Seccionar la vena hepática izquierda (LHV) utilizando una grapadora de corte lineal endoscópica (ENDO-GIA). Resecar completamente el hemíniver izquierdo y todo el lóbulo caudado, y colocar la muestra en una bolsa de extracción (Figura 6).
- Transecto del yeyuno aproximadamente 20 cm distal al ligamento de Treitz. Elevar el asa distal posterior al colon para una anastomosis de extremo a lado con el conducto hepático derecho, utilizando suturas continuas para las paredes anterior y posterior (Figura 7). Realizar una yeyunoyuyunostomía lateral de aproximadamente 45 cm distal a la anastomosis del conducto hepático derecho-yeyunal.
- Irrigar la cavidad abdominal con agua destilada estéril. Inspeccione cuidadosamente el campo quirúrgico en busca de sangrado activo, fugas de bilis y lesiones de las ramas laterales gastrointestinales. Coloque tubos de drenaje en la sección izquierda del hígado y en el agujero de Winslow.
- Extienda la incisión umbilical aproximadamente 5 cm y diseccione la pared abdominal capa por capa para recuperar la muestra. Verificar el recuento de instrumental quirúrgico y gasas. Retire los trócares bajo visión directa. Cierre la incisión de la pared abdominal con suturas reabsorbibles 2-0 interrumpidas para completar la cirugía.
3. Cuidados postoperatorios
- Transportar al paciente de manera segura de regreso a la sala después de que el paciente recupere la conciencia.
- Administrar antibióticos intravenosos, omeprazol y soporte nutricional en el postoperatorio.
- Iniciar una dieta líquida al tercer día postoperatorio después de la expulsión de gases del paciente.
- Retirar los tubos de drenaje abdominal en el4º y13º día postoperatorio.
Resultados
La cirugía evolucionó sin problemas y la patología de la sección congelada intraoperatoria mostró márgenes negativos tanto en la vía biliar distal como en la proximal. Durante todo el procedimiento, los signos vitales del paciente se mantuvieron estables y la anestesia fue efectiva. La operación duró 360 min, con un tiempo de oclusión de PV de 60 min (15 min + 5 min × 4 veces). La pérdida de sangre intraoperatoria fue de 400 mL, y el paciente recibió 2 unidades de glóbulos rojos privativos de leucocitos y 600 mL de plasma fresco congelado. Se observó flato postoperatorio a las 72 h de la cirugía. No hubo complicaciones, como sangrado abdominal, pérdida de bilis, infección abdominal o infección de la incisión. La estancia hospitalaria postoperatoria fue de 14 días. El análisis histopatológico postoperatorio incluido en parafina mostró adenocarcinoma biliar moderadamente diferenciado con compromiso de tejido hepático adyacente, sin invasión vascular definida y márgenes hepáticos negativos. Se extirparon dieciséis ganglios linfáticos sin que se detectara metástasis. El tumor se estadificó como pT2bN0M0, estadio II (Tabla 1). La tomografía computarizada realizada 1 mes después de la operación mostró una resección tumoral exitosa, sin recidiva ni metástasis evidentes (Figura 8).
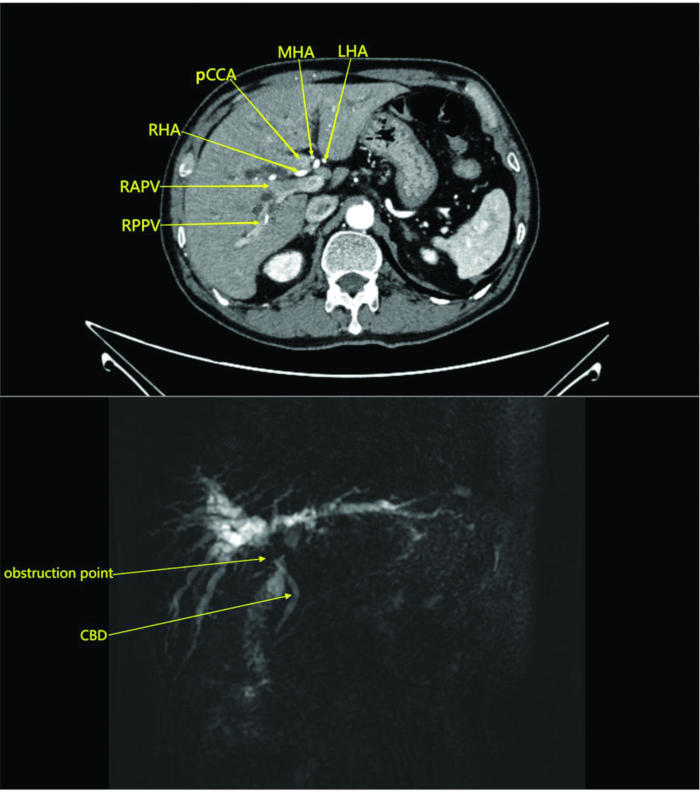
Figura 1: TC abdominal e imágenes de la fase arterial con contraste del paciente. Las imágenes revelan una masa en el hilio hepático sin invasión de los vasos sanguíneos circundantes, lo que sugiere un colangiocarcinoma con obstrucción. Abreviaturas: RAPV: rama anterior derecha de la vena porta; RPPV: rama posterior derecha de la vena porta; CBD: conducto biliar común; RHA: arteria hepática derecha; pCCA: Colangiocarcinoma perihiliar; MHA: arteria hepática media; LHA: arteria hepática izquierda. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Posición del cirujano y colocación del trócar. El cirujano se coloca tal y como se muestra en la figura, con los trócares colocados en la cavidad peritoneal en las posiciones indicadas en la imagen. Haga clic aquí para ver una versión más grande de esta figura.
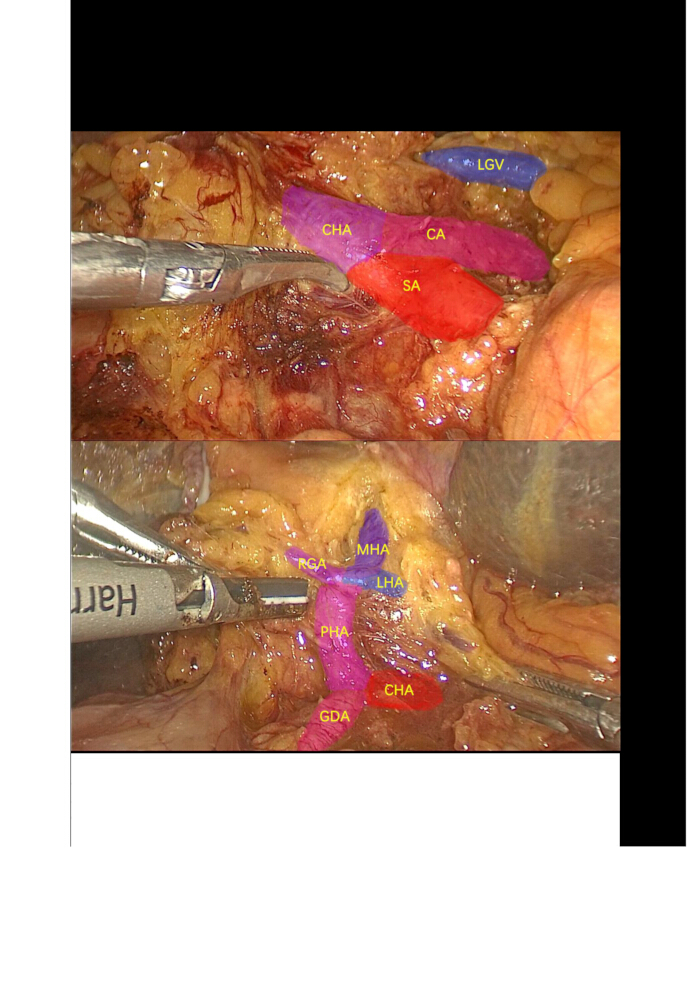
Figura 3: Disección de ganglios linfáticos. Disección y aislamiento de la arteria celíaca del tronco, la arteria esplénica, la arteria hepática común, la arteria gastroduodenal, la arteria hepática propia, la arteria gástrica derecha, la arteria hepática izquierda, la arteria hepática media y los ganglios linfáticos circundantes. Abreviaturas: CA: Arteria celíaca; SA: Arteria esplénica; LGV: Vena gástrica izquierda; CHA: arteria hepática común; GDA: arteria gastroduodenal; PHA: arteria hepática adecuada; LHA: arteria hepática izquierda; MHA: arteria hepática media; RGA: arterias gástricas derechas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Disección del lóbulo caudado. El lóbulo caudado se disecó a lo largo de la vena cava inferior (VCI) desde la dirección caudal hasta la craneal y desde el lado izquierdo hacia el derecho. Al llegar al lado derecho de la VCI, se levantó el hígado izquierdo, revelando la VCI, la rama paracava, la rama de proceso y el lóbulo de Spiegel de izquierda a derecha. Haga clic aquí para ver una versión más grande de esta figura.
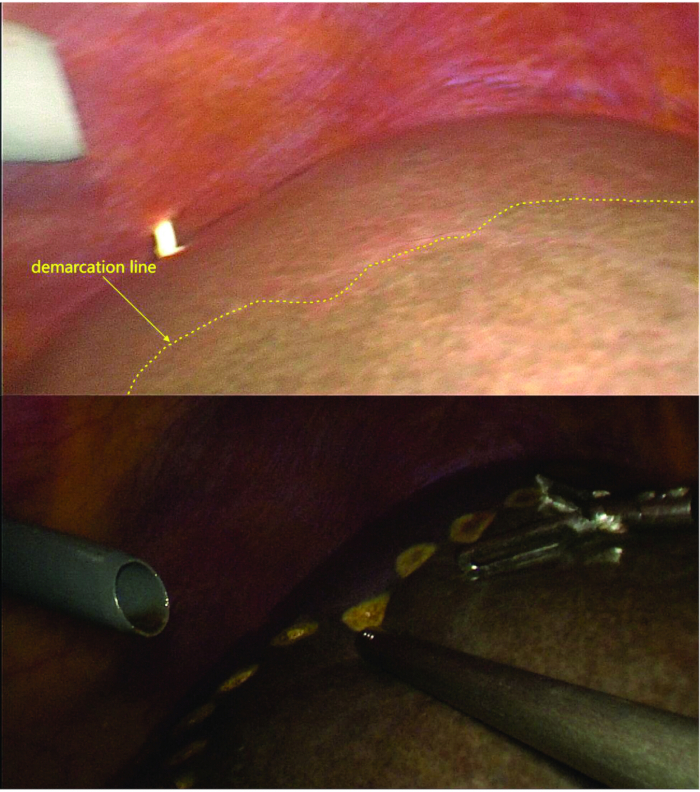
Figura 5: Marcado de la línea de demarcación. Después de la ligadura y transección de la rama LPV, la rama de la vena porta del lóbulo caudado y las venas hepáticas cortas, la línea de demarcación entre las hemiliveres izquierda y derecha es visible. Bajo fluoroscopia, la línea de demarcación observada se alinea con la línea isquémica. Haga clic aquí para ver una versión más grande de esta figura.
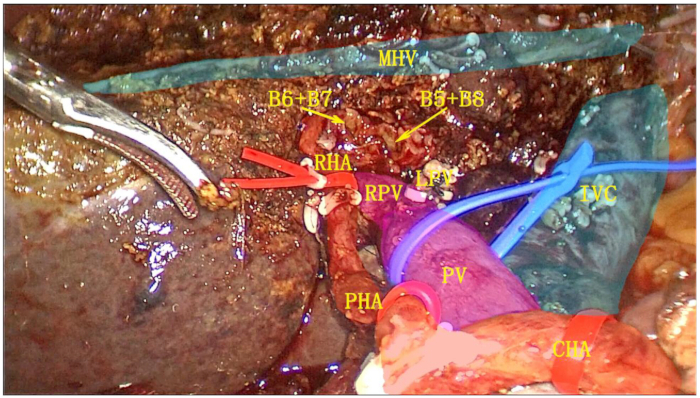
Figura 6: Superficie de corte postoperatoria tras hemihepatectomía izquierda combinada con resección completa del lóbulo caudado. La vesícula biliar, el ligamento hepatoduodenal, el hemihígado izquierdo y el lóbulo caudado completo se resecaron como una sola unidad. Abreviaturas: RPV: rama derecha de la vena porta; IVS: vena cava inferior; MHV: vena hepática media; RHA: arteria hepática derecha; PV: vena porta; PHA: arteria hepática adecuada; CHA: arteria hepática común. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Vista postoperatoria de la resección de pCCA. El MHV está totalmente expuesto, y las paredes posterior y anterior del conducto hepático derecho están anastomosadas al yeyunal de forma continua. Abreviaturas: MHV: vena hepática media. Haga clic aquí para ver una versión más grande de esta figura.
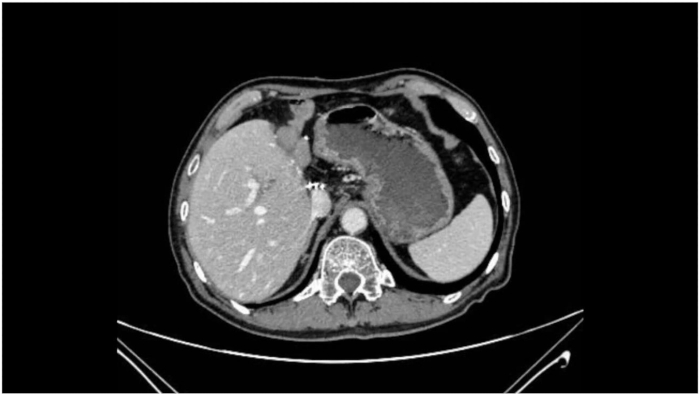
Figura 8: Tomografía computarizada postoperatoria. La tomografía computarizada postoperatoria demuestra una resección exitosa del tumor sin recidiva ni metástasis evidentes. Haga clic aquí para ver una versión más grande de esta figura.
| Tiempo de funcionamiento (min) | 360 |
| Pérdida de sangre intraoperatoria (mL) | 400 |
| Transfusión de sangre intraoperatoria (mL) | 1000 |
| Tiempo de oclusión PV (min) | 60 |
| Primer flato (h) | 72 |
| Primera dieta líquida postoperatoria (días) | 3 |
| Estancia hospitalaria postoperatoria (días) | 14 |
| Complicaciones postoperatorias (sí/no) | No |
| Sangrado (sí/no) | No |
| Fuga de bilis (sí/no) | No |
| Infección abdominal (sí/no) | No |
| Infección de la incisión (sí/no) | No |
| Resultado anatomopatológico | Adenocarcinoma biliar |
| Diferenciación | Moderado |
| Etapa TNM | pT2bN0M0 |
| Etapa AJCC | II |
Tabla 1: Los resultados quirúrgicos del paciente.
Discusión
El pCCA es un tumor maligno frecuente de las vías biliares, siendo la resección quirúrgica radical el único tratamiento curativo potencial2. La cirugía radical tradicional para la pCCA suele requerir una incisión abdominal de 20 a 30 cm, lo que resulta en un traumatismo quirúrgico significativo. Las incisiones grandes a menudo causan un dolor postoperatorio considerable, afectando la comodidad y la recuperación del paciente, prolongando así la estancia hospitalaria 5,6,7. A excepción de algunos PCCA de tipo I que pueden someterse a resección local del conducto biliar y anastomosis biliar-entérica, otros tipos requieren resección hepática, incluida la resección completa del lóbulo caudado11. Sin embargo, el campo visual en la cirugía abierta se basa principalmente en la visualización directa por parte del cirujano, que es limitada, especialmente cuando se manejan estructuras profundas. Por el contrario, la tecnología laparoscópica permite la visualización directa con aumento y ángulos variables, lo que facilita la identificación de estructuras anatómicas y permite operaciones más precisas y seguras. Además, la tecnología laparoscópica permite la exploración mínimamente invasiva, evitando potencialmente laparotomías innecesarias en pacientes con metástasis ocultas de pCCA17.
Los estudios han demostrado que la laparoscopia en las cirugías hepáticas y biliares ofrece ventajas potenciales, como la reducción de las complicaciones perioperatorias, la reducción de las estancias hospitalarias y la recuperación más rápida18,19. Con el avance continuo de la tecnología y los instrumentos laparoscópicos, la cirugía radical laparoscópica para la pCCA se ha implementado gradualmente clínicamente. En 2011, Hong Yu et al. informaron por primera vez de la cirugía radical laparoscópica para 14 casos de pCCA tipo I y II20. En 2020, Ratti et al.21aportaron la primera evidencia de comparabilidad entre la cirugía abierta y la cirugía mínimamente invasiva (MIS) a través de un análisis de propensity score matching analysis. En este estudio bien realizado, el estudio demostró resultados similares entre las cirugías abiertas y laparoscópicas21. Durante la última década, ha habido informes de cirugía radical laparoscópica para la PCCa, pero la mayoría son estudios retrospectivos con evidencia insuficiente. Las guías actuales recomiendan la exploración laparoscópica y la biopsia para algunosPCCp 17. Los estudios no han mostrado diferencias significativas en las tasas de resección R0, la supervivencia general (SG), la supervivencia libre de enfermedad (SSE) y las complicaciones entre la cirugía radical abierta y laparoscópica para la pCCA 22,23,24. Además, la introducción de la tecnología de imágenes de fluorescencia laparoscópica ha mejorado aún más la precisión y la seguridad de las cirugías. Esta tecnología utiliza tintes fluorescentes que se distribuyen específicamente en los tejidos, proporcionando imágenes en tiempo real a través de un sistema de cámaras de fluorescencia. Esto ayuda a los cirujanos a distinguir más claramente los límites entre el tumor y los tejidos normales25,26. En la resección anatómica del hígado, la tecnología de imágenes de fluorescencia ayuda a los cirujanos a delinear los límites de los segmentos de la resección hepática con mayor precisión. Demuestra una mayor tasa de detección de lesiones hepáticas superficiales en comparación con la imagen convencional, aumentando la minuciosidad de la resección y la tasa de resección R0, lo que finalmente aumenta la radicalidad oncológica de la cirugía27,28. Sin embargo, en los pacientes con cirrosis, la tasa de falsos positivos es más alta y puede producirse una tinción del límite de fluorescencia. A medida que los cirujanos hepatobiliares continúan explorando y adquiriendo experiencia en esta área, se ha validado aún más la viabilidad y la seguridad de este enfoque quirúrgico.
La cirugía radical tradicional para la pCCA tipo IIIb implica hemihepatectomía izquierda combinada con resección completa del lóbulo caudado y disección estandarizada de los ganglios linfáticos. El enfoque generalmente se divide en enfoques del lado izquierdo y del lado derecho. El abordaje del lado izquierdo consiste primero en la disección de los ganglios linfáticos adyacentes a la arteria hepática común, seguida de los ganglios linfáticos del ligamento hepatoduodenal y el margen posterior del páncreas. El abordaje del lado derecho comienza con los ganglios linfáticos en el margen posterior del páncreas, seguidos por los ganglios linfáticos del ligamento hepatoduodenal y los ganglios linfáticos adyacentes a la arteria hepática común. La secuencia de disección se puede adaptar a las características de la cirugía laparoscópica y a los hábitos del cirujano, seleccionando la secuencia de disección de ganglios linfáticos regionales y plexo nervioso adecuada y estandarizada en función de las estructuras anatómicas intraoperatorias.
En este paciente, las imágenes preoperatorias no revelaron ningún signo de metástasis en los ganglios linfáticos. Por lo tanto, adoptamos el abordaje convencional del lado izquierdo, diseccionando secuencialmente los ganglios linfáticos adyacentes a la arteria hepática común, el ligamento hepatoduodenal y el margen posterior del páncreas desde el lado caudal hasta el lado craneal. Se extirpó el margen distal de la vía biliar y se envió a anatomía patológica de corte congelado intraoperatorio, que confirmó márgenes negativos. A continuación, se realizó hemihepatectomía izquierda combinada con resección completa del lóbulo caudado y extirpación del margen de la vía biliar proximal, que también mostró márgenes negativos en la patología de corte congelado intraoperatorio, logrando una resección R0.
En los estudios se observó que los pacientes con pCCA que logran la resección R0 tienen una SG y una SSE significativamente mejores en comparación con aquellos con resección R1. Las directrices actuales también indican que es crucial lograr la resección R0 mediante hepatectomía segmentaria combinada con la resección completa del lóbulo caudado y la disección estandarizada de los ganglios linfáticos. Sin embargo, debido a las dificultades técnicas y a la insuficiente evidencia, solo unos pocos centros hepatobiliares de alto volumen realizan actualmente cirugía radical laparoscópica para el PCCa, con la mayoría de los informes procedentes de países orientales22. Además, en las primeras etapas del desarrollo de esta tecnología, se requieren tiempos operativos más largos y una curva de aprendizaje pronunciada, que son limitaciones de esta técnica. Actualmente, no existen estudios que indiquen el tiempo y el número de cirugías necesarias para que los cirujanos dominen este complejo procedimiento. La única orientación proviene del Grupo de Expertos sobre Normas Operacionales de la Resección Radical Laparoscópica del Colangiocarcinoma Perihiliar en China, que sugiere que la curva de aprendizaje para realizar la resección hepática laparoscópica y la pancreaticoduodenectomía laparoscópica debería incluir más de 50 casos cada una. Los datos existentes siguen siendo insuficientes para demostrar la superioridad de una técnica sobre otra o para comparar los resultados con los métodos abiertos. Por lo tanto, recomendamos que un equipo especializado de cirujanos mínimamente invasivos en los principales centros hepatobiliares, después de superar la curva de aprendizaje, elija selectivamente los casos adecuados (sin contraindicaciones para la resección radical laparoscópica estándar o abierta de la pCCA, y sin invasión de la vena porta o la arteria hepática). Los cirujanos deben intentar primero las cirugías radicales laparoscópicas para el pCCA Tipo I y Tipo II antes de progresar a los procedimientos laparoscópicos Tipo IIIb. Este enfoque ayudará a garantizar resultados posoperatorios seguros, una resección tumoral suficiente y una identificación y tratamiento adecuados de las posibles complicaciones.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este documento contó con el apoyo financiero de la Fundación Nacional de Ciencias Naturales de China (82060454), el programa clave de investigación y desarrollo de la provincia de Jiangxi de China (20203BBGL73143) y el proyecto de formación de talentos líderes de alto nivel y alta habilidad de la provincia de Jiangxi (G/Y3035).
Materiales
| Name | Company | Catalog Number | Comments |
| 5-mm trocar | CANWELL MEDICAL Co., LTD | 179094F | Sterile, ethylene oxide sterilized, disposable |
| 12-mm trocar | CANWELL MEDICAL Co., LTD | NB12STF | Sterile, ethylene oxide sterilized, disposable |
| Absorbable Sutures | America Ethicon Medical Technology Co., LTD | W8557/W9109H/VCPB839D | Sterile, ethylene oxide sterilized, disposable |
| Alligaclip Absorbable Ligating Clip | Hangzhou Sunstone Technology Co., Ltd. | K12 | Sterile, ethylene oxide sterilized, disposable |
| Endoscopic linear cutting stapler | America Ethicon Medical Technology Co., LTD | ECR60W/PSEE60A | Sterile, ethylene oxide sterilized, disposable |
| Non-absorbable polymer ligature clip | Greiner Bio-One Shanghai Co., Ltd. | 0301-03M04/0301-03L04/0301-03ML02 | Sterile, ethylene oxide sterilized, disposable |
| NonAbsorbable Sutures | America Ethicon Medical Technology Co., LTD | EH7241H/EH7242H | Sterile, ethylene oxide sterilized, disposable |
| Ultrasonic scalpel | America Ethicon Medical Technology Co., LTD | HARH36 | Sterile, ethylene oxide sterilized, disposable |
Referencias
- Klatskin, G. Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis: An unusual tumor with distinctive clinical and pathological features. Am J Med. 38 (2), 241-256 (1965).
- Cillo, U., et al. Surgery for cholangiocarcinoma. Liver Int. 39 Suppl 1 (Suppl Suppl 1), 143-155 (2019).
- Jingdong, L., et al. Minimally invasive surgery for hilar cholangiocarcinoma: A multicenter retrospective analysis of 158 patients. Surg Endosc. 35 (12), 6612-6622 (2021).
- Vogel, A., et al. Biliary tract cancer: Esmo clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 34 (2), 127-140 (2023).
- Giannini, A., et al. The great debate: Surgical outcomes of laparoscopic versus laparotomic myomectomy. A meta-analysis to critically evaluate current evidence and look over the horizon. Eur J Obstet Gynecol Reprod Biol. 297, 50-58 (2024).
- Hakkenbrak, N. A. G., Jansma, E. P., Van Der Wielen, N., Van Der Peet, D. L., Straatman, J. Laparoscopic versus open distal gastrectomy for gastric cancer: A review and meta-analysis. Surgery. 171 (6), 1552-1561 (2022).
- Macacari, R. L., et al. Laparoscopic vs. Open left lateral sectionectomy: An update meta-analysis of randomized and non-randomized controlled trials. Int J Surg. 61, 1-10 (2019).
- Zhou, Y., Cai, P., Zeng, N. Augmented reality navigation system makes laparoscopic radical resection of hilar cholangiocarcinoma type b more precise and safe. Gastrointest Surg. 28 (7), 1212-1213 (2024).
- Hu, H. J., et al. Hepatic artery resection for bismuth type iii and iv hilar cholangiocarcinoma: Is reconstruction always required. J Gastrointest Surg. 22 (7), 1204-1212 (2018).
- Rushbrook, S. M., et al. British Society of Gastroenterology guidelines for the diagnosis and management of cholangiocarcinoma. Gut. 73 (1), 16-46 (2023).
- Xiong, Y., Jingdong, L., Zhaohui, T., Lau, J. A consensus meeting on expert recommendations on operating specifications for laparoscopic radical resection of hilar cholangiocarcinoma. Front Surg. 8, 731448 (2021).
- Benson, A. B., et al. Hepatobiliary cancers, version 2.2021, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 19 (5), 541-565 (2021).
- Kokudo, N., Ishizawa, T. Clinical application of fluorescence imaging of liver cancer using indocyanine green. Liver Cancer. 1 (1), 15-21 (2012).
- Terasawa, M., et al. Applications of fusion-fluorescence imaging using indocyanine green in laparoscopic hepatectomy. Surg Endosc. 31 (12), 5111-5118 (2017).
- Pringle, J. H. V. Notes on the arrest of hepatic hemorrhage due to trauma. Ann Surg. 48 (4), 541-549 (1908).
- Otsuka, S., et al. Efficacy of extended modification in left hemihepatectomy for advanced perihilar cholangiocarcinoma: Comparison between H12345'8'-B-MHV and H1234-B. Ann Surg. 277 (3), e585-e591 (2023).
- Roth, G. S., et al. Biliary tract cancers: French national clinical practice guidelines for diagnosis, treatments and follow-up (TNCD, SNFGE, FFCD, UNICANCER, GERCOR, SFCD, SFED, AFEF, SFRO, SFP, SFR, ACABI, ACHBPT). Eur J Cancer. 202, 114000 (2024).
- Abu Hilal, M., et al. The Southampton consensus guidelines for laparoscopic liver surgery: From indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Tang, W., et al. Minimally invasive versus open radical resection surgery for hilar cholangiocarcinoma: Comparable outcomes associated with advantages of minimal invasiveness. PLoS One. 16 (3), e0248534 (2021).
- Yu, H., Wu, S. -. D., Chen, D. -. X., Zhu, G. Laparoscopic resection of bismuth type I and II hilar cholangiocarcinoma: An audit of 14 cases from two institutions. Dig Surg. 28 (1), 44-49 (2011).
- Ratti, F., et al. Perihilar cholangiocarcinoma: Are we ready to step towards minimally invasiveness. Updates Surg. 72 (2), 423-433 (2020).
- Berardi, G., et al. Minimally invasive surgery for perihilar cholangiocarcinoma: A systematic review of the short- and long-term results. Cancers (Basel). 15 (11), 3048 (2023).
- Xiong, F., Peng, F., Li, X., Chen, Y. Preliminary comparison of total laparoscopic and open radical resection for hepatic hilar cholangiocarcinoma a single-center cohort study. Asian J Surg. 46 (22), 856-862 (2023).
- Qin, T., et al. The long-term outcome of laparoscopic resection for perihilar cholangiocarcinoma compared with the open approach: A real-world multicentric analysis. Ann Surg Oncol. 30 (3), 1366-1378 (2023).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancers. 115 (11), 2491-2504 (2009).
- Xu, C., Cui, X., Jia, Z., Shen, X., Che, J. A meta-analysis of short-term and long-term effects of indocyanine green fluorescence imaging in hepatectomy for liver cancer. Photodiagnosis Photodyn Ther. 42, 103497 (2023).
- Tangsirapat, V., et al. Surgical margin status outcome of intraoperative indocyanine green fluorescence-guided laparoscopic hepatectomy in liver malignancy: A systematic review and meta-analysis. BMC Surg. 24 (1), 181 (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados