Method Article
Resezione radicale laparoscopica completa del colangiocarcinoma periilare di tipo IIIb
In questo articolo
Riepilogo
Il colangiocarcinoma periilare (pCCA) è un tumore altamente maligno e aggressivo, con la resezione radicale che è l'unico trattamento curativo disponibile. Con i continui progressi nelle tecniche e negli strumenti laparoscopici, la chirurgia radicale laparoscopica per la pCCA è ora considerata tecnicamente sicura e fattibile. Tuttavia, a causa dell'elevata complessità dell'intervento chirurgico e della mancanza di un supporto clinico basato sull'evidenza, la chirurgia radicale laparoscopica per la pCCA di tipo IIIb viene eseguita solo in pochi grandi centri epatobiliari. Le attuali linee guida raccomandano l'emiepatectomia sinistra combinata con lobectomia caudatato totale e linfoadenectomia standardizzata per pCCA di tipo IIIb resecabile. Pertanto, in questo articolo, forniamo una descrizione dettagliata delle fasi chirurgiche e dei punti tecnici dell'emiepatectomia sinistra laparoscopica completa combinata con lobectomia caudatale totale, linfoadenectomia regionale e anastomosi Roux-en-Y del dotto epatico destro in pazienti con CCA di tipo IIIb, utilizzando la tecnologia di navigazione a fluorescenza per migliorare la precisione e la sicurezza chirurgica. Aderendo a procedure chirurgiche standardizzate e a precise tecniche intraoperatorie, offriamo un mezzo efficace per migliorare i risultati dei pazienti.
Abstract
Il colangiocarcinoma periilare (pCCA) è un tumore altamente maligno e aggressivo, con la resezione radicale che è l'unico trattamento curativo disponibile. Con i continui progressi nelle tecniche e negli strumenti laparoscopici, la chirurgia radicale laparoscopica per la pCCA è ora considerata tecnicamente sicura e fattibile. Tuttavia, a causa dell'elevata complessità dell'intervento chirurgico e della mancanza di un supporto clinico basato sull'evidenza, la chirurgia radicale laparoscopica per la pCCA di tipo IIIb viene eseguita solo in pochi grandi centri epatobiliari. Le attuali linee guida raccomandano l'emiepatectomia sinistra combinata con lobectomia caudatato totale e linfoadenectomia standardizzata per pCCA di tipo IIIb resecabile. Pertanto, in questo articolo, forniamo una descrizione dettagliata delle fasi chirurgiche e dei punti tecnici dell'emiepatectomia sinistra laparoscopica completa combinata con lobectomia caudatale totale, linfoadenectomia regionale e anastomosi Roux-en-Y del dotto epatico destro in pazienti con CCA di tipo IIIb, utilizzando la tecnologia di navigazione a fluorescenza per migliorare la precisione e la sicurezza chirurgica. Aderendo a procedure chirurgiche standardizzate e a precise tecniche intraoperatorie, offriamo un mezzo efficace per migliorare i risultati dei pazienti.
Introduzione
Il colangiocarcinoma periilare (pCCA), noto anche come tumore di Klatskin, è stato descritto per la prima volta da Gerald Klatskin ed è un tumore maligno che si verifica nell'epitelio del dotto biliare alla confluenza dei dotti epatici destro e sinistro1. Questa malattia è altamente maligna e aggressiva e spesso si presenta con ittero e colangite in stadio avanzato. Nonostante i progressi nella diagnosi e nel trattamento, la prognosi per la pCCA rimane sfavorevole, con la resezione chirurgica radicale che rimane l'unico approccio potenzialmente curativo. Tali interventi chirurgici comportano tipicamente un'epatectomia estesa, la resezione del dotto biliare e la linfoadenectomia regionale2. L'obiettivo della chirurgia è ottenere una resezione R0, che migliora significativamente i tassi di sopravvivenza del paziente 3,4. Tuttavia, la complessa anatomia della regione ilare e la vicinanza del tumore alle strutture vascolari vitali rendono questi interventi chirurgici molto impegnativi.
Negli ultimi anni, l'avvento della tecnologia laparoscopica ha rivoluzionato l'oncologia chirurgica, offrendo potenziali vantaggi come la riduzione delle complicanze perioperatorie, degenze ospedaliere più brevi e un recupero più rapido 5,6,7. Tuttavia, l'applicazione della chirurgia laparoscopica nella pCCA, in particolare per i casi di tipo IIIb, rimane limitata, con solo pochi rapporti disponibili 3,8. Ciò è dovuto principalmente alla difficoltà tecnica di ottenere margini adeguati e di eseguire ricostruzioni biliari e vascolari complesse per via laparoscopica9. Le attuali linee guida raccomandano l'emiepatectomia sinistra combinata con lobectomia caudatato totale e linfoadenectomia standardizzata per pCCA di tipo IIIbresecabile 4,10,11,12. Tuttavia, le prove a sostegno dell'uso di metodi laparoscopici per questo intervento chirurgico esteso si stanno ancora accumulando.
Questo studio presenta la resezione radicale laparoscopica completa del pCCA di tipo IIIb. Il nostro obiettivo è quello di dettagliare le tecniche e i passaggi chiave di questo intervento chirurgico, tra cui l'emiepatectomia sinistra, la lobectomia caudata, la linfoadenectomia regionale e l'epaticodigiunostomia di Roux-en-Y. Condividendo questo protocollo, speriamo di contribuire alle prove a sostegno della fattibilità e della sicurezza dei metodi laparoscopici nel trattamento del pCCA di tipo IIIb, migliorando in ultima analisi gli esiti dei pazienti.
Protocollo
Lo studio segue il comitato etico per la ricerca umana del Secondo Ospedale Affiliato dell'Università di Nanchang. Il consenso informato scritto è stato ottenuto dal paziente prima dell'intervento chirurgico.
NOTA: Il paziente era un uomo di 65 anni che presentava una lamentela principale di "ittero generalizzato e prurito per 2 settimane". Una tomografia computerizzata (TC) in un ospedale esterno ha rivelato una massa del dotto biliare periilare con dilatazione del dotto biliare intraepatico. Gli strumenti chirurgici e le attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Preparazione preoperatoria
- Eseguire esami del sangue di routine prima dell'intervento, tra cui emocromo completo, test di funzionalità epatica e renale, profilo di coagulazione e marcatori tumorali sierici.
- Prelevare campioni di sangue, inviarli al laboratorio per vari esami del sangue e riportare i risultati.
NOTA: I test di funzionalità epatica hanno mostrato un aumento della bilirubina totale (230,8 μmol/L) e una diminuzione dell'albumina (35,7 g/L). I test dei marcatori tumorali sierici hanno rivelato un aumento dell'antigene dei carboidrati antigene dei carboidrati 199 (184,46 U/mL)4,12.
- Prelevare campioni di sangue, inviarli al laboratorio per vari esami del sangue e riportare i risultati.
- Eseguire l'elettrocardiogramma (ECG) preoperatorio, la TC addominale, la risonanza magnetica (MRI) dell'addome, la TC del torace e altri esami pertinenti 4,12.
NOTA: In questo studio, il paziente è stato sottoposto a una TAC addominale con e senza contrasto nel reparto di radiologia. La scansione ha mostrato una massa nella regione periilare senza coinvolgimento dei vasi circostanti, suggerendo un colangiocarcinoma con ostruzione (Figura 1). La risonanza magnetica con e senza mezzo di contrasto e la colangiopancreatografia a risonanza magnetica hanno dimostrato una massa nel dotto biliare periilare e nel parenchima epatico adiacente con dilatazione intraepatica del dotto biliare e linfonodi periilari ingrossati, indicando una lesione neoplastica (Figura 1).
2. Procedura chirurgica
- Somministrare l'anestesia generale con intubazione tracheale, agenti endovenosi e inalatori. Posizionare il paziente in posizione supina con la testa sollevata e le gambe divaricate. Eseguire la disinfezione di routine utilizzando una soluzione di iodio povidone.
NOTA: Il chirurgo primario si trova sul lato destro del paziente, l'assistente sul lato sinistro e il supporto della telecamera tra le gambe del paziente (Figura 2). - Praticare un'incisione longitudinale di circa 1 cm all'ombelico, inserire un ago di Veress e insufflare CO2 per mantenere una pressione intra-addominale di 12 mmHg. Inserire un trocar da 10 mm e un laparoscopio da 30° . Dopo aver confermato l'assenza di metastasi a distanza tramite laparoscopia, posizionare i trocar chirurgici come mostrato nella Figura 2.
- Sezionare l'arteria cistica e il dotto cistico, quindi procedere con la rimozione retrograda della cistifellea. Utilizzare un bisturi a ultrasuoni per sezionare, mobilizzare e sospendere l'arteria epatica comune (CHA), l'arteria gastroduodenale (GDA), l'arteria epatica corretta (PHA) e le arterie epatiche sinistre (LHA) (che emettono l'arteria epatica media (MHA)) e le arterie epatiche destre (RHA). Legare e dividere le arterie gastriche destre (RGA) e LHA (Figura 3).
- Sezionare il dotto biliare comune (CBD) al bordo superiore del pancreas e inviare il margine distale per la patologia della sezione congelata per confermare i margini negativi.
- Utilizzare un bisturi a ultrasuoni per sezionare, mobilizzare e sospendere la vena porta (PV). Rimuovere il dotto biliare extraepatico e i gruppi linfonodali 8, 12 e 13 in blocco lungo il PV verso l'ilo epatico, ottenendo la scheletrizzazione del legamento epatoduodenale.
- Legare e dividere il ramo sinistro della vena porta (LPV) e i rami della vena porta del lobo caudato.
- Sezionare i legamenti epatici sinistri e dividere le vene epatiche corte del lobo caudato, delineando chiaramente la linea di demarcazione (linea ischemica) tra i lobi epatici destro e sinistro.
- Dopo aver segnato la linea di demarcazione, confermare che il limite di fluorescenza corrisponda alla linea ischemica utilizzando l'imaging a fluorescenza (Figura 4 e Figura 5).
NOTA: In questo caso viene utilizzato un metodo di colorazione negativa, con il verde di indocianina somministrato tramite iniezione endovenosa periferica alla dose di 0,25 mg13,14.
- Occludi in modo intermittente il PV principale usando la manovra di Pringle15. Utilizzare un bisturi a ultrasuoni per sezionare il parenchima epatico lungo la linea di demarcazione, quindi lungo il piano della vena epatica media (MHV), assicurandosi di dividere i suoi rami V4b e V4a.
NOTA: I pazienti con un margine epatico positivo possono prendere in considerazione l'idea di sottoporsi a epatectomia sinistra espansa (LH), che comporta la resezione completa del tronco principale dell'MHV e delle porzioni sinistre dei segmenti 5 e 8. Questo approccio può migliorare i tassi di sopravvivenza16. - Sezionare il dotto epatico destro a circa 1 cm dal tumore e inviare il margine prossimale per la patologia della sezione congelata per confermare i margini negativi.
- Eseguire l'analisi intraoperatoria della sezione congelata del margine del dotto epatico prossimale più volte, se necessario, per garantire una resezione R0. Se il dotto epatico destro è ampiamente diviso, prendere in considerazione la ricostruzione del dotto biliare o la doppia epaticodigiunostomia dei dotti biliari anteriori e posteriori destri.
- Sezionare la vena epatica sinistra (LHV) utilizzando una suturatrice lineare endoscopica (ENDO-GIA). Resecare completamente l'emifegato sinistro e l'intero lobo caudato e posizionare il campione in una sacca di recupero (Figura 6).
- Sezionare il digiuno a circa 20 cm distalmente al legamento di Treitz. Elevare l'ansa distale posteriormente al colon per un'anastomosi end-to-side con il dotto epatico destro, utilizzando suture continue per le pareti anteriore e posteriore (Figura 7). Eseguire una digiunodigiunostomia laterale a circa 45 cm distalmente all'anastomosi digiunale del dotto epatico destro.
- Irrigare la cavità addominale con acqua distillata sterile. Ispezionare attentamente il campo chirurgico per verificare la presenza di sanguinamento attivo, perdite biliari e lesioni del ramo laterale gastrointestinale. Posizionare i tubi di drenaggio nella sezione epatica sinistra e nel forame di Winslow.
- Estendere l'incisione ombelicale di circa 5 cm e sezionare la parete addominale strato per strato per recuperare il campione. Verificare il conteggio degli strumenti chirurgici e delle garze. Rimuovere i trocar sotto la visione diretta. Chiudere l'incisione della parete addominale con suture riassorbibili 2-0 interrotte per completare l'intervento chirurgico.
3. Cure postoperatorie
- Trasporta il paziente in sicurezza in reparto dopo che il paziente ha ripreso conoscenza.
- Somministrare antibiotici per via endovenosa, omeprazolo e supporto nutrizionale dopo l'intervento.
- Inizia una dieta liquida il terzo giorno postoperatorio dopo che il paziente ha espulso il gas.
- Rimuovere i tubi di drenaggio addominale al 4° e 13° giornopostoperatorio.
Risultati
L'intervento chirurgico è progredito senza intoppi e la patologia intraoperatoria della sezione congelata ha mostrato margini negativi sia nei dotti biliari distali che prossimali. Durante tutta la procedura, i segni vitali del paziente sono rimasti stabili e l'anestesia è stata efficace. L'intervento è durato 360 minuti, con un tempo di occlusione PV totale di 60 minuti (15 minuti + 5 minuti × 4 volte). La perdita di sangue intraoperatoria è stata di 400 ml e il paziente ha ricevuto 2 unità di globuli rossi privativi leucocitari e 600 ml di plasma fresco congelato. La flatulenza postoperatoria è stata osservata 72 ore dopo l'intervento. Non ci sono state complicanze, come sanguinamento addominale, perdita di bile, infezione addominale o infezione da incisione. La degenza ospedaliera postoperatoria è stata di 14 giorni. L'analisi istopatologica postoperatoria con paraffina incorporata ha mostrato un adenocarcinoma biliare moderatamente differenziato che coinvolge il tessuto epatico adiacente, senza invasione vascolare definita e margini epatici negativi. Sedici linfonodi sono stati rimossi, senza che siano state rilevate metastasi. Il tumore è stato stadiato, come pT2bN0, M0, stadio II (Tabella 1). Una TAC 1 mese dopo l'intervento ha mostrato una resezione del tumore riuscita senza recidive o metastasi evidenti (Figura 8).
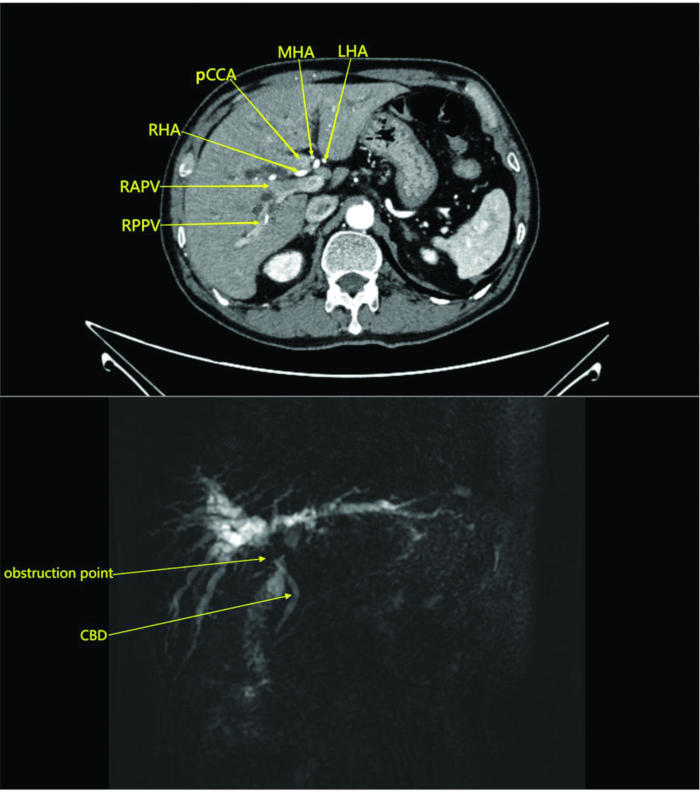
Figura 1: TC addominale e immagini della fase arteriosa con mezzo di contrasto del paziente. Le immagini rivelano una massa all'ilo epatico senza invasione dei vasi sanguigni circostanti, suggerendo un colangiocarcinoma con ostruzione. Abbreviazioni: RAPV: ramo anteriore destro della vena porta; RPPV: ramo posteriore destro della vena porta; CBD: dotto biliare comune; RHA: arteria epatica destra; pCCA: Colangiocarcinoma periilare; MHA: arteria epatica media; LHA: arteria epatica sinistra. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Posizione del chirurgo e posizionamento del trocar. Il chirurgo si trova in piedi come mostrato in figura, con i trocar posizionati nella cavità peritoneale nelle posizioni indicate nell'immagine. Clicca qui per visualizzare una versione più grande di questa figura.
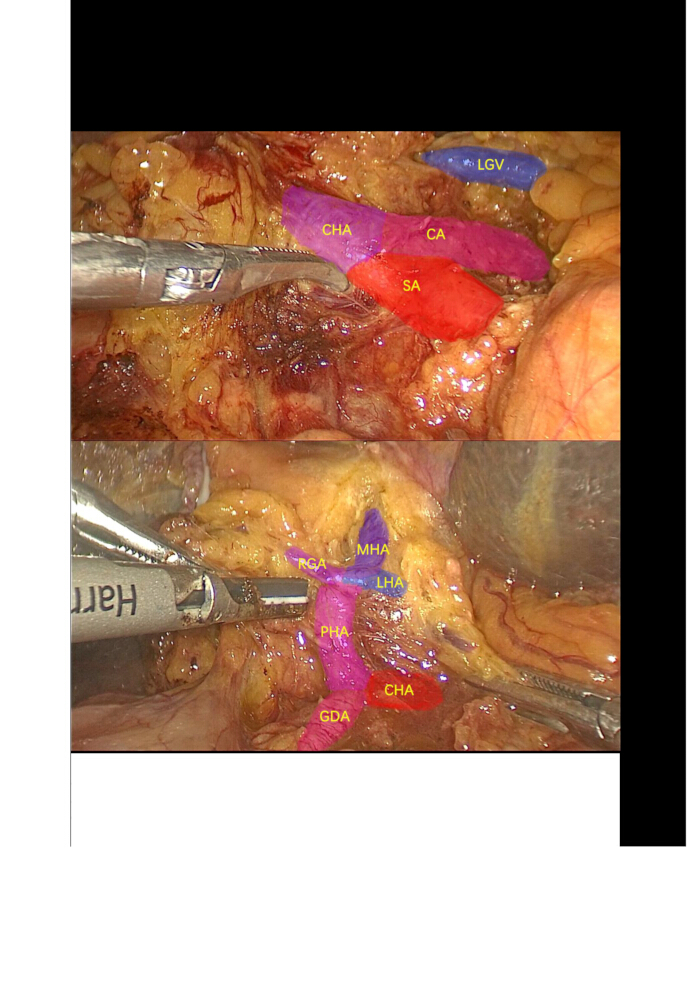
Figura 3: Dissezione linfonodale. Dissezione e isolamento dell'arteria celiaca del tronco, dell'arteria splenica, dell'arteria epatica comune, dell'arteria gastroduodenale, dell'arteria epatica corretta, dell'arteria gastrica destra, dell'arteria epatica sinistra, dell'arteria epatica media e dei linfonodi circostanti. Abbreviazioni: CA: Arteria celiaca; SA: Arteria splenica; LGV: Vena gastrica sinistra; CHA: arteria epatica comune; GDA: arteria gastroduodenale; PHA: arteria epatica corretta; LHA: arteria epatica sinistra; MHA: arteria epatica media; RGA: arterie gastriche destre. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Dissezione del lobo caudato. Il lobo caudato è stato sezionato lungo la vena cava inferiore (IVC) dalla direzione caudale a quella cranica e dal lato sinistro a quello destro. Dopo aver raggiunto il lato destro dell'IVC, il fegato sinistro è stato sollevato, rivelando l'IVC, il ramo paracavale, il ramo del processo e il lobo di Spiegel da sinistra a destra. Clicca qui per visualizzare una versione più grande di questa figura.
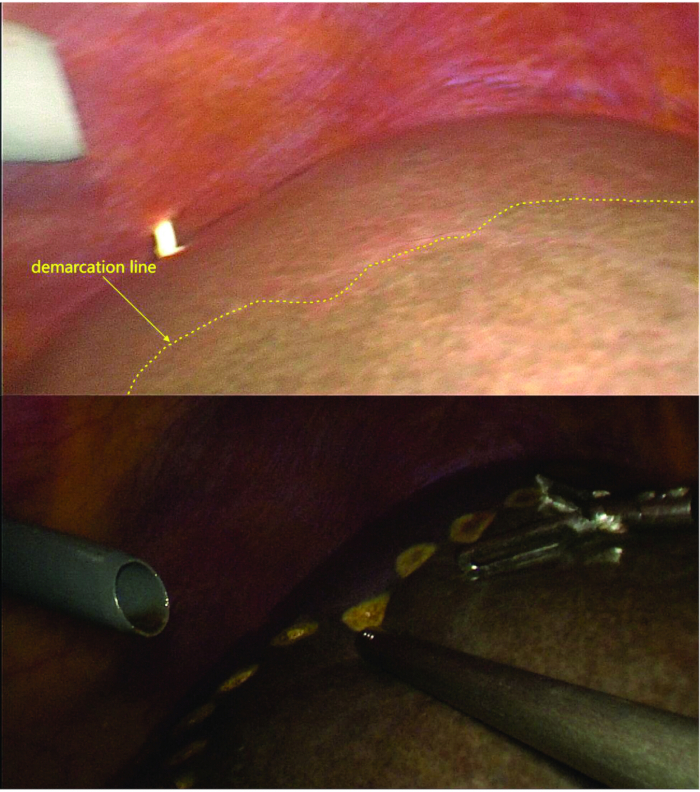
Figura 5: Marcatura della linea di demarcazione. Dopo la legatura e la trassezione del ramo LPV, del ramo della vena porta del lobo caudato e delle vene epatiche corte, è visibile la linea di demarcazione tra gli emilenti sinistro e destro. In fluoroscopia, la linea di demarcazione osservata si allinea con la linea ischemica. Clicca qui per visualizzare una versione più grande di questa figura.
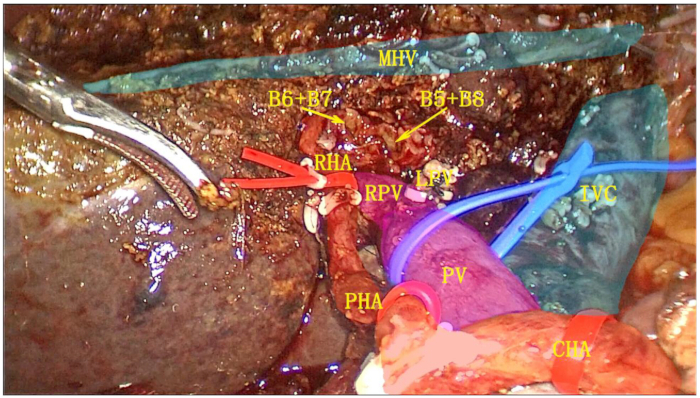
Figura 6: Superficie di taglio postoperatoria dopo emiepatectomia sinistra combinata con resezione completa del lobo caudato. La cistifellea, il legamento epatoduodenale, l'emifegato sinistro e il lobo caudato completo sono stati resecati come un'unica unità. Abbreviazioni: RPV: ramo destro della vena porta; IVS: vena cava inferiore; MHV: vena epatica media; RHA: arteria epatica destra; PV: vena porta; PHA: arteria epatica corretta; CHA: arteria epatica comune. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Vista postoperatoria della resezione del pCCA. L'MHV è completamente esposto e le pareti posteriore e anteriore del dotto epatico destro sono anastomizzate al digiunale in modo continuo. Abbreviazioni: MHV: vena epatica media. Clicca qui per visualizzare una versione più grande di questa figura.
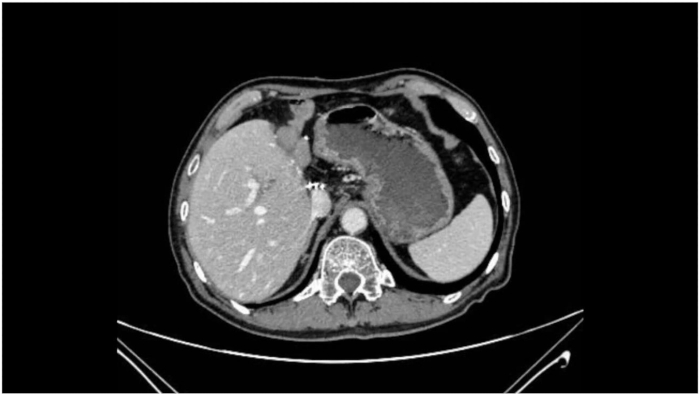
Figura 8: TAC postoperatoria. La TAC postoperatoria dimostra il successo della resezione del tumore senza evidenti recidive o metastasi. Clicca qui per visualizzare una versione più grande di questa figura.
| Tempo di funzionamento (min) | 360 |
| Perdita di sangue intraoperatoria (mL) | 400 |
| Trasfusione di sangue intraoperatoria (mL) | 1000 |
| Tempo di occlusione PV (min) | 60 |
| Primo flatulenza (h) | 72 |
| Prima dieta liquida postoperatoria (giorni) | 3 |
| Degenza ospedaliera postoperatoria (giorni) | 14 |
| Complicanze postoperatorie (sì/no) | No |
| Sanguinamento (sì/no) | No |
| Perdita di bile (sì/no) | No |
| Infezione addominale (sì/no) | No |
| Infezione da incisione (sì/no) | No |
| Risultato patologico | Adenocarcinoma biliare |
| Differenziazione | Moderato |
| Stadio TNM | pT2bN0M0 |
| Tappa AJCC | II |
Tabella 1: Gli esiti chirurgici del paziente.
Discussione
La pCCA è un tumore maligno comune dei dotti biliari e la resezione chirurgica radicale è l'unico trattamento curativo potenziale2. La chirurgia radicale tradizionale per la pCCA richiede in genere un'incisione addominale di 20-30 cm, con conseguente trauma chirurgico significativo. Grandi incisioni spesso causano un notevole dolore postoperatorio, compromettendo il comfort e il recupero del paziente, prolungando così la degenza ospedaliera 5,6,7. Ad eccezione di alcuni pCCA di tipo I che possono essere sottoposti a resezione locale del dotto biliare e anastomosi bilio-enterica, altri tipi richiedono la resezione epatica, inclusa la resezione completa del lobo caudato11. Tuttavia, il campo visivo nella chirurgia a cielo aperto si basa principalmente sulla visualizzazione diretta da parte del chirurgo, che è limitata, soprattutto quando si maneggiano strutture profonde. Al contrario, la tecnologia laparoscopica consente la visualizzazione diretta in caso di ingrandimento e angoli variabili, facilitando l'identificazione delle strutture anatomiche e consentendo operazioni più precise e sicure. Inoltre, la tecnologia laparoscopica consente l'esplorazione minimamente invasiva, evitando potenzialmente laparotomie non necessarie nei pazienti con metastasi occulte di pCCA17.
Gli studi hanno dimostrato che la laparoscopia negli interventi chirurgici al fegato e alle vie biliari offre potenziali vantaggi come la riduzione delle complicanze perioperatorie, degenze ospedaliere più brevi e un recupero più rapido18,19. Con il continuo progresso della tecnologia e degli strumenti laparoscopici, la chirurgia radicale laparoscopica per la pCCA è stata gradualmente implementata clinicamente. Nel 2011, Hong Yu et al. hanno riportato per la prima volta la chirurgia radicale laparoscopica per 14 casi di pCCA20 di tipo I e II. Nel 2020, Ratti et al.21hanno fornito la prima prova di comparabilità tra chirurgia aperta e chirurgia minimamente invasiva (MIS) attraverso un'analisi di corrispondenza del punteggio di propensione. In questo studio ben condotto, lo studio ha dimostrato risultati simili tra interventi chirurgici a cielo aperto e laparoscopici21. Nell'ultimo decennio, ci sono state segnalazioni di chirurgia radicale laparoscopica per pCCA, ma la maggior parte sono studi retrospettivi con prove insufficienti. Le attuali linee guida raccomandano l'esplorazione laparoscopica e la biopsia per alcuni pCCA17. Gli studi non hanno mostrato differenze significative nei tassi di resezione R0, nella sopravvivenza globale (OS), nella sopravvivenza libera da malattia (DFS) e nelle complicanze tra chirurgia radicale aperta e laparoscopica per pCCA 22,23,24. Inoltre, l'introduzione della tecnologia di imaging a fluorescenza laparoscopica ha ulteriormente migliorato la precisione e la sicurezza degli interventi chirurgici. Questa tecnologia utilizza coloranti fluorescenti che sono specificamente distribuiti nei tessuti, fornendo immagini in tempo reale attraverso un sistema di telecamere a fluorescenza. Questo aiuta i chirurghi a distinguere più chiaramente i confini tra tumore e tessuti normali25,26. Nella resezione epatica anatomica, la tecnologia di imaging a fluorescenza aiuta i chirurghi a delineare i confini dei segmenti di resezione epatica in modo più accurato. Dimostra un tasso di rilevamento più elevato per le lesioni epatiche superficiali rispetto all'imaging convenzionale, aumentando così l'accuratezza della resezione e il tasso di resezione R0, migliorando in ultima analisi la radicalità oncologica dell'intervento chirurgico27,28. Tuttavia, nei pazienti con cirrosi, il tasso di falsi positivi è più alto e può verificarsi una colorazione del limite di fluorescenza. Poiché i chirurghi epatobiliari continuano a esplorare e acquisire esperienza in questo settore, la fattibilità e la sicurezza di questo approccio chirurgico sono state ulteriormente convalidate.
La chirurgia radicale tradizionale per la pCCA di tipo IIIb prevede l'emiepatectomia sinistra combinata con la resezione completa del lobo caudato e la dissezione linfonodale standardizzata. L'approccio è generalmente suddiviso in approcci sul lato sinistro e sul lato destro. L'approccio sul lato sinistro prevede innanzitutto la dissezione dei linfonodi adiacenti all'arteria epatica comune, seguiti dai linfonodi del legamento epatoduodenale e dal margine posteriore del pancreas. L'approccio sul lato destro inizia con i linfonodi nel margine posteriore del pancreas, seguiti dai linfonodi del legamento epatoduodenale e dai linfonodi adiacenti all'arteria epatica comune. La sequenza di dissezione può essere adattata alle caratteristiche della chirurgia laparoscopica e alle abitudini del chirurgo, selezionando la sequenza di dissezione dei linfonodi regionali e del plesso nervoso appropriata e standardizzata in base alle strutture anatomiche intraoperatorie.
Per questo paziente, l'imaging preoperatorio non ha rivelato alcun segno di metastasi linfonodali. Pertanto, abbiamo adottato l'approccio convenzionale del lato sinistro, sezionando in sequenza i linfonodi adiacenti all'arteria epatica comune, al legamento epatoduodenale e al margine posteriore del pancreas dal lato caudale al lato cranico. Il margine del dotto biliare distale è stato asportato e inviato per la patologia intraoperatoria della sezione congelata, che ha confermato i margini negativi. Abbiamo quindi eseguito l'emiepatectomia sinistra combinata con la resezione completa del lobo caudato e asportato il margine del dotto biliare prossimale, che ha anche mostrato margini negativi sulla patologia della sezione congelata intraoperatoria, ottenendo la resezione R0.
Gli studi hanno dimostrato che i pazienti con pCCA che ottengono la resezione R0 hanno OS e DFS significativamente migliori rispetto a quelli con resezione R1. Le attuali linee guida indicano anche che il raggiungimento della resezione R0 attraverso l'epatectomia segmentale combinata con la resezione completa del lobo caudato e la dissezione linfonodale standardizzata è fondamentale. Tuttavia, a causa di difficoltà tecniche e prove insufficienti, solo pochi centri epatobiliari ad alto volume stanno attualmente eseguendo la chirurgia radicale laparoscopica per la pCCA, con la maggior parte delle segnalazioni provenienti dai paesi dell'Est22. Inoltre, nelle prime fasi di sviluppo di questa tecnologia, sono necessari tempi operativi più lunghi e una curva di apprendimento ripida, che sono limiti di questa tecnica. Attualmente, non ci sono studi che indichino il tempo e il numero di interventi chirurgici necessari ai chirurghi per padroneggiare questa complessa procedura. L'unica guida proviene dal gruppo di esperti sulle norme operative della resezione radicale laparoscopica del colangiocarcinoma periilare in Cina, che suggerisce che la curva di apprendimento per l'esecuzione della resezione epatica laparoscopica e della duodenectomia pancreatica laparoscopica dovrebbe coinvolgere più di 50 casi ciascuno. I dati esistenti sono ancora insufficienti per dimostrare la superiorità di una tecnica rispetto a un'altra o per confrontare i risultati con i metodi aperti. Pertanto, raccomandiamo che un'équipe specializzata di chirurghi minimamente invasivi presso i principali centri epatobiliari, dopo aver superato la curva di apprendimento, scelga selettivamente i casi idonei (senza controindicazioni per la resezione laparoscopica standard o radicale aperta del pCCA e nessuna invasione della vena porta o dell'arteria epatica). I chirurghi devono prima tentare interventi di chirurgia radicale laparoscopica per pCCA di tipo I e II prima di passare alle procedure laparoscopiche di tipo IIIb. Questo approccio contribuirà a garantire esiti postoperatori sicuri, una resezione del tumore sufficiente e un'adeguata identificazione e gestione delle potenziali complicanze.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo documento è stato supportato da finanziamenti della National Natural Science Foundation of China (82060454), del programma chiave di ricerca e sviluppo della provincia cinese di Jiangxi (20203BBGL73143) e del progetto di formazione dei talenti leader di alto livello e ad alta competenza della provincia di Jiangxi (G/Y3035).
Materiali
| Name | Company | Catalog Number | Comments |
| 5-mm trocar | CANWELL MEDICAL Co., LTD | 179094F | Sterile, ethylene oxide sterilized, disposable |
| 12-mm trocar | CANWELL MEDICAL Co., LTD | NB12STF | Sterile, ethylene oxide sterilized, disposable |
| Absorbable Sutures | America Ethicon Medical Technology Co., LTD | W8557/W9109H/VCPB839D | Sterile, ethylene oxide sterilized, disposable |
| Alligaclip Absorbable Ligating Clip | Hangzhou Sunstone Technology Co., Ltd. | K12 | Sterile, ethylene oxide sterilized, disposable |
| Endoscopic linear cutting stapler | America Ethicon Medical Technology Co., LTD | ECR60W/PSEE60A | Sterile, ethylene oxide sterilized, disposable |
| Non-absorbable polymer ligature clip | Greiner Bio-One Shanghai Co., Ltd. | 0301-03M04/0301-03L04/0301-03ML02 | Sterile, ethylene oxide sterilized, disposable |
| NonAbsorbable Sutures | America Ethicon Medical Technology Co., LTD | EH7241H/EH7242H | Sterile, ethylene oxide sterilized, disposable |
| Ultrasonic scalpel | America Ethicon Medical Technology Co., LTD | HARH36 | Sterile, ethylene oxide sterilized, disposable |
Riferimenti
- Klatskin, G. Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis: An unusual tumor with distinctive clinical and pathological features. Am J Med. 38 (2), 241-256 (1965).
- Cillo, U., et al. Surgery for cholangiocarcinoma. Liver Int. 39 Suppl 1 (Suppl Suppl 1), 143-155 (2019).
- Jingdong, L., et al. Minimally invasive surgery for hilar cholangiocarcinoma: A multicenter retrospective analysis of 158 patients. Surg Endosc. 35 (12), 6612-6622 (2021).
- Vogel, A., et al. Biliary tract cancer: Esmo clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 34 (2), 127-140 (2023).
- Giannini, A., et al. The great debate: Surgical outcomes of laparoscopic versus laparotomic myomectomy. A meta-analysis to critically evaluate current evidence and look over the horizon. Eur J Obstet Gynecol Reprod Biol. 297, 50-58 (2024).
- Hakkenbrak, N. A. G., Jansma, E. P., Van Der Wielen, N., Van Der Peet, D. L., Straatman, J. Laparoscopic versus open distal gastrectomy for gastric cancer: A review and meta-analysis. Surgery. 171 (6), 1552-1561 (2022).
- Macacari, R. L., et al. Laparoscopic vs. Open left lateral sectionectomy: An update meta-analysis of randomized and non-randomized controlled trials. Int J Surg. 61, 1-10 (2019).
- Zhou, Y., Cai, P., Zeng, N. Augmented reality navigation system makes laparoscopic radical resection of hilar cholangiocarcinoma type b more precise and safe. Gastrointest Surg. 28 (7), 1212-1213 (2024).
- Hu, H. J., et al. Hepatic artery resection for bismuth type iii and iv hilar cholangiocarcinoma: Is reconstruction always required. J Gastrointest Surg. 22 (7), 1204-1212 (2018).
- Rushbrook, S. M., et al. British Society of Gastroenterology guidelines for the diagnosis and management of cholangiocarcinoma. Gut. 73 (1), 16-46 (2023).
- Xiong, Y., Jingdong, L., Zhaohui, T., Lau, J. A consensus meeting on expert recommendations on operating specifications for laparoscopic radical resection of hilar cholangiocarcinoma. Front Surg. 8, 731448(2021).
- Benson, A. B., et al. Hepatobiliary cancers, version 2.2021, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 19 (5), 541-565 (2021).
- Kokudo, N., Ishizawa, T. Clinical application of fluorescence imaging of liver cancer using indocyanine green. Liver Cancer. 1 (1), 15-21 (2012).
- Terasawa, M., et al. Applications of fusion-fluorescence imaging using indocyanine green in laparoscopic hepatectomy. Surg Endosc. 31 (12), 5111-5118 (2017).
- Pringle, J. H. V. Notes on the arrest of hepatic hemorrhage due to trauma. Ann Surg. 48 (4), 541-549 (1908).
- Otsuka, S., et al. Efficacy of extended modification in left hemihepatectomy for advanced perihilar cholangiocarcinoma: Comparison between H12345'8'-B-MHV and H1234-B. Ann Surg. 277 (3), e585-e591 (2023).
- Roth, G. S., et al. Biliary tract cancers: French national clinical practice guidelines for diagnosis, treatments and follow-up (TNCD, SNFGE, FFCD, UNICANCER, GERCOR, SFCD, SFED, AFEF, SFRO, SFP, SFR, ACABI, ACHBPT). Eur J Cancer. 202, 114000(2024).
- Abu Hilal, M., et al. The Southampton consensus guidelines for laparoscopic liver surgery: From indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Tang, W., et al. Minimally invasive versus open radical resection surgery for hilar cholangiocarcinoma: Comparable outcomes associated with advantages of minimal invasiveness. PLoS One. 16 (3), e0248534(2021).
- Yu, H., Wu, S. -D., Chen, D. -X., Zhu, G. Laparoscopic resection of bismuth type I and II hilar cholangiocarcinoma: An audit of 14 cases from two institutions. Dig Surg. 28 (1), 44-49 (2011).
- Ratti, F., et al. Perihilar cholangiocarcinoma: Are we ready to step towards minimally invasiveness. Updates Surg. 72 (2), 423-433 (2020).
- Berardi, G., et al. Minimally invasive surgery for perihilar cholangiocarcinoma: A systematic review of the short- and long-term results. Cancers (Basel). 15 (11), 3048(2023).
- Xiong, F., Peng, F., Li, X., Chen, Y. Preliminary comparison of total laparoscopic and open radical resection for hepatic hilar cholangiocarcinoma a single-center cohort study. Asian J Surg. 46 (22), 856-862 (2023).
- Qin, T., et al. The long-term outcome of laparoscopic resection for perihilar cholangiocarcinoma compared with the open approach: A real-world multicentric analysis. Ann Surg Oncol. 30 (3), 1366-1378 (2023).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancers. 115 (11), 2491-2504 (2009).
- Xu, C., Cui, X., Jia, Z., Shen, X., Che, J. A meta-analysis of short-term and long-term effects of indocyanine green fluorescence imaging in hepatectomy for liver cancer. Photodiagnosis Photodyn Ther. 42, 103497(2023).
- Tangsirapat, V., et al. Surgical margin status outcome of intraoperative indocyanine green fluorescence-guided laparoscopic hepatectomy in liver malignancy: A systematic review and meta-analysis. BMC Surg. 24 (1), 181(2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon