Method Article
Микрофлюидика в оценке функции тромбоцитов
В этой статье
Резюме
Можно оценить функцию тромбоцитов под действием потока и смоделировать гемостатическую реанимацию с помощью микрофлюидного устройства, которое применяется в травматологии и трансфузионной медицине.
Аннотация
Микрофлюидика включает в себя физиологически значимые субстраты и потоки, которые имитируют сосудистую сеть и, следовательно, являются ценным инструментом для изучения аспектов тромбоза и гемостаза. В средах с большим сдвигом, имитирующих артериальный поток, микрофлюидный анализ облегчает изучение функции тромбоцитов, поскольку богатые тромбоцитами тромбы образуются в локализованной стенотической области проточного канала. Использование устройств, которые позволяют использовать небольшой объем образца, может дополнительно помочь в оценке функции тромбоцитов в потоке из образцов пациентов с ограниченным объемом или животных моделей. Изучение образцов пациентов с травмами или образцов после переливания тромбоцитарных продуктов может помочь в определении терапевтических стратегий для групп пациентов, у которых функция тромбоцитов имеет решающее значение. В этой модели также могут быть изучены эффекты ингибирования тромбоцитов с помощью фармакологических агентов. Целью данного протокола является создание микрофлюидной платформы, которая включает в себя физиологический поток, биологические поверхности и соответствующие гемостатические механизмы для оценки функции тромбоцитов с последствиями для изучения травматической коагулопатии и трансфузионной медицины.
Введение
Травма является одной из основных причин смерти и инвалидности во всем мире. Тяжелая травма часто осложняется уникальным эндогенным нарушением гемостаза и тромбоза, называемым травматической коагулопатией (ТИК)1. Тромбоциты играют решающую роль при ТИК, и они были описаны как обладающие как адаптивными, так и дезадаптивными функциями2. Механизмы дисфункции тромбоцитов после травмы остаются неясными, и существует острая необходимость в лучшем понимании клеточного ответа для разработки улучшенной реанимации и терапии. Еще одной неприятной проблемой, связанной с функцией тромбоцитов после травмы, является неопределенность надежности имеющихся показаний функции тромбоцитов у пациента с травмой.
Многочисленные исследования показали, что даже пациенты с легкими травмами, без известного фенотипа клинического кровотечения, имеют аномальную функцию тромбоцитов при использовании обычного тестирования функции тромбоцитов, такого как агрегометрия 3,4. Тем не менее, ограничения в агрегометрии для оценки функции тромбоцитов в условиях травмы включают отсутствие физиологически значимой поверхности повреждения, редукционистский подход к стимуляции агонистов, разведение образцов с помощью импедансной агрегометрии цельной крови, разделение плазмы с помощью агрегометрии оптического пропускания света и оценку застойных образцов. Кроме того, остается неясным, представляет ли эта чувствительность функции тромбоцитов истинную клеточную дисфункцию или артефакт измерения, такой как повышенный исходный электрический импеданс, в условиях травмы2. Таким образом, изучение соответствующих функций тромбоцитов в контексте травмы имеет решающее значение для понимания TIC, и в этой области есть значительные возможности для инноваций и улучшений.
Платформы, традиционно используемые для изучения функции тромбоцитов, не включают динамику и поток жидкости, что может иметь решающее значение для понимания дисфункции тромбоцитов, связанной с травмой и коагулопатией, вызванной травмой5. Механизмы гемостаза, которые зависят от потока, включают удлинение фактора Виллебранда (VWF) при высоком сдвиге, выше критической скорости сдвига, и захват тромбоцитов с помощью гликопротеина 1b 6,7,8, который не захватывается с помощью анализа застойной функции тромбоцитов. Кроме того, тромбоциты преимущественно связываются с VWF или фибриногеном в зависимости от режима кровотока и играют дифференцированную роль в артериальном и венозном тромбозе 9,10. Артериальные тромбы в основном состоят из тромбоцитов, в то время как венозные тромбы в основном состоят из эритроцитов, основанных, в частности, на режимах потока11. Анализы, включающие режимы потока, могут помочь в выяснении дисфункций, относящихся к спектру фенотипов TIC, от гипокоагуляции и фенотипов кровотечения до гиперкоагуляции и тромботических фенотипов. Наконец, ограничения по объему забора крови в популяциях пациентов с травмами могут затруднить традиционное функциональное тестирование тромбоцитов. В то время как такие анализы, как проточная цитометрия, могут и должны использоваться в этих обстоятельствах, результаты часто отражают физическую характеристику образца, а не функциональную оценку гемостаза.
В то время как механизмы дисфункции тромбоцитов могут быть не до конца поняты при травме, моделирование дисфункции тромбоцитов in vitro, например, с антагонистами P2Y12, также может помочь в изучении терапевтических вмешательств. Гемостатическая реанимация критически важна для пациентов с травмами, когда продукты крови переливаются сбалансированным подходом для лечения шока, коагулопатии и эндотелиального повреждения либо цельной кровью, либо компонентами крови (эритроцитами, плазмой и концентратами тромбоцитов) в соотношении единиц 1:1:1 12,13,14. У пациентов с травмами раннее использование препаратов крови связано с улучшением выживаемости15,16. Для продления срока годности все чаще изучаются тромбоцитарные продукты, хранящиеся в холоде. Исследование тромбоцитов, хранящихся в холоде, показывает повышенную гемостатическую активность, а также безопасность при переливании крови после травмы17,18.
Эволюция реанимации тромбоцитов, хранящихся в холоде, подчеркивает необходимость проведения дополнительных тестов, чтобы понять, какой тромбоцитарный продукт наиболее эффективен при травме. Тем не менее, традиционные анализы функции тромбоцитов часто подвергаются чрезмерной или недостаточной потенциации для выявления дисфункции, возникающей как у пациента с травмой, получающего терапевтическое переливание тромбоцитов, так и у самого переливаемого продукта, наблюдаемой при повреждениях при накоплении тромбоцитов. Определение происхождения дисфункции может быть сложной задачей, учитывая ограничения в современных анализах функции тромбоцитов, в том числе статический характер большинства этих тестов. Таким образом, при изучении гемостатической реанимации in vitro платформа и методы обнаружения как реципиентных, так и продуктовых тромбоцитов имеют решающее значение для определения оптимальных терапевтических вмешательств.
Микрофлюидное тестирование предлагает профили потока и биофиделические поверхности для создания физиологически релевантного анализа для изучения тромбоцитов. Микрофлюидные устройства могут быть настроены для изучения определенной патофизиологии или типов травм, таких как пункция сосудов19 или повреждение эндотелия20. Эти устройства обычно состоят из полидиметилсилоксана (PDMS), прикрепленного к предметному стеклу стеклянного микроскопа с модификациями поверхности, такими как коллаген, для имитации субэндотелия и повреждения тканей. Использование этих типов устройств на основе потока может помочь в проведении исследований дисфункции тромбоцитов, связанных с травмой, и помочь в изучении оптимальных подходов трансфузионной медицины для улучшения дисфункции тромбоцитов. Эти стратегии могут помочь прояснить существующую путаницу в отношении актуальности статических анализов тромбоцитов, таких как агрегометрия, у пациента с травмой.
протокол
Все исследования проводились в соответствии с институциональными рекомендациями. Было получено одобрение от Управления по защите исследований человека Университета Питтсбурга и получено информированное согласие от здоровых добровольцев.
1. Подготовка микрофлюидных устройств
- Чтобы изготовить часть устройства PDMS, подготовьте мастер-форму с использованием латуни с помощью микрообработки с числовым программным управлением (ЧПУ).
ПРИМЕЧАНИЕ: В зависимости от размеров канала, для создания мастер-формы могут использоваться методы фотолитографии. Устройство, используемое в данном протоколе, включает в себя восемь параллельных микромеханических каналов шириной приблизительно 480 мкм, высотой 140 мкм на входе и выходе устройства и высотой 40 мкм на стенозе устройства, с длиной пандуса в/от стенозирующей области приблизительно 0,3 мм. Длина канала составляет примерно 6 мм. - С помощью полученной мастер-формы вылейте силиконовую эластомерную основу (полученную из набора эластомеров) в чашку для взвешивания. Добавьте силиконовый отвердитель (полученный из набора эластомеров), который способствует сшивке цепей силиконового полимера для преобразования жидкого PDMS в прочное и гибкое твердое вещество в соотношении 10:1 (базовый агент) и хорошо перемешайте смесь.
- Поместите форму в чашку Петри и вылейте на форму неотвержденный PDMS. Поместите чашку Петри в вакуумный эксикатор на 30 минут, чтобы удалить пузырьки.
- Завершите отверждение PDMS в мастер-форме, поместив ее в печь, настроенную на 70 °C, на 90 минут.
- После полного отверждения PDMS вырежьте микрофлюидный слепок с помощью бритвенного лезвия или скальпеля. Пробейте отверстия по краям каналов (1,5 мм в диаметре с обеих сторон).
- С помощью лабораторной ленты очистите поверхность предметного стекла и протравленную сторону микрофлюидного слепка. При необходимости используйте сжатый воздух для удаления оставшегося мусора.
- Поместите предметное стекло и микрофлюидный слепок травленой стороной вверх в плазменный очиститель. Запустите вакуумный насос, загерметизируйте камеру и включите плазменный очиститель на высокую настройку. Оставьте предметное стекло и PDMS в плазменном очистителе на 30 с, затем выключите плазменный очиститель и снимите вакуум.
- Свяжите очищенный плазмой литой материал и предметное стекло вместе, аккуратно прижав друг к другу стороны, которые были обращены вверх в плазменном очистителе. Затем поместите микрофлюидное устройство в духовку/конфорку при температуре 70 °C на 10 минут.
ПРИМЕЧАНИЕ: Не прикладывайте слишком большого давления при склеивании литого литья и стекла вместе, так как это может привести к потере морфологии канала. - Промойте каждую камеру 10-30 μл 70% этанола для стерилизации и дайте микрофлюидному устройству высохнуть на горячей плите при температуре 70 °C.
ПРИМЕЧАНИЕ: Устройства должны быть изготовлены не менее чем за 24 часа, но могут быть изготовлены за недели или месяцы. Устройства следует хранить в герметичном контейнере или закрытой чашке Петри при комнатной температуре. - За день до эксперимента с микрофлюидным устройством повторно промойте каждую камеру 10-30 мкл 70% этанола для стерилизации и дайте микрофлюидному устройству высохнуть на конфорке при температуре 70 °C.
- Покройте камеру реагентом для фибриллярного коллагена лошадей 1-го типа (1 мг/мл), разведенным в 0,9% NaCl в объемном соотношении 1:5 через назначенное выходное отверстие к назначенному входу. Убедитесь, что направленность в эксперименте сохраняется. Храните устройство в теплом, влажном закрытом контейнере, чтобы предотвратить испарение коллагена с покрытием внутри канала.
- Через 1 час промойте фосфатно-солевым буфером (PBS), чтобы вымыть раствор коллагена. Заподлицо в направлении, противоположном нанесению покрытия. Когда устройство не используется, храните его в теплом, влажном закрытом контейнере.
2. Подготовка образца крови
- Получите образец цитратной цельной крови с помощью венепункции. Инкубируйте цицитированную цельную кровь с раствором, блокирующим рецепторы ФК (1:600).
ПРИМЕЧАНИЕ: Образцы крови хранятся при комнатной температуре до и во время эксперимента. - Инкубируйте цицитированную цельную кровь с флуоресцентно-конъюгированными (с использованием флуорофора выбора) антителами к CD41 (1:600). Заморочьте на 30 минут на качалке.
- В качестве положительного контроля ингибирования тромбоцитов добавьте Тикагрелор, антагонист рецепторов P2Y12, восстановленный в растворе 30% w/v 2-гидроксипропил-β-циклодекстрина (HP-β-CD) в PBS.
ПРИМЕЧАНИЕ: Необходимо подготовить запасы тикагрелора до 6,4 мМ и провести дальнейшее разведение запасов тикагрелора в растворе HP-β-CD (30% HP-β-CD, растворенных в PBS) до начала эксперимента (рекомендуется 1000-кратная концентрация запаса). - Инкубировать цитратный образец с тикагрелором (конечная концентрация до 6,4 мкМ) в течение 30 мин для наблюдения за ингибированием тромбоцитов.
- При смешивании продукта крови с цитратным образцом окрасьте продукт крови раствором, блокирующим рецептор ФК (1:600) и флуоресцентно-конъюгированным (с использованием отдельного флуорофора к цитратированному образцу) антителом CD41 (1:600).
- Смешайте объемный эквивалент единиц перелитого продукта с цитратным образцом. Например, чтобы смоделировать 2 единицы продуктов тромбоцитов, перелитых человеку с кровотечением (примерно 250 мл на продукт в общем объеме крови 5000 мл), смешайте 100 мкл продукта крови с 1000 мкл образца цитратной крови.
- Непосредственно перед экспериментом отфильтруйте образец крови через фильтр 40 мкм в стерильную микроцентрифужную пробирку объемом 1,5 мл.
3. Проверка функции тромбоцитов под действием потока (Метод 1)
- Включите микроскоп и соответствующее программное обеспечение.
- Установите уровень отвода шприца насосом с помощью предметного столика микроскопа. Отрегулируйте настройки на шприцевой помпе.
- Рассчитайте объемный расход (Q) для желаемой средней скорости сдвига стенки (γ) 3 500 с-1 в стенотической области канала, используя уравнения (1) и (2)21.
 (1)
(1)
 (2)
(2)
Где A — площадь поперечного сечения канала, P — увлажненный периметр, λ — коэффициент формы, b — короткая сторона прямоугольника (высота), а a — длинная сторона прямоугольника (ширина).
ПРИМЕЧАНИЕ: Значение 3,500 с-1 выбрано из-за критического сдвига VWF и находится в артериальном режиме 7,22,23.
- Рассчитайте объемный расход (Q) для желаемой средней скорости сдвига стенки (γ) 3 500 с-1 в стенотической области канала, используя уравнения (1) и (2)21.
- Поместите микрофлюидное устройство на предметный столик микроскопа. Прикрепите края микрофлюидного устройства к сцене, чтобы избежать движения. Убедитесь, что выходное отверстие обращено к задней части микроскопа.
- Подсоедините один конец трубки с внутренним диаметром 1/16 дюйма (длиной около 30 см) к локтевому соединителю, а другой конец — к шприцу объемом 10 мл с внутренним разъемом 1/16 дюйма.
- Наполните шприц стерильным PBS и подсоедините его к шприцевому насосу.
- Вставьте локтевый разъем в розетку устройства.
- Подготовьте впускные трубопроводы длиной около 10 см с коленчатым соединителем на одном конце и угловым вырезом на другом конце.
- Подсоедините входной угловой разъем к входу устройства.
- Поместите впускную линию в пробирку для отходов микроцентрифуги на угловом держателе.
- Используйте объектив 10x для размеров канала шириной около 500 μм и сосредоточьтесь на краях канала микрофлюидного устройства.
- Загрунтуйте трубопроводы PBS и очистите канал от PDMS/мусора, перемещая шприцевой насос вручную. Обязательно проверьте рядом с входом и выходом канала.
- Откройте сохраненные настройки захвата изображений или создайте процедуру захвата изображений временных рядов, снятых каждые 1–2 с с помощью светлопольного канала и флуоресцентных каналов, соответствующих флуоресцентным антителам к CD41, используемым в образце крови.
- Возьмите отфильтрованный образец цитированной крови и смешайте с помощью пипетирования вверх и вниз непосредственно перед экспериментом. Поместите образец на угловой держатель микроцентрифуги.
- Поместите впускную линию в образец.
- Начните запись снимка.
- Медленно извлеките шприц, чтобы заполнить мертвый объем в трубке. Как только кровь достигнет канала, немедленно нажмите кнопку воспроизведения на шприцевом насосе, чтобы возобновить поток с желаемой скоростью сдвига.
- При необходимости отрегулируйте фокус.
- Проводите эксперимент до тех пор, пока тромбоциты полностью не окклюзируют стенотическую область микрофлюидного устройства или до экспериментальной конечной точки (т.е. 10 минут).
- Убедитесь, что входная трубка погружена в образец крови на время эксперимента.
- После завершения эксперимента остановите захват изображения и остановите работу шприцевого насоса. Сохраните снимок.
- Снимите впускной соединитель колена и вылейте содержимое трубки в конус для отходов. Слейте содержимое шприца и выпускных линий также в коническую для отходов.
- При необходимости замените впускной и выпускной патрубки и трубки для последующих проб.
4. Проверка функции тромбоцитов в потоке с образцами малого объема (менее 1 мл) (метод 2)
- Повторите шаги с 1.1 по 1.4, как указано выше.
- Пробейте выпускное отверстие диаметром 1,5 мм и входное отверстие диаметром 3 мм по краям каналов.
- Повторите шаги с 1.6 по 3.6, как указано выше.
- Используйте объектив 10x для размеров канала шириной около 500 μм и сосредоточьтесь на краях канала микрофлюидного устройства.
- Очистите канал от PDMS/мусора, вручную переместив шприцевой насос и откачав доступную жидкость с помощью лабораторной салфетки. Удалите мусор с помощью лабораторной ленты в верхней части микрофлюидного устройства.
- Вручную продвиньте насос, чтобы заполнить впускной бачок диаметром 3 мм PBS.
- Откройте сохраненные настройки захвата изображений или создайте процедуру захвата изображений временных рядов, снятых каждые 1–2 с с помощью светлопольного канала и флуоресцентных каналов, соответствующих флуоресцентным антителам к CD41, используемым в образце крови.
- Начните забор на шприцевом насосе (вручную или с заданной скоростью) и как только PBS будет продвигаться в канал и линия наполнения в резервуаре пойдет вниз, приостановить забор на насосе.
- Удалите излишки PBS из резервуара с помощью пипетки.
- Запустите захват изображения.
- Нанесите образец крови пипеткой в резервуар (примерно 40 мкл) и немедленно запустите шприц для забора. Убедитесь, что поток запустился.
ПРИМЕЧАНИЕ: Если двигатель шприцевого насоса для вывода не был заправлен на шаге 4.8, поток не начнется немедленно, и эксперимент следует повторить. - Пополняйте резервуар с кровью на время эксперимента, следя за тем, чтобы в канал не попадали воздушные карманы.
- Проводите эксперимент до тех пор, пока тромбоциты полностью не окклюзируют стенотическую область микрофлюидного устройства или до экспериментальной конечной точки (т.е. через 10 минут).
- После завершения эксперимента остановите захват изображения и остановите работу шприцевого насоса. Сохраните снимок.
- Удалите избыток крови в резервуаре с помощью пипетирования. Вылейте содержимое отводной трубки в отработанную коническую трубку.
- При необходимости замените соединители и трубки для последующих образцов.
5. Обеззараживание
- Очистите входные и выходные линии от крови, промыв в 10% растворе отбеливателя.
- Если все каналы микрофлюидного устройства были использованы, выбросьте устройство в контейнер для биологически опасных отходов Sharps.
ПРИМЕЧАНИЕ: Все биологические отходы должны быть утилизированы вместе с биологически опасными отходами надлежащим образом.
6. Анализ изображений
- Экспортируйте изображения из кинетических экспериментов с помощью программного обеспечения, нажав «Файл» | Экспорт/Импорт | Экспорт.
- Выберите следующие параметры: тип файла: Tagged Image File Format (TIFF); компрессия: LZW; проверить исходные данные и сдвинуть пиксель; снимите флажок Применить кривую отображения и цвет канала; отметьте Определить подмножество (Область, Прямоугольная область и выберите область канала с сохранением измерения ширины и высоты между условиями). Экспортируйте в нужную папку и отметьте галочкой «Создать папку».
- Обратите внимание на следующие экспериментальные значения в программном обеспечении: запуск кадра , когда кровь поступает в канал; частота кадров (информация, временные ряды).
- Измерьте нормализованную среднюю интенсивность флуоресценции каждого кадра в эксперименте с использованием кода Matlab, предоставленного в качестве дополнительного файла 1, изменяя следующие входные данные для каждого эксперимента: начальный кадр/конечный кадр в зависимости от длины эксперимента (убедитесь, что длина эксперимента сохраняется между условиями); название эксперимента/название папки; обрезка параметров X, Y, H и W. Запустите код один раз для флуоресцентного канала тромбоцитов получателя и один раз для флуоресцентного канала тромбоцитов продукта. Отчет о нормализованных значениях MFI (столбец 2) и нормализованных значениях AUC (нормализованных к начальному кадру). Вычтите значение длины эксперимента из нормализованного значения AUC.
Результаты
Микрофлюидные эксперименты после использования этого метода должны показать образование богатых тромбоцитами тромбов в области стеноза проточного канала (рис. 1). На рисунке 1А показаны репрезентативные результаты, когда функциональные тромбоциты образовывали тромб в стенозированной области канала, блокируя кровоток через канал. Кривые средней интенсивности флуоресценции (MFI) кинетических изображений, полученных в течение эксперимента, иллюстрируют запаздывающую, рост и фазу плато включения тромбоцитов в растущий тромб (рис. 2A, C). Увеличение концентрации антагониста P2Y12, тикагрелора, снижает МФИ тромбоцитов, а также рассчитанную площадь под кривой (AUC) кривых ИМП (рис. 2B, D). Для наблюдения выраженной дисфункции тромбоцитов требуется более длительное время инкубации (30 мин по сравнению с 5 мин) в соответствии с более выраженной зависимостью «доза-реакция» с использованием импедансной агрегометрии цельной крови после 30-минутной инкубации тикагрелора по сравнению с 5-минутной инкубацией (дополнительный рисунок S1). При различных условиях использования транспортных средств аналогичные зависящие от времени эффекты ингибирования P2Y12 наблюдались в микрофлюидной модели (дополнительный рисунок S2).
Визуализация двух популяций тромбоцитов в смоделированном методе гемостатической реанимации иллюстрирует включение обеих популяций тромбоцитов в тромб (рис. 3A). Включение обеих популяций тромбоцитов в соответствующий флуоресцентный сигнал может быть количественно количественно определено кинетически в течение эксперимента с помощью измерений MFI (рис. 3B). Более крутые наклоны в фазе роста, а также увеличение конечных точек измерений MFI демонстрируют повышенную функциональность тромбоцитов и гемостатический потенциал, что можно увидеть в количественном определении тромбоцитов-реципиентов, когда образец крови был индуцирован дисфункцией тромбоцитов путем ингибирования P2Y12, а затем в реанимации, смоделированной путем смешивания свежей аутологичной цельной крови в объемном соотношении 1:10, окрашенной отчетливым флуорофором тромбоцитов. При аутологичном смешивании цельной крови большее количество тромбоцитов было включено из моделируемого трансфункционирующего продукта по сравнению с продуктом аферезного тромбоцитов при 5-м дне хранения при комнатной температуре, что показало минимальное включение продукта в формирующийся тромб. Смешивание тромбоцитов комнатной температуры на 5-й день также показало более низкое включение тромбоцитов реципиентом по сравнению со свежей аутологичной цельной кровью (рисунок 3B).
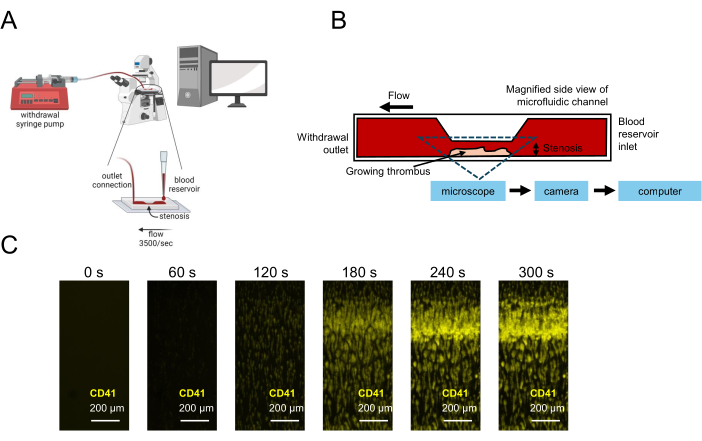
Рисунок 1: Представление тестирования функции тромбоцитов с использованием микрофлюидики. (A) Показана схематическая микрофлюидная экспериментальная установка для тестирования функции тромбоцитов с использованием образцов крови малого объема, включая насос для отвода шприца, протягивающий кровь через стенотическую проточную камеру, что позволяет получать изображения в режиме реального времени. (B) Показан вид сбоку на стенотическую проточную камеру, включая покрытую коллагеном поверхность, на которой тромбоциты будут прилипать, активироваться и агрегировать, что приводит к росту тромба в стенозированной области. (C) Съемка в режиме реального времени образца цитратной крови под потоком в стенотическом микрофлюидном канале (3500 с-1) и растущего тромба, сформированного в течение 300 с. Масштабные линейки = 200 μм (С). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
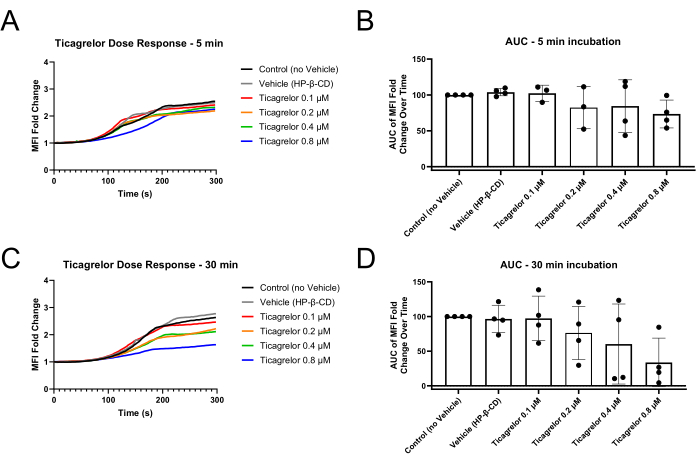
Рисунок 2: Уменьшение изменений кратности ИМП тромбоцитов и площадь под кривой после 30 мин инкубации с антагонистом P2Y12 Тикагрелором. (А) Инкубация с антагонистом P2Y12 в течение всего 5 мин демонстрирует несколько удлиненные запаздывающие фазы кривых ИМП и (В) небольшое снижение AUC ИМП. (C) Инкубация в течение 30 мин с антагонистом P2Y12 приводит к удлинению фаз лага и снижению конечных значений MFI, а также (D) более устойчивой дисфункции, демонстрируемой с помощью MFI AUC. Отдельные точки данных представляют биологические реплики, а среднее ± стандартное отклонение отображается. Сокращения: MFI = средняя интенсивность флуоресценции; AUC = площадь под кривой; HP-β-CD = 2-гидроксипропил-β-циклодекстрин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Смешивание продуктов крови с коагулопатическим ингибированием P2Y12 в образце реципиента, имитирующее дисфункцию тромбоцитов пациента, в микрофлюидной камере. (A) Аферезная тромбоцитарная единица (плазма, 7-й день хранения) (CD41 в голубом цвете), смешанная в соотношении 1:10 с цитратной кровью, предварительно инкубированной с 0,8 мкМ тикагрелором в течение 30 мин (CD41 в красном цвете). (B) Репрезентативные нормализованные средние кривые интенсивности флуоресценции образца крови реципиента, получающего либо аферезную тромбоцитарную единицу (5-й день хранения), либо аутологичную свежую цельную кровь (соотношение 1:10), а также кинетику тромбоцитов реципиента с течением времени. Кровь рецитриента предварительно инкубировали с 0,8 мкМ тикагрелором в течение 30 мин перед смешиванием с продуктами крови. (C) Репрезентативное изображение z-стека с модифицированного устройства, прикрепленного к покровному стеклу для конфокальной микроскопии. Продукт тромбоцитов афереза смешивали с образцом тромбоцитопенической крови в объемном соотношении 1:5 (продукт:кровь) в дополнение к антителам к фактору фон Виллебранда (1:600). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный файл 1: Код Matlab для анализа изображений. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S1: Зависимость импедансной агрегометрии цельной крови от времени ингибирования P2Y12 Тикагрелором. Инкубация в течение 30 мин приводит к более выраженной зависимости «доза-реакция» по сравнению с 5 мин. Растворы для транспортных средств и лекарств использовались в концентрации 0,1% по объему. Отдельные точки данных представляют биологические реплики, а среднее ± стандартное отклонение отображается. Сокращения: AUC = площадь под кривой; HP-β-CD = 2-гидроксипропил-β-циклодекстрин. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2:Зависящее от времени ингибирование P2Y12 Тикагрелором в микрофлюидной модели функции тромбоцитов. Репрезентативные кривые MFI и площадь под значениями кривой для технических реплик от индивидуального здорового донора показаны с использованием этанола (1% v/v), используемого для растворимости препарата. Сокращения: MFI = средняя интенсивность флуоресценции; AUC = площадь под кривой. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Вышеуказанный протокол включает в себя некоторые важные шаги для обеспечения надежности и воспроизводимости экспериментов. Во-первых, следует тщательно рассмотреть вопрос о флуоресцентных антителах. Антитела, используемые для обнаружения тромбоцитов в образце, не должны блокировать функцию рецептора гликопротеина Ib (GPIb) тромбоцитов. Согласование партий, когда это возможно между экспериментами, также имеет решающее значение для обеспечения воспроизводимости флуоресцентного сигнала. Еще одним важным шагом в этом протоколе является использование стерильных расходных материалов и растворов, а также отфильтрованных образцов, когда это возможно. Фильтрация образцов крови непосредственно перед экспериментом предотвратит блокирование потока мусором или сгустками тромбоцитов, размер которых превышает размеры канала, что является еще одним важным параметром, который необходимо поддерживать между экспериментами. Кроме того, образцы крови должны быть проверены в течение 4 часов после сбора, как описано в циркуляре с информацией об использовании человеческой крови и ее компонентов, подготовленном AABB, Американским Красным Крестом, Американскими центрами крови и Программой крови вооруженных сил, за исключением случаев тестирования на повреждение продуктов крови при хранении.
В этом протоколе могут быть учтены модификации, такие как приклеивание PDMS к покровному стеклу для конфокальной микроскопии, как показано на рисунке 3C. При необходимости, перед визуализацией, фиксирующий раствор может быть перфузирован через каналы и промыт PBS для хранения перед визуализацией. Кроме того, в то время как воспроизводимые размеры канала являются ключом к обеспечению сохраняющейся скорости сдвига между условиями, высота стенозирующей области может быть изменена, но будет напрямую влиять на время образования тромба, даже если скорость сдвига совпадает. Поскольку большие размеры канала потребуют больше времени для значительного образования тромбов, потребуется больший объем образца. При устранении неполадок в этом протоколе важным фактором должна быть стратегия нанесения покрытия. Конкретный тип коллагена, время, разведение и условия хранения — все это факторы, которые могут повлиять на поверхностное покрытие. Несмотря на то, что этот протокол был валидирован для данного конкретного коллагенового реагента (Таблица материалов), можно рассмотреть альтернативы коллагену, которые могут надежно прилипать к поверхности устройства и проверять адгезию с помощью иммунофлуоресцентного окрашивания или других мер, которые ранее успешно использовались другими группами24.
Потенциальным ограничением этого протокола является отсутствие прямого эндотелиального ответа. Тем не менее, стратегии нанесения покрытий и модификации могут быть сделаны для включения тестирования функции тромбоцитов в ответ на повреждение эндотелия. Например, воспалительные факторы, которые эндотелиальные клетки выделяют в ответ на повреждение, могут быть изменены в стратегии покрытия данного протокола или добавлены экзогенно в исследуемый образец крови. Добавление этих факторов без сложностей клелюляризации позволило бы разработать целенаправленный подход к изучению влияния эндотелиопатии на функцию тромбоцитов. Аналогичным образом, плазма пациента из больного или здорового контрольного состояния может быть введена в систему для проверки влияния растворимых в плазме медиаторов на функцию тромбоцитов.
Изучение функции тромбоцитов в потоке в соответствии с этим протоколом может облегчить изучение коагулопатии, вызванной травмой, и подходов трансфузионной медицины при травме. Текущее тестирование функции тромбоцитов часто чрезмерно или недостаточно потенцировано, чтобы увидеть дисфункциональную реакцию у пациента с травмой. Этот метод обеспечивает гибкость и модификацию конструкции для наблюдения за функцией тромбоцитов в образцах пациентов с травмой, даже с ограничениями по объему, в дополнение к моделированию дисфункции тромбоцитов для оценки терапевтических вмешательств. Помимо пациентов с травмой, этот метод может быть рассмотрен для пациентов с послеродовым кровотечением, кардиохирургических пациентов или онкологических пациентов для оценки функциональности тромбоцитов и потенциальных терапевтических вмешательств. Важно отметить, что этот метод включает в себя динамику потока, которая имеет решающее значение для механизмов формирования тромбоцитарных пробок и гемостатической функции.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Авторы выражают признательность и благодарят всех доноров крови, которые приняли участие, а также флеботомистов Исследовательской лаборатории травматологии и трансфузионной медицины и Центр клинических и трансляционных исследований UPMC Montefiore за помощь в сборе средств. SMS поддерживает K25HL161401. MDN поддерживается 1R01HL166944-01A1.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
Ссылки
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112(2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509(2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502(2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62(2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены