Method Article
Microfluidica nella valutazione della funzione piastrinica
In questo articolo
Riepilogo
La funzione piastrinica sotto flusso può essere valutata e la rianimazione emostatica simulata può essere modellata utilizzando un dispositivo microfluidico, che ha applicazioni nella medicina traumatologica e trasfusionale.
Abstract
La microfluidica incorpora substrati e flussi fisiologicamente rilevanti che imitano la vascolarizzazione e sono, quindi, uno strumento prezioso per studiare gli aspetti della trombosi e dell'emostasi. In ambienti ad alto taglio che simulano il flusso arterioso, un saggio microfluidico facilita lo studio della funzione piastrinica, poiché i trombi ricchi di piastrine si formano in una regione stenotica localizzata di un canale di flusso. L'utilizzo di dispositivi che consentono un volume di campione ridotto può inoltre aiutare a valutare la funzione piastrinica sotto flusso da campioni di pazienti o modelli animali a volume limitato. Lo studio di campioni di pazienti traumatizzati o di campioni successivi alla trasfusione di prodotti piastrinici può aiutare a indirizzare le strategie terapeutiche per le popolazioni di pazienti in cui la funzione piastrinica è fondamentale. In questo modello possono essere studiati anche gli effetti dell'inibizione piastrinica tramite agenti farmacologici. L'obiettivo di questo protocollo è quello di stabilire una piattaforma microfluidica che incorpori il flusso fisiologico, le superfici biologiche e i meccanismi emostatici rilevanti per valutare la funzione piastrinica con implicazioni per lo studio della coagulopatia indotta da traumi e della medicina trasfusionale.
Introduzione
Il trauma è una delle principali cause globali di morte e disabilità. La lesione grave è spesso complicata da un disturbo endogeno unico dell'emostasi e della trombosi, definito coagulopatia indotta da trauma (TIC)1. Le piastrine svolgono un ruolo fondamentale nella TIC e sono state descritte come aventi funzioni sia adattative che disadattive2. I meccanismi della disfunzione piastrinica dopo la lesione rimangono poco chiari e vi è un bisogno critico di comprendere meglio la risposta cellulare per guidare lo sviluppo di una migliore rianimazione e terapia. Un ulteriore problema fastidioso per quanto riguarda la funzione piastrinica dopo una lesione è l'incertezza dell'affidabilità delle attuali letture della funzione piastrinica nel paziente traumatizzato.
Diversi studi hanno dimostrato che anche i pazienti lievemente danneggiati, senza fenotipo di sanguinamento clinico noto, hanno una funzione piastrinica anormale utilizzando test convenzionali di funzionalità piastrinica come l'aggregometria 3,4. Tuttavia, i limiti dell'aggregometria per valutare la funzione piastrinica in un contesto di lesione includono la mancanza di una superficie della lesione fisiologicamente rilevante, un approccio riduzionista alla stimolazione degli agonisti, la diluizione del campione con aggregometria di impedenza del sangue intero, la separazione del plasma con aggregometria a trasmissione ottica della luce e la valutazione stagnante del campione. Inoltre, non è chiaro se questa sensibilità della funzione piastrinica rappresenti una vera disfunzione cellulare o un artefatto di misurazione, come l'aumento dell'impedenza elettrica di base, nel contesto della lesione2. Pertanto, lo studio delle funzioni piastriniche rilevanti nel contesto del trauma è fondamentale per comprendere la TIC e c'è un notevole spazio per l'innovazione e il miglioramento in questo settore.
Le piattaforme tradizionalmente utilizzate per studiare la funzione piastrinica non includono la fluidodinamica e il flusso, che possono essere fondamentali per comprendere la disfunzione piastrinica relativa al trauma e alla coagulopatia indotta da traumi5. I meccanismi dell'emostasi che dipendono dal flusso includono l'allungamento del fattore di von Willebrand (VWF) ad alto taglio, al di sopra di una velocità di taglio critica, e la cattura piastrinica tramite glicoproteina 1b 6,7,8, che non vengono catturati utilizzando saggi di funzionalità piastrinica stagnante. Inoltre, le piastrine legano preferenzialmente il VWF o il fibrinogeno a seconda del regime di flusso e suscitano ruoli differenziali nella trombosi arteriosa rispetto a quella venosa 9,10. I trombi arteriosi sono costituiti principalmente da piastrine, mentre i trombi venosi sono costituiti principalmente da globuli rossi, basandosi, in parte, sui regimi di flusso11. I saggi che incorporano regimi di flusso possono aiutare a chiarire le disfunzioni relative allo spettro dei fenotipi TIC, dai fenotipi di ipocoagulabilità e sanguinamento all'ipercoagulabilità e ai fenotipi trombotici. Infine, i vincoli di campionamento del volume ematico con popolazioni di pazienti traumatizzati possono rendere difficile il test tradizionale della funzionalità piastrinica. Sebbene saggi come la citometria a flusso possano e debbano essere utilizzati in queste circostanze, i risultati spesso descrivono una caratterizzazione fisica di un campione e non una valutazione funzionale emostatica.
Mentre i meccanismi della disfunzione piastrinica possono non essere completamente compresi nei traumi, la modellazione della disfunzione piastrinica in vitro, ad esempio con antagonisti P2Y12, può anche aiutare a guidare lo studio degli interventi terapeutici. La rianimazione emostatica è di fondamentale importanza nei pazienti traumatizzati in cui gli emoderivati vengono trasfusi in un approccio bilanciato per affrontare lo shock, la coagulopatia e il danno endoteliale con sangue intero o componenti del sangue (globuli rossi, plasma e concentrati piastrinici) in un rapporto unitario 1:1:1 12,13,14. Nei pazienti traumatizzati, l'uso precoce di emoderivati è associato a un miglioramento della sopravvivenza15,16. Per prolungare la durata di conservazione, i prodotti piastrinici conservati a freddo sono stati sempre più studiati. L'esame delle piastrine conservate a freddo mostra un aumento dell'attività emostatica, nonché sicurezza quando trasfuse dopo una lesione17,18.
L'evoluzione della rianimazione piastrinica con celle frigorifere sottolinea la necessità di ulteriori test per comprendere il prodotto piastrinico più efficace disponibile per i traumi. Tuttavia, i saggi tradizionali della funzione piastrinica sono spesso sovra o sottopotenziati per rilevare la disfunzione, che si verifica sia nel paziente traumatizzato che riceve trasfusioni piastriniche terapeutiche, sia nel prodotto trasfuso stesso osservato nelle lesioni da accumulo piastrinico. Determinare l'origine della disfunzione può essere difficile, date le limitazioni degli attuali test di funzionalità piastrinica, inclusa la natura statica della maggior parte di questi test. Pertanto, quando si studia la rianimazione emostatica in vitro, la piattaforma e i metodi di rilevamento per le popolazioni piastriniche del ricevente e del prodotto sono di fondamentale importanza nel determinare gli interventi terapeutici ottimali.
I test microfluidici offrono profili di flusso e superfici biofidelizzanti per creare un test fisiologicamente rilevante su cui studiare le piastrine. I dispositivi microfluidici possono essere personalizzati per studiare particolari fisiopatologie o tipi di lesioni, come la puntura del vaso19 o il danno endoteliale20. Questi dispositivi sono generalmente costituiti da polidimetilsilossano (PDMS) legato a un vetrino da microscopio con modifiche superficiali, come il collagene, per imitare il subendotelio e le lesioni tissutali. L'utilizzo di questi tipi di dispositivi basati sul flusso può aiutare a guidare la ricerca sulla disfunzione piastrinica correlata al trauma e aiutare a esaminare gli approcci ottimali della medicina trasfusionale per migliorare la disfunzione piastrinica. Queste strategie possono aiutare a chiarire la confusione esistente sulla rilevanza dei test statici piastrinici come l'aggregometria nel paziente ferito.
Protocollo
Tutte le ricerche sono state condotte nel rispetto delle linee guida istituzionali. È stata ottenuta l'approvazione dall'Ufficio per la protezione della ricerca umana dell'Università di Pittsburgh ed è stato ottenuto il consenso informato da volontari umani sani.
1. Preparazione del dispositivo microfluidico
- Per fabbricare la parte PDMS del dispositivo, preparare uno stampo master utilizzando l'ottone tramite microlavorazione a controllo numerico computerizzato (CNC).
NOTA: A seconda delle dimensioni del canale, le tecniche di fotolitografia possono essere utilizzate per creare uno stampo master. Il dispositivo utilizzato in questo protocollo include otto canali paralleli microlavorati di circa 480 μm di larghezza, 140 μm di altezza all'ingresso e all'uscita del dispositivo e 40 μm di altezza alla stenosi del dispositivo, con una lunghezza della rampa da/verso la regione stenotica di circa 0,3 mm. La lunghezza dei canali è di circa 6 mm. - Con uno stampo master ottenuto, versare la Base in Elastomero Siliconico (ottenuta dal kit di elastomeri) in un piatto di pesatura. Aggiungere l'agente indurente siliconico (ottenuto dal kit di elastomeri), che facilita la reticolazione delle catene del polimero siliconico per trasformare il PDMS liquido in un solido durevole e flessibile, in un rapporto di 10:1 (agente di base) e mescolare bene la miscela.
- Mettere lo stampo in una capsula di Petri e versare il PDMS non polimerizzato sullo stampo. Mettere la capsula di Petri all'interno di un essiccatore sottovuoto per 30 minuti per rimuovere le bolle.
- Terminare l'indurimento del PDMS nello stampo master mettendolo in forno a 70 °C per 90 minuti.
- Dopo la completa polimerizzazione PDMS, ritagliare il calco microfluidico utilizzando una lama di rasoio o un bisturi. Praticare dei fori ai bordi dei canali (1,5 mm di diametro su entrambi i lati).
- Utilizzando del nastro adesivo da laboratorio, pulire la superficie di un vetrino e il lato inciso del calco microfluidico. Utilizzare aria compressa secondo necessità per rimuovere i detriti rimanenti.
- Posizionare il vetrino e il calco microfluidico con il lato inciso verso l'alto in un pulitore al plasma. Avviare la pompa del vuoto, sigillare la camera e accendere il pulitore al plasma al massimo. Lasciare il vetrino e il PDMS nel pulitore al plasma per 30 s, quindi spegnere il pulitore al plasma e rimuovere l'aspirapolvere.
- Unire il cast pulito al plasma e il vetrino premendo delicatamente i lati rivolti verso l'alto nel pulitore al plasma. Quindi, posizionare il dispositivo microfluidico in un forno/piastra a 70 °C per 10 minuti.
NOTA: Non applicare troppa pressione quando si incollano insieme il cast e il vetrino in quanto ciò potrebbe portare a una perdita della morfologia del canale. - Sciacquare ogni camera con 10-30 μL di etanolo al 70% per sterilizzare e lasciare asciugare il dispositivo microfluidico su una piastra riscaldante a 70 °C.
NOTA: I dispositivi devono essere realizzati con almeno 24 ore di anticipo, ma possono essere realizzati con settimane o mesi di anticipo. I dispositivi devono essere conservati in un contenitore ermetico o in una capsula di Petri coperta a temperatura ambiente. - Il giorno prima della sperimentazione con il dispositivo microfluidico, risciacquare nuovamente ogni camera con 10-30 μL di etanolo al 70% per sterilizzare e lasciare asciugare il dispositivo microfluidico su una piastra riscaldante a 70 °C.
- Rivestire la camera con il reagente di collagene fibrillare equino di tipo 1 (1 mg/mL), diluito in NaCl allo 0,9% in un rapporto volumetrico 1:5 attraverso un'uscita designata all'ingresso designato. Assicurarsi che la direzionalità sia conservata all'interno di un esperimento. Conservare il dispositivo in un contenitore chiuso caldo e umido per evitare l'evaporazione del collagene rivestito all'interno del canale.
- Dopo 1 ora, risciacquare con soluzione salina tamponata con fosfato (PBS) per eliminare la soluzione di collagene. Sciacquare nella direzione opposta al rivestimento. Quando non è in uso, conservare nuovamente il dispositivo in un contenitore caldo, umido e chiuso.
2. Preparazione del campione di sangue
- Ottenere un campione di sangue intero citrato tramite venipuntura. Incubare il sangue intero citrato con una soluzione bloccante del recettore FC (1:600).
NOTA: I campioni di sangue vengono conservati a temperatura ambiente prima e durante la sperimentazione. - Incubare sangue intero citrato con anticorpo CD41 coniugato a fluorescenza (utilizzando un fluoroforo a scelta) (1:600). Macchiare per 30 minuti su un rocker nutante.
- Come controllo positivo per l'inibizione piastrinica, aggiungere Ticagrelor, un antagonista del recettore P2Y12 ricostituito in una soluzione di 2-idrossipropil-β-ciclodestrina al 30% p/v (HP-β-CD) in PBS.
NOTA: Prima della sperimentazione devono essere preparate le scorte di Ticagrelor fino a 6,4 mM e può essere effettuata un'ulteriore diluizione delle scorte di Ticagrelor in soluzione di HP-β-CD (30% di HP-β-CD disciolto in PBS) (si raccomandano concentrazioni di 1.000 volte). - Incubare il campione citrato con Ticagrelor (concentrazione finale fino a 6,4 μM) per 30 minuti per osservare l'inibizione piastrinica.
- Se si mescola l'emoderivato con il campione cittrato, colorare l'emoderivato con una soluzione bloccante del recettore FC (1:600) e un anticorpo CD41 coniugato con fluorescenza (utilizzando un fluoroforo separato e distinto dal campione citato) (1:600).
- Miscelare un equivalente volumetrico delle unità di prodotto trasfuse con il campione cittrato. Ad esempio, per simulare 2 unità di prodotti piastrinici trasfusi in una persona in emorragia (circa 250 ml per prodotto in un volume ematico totale di 5.000 ml), mescolare 100 μl di emoderivato in 1.000 μl di campione di sangue cittrato.
- Immediatamente prima dell'esperimento, filtrare il campione di sangue attraverso un filtro da 40 μm in una provetta sterile da microcentrifuga da 1,5 ml.
3. Test di funzionalità piastrinica sotto flusso (Metodo 1)
- Accendere il microscopio e il software associato.
- Impostare un livello della pompa della siringa di estrazione con il tavolino del microscopio. Regolare le impostazioni sulla pompa a siringa.
- Calcolare una portata volumetrica (Q) per una velocità di taglio media desiderata (γ) di 3.500 s-1 nella regione stenotica del canale utilizzando le equazioni (1) e (2)21.
 (1)
(1)
 (2)
(2)
Dove A è l'area della sezione trasversale del canale, P è il perimetro bagnato, λ è il fattore di forma, b è il lato corto del rettangolo (altezza) e a è il lato lungo del rettangolo (larghezza).
NOTA: Il valore di 3.500 s-1 è scelto a causa del taglio critico VWF ed è nel regime arterioso 7,22,23.
- Calcolare una portata volumetrica (Q) per una velocità di taglio media desiderata (γ) di 3.500 s-1 nella regione stenotica del canale utilizzando le equazioni (1) e (2)21.
- Posizionare il dispositivo microfluidico sul tavolino del microscopio. Fissare i bordi del dispositivo microfluidico al tavolino per evitare movimenti. Assicurarsi che l'uscita sia rivolta verso il retro del microscopio.
- Collegare un'estremità di un tubo con diametro interno da 1/16" (lungo circa 30 cm) a un connettore a gomito e l'altra estremità a una siringa da 10 ml con connettore con diametro interno da 1/16".
- Riempire la siringa con PBS sterile e collegarla alla pompa a siringa.
- Posizionare il connettore a gomito nella presa del dispositivo.
- Preparare linee di ingresso lunghe circa 10 cm con il connettore a gomito su un'estremità e il taglio angolato sull'altra estremità.
- Collegare il connettore a gomito di ingresso all'ingresso del dispositivo.
- Posizionare la linea di ingresso in una provetta per microcentrifuga di scarto su un supporto angolato.
- Utilizzare l'obiettivo 10x per dimensioni del canale di circa 500 μm di larghezza e concentrarsi sui bordi del canale del dispositivo microfluidico.
- Adescare le linee con PBS e liberare il canale da eventuali PDMS/detriti facendo avanzare manualmente la pompa a siringa. Assicurati di controllare vicino all'ingresso e all'uscita del canale.
- Aprire le impostazioni di acquisizione delle immagini salvate o creare una procedura di acquisizione delle immagini per le serie temporali acquisite ogni 1-2 s con un canale di campo chiaro e canali fluorescenti corrispondenti agli anticorpi fluorescenti CD41 utilizzati nel campione di sangue.
- Ottenere il campione di sangue citrato filtrato e mescolarlo pipettandolo su e giù appena prima dell'esperimento. Posizionare il campione sul supporto angolato per microcentrifuga.
- Posizionare la linea di ingresso nel campione.
- Avvia la registrazione dell'acquisizione dell'immagine.
- Lentamente, estrarre la siringa per riempire il volume morto nel tubo. Una volta che il sangue raggiunge il canale, premere immediatamente play sulla pompa a siringa per riprendere il flusso alla velocità di taglio desiderata.
- Regolare la messa a fuoco se necessario.
- Eseguire l'esperimento fino a quando le piastrine non hanno completamente occluso la regione stenotica del dispositivo microfluidico o fino a un punto finale sperimentale (cioè 10 minuti).
- Assicurarsi che il tubo di ingresso sia immerso nel campione di sangue per tutta la durata dell'esperimento.
- Una volta completato l'esperimento, interrompere l'acquisizione dell'immagine e arrestare la pompa a siringa. Salva l'acquisizione dell'immagine.
- Rimuovere il connettore a gomito di ingresso e svuotare il contenuto del tubo in un conico di scarico. Svuotare anche il contenuto della siringa e le linee di uscita nei rifiuti conici.
- Sostituire i connettori di ingresso e di uscita e i tubi, se necessario, per i campioni successivi.
4. Test di funzionalità piastrinica sotto flusso con campioni a basso volume (inferiori a 1 mL) (Metodo 2)
- Ripetere i passaggi da 1.1 a 1.4 come sopra.
- Perforare un'uscita di 1,5 mm di diametro e un'entrata di 3 mm di diametro ai bordi dei canali.
- Ripetere i passaggi da 1.6 a 3.6 come sopra.
- Utilizzare l'obiettivo 10x per dimensioni del canale di circa 500 μm di larghezza e concentrarsi sui bordi del canale del dispositivo microfluidico.
- Liberare il canale da eventuali PDMS/detriti facendo avanzare manualmente la pompa a siringa e allontanando il fluido di accesso con una salvietta da laboratorio. Rimuovere eventuali detriti con del nastro adesivo da laboratorio sulla parte superiore del dispositivo microfluidico.
- Far avanzare manualmente la pompa per riempire il serbatoio di ingresso da 3 mm con PBS.
- Aprire le impostazioni di acquisizione delle immagini salvate o creare una procedura di acquisizione delle immagini per le serie temporali acquisite ogni 1-2 s con un canale di campo chiaro e canali fluorescenti corrispondenti agli anticorpi fluorescenti CD41 utilizzati nel campione di sangue.
- Avviare l'estrazione della pompa a siringa (manualmente o con la velocità impostata) e una volta che il PBS avanza nel canale e la linea di riempimento nel serbatoio sta scendendo, mettere in pausa l'estrazione della pompa.
- Rimuovere il PBS in eccesso dal serbatoio con una pipetta.
- Avvia l'acquisizione dell'immagine.
- Pipettare il campione di sangue nel serbatoio (circa 40 μL) e avviare immediatamente la siringa di prelievo. Assicurati che il flusso inizi.
NOTA: Se il motore della pompa a siringa per l'estrazione non è stato innescato al passaggio 4.8, il flusso non si avvierà immediatamente e l'esperimento deve essere ripetuto. - Riempire il serbatoio di sangue per tutta la durata dell'esperimento, assicurandosi che nessuna sacca d'aria entri nel canale.
- Eseguire l'esperimento fino a quando le piastrine non hanno completamente occluso la regione stenotica del dispositivo microfluidico o fino a un punto finale sperimentale (cioè 10 minuti).
- Una volta completato l'esperimento, interrompere l'acquisizione dell'immagine e arrestare la pompa a siringa. Salva l'acquisizione dell'immagine.
- Rimuovere il sangue in eccesso nel serbatoio mediante pipettaggio. Svuotare il contenuto del tubo di prelievo in un tubo conico di scarico.
- Sostituire i connettori e i tubi, se necessario, per i campioni successivi.
5. Decontaminazione
- Eliminare le linee di ingresso e uscita dal sangue versandolo in una soluzione di candeggina al 10%.
- Se sono stati utilizzati tutti i canali del dispositivo microfluidico, gettare il dispositivo nel contenitore dei rifiuti a rischio biologico Sharps.
NOTA: Tutti i rifiuti biologici devono essere smaltiti in modo appropriato nei rifiuti a rischio biologico.
6. Analisi delle immagini
- Esporta le immagini dagli esperimenti cinetici utilizzando il software facendo clic su File | Esportazione/Importazione | Esporta.
- Seleziona i seguenti parametri: tipo di file: Tagged Image File Format (TIFF); compressione: LZW; controllare i dati originali e il pixel di spostamento; deselezionare Applica curva di visualizzazione e colore del canale; selezionare Definisci sottoinsieme (regione, regione rettangolare e selezionare l'area del canale con una misura di conservazione della larghezza e dell'altezza tra le condizioni). Esporta nella cartella desiderata e seleziona Crea cartella.
- Notare i seguenti valori sperimentali sul software: frame iniziale quando il sangue entra nel canale; frame rate (Info, Serie Storiche).
- Misurare l'intensità di fluorescenza media normalizzata di ciascun fotogramma in un esperimento utilizzando il codice Matlab fornito come file supplementare 1, modificando i seguenti input per ogni esperimento: fotogramma iniziale/fotogramma finale in base alla lunghezza dell'esperimento (assicurarsi che la lunghezza dell'esperimento sia conservata tra le condizioni); nome dell'esperimento/nome della cartella; ritaglio dei parametri X, Y, H e W. Eseguire il codice una volta per il canale fluorescente piastrinico ricevente e una volta per il canale fluorescente piastrinico del prodotto. Riportare i valori MFI normalizzati (colonna 2) e AUC normalizzati (normalizzati al frame iniziale). Sottrarre il valore della lunghezza dell'esperimento dal valore dell'AUC normalizzato.
Risultati
Gli esperimenti microfluidici successivi all'uso di questo metodo dovrebbero mostrare la formazione di trombi ricchi di piastrine nella regione di stenosi del canale di flusso (Figura 1). La Figura 1A illustra i risultati rappresentativi in cui le piastrine funzionali hanno formato un trombo nella regione stenotica del canale per bloccare il flusso sanguigno attraverso il canale. Le curve di intensità media di fluorescenza (MFI) delle immagini cinetiche scattate per la durata dell'esperimento illustrano una fase di ritardo, crescita e plateau dell'incorporazione piastrinica nel trombo in crescita (Figura 2A, C). L'aumento delle concentrazioni di un antagonista di P2Y12, Ticagrelor, riduce l'MFI piastrinica e l'area calcolata sotto la curva (AUC) delle curve MFI (Figura 2B, D). Sono necessari tempi di incubazione più lunghi (30 minuti rispetto a 5 minuti) per osservare una pronunciata disfunzione piastrinica, in accordo con una relazione dose-risposta più pronunciata utilizzando l'aggregometria di impedenza del sangue intero dopo un'incubazione di Ticagrelor di 30 minuti rispetto a 5 minuti di incubazione (Figura supplementare S1). In diverse condizioni del veicolo, nel modello microfluidico sono stati osservati effetti simili dipendenti dal tempo dell'inibizione di P2Y12 (Figura supplementare S2).
La visualizzazione di due popolazioni piastriniche nel metodo di rianimazione emostatica simulata illustra l'incorporazione di entrambe le popolazioni piastriniche all'interno del trombo (Figura 3A). L'incorporazione di entrambe le popolazioni piastriniche nel loro corrispondente segnale fluorescente può essere quantificata cineticamente per tutta la durata dell'esperimento tramite misurazioni MFI (Figura 3B). Pendii più ripidi nella fase di crescita e maggiori misurazioni MFI dell'endpoint dimostrano un aumento della funzionalità piastrinica e del potenziale emostatico, che può essere visto nella quantificazione delle piastrine riceventi quando il campione di sangue è stato indotto con disfunzione piastrinica tramite inibizione P2Y12 e, quindi, la rianimazione simulata mescolando sangue intero autologo fresco in un rapporto volumetrico 1:10 colorato con un fluoroforo piastrinico distinto. Con la miscelazione autologa di sangue intero, sono state incorporate più piastrine dal prodotto trasfuso simulato rispetto a un prodotto piastrinico per aferesi al giorno 5 di conservazione a temperatura ambiente, che ha mostrato un'incorporazione minima del prodotto nel trombo in formazione. La miscelazione del prodotto piastrinico a temperatura ambiente del giorno 5 ha anche mostrato una minore incorporazione piastrinica del ricevente rispetto alla miscelazione con sangue intero autologo fresco (Figura 3B).
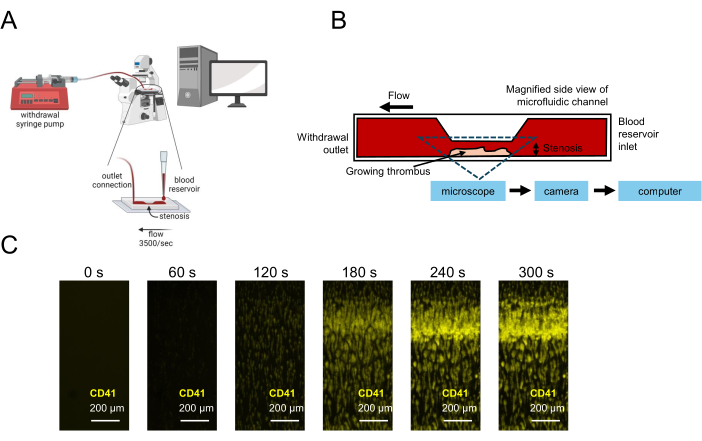
Figura 1: Rappresentazione del test di funzionalità piastrinica mediante microfluidica. (A) Viene mostrata la configurazione sperimentale microfluidica schematica per il test di funzionalità piastrinica utilizzando campioni di sangue a basso volume, inclusa una pompa a siringa di estrazione che aspira il sangue attraverso una camera di flusso stenotica, consentendo l'acquisizione di immagini in tempo reale. (B) Viene mostrata una vista laterale di una camera di flusso stenotica, inclusa una superficie rivestita di collagene su cui le piastrine aderiranno, si attiveranno e si aggregheranno, provocando un aumento del trombo nella regione stenotica. (C) Acquisizione di immagini in tempo reale di un campione di sangue citrato sotto flusso in un canale microfluidico stenotico (3.500 s-1) e di un trombo in crescita formato in 300 s. Barre di scala = 200 μm (C). Clicca qui per visualizzare una versione più grande di questa figura.
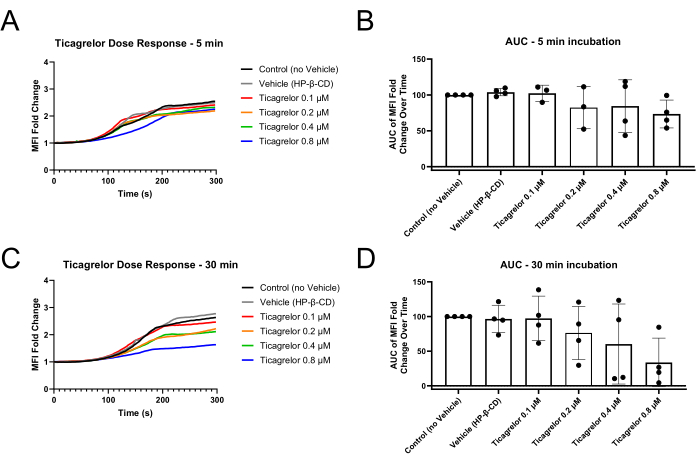
Figura 2: Riduzione delle variazioni del ripiegamento delle MFI piastriniche e dell'area sotto la curva dopo 30 minuti di incubazione con l'antagonista P2Y12 Ticagrelor. (A) L'incubazione con l'antagonista P2Y12 per soli 5 minuti dimostra fasi di ritardo leggermente estese delle curve MFI e (B) lievi diminuzioni dell'AUC delle MFI. (C) L'incubazione per 30 minuti con l'antagonista P2Y12 determina fasi di ritardo prolungate e valori di MFI dell'endpoint ridotti, nonché (D) una disfunzione più robusta dimostrata tramite AUC MFI. I singoli punti dati rappresentano repliche biologiche e viene mostrata la media ± deviazione standard. Abbreviazioni: MFI = intensità media della fluorescenza; AUC = area sotto la curva; HP-β-CD = 2-idrossipropil-β-ciclodestrina. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Miscelazione di emoderivati con inibizione coagulopatica P2Y12 nel campione ricevente, simulando la disfunzione piastrinica del paziente, nella camera microfluidica. (A) Unità piastrinica per aferesi (plasma, giorno di conservazione 7) (CD41 in ciano) miscelata in rapporto 1:10 con sangue citrato pre-incubato con 0,8 μM di Ticagrelor per 30 minuti (CD41 in rosso). (B) Curve di intensità di fluorescenza medie normalizzate rappresentative del campione di sangue ricevente che riceve unità piastrinica di aferesi (giorno di conservazione 5) o sangue intero fresco autologo (rapporto 1:10) insieme alla cinetica piastrinica del ricevente nel tempo. Il sangue cittrato del ricevente è stato pre-incubato con 0,8 μM di Ticagrelor per 30 minuti prima di essere miscelato con emoderivati. (C) Immagine z-stack rappresentativa da un dispositivo modificato incollato a un vetrino coprioggetti per microscopia confocale. Il prodotto piastrinico per aferesi è stato miscelato con un campione di sangue trombocitopenico in un rapporto volumetrico 1:5 (prodotto:sangue) oltre a un anticorpo del fattore di von Willebrand (1:600). Clicca qui per visualizzare una versione più grande di questa figura.
File supplementare 1: codice Matlab per l'analisi delle immagini. Clicca qui per scaricare questo file.
Figura supplementare S1: Aggregometria di impedenza del sangue intero dipendente dal tempo dell'inibizione di P2Y12 con Ticagrelor. L'incubazione per 30 minuti determina una relazione dose-risposta più pronunciata rispetto a 5 minuti. Le soluzioni per veicoli e farmaci sono state utilizzate allo 0,1% v/v. I singoli punti dati rappresentano repliche biologiche e viene mostrata la media ± deviazione standard. Abbreviazioni: AUC = area sotto la curva; HP-β-CD = 2-idrossipropil-β-ciclodestrina. Clicca qui per scaricare questo file.
Figura supplementare S2: Inibizione P2Y12 tempo-dipendente con Ticagrelor in un modello microfluidico della funzione piastrinica. Le curve MFI rappresentative e i valori dell'area sotto la curva per le repliche tecniche di un singolo donatore sano sono mostrati con il veicolo di etanolo (1% v/v) utilizzato per la solubilità dei farmaci. Abbreviazioni: MFI = intensità media della fluorescenza; AUC = area sotto la curva. Clicca qui per scaricare questo file.
Discussione
Il protocollo di cui sopra prevede alcuni passaggi critici per garantire l'affidabilità e la riproducibilità degli esperimenti. Innanzitutto, gli anticorpi fluorescenti devono essere attentamente considerati. Gli anticorpi utilizzati per rilevare le piastrine nel campione non devono bloccare la funzione del recettore piastrinico della glicoproteina Ib (GPIb). Anche la corrispondenza dei lotti, quando possibile tra gli esperimenti, è fondamentale per garantire la riproducibilità del segnale fluorescente. Un altro passaggio critico di questo protocollo consiste nell'utilizzo di materiali di consumo e soluzioni sterili e campioni filtrati quando possibile. Il filtraggio dei campioni di sangue immediatamente prima della sperimentazione impedirà ai detriti o ai grumi di piastrine più grandi delle dimensioni del canale di bloccare il flusso, che è un altro parametro critico per mantenere la coerenza tra gli esperimenti. Inoltre, i campioni di sangue devono essere analizzati entro 4 ore dalla raccolta, come descritto nella circolare di informazioni per l'uso del sangue umano e dei suoi componenti preparata da AABB, dalla Croce Rossa Americana, dai Centri Trasfusionali Americani e dall'Armed Services Blood Program, tranne quando si esegue il test della lesione da conservazione dei prodotti ematici.
In questo protocollo possono essere prese in considerazione modifiche, come l'incollaggio del PDMS a un vetrino coprioggetti per microscopia confocale, illustrato nella Figura 3C. Se necessario, prima dell'imaging, una soluzione fissativa può essere perfusa attraverso i canali e lavata con PBS per la conservazione prima dell'imaging. Inoltre, mentre le dimensioni riproducibili del canale sono fondamentali per garantire velocità di taglio conservate tra le condizioni, l'altezza della regione stenotica può essere modificata, ma influenzerà direttamente i tempi di formazione dei trombi, anche se corrispondenti alle velocità di taglio. Poiché le dimensioni maggiori dei canali richiederanno più tempo per raggiungere una sostanziale formazione di trombi, sarà necessario un volume di campione maggiore. Quando si risolvono i problemi di questo protocollo, una considerazione importante dovrebbe essere la strategia di rivestimento. Il tipo specifico di collagene, i tempi, la diluizione e le condizioni di conservazione sono tutti fattori che possono influenzare il rivestimento superficiale. Sebbene questo protocollo sia stato convalidato per questo particolare reagente di collagene (Tabella dei materiali), possono essere prese in considerazione alternative al collagene in grado di aderire in modo affidabile alla superficie del dispositivo e all'adesione convalidata tramite colorazione in immunofluorescenza o altre misure che sono state precedentemente utilizzate con successo da altri gruppi24.
Una potenziale limitazione di questo protocollo è la mancanza di risposta endoteliale diretta. Tuttavia, le strategie e le modifiche del rivestimento possono essere apportate per includere il test di funzionalità piastrinica in risposta al danno endoteliale. Ad esempio, i fattori infiammatori che le cellule endoteliali secernono in risposta a una lesione potrebbero essere modificati nella strategia di rivestimento di questo protocollo o aggiunti esogenamente al campione di sangue testato. L'aggiunta di questi fattori senza le complessità della cellularizzazione consentirebbe un approccio mirato per esaminare gli effetti dell'endoteliopatia sulla funzione piastrinica. Allo stesso modo, il plasma del paziente proveniente dalla malattia o da stati di controllo sani può essere iniettato nel sistema per testare l'impatto dei mediatori solubili nel plasma sulla funzione piastrinica.
Lo studio della funzione piastrinica sotto flusso seguendo questo protocollo può facilitare lo studio della coagulopatia indotta da traumi e degli approcci di medicina trasfusionale nel trauma. Gli attuali test di funzionalità piastrinica sono spesso sovra o sottopotenziati per vedere una risposta disfunzionale in un paziente traumatizzato. Questo metodo consente flessibilità e modifiche progettuali per osservare la funzione piastrinica in campioni di pazienti traumatizzati, anche con vincoli di volume, oltre alla simulazione della disfunzione piastrinica per valutare gli interventi terapeutici. Oltre al paziente traumatizzato, questo metodo potrebbe essere preso in considerazione per i pazienti con emorragia postpartum, i pazienti cardiochirurgici o i pazienti oncologici per valutare la funzionalità piastrinica e i potenziali interventi terapeutici. È importante sottolineare che questo metodo incorpora la dinamica del flusso che è di fondamentale importanza per i meccanismi di formazione del tappo piastrinico e la funzione emostatica.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Gli autori ringraziano e ringraziano tutti i donatori di sangue che hanno partecipato, nonché i flebotomi del Trauma and Transfusion Medicine Research Lab e il Centro di Ricerca Clinica e Traslazionale UPMC Montefiore per l'assistenza nelle raccolte. Gli SMS sono supportati da K25HL161401. MDN è supportato da 1R01HL166944-01A1.
Materiali
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
Riferimenti
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112(2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509(2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502(2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62(2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon