Method Article
מיקרופלואידיקה בהערכת תפקוד טסיות הדם
In This Article
Summary
ניתן להעריך את תפקוד טסיות הדם תחת זרימה ולדמות החייאה המוסטטית באמצעות מכשיר מיקרופלואידי, שיש לו יישומים ברפואת טראומה ועירוי.
Abstract
מיקרופלואידיקה משלבת מצעים וזרמים רלוונטיים מבחינה פיזיולוגית המחקים את כלי הדם ולכן הם כלי רב ערך לחקר היבטים של פקקת והמוסטאזיס. בסביבות בעלות גזירה גבוהה המדמות זרימה עורקית, בדיקה מיקרופלואידית מאפשרת את המחקר של תפקוד טסיות הדם, כאשר טרומבי עשיר בטסיות דם נוצר באזור סטנוטי מקומי של ערוץ זרימה. שימוש במכשירים המאפשרים נפח דגימה קטן יכול גם לסייע בהערכת תפקוד טסיות הדם תחת זרימה מדגימות חולים מוגבלות נפח או מודלים של בעלי חיים. חקר דגימות או דגימות של מטופלי טראומה לאחר עירוי טסיות עשוי לסייע בהכוונת אסטרטגיות טיפוליות לאוכלוסיות חולים בהן תפקוד טסיות הדם הוא קריטי. השפעות של עיכוב טסיות באמצעות סוכנים פרמקולוגיים ניתן ללמוד גם במודל זה. מטרת פרוטוקול זה היא להקים פלטפורמה מיקרופלואידית המשלבת זרימה פיזיולוגית, משטחים ביולוגיים ומנגנונים המוסטטיים רלוונטיים להערכת תפקוד טסיות הדם עם השלכות לחקר קוגולופתיה הנגרמת על ידי טראומה ורפואת עירוי.
Introduction
טראומה היא גורם עולמי מוביל למוות ונכות. פציעה חמורה מסובכת לעתים קרובות על ידי הפרעה ייחודית ואנדוגנית של המוסטזיס ופקקת, המכונה קוגולופתיה הנגרמת על ידי טראומה (TIC)1. טסיות הדם ממלאות תפקיד קריטי ב-TIC, והן תוארו כבעלות פונקציות אדפטיביות ולא מסתגלות2. המנגנונים של תפקוד לקוי של טסיות הדם לאחר פציעה עדיין אינם ברורים, ויש צורך קריטי להבין טוב יותר את התגובה התאית כדי להנחות את הפיתוח של החייאה וטיפול משופרים. בעיה מטרידה נוספת בנוגע לתפקוד טסיות הדם לאחר פציעה היא חוסר הוודאות לגבי אמינות הקריאות הנוכחיות של תפקוד טסיות הדם אצל מטופל הטראומה.
מחקרים רבים הראו כי אפילו חולים פצועים קל, ללא פנוטיפ דימום קליני ידוע, יש תפקוד טסיות חריג באמצעות בדיקות תפקודי טסיות קונבנציונליות כגון aggregometry 3,4. עם זאת, מגבלות באגרגומטריה להערכת תפקוד טסיות הדם במצב פציעה כוללות היעדר משטח פציעה רלוונטי מבחינה פיזיולוגית, גישה רדוקציוניסטית לגירוי אגוניסט, דילול דגימה עם אגרגומטריה של עכבת דם שלמה, הפרדת פלזמה עם אגרגומטריה של העברת אור אופטית, והערכת דגימה עומדת. בנוסף, עדיין לא ברור אם רגישות זו של תפקוד טסיות הדם מייצגת תפקוד לקוי אמיתי של התא או ממצא מדידה, כגון עכבה חשמלית בסיסית מוגברת, במצב של פציעה2. לפיכך, חקר תפקודי טסיות רלוונטיים בהקשר של טראומה הוא חיוני להבנת TIC, ויש מקום משמעותי לחדשנות ושיפור בתחום זה.
פלטפורמות המשמשות באופן מסורתי לחקר תפקוד טסיות הדם אינן כוללות דינמיקה של נוזלים וזרימה, אשר עשויים להיות קריטיים להבנת תפקוד לקוי של טסיות הדם הקשור לטראומה וקוגלופתיה הנגרמת על ידי טראומה5. מנגנונים של המוסטאזיס התלויים בזרימה כוללים התארכות גורם פון וילברנד (VWF) בגזירה גבוהה, מעל קצב גזירה קריטי, ולכידת טסיות באמצעות גליקופרוטאין 1b 6,7,8, שאינם נלכדים באמצעות בדיקות תפקוד טסיות עומדות. בנוסף, טסיות הדם מעדיפות לקשור VWF או פיברינוגן בהתאם למשטר הזרימה ומעוררות תפקידים דיפרנציאליים בפקקת עורקים לעומת פקקת ורידית 9,10. טרומבי עורקי מורכב בעיקר מטסיות בעוד תרומבי ורידי מורכב בעיקר מכדוריות דם אדומות, המבוססות, בחלקן, על משטרי זרימה11. בדיקות המשלבות משטרי זרימה יכולות לסייע בהבהרת תפקודים לקויים הנוגעים לספקטרום של פנוטיפים של TIC, החל מהיפוקוגולביליות ופנוטיפים מדממים ועד קרישיות יתר ופנוטיפים טרומבוטיים. לבסוף, אילוצי דגימת נפח דם עם אוכלוסיות מטופלי טראומה עשויים להפוך את בדיקת תפקודי הטסיות המסורתית למאתגרת. בעוד שבדיקות כגון ציטומטריית זרימה יכולות וצריכות לשמש בנסיבות אלה, התוצאות מתארות לעתים קרובות אפיון פיזי של מדגם ולא הערכה תפקודית המוסטטית.
בעוד מנגנונים של תפקוד לקוי של טסיות הדם עשויים שלא להיות מובנים לחלוטין בטראומה, מודלים של תפקוד לקוי של טסיות במבחנה, עם אנטגוניסטים P2Y12 למשל, יכול גם לעזור להנחות את המחקר של התערבויות טיפוליות. החייאה המוסטטית היא בעלת חשיבות קריטית בחולי טראומה שבהם מוצרי הדם עוברים טרנספוזיה בגישה מאוזנת לטיפול בהלם, קרישת דם ופגיעה אנדותל עם דם שלם או מרכיבי דם (תאי דם אדומים, פלזמה ותרכיזי טסיות) ביחס יחידה של 1:1:1 12,13,14. בחולי טראומה, שימוש מוקדם במוצרי דם קשור לשיפור בהישרדות15,16. כדי להאריך את חיי המדף, מוצרי טסיות מאוחסנים קר נחקרו יותר ויותר. בדיקה של טסיות דם מאוחסנות בקור מראה פעילות המוסטטית מוגברת, כמו גם בטיחות בעת transfused לאחר פציעה17,18.
האבולוציה של החייאה טסיות המאוחסנת בקור מדגישה את הצורך בבדיקות נוספות כדי להבין את מוצר הטסיות היעיל ביותר הזמין לטראומה. עם זאת, בדיקות מסורתיות של תפקוד טסיות הדם הן לעתים קרובות מוגזמות או חסרות עוצמה כדי לזהות תפקוד לקוי, המתרחשות הן במטופל הטראומה המקבל עירוי טסיות טיפולי, כמו גם במוצר הטרנספוזיה עצמו שנראה בנגעים של אחסון טסיות. קביעת מקור התפקוד הלקוי יכולה להיות מאתגרת, בהתחשב במגבלות בבדיקות תפקוד טסיות הדם הנוכחיות, כולל האופי הסטטי של רוב הבדיקות הללו. לכן, כאשר חוקרים החייאה המוסטטית במבחנה, הפלטפורמה ושיטות הזיהוי הן עבור אוכלוסיית טסיות הדם המושתל והן עבור אוכלוסיית טסיות המוצר הן בעלות חשיבות קריטית בקביעת התערבויות טיפוליות אופטימליות.
בדיקות מיקרופלואידיות מציעות פרופילי זרימה ומשטחים ביופידליים כדי ליצור בדיקה רלוונטית פיזיולוגית שעליה ניתן לחקור טסיות. התקנים מיקרופלואידים יכולים להיות מותאמים אישית כדי לחקור פתופיזיולוגיה או סוגי פציעה מסוימים, כגון ניקוב כלי דם19 או נזק אנדותל20. התקנים אלה מורכבים בדרך כלל מפולידימתילסילוקסאן (PDMS) המחוברים למגלשת מיקרוסקופ זכוכית עם שינויים בפני השטח, כגון קולגן, כדי לחקות תת-אנדותל ופגיעה ברקמות. שימוש במכשירים מבוססי זרימה מסוג זה יכול לסייע בהנחיית מחקר הקשור לטראומה בתפקוד לקוי של טסיות הדם ולסייע בבחינת גישות מיטביות של רפואת עירוי לשיפור תפקוד לקוי של טסיות. אסטרטגיות אלה עשויות לעזור להבהיר את הבלבול הקיים לגבי הרלוונטיות של בדיקות טסיות סטטיות כגון אגרגומטריה אצל המטופל הפגוע.
Protocol
כל המחקרים בוצעו בהתאם להנחיות המוסדיים. התקבל אישור מהמשרד להגנת המחקר האנושי באוניברסיטת פיטסבורג והתקבלה הסכמה מדעת של מתנדבים אנושיים בריאים.
1. הכנת מכשיר מיקרופלואידי
- כדי לייצר את החלק PDMS של המכשיר, להכין תבנית אב באמצעות פליז באמצעות מיקרו-עיבוד שבבי של בקרה נומרית ממוחשבת (CNC).
הערה: בהתאם למידות הערוץ, ניתן להשתמש בטכניקות פוטוליתוגרפיה ליצירת תבנית אב. ההתקן המשמש בפרוטוקול זה כולל שמונה תעלות מיקרו-מכונות מקבילות ברוחב של כ-480 מיקרומטר, בגובה של 140 מיקרומטר בכניסה וביציאה של המכשיר, ובגובה של 40 מיקרומטר בהיצרות המכשיר, עם אורך רמפה מ/אל האזור הסטנוטי של כ-0.3 מ"מ. אורכי התעלה הם כ-6 מ"מ. - לאחר שהושגה תבנית מאסטר, יוצקים את בסיס האלסטומר סיליקון (המתקבל מערכת האלסטומר) לצלחת שקילה. הוסיפו את חומר ריפוי הסיליקון (המתקבל מערכת האלסטומרים), המאפשר קישור צולב של שרשראות פולימר הסיליקון כדי להפוך את PDMS הנוזלי למוצק עמיד וגמיש, ביחס של 10:1 (סוכן בסיס) וערבבו היטב את התערובת.
- מניחים את התבנית לתוך צלחת פטרי ויוצקים את PDMS uncured על התבנית. הניחו את צלחת הפטרי בתוך מייבש ואקום למשך 30 דקות כדי להסיר בועות.
- סיים לרפא את PDMS בתבנית האב על ידי הכנסתו לתנור להגדיר 70 ° C למשך 90 דקות.
- לאחר ריפוי PDMS מלא, לחתוך את הגבס microfluidic באמצעות סכין גילוח או אזמל. חורי ניקוב בשולי התעלות (קוטר 1.5 מ"מ משני הצדדים).
- בעזרת סרט מעבדה, נקו את פני השטח של מגלשת זכוכית ואת הצד החרוט של הגבס המיקרופלואידי. השתמש באוויר דחוס לפי הצורך כדי להסיר את הפסולת שנותרה.
- הניחו את מגלשת הזכוכית ואת הגבס המיקרופלואידי עם הצד החרוט כלפי מעלה לתוך מנקה פלזמה. הפעילו את משאבת הוואקום, אטמו את התא והפעילו את שואב הפלזמה למצב גבוה. השאירו את המגלשה ואת PDMS בשואב הפלזמה למשך 30 שניות, ואז כבו את שואב הפלזמה והוציאו את שואב האבק.
- קשרו את הגבס והזכוכית שעברו ניקוי פלזמה יחד על ידי לחיצה עדינה יחד על הצדדים שהיו עם הפנים כלפי מעלה במנקה הפלזמה. לאחר מכן, הניחו את המכשיר המיקרופלואידי בתנור/פלטה חמה בטמפרטורה של 70°C למשך 10 דקות.
הערה: אין להפעיל לחץ רב מדי בעת חיבור הגבס והזכוכית יחד, מכיוון שהדבר עלול להוביל לאובדן מורפולוגיית הערוץ. - יש לשטוף כל תא עם 10-30 μL של אתנול 70% כדי לעקר ולאפשר למכשיר המיקרופלואידי להתייבש על פלטה חמה של 70°C.
הערה: יש להכין מכשירים לפחות 24 שעות מראש, אך ניתן להכין אותם שבועות עד חודשים מראש. יש לאחסן את המכשירים במיכל אטום או בצלחת פטרי מכוסה בטמפרטורת החדר. - יום לפני הניסוי עם המכשיר microfluidic, לשטוף מחדש כל תא עם 10-30 μL של אתנול 70% כדי לעקר ולאפשר את המכשיר microfluidic להתייבש על פלטה 70 מעלות צלזיוס.
- צפו את התא בריאגנט קולגן פיברילרי מסוג 1 סוסים (1 מ"ג/מ"ל), מדולל ב-0.9% NaCl ביחס נפחי של 1:5 דרך שקע ייעודי לכניסה ייעודית. ודא שהכיווניות נשמרת במהלך ניסוי. אחסנו את המכשיר בכלי סגור חם ולח כדי למנוע אידוי של הקולגן המצופה בתוך התעלה.
- לאחר שעה, יש לשטוף במי מלח חוצצים פוספט (PBS) כדי לשטוף את תמיסת הקולגן. סומקים בכיוון ההפוך לציפוי. כאשר המכשיר אינו בשימוש, יש לאחסן אותו שוב במיכל חם, לח וסגור.
2. הכנת דגימת דם
- קבל דגימת דם ציטרציה מלאה באמצעות venipuncture. לדגור על דם שלם ציטראטי עם תמיסת חסימת קולטן FC (1:600).
הערה: דגימות דם מאוחסנות בטמפרטורת החדר לפני ובמהלך הניסוי. - לדגור דם שלם ציטרציה עם פלואורסצנטיות מצומדת (באמצעות פלואורופור לבחירה) נוגדן CD41 (1:600). כתם במשך 30 דקות על נדנדה אגוזית.
- כבקרה חיובית לעיכוב טסיות, הוסף Ticagrelor, אנטגוניסט קולטן P2Y12 שנוצר מחדש בתמיסה של 30% w/v 2-hydroxypropyl-β-cyclodextrin (HP-β-CD) ב- PBS.
הערה: יש להכין מלאי של Ticagrelor עד 6.4 mM ודילול נוסף של מלאי Ticagrelor בתמיסת HP-β-CD (30% HP-β-CD מומס ב-PBS) לפני הניסויים (מומלץ ריכוז מלאי של פי 1,000). - דגרו על הדגימה הציטרטית עם טיקרלור (ריכוז סופי עד 6.4 מיקרומטר) למשך 30 דקות כדי לצפות בעיכוב טסיות.
- אם מערבבים את מוצר הדם עם דגימת הציטרציה, יש להכתים את מוצר הדם בתמיסת חסימת קולטן FC (1:600) ובנוגדן CD41 מצומד פלואורסצנטי (באמצעות פלואורופור נפרד ומובהק לדגימה המצטרת) CD41 (1:600).
- מערבבים מקבילה נפחית של יחידות המוצר transfused עם הדגימה ציטרציה. לדוגמה, כדי לדמות 2 יחידות של מוצרי טסיות דם שהועתקו לאדם מדמם (כ-250 מ"ל למוצר לנפח דם כולל של 5,000 מ"ל), ערבבו 100 מיקרוליטר של מוצר דם לתוך 1,000 מיקרוליטר של דגימת דם ציטרת.
- מיד לפני הניסוי, סננו את דגימת הדם דרך מסנן 40 מיקרומטר לתוך צינור מיקרוצנטריפוגה סטרילי של 1.5 מ"ל.
3. בדיקת תפקוד טסיות תחת זרימה (שיטה 1)
- הפעל את המיקרוסקופ ואת התוכנה המשויכת.
- הגדר רמת משאבת מזרק נסיגה עם שלב המיקרוסקופ. התאם את ההגדרות במשאבת המזרק.
- חשב קצב זרימה נפחי (Q) עבור קצב גזירה ממוצע רצוי (γ) של 3,500 s-1 באזור הסטנוטי של התעלה באמצעות משוואות (1) ו- (2)21.
 (1)
(1)
 (2)
(2)
כאשר A הוא שטח החתך של התעלה, P הוא ההיקף הרטוב, λ הוא גורם הצורה, b הוא הצד הקצר של המלבן (גובה), ו-a הוא הצד הארוך של המלבן (רוחב).
הערה: הערך של 3,500 s-1 נבחר עקב גזירה קריטית של VWF ונמצא במשטר העורקים 7,22,23.
- חשב קצב זרימה נפחי (Q) עבור קצב גזירה ממוצע רצוי (γ) של 3,500 s-1 באזור הסטנוטי של התעלה באמצעות משוואות (1) ו- (2)21.
- הניחו את המכשיר המיקרופלואידי על במת המיקרוסקופ. הדביקו את קצוות המכשיר המיקרופלואידי לבמה כדי למנוע תנועה. ודא שהשקע פונה לחלק האחורי של המיקרוסקופ.
- חבר קצה אחד של צינור זיהוי בגודל 1/16 אינץ' (באורך של כ-30 ס"מ) למחבר מרפק ואת הקצה השני למזרק בנפח 10 מ"ל עם מחבר מזהה בגודל 1/16 אינץ'.
- ממלאים את המזרק ב-PBS סטרילי ומחברים אותו למשאבת המזרק.
- הכנס את מחבר המרפק לשקע המכשיר.
- הכינו קווי כניסה באורך של כ-10 ס"מ כאשר מחבר המרפק בקצה אחד והחתך הזוויתי בקצה השני.
- חבר את מחבר מרפק הכניסה לכניסת ההתקן.
- מקם את קו הכניסה לתוך צינור מיקרוצנטריפוגה פסולת על מחזיק זוויתי.
- השתמש במטרה 10x עבור מידות ערוץ ברוחב של כ- 500 מיקרומטר והתמקד בקצוות הערוץ של ההתקן המיקרופלואידי.
- מקדמים את הקווים עם PBS ומנקים את התעלה מכל PDMS/פסולת על ידי קידום משאבת המזרק באופן ידני. הקפד לבדוק ליד הכניסה והשקע של הערוץ.
- פתח את הגדרות לכידת התמונה שנשמרו או צור הליך לכידת תמונה עבור תמונות מסדרות זמן שצולמו כל 1-2 שניות עם ערוץ שדה בהיר ותעלות פלואורסצנטיות המתאימות לנוגדנים הפלואורסצנטיים CD41 המשמשים בדגימת הדם.
- קבל את דגימת הדם הציטר המסונן וערבב על ידי pipeting למעלה ולמטה ממש לפני הניסוי. מניחים את הדגימה על מחזיק מיקרוצנטריפוגה זוויתית.
- מקם את קו הכניסה בדגימה.
- התחל להקליט את לכידת התמונה.
- לאט, למשוך את המזרק כדי למלא את נפח מת בצינורית. ברגע שהדם מגיע לערוץ, לחץ מיד על הפעל על משאבת המזרק כדי לחדש את הזרימה בקצב הגזירה הרצוי.
- התאם את המיקוד במידת הצורך.
- הפעל את הניסוי עד שהטסיות הסתירו לחלוטין את האזור הסטנוטי של המכשיר המיקרופלואידי או עד לנקודת סיום ניסיונית (כלומר, 10 דקות).
- ודא שצינורית הכניסה שקועה בדגימת הדם למשך הניסוי.
- לאחר השלמת הניסוי, עצור את לכידת התמונה ועצור את משאבת המזרק. שמור את לכידת התמונה.
- הסר את מחבר מרפק הכניסה ורוקן את תכולת הצינור לחרוט פסולת. רוקנו גם את תכולת המזרקים וקווי היציאה לחרוטיות פסולת.
- החלף את מחברי הכניסה והיציאה ואת הצינורות לפי הצורך עבור הדגימות הבאות.
4. בדיקת תפקוד טסיות בזרימה עם דגימות בנפח נמוך (מתחת ל-1 מ"ל) (שיטה 2)
- חזור על שלבים 1.1 עד 1.4 כמפורט לעיל.
- ניקבו פתח בקוטר 1.5 מ"מ ובכניסה בקוטר 3 מ"מ בשולי התעלות.
- חזור על שלבים 1.6 עד 3.6 כמפורט לעיל.
- השתמש במטרה 10x עבור מידות ערוץ ברוחב של כ- 500 מיקרומטר והתמקד בקצוות הערוץ של ההתקן המיקרופלואידי.
- נקו את התעלה מכל PDMS/פסולת על ידי הקדמת משאבת המזרק באופן ידני וניקוי נוזל גישה באמצעות מגבון מעבדה. הסר את כל הלכלוך עם סרט מעבדה בחלק העליון של המכשיר microfluidic.
- קדם ידנית את המשאבה כדי למלא את מאגר הכניסה 3 מ"מ עם PBS.
- פתח את הגדרות לכידת התמונה שנשמרו או צור הליך לכידת תמונה עבור תמונות מסדרות זמן שצולמו כל 1-2 שניות עם ערוץ שדה בהיר ותעלות פלואורסצנטיות המתאימות לנוגדנים הפלואורסצנטיים CD41 המשמשים בדגימת הדם.
- התחל את המשיכה במשאבת המזרק (ידנית או במהירות מוגדרת) וברגע ש- PBS מתקדם לתוך התעלה וקו המילוי במאגר יורד, השהה את המשיכה במשאבה.
- הסר עודף PBS מהמאגר עם פיפטה.
- התחל את לכידת התמונה.
- פיפטה את דגימת הדם לתוך המאגר (כ 40 μL) ומיד להתחיל מזרק נסיגה. ודא שהזרימה מתחילה.
הערה: אם מנוע משאבת המזרק לנסיגה לא היה דרוך בשלב 4.8, הזרימה לא תתחיל מיד, ויש לחזור על הניסוי. - מלאו מחדש את מאגר הדם למשך הניסוי, כדי לוודא שלא נכנסים כיסי אוויר לתעלה.
- הפעל את הניסוי עד שהטסיות הסתירו לחלוטין את האזור הסטנוטי של המכשיר המיקרופלואידי או עד לנקודת סיום ניסיונית (כלומר, 10 דקות).
- לאחר השלמת הניסוי, הפסק את לכידת התמונה ועצור את משאבת המזרק. שמור את לכידת התמונה.
- הסר עודפי דם במאגר על ידי pipetting. רוקנו את תכולת צינור הגמילה לתוך צינור חרוטי פסולת.
- החלף את המחברים והצנרת לפי הצורך עבור הדגימות הבאות.
5. טיהור
- נקו את קווי הכניסה והיציאה של הדם על ידי שטיפה לתמיסת אקונומיקה 10%.
- אם נעשה שימוש בכל התעלות במכשיר המיקרופלואידי, השליכו את המכשיר במיכל הפסולת הביולוגית המסוכנת של שארפ.
הערה: יש להשליך את כל הפסולת הביולוגית לפסולת מסוכנת ביולוגית כראוי.
6. ניתוח תמונות
- ייצא את התמונות מניסויים קינטיים באמצעות תוכנה על ידי לחיצה על קובץ | ייצוא/ייבוא | ייצוא.
- בחר את הפרמטרים הבאים: סוג קובץ: Tagged Image File Format (TIFF); דחיסה: LZW; סמן את הנתונים המקוריים ואת Shift Pixel; בטל את הסימון של האפשרות החל עקומת תצוגה וצבע ערוץ; סמן ' הגדר תת-ערכה (אזור, אזור מלבן', ובחר באזור הערוץ עם מדידת רוחב וגובה לשימור בין תנאים). ייצא לתיקיה הרצויה וסמן את צור תיקיה.
- שים לב לערכי הניסוי הבאים בתוכנה: התחל מסגרת כאשר הדם נכנס לערוץ; קצב פריימים (מידע, סדרת זמן).
- למדוד את עוצמת הפלואורסצנטיות הממוצעת המנורמלת של כל מסגרת בניסוי באמצעות קוד Matlab שסופק כקובץ משלים 1, תוך שינוי הקלטים הבאים עבור כל ניסוי: מסגרת התחלה/מסגרת סיום בהתבסס על אורך הניסוי (ודא שאורך הניסוי נשמר בין התנאים); שם הניסוי/שם התיקייה; חיתוך פרמטרים X, Y, H ו- W. הפעל את הקוד פעם אחת עבור ערוץ הפלואורסצנטי של טסיות הנמען ופעם אחת עבור ערוץ הפלואורסצנטי של טסיות המוצר. דווח על ערכי MFI מנורמלים (עמודה 2) וערכי AUC מנורמלים (מנורמלים למסגרת התחלה). הפחת את ערך אורך הניסוי מערך AUC המנורמל.
תוצאות
ניסויים מיקרופלואידים בעקבות השימוש בשיטה זו אמורים להראות היווצרות תרומבי עשירה בטסיות באזור ההיצרות של ערוץ הזרימה (איור 1). איור 1A מדגים תוצאות מייצגות שבהן טסיות דם תפקודיות יצרו פקקת באזור הסטנוטי של התעלה כדי לחסום את זרימת הדם דרך הערוץ. עקומות של עוצמה פלואורסצנטית ממוצעת (MFI) של תמונות קינטיות שצולמו במשך הניסוי מדגימות פיגור, צמיחה ושלב מישורי של שילוב טסיות בפקקת הגדלה (איור 2A,C). הגדלת הריכוזים של אנטגוניסט P2Y12, Ticagrelor, מפחיתה את ה-MFI של טסיות הדם כמו גם את השטח המחושב מתחת לעקומה (AUC) של עקומות MFI (איור 2B,D). יש צורך בזמני דגירה ארוכים יותר (30 דקות לעומת 5 דקות) כדי לצפות בתפקוד לקוי בולט של טסיות הדם, בהתאם ליחס מנה-תגובה בולט יותר תוך שימוש באגרגומטריה של עכבת דם מלאה לאחר דגירה של 30 דקות Ticagrelor בהשוואה לדגירה של 5 דקות (איור משלים S1). בתנאי רכב שונים, השפעות תלויות זמן דומות של עיכוב P2Y12 נצפו במודל המיקרופלואידי (איור משלים S2).
הדמיה של שתי אוכלוסיות טסיות בשיטת החייאה המוסטטית מדומה מדגימה את השילוב של שתי אוכלוסיות טסיות הדם בתוך פקקת (איור 3A). ניתן לכמת את השילוב של שתי אוכלוסיות טסיות הדם באות הפלואורסצנטי המתאים להן באופן קינטי לאורך משך הניסוי באמצעות מדידות MFI (איור 3B). שיפועים תלולים יותר בשלב הצמיחה, כמו גם מדידות MFI מוגברות של נקודות קצה, מדגימים פונקציונליות טסיות מוגברת ופוטנציאל המוסטטי, אשר ניתן לראות בכימות של טסיות הדם כאשר דגימת הדם נגרמה עם תפקוד לקוי של טסיות הדם באמצעות עיכוב P2Y12, ולאחר מכן, החייאה המדומה על ידי ערבוב דם שלם אוטולוגי טרי ביחס נפחי של 1:10 המוכתם בפלואורופור טסיות מובהק. עם ערבוב אוטולוגי של דם שלם, יותר טסיות שולבו מהמוצר המדומה בהשוואה למוצר טסיות אפרזיס ביום אחסון בטמפרטורת החדר ביום 5, אשר הראה שילוב מוצר מינימלי בפקקת היוצרת. ערבוב מוצרי טסיות בטמפרטורת החדר ביום 5 הראה גם שילוב טסיות נמוך יותר בהשוואה לערבוב עם דם מלא אוטולוגי טרי (איור 3B).
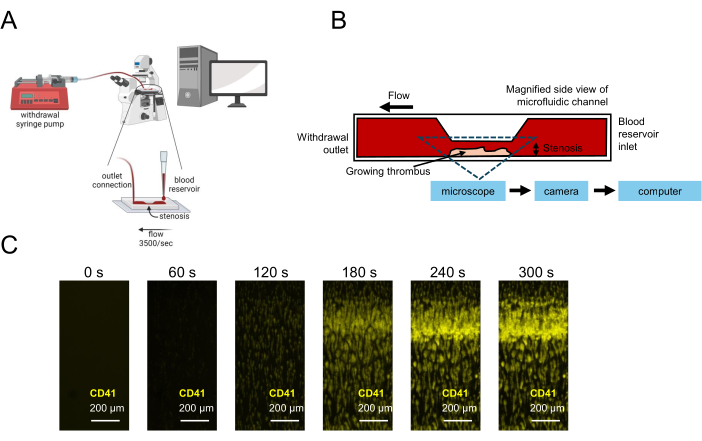
איור 1: ייצוג של בדיקת תפקודי טסיות באמצעות מיקרופלואידיקה. (A) מוצג מערך ניסויי מיקרופלואידי סכמטי לבדיקת תפקודי טסיות באמצעות דגימות דם בנפח נמוך, כולל משאבת מזרק נסיגה המושכת דם דרך תא זרימה סטנוטי, ומאפשרת לכידת תמונה בזמן אמת. (B) מוצג מבט צדדי על תא זרימה סטנוטי, כולל משטח מצופה קולגן שעליו טסיות הדם נצמדות, מופעלות ומצטברות, וכתוצאה מכך פקקת הולכת וגדלה באזור הסטנוטי. (C) לכידת תמונה בזמן אמת של דגימת דם ציטרלית תחת זרימה בתעלה מיקרופלואידית סטנוטית (3,500 s-1) ופקקת הולכת וגדלה שנוצרה מעל 300 שניות. פסי קנה מידה = 200 מיקרומטר (C). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
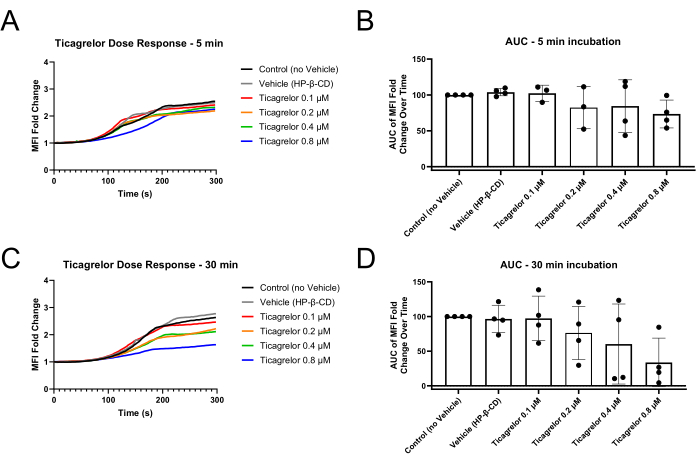
איור 2: שינויים מופחתים בקיפול MFI טסיות ובשטח מתחת לעקומה לאחר 30 דקות דגירה עם אנטגוניסט P2Y12 Ticagrelor. (A) דגירה עם אנטגוניסט P2Y12 במשך 5 דקות בלבד מדגימה שלבי השהיה מעט מורחבים של עקומות MFI ו-(B) ירידות קלות ב-MFI AUC. (C) דגירה במשך 30 דקות עם אנטגוניסט P2Y12 גורמת לשלבי השהיה מורחבים ולערכי MFI מופחתים של נקודות קצה, כמו גם (D) תפקוד לקוי חזק יותר שהודגם באמצעות MFI AUC. נקודות נתונים בודדות מייצגות שכפולים ביולוגיים ומוצגת סטיית תקן ± ממוצעת. קיצורים: MFI = עוצמת פלואורסצנטיות ממוצעת; AUC = שטח מתחת לעקומה; HP-β-CD = 2-hydroxypropyl-β-cyclodextrin. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: ערבוב של תוצרי דם עם עיכוב P2Y12 קוגולופתי בדגימת הנמען, המדמה תפקוד לקוי של טסיות הדם של המטופל, בתא המיקרופלואידי. (A) יחידת טסיות אפרזיס (פלזמה, יום אחסון 7) (CD41 בציאן) מעורבבת ביחס של 1:10 עם דם ציטרטי מודגר מראש עם 0.8 מיקרומטר טיקרלור למשך 30 דקות (CD41 באדום). (B) עקומות עוצמת פלואורסצנטיות מנורמלות מייצגות של דגימת הדם המקבלת יחידת טסיות אפרזיס (יום אחסון 5) או דם שלם טרי אוטולוגי (יחס של 1:10) יחד עם קינטיקה של טסיות הדם המקבלות לאורך זמן. דם ציטרלי מושתל הודגר מראש עם 0.8 מיקרומטר Ticagrelor במשך 30 דקות לפני ערבוב עם מוצרי דם. (C) תמונה מייצגת של ערימת z ממכשיר שעבר שינוי המחוברת למכסה עבור מיקרוסקופ קונפוקלי. מוצר טסיות אפרזיס עורבב עם דגימת דם טרומבוציטופנית ביחס נפחי של 1:5 (מוצר:דם) בנוסף לנוגדן גורם פון וילברנד (1:600). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
קובץ משלים 1: קוד Matlab לניתוח תמונות. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S1: עכבת דם שלמה אגרגומטריה תלות בזמן של עיכוב P2Y12 עם Ticagrelor. דגירה במשך 30 דקות מביאה ליחס מנה-תגובה בולט יותר בהשוואה ל-5 דקות. פתרונות רכב ותרופות נוצלו ב -0.1% v/v. נקודות נתונים בודדות מייצגות שכפולים ביולוגיים ומוצגת סטיית תקן ± ממוצעת. קיצורים: AUC = שטח מתחת לעקומה; HP-β-CD = 2-hydroxypropyl-β-cyclodextrin. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S2: עיכוב P2Y12 תלוי זמן עם Ticagrelor במודל מיקרופלואידי של תפקוד טסיות. עקומות MFI מייצגות וערכי שטח מתחת לעקומה עבור שכפולים טכניים מתורם בריא יחיד מוצגים עם רכב אתנול (1% v/v) המשמש למסיסות תרופות. קיצורים: MFI = עוצמת פלואורסצנטיות ממוצעת; AUC = שטח מתחת לעקומה. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
הפרוטוקול לעיל כולל כמה צעדים קריטיים כדי להבטיח את האמינות ואת יכולת השחזור של ניסויים. ראשית, יש לשקול היטב נוגדנים פלואורסצנטיים. הנוגדנים המשמשים לזיהוי טסיות הדם בדגימה אינם אמורים לחסום את תפקודו של קולטן טסיות הגליקופרוטאין Ib (GPIb). התאמת לוט, במידת האפשר בין ניסויים, היא גם קריטית כדי להבטיח את יכולת השחזור של האות הפלואורסצנטי. שלב קריטי נוסף בפרוטוקול זה הוא שימוש בחומרים מתכלים סטריליים ותמיסות ודגימות מסוננות במידת האפשר. סינון דגימות דם מיד לפני הניסוי ימנע מפסולת או גושי טסיות גדולים יותר מממדי התעלה לחסום את הזרימה, שהיא פרמטר קריטי נוסף לשמירה על עקביות בין ניסויים. בנוסף, יש לבדוק דגימות דם תוך 4 שעות מהאיסוף כמתואר בחוזר המידע לשימוש בדם אנושי ובמרכיבי דם שהוכנו על ידי AABB, הצלב האדום האמריקאי, מרכזי הדם של אמריקה ותוכנית הדם של השירותים המזוינים, למעט בעת בדיקת נגע אחסון של מוצרי דם.
ניתן לשקול שינויים בפרוטוקול זה, כגון חיבור PDMS לכיסוי עבור מיקרוסקופ קונפוקלי, כפי שמודגם באיור 3C. במידת הצורך, לפני ההדמיה, ניתן לנקב תמיסה מקבעת דרך התעלות ולשטוף עם PBS לאחסון לפני ההדמיה. בנוסף, בעוד שמידות ערוץ ניתנות לשחזור הן המפתח להבטחת קצבי גזירה שמורים בין תנאים, ניתן לשנות את גובה האזור הסטנוטי אך ישפיע ישירות על תזמון היווצרות הפקקת, גם אם קצב הגזירה תואם. מכיוון שממדי ערוץ גדולים יותר ידרשו זמן רב יותר כדי להגיע להיווצרות פקקת משמעותית, יהיה צורך בנפח דגימה גדול יותר. בעת פתרון בעיות בפרוטוקול זה, שיקול חשוב צריך להיות אסטרטגיית הציפוי. סוג קולגן ספציפי, תזמון, דילול ותנאי אחסון ספציפיים הם כולם גורמים שעשויים להשפיע על ציפוי פני השטח. בעוד פרוטוקול זה אומת עבור מגיב קולגן מסוים זה (טבלה של חומרים), חלופות קולגן שיכולות להיצמד באופן אמין לפני השטח של המכשיר והידבקות שאומתו באמצעות צביעה immunofluorescence או אמצעים אחרים ניתן לשקול ושימשו בעבר על ידי קבוצות אחרות בהצלחה24.
מגבלה אפשרית של פרוטוקול זה היא היעדר תגובה אנדותל ישירה. עם זאת, ניתן לבצע אסטרטגיות ציפוי ושינויים שיכללו בדיקת תפקודי טסיות בתגובה לנזק לאנדותל. לדוגמה, גורמים דלקתיים שתאי אנדותל מפרישים בתגובה לפציעה יכולים להשתנות באסטרטגיית הציפוי של פרוטוקול זה או להוסיף באופן אקסוגני לדגימת הדם שנבדקה. הוספת גורמים אלה ללא המורכבות של התא תאפשר גישה ממוקדת לבחינת ההשפעות של אנדותליופתיה על תפקוד טסיות הדם. ברוח דומה, פלזמה של מטופלים ממחלות או מצבי בקרה בריאים יכולה להיות מוחדרת למערכת כדי לבדוק את ההשפעה של מתווכים מסיסים בפלזמה על תפקוד טסיות הדם.
המחקר של תפקוד טסיות הדם תחת זרימה בעקבות פרוטוקול זה יכול להקל על המחקר של קוגולופתיה הנגרמת על ידי טראומה וגישות רפואת עירוי בטראומה. בדיקות תפקודי טסיות הדם הנוכחיות הן לעתים קרובות מעל או מתחת לעוצמה כדי לראות תגובה לא מתפקדת אצל מטופל טראומה. שיטה זו מאפשרת גמישות ושינויי תכנון כדי לצפות בתפקוד טסיות הדם בדגימות של מטופלי טראומה, גם עם מגבלות נפח, בנוסף לסימולציה של תפקוד לקוי של טסיות הדם כדי להעריך התערבויות טיפוליות. מעבר למטופל הטראומה, שיטה זו יכולה להיחשב עבור מטופלות דימום לאחר לידה, חולות ניתוחי לב או חולות סרטן כדי להעריך את תפקוד טסיות הדם והתערבויות טיפוליות פוטנציאליות. חשוב לציין כי שיטה זו משלבת דינמיקת זרימה בעלת חשיבות קריטית למנגנוני היווצרות פקק טסיות הדם ותפקוד המוסטטי.
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
המחברים מודים ומודים לכל תורמי הדם שהשתתפו, כמו גם לפלבוטומיסטים של מעבדת המחקר לרפואת טראומה ועירוי ולמרכז המחקר הקליני והתרגומי של UPMC מונטיפיורי על הסיוע באוספים. SMS נתמך על-ידי K25HL161401. MDN נתמך על-ידי 1R01HL166944-01A1.
Materials
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
References
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112(2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509(2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502(2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved