Method Article
血小板機能の評価におけるマイクロ流体工学
要約
フロー下での血小板機能を評価し、マイクロ流体デバイスを使用してシミュレートされた止血蘇生法をモデル化でき、これは外傷および輸血医療に応用できます。
要約
マイクロ流体工学は、血管系を模倣する生理学的に関連性のある基質と流れを組み込んでいるため、血栓症と止血の側面を研究するための貴重なツールです。動脈の流れをシミュレートする高せん断環境では、マイクロ流体アッセイにより、流路の局所狭窄領域に多血小板血栓が形成されるため、血小板機能の研究が容易になります。少量のサンプルを許容するデバイスを利用することで、量が限られている患者サンプルや動物モデルからの流れ下での血小板機能の評価にも役立ちます。外傷患者のサンプルまたは血小板製品輸血後のサンプルを研究することは、血小板機能が重要な患者集団の治療戦略を指示するのに役立つ可能性があります。薬理学的薬剤による血小板阻害の効果も、このモデルで研究できます。このプロトコルの目的は、生理学的流れ、生物学的表面、および関連する止血メカニズムを組み込んだマイクロ流体プラットフォームを確立することです 外傷誘発性凝固障害と輸血医学の研究に影響を与える血小板機能を評価します。
概要
トラウマは、世界の主要な死因と障害の原因です。重傷は、外傷誘発性凝固障害(TIC)1と呼ばれる、止血と血栓症の独特な内因性障害によってしばしば複雑になります。血小板はTICにおいて重要な役割を果たしており、適応機能と不適応機能の両方を持っていると説明されています2。損傷後の血小板機能障害のメカニズムは依然として不明であり、改善された蘇生と治療の開発を導くために、細胞応答をよりよく理解することが非常に重要です。損傷後の血小板機能に関する追加の厄介な問題は、外傷患者の血小板機能の現在の測定値の信頼性の不確実性です。
複数の研究により、臨床的出血表現型が知られていない軽傷の患者でさえ、凝集法などの従来の血小板機能検査を使用して異常な血小板機能を持っていることが示されています3,4。ただし、損傷環境で血小板機能を評価するための凝集法には、生理学的に関連する損傷表面の欠如、アゴニスト刺激への還元主義的アプローチ、全血インピーダンス凝集法によるサンプル希釈、光透過凝集法による血漿分離、およびサンプル評価の停滞が含まれます。さらに、この血小板機能の感度が真の細胞機能障害を表しているのか、それとも損傷の状況におけるベースラインの電気インピーダンスの増加などの測定アーティファクトを表しているのかは不明のままです2。したがって、トラウマの文脈で関連する血小板機能を研究することは、TICを理解するために重要であり、この分野には革新と改善の余地がかなりあります。
血小板機能の研究に伝統的に使用されてきたプラットフォームには、外傷や外傷誘発性凝固障害5に関連する血小板機能障害を理解するために重要な流体力学や流れは含まれていません。流れに依存する止血のメカニズムには、臨界せん断速度を超える高せん断でのフォン・ヴィレブランド因子(VWF)の伸長、および糖タンパク質1b 6,7,8を介した血小板捕捉が含まれますが、これらは停滞した血小板機能アッセイでは捕捉されません。さらに、血小板は、血流レジームに応じてVWFまたはフィブリノーゲンに優先的に結合し、動脈血栓症と静脈血栓症において異なる役割を引き出します9,10。動脈血栓は主に血小板で構成され、静脈血栓は主に赤血球で構成されており、一部はフローレジームに基づいています11。フローレジームを組み込んだアッセイは、凝固低下や出血表現型から凝固亢進性や血栓性表現型まで、TIC表現型のスペクトルに関連する機能障害の解明に役立ちます。最後に、外傷患者集団の血液量サンプリングの制約により、従来の血小板機能検査が困難になる可能性があります。このような状況では、フローサイトメトリーなどのアッセイを利用することができ、また利用すべきですが、多くの場合、結果はサンプルの物理的特性評価を示しており、止血機能評価ではありません。
外傷では血小板機能障害のメカニズムが完全に理解されていない場合がありますが、P2Y12拮抗薬など、in vitroでの血小板機能障害のモデリングも、治療介入の研究を導くのに役立ちます。止血蘇生法は、全血または血液成分(赤血球、血漿、血小板濃縮物)のいずれかを使用してショック、凝固障害、および内皮損傷に対処するためにバランスの取れたアプローチで血液製剤が輸血される外傷患者にとって非常に重要です12,13,14。外傷患者では、血液製剤の早期使用は生存率の向上と関連しています15,16。貯蔵寿命を延ばすために、冷蔵保存された血小板製品がますます研究されています。冷蔵保存された血小板の検査では、止血活性の増加と、損傷後に輸血した場合の安全性が示されています17,18。
冷蔵保存血小板蘇生法の進化は、外傷に対して利用可能な最も効果的な血小板製品を理解するための追加の検査の必要性を強調しています。しかし、従来の血小板機能アッセイは、機能障害を検出するために過剰または過小に増強されることが多く、治療用血小板輸血を受けている外傷患者と、血小板貯留病変に見られる輸血製品自体の両方で発生します。機能障害の原因を特定することは、現在の血小板機能アッセイの限界(これらのテストのほとんどに静的な性質が含まれている)を考えると、困難な場合があります。したがって、 in vitroで止血蘇生法を研究する場合、レシピエントと製品血小板集団の両方のプラットフォームと検出方法は、最適な治療介入を決定する上で非常に重要です。
マイクロ流体試験は、血小板を研究するための生理学的に適切なアッセイを作成するためのフロープロファイルとバイオフィデリック表面を提供します。マイクロ流体デバイスは、血管穿刺19 または内皮損傷20のような特定の病態生理学または損傷タイプを研究するためにカスタマイズすることができる。これらのデバイスは、一般に、ポリジメチルシロキサン(PDMS)をガラス顕微鏡スライドに結合し、コラーゲンなどの表面改質を施して、内皮下や組織の損傷を模倣することで構成されています。これらのタイプのフローベースのデバイスを利用することで、外傷関連の血小板機能障害の研究を導き、血小板機能障害を改善するための最適な輸血医学アプローチを検討するのに役立ちます。これらの戦略は、負傷した患者における凝集法などの静的血小板アッセイの関連性に関する既存の混乱を明らかにするのに役立つ可能性があります。
プロトコル
すべての研究は、機関のガイドラインに準拠して実施されました。ピッツバーグ大学ヒト研究保護オフィスからの承認が得られ、健康な人間のボランティアからのインフォームドコンセントが得られました。
1. マイクロ流体デバイスの調製
- デバイスのPDMS部分を製造するには、コンピューター数値制御(CNC)マイクロマシニングを介して真鍮を使用してマスターモールドを準備します。
注意: チャネルの寸法によっては、フォトリソグラフィー技術を使用してマスターモールドを作成できます。このプロトコルで使用されるデバイスには、幅約480μm、デバイスの入口と出口の高さが140μm、デバイスの狭窄部の高さが40μmの8つの並列マイクロマシニングチャネルが含まれ、狭窄領域との間のランプ長は約0.3mmです。チャンネルの長さは約6mmです。 - 得られたマスターモールドを使用して、シリコンエラストマーベース(エラストマーキットから入手)を計量皿に注ぎます。シリコーンポリマー鎖の架橋を促進し、液体PDMSを耐久性と柔軟性のある固体に変換するシリコーン硬化剤(エラストマーキットから得られる)を10:1(ベース剤)の比率で添加し、混合物をよく攪拌します。
- 型をペトリ皿に入れ、未硬化のPDMSを型に注ぎます。ペトリ皿を真空デシケーター内に30分間入れて、泡を取り除きます。
- マスターモールドでのPDMSの硬化を完了するには、PDMSを70°Cに設定したオーブンに90分間入れます。
- PDMSの硬化が完了したら、カミソリの刃やメスでマイクロ流路ギプスを切り取ります。チャネルの端に穴を開けます(両側の直径1.5 mm)。
- ラボテープを使用して、スライドガラスの表面とマイクロ流体キャストのエッチング面を清掃します。必要に応じて圧縮空気を使用して、残っている破片を取り除きます。
- スライドガラスとエッチング面を上向きにしたマイクロ流体キャストをプラズマクリーナーに入れます。真空ポンプを始動し、チャンバーを密閉し、プラズマクリーナーを高設定にします。スライドとPDMSをプラズマクリーナーに30秒間置いてから、プラズマクリーナーの電源を切り、真空を取り除きます。
- プラズマクリーナーで上向きになっていた側面を優しく押し合わせて、プラズマクリーニングされたキャストとスライドガラスを結合します。次に、マイクロ流体デバイスを70°Cのオーブン/ホットプレートに10分間置きます。
注:キャストとスライドガラスを接着するときは、チャネルの形態が失われる可能性があるため、圧力をかけすぎないでください。 - 各チャンバーを10〜30μLの70%エタノールですすぎ、滅菌し、マイクロ流体デバイスを70°Cのホットプレートで乾燥させます。
注:デバイスは少なくとも24時間前に作成する必要がありますが、数週間から数か月前に作成することもできます。デバイスは、密閉容器または蓋付きのペトリ皿に室温で保管する必要があります。 - マイクロ流体デバイスでの実験の前日に、各チャンバーを10〜30μLの70%エタノールで再すすぎ、滅菌してマイクロ流体デバイスを70°Cのホットプレートで乾燥させます。
- チャンバーを1型ウマ線維性コラーゲン試薬(1 mg/mL)でコーティングし、0.9% NaClで希釈し、1:5の容量比で、指定の出口から指定の入口まで通します。実験内で方向性が保存されていることを確認してください。コーティングされたコラーゲンがチャネル内で蒸発するのを防ぐために、デバイスを暖かく湿気の多い密閉容器に保管してください。
- 1時間後、リン酸緩衝生理食塩水(PBS)ですすぎ、コラーゲン溶液を洗い流します。コーティングの反対方向にフラッシュします。使用しないときは、デバイスを暖かく湿気の多い密閉容器に再度保管してください。
2.血液サンプルの準備
- 静脈穿刺によりクエン酸全血サンプルを採取します。クエン酸全血をFC受容体ブロッキング溶液(1:600)でインキュベートします。
注:血液サンプルは、実験前および実験中に室温で保存されます。 - クエン酸全血を蛍光標識(お好みの蛍光色素を使用)CD41抗体(1:600)とインキュベートします。ナットロッカーで30分間染色します。
- 血小板阻害のポジティブコントロールとして、PBSの30%w / v 2-ヒドロキシプロピル-β-シクロデキストリン(HP-β-CD)の溶液で再構成されたP2Y12受容体拮抗薬であるTicagrelorを追加します。.
注:6.4 mMまでのチカグレロルストックを調製し、実験前にHP-β-CD溶液(PBSに溶解した30%HP-β-CD)でのチカグレロルストックをさらに希釈することができます(1,000倍のストック濃度を推奨)。 - クエン酸サンプルをTicaglelor(最終濃度6.4 μMまで)と30分間インキュベートして、血小板阻害を観察します。
- 血液製剤をクエン酸サンプルと混合する場合は、血液製剤をFC受容体ブロッキング溶液(1:600)および蛍光標識(クエン酸サンプルとは別の異なる蛍光色素を使用)CD41抗体(1:600)で染色します。
- 輸血した製品ユニットと同等の容量をクエン酸サンプルと混合します。たとえば、出血している人に輸血された 2 単位の血小板製剤 (製品あたり約 250 mL、総血液量 5,000 mL) をシミュレートするには、100 μL の血液製剤を 1,000 μL のクエン酸血液サンプルに混合します。
- 実験の直前に、血液サンプルを40 μmフィルターでろ過し、滅菌済みの1.5 mLマイクロ遠心チューブに入れます。
3. フロー下での血小板機能検査(方法1)
- 顕微鏡と関連ソフトウェアの電源を入れます。
- 回収シリンジポンプを顕微鏡のステージと同じレベルに設定します。シリンジポンプの設定を調整します。
- 式(1)および(2)21を使用して、チャネルの狭窄領域で3,500 s-1の所望の平均壁せん断速度(γ)の体積流量(Q)を計算します。
 (1)
(1)
 (2)
(2)
ここで、Aはチャネルの断面積、Pは接液周囲長、λは形状係数、bは長方形の短辺(高さ)、aは長方形の長辺(幅)です。
注:3,500 s-1の値は、VWF臨界せん断のために選択され、動脈レジーム7,22,23にあります。
- 式(1)および(2)21を使用して、チャネルの狭窄領域で3,500 s-1の所望の平均壁せん断速度(γ)の体積流量(Q)を計算します。
- マイクロ流体デバイスを顕微鏡ステージに置きます。マイクロ流体デバイスの端をステージにテープで固定して、動きを避けます。コンセントが顕微鏡の背面を向いていることを確認してください。
- 内径1/16インチチューブ(長さ約30cm)の一方の端をエルボーコネクターに接続し、もう一方の端を内径1/16インチコネクター付きの10mLシリンジに接続します。
- シリンジに滅菌PBSを充填し、シリンジポンプに接続します。
- エルボコネクタをデバイスのコンセントに差し込みます。
- 長さ約10cmのインレットラインを用意し、一方の端にエルボーコネクタ、もう一方の端に角度のついたカットを配置します。
- インレットエルボコネクタをデバイスインレットに接続します。
- インレットラインを角度付きホルダーの廃マイクロ遠心チューブに配置します。
- 幅約500μmのチャネル寸法の10倍対物レンズを使用し、マイクロ流体デバイスのチャネルエッジに焦点を当てます。
- PBSでラインをプライミングし、シリンジポンプを手動で進めて、PDMS/破片のチャネルをクリアします。チャネルの入口と出口の近くを必ず確認してください。
- 保存した画像キャプチャ設定を開くか、血液サンプルに使用された蛍光CD41抗体に対応する明視野チャネルと蛍光チャネルを使用して、1〜2秒ごとにキャプチャされた時系列画像の画像キャプチャ手順を作成します。
- ろ過したクエン酸血液サンプルを採取し、実験の直前にピペッティングで上下させて混合します。角度のついた微量遠心分離機ホルダーにサンプルを置きます。
- インレットラインをサンプルに配置します。
- 画像キャプチャの記録を開始します。
- ゆっくりとシリンジを引き出し、チューブ内のデッドボリュームを充填します。血液がチャネルに到達したら、すぐにシリンジポンプで 再生 を押して、目的のせん断速度で流れを再開します。
- 必要に応じてフォーカスを調整します。
- 血小板がマイクロ流体デバイスの狭窄領域を完全に閉塞するまで、または実験エンドポイント(つまり、10分)まで実験を実行します。
- 実験期間中、インレットチューブが血液サンプルに沈められていることを確認してください。
- 実験が完了したら、画像キャプチャを停止し、シリンジポンプを停止します。画像キャプチャーを保存します。
- インレットエルボコネクタを取り外し、チューブの内容物を廃棄物円錐形に空にします。シリンジとアウトレットラインの内容物も廃棄物円錐形に空にします。
- 後続のサンプルの必要に応じて、インレットコネクタとアウトレットコネクタ、およびチューブを交換します。
4. 少量サンプル(1mL未満)を用いたフロー下での血小板機能検査(方法2)
- 上記のように手順 1.1 から 1.4 を繰り返します。
- チャネルの端に直径1.5mmの出口と直径3mmの入口を打ち抜きます。
- 上記のように手順1.6から3.6を繰り返します。
- 幅約500μmのチャネル寸法の10倍対物レンズを使用し、マイクロ流体デバイスのチャネルエッジに焦点を当てます。
- シリンジポンプを手動で進め、実験室のワイプでアクセス液を吸い上げて、PDMS/破片のチャネルをクリアします。マイクロ流体デバイスの上部にあるラボテープで破片を取り除きます。
- ポンプを手動で進めて、3mmのインレットリザーバーにPBSを充填します。
- 保存した画像キャプチャ設定を開くか、血液サンプルに使用された蛍光CD41抗体に対応する明視野チャネルと蛍光チャネルを使用して、1〜2秒ごとにキャプチャされた時系列画像の画像キャプチャ手順を作成します。
- シリンジポンプで(手動または設定速度で)回収を開始し、PBSがチャネルに進み、リザーバーの充填ラインが下がったら、ポンプの回収を一時停止します。
- ピペットでリザーバーから余分なPBSを取り除きます。
- 画像キャプチャを開始します。
- 血液サンプルをリザーバー(約40μL)にピペットで入れ、すぐに離脱シリンジを開始します。フローが開始されていることを確認します。
注:ステップ4.8で回収用のシリンジポンプモーターがプライミングされなかった場合、フローはすぐには開始されず、実験を繰り返す必要があります。 - 実験期間中は血液リザーバーを補充し、エアポケットがチャネルに入らないようにします。
- 血小板がマイクロ流体デバイスの狭窄領域を完全に閉塞するまで、または実験の終点(すなわち、10分)まで実験を実行します。
- 実験が完了したら、画像キャプチャを停止し、シリンジポンプを停止します。画像キャプチャーを保存します。
- ピペッティングでリザーバー内の余分な血液を取り除きます。引き出しチューブの内容物を廃棄物の円錐形のチューブに空にします。
- 後続のサンプルの必要に応じて、コネクタとチューブを交換します。
5. 除染
- 血液の入口と出口のラインを10%漂白剤溶液に洗い流してきれいにします。
- マイクロ流体デバイスのすべてのチャネルが使用されている場合は、デバイスをシャープスのバイオハザード廃棄物容器に廃棄します。
注:すべての生物学的廃棄物は、バイオハザード廃棄物として適切に処分する必要があります。
6. 画像解析
- ソフトウェアを使用して速度論的実験から画像をエクスポートするには、[ファイル] |エクスポート/インポート |エクスポート。
- 次のパラメータを選択します: filetype: Tagged Image File Format (TIFF);圧縮:LZW;オリジナルデータとシフトピクセルを確認してください。[表示カーブとチャンネルの色を適用] のチェックを外します。サブセットの定義(領域、長方形領域)をチェックし、条件間で幅と高さの測定値を節約するチャネル領域を選択します。目的のフォルダにエクスポートし、[フォルダの作成]をオンにします。
- ソフトウェアで以下の実験値に注意してください:血液がチャネルに入ったときの開始フレーム。フレーム レート (情報、時系列)。
- Supplemental File 1として提供されるMatlabコードを使用して、実験の各フレームの各フレームの正規化された平均蛍光強度を測定し、各実験の次の入力を変更します:実験の長さに基づく開始フレーム/終了フレーム(実験の長さが条件間で保存されていることを確認してください)。実験名/フォルダ名。X、Y、H、W パラメータのトリミング。コードをレシピエント血小板蛍光チャンネルに1回、製品血小板蛍光チャンネルに1回実行します。正規化されたMFI(2列目)と正規化されたAUC値(開始フレームに正規化された値)を報告します。正規化された AUC 値から実験の長さの値を減算します。
結果
この方法を使用した後のマイクロ流体実験では、流路の狭窄領域に多血小板血栓が形成されることが示されています(図1)。 図1A は、機能性血小板がチャネルの狭窄領域に血栓を形成してチャネルを通る血流を遮断する代表的な結果を示しています。実験期間中に撮影されたカイネティック画像の平均蛍光強度(MFI)曲線は、成長する血栓における血小板の取り込みの遅延、成長、およびプラトー期を示しています(図2A、C)。P2Y12 アンタゴニストであるチカグレロルの濃度を上げると、血小板 MFI と MFI 曲線の計算下曲線下面積 (AUC) が減少します (図 2B、D)。顕著な血小板機能障害を観察するには、より長いインキュベーション時間(5分に対して30分)が必要であり、5分間のインキュベーションと比較して30分のチカグレロールインキュベーション後の全血インピーダンス凝集法を利用したより顕著な用量反応関係に従っています(補足図S1)。異なる車両条件下では、P2Y12阻害の同様の時間依存性の影響がマイクロ流体モデルで観察されました(補足図S2)。
シミュレートされた止血蘇生法における2つの血小板集団の視覚化は、血栓内に両方の血小板集団が組み込まれていることを示しています(図3A)。両方の血小板集団の対応する蛍光シグナルへの取り込みは、MFI測定を介して実験期間中の速度論的に定量化できます(図3B)。成長期の傾斜が急になり、エンドポイントのMFI測定値が増加すると、血小板機能と止血電位が増加することが示され、これは、P2Y12阻害を介して血液サンプルが血小板機能障害を誘発された場合のレシピエント血小板の定量化、およびその後、新鮮な自家全血を1:10の容量比で混合して蘇生をシミュレートし、明確な血小板蛍光色素で染色することで蘇生に見られます。自家全血混合では、室温保存5日目のアフェレーシス血小板製品と比較して、模擬輸血産物からより多くの血小板が組み込まれ、形成血栓への製品の取り込みが最小限であることが示されました。5日目の室温血小板製品の混合も、新鮮な自家全血との混合と比較して、レシピエント血小板の取り込みが低いことを示しました(図3B)。
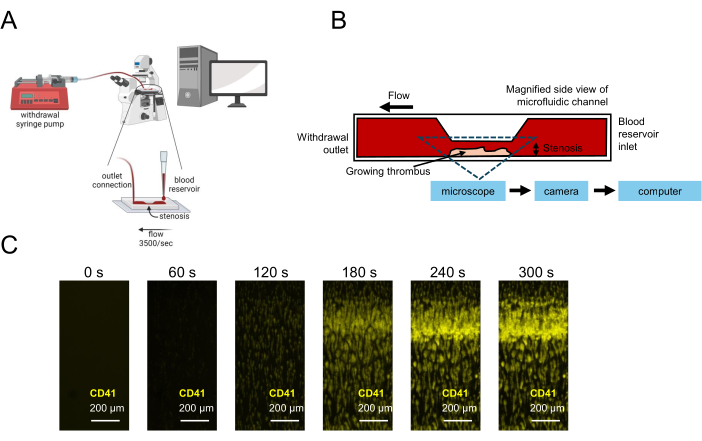
図1:マイクロ流体工学を使用した血小板機能検査の表現。 (A)狭窄フローチャンバーから血液を吸引する抜取シリンジポンプなど、少量の血液サンプルを用いた血小板機能検査のためのマイクロ流体実験装置の概略図を示し、リアルタイムでの画像取得を可能にしました。(B)血小板が付着し、活性化し、凝集し、狭窄領域で血栓が成長するコラーゲン被覆表面を含む、狭窄フローチャンバーの側面図が示されています。(C)狭窄性マイクロ流体チャネル(3,500 s-1)および300 s以上で形成された成長血栓に流れているクエン酸血液サンプルのリアルタイム画像キャプチャ。スケールバー = 200 μm (C)。 この図の拡大版を表示するには、ここをクリックしてください。
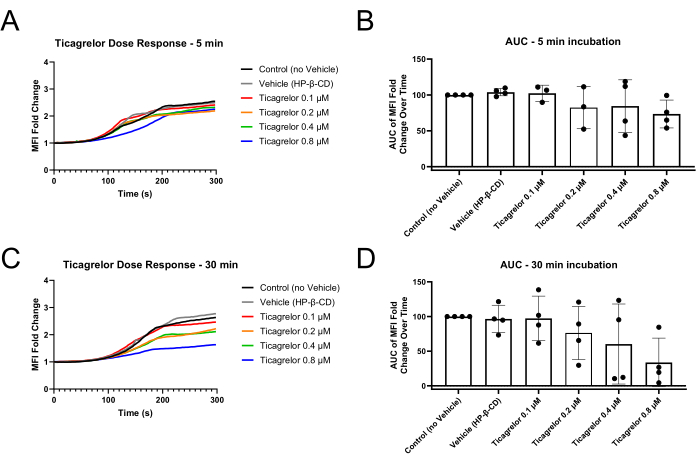
図2:P2Y12拮抗薬Ticagrelorとのインキュベーション30分後の血小板MFI倍率変化と曲線下面積の減少 (A)P2Y12拮抗薬とのわずか5分間のインキュベーションは、MFI曲線のわずかに延長された遅延フェーズを示し、(B)MFI AUCのわずかな減少を示しています。(C)P2Y12拮抗薬と30分間インキュベートすると、遅延フェーズが延長され、エンドポイントMFI値が低下するだけでなく、(D)MFI AUCを介してより堅牢な機能障害が示されます。個々のデータポイントは生物学的反復を表し、平均±標準偏差が表示されます。略語:MFI =平均蛍光強度。AUC = 曲線下面積HP-β-CD = 2-ヒドロキシプロピル-β-シクロデキストリン。 この図の拡大版を表示するには、ここをクリックしてください。

図3:レシピエントサンプルで凝固障害性P2Y12阻害と混合された血液製剤、マイクロ流体チャンバー内の患者の血小板機能障害をシミュレート 。(A)アフェレーシス血小板ユニット(血漿、保存7日目)(シアン中のCD41)を1:10の比率で混合し、クエン酸血液と0.8μMチカグレロルで30分間プレインキュベートしました(CD41は赤)。(B)アフェレーシス血小板ユニット(保存日5)または自家新鮮全血(1:10の比率)のいずれかを投与されたレシピエント血液サンプルの代表的な正規化平均蛍光強度曲線と、レシピエントの血小板動態を経時的に。レシピエントのクエン酸血液を0.8 μMチカグレロルと30分間事前にインキュベートしてから、血液製剤と混合しました。(C)共焦点顕微鏡用のカバースリップに接着された改変されたデバイスからの代表的なzスタック画像。アフェレーシス血小板製剤は、フォン・ヴィレブランド因子抗体(1:600)に加えて、血小板減少性血液サンプル(製品:血液)と1:5の容量比で混合しました。 この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:画像解析用のMatlabコード。このファイルをダウンロードするには、ここをクリックしてください。
補足図S1:全血インピーダンス凝集法、TicagrelorによるP2Y12阻害の時間依存性。 30分間のインキュベーションは、5分間と比較してより顕著な用量反応関係をもたらします。ビヒクルおよび薬物溶液は 0.1% v/v で利用されました。個々のデータポイントは生物学的反復を表し、平均±標準偏差が表示されます。略語:AUC =曲線下の面積。HP-β-CD = 2-ヒドロキシプロピル-β-シクロデキストリン。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S2:血小板機能のマイクロ流体モデルにおけるチカグレロルによる時間依存性P2Y12阻害。 個々の健康なドナーからの技術的複製の代表的な MFI 曲線と曲線下面積の値を、薬物溶解性に利用されるエタノールビヒクル (1% v/v) で示しています。略語:MFI =平均蛍光強度。AUC = 曲線下面積。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
上記のプロトコルには、実験の信頼性と再現性を確保するためのいくつかの重要なステップがあります。まず、蛍光抗体を慎重に検討する必要があります。サンプル中の血小板を検出するために使用される抗体は、糖タンパク質Ib(GPIb)血小板受容体の機能を阻害してはなりません。実験間で可能な限りロットマッチングを行うことも、蛍光シグナルの再現性を確保するために重要です。このプロトコルのもう一つの重要なステップは、可能な限り滅菌済みの消耗品と溶液、およびろ過されたサンプルを使用することです。実験の直前に血液サンプルをろ過することで、チャネルの寸法よりも大きな破片や血小板の塊が流れを妨げるのを防ぐことができます。これは、実験間で一貫性を保つためのもう1つの重要なパラメーターです。さらに、血液サンプルは、AABB、米国赤十字社、米国血液センター、および軍用血液プログラムによって準備されたヒトの血液および血液成分の使用に関する情報の回覧に記載されているように、収集から4時間以内に検査する必要があります。
このプロトコルでは、 図3Cに示すように、PDMSを共焦点顕微鏡用のカバースリップに接着するなどの変更を検討することができます。必要に応じて、イメージングの前に、固定溶液をチャネルを介して灌流し、イメージング前にPBSで洗浄して保存することができます。さらに、再現性のあるチャネル寸法は、条件間のせん断速度の保存を確保するための鍵となりますが、狭窄領域の高さは変更できますが、せん断速度が一致していても、血栓形成のタイミングに直接影響します。チャネルの寸法が大きいほど、十分な血栓形成に到達するのに時間がかかるため、より多くのサンプル量が必要になります。このプロトコルのトラブルシューティングを行う際には、コーティング戦略を重要視する必要があります。特定のコラーゲンの種類、タイミング、希釈、および保存条件はすべて、表面コーティングに影響を与える可能性のある要因です。このプロトコルは、この特定のコラーゲン試薬(材料表)に対して検証されていますが、デバイス表面に確実に接着でき、免疫蛍光染色またはその他の手段によって検証された接着が可能なコラーゲンの代替品を検討することができ、以前に他のグループによって成功裏に使用されていました24。
このプロトコルの潜在的な制限は、直接的な内皮反応の欠如です。ただし、コーティング戦略と変更を加えて、内皮損傷に応じた血小板機能試験を含めることができます。例えば、内皮細胞が損傷に応答して分泌する炎症性因子は、このプロトコルのコーティング戦略において変更されるか、または試験された血液サンプルに外因的に追加され得る。細胞化の複雑さなしにこれらの因子を追加することで、内皮症が血小板機能に及ぼす影響を調べるための的を絞ったアプローチが可能になります。同様に、疾患または健康な制御状態からの患者の血漿をシステムにスパイクして、血漿可溶性メディエーターが血小板機能に与える影響を試験できます。
このプロトコルに従った血小板流下での血小板機能の研究は、外傷誘発性凝固障害および外傷における輸血医学アプローチの研究を容易にすることができます。現在の血小板機能検査は、外傷患者の機能不全の反応を見るために、しばしば増強過剰または過少に増強されています。この方法では、治療介入を評価するための血小板機能障害のシミュレーションに加えて、体積に制約がある場合でも、外傷患者サンプルの血小板機能を観察するための柔軟性と設計変更が可能になります。外傷患者以外にも、この方法は、分娩後出血患者、心臓手術患者、または癌患者が血小板の機能と潜在的な治療介入を評価するために検討できます。重要なことに、この方法には、血小板プラグ形成と止血機能のメカニズムにとって非常に重要なフローダイナミクスが組み込まれています。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
著者らは、参加したすべての献血者、およびTrauma and Transfusion Medicine Research Labの瀉血専門医、およびコレクションの支援を提供してくれたUPMCモンテフィオーレ臨床およびトランスレーショナルリサーチセンターに感謝の意を表します。SMS は K25HL161401 でサポートされています。MDN は 1R01HL166944-01A1 でサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
参考文献
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112(2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509(2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502(2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved