Method Article
Microfluídica na avaliação da função plaquetária
Neste Artigo
Resumo
A função plaquetária sob fluxo pode ser avaliada e a ressuscitação hemostática simulada pode ser modelada usando um dispositivo microfluídico, que tem aplicações em trauma e medicina transfusional.
Resumo
A microfluídica incorpora substratos e fluxos fisiologicamente relevantes que mimetizam a vasculatura e são, portanto, uma ferramenta valiosa para estudar aspectos de trombose e hemostasia. Em ambientes de alto cisalhamento simulando fluxo arterial, um ensaio microfluídico facilita o estudo da função plaquetária, pois trombos ricos em plaquetas se formam em uma região estenótica localizada de um canal de fluxo. A utilização de dispositivos que permitem um pequeno volume de amostra também pode ajudar na avaliação da função plaquetária sob fluxo de amostras de pacientes com volume limitado ou modelos animais. O estudo de amostras de pacientes com trauma ou amostras após transfusão de produtos plaquetários pode ajudar a direcionar estratégias terapêuticas para populações de pacientes nas quais a função plaquetária é crítica. Os efeitos da inibição plaquetária via agentes farmacológicos também podem ser estudados neste modelo. O objetivo deste protocolo é estabelecer uma plataforma microfluídica que incorpore fluxo fisiológico, superfícies biológicas e mecanismos hemostáticos relevantes para avaliar a função plaquetária com implicações para o estudo da coagulopatia induzida por trauma e medicina transfusional.
Introdução
O trauma é uma das principais causas globais de morte e incapacidade. A lesão grave é frequentemente complicada por um distúrbio endógeno único de hemostasia e trombose, denominado coagulopatia induzida por trauma (TIC)1. As plaquetas desempenham um papel crítico na TIC e foram descritas como tendo funções adaptativas e desadaptativas2. Os mecanismos da disfunção plaquetária após a lesão permanecem obscuros, e há uma necessidade crítica de entender melhor a resposta celular para orientar o desenvolvimento de ressuscitação e terapia aprimoradas. Um problema adicional incômodo em relação à função plaquetária após a lesão é a incerteza da confiabilidade das leituras atuais da função plaquetária no paciente traumatizado.
Vários estudos mostraram que mesmo pacientes levemente feridos, sem fenótipo de sangramento clínico conhecido, apresentam função plaquetária anormal usando testes convencionais de função plaquetária, como a agregometria 3,4. No entanto, as limitações na agregometria para avaliar a função plaquetária em um cenário de lesão incluem a falta de superfície de lesão fisiologicamente relevante, uma abordagem reducionista para estimulação agonista, diluição de amostra com agregometria de impedância de sangue total, separação de plasma com agregometria de transmissão de luz óptica e avaliação de amostra estagnada. Além disso, ainda não está claro se essa sensibilidade da função plaquetária representa disfunção celular verdadeira ou um artefato de medição, como aumento da impedância elétrica basal, no cenário de lesão2. Assim, estudar as funções plaquetárias relevantes no contexto do trauma é crucial para a compreensão da TIC, e há espaço substancial para inovação e melhoria nessa área.
As plataformas tradicionalmente usadas para estudar a função plaquetária não incluem dinâmica e fluxo de fluidos, o que pode ser crítico na compreensão da disfunção plaquetária relacionada ao trauma e à coagulopatia induzida por trauma5. Os mecanismos de hemostasia que dependem do fluxo incluem o alongamento do fator de von Willebrand (FVW) em alto cisalhamento, acima de uma taxa de cisalhamento crítica, e a captura de plaquetas via glicoproteína 1b 6,7,8, que não são capturadas usando ensaios de função plaquetária estagnada. Além disso, as plaquetas ligam-se preferencialmente ao FVW ou ao fibrinogênio, dependendo do regime de fluxo, e provocam papéis diferenciais na trombose arterial versus venosa 9,10. Os trombos arteriais são compostos principalmente de plaquetas, enquanto os trombos venosos são compostos principalmente de glóbulos vermelhos, baseados, em parte, em regimes de fluxo11. Ensaios que incorporam regimes de fluxo podem ajudar a elucidar disfunções pertencentes ao espectro de fenótipos de TIC, desde fenótipos de hipocoagulabilidade e sangramento até hipercoagulabilidade e fenótipos trombóticos. Finalmente, as restrições de amostragem de volume sanguíneo com populações de pacientes com trauma podem tornar os testes tradicionais da função plaquetária desafiadores. Embora ensaios como a citometria de fluxo possam e devam ser utilizados nessas circunstâncias, os resultados geralmente retratam uma caracterização física de uma amostra e não uma avaliação funcional hemostática.
Embora os mecanismos de disfunção plaquetária possam não ser completamente compreendidos no trauma, a modelagem da disfunção plaquetária in vitro, com antagonistas P2Y12, por exemplo, também pode ajudar a orientar o estudo de intervenções terapêuticas. A ressuscitação hemostática é extremamente importante em pacientes com trauma, onde os hemoderivados são transfundidos em uma abordagem equilibrada para tratar choque, coagulopatia e lesão endotelial com sangue total ou componentes sanguíneos (glóbulos vermelhos, plasma e concentrados de plaquetas) emuma proporção de 1:1:1 12,13,14. Em pacientes traumatizados, o uso precoce de hemoderivados está associado à melhora da sobrevida15,16. Para prolongar a vida útil, os produtos plaquetários armazenados a frio têm sido cada vez mais estudados. O exame de plaquetas armazenadas a frio mostra aumento da atividade hemostática, bem como segurança quando transfundidas após lesão17,18.
A evolução da ressuscitação plaquetária armazenada a frio enfatiza a necessidade de testes adicionais para entender o produto plaquetário mais eficaz disponível para trauma. No entanto, os ensaios tradicionais da função plaquetária são frequentemente superpotencializados ou subpotencializados para detectar disfunção, ocorrendo tanto no paciente traumatizado que recebe transfusão terapêutica de plaquetas quanto no próprio produto transfundido visto em lesões de armazenamento plaquetário. Determinar a origem da disfunção pode ser um desafio, dadas as limitações nos ensaios atuais da função plaquetária, incluindo a natureza estática da maioria desses testes. Portanto, ao estudar a ressuscitação hemostática in vitro, a plataforma e os métodos de detecção para as populações de plaquetas receptoras e do produto são de importância crítica na determinação das intervenções terapêuticas ideais.
O teste microfluídico oferece perfis de fluxo e superfícies biofidélicas para criar um ensaio fisiologicamente relevante para estudar as plaquetas. Os dispositivos microfluídicos podem ser personalizados para estudar fisiopatologia específica ou tipos de lesões, como punção do vaso19 ou dano endotelial20. Esses dispositivos são geralmente compostos de polidimetilsiloxano (PDMS) ligado a uma lâmina de microscópio de vidro com modificações de superfície, como colágeno, para imitar subendotélio e lesão tecidual. A utilização desses tipos de dispositivos baseados em fluxo pode ajudar a orientar a pesquisa de disfunção plaquetária relacionada ao trauma e auxiliar no exame de abordagens ideais de medicina transfusional para melhorar a disfunção plaquetária. Essas estratégias podem ajudar a esclarecer a confusão existente sobre a relevância dos ensaios estáticos de plaquetas, como a agregometria no paciente lesionado.
Protocolo
Todas as pesquisas foram realizadas de acordo com as diretrizes institucionais. A aprovação do Escritório de Proteção à Pesquisa Humana da Universidade de Pittsburgh foi obtida e o consentimento informado de voluntários humanos saudáveis foi obtido.
1. Preparação do dispositivo microfluídico
- Para fabricar a parte PDMS do dispositivo, prepare um molde mestre usando latão por meio de microusinagem de controle numérico computadorizado (CNC).
NOTA: Dependendo das dimensões do canal, técnicas de fotolitografia podem ser usadas para criar um molde mestre. O dispositivo usado neste protocolo inclui oito canais microusinados paralelos com aproximadamente 480 μm de largura, 140 μm de altura na entrada e saída do dispositivo e 40 μm de altura na estenose do dispositivo, com um comprimento de rampa de/para a região estenótica de aproximadamente 0,3 mm. Os comprimentos dos canais são de aproximadamente 6 mm. - Com um molde mestre obtido, despeje a Base de Elastômero de Silicone (obtida do kit de elastômero) em um prato de pesagem. Adicione o Agente de Cura de Silicone (obtido a partir do kit de elastômero), que facilita a reticulação das cadeias de polímero de silicone para transformar o PDMS líquido em um sólido durável e flexível, na proporção de 10:1 (agente base) e agite bem a mistura.
- Coloque o molde em uma placa de Petri e despeje o PDMS não curado no molde. Coloque a placa de Petri dentro de um dessecador a vácuo por 30 min para remover as bolhas.
- Termine de curar o PDMS no molde mestre, colocando-o em um forno regulado para 70 °C por 90 min.
- Após a cura completa do PDMS, corte o molde microfluídico usando uma lâmina de barbear ou bisturi. Faça furos nas bordas dos canais (1,5 mm de diâmetro em ambos os lados).
- Usando fita adesiva de laboratório, limpe a superfície de uma lâmina de vidro e o lado gravado do molde microfluídico. Use ar comprimido conforme necessário para remover os detritos restantes.
- Coloque a lâmina de vidro e o molde microfluídico com o lado gravado para cima em um limpador de plasma. Ligue a bomba de vácuo, sele a câmara e ligue o limpador de plasma para a configuração alta. Deixe a lâmina e o PDMS no limpador de plasma por 30 s, depois desligue o limpador de plasma e remova o vácuo.
- Amarre o molde limpo de plasma e a lâmina de vidro pressionando suavemente os lados que estavam voltados para cima no limpador de plasma. Em seguida, coloque o dispositivo microfluídico em um forno/placa de aquecimento a 70 °C por 10 min.
NOTA: Não aplique muita pressão ao unir o molde e a lâmina de vidro, pois isso pode levar a uma perda na morfologia do canal. - Enxágue cada câmara com 10-30 μL de etanol a 70% para esterilizar e deixe o dispositivo microfluídico secar em uma placa quente a 70 °C.
NOTA: Os dispositivos devem ser feitos com pelo menos 24 horas de antecedência, mas podem ser feitos com semanas a meses de antecedência. Os dispositivos devem ser armazenados em um recipiente hermético ou placa de Petri coberta em temperatura ambiente. - No dia anterior à experimentação com o dispositivo microfluídico, enxágue novamente cada câmara com 10-30 μL de etanol a 70% para esterilizar e deixe o dispositivo microfluídico secar em uma placa de aquecimento a 70 ° C.
- Cubra a câmara com reagente de colágeno fibrilar equino tipo 1 (1 mg / mL), diluído em NaCl a 0,9% em uma proporção volumétrica de 1: 5 através de uma saída designada para a entrada designada. Certifique-se de que a direcionalidade seja conservada em um experimento. Armazene o dispositivo em um recipiente fechado quente e úmido para evitar a evaporação do colágeno revestido dentro do canal.
- Após 1 h, enxágue com solução salina tamponada com fosfato (PBS) para remover a solução de colágeno. Nivele na direção oposta do revestimento. Quando não estiver em uso, guarde o dispositivo novamente em um recipiente quente, úmido e fechado.
2. Preparação da amostra de sangue
- Obter uma amostra de sangue total citrato por punção venosa. Incubar sangue total citrato com solução de bloqueio do receptor FC (1:600).
NOTA: As amostras de sangue são armazenadas em temperatura ambiente antes e durante a experimentação. - Incubar sangue total citrato com anticorpo CD41 conjugado com fluorescência (usando um fluoróforo de escolha) (1:600). Manchar por 30 min em um balancim nutatório.
- Como controle positivo para a inibição plaquetária, adicione Ticagrelor, um antagonista do receptor P2Y12 reconstituído em uma solução de 30% p / v de 2-hidroxipropil-β-ciclodextrina (HP-β-CD) em PBS.
NOTA: Estoques de ticagrelor de até 6,4 mM devem ser preparados e diluição adicional dos estoques de ticagrelor em solução de HP-β-CD (30% de HP-β-CD dissolvido em PBS) pode ser feita antes da experimentação (recomenda-se concentrações de estoque de 1.000x). - Incubar a amostra citrada com Ticagrelor (concentração final até 6,4 μM) durante 30 min para observar a inibição plaquetária.
- Se misturar o hemoderivado com a amostra citrata, corar o hemoderivado com solução de bloqueio do receptor FC (1:600) e anticorpo CD41 conjugado com fluorescência (usando um fluoróforo separado e distinto para a amostra citrato) (1:600).
- Misturar um equivalente volumétrico das unidades de produto transfundido com a amostra citrada. Por exemplo, para simular 2 unidades de produtos plaquetários transfundidos em uma pessoa com hemorragia (aproximadamente 250 mL por produto em um volume total de sangue de 5.000 mL), misture 100 μL de hemoderivado em 1.000 μL de amostra de sangue citrato.
- Imediatamente antes da experimentação, filtre a amostra de sangue através de um filtro de 40 μm em um tubo de microcentrífuga estéril de 1,5 mL.
3. Teste da função plaquetária sob fluxo (Método 1)
- Ligue o microscópio e o software associado.
- Defina o nível da bomba da seringa de retirada com o estágio do microscópio. Ajuste as configurações na bomba de seringa.
- Calcule uma taxa de fluxo volumétrico (Q) para uma taxa média de cisalhamento da parede desejada (γ) de 3.500 s-1 na região estenótica do canal usando as equações (1) e (2)21.
 Características (1)
Características (1)
 (2)
(2)
Onde A é a área da seção transversal do canal, P é o perímetro molhado, λ é o fator de forma, b é o lado curto do retângulo (altura) e a é o lado longo do retângulo (largura).
NOTA: O valor de 3.500 s-1 é escolhido devido ao cisalhamento crítico do FVW e está no regime arterial 7,22,23.
- Calcule uma taxa de fluxo volumétrico (Q) para uma taxa média de cisalhamento da parede desejada (γ) de 3.500 s-1 na região estenótica do canal usando as equações (1) e (2)21.
- Coloque o dispositivo microfluídico no microscópio stage. Cole as bordas do dispositivo microfluídico no palco para evitar movimento. Certifique-se de que a saída esteja voltada para a parte traseira do microscópio.
- Conecte uma extremidade do tubo de 1/16" ID (aproximadamente 30 cm de comprimento) a um conector de cotovelo e a outra extremidade a uma seringa de 10 mL com conector de 1/16" ID.
- Encha a seringa com PBS estéril e conecte-a à bomba da seringa.
- Coloque o conector de cotovelo na saída do dispositivo.
- Prepare linhas de entrada com aproximadamente 10 cm de comprimento com o conector de cotovelo em uma extremidade e o corte angular na outra extremidade.
- Conecte o conector do cotovelo de entrada na entrada do dispositivo.
- Posicione a linha de entrada em um tubo de microcentrífuga residual em um suporte angular.
- Use a objetiva de 10x para dimensões de canal de aproximadamente 500 μm de largura e concentre-se nas bordas do canal do dispositivo microfluídico.
- Prepare as linhas com PBS e limpe o canal de qualquer PDMS/detritos avançando a bomba de seringa manualmente. Certifique-se de verificar perto da entrada e saída do canal.
- Abra as configurações de captura de imagem salva ou crie um procedimento de captura de imagem para imagens de séries temporais capturadas a cada 1–2 s com um canal de campo claro e canais fluorescentes correspondentes aos anticorpos CD41 fluorescentes usados na amostra de sangue.
- Obter a amostra de sangue citrato filtrado e misturar pipetando para cima e para baixo imediatamente antes da experiência. Coloque a amostra no suporte da microcentrífuga angular.
- Posicione a linha de entrada na amostra.
- Comece a gravar a captura de imagem.
- Lentamente, retire a seringa para preencher o volume morto no tubo. Assim que o sangue atingir o canal, aperte imediatamente o play na bomba da seringa para retomar o fluxo na taxa de cisalhamento desejada.
- Ajuste o foco, se necessário.
- Execute o experimento até que as plaquetas tenham ocluído completamente a região estenótica do dispositivo microfluídico ou até um ponto final experimental (ou seja, 10 min).
- Certifique-se de que o tubo de entrada esteja submerso na amostra de sangue durante o experimento.
- Quando o experimento estiver concluído, pare a captura de imagem e pare a bomba de seringa. Salve a captura de imagem.
- Remova o conector do cotovelo de entrada e esvazie o conteúdo da tubulação em uma cônica de resíduos. Esvazie também o conteúdo da seringa e das linhas de saída na cônica de resíduos.
- Substitua os conectores de entrada e saída e a tubulação conforme necessário para amostras subsequentes.
4. Teste da função plaquetária sob fluxo com amostras de baixo volume (abaixo de 1 mL) (Método 2)
- Repita as etapas 1.1 a 1.4 como acima.
- Perfure uma saída de 1,5 mm de diâmetro e uma entrada de 3 mm de diâmetro nas bordas dos canais.
- Repita as etapas 1.6 a 3.6 como acima.
- Use a objetiva de 10x para dimensões de canal de aproximadamente 500 μm de largura e concentre-se nas bordas do canal do dispositivo microfluídico.
- Limpe o canal de qualquer PDMS/detritos avançando a bomba da seringa manualmente e absorvendo o fluido de acesso com um lenço de laboratório. Remova quaisquer detritos com fita adesiva na parte superior do dispositivo microfluídico.
- Avance manualmente a bomba para encher o reservatório de entrada de 3 mm com PBS.
- Abra as configurações de captura de imagem salva ou crie um procedimento de captura de imagem para imagens de séries temporais capturadas a cada 1–2 s com um canal de campo claro e canais fluorescentes correspondentes aos anticorpos CD41 fluorescentes usados na amostra de sangue.
- Inicie a retirada na bomba de seringa (manualmente ou com velocidade definida) e assim que o PBS estiver avançando para o canal e a linha de enchimento no reservatório estiver diminuindo, pause a retirada na bomba.
- Remova o excesso de PBS do reservatório com uma pipeta.
- Inicie a captura de imagem.
- Pipetar a amostra de sangue para o reservatório (aproximadamente 40 μL) e iniciar imediatamente a seringa de retirada. Certifique-se de que o fluxo comece.
NOTA: Se o motor da bomba de seringa para retirada não foi preparado na etapa 4.8, o fluxo não começará imediatamente e o experimento deve ser repetido. - Reabasteça o reservatório de sangue durante o experimento, garantindo que nenhuma bolsa de ar entre no canal.
- Execute o experimento até que as plaquetas tenham ocluído completamente a região estenótica do dispositivo microfluídico ou até um ponto final experimental (ou seja, 10 min).
- Quando o experimento estiver concluído, pare a captura de imagem e pare a bomba de seringa. Salve a captura de imagem.
- Remova o excesso de sangue no reservatório pipetando. Esvazie o conteúdo do tubo de extração em um tubo cônico de resíduos.
- Substitua os conectores e a tubulação conforme necessário para amostras subsequentes.
5. Descontaminação
- Limpe as linhas de entrada e saída de sangue lavando em uma solução de alvejante a 10%.
- Se todos os canais do dispositivo microfluídico tiverem sido usados, descarte o dispositivo no recipiente de resíduos biológicos perigosos Sharps.
NOTA: Todos os resíduos biológicos devem ser descartados adequadamente em resíduos de risco biológico.
6. Análise de imagem
- Exporte as imagens de experimentos cinéticos usando software clicando em Arquivo | Exportação/Importação | Exportação.
- Selecione os seguintes parâmetros: tipo de arquivo: Formato de arquivo de imagem marcada (TIFF); compressão: LZW; verifique os dados originais e o deslocamento de pixel; desmarque Aplicar curva de exibição e cor do canal; marque Definir subconjunto (região, região do retângulo e selecione a área do canal com uma medida de conservação de largura e altura entre as condições). Exporte para a pasta desejada e marque Criar pasta.
- Observe os valores experimentais abaixo no software: iniciar o quadro quando o sangue entrar no canal; taxa de quadros (Info, Série Temporal).
- Meça a intensidade média de fluorescência normalizada de cada quadro em um experimento utilizando o código Matlab fornecido como Arquivo Suplementar 1, alterando as seguintes entradas para cada experimento: quadro inicial/quadro final com base na duração do experimento (certifique-se de que o comprimento do experimento seja conservado entre as condições); nome do experimento/nome da pasta; recortando os parâmetros X, Y, H e W. Execute o código uma vez para o canal fluorescente de plaquetas receptoras e uma vez para o canal fluorescente de plaquetas do produto. Relate os valores de MFI normalizados (coluna 2) e AUC normalizados (normalizados para o quadro inicial). Subtraia o valor de duração do experimento do valor de AUC normalizado.
Resultados
Experimentos microfluídicos após o uso deste método devem mostrar a formação de trombos ricos em plaquetas na região de estenose do canal de fluxo (Figura 1). A Figura 1A ilustra resultados representativos em que as plaquetas funcionais formaram um trombo na região estenótica do canal para bloquear o fluxo sanguíneo através do canal. As curvas de intensidade média de fluorescência (MFI) das imagens cinéticas obtidas durante o experimento ilustram uma fase de atraso, crescimento e platô da incorporação plaquetária no trombo em crescimento (Figura 2A, C). O aumento das concentrações de um antagonista P2Y12, o ticagrelor, diminui o MFI plaquetário, bem como a área calculada sob a curva (AUC) das curvas MFI ( Figura 2B , D ). São necessários tempos de incubação mais longos (30 min em comparação com 5 min) para observar disfunção plaquetária pronunciada, de acordo com uma relação dose-resposta mais pronunciada utilizando agregometria de impedância de sangue total após uma incubação de Ticagrelor de 30 min em comparação com 5 min de incubação (Figura Suplementar S1). Sob diferentes condições do veículo, efeitos dependentes do tempo semelhantes da inibição de P2Y12 foram observados no modelo microfluídico (Figura Suplementar S2).
A visualização de duas populações de plaquetas no método de ressuscitação hemostática simulada ilustra a incorporação de ambas as populações de plaquetas no trombo (Figura 3A). A incorporação de ambas as populações de plaquetas em seu sinal fluorescente correspondente pode ser quantificada cineticamente ao longo da duração do experimento por meio de medições de MFI (Figura 3B). Inclinações mais íngremes na fase de crescimento, bem como o aumento das medições de MFI de desfecho, demonstram aumento da funcionalidade plaquetária e potencial hemostático, que pode ser visto na quantificação de plaquetas receptoras quando a amostra de sangue foi induzida com disfunção plaquetária via inibição P2Y12 e, em seguida, ressuscitação simulada pela mistura de sangue total autólogo fresco em uma proporção volumétrica de 1:10 corada com um fluoróforo plaquetário distinto. Com a mistura autóloga de sangue total, mais plaquetas foram incorporadas do produto transfundido simulado em comparação com um produto plaquetário por aférese no dia 5 de armazenamento em temperatura ambiente, que mostrou incorporação mínima do produto no trombo em formação. A mistura de produtos plaquetários à temperatura ambiente do dia 5 também mostrou menor incorporação de plaquetas receptoras em comparação com a mistura com sangue total autólogo fresco (Figura 3B).
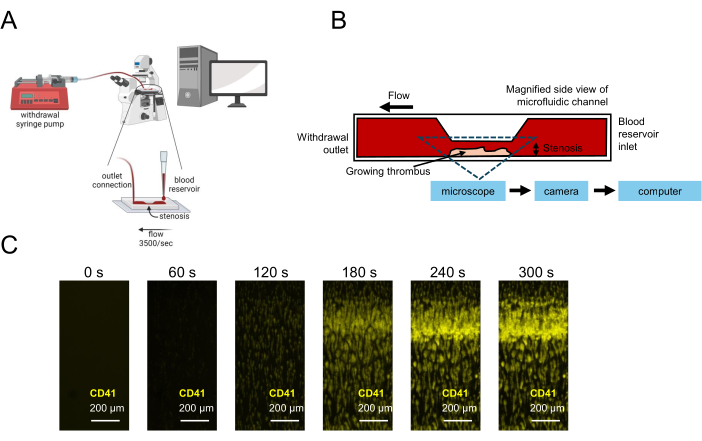
Figura 1: Representação do teste da função plaquetária usando microfluídica. (A) A configuração experimental microfluídica esquemática para testes de função plaquetária usando amostras de sangue de baixo volume é mostrada, incluindo uma bomba de seringa de retirada puxando sangue através de uma câmara de fluxo estenótico, permitindo a captura de imagens em tempo real. (B) Uma vista lateral de uma câmara de fluxo estenótico é mostrada, incluindo uma superfície revestida de colágeno na qual as plaquetas irão aderir, ativar e agregar, resultando em um trombo crescente na região estenótica. (C) Captura de imagem em tempo real de uma amostra de sangue citrato sob fluxo em um canal microfluídico estenótico (3.500 s-1) e um trombo crescente formado ao longo de 300 s. Barras de escala = 200 μm (C). Clique aqui para ver uma versão maior desta figura.
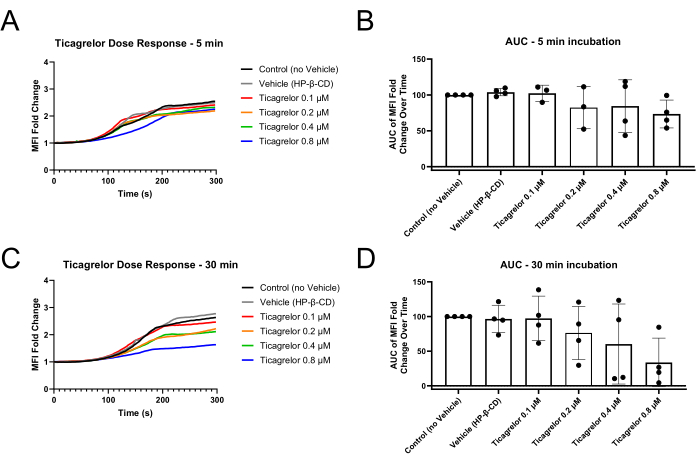
Figura 2: Redução das alterações nas dobras do IMF plaquetário e na área sob a curva após 30 min de incubação com o antagonista P2Y12 Ticagrelor. (A) A incubação com o antagonista P2Y12 por apenas 5 min demonstra fases de atraso ligeiramente estendidas das curvas MFI e (B) ligeiras diminuições na AUC do MFI. (C) A incubação por 30 min com antagonista P2Y12 resulta em fases de atraso prolongadas e valores reduzidos de MFI de endpoint, bem como (D) disfunção mais robusta demonstrada via MFI AUC. Os pontos de dados individuais representam réplicas biológicas e a média ± desvio padrão é mostrada. Abreviaturas: MFI = intensidade média de fluorescência; AUC = área sob a curva; HP-β-CD = 2-hidroxipropil-β-ciclodextrina. Clique aqui para ver uma versão maior desta figura.

Figura 3: Mistura de hemoderivados com inibição coagulopática de P2Y12 na amostra receptora, simulando disfunção plaquetária do paciente, na câmara microfluídica. (A) Unidade plaquetária por aférese (plasma, dia de armazenamento 7) (CD41 em ciano) misturada na proporção de 1:10 com sangue citrato pré-incubado com 0,8 μM de Ticagrelor por 30 min (CD41 em vermelho). (B) Curvas de intensidade de fluorescência média normalizadas representativas da amostra de sangue do receptor que recebeu unidade de plaquetas por aférese (dia de armazenamento 5) ou sangue total fresco autólogo (proporção de 1:10) junto com a cinética plaquetária do receptor ao longo do tempo. O sangue citrato do receptor foi pré-incubado com 0,8 μM de Ticagrelor por 30 minutos antes de ser misturado com hemoderivados. (C) Imagem representativa da pilha z de um dispositivo modificado colado a uma lamínula para microscopia confocal. O produto plaquetário por aférese foi misturado com uma amostra de sangue trombocitopênico na proporção volumétrica de 1:5 (produto:sangue), além de um anticorpo do fator de von Willebrand (1:600). Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Código Matlab para análise de imagem. Clique aqui para baixar este arquivo.
Figura Suplementar S1: Agregometria de impedância de sangue total dependência do tempo de inibição de P2Y12 com Ticagrelor. A incubação por 30 min resulta em uma relação dose-resposta mais pronunciada em comparação com 5 min. As soluções veiculares e medicamentosas foram utilizadas a 0,1% v/v. Os pontos de dados individuais representam réplicas biológicas e a média ± desvio padrão é mostrada. Abreviaturas: AUC = área sob a curva; HP-β-CD = 2-hidroxipropil-β-ciclodextrina. Clique aqui para baixar este arquivo.
Figura suplementar S2: Inibição P2Y12 dependente do tempo com Ticagrelor em um modelo microfluídico da função plaquetária. Curvas representativas de MFI e valores de área sob a curva para réplicas técnicas de um doador saudável individual são mostradas com etanol veículo (1% v/v) utilizado para solubilidade do medicamento. Abreviaturas: MFI = intensidade média de fluorescência; AUC = área sob a curva. Clique aqui para baixar este arquivo.
Discussão
O protocolo acima tem algumas etapas críticas para garantir a confiabilidade e reprodutibilidade dos experimentos. Primeiro, os anticorpos fluorescentes devem ser cuidadosamente considerados. Os anticorpos usados para detectar plaquetas na amostra não devem bloquear a função do receptor plaquetário da glicoproteína Ib (GPIb). A correspondência de lotes, sempre que possível entre os experimentos, também é fundamental para garantir a reprodutibilidade do sinal fluorescente. Outra etapa crítica neste protocolo é o uso de consumíveis e soluções estéreis e amostras filtradas sempre que possível. A filtragem de amostras de sangue imediatamente antes da experimentação evitará que detritos ou aglomerados de plaquetas maiores que as dimensões do canal bloqueiem o fluxo, que é outro parâmetro crítico a ser mantido consistente entre os experimentos. Além disso, as amostras de sangue devem ser testadas dentro de 4 h após a coleta, conforme descrito na circular de informações para o uso de sangue humano e componentes sanguíneos preparada pela AABB, a Cruz Vermelha Americana, os Centros de Sangue da América e o Programa de Sangue das Forças Armadas, exceto ao testar lesões de armazenamento de hemoderivados.
Modificações podem ser consideradas neste protocolo, como a colagem do PDMS a uma lamínula para microscopia confocal, ilustrada na Figura 3C. Se necessário, antes da imagem, uma solução fixadora pode ser perfundida através dos canais e lavada com PBS para armazenamento antes da imagem. Além disso, embora as dimensões reprodutíveis do canal sejam fundamentais para garantir taxas de cisalhamento conservadas entre as condições, a altura da região estenótica pode ser modificada, mas afetará diretamente o tempo de formação do trombo, mesmo que correspondam às taxas de cisalhamento. Como dimensões maiores do canal exigirão mais tempo para atingir a formação substancial de trombos, será necessário mais volume de amostra. Ao solucionar problemas desse protocolo, uma consideração importante deve ser a estratégia de revestimento. O tipo específico de colágeno, o tempo, a diluição e as condições de armazenamento são fatores que podem afetar a camada superficial. Embora este protocolo tenha sido validado para este reagente de colágeno específico (Tabela de Materiais), alternativas de colágeno que podem aderir de forma confiável à superfície do dispositivo e adesão validada por meio de coloração por imunofluorescência ou outras medidas podem ser consideradas e foram usadas anteriormente por outros grupos com sucesso24.
Uma limitação potencial desse protocolo é a falta de resposta endotelial direta. No entanto, estratégias e modificações de revestimento podem ser feitas para incluir testes de função plaquetária em resposta a danos endoteliais. Por exemplo, fatores inflamatórios que as células endoteliais secretam em resposta à lesão podem ser modificados na estratégia de revestimento deste protocolo ou adicionados exogenamente à amostra de sangue testada. A adição desses fatores sem as complexidades da celularização permitiria uma abordagem direcionada para examinar os efeitos da endoteliopatia na função plaquetária. Da mesma forma, o plasma do paciente de doenças ou estados de controle saudáveis pode ser inserido no sistema para testar o impacto dos mediadores solúveis no plasma na função plaquetária.
O estudo da função plaquetária em fluxo seguindo este protocolo pode facilitar o estudo da coagulopatia induzida por trauma e abordagens de medicina transfusional no trauma. O teste da função plaquetária atual geralmente é super-potencializado ou subpotencializado para ver uma resposta disfuncional em um paciente com trauma. Esse método permite flexibilidade e modificações de design para observar a função plaquetária em amostras de pacientes traumatizados, mesmo com restrições de volume, além da simulação da disfunção plaquetária para avaliar intervenções terapêuticas. Além do paciente com trauma, esse método pode ser considerado para pacientes com hemorragia pós-parto, pacientes de cirurgia cardíaca ou pacientes com câncer para avaliar a funcionalidade plaquetária e possíveis intervenções terapêuticas. É importante ressaltar que este método incorpora a dinâmica de fluxo que é de importância crítica para os mecanismos de formação do tampão plaquetário e função hemostática.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Os autores reconhecem e agradecem a todos os doadores de sangue que participaram, bem como aos flebotomistas do Laboratório de Pesquisa em Medicina Transfusional e Trauma e ao Centro de Pesquisa Clínica e Translacional UPMC Montefiore pela assistência nas coletas. O SMS é suportado pelo K25HL161401. O MDN é suportado por 1R01HL166944-01A1.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
Referências
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112(2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509(2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502(2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62(2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados