Method Article
Имплантация осмотического мини-насоса для повышения концентрации глюкозы в спинномозговой жидкости мыши
В этой статье
Резюме
В этой статье описан подробный протокол повышения концентрации глюкозы в спинномозговой жидкости (СМЖ) мышей. Этот подход может быть полезен для изучения влияния высокого уровня глюкозы в спинномозговой жидкости на нейродегенерацию, когнитивные функции и периферический метаболизм глюкозы у мышей.
Аннотация
Диабет увеличивает риск снижения когнитивных функций и ухудшает работу мозга. Является ли эта связь между высоким уровнем глюкозы и когнитивным дефицитом причинно-следственной, остается неуловимым. Более того, также неясно, опосредованы ли эти дефициты повышением уровня глюкозы в спинномозговой жидкости (СМЖ) и/или крови. Существует очень мало исследований, изучающих прямое влияние высокого уровня глюкозы в спинномозговой жидкости на функцию центральной нервной системы (ЦНС), особенно на обучение и память, поскольку современные модели диабета недостаточно развиты для решения таких исследовательских вопросов. В этой статье описывается метод хронического повышения уровня глюкозы в спинномозговой жидкости в течение 4 недель путем непрерывного введения глюкозы в боковой желудочек с использованием осмотических мини-насосов у мышей. Протокол был подтвержден путем измерения уровня глюкозы в спинномозговой жидкости. Этот протокол повышал уровень глюкозы в спинномозговой жидкости до ~ 328 мг / дл после инфузии 50% раствора глюкозы при скорости потока 0,25 мкл / ч по сравнению с концентрацией глюкозы в спинномозговой жидкости ~ 56 мг / дл у мышей, получавших искусственную спинномозговую жидкость (ликвор). Кроме того, этот протокол не влиял на уровень глюкозы в крови. Таким образом, этот метод может быть использован для определения прямого влияния высокого уровня глюкозы в спинномозговой жидкости на функцию мозга или конкретный нейронный путь независимо от изменений уровня глюкозы в крови. В целом, подход, описанный здесь, будет способствовать разработке животных моделей для проверки роли высокого уровня глюкозы в спинномозговой жидкости в опосредующих особенностях болезни Альцгеймера и / или других нейродегенеративных расстройств, связанных с диабетом.
Введение
Диабет 1 и 2 типа нарушает функцию мозга 1,2,3. Например, диабет увеличивает риск снижения когнитивных функций и нейродегенеративных расстройств, включая болезнь Альцгеймера 3,4. Кроме того, люди с диабетом имеют дефектное восприятие глюкозы в головном мозге 5,6. Этот дефект способствует патогенезу гипогликемии, связанной с неосведомленностью и недостаточным контррегуляторным ответом на гипогликемию7,8, которая может привести к летальному исходу, если ее не лечить немедленно.
Учитывая, что диабет повышает уровень глюкозы в крови, а также в спинномозговой жидкости (CSF)9, важно определить, способствует ли один или оба этих фактора нарушению функции мозга. Вопрос о том, вызывает ли диабет повреждение головного мозга из-за высокого уровня глюкозы в спинномозговой жидкости отдельно или в сочетании с другими факторами, такими как дефицит инсулина или резистентность к инсулину, также остается открытым. Животные модели диабета 1 и 2 типа демонстрируют снижение когнитивных функций и нейродегенерацию в дополнение к нарушенному энергетическому балансу и периферическому метаболизму глюкозы10,11,12,13. Однако из этих моделей невозможно отделить селективные эффекты высокого уровня глюкозы в спинномозговой жидкости от уровня глюкозы в крови при опосредовании осложнений диабета на функцию мозга.
В этом протоколе описываются методы разработки мышиной модели гипергликорахии для проверки влияния хронически высоких уровней глюкозы в спинномозговой жидкости на функцию мозга, энергетический баланс и гомеостаз глюкозы. Мышиная модель, разработанная с помощью этого метода, представляет собой инструмент для исследований, изучающих этиологическую роль нерегулируемого гомеостаза глюкозы в нервной и поведенческой функции.
Поэтому предложенный подход будет полезен для понимания прямых эффектов повышенного уровня глюкозы в спинномозговой жидкости при различных патофизиологических состояниях.
протокол
Все процедуры на мышах были одобрены Институциональным комитетом по уходу за животными и их использованию в Университете Рочестера и были выполнены в соответствии с рекомендациями Службы общественного здравоохранения США по гуманному уходу и использованию экспериментальных животных. Шестинедельные самцы мышей C57BL / 6J, использованные для этого исследования, были коммерчески получены. Все животные были размещены в группах (по 5 мышей в клетке) в комнате с 12-часовым циклом день/ночь и получили доступ к пище и воде ad libitum. После того, как мышам была имплантирована канюля для вливания глюкозы в боковой желудочек, они были размещены в одном месте, чтобы предотвратить любое повреждение имплантатов от других мышей.
1. Сборка осмотических мининасосов
- Подготовьте искусственную спинномозговую жидкость (aCSF) в соответствии со следующим протоколом. Растворяют NaCl (8,66 г), KCl (0,224 г), CaCl 2,2H 2 O (0,206 г) и MgCl 2,6H 2 O (0,163 г) в 500 мл стерильной воды для приготовления раствора A. Растворяют Na 2 HPO 4,7H 2 O (0,214 г) и 2 PO4. Н2О (0,027 г) в 500 мл стерильной воды для приготовления раствора В. Затем смешайте растворы А и В в соотношении 1:1, чтобы приготовить ликвор.
ПРИМЕЧАНИЕ: Этот состав aCSF не содержит глюкозы. - Чтобы приготовить 50% раствор глюкозы, добавьте 50 г глюкозы к 50 мл ликвора в стакане. Поместите стакан на горячую плиту и доведите температуру суспензии до 60 °C. Смешайте суспензию магнитной мешалкой до полного растворения глюкозы.
- Добавьте ликвор в стакан, чтобы получить окончательный объем 100 мл. Пропустите раствор через пористый фильтр 0,22 мкм, чтобы стерилизовать его.
- Приготовьте 0,9% физиологический раствор (NaCl) и пропустите раствор через фильтр 0,22 мкм.
- Поместите все компоненты мини-насоса и инфузионного набора в стерильный лоток и отрежьте стерильными ножницами трубку от набора для инфузии мозга до 1 дюйма в длину. Держите трубку стерильным гемостатом и надавите на верхнюю часть одного конца канюли. Подсоедините другой конец трубки к верхней стороне модулятора потока. Покройте оба конца трубки небольшим количеством клея для более прочного соединения.
- Прикрепите иглу 27 г к шприцу объемом 1 мл и заполните его либо ликвором, либо раствором глюкозы. Вставьте иглу 27 G в небольшой кусочек трубки. Затем подсоедините трубку к открытому концу модулятора потока и наполните ее соответствующим раствором до тех пор, пока капли раствора не начнут выходить из канюли. Удалите все пузырьки воздуха, попавшие в трубку.
- Чтобы наполнить мини-насос, держите насос в вертикальном положении и вставьте иглу шприца в насос. Заполняйте его соответствующим раствором до тех пор, пока при открытии мини-насоса не начнет образовываться капля раствора.
- Медленно вставьте модулятор потока в насос, следя за тем, чтобы в узел не попадали пузырьки воздуха.
- После того, как осмотический мини-насос собран, перенесите их в коническую трубку объемом 50 мл. Заполните пробирку стерильным физиологическим раствором так, чтобы насосы были полностью погружены в воду, следя за тем, чтобы канюля не попадала в физиологический раствор. Четыре таких насоса в сборе могут быть размещены в одной трубке объемом 50 мл.
- Неплотно наденьте крышку на каждую трубку и инкубируйте насосы при 37 °C для заправки в течение не менее 48 часов.
2. Операция по имплантации осмотических насосов
- Предоперационная процедура
- Стерилизуйте хирургические инструменты в автоклаве и дайте им остыть не менее 30 минут перед использованием. Условия автоклава включают стерилизацию паром при 121 °C в течение 30 минут.
- Продезинфицируйте операционную область 70% этанолом. Протрите ручки, амбушюры и поверхность стереотаксической оправы.
ПРИМЕЧАНИЕ: Хирургическое вмешательство следует проводить в асептической среде, не допуская прикосновения к нестерильным поверхностям во время операции. Замените перчатки, если есть подозрение на загрязнение. - Поместите мышь в анестезиологическую камеру, чтобы обезболить ее 3% изофлураном, смешанным с воздухом, в течение 3-5 минут. Затем извлеките мышь из камеры и поместите ее на стерильную драпировку. Поддерживайте анестезию через носовой колбочку на уровне 1,5%-2%.
- Ущипните мышь за заднюю лапу, чтобы соблюсти какой-либо рефлекс и проверить глубину анестезии.
- Вводят 5 мг/кг карпрофена подкожно для обезболивания.
- Используйте чистые машинки для стрижки, чтобы закрепить операционную область на голове мыши. Протрите кожу головы сначала раствором повидон-йода, а затем спиртовыми тампонами в течение не менее 2 минут. Повторите этот процесс не менее трех раз.
- Нанесите смазку для глаз, чтобы предотвратить высыхание глаз во время операции.
- Хирургия
- Поместите мышь на стереотаксическую рамку и установите голову на резц. Прикройте нос носовым конусом. Наложите стерильные простыни, чтобы обезопасить операционную область.
- Сместите поток изофлурана к носовому конусу. Продолжайте поддерживать анестезию на уровне 1,5%-2% изофлурана.
- Подложите под мышь грелку, чтобы поддерживать температуру тела.
- Наденьте новые стерильные перчатки и скальпелем сделайте разрез по средней линии (~10-15 мм длиной) на коже головы. Обнажьте поверхность черепа шпателем, используя ватные наконечники, чтобы вытереть кровотечение.
ПРИМЕЧАНИЕ: Используйте прижигатель при обильном кровотечении, что бывает редко. - Потрите ватным кончиком, смоченным в 3% перекиси водорода, чтобы обнажить черепные швы.
- Обратите внимание на брегму и лямбду, чтобы ориентироваться в координатах черепа. Установите все координаты равными нулю в bregma.
ПРИМЕЧАНИЕ: Эти координаты были получены из атласа мозгамыши 14. Эталонное расстояние брегма-лямбда в атласе составляет 4,21 мм. Чтобы скорректировать возрастные и половые различия в размере черепа, расстояние брегма-лямбда для каждой мыши было измерено, а затем разделено на 4,21 мм для получения коэффициента умножения. Например, если расстояние между брегмой и лямбдой составляло 4,65 мм, то деление на 4,21 мм давало коэффициент умножения 1,10. Все координаты, полученные из атласа, затем были умножены на этот коэффициент, чтобы измерить фактические координаты, которые использовались для бурения скважины. В приведенном выше примере результирующие передне-задние (AP) и медиально-латеральные (ML) координаты будут составлять 0,55 и 1,1 мм соответственно (т.е. 1,1 x 0,5 или 1 мм). - Используйте электрическую дрель, чтобы сделать отверстие в следующих координатах: 0,5 мм кзади от брегмы и 1 мм сбоку от средней линии справа.
ПРИМЕЧАНИЕ: Сверля отверстие в черепе, будьте осторожны, чтобы не разорвать твердую мозговую оболочку. Убедитесь, что сверло стерильно. Его можно поместить вместе с другими инструментами в тот же мешочек автоклава для стерилизации. - Вставьте гемостат под надрезанную кожу и прижмите его к месту, куда будет имплантирован осмотический мини-насос. Аккуратно открывайте и закрывайте гемостат, чтобы получился карман для мини-насоса.
- Используйте стерильный гемостат, чтобы выбрать заправленный осмотический мини-насос с наконечника модулятора потока. Протолкните насос через надрезанную кожу в карман.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы насос и канюля не касались нестерильной поверхности. - Нанесите немного клея на нижнюю сторону канюли и закрепите ее в держателе канюли. Медленно опустите канюлю через просверленное отверстие 2 мм вентрально к поверхности черепа. Оставьте его там минимум на 5 минут, чтобы клей затвердел.
- Прежде чем вставлять канюлю в мозг, убедитесь, что канюля не забита и что раствор течет правильно.
ПРИМЕЧАНИЕ: Иногда глюкоза может осаждаться на кончике канюли из-за очень низкой скорости потока, блокируя поток. - С помощью ножниц обрежьте верхнюю часть канюли, следя за тем, чтобы она не смещалась с поверхности черепа.
- Покройте канюлю слоем стоматологического цемента для дополнительной поддержки.
- Используйте нейлоновые швы (размер 5-0 и длина 30 дюймов), чтобы закрыть рану, и нанесите на рану местный антибиотик, чтобы предотвратить инфекцию.
- Выключите изофлуран и дайте животному восстановиться после анестезии. Затем переведите животное в новую чистую клетку.
- Послеоперационный уход
- После операции наблюдайте за мышью не менее 1 недели.
- Вводите 5 мг / кг карпрофена подкожно один раз каждые 24 часа в течение трех дней после операции.
- Дайте ране полностью зажить перед снятием швов через 7-10 дней после операции.
ПРИМЕЧАНИЕ: Было замечено, что мышам с высоким уровнем глюкозы в спинномозговой жидкости требовалось больше времени для заживления. Обрезка когтей на задних лапах мыши сводит к минимуму вероятность травмы места разреза из-за царапающего поведения мышей.
3. Замена мини-насосов
ПРИМЕЧАНИЕ: Поскольку мини-насосы, используемые в этом исследовании, работают только в течение 4 недель, замена мини-насосов также была протестирована для увеличения продолжительности инфузии глюкозы, поскольку это может потребоваться в случае долгосрочных исследований. Для этого были предприняты следующие шаги.
- Подготовьте мышей к операции, как описано выше.
- Сделайте небольшой вертикальный разрез в 1 см на коже немного выше помпы.
- Вставьте гемостат под надрезанную кожу и вытащите насос.
- Снимите насос с трубки и подсоедините новый заправленный насос к трубке.
- Вставьте помпу обратно внутрь и сшите кожу.
- Следуйте тем же инструкциям по послеоперационному уходу, которые описаны выше.
4. Порядок сбора спинномозговой жидкости
- Подготовка
- Вытяните стеклянные капилляры диаметром 1 мм с помощью съёмника микропипеток, чтобы получить наконечники диаметром 0.5 мм. Настройки: тепло = 800, тяга = 15, скорость = 5 и время = 200 единиц. Поместите вытянутые капилляры в стерильную коробку до использования.
- Прикрепите иглу 27 г к шприцу объемом 1 мл. Вставьте натянутый капилляр на иглу и используйте небольшую клейкую ленту, чтобы закрепить соединение.
- Прочно зафиксируйте шприц в капилляродержателе микроманипулятора.
- Затем подготовьте мышь к операции, как описано в предоперационной процедуре выше.
- Хирургическое вмешательство
- Поместите мышь на стереотаксическую рамку. После фиксации головы на раме, как описано ранее, поверните ручки, чтобы наклонить голову так, чтобы нос был обращен вниз. Наложите стерильные простыни, чтобы обезопасить операционную область.
- Сделайте небольшой разрез на дорсальной поверхности, начиная от внутрислуховой плоскости к каудальной стороне.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не повредить трубку во время разреза. - Снимите опору с тела мыши и дайте мыши отдохнуть вертикально, чтобы шея была полностью вытянута дорсально.
- С помощью изогнутых тупых щипцов аккуратно разделите пополам задние мышцы шеи от средней линии, чтобы создать небольшое окошко. Затем используйте влажный аппликатор с ватным наконечником, чтобы аккуратно переместить мышцы шеи от средней линии к периферии.
- Обратите внимание, обнажается ли большая цистерна, которая выглядит как треугольное окно с прозрачной мембраной твердой мозговой оболочки.
- Поместите узел микроманипулятора на стереотаксическую рамку рядом с мышью, убедившись, что наконечник капилляра не касается какой-либо поверхности.
- Аккуратно разорвите наконечник капилляра, не нарушая настройку.
- Глядя в увеличительное стекло (увеличение 2,25x), поверните соответствующие ручки на микроманипуляторе, чтобы медленно выровнять и переместить наконечник капилляра к большой цистерне.
- Некоторое сопротивление ощущается, когда наконечник капилляра касается большой мембраны цистерны. Очень медленно прижмите наконечник к мембране с помощью ручек.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не повредить кровеносные сосуды в мембране. Этот шаг очень важен, чтобы избежать загрязнения крови в спинномозговой жидкости. - Очень аккуратно прокалывают мембрану. Спинномозговая жидкость сразу начнет поступать в капилляр из-за отрицательного давления в капилляре.
- Оставьте установку на несколько минут, пока ~ 10 мкл спинномозговой жидкости не соберется в капилляре.
- Затем медленно вытяните капилляр из большой цистерны и осторожно прижмите стерильный аппликатор с ватным наконечником к отверстию большой цистерны, чтобы остановить утечку спинномозговой жидкости.
- Осторожно извлеките капилляр из шприца и приложите его к дозатору колбы с микроколпачком. Нажмите на колбу, чтобы перенести спинномозговую жидкость в стерильную микроцентрифужную пробирку.
- Подложите под мышь опору и вращайте стереотаксические ручки, чтобы выровнять голову.
- Закройте рану капроновыми швами.
- Введите 300 мкл стерильного физиологического раствора подкожно, прежде чем извлекать мышь из аппарата.
- Обеспечьте послеоперационный уход за животными, как описано выше, до тех пор, пока не придет время снимать швы - ~ 7-10 дней после операции.
5. Анализ глюкозы
- Следуйте протоколу, описанному в наборе для колориметрического анализа глюкозы.
- Разбавьте буферный раствор фосфата натрия, входящий в комплект, до концентрации 50 мМ в сверхчистой воде.
- Приготовьте стандарты глюкозы в 0, 2,5, 5, 7,5, 10, 15, 20, 25 и 50 мг / дл в диапазоне от исходного раствора 1000 мг / дл, предоставленного в наборе, в разбавленном буферном растворе.
- Приготовьте 7-кратное разведение образцов ликвора в буфере. Например, если общий объем собранной спинномозговой жидкости составляет 10 мкл, то семикратный разбавленный объем составит 70 мкл.
- Пипетка 15 мкл стандартов глюкозы и разведенный ликвор в двух экземплярах в 96-луночном планшете.
- Пипетка 85 мкл разбавленного буфера в каждую из лунок со стандартами и ликвором.
- Добавьте 6 мл разбавленного буфера во флакон со смесью калориметрических ферментов глюкозы и перемешивайте его в течение нескольких секунд, чтобы тщательно перемешать.
- Добавьте по 100 мкл препарата ферментной смеси в каждую лунку, чтобы начать реакцию.
- Запечатайте пластину покровным листом и аккуратно постучите по пластине, чтобы перемешать реагенты.
- Поместите планшет в инкубатор при температуре 37 °C на 10 минут. Флаконы с высоким содержанием глюкозы сразу же начинают окрашиваться в фиолетовый цвет.
- Через 10 минут снимите крышку и измерьте коэффициент поглощения на длине волны 500-520 нм с помощью считывателя пластин.
- Рассчитайте концентрацию глюкозы в образцах ликвора, интерполируя их значения со стандартной кривой.
6. Анализ глюкозы в крови
- Сделайте небольшую боковую зазубрину к хвосту мыши с помощью лезвия бритвы и используйте каплю крови для измерения уровня глюкозы в крови глюкометром, согласно инструкции по эксплуатации.
Результаты
Самцам мышей имплантировали канюлю, собранную в осмотической мини-помпе (рис. 1), для хронической инфузии спинномозговой жидкости или 50% раствора глюкозы в боковые желудочки (рис. 2). Спинномозговая жидкость была собрана через 10 дней после операции (рис. 3) для подтверждения эффективности этой процедуры. Результаты показали увеличение уровня глюкозы в спинномозговой жидкости (в среднем: 327,7 мг / дл) у мышей, которым вводили 50% глюкозы, по сравнению с (в среднем: 56,5 мг / дл) у мышей, которым вводили ликвор. Это примерно шестикратное увеличение уровня глюкозы в спинномозговой жидкости у экспериментальных мышей по сравнению с их контрольными однопометниками (рис. 4А). Уровни глюкозы в крови не различались между группами (рис. 4B).
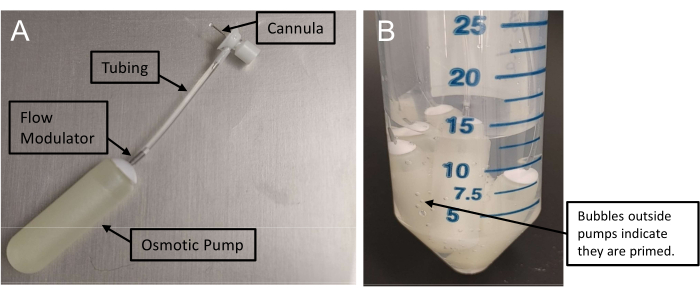
Рисунок 1: Сборка осмотических мининасосов . (A) Инфузионный узел с канюлей, соединенной с мини-насосом через трубку. Для заправки этих насосов требуется не менее 48 часов. (B) Наличие пузырьков воздуха снаружи мини-насосов подтверждает заправку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Стереотаксическая аппаратура и аксессуары . (А, Б) Стереотаксическое оборудование с прикрепленным микроманипулятором и другими аксессуарами. (C) Координаты отверстия для заусенцев для вставки канюли. (D) Имплантация осмотического мини-насоса, (E, F) Введение канюли в просверленное отверстие. Поддерживайте асептические условия на протяжении всей операции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Процедура сбора спинномозговой жидкости (СМЖ). (А) Спинные мышцы шеи были аккуратно смещены тупыми щипцами, чтобы обнажить большую цистерну. Капилляр диаметром 1 мм с наконечником диаметром 0,5 мм использовался для разрыва (B) и (C, D) сбора спинномозговой жидкости из большой цистерны. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
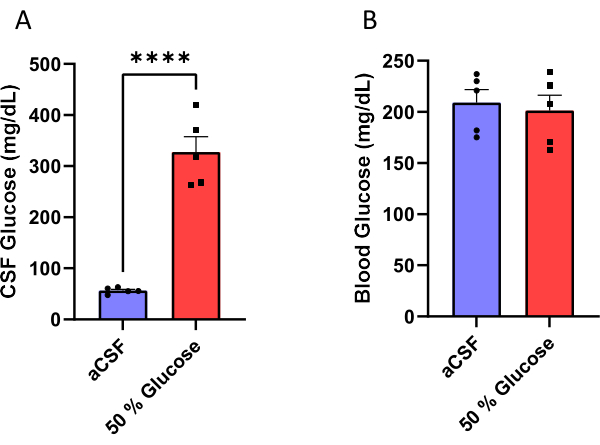
Рисунок 4: Измерение уровня глюкозы. (A) Повышенный уровень глюкозы в спинномозговой жидкости (B) без влияния на уровень глюкозы в крови натощак у мышей, которым вводили 50% раствор глюкозы в боковой желудочек. Эффективность этого протокола была подтверждена путем измерения концентрации спинномозговой жидкости и глюкозы в крови через 10 дней после начала инфузии глюкозы. У мышей, которым вводили 50% раствор глюкозы, уровень глюкозы в спинномозговой жидкости составлял 327,7 ± 30,1 мг/дл (среднее значение ± стандартной ошибки) по сравнению с мышами, получавшими искусственную инфузию спинномозговой жидкости, у которых уровень глюкозы составлял 56,5 ± 2,6 мг/дл. p < 0,0001, непарный t-критерий. Столбцы погрешности представляют собой стандартную среднюю ошибку (n = 5). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этой статье представлен подробный протокол повышения уровня глюкозы в спинномозговой жидкости у мышей с помощью осмотических мини-насосов, подключенных к канюле, имплантированной в боковой желудочек. Хроническая инфузия глюкозы в мозг мыши с помощью этой процедуры будет полезна для определения влияния длительной гипергликорахии на когнитивные функции, системный метаболизм глюкозы и энергетический баланс, а также для лучшего понимания патогенеза осложнений диабета.
Хронический диабет вызывает повреждение головного мозга, которое прерывает связь между мозгом и периферическими органами15. Диабет также увеличивает риск нейродегенеративных заболеваний, включая болезнь Альцгеймера 3,4. Диабет 1 типа, индуцированный стрептозотоцином (STZ), был стандартной моделью грызунов в исследованиях диабета16; STZ повреждает β-клетки поджелудочной железы, что приводит к диабетоподобной патологии 1 типа. Кроме того, в модифицированном варианте использование STZ в сопровождении никотинамидов может вызвать диабет 2 типа. Другим способом развития диабетоподобных фенотипов 2 типа у животных является кормление их диетой с высоким содержанием жиров16. Однако в контексте изучения влияния гипергликемии на функцию мозга эти методы ограничены в контроле большого количества факторов (например, периферических уровней инсулина / глюкагона и метаболической функции в целом). Таким образом, любое влияние STZ-индуцированного диабета на функцию мозга может быть интерпретировано только как ассоциированное осложнение, а не как определение одного этиологического фактора. Острая инъекция или хроническая инфузия веществ в церебровентрикулярном пространстве - это метод, часто используемый для проверки их прямого воздействия на функцию мозга. Внутримозговая инъекция STZ (ICV) была использована для разработки модели болезни Альцгеймера на грызунах, однако остается неясным, связано ли нейронное повреждение, связанное с STZ, нарушением регуляции при восприятии глюкозы / гомеостазе или другими независимыми механизмами, такими как STZ-индуцированный окислительный стресс и повреждение ДНК17.
Процедуры, описанные в текущем протоколе, будут полезны при разработке моделей грызунов, которые могут ответить на исследовательские вопросы, например, может ли увеличение концентрации глюкозы в спинномозговой жидкости вызвать когнитивные нарушения. Описанный здесь протокол может быть использован для определения прямого воздействия высоких уровней глюкозы в спинномозговой жидкости на гипоталамус и гиппокамп, а также на другие области мозга, участвующие в восприятии питательных веществ, метаболизме и/или познании. Этот метод также проясняет, влияет ли повышение уровня глюкозы в спинномозговой жидкости на чувствительность к инсулину, секрецию инсулина, потребление пищи и / или энергетический баланс на исходном уровне и в ответ на метаболические нарушения. Более того, протокол, представленный здесь, будет применим при проверке гипотез, требующих лонгитюдных исследований. Например, данные могут быть собраны до, во время и в конце инфузий глюкозы для сравнения результатов от одних и тех же животных в разное время. Такая стратегия будет направлена на решение вопроса о том, являются ли осложнения, возникающие из-за высокого уровня глюкозы в спинномозговой жидкости, обратимыми после восстановления нормального уровня глюкозы в спинномозговой жидкости. Напротив, этот метод также может быть использован для исследований, генерирующих гипотезы. Например, спинномозговая жидкость может быть собрана у одних и тех же животных в разное время и подвергнута метаболомному или протеомному анализу для идентификации биомаркеров или любых метаболических нарушений, вызванных высоким уровнем глюкозы в спинномозговой жидкости. Точно так же различные области мозга могут быть проанализированы с помощью пространственной транскриптомики, чтобы получить клеточную информацию, которая могла быть изменена высоким уровнем глюкозы в спинномозговой жидкости.
Обоснование введения безглюкозного aCSF в фиктивную группу состояло в том, чтобы поддерживать концентрацию глюкозы в спинномозговой жидкости на исходном уровне, чтобы можно было естественным образом контролировать любое изменение уровня глюкозы в спинномозговой жидкости, вызванное имплантацией канюли. Результаты этого исследования показали, что фиктивная группа имела концентрацию глюкозы в спинномозговой жидкости ~ 60 мг / дл (~ 3 мМ), что находится в нормальном диапазоне глюкозы спинномозговой жидкости у мышей18. Уровни глюкозы в спинномозговой жидкости, наблюдаемые у людей с диабетом 2 типа, составляют ~ 110 мг / дл или ~ 6мМ 9. В текущем исследовании инфузия ICV 50% глюкозы со скоростью 125 мкг / ч повысила уровень глюкозы в спинномозговой жидкости до ~ 300 мг / дл (16 мМ), что является супрафизиологическим19. Хотя этот супрафизиологический уровень глюкозы в спинномозговой жидкости может быть клинически не связан с уровнями, наблюдаемыми у людей с диабетом 2 типа, результаты, представленные в этом исследовании, показывают, что инфузия глюкозы в спинномозговой жидкости может вызвать хроническое повышение концентрации глюкозы в спинномозговой жидкости у мышей.
Представленный здесь метод имеет некоторые ограничения. Он включает в себя сложную операцию на головном мозге мыши, которая требует соответствующей подготовки, навыков и опыта в выполнении таких сложных процедур. Поскольку катетер и мини-насосы имплантируются в течение длительного времени, необходим тщательный уход за мышами на протяжении всего исследования для мониторинга проблем со здоровьем или повреждения узла катетера. Концентрация глюкозы 50% была выбрана потому, что вязкость раствора сверх этой концентрации могла повлиять на инфузию глюкозы в желудочки. Мини-насосы, используемые в этом протоколе, имели скорость потока 0,25 мкл / ч, поэтому группа мышей с 50% инфузией глюкозы получала глюкозу со скоростью 125 мкг / ч, или 3 мг глюкозы в день. Таким образом, эта доза глюкозы в единицу времени была ограничена расходом мини-насосов.
Таким образом, в этой статье сообщается о проверенном методе хронического повышения уровня глюкозы в спинномозговой жидкости у мышей. Информация, полученная с помощью этой модели, будет полезна для определения того, участвует ли повышение уровня глюкозы в спинномозговой жидкости в опосредовании осложнений, связанных с диабетом, таких как нейродегенеративные расстройства, или вызывает периферические метаболические нарушения при диабете и ожирении.
Устранение неполадок
Если трубка отрывается от канюли у мышей, при сборке мини-насоса можно нанести небольшое количество клея на соединение канюли-трубки. Если швы сняты и канюля становится видимой, область разреза может быть полностью закрыта с помощью швов или скоб. Когти с задних лап мыши должны быть подстрижены, чтобы была меньшая вероятность поцарапать область операции мышью. Кроме того, будьте осторожны, чтобы не завязать швы так туго, что кожа порвется, так как у мышей нежная кожа.
Для быстрого восстановления после забора спинномозговой жидкости рекомендуется инъекция 300 мкл стерильного физиологического раствора подкожно после операции. Кроме того, важно поддерживать максимальный объем сбора спинномозговой жидкости на уровне 10 мкл.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Грант Национального института здравоохранения DK124619 для KHC.
Стартовые фонды и награда за пилотные исследования, медицинский факультет Рочестерского университета, штат Нью-Йорк, в KHC.
Премия Института неврологии Дель Монте за пилотные исследования, Университет Рочестера, KHC.
Университетская исследовательская премия, офис вице-президента по исследованиям, Университет Рочестера, штат Нью-Йорк, в KHC.
МУР разработал и выполнил метод, проанализировал результаты, подготовил графики и рисунки, написал и отредактировал рукопись. KHC задумал и руководил исследованием, проанализировал результаты, написал и отредактировал рукопись. КХК является гарантом этой работы. Все авторы одобрили окончательный вариант рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Membrane solutions | SFPES030022S | |
| 1 mL sterile Syringe (Luer-lok tip) | BD | 309628 | |
| 1 mL TB syringe | BD | 309659 | |
| 100 mL Glass beaker | Fisher | N/a | |
| 100% Ethanol (Koptec) | DLI | UN170 | Use 70% dilution to clean the surgery area |
| 50 mL conical tube | Fisher | N/A | |
| Allignment indicator | KOPF | 1905 | |
| Alzet brain infusion kit | DURECT | Kit # 3; 0008851 | Cut tubing in the kit to 1 inch length |
| Alzet osmotic pump | DURECT | 2004 | Flow rate 0.25 µL/h |
| Anesthesia system | Kent Scientific | SomnoSuite | |
| Betadine solution | Avrio Health | N/A | |
| CaCl2 . 2H2O | Fisher | C79-500 | |
| Cannula holder | KOPF | 1966 | |
| Centering scope | KOPF | 1915 | |
| Dental Cement Liquid | Lang Dental | REF1404 | |
| Dental cement Powder | Lang Dental | REF1220-C | |
| D-glucose | Sigma | G8270 | |
| Electric drill | KOPF | 1911 | While drilling a hole avoid rupturing dura mater |
| Eye lubricant (Optixcare) | CLC Medica | N/A | |
| Glass Bead sterilizer (Germinator 500) | VWR | 101326-488 | Place instruments in sterile water to let them cool before surgery |
| Glucose Assay Kit | Cayman chemical | 10009582 | |
| H2O2 | Sigma | H1009-500ml | Apply 3% H2O2 on skull surface to make the cranial sutures visible. |
| Hair Clipper | WAHL | N/A | |
| heating pad | Heatpax | 19520483 | |
| Hemostat | N/A | N/A | |
| Isoflurane (Fluriso) | Zoetis | NDC1385-046-60 | |
| KCl | VWR | 0395-500g | |
| Magnetic stand | WPI | M1 | |
| Magnifying desk lamp | Brightech | LightView Pro Flex 2 | |
| Metal Spatula | N/A | N/A | |
| MgCl2 . 6H2O | Fisher | BP214-500 | |
| Micromanipulator (Right handed) | WPI | M3301R | |
| Micromanipulator with digital display | KOPF | 1940 | |
| Na2HPO4 . 7H2O | Fisher | S373-500 | |
| NaCl | Sigma | S7653-5Kg | |
| NaH2PO4 . H2O | Fisher | S369-500 | |
| Neosporin | Johnson & Johnson | N/A | Apply topical oinment to prevent infection |
| Parafilm | Bemis | DM-999 | |
| Rimadyl (Carprofen) 50mg/ml | Zoetis | N/A | 5 mg/kg, subcutaneous, for analgesia |
| Scalpel | N/A | N/A | |
| Stereotaxic allignment system | KOPF | 1900 | |
| Sterile 27 gauge needle | BD | 305109 | |
| Sterile cotton tip applicators (Solon) | AMD Medicom | 56200 | |
| Sterile nylon sutures (5.0) | Oasis | MV-661 | Use non-absorable suture for closing the wound |
| Sterile sharp scissors | N/A | N/A | |
| Sterile surgical blades | VWR | 55411-050 | |
| Surgical gloves (Nitrile) | Ammex | N/A | Change gloves if there is suspision of contamination |
| Tray | N/A | N/A |
Ссылки
- Moheet, A., Mangia, S., Seaquist, E. R. Impact of diabetes on cognitive function and brain structure. Annals of the New York Academy of Sciences. 1353, 60-71 (2015).
- Takeda, S., et al. Diabetes-accelerated memory dysfunction via cerebrovascular inflammation and Abeta deposition in an Alzheimer mouse model with diabetes. Proceedings of the National Academy of Sciences. 107 (15), 7036-7041 (2010).
- Arvanitakis, Z., Wilson, R. S., Bienias, J. L., Evans, D. A., Bennett, D. A. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function. Archives of Neurology. 61 (5), 661-666 (2004).
- Zilliox, L. A., Chadrasekaran, K., Kwan, J. Y., Russell, J. W. Diabetes and cognitive impairment. Current Diabetes Reports. 16 (9), 87(2016).
- Reno, C. M., Litvin, M., Clark, A. L., Fisher, S. J. Defective counterregulation and hypoglycemia unawareness in diabetes: mechanisms and emerging treatments. Endocrinology and Metabolism Clinics of North America. 42 (1), 15-38 (2013).
- Cryer, P. E., Davis, S. N., Shamoon, H. Hypoglycemia in diabetes. Diabetes Care. 26 (6), 1902-1912 (2003).
- Hwang, J. J., et al. Hypoglycemia unawareness in type 1 diabetes suppresses brain responses to hypoglycemia. The Journal of Clinical Investigation. 128 (4), 1485-1495 (2018).
- Cryer, P. E., Gerich, J. E. Glucose counterregulation, hypoglycemia, and intensive insulin therapy in diabetes mellitus. The New England Journal of Medicine. 313 (4), 232-241 (1985).
- Tigchelaar, C., et al. Elevated cerebrospinal fluid glucose levels and diabetes mellitus are associated with activation of the neurotoxic polyol pathway. Diabetologia. 65 (7), 1098-1107 (2022).
- Zheng, H., et al. Cognitive decline in type 2 diabetic db/db mice may be associated with brain region-specific metabolic disorders. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (1), 266-273 (2017).
- Ernst, A., et al. Diabetic db/db mice exhibit central nervous system and peripheral molecular alterations as seen in neurological disorders. Translational Psychiatry. 3 (5), 263(2013).
- Wang, Y., Yang, Y., Liu, Y., Guo, A., Zhang, Y. Cognitive impairments in type 1 diabetes mellitus model mice are associated with synaptic protein disorders. Neuroscience Letters. 777, 136587(2022).
- Jolivalt, C. G., et al. Type 1 diabetes exaggerates features of Alzheimer's disease in APP transgenic mice. Experimental Neurology. 223 (2), 422-431 (2010).
- Paxinos, G., Franklin, K. B. J. Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , Academic Press. (2019).
- Vinik, A. I., Maser, R. E., Mitchell, B. D., Freeman, R. Diabetic autonomic neuropathy. Diabetes Care. 26 (5), 1553-1579 (2003).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), 78(2021).
- Grieb, P. Intracerebroventricular streptozotocin injections as a model of Alzheimer's disease: in search of a relevant mechanism. Molecular Neurobiology. 53 (3), 1741-1752 (2016).
- Kealy, J., et al. Acute inflammation alters brain energy metabolism in mice and humans: role in suppressed spontaneous activity, impaired cognition, and delirium. The Journal of Neuroscience. 40 (29), 5681-5696 (2020).
- Dougherty, J. M., Roth, R. M. Cerebral spinal fluid. Emergency Medicine Clinics of North America. 4 (2), 281-297 (1986).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены