Method Article
Osmotische Minipump-Implantation zur Erhöhung der Glukosekonzentration im Liquor der Maus
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt ein detailliertes Protokoll zur Erhöhung der Glukosekonzentration im Liquor cerebrospinalis (CSF) von Mäusen. Dieser Ansatz kann nützlich sein, um die Auswirkungen einer hohen Liquorglukose auf die Neurodegeneration, die Kognition und den peripheren Glukosestoffwechsel bei Mäusen zu untersuchen.
Zusammenfassung
Diabetes erhöht das Risiko eines kognitiven Verfalls und beeinträchtigt die Gehirnfunktion. Ob dieser Zusammenhang zwischen hohem Glukosespiegel und kognitiven Defiziten ursächlich ist oder nicht, bleibt unklar. Darüber hinaus ist auch unklar, ob diese Defizite durch einen Anstieg des Glukosespiegels im Liquor und/oder Blut vermittelt werden. Es gibt nur sehr wenige Studien, die die direkten Auswirkungen eines hohen Liquorglukosespiegels auf die Funktion des zentralen Nervensystems (ZNS), insbesondere auf das Lernen und das Gedächtnis, untersuchen, da die aktuellen Diabetesmodelle nicht ausreichend entwickelt sind, um solche Forschungsfragen zu beantworten. Dieser Artikel beschreibt eine Methode zur chronischen Erhöhung des Liquorglukosespiegels für 4 Wochen durch kontinuierliche Infundierung von Glukose in den Seitenventrikel mit osmotischen Minipumpen bei Mäusen. Das Protokoll wurde durch die Messung des Glukosespiegels im Liquor validiert. Dieses Protokoll erhöhte den Liquorglukosespiegel auf ~328 mg/dl nach Infusion einer 50%igen Glukoselösung bei einer Flussrate von 0,25 μl/h, verglichen mit einer Liquorglukosekonzentration von ~56 mg/dl bei Mäusen, die künstliche Zerebrospinalflüssigkeit (aCSF) erhielten. Darüber hinaus hatte dieses Protokoll keinen Einfluss auf den Blutzuckerspiegel. Daher kann diese Methode verwendet werden, um die direkten Auswirkungen einer hohen Liquorglukose auf die Gehirnfunktion oder eine bestimmte Nervenbahn unabhängig von Veränderungen des Blutzuckerspiegels zu bestimmen. Insgesamt wird der hier beschriebene Ansatz die Entwicklung von Tiermodellen erleichtern, um die Rolle einer hohen Liquorglukose bei der Vermittlung von Merkmalen der Alzheimer-Krankheit und/oder anderer neurodegenerativer Erkrankungen im Zusammenhang mit Diabetes zu testen.
Einleitung
Sowohl Typ-1- als auch Typ-2-Diabetes beeinträchtigen die Gehirnfunktion 1,2,3. Zum Beispiel erhöht Diabetes das Risiko für kognitiven Verfall und neurodegenerative Erkrankungen, einschließlich der Alzheimer-Krankheit 3,4. Darüber hinaus haben Menschen mit Diabetes eine gestörte Glukosewahrnehmung im Gehirn 5,6. Dieser Defekt trägt zur Pathogenese der Hypoglykämie-assoziierten Unwissenheit und einer unzureichenden gegenregulatorischen Reaktion auf Hypoglykämie bei7,8, die tödlich sein kann, wenn sie nicht sofort behandelt wird.
In Anbetracht der Tatsache, dass Diabetes den Glukosespiegel sowohl im Blut als auch im Liquor cerebrospinalis (CSF)9 erhöht, ist es wichtig festzustellen, ob einer oder beide dieser Faktoren zu einer Beeinträchtigung der Gehirnfunktion beitragen. Ob Diabetes allein durch einen hohen Liquorglukosespiegel oder in Kombination mit anderen Faktoren wie Insulinmangel oder Insulinresistenz Hirnschäden verursacht, ist ebenfalls eine offene Frage. Tiermodelle für Typ-1- und Typ-2-Diabetes zeigen neben einem gestörten Energiehaushalt und peripheren Glukosestoffwechsel auch kognitiven Verfall und Neurodegeneration10,11,12,13. Aus diesen Modellen ist es jedoch nicht möglich, die selektiven Effekte von hohen Liquorglukose- und Blutzuckerspiegeln bei der Vermittlung der Komplikationen von Diabetes auf die Gehirnfunktion zu entkoppeln.
Dieses Protokoll beschreibt Methoden zur Entwicklung eines Mausmodells für Hyperglykorrhachie, um die Auswirkungen chronisch hoher Liquorglukosespiegel auf die Gehirnfunktion, den Energiehaushalt und die Glukosehomöostase zu testen. Das mit dieser Technik entwickelte Mausmodell stellt ein Werkzeug für Studien dar, die die ätiologische Rolle der dysregulierten Glukosehomöostase auf die neuronale und Verhaltensfunktion untersuchen.
Daher wird der vorgeschlagene Ansatz nützlich sein, um die direkten Auswirkungen erhöhter Liquorglukosespiegel bei verschiedenen pathophysiologischen Bedingungen zu verstehen.
Protokoll
Alle Mausverfahren wurden vom Institutional Animal Care and Use Committee der University of Rochester genehmigt und gemäß den Richtlinien des US Public Health Service für die humane Pflege und Verwendung von Versuchstieren durchgeführt. Sechs Wochen alte männliche C57BL/6J-Mäuse, die für diese Studie verwendet wurden, wurden kommerziell beschafft. Alle Tiere wurden in Gruppen (5 Mäuse pro Käfig) in einem Raum mit einem 12-stündigen Tag-Nacht-Zyklus untergebracht und erhielten ad libitum Zugang zu Futter und Wasser. Nachdem den Mäusen eine Kanüle zur Infusion von Glukose in den Seitenventrikel implantiert worden war, wurden sie einzeln untergebracht, um Schäden an den Implantaten durch andere Mäuse zu vermeiden.
1. Montage osmotischer Minipumpen
- Bereiten Sie künstlichen Liquor cerebrospinalis (aCSF) gemäß dem folgenden Protokoll vor. NaCl (8,66 g), KCl (0,224 g),CaCl 2,2H2O (0,206 g) und MgCl2,6H2O (0,163 g) werden in 500 ml sterilem Wasser gelöst, um Lösung A herzustellen. Na2HPO 4,7H2O (0,214 g) und NaH2PO 4 lösen. H2O(0,027 g) in 500 ml sterilem Wasser zur Herstellung von Lösung B. Mischen Sie dann Lösung A und B im Verhältnis 1:1, um den aCSF herzustellen.
HINWEIS: Diese Formulierung von aCSF enthält keine Glukose. - Zur Herstellung der 50%igen Glukoselösung 50 g Glukose zu 50 ml Liquor in ein Becherglas geben. Stellen Sie das Becherglas auf eine Kochplatte und bringen Sie die Temperatur der Suspension auf 60 °C. Mischen Sie die Suspension mit einem Magnetrührer, bis sich die Glukose vollständig aufgelöst hat.
- Geben Sie aCSF in das Becherglas, um das endgültige Volumen auf 100 ml zu erhöhen. Führen Sie die Lösung durch einen 0,22 μm Porenfilter, um sie zu sterilisieren.
- Bereiten Sie eine 0,9%ige Kochsalzlösung (NaCl) vor und passieren Sie die Lösung durch den 0,22-μm-Filter.
- Legen Sie alle Komponenten der Minipumpe und des Infusionssets in eine sterile Schale und schneiden Sie den Schlauch des Gehirninfusionssets mit einer sterilen Schere auf 1 Zoll Länge. Halten Sie den Schlauch mit einem sterilen Hämostat fest und schieben Sie ihn auf die Oberseite eines Endes der Kanüle. Verbinden Sie das andere Ende des Schlauchs mit der Oberseite des Durchflussmodulators. Bedecke beide Enden des Schlauchs mit etwas Kleber, um eine stärkere Verbindung zu erhalten.
- Befestigen Sie eine 27-g-Nadel an einer 1-ml-Spritze und füllen Sie sie entweder mit aCSF oder der Glukoselösung. Führen Sie die 27-G-Nadel in ein kleines Stück Schlauch ein. Schließen Sie dann den Schlauch an das offene Ende des Durchflussmodulators an und füllen Sie ihn mit der entsprechenden Lösung, bis Tropfen der Lösung aus der Kanüle austreten. Entfernen Sie alle Luftblasen, die im Schlauch eingeschlossen sind.
- Um die Minipumpe zu befüllen, halten Sie die Pumpe aufrecht und führen Sie die Spritzennadel in die Pumpe ein. Füllen Sie es mit der entsprechenden Lösung, bis sich an der Öffnung der Minipumpe ein Tropfen der Lösung bildet.
- Setzen Sie den Durchflussmodulator langsam in die Pumpe ein und achten Sie darauf, dass keine Luftblasen in die Baugruppe gelangen.
- Nachdem die osmotischen Minipumpen zusammengebaut sind, füllen Sie sie in ein konisches 50-ml-Röhrchen. Füllen Sie den Schlauch mit der sterilen Kochsalzlösung, so dass die Pumpen vollständig eingetaucht sind, und achten Sie darauf, dass die Kanüle nicht in die Kochsalzlösung gelangt. Vier solcher zusammengebauten Pumpen können in einem 50-ml-Röhrchen untergebracht werden.
- Setzen Sie die Kappe locker auf jedes Röhrchen und inkubieren Sie die Pumpen bei 37 °C, um sie mindestens 48 h lang anzusaugen.
2. Operation zur Implantation osmotischer Pumpen
- Präoperativer Eingriff
- Sterilisieren Sie die chirurgischen Instrumente in einem Autoklaven und lassen Sie sie vor Gebrauch mindestens 30 Minuten abkühlen. Die Autoklavenbedingungen beinhalten eine Dampfsterilisation bei 121 °C für 30 Minuten.
- Desinfizieren Sie den Operationsbereich mit 70% Ethanol. Wischen Sie die Knöpfe, Ohrbügel und die stereotaktische Rahmenoberfläche ab.
Anmerkungen: Die Operation sollte in einer aseptischen Umgebung durchgeführt werden, wobei zu beachten ist, dass während der Operation keine unsterilen Oberflächen berührt werden. Ersetzen Sie die Handschuhe, wenn der Verdacht auf eine Kontamination besteht. - Legen Sie die Maus in eine Anästhesiekammer, um sie 3-5 Minuten lang mit 3% Isofluran an der Luft zu betäuben. Nehmen Sie dann die Maus aus der Kammer und legen Sie sie auf ein steriles Tuch. Halten Sie die Anästhesie über einen Nasenkegel bei 1,5%-2%.
- Kneifen Sie die Hinterpfote der Maus zusammen, um einen Reflex zu beobachten und die Narkosetiefe zu überprüfen.
- Injizieren Sie 5 mg/kg Carprofen subkutan zur Analgesie.
- Verwenden Sie eine saubere Haarschneidemaschine, um den Operationsbereich am Mauskopf zu befestigen. Reiben Sie die Kopfhaut zuerst mit Povidon-Jod-Lösung und dann mit Alkoholtupfern gründlich für mindestens 2 Minuten ein. Wiederholen Sie diesen Vorgang mindestens dreimal.
- Tragen Sie ein Augengleitmittel auf, um zu verhindern, dass die Augen während der Operation austrocknen.
- Chirurgie
- Setzen Sie die Maus auf den stereotaktischen Rahmen und setzen Sie den Kopf auf die Schneidezahnstange. Bedecken Sie die Nase mit dem Nasenkegel. Bringen Sie sterile Abdeckungen an, um den Operationsbereich zu sichern.
- Verlagern Sie den Isofluranfluss auf den Nasenkegel. Halten Sie die Anästhesie weiterhin bei 1,5%-2% Isofluran.
- Legen Sie ein Heizkissen unter die Maus, um die Körpertemperatur aufrechtzuerhalten.
- Ziehen Sie neue sterile Handschuhe an und machen Sie mit einem Skalpell einen Mittellinienschnitt (~10-15 mm lang) auf der Kopfhaut. Lege die Schädeloberfläche mit einem Spatel frei, während du Wattestäbchen verwendest, um Blutungen abzuwischen.
Anmerkungen: Verwenden Sie einen Kauterisator, wenn Sie stark bluten, was selten vorkommt. - Reiben Sie mit einer in 3%iges Wasserstoffperoxid getauchten Wattespitze, um die Schädelnähte freizulegen.
- Notieren Sie sich Bregma und Lambda, um in den Schädelkoordinaten zu navigieren. Setzen Sie alle Koordinaten bei bremma auf Null.
HINWEIS: Diese Koordinaten stammen aus einem Mausgehirnatlas14. Der Referenzabstand zwischen Bregma und Lambda im Atlas beträgt 4,21 mm. Um alters- und geschlechtsbedingte Unterschiede in der Schädelgröße zu korrigieren, wurde der Bregma-Lambda-Abstand für jede Maus gemessen und dann durch 4,21 mm geteilt, um einen Multiplikationsfaktor zu erhalten. Wenn beispielsweise der Abstand zwischen Bregma und Lambda 4,65 mm beträgt, ergibt die Division durch 4,21 mm einen Multiplikationsfaktor von 1,10. Alle Koordinaten aus dem Atlas wurden dann mit diesem Faktor multipliziert, um die tatsächlichen Koordinaten zu messen, die zum Bohren des Lochs verwendet wurden. Im obigen Beispiel wären die resultierenden anterior-posterioren (AP) und medial-lateralen (ML) Koordinaten 0,55 bzw. 1,1 mm (d. h. 1,1 x 0,5 oder 1 mm). - Verwenden Sie eine Bohrmaschine, um ein Loch an diesen Koordinaten zu bohren: 0,5 mm posterior zu Bremma und 1 mm seitlich zur Mittellinie nach rechts.
HINWEIS: Achten Sie beim Bohren des Lochs im Schädel darauf, dass die Dura mater nicht reißt. Stellen Sie sicher, dass der Bohrer steril ist. Es kann zur Sterilisation mit anderen Instrumenten in denselben Autoklavenbeutel gelegt werden. - Führen Sie ein Hämostat unter die eingeschnittene Haut ein und schieben Sie es an die Stelle, an der die osmotische Minipumpe implantiert werden soll. Öffnen und schließen Sie das Hämostat vorsichtig, um eine Tasche für die Minipumpe zu schaffen.
- Verwenden Sie ein steriles Hämostat, um eine vorbereitete osmotische Minipumpe von der Spitze des Durchflussmodulators zu entnehmen. Schieben Sie die Pumpe durch die eingeschnittene Haut in die Tasche.
Anmerkungen: Achten Sie darauf, dass die Pumpe und die Kanüle keine unsterile Oberfläche berühren. - Tragen Sie etwas Kleber auf die Unterseite der Kanüle auf und fixieren Sie sie im Kanülenhalter. Senken Sie die Kanüle langsam durch das gebohrte Loch 2 mm ventral auf die Schädeloberfläche. Lassen Sie es dort mindestens 5 Minuten einwirken, damit sich der Kleber verfestigen kann.
- Bevor Sie die Kanüle in das Gehirn einführen, vergewissern Sie sich, dass die Kanüle nicht verstopft ist und die Lösung richtig fließt.
Anmerkungen: Manchmal kann sich aufgrund einer sehr geringen Flussrate Glukose an der Spitze der Kanüle ablagern und den Fluss blockieren. - Schneiden Sie mit Hilfe einer Schere die Oberseite der Kanüle ab, um sicherzustellen, dass sie sich nicht von der Schädeloberfläche löst.
- Decken Sie die Kanüle mit einer Schicht Zahnzement ab, um zusätzlichen Halt zu erhalten.
- Verwenden Sie Nylonnähte (Größe 5-0 und 30 Zoll Länge), um die Wunde zu schließen, und tragen Sie ein topisches Antibiotikum auf die Wunde auf, um eine Infektion zu verhindern.
- Schalten Sie Isofluran aus und lassen Sie das Tier sich von der Narkose erholen. Setzen Sie das Tier dann in einen neuen, sauberen Käfig um.
- Nachsorge
- Überwachen Sie die Maus nach der Operation mindestens 1 Woche lang.
- Verabreichen Sie 5 mg/kg Carprofen subkutan einmal alle 24 Stunden für drei Tage nach der Operation.
- Lassen Sie die Wunde vollständig heilen, bevor Sie die Fäden 7-10 Tage nach der Operation entfernen.
HINWEIS: Es wurde beobachtet, dass Mäuse mit hohem Liquorglukosespiegel länger brauchten, um zu heilen. Das Trimmen von Krallen an den Hinterpfoten der Maus minimiert die Wahrscheinlichkeit einer Verletzung der Einschnittstelle aufgrund des Kratzverhaltens von Mäusen.
3. Austausch der Minipumpen
HINWEIS: Da die in dieser Studie verwendeten Minipumpen nur 4 Wochen halten, wurde auch der Austausch von Minipumpen getestet, um die Dauer der Glukoseinfusion zu verlängern, wie es bei Langzeitstudien erforderlich sein kann. Dies umfasste die folgenden Schritte.
- Bereiten Sie die Mäuse wie oben beschrieben auf die Operation vor.
- Machen Sie einen kleinen vertikalen Schnitt von 1 cm in der Haut etwas oberhalb der Pumpe.
- Führen Sie ein Hämostat unter die eingeschnittene Haut ein und ziehen Sie die Pumpe heraus.
- Entfernen Sie die Pumpe aus dem Schlauch und schließen Sie eine neue angesaugte Pumpe an den Schlauch an.
- Setzen Sie die Pumpe wieder ein und nähen Sie die Haut.
- Befolgen Sie die gleichen Pflegeanweisungen nach der Operation wie oben beschrieben.
4. Verfahren zur Sammlung des Liquors
- Präparat
- Ziehen Sie Glaskapillaren mit einem Durchmesser von 1 mm mit einer Mikropipettenabziehmaschine, um Spitzen mit einem Durchmesser von 0,5 mm zu erhalten. Die Einstellungen sind: Wärme = 800, Zug = 15, Geschwindigkeit = 5 und Zeit = 200 Einheiten. Legen Sie die gezogenen Kapillaren bis zur Verwendung in eine sterile Schachtel.
- Befestigen Sie eine 27-g-Nadel an einer 1-ml-Spritze. Führen Sie die gezogene Kapillare in die Nadel ein und verwenden Sie ein kleines Klebeband, um die Verbindung zu sichern.
- Fixieren Sie die Spritze fest in einem Kapillarhalter eines Mikromanipulators.
- Bereiten Sie als Nächstes die Maus auf die Operation vor, wie oben im voroperativen Verfahren beschrieben.
- Chirurgischer Eingriff
- Platzieren Sie die Maus auf dem stereotaktischen Rahmen. Nachdem Sie den Kopf wie zuvor beschrieben am Rahmen befestigt haben, drehen Sie die Knöpfe, um den Kopf so zu neigen, dass die Nase nach unten zeigt. Bringen Sie sterile Abdeckungen an, um den Operationsbereich zu sichern.
- Machen Sie einen kleinen Schnitt auf der dorsalen Oberfläche, beginnend von der intraauralen Ebene bis zur kaudalen Seite.
Anmerkungen: Achten Sie darauf, den Schlauch beim Einschnitt nicht zu beschädigen. - Entfernen Sie die Stütze vom Mauskörper und lassen Sie die Maus senkrecht ruhen, so dass der Hals nach hinten vollständig gestreckt ist.
- Mit Hilfe einer gebogenen stumpfen Pinzette halbieren Sie die hinteren Nackenmuskeln sanft von der Mittellinie aus, um ein kleines Fenster zu schaffen. Verwenden Sie dann einen feuchten Applikator mit Wattespitzen, um die Nackenmuskulatur sanft von der Mittellinie zur Peripherie zu verschieben.
- Beobachten Sie, ob die Cisterna magna freiliegt, die als dreieckiges Fenster mit einer transparenten Dura-Membran erscheint.
- Platzieren Sie die Mikromanipulatorbaugruppe auf dem stereotaktischen Rahmen neben der Maus und achten Sie darauf, dass die Kapillarspitze keine Oberfläche berührt.
- Brechen Sie die Kapillarspitze vorsichtig auf, ohne das Setup zu stören.
- Während Sie in die Lupe schauen (2,25-fache Vergrößerung), drehen Sie die entsprechenden Knöpfe am Mikromanipulator, um die Kapillarspitze langsam auszurichten und in Richtung der Cisterna Magna zu bewegen.
- Ein gewisser Widerstand ist zu spüren, sobald die Kapillarspitze die Membran der Cisterna magna berührt. Drücken Sie die Spitze mit Hilfe der Noppen sehr langsam gegen die Membran.
Anmerkungen: Achten Sie darauf, keine Blutgefäße in der Membran zu beschädigen. Dieser Schritt ist sehr wichtig, um eine Blutkontamination im Liquor zu vermeiden. - Stechen Sie sehr vorsichtig in die Membran. Der Liquor beginnt aufgrund des Unterdrucks in der Kapillare sofort in die Kapillare zu fließen.
- Lassen Sie den Aufbau einige Minuten stehen, bis ~10 μl Liquor in der Kapillare gesammelt sind.
- Ziehen Sie dann langsam die Kapillare aus der Cisterna Magna heraus und drücken Sie einen sterilen Applikator mit Wattestäbchen vorsichtig gegen die Öffnung der Cisterna Magna, um ein Auslaufen des Liquors zu verhindern.
- Entfernen Sie vorsichtig die Kapillare aus der Spritze und befestigen Sie sie an einem Mikrokappen-Bulb-Dispenser. Drücken Sie auf die Glühbirne, um den Liquor in ein steriles Mikrozentrifugenröhrchen zu überführen.
- Platzieren Sie eine Stütze unter der Maus und drehen Sie die stereotaktischen Knöpfe, um den Kopf auszurichten.
- Verschließen Sie die Wunde mit Nylonnähten.
- Injizieren Sie 300 μl sterile Kochsalzlösung subkutan, bevor Sie die Maus aus dem Gerät nehmen.
- Pflegen Sie die Tiere wie oben beschrieben, bis es Zeit ist, die Fäden zu entfernen - ~ 7-10 Tage nach der Operation.
5. Glukose-Assay
- Befolgen Sie das Protokoll, wie es im kolorimetrischen Glukose-Assay-Kit beschrieben ist.
- Die im Kit enthaltene Natriumphosphat-Pufferlösung wird in Reinstwasser auf eine Konzentration von 50 mM verdünnt.
- Bereiten Sie Glukosestandards in den Bereichen 0, 2,5, 5, 7,5, 10, 15, 20, 25 und 50 mg/dl aus der im Kit enthaltenen 1.000 mg/dl Stammlösung in verdünnter Pufferlösung vor.
- Bereiten Sie eine 7-fache Verdünnung der Liquorproben im Puffer vor. Wenn beispielsweise das gesammelte Gesamtvolumen des Liquors 10 μl beträgt, beträgt das siebenfach verdünnte Volumen 70 μl.
- Pipettieren Sie 15 μl Glukosestandards und verdünnten Liquor in Duplikaten in eine 96-Well-Platte.
- Pipettieren Sie 85 μl verdünnten Puffer in jede der Vertiefungen mit Standards und Liquor.
- Geben Sie 6 ml verdünnten Puffer in die Durchstechflasche mit der kalorimetrischen Glukoseenzymmischung und wirbeln Sie sie einige Sekunden lang, um sie gründlich zu mischen.
- Geben Sie 100 μl der Enzymmischung in jede Vertiefung, um die Reaktion zu starten.
- Verschließen Sie die Platte mit einer Abdeckfolie und klopfen Sie vorsichtig auf die Platte, um die Reagenzien zu mischen.
- Stellen Sie die Platte für 10 Minuten in einen Inkubator bei 37 °C. Fläschchen mit hohem Glukosespiegel beginnen sich sofort violett zu verfärben.
- Entfernen Sie nach 10 Minuten die Abdeckung und messen Sie die Absorption bei 500-520 nm mit einem Plattenleser.
- Berechnen Sie die Glukosekonzentration in den Liquorproben, indem Sie ihre Werte aus der Standardkurve interpolieren.
6. Blutzuckertest
- Machen Sie mit einer Rasierklinge einen kleinen seitlichen Schnitt in den Mausschwanz und verwenden Sie einen Tropfen Blut, um den Blutzucker mit einem Blutzuckermessgerät gemäß den Anweisungen der Bedienungsanleitung zu messen.
Ergebnisse
Männlichen Mäusen wurde eine Kanüle implantiert, die an eine osmotische Minipumpe angeschlossen war (Abbildung 1), um einen Liquor oder eine 50%ige Glukoselösung in ihre Seitenventrikel zu infundieren (Abbildung 2). Der Liquor wurde 10 Tage nach der Operation entnommen (Abbildung 3), um die Wirksamkeit dieses Verfahrens zu validieren. Die Ergebnisse zeigten einen Anstieg des Liquorglukosespiegels (Mittelwert: 327,7 mg/dl) bei Mäusen, die mit 50 % Glukose infundiert wurden, im Vergleich zu dem (Mittelwert: 56,5 mg/dl) bei Mäusen, die mit aCSF infundiert wurden. Dies entspricht einer etwa sechsfachen Erhöhung des Liquorglukosespiegels bei den Versuchsmäusen im Vergleich zu ihren Kontrollwurfgeschwistern (Abbildung 4A). Die Blutzuckerwerte unterschieden sich nicht zwischen den Gruppen (Abbildung 4B).
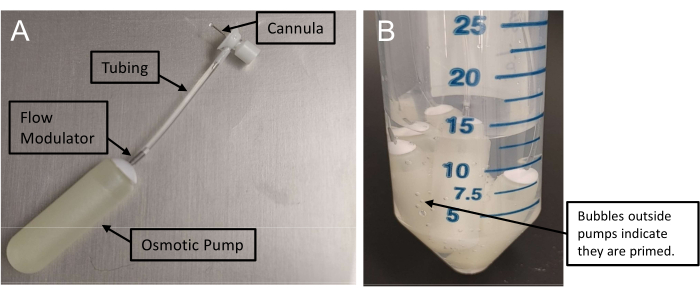
Abbildung 1: Montage osmotischer Minipumpen . (A) Infusionsanordnung mit einer Kanüle, die über einen Schlauch mit einer Minipumpe verbunden ist. Diese Pumpen benötigen mindestens 48 Stunden zum Ansaugen. (B) Das Vorhandensein von Luftblasen außerhalb der Minipumpen bestätigt das Ansaugen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Stereotaktische Apparatur und Zubehör. (A,B) Stereotaktische Ausrüstung mit angebautem Mikromanipulator und anderem Zubehör. (C) Bohrlochkoordinaten zum Einführen der Kanüle. (D) Implantation einer osmotischen Minipumpe, (E,F) Einführen der Kanüle in das Bohrloch. Sorgen Sie für aseptische Bedingungen während der gesamten Operation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Verfahren zur Entnahme von Liquor cerebrospinalis (CSF). (A) Die dorsale Halsmuskulatur wurde sanft mit einer stumpfen Pinzette verschoben, um die Cisterna magna freizulegen. Eine 1 mm Kapillare mit einer Spitze von 0,5 mm Durchmesser wurde verwendet, um (B) zu rupen und (C,D) Liquor aus der Cisterna magna zu sammeln. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
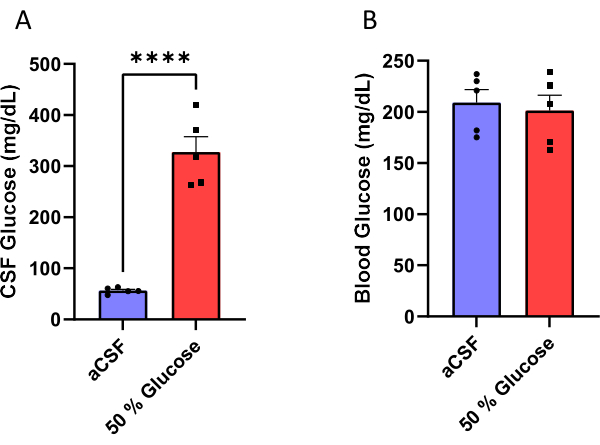
Abbildung 4: Messung der Glukose. (A) Erhöhte Liquorglukose (B) ohne Beeinflussung des nicht-nüchternen Blutzuckerspiegels bei Mäusen, die mit 50%iger Glukoselösung in den Seitenventrikel infundiert wurden. Die Wirksamkeit dieses Protokolls wurde durch die Messung der Liquor- und Blutzuckerkonzentration 10 Tage nach Beginn der Glukoseinfusion validiert. Mäuse, die mit 50%iger Glukoselösung infundiert wurden, wiesen Liquorglukosespiegel von 327,7 ± 30,1 mg/dl (Mittelwert ± Standardfehler des Mittelwerts) auf, verglichen mit Mäusen, die eine künstliche Liquorinfusion erhielten und Glukosespiegel von 56,5 ± 2,6 mg/dl aufwiesen. P < 0,0001, ungepaarter t-Test. Fehlerbalken stellen den Standardfehler des Mittelwerts dar (n = 5). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Dieser Artikel berichtet über ein detailliertes Protokoll zur Erhöhung der Liquorglukose bei Mäusen durch die Verwendung osmotischer Minipumpen, die an eine Kanüle angeschlossen sind, die in den Seitenventrikel implantiert wird. Die chronische Infusion von Glukose in das Mäusegehirn durch dieses Verfahren wird nützlich sein, um die Auswirkungen einer langfristigen Hyperglykorrhachie auf die Kognition, den systemischen Glukosestoffwechsel und den Energiehaushalt zu beschreiben und die Pathogenese von Diabeteskomplikationen besser zu verstehen.
Chronischer Diabetes verursacht Hirnschäden, die die Kommunikation zwischen dem Gehirn und den peripheren Organen unterbrechen15. Diabetes erhöht auch das Risiko für neurodegenerative Erkrankungen, einschließlich der Alzheimer-Krankheit 3,4. Streptozotocin (STZ)-induzierter Typ-1-Diabetes ist das Standardmodell für Nagetiere in der Diabetesforschung16; STZ schädigt β-Zellen in der Bauchspeicheldrüse, was zu einer Typ-1-Diabetes-ähnlichen Pathologie führt. Darüber hinaus kann in einer modifizierten Version die Verwendung von STZ in Verbindung mit Nicotinamiden Typ-2-Diabetes induzieren. Eine weitere Möglichkeit, Typ-2-Diabetes-ähnliche Phänotypen bei Tieren zu entwickeln, besteht darin, sie mit einer fettreichen Diät zu füttern16. Im Zusammenhang mit der Untersuchung der Auswirkungen von Hyperglykämie auf die Gehirnfunktion sind diese Techniken jedoch bei der Kontrolle einer großen Anzahl von Faktoren (z. B. peripherer Insulin-/Glukagonspiegel und Stoffwechselfunktion im Allgemeinen) begrenzt. Daher kann jeder Effekt eines STZ-induzierten Diabetes auf die Gehirnfunktion nur als assoziierte Komplikation interpretiert werden, anstatt einen einzelnen ätiologischen Faktor zu lokalisieren. Die akute Injektion oder chronische Infusion von Substanzen in den zerebroventrikulären Raum ist eine Technik, die häufig verwendet wird, um ihre direkten Auswirkungen auf die Gehirnfunktion zu testen. Die intracerebroventrikuläre (ICV) Injektion von STZ wurde verwendet, um ein Nagetiermodell der Alzheimer-Krankheit zu entwickeln, es bleibt jedoch unklar, ob STZ-assoziierte neuronale Schäden auf eine Dysregulation der Glukoseerkennung/Homöostase oder auf andere unabhängige Mechanismen wie STZ-induzierten oxidativen Stress und DNA-Schäden zurückzuführen sind17.
Die im aktuellen Protokoll beschriebenen Verfahren werden bei der Entwicklung von Nagetiermodellen nützlich sein, die Forschungsfragen beantworten können, z. B. ob ein Anstieg der Glukosekonzentration im Liquor zu kognitiven Beeinträchtigungen führen kann. Das hier beschriebene Protokoll könnte verwendet werden, um die direkten Auswirkungen eines hohen Liquorglukosespiegels auf den Hypothalamus und den Hippocampus zu bestimmen, neben anderen Gehirnregionen, die an der Nährstoffwahrnehmung, dem Stoffwechsel und/oder der Kognition beteiligt sind. Diese Methode würde auch klären, ob ein Anstieg des Liquorglukosespiegels die Insulinsensitivität, die Insulinsekretion, die Nahrungsaufnahme und/oder den Energiehaushalt zu Beginn und als Reaktion auf metabolische Insulte beeinflusst. Darüber hinaus wäre das hier beschriebene Protokoll bei der Überprüfung von Hypothesen anwendbar, die Längsschnittstudien erfordern. So könnten beispielsweise vor, während und am Ende der Glukoseinfusionen Daten gesammelt werden, um die Befunde derselben Tiere zu unterschiedlichen Zeitpunkten zu vergleichen. Eine solche Strategie würde sich mit der Frage befassen, ob Komplikationen, die sich aus einem hohen Liquorglukosespiegel ergeben, reversibel sind, nachdem der normale Liquorglukosespiegel wiederhergestellt ist. Im Gegensatz dazu könnte die Methode auch für hypothesengenerierende Studien verwendet werden. Zum Beispiel könnte Liquor von denselben Tieren zu unterschiedlichen Zeiten entnommen und einer Metabolom- oder Proteomik-Analyse unterzogen werden, um Biomarker oder Stoffwechselstörungen zu identifizieren, die durch einen hohen Liquorglukosespiegel hervorgerufen werden. In ähnlicher Weise könnten verschiedene Regionen des Gehirns durch räumliche Transkriptomik analysiert werden, um zellspezifische Informationen zu erhalten, die möglicherweise durch hohe Liquorglukose verändert wurden.
Der Grundgedanke für die Infusion von glukosefreiem aCSF in eine Scheingruppe bestand darin, die Liquorglukosekonzentration auf dem Ausgangsniveau zu halten, so dass jede durch die Kanülenimplantation induzierte Veränderung des Liquorglukosespiegels auf natürliche Weise kontrolliert werden kann. Die Ergebnisse dieser Studie zeigten, dass die Scheingruppe eine Liquorglukosekonzentration von ~60 mg/dl (~3 mM) aufwies, was bei Mäusen18 im normalen Liquorglukosebereich liegt. Der bei Personen mit Typ-2-Diabetes beobachtete Liquorglukosespiegel beträgt ~110 mg/dl oder ~6 mM9. In der aktuellen Studie erhöhte die ICV-Infusion von 50 % Glukose mit einer Rate von 125 μg/h den Liquorglukosespiegel auf ~300 mg/dl (16 mM), was supraphysiologisch ist19. Obwohl dieser supraphysiologische Glukosespiegel im Liquor möglicherweise nicht klinisch relevant für die bei Personen mit Typ-2-Diabetes beobachteten Werte ist, zeigen die in dieser Studie vorgestellten Ergebnisse, dass die Infusion von Glukose in den Liquor bei Mäusen eine chronische Erhöhung der Glukosekonzentration im Liquor induzieren kann.
Die hier vorgestellte Methode weist einige Einschränkungen auf. Es handelt sich um eine ausgeklügelte Mausgehirnchirurgie, die eine entsprechende Ausbildung, Fähigkeiten und Erfahrung bei der Durchführung solcher fortgeschrittenen Verfahren erfordert. Da der Katheter und die Minipumpen langfristig implantiert werden, ist eine sorgfältige Pflege der Mäuse während der gesamten Studie erforderlich, um gesundheitliche Bedenken oder Schäden an der Katheteranordnung zu überwachen. Eine Glukosekonzentration von 50 % wurde gewählt, da die Viskosität einer Lösung, die über diese Konzentration hinausging, die Infusion von Glukose in die Ventrikel beeinflusst haben könnte. Die in diesem Protokoll verwendeten Minipumpen hatten eine Durchflussrate von 0,25 μl/h, so dass die Gruppe der Mäuse mit 50%iger Glukoseinfusion Glukose mit einer Rate von 125 μg/h oder 3 mg Glukose pro Tag erhielt. Diese Glukosedosis pro Zeiteinheit war daher durch die Durchflussrate der Minipumpen begrenzt.
Zusammenfassend berichtet dieser Artikel über eine validierte Methode für den chronischen Anstieg der Liquorglukose bei Mäusen. Die aus diesem Modell gewonnenen Informationen werden nützlich sein, um festzustellen, ob oder wie ein Anstieg des Liquorglukosespiegels an der Vermittlung von Diabetes-assoziierten Komplikationen, wie z. B. neurodegenerativen Erkrankungen, oder der Verursachung peripherer Stoffwechselstörungen bei Diabetes und Fettleibigkeit beteiligt ist.
Fehlerbehebung
Wenn sich der Schlauch bei den Mäusen von der Kanüle löst, kann beim Zusammenbau der Minipumpe eine kleine Menge Kleber auf die Kanülen-Schlauch-Verbindung aufgetragen werden. Wenn sich Fäden lösen und die Kanüle sichtbar wird, kann der Schnittbereich mit Nähten oder Klammern vollständig verschlossen werden. Nägel von den Hinterpfoten der Maus sollten geschnitten werden, damit die Wahrscheinlichkeit, dass die Maus den Operationsbereich kratzt, geringer ist. Achten Sie außerdem darauf, die Nähte nicht so fest abzubinden, dass die Haut reißt, da Mäuse eine empfindliche Haut haben.
Für eine schnelle Genesung nach der Liquorentnahme wird die subkutane Injektion von 300 μl steriler Kochsalzlösung nach der Operation empfohlen. Darüber hinaus ist es wichtig, das maximale Volumen der Liquorsammlung auf 10 μl zu beschränken.
Offenlegungen
Die Autoren erklären, dass sie keinen Interessenkonflikt haben.
Danksagungen
National Institutes of Health gewähren DK124619 an KHC.
Anschubfinanzierung und Pilotforschungspreis, Department of Medicine, University of Rochester, NY, an KHC.
Der Del Monte Institute for Neuroscience Pilot Research Award, University of Rochester, an KHC.
Forschungspreis der Universität, Büro des Vizepräsidenten für Forschung, Universität Rochester, NY, an KHC.
MUR entwarf und führte die Methode durch, analysierte die Ergebnisse, erstellte Grafiken und Abbildungen und schrieb und redigierte das Manuskript. KHC konzipierte und betreute die Studie, analysierte die Ergebnisse und schrieb und redigierte das Manuskript. KHC ist der Garant für diese Arbeit. Alle Autoren stimmten der endgültigen Fassung des Manuskripts zu.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Membrane solutions | SFPES030022S | |
| 1 mL sterile Syringe (Luer-lok tip) | BD | 309628 | |
| 1 mL TB syringe | BD | 309659 | |
| 100 mL Glass beaker | Fisher | N/a | |
| 100% Ethanol (Koptec) | DLI | UN170 | Use 70% dilution to clean the surgery area |
| 50 mL conical tube | Fisher | N/A | |
| Allignment indicator | KOPF | 1905 | |
| Alzet brain infusion kit | DURECT | Kit # 3; 0008851 | Cut tubing in the kit to 1 inch length |
| Alzet osmotic pump | DURECT | 2004 | Flow rate 0.25 µL/h |
| Anesthesia system | Kent Scientific | SomnoSuite | |
| Betadine solution | Avrio Health | N/A | |
| CaCl2 . 2H2O | Fisher | C79-500 | |
| Cannula holder | KOPF | 1966 | |
| Centering scope | KOPF | 1915 | |
| Dental Cement Liquid | Lang Dental | REF1404 | |
| Dental cement Powder | Lang Dental | REF1220-C | |
| D-glucose | Sigma | G8270 | |
| Electric drill | KOPF | 1911 | While drilling a hole avoid rupturing dura mater |
| Eye lubricant (Optixcare) | CLC Medica | N/A | |
| Glass Bead sterilizer (Germinator 500) | VWR | 101326-488 | Place instruments in sterile water to let them cool before surgery |
| Glucose Assay Kit | Cayman chemical | 10009582 | |
| H2O2 | Sigma | H1009-500ml | Apply 3% H2O2 on skull surface to make the cranial sutures visible. |
| Hair Clipper | WAHL | N/A | |
| heating pad | Heatpax | 19520483 | |
| Hemostat | N/A | N/A | |
| Isoflurane (Fluriso) | Zoetis | NDC1385-046-60 | |
| KCl | VWR | 0395-500g | |
| Magnetic stand | WPI | M1 | |
| Magnifying desk lamp | Brightech | LightView Pro Flex 2 | |
| Metal Spatula | N/A | N/A | |
| MgCl2 . 6H2O | Fisher | BP214-500 | |
| Micromanipulator (Right handed) | WPI | M3301R | |
| Micromanipulator with digital display | KOPF | 1940 | |
| Na2HPO4 . 7H2O | Fisher | S373-500 | |
| NaCl | Sigma | S7653-5Kg | |
| NaH2PO4 . H2O | Fisher | S369-500 | |
| Neosporin | Johnson & Johnson | N/A | Apply topical oinment to prevent infection |
| Parafilm | Bemis | DM-999 | |
| Rimadyl (Carprofen) 50mg/ml | Zoetis | N/A | 5 mg/kg, subcutaneous, for analgesia |
| Scalpel | N/A | N/A | |
| Stereotaxic allignment system | KOPF | 1900 | |
| Sterile 27 gauge needle | BD | 305109 | |
| Sterile cotton tip applicators (Solon) | AMD Medicom | 56200 | |
| Sterile nylon sutures (5.0) | Oasis | MV-661 | Use non-absorable suture for closing the wound |
| Sterile sharp scissors | N/A | N/A | |
| Sterile surgical blades | VWR | 55411-050 | |
| Surgical gloves (Nitrile) | Ammex | N/A | Change gloves if there is suspision of contamination |
| Tray | N/A | N/A |
Referenzen
- Moheet, A., Mangia, S., Seaquist, E. R. Impact of diabetes on cognitive function and brain structure. Annals of the New York Academy of Sciences. 1353, 60-71 (2015).
- Takeda, S., et al. Diabetes-accelerated memory dysfunction via cerebrovascular inflammation and Abeta deposition in an Alzheimer mouse model with diabetes. Proceedings of the National Academy of Sciences. 107 (15), 7036-7041 (2010).
- Arvanitakis, Z., Wilson, R. S., Bienias, J. L., Evans, D. A., Bennett, D. A. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function. Archives of Neurology. 61 (5), 661-666 (2004).
- Zilliox, L. A., Chadrasekaran, K., Kwan, J. Y., Russell, J. W. Diabetes and cognitive impairment. Current Diabetes Reports. 16 (9), 87(2016).
- Reno, C. M., Litvin, M., Clark, A. L., Fisher, S. J. Defective counterregulation and hypoglycemia unawareness in diabetes: mechanisms and emerging treatments. Endocrinology and Metabolism Clinics of North America. 42 (1), 15-38 (2013).
- Cryer, P. E., Davis, S. N., Shamoon, H. Hypoglycemia in diabetes. Diabetes Care. 26 (6), 1902-1912 (2003).
- Hwang, J. J., et al. Hypoglycemia unawareness in type 1 diabetes suppresses brain responses to hypoglycemia. The Journal of Clinical Investigation. 128 (4), 1485-1495 (2018).
- Cryer, P. E., Gerich, J. E. Glucose counterregulation, hypoglycemia, and intensive insulin therapy in diabetes mellitus. The New England Journal of Medicine. 313 (4), 232-241 (1985).
- Tigchelaar, C., et al. Elevated cerebrospinal fluid glucose levels and diabetes mellitus are associated with activation of the neurotoxic polyol pathway. Diabetologia. 65 (7), 1098-1107 (2022).
- Zheng, H., et al. Cognitive decline in type 2 diabetic db/db mice may be associated with brain region-specific metabolic disorders. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (1), 266-273 (2017).
- Ernst, A., et al. Diabetic db/db mice exhibit central nervous system and peripheral molecular alterations as seen in neurological disorders. Translational Psychiatry. 3 (5), 263(2013).
- Wang, Y., Yang, Y., Liu, Y., Guo, A., Zhang, Y. Cognitive impairments in type 1 diabetes mellitus model mice are associated with synaptic protein disorders. Neuroscience Letters. 777, 136587(2022).
- Jolivalt, C. G., et al. Type 1 diabetes exaggerates features of Alzheimer's disease in APP transgenic mice. Experimental Neurology. 223 (2), 422-431 (2010).
- Paxinos, G., Franklin, K. B. J. Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , Academic Press. (2019).
- Vinik, A. I., Maser, R. E., Mitchell, B. D., Freeman, R. Diabetic autonomic neuropathy. Diabetes Care. 26 (5), 1553-1579 (2003).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), 78(2021).
- Grieb, P. Intracerebroventricular streptozotocin injections as a model of Alzheimer's disease: in search of a relevant mechanism. Molecular Neurobiology. 53 (3), 1741-1752 (2016).
- Kealy, J., et al. Acute inflammation alters brain energy metabolism in mice and humans: role in suppressed spontaneous activity, impaired cognition, and delirium. The Journal of Neuroscience. 40 (29), 5681-5696 (2020).
- Dougherty, J. M., Roth, R. M. Cerebral spinal fluid. Emergency Medicine Clinics of North America. 4 (2), 281-297 (1986).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten