Method Article
Impianto di minipompa osmotica per aumentare la concentrazione di glucosio nel liquido cerebrospinale di topo
In questo articolo
Riepilogo
Questo articolo descrive un protocollo dettagliato per aumentare la concentrazione di glucosio nel liquido cerebrospinale (CSF) dei topi. Questo approccio può essere utile per studiare gli effetti del glucosio CSF alto sulla neurodegenerazione, sulla cognizione e sul metabolismo periferico del glucosio nei topi.
Abstract
Il diabete aumenta il rischio di declino cognitivo e compromette la funzione cerebrale. Se questa relazione tra glucosio alto e deficit cognitivi sia causale rimane elusiva. Inoltre, non è chiaro se questi deficit siano mediati da un aumento dei livelli di glucosio nel liquido cerebrospinale (CSF) e / o nel sangue. Ci sono pochissimi studi che studiano gli effetti diretti di alti livelli di glucosio nel liquido cerebrospinale sulla funzione del sistema nervoso centrale (SNC), in particolare sull'apprendimento e sulla memoria, poiché gli attuali modelli di diabete non sono sufficientemente sviluppati per affrontare tali domande di ricerca. Questo articolo descrive un metodo per aumentare cronicamente i livelli di glucosio nel CSF per 4 settimane infondendo continuamente glucosio nel ventricolo laterale utilizzando minipompe osmotiche nei topi. Il protocollo è stato convalidato misurando i livelli di glucosio nel liquido cerebrospinale. Questo protocollo ha aumentato i livelli di glucosio nel CSF a ~ 328 mg / dL dopo l'infusione di una soluzione di glucosio al 50% a una velocità di flusso di 0,25 μL / h, rispetto a una concentrazione di glucosio nel CSF di ~ 56 mg / dL nei topi che hanno ricevuto liquido cerebrospinale artificiale (aCSF). Inoltre, questo protocollo non ha influenzato i livelli di glucosio nel sangue. Pertanto, questo metodo può essere utilizzato per determinare gli effetti diretti di glucosio CSF alto sulla funzione cerebrale o su uno specifico percorso neurale indipendentemente dai cambiamenti nei livelli di glucosio nel sangue. Nel complesso, l'approccio qui descritto faciliterà lo sviluppo di modelli animali per testare il ruolo dell'alto livello di glucosio nel liquido cerebrospinale nelle caratteristiche di mediazione della malattia di Alzheimer e / o di altri disturbi neurodegenerativi associati al diabete.
Introduzione
Sia il diabete di tipo 1 che quello di tipo 2 compromettono la funzione cerebrale 1,2,3. Ad esempio, il diabete aumenta il rischio di declino cognitivo e disturbi neurodegenerativi, tra cui il morbo di Alzheimer 3,4. Inoltre, le persone con diabete hanno un rilevamento del glucosio difettoso nel cervello 5,6. Questo difetto contribuisce alla patogenesi dell'inconsapevolezza associata all'ipoglicemia e ad una risposta controregolatoria insufficiente all'ipoglicemia7,8, che può essere fatale se non trattata immediatamente.
Considerando che il diabete aumenta i livelli di glucosio nel sangue e nel liquido cerebrospinale (CSF)9, è importante determinare se uno o entrambi questi fattori contribuiscono alla compromissione della funzione cerebrale. Se il diabete provoca danni cerebrali da alto glucosio CSF da solo o in combinazione con altri fattori come la carenza di insulina o insulino-resistenza è anche una questione aperta. I modelli animali di diabete di tipo 1 e di tipo 2 mostrano declino cognitivo e neurodegenerazione oltre a un bilancio energetico influenzato e al metabolismo periferico del glucosio10,11,12,13. Tuttavia, da questi modelli, non è possibile disaccoppiare gli effetti selettivi di alti livelli di glucosio nel CSF rispetto ai livelli di glucosio nel sangue nel mediare le complicanze del diabete sulla funzione cerebrale.
Questo protocollo descrive i metodi per sviluppare un modello murino di iperglicorrichia per testare gli effetti di livelli di glucosio cronicamente elevati nel CSF sulla funzione cerebrale, sul bilancio energetico e sull'omeostasi del glucosio. Il modello murino sviluppato attraverso questa tecnica presenta uno strumento per studi che indagano il ruolo eziologico dell'omeostasi del glucosio disregolata sulla funzione neurale e comportamentale.
Pertanto, l'approccio proposto sarà utile per comprendere gli effetti diretti di elevati livelli di glucosio nel liquido cerebrospinale in varie condizioni fisiopatologiche.
Protocollo
Tutte le procedure sui topi sono state approvate dall'Institutional Animal Care and Use Committee dell'Università di Rochester e sono state eseguite secondo le linee guida del servizio sanitario pubblico degli Stati Uniti per la cura umana e l'uso di animali da esperimento. I topi maschi C57BL / 6J di sei settimane utilizzati per questo studio sono stati ottenuti commercialmente. Tutti gli animali sono stati alloggiati in gruppo (5 topi per gabbia) in una stanza con un ciclo giorno/notte di 12 ore e hanno avuto accesso a cibo e acqua ad libitum. Dopo che i topi sono stati impiantati con una cannula per infondere glucosio nel ventricolo laterale, sono stati alloggiati singolarmente per prevenire eventuali danni agli impianti da altri topi.
1. Assemblaggio di minipompe osmotiche
- Preparare il liquido cerebrospinale artificiale (aCSF) secondo il seguente protocollo. Sciogliere NaCl (8,66 g), KCl (0,224 g), CaCl 2,2H 2 O (0,206 g) e MgCl 2,6H 2 O (0,163 g) in 500 ml di acqua sterile per preparare la soluzione A. Sciogliere Na 2 HPO 4,7H 2 O (0,214 g) e NaH 2 PO4. H2O (0,027 g) in 500 mL di acqua sterile per preparare la soluzione B. Quindi, mescolare la soluzione A e B in un rapporto 1: 1 per preparare l'aCSF.
NOTA: Questa formulazione di aCSF non contiene glucosio. - Per preparare la soluzione di glucosio al 50%, aggiungere 50 g di glucosio a 50 ml di aCSF in un becher. Posizionare il becher su una piastra riscaldante e portare la temperatura della sospensione a 60 °C. Mescolare la sospensione con un agitatore magnetico fino a quando il glucosio è completamente sciolto.
- Aggiungere aCSF al becher per rendere il volume finale di 100 ml. Passare la soluzione attraverso il filtro dei pori da 0,22 μm per sterilizzarla.
- Preparare una soluzione salina allo 0,9% (NaCl) e far passare la soluzione attraverso il filtro da 0,22 μm.
- Posizionare tutti i componenti della minipompa e del kit di infusione in un vassoio sterile e tagliare il tubo dal kit di infusione cerebrale a 1 pollice di lunghezza con una forbice sterile. Tenere il tubo con un emostatico sterile e spingerlo sulla parte superiore di un'estremità della cannula. Collegare l'altra estremità del tubo al lato superiore del modulatore di flusso. Coprire entrambe le estremità del tubo con una piccola quantità di colla per una connessione più forte.
- Collegare un ago da 27 G a una siringa da 1 mL e riempirla con aCSF o la soluzione di glucosio. Inserire l'ago da 27 G in un piccolo pezzo di tubo. Quindi, collegare il tubo all'estremità aperta del modulatore di flusso e riempirlo con la soluzione corrispondente fino a quando le gocce della soluzione iniziano a fuoriuscire dalla cannula. Rimuovere eventuali bolle d'aria intrappolate nel tubo.
- Per riempire la minipompa, tenere la pompa in posizione verticale e inserire l'ago della siringa nella pompa. Riempirlo con la soluzione corrispondente fino a quando una goccia della soluzione inizia a formarsi all'apertura della minipompa.
- Inserire lentamente il modulatore di flusso nella pompa facendo attenzione a non introdurre bolle d'aria nel gruppo.
- Dopo aver assemblato le minipompe osmotiche, trasferirle in un tubo conico da 50 ml. Riempire il tubo con la soluzione salina sterile in modo che le pompe siano completamente sommerse, assicurandosi che la cannula rimanga fuori dalla soluzione salina. Quattro di queste pompe assemblate possono essere collocate in un tubo da 50 ml.
- Posizionare liberamente il tappo su ciascun tubo e incubare le pompe a 37 °C fino all'innesco per almeno 48 ore.
2. Chirurgia per l'impianto di pompe osmotiche
- Procedura pre-operatoria
- Sterilizzare gli strumenti chirurgici in autoclave e lasciarli raffreddare per almeno 30 minuti prima dell'uso. Le condizioni dell'autoclave prevedono la sterilizzazione a vapore a 121 °C per 30 minuti.
- Disinfettare l'area chirurgica con etanolo al 70%. Pulire le manopole, le barre auricolari e la superficie del telaio stereotassico.
NOTA: La chirurgia deve essere eseguita in un ambiente asettico, tenendo presente di evitare di toccare superfici non sterili durante l'esecuzione dell'intervento chirurgico. Sostituire i guanti se vi è il sospetto di contaminazione. - Posizionare il topo in una camera di anestesia per anestetizzarlo con isoflurano al 3% miscelato in aria per 3-5 minuti. Quindi, rimuovere il mouse dalla camera e posizionarlo su un drappeggio sterile. Mantenere l'anestesia tramite un cono nasale all'1,5% -2%.
- Pizzica la zampa posteriore del topo per osservare qualsiasi riflesso e verificare la profondità dell'anestesia.
- Iniettare 5 mg/kg di carprofen per via sottocutanea per l'analgesia.
- Utilizzare tosatrici pulite per agganciare l'area chirurgica sulla testa del mouse. Strofinare il cuoio capelluto prima con una soluzione di povidone-iodio e poi con tamponi imbevuti di alcool accuratamente per almeno 2 minuti. Ripeti questo processo almeno tre volte.
- Applicare un lubrificante per gli occhi per evitare che gli occhi si secchino durante l'intervento chirurgico.
- Chirurgia
- Posizionare il mouse sul telaio stereotassico e montare la testa sulla barra incisiva. Coprire il naso con il cono del naso. Applicare teli sterili per fissare l'area chirurgica.
- Spostare il flusso di isoflurano al cono del naso. Continuare a mantenere l'anestesia all'1,5%-2% di isoflurano.
- Posizionare una piastra elettrica sotto il mouse per mantenere la temperatura corporea.
- Indossare nuovi guanti sterili e, con un bisturi, praticare un'incisione sulla linea mediana (~ 10-15 mm di lunghezza) sul cuoio capelluto. Esporre la superficie del cranio con una spatola mentre si utilizzano punte di cotone per pulire eventuali sanguinamenti.
NOTA: Utilizzare un cauterizzatore se sanguina abbondantemente, il che è raro. - Strofinare con una punta di cotone immersa in perossido di idrogeno al 3% per esporre le suture craniche.
- Prendi nota di bregma e lambda per navigare le coordinate del cranio. Imposta tutte le coordinate a zero su bregma.
NOTA: Queste coordinate sono state ottenute da un atlante cerebrale di topo14. La distanza bregma-lambda di riferimento nell'atlante è di 4,21 mm. Per correggere le differenze basate sull'età e sul sesso nelle dimensioni del cranio, la distanza bregma-lambda per ciascun topo è stata misurata e poi divisa per 4,21 mm per ottenere un fattore di moltiplicazione. Ad esempio, se la distanza tra bregma e lambda era di 4,65 mm, la divisione per 4,21 mm dava un fattore di moltiplicazione di 1,10. Tutte le coordinate ottenute dall'atlante sono state poi moltiplicate con questo fattore per misurare le coordinate effettive utilizzate per praticare il foro. Nell'esempio precedente, le coordinate antero-posteriore (AP) e mediale-laterale (ML) risultanti sarebbero rispettivamente 0,55 e 1,1 mm (cioè 1,1 x 0,5 o 1 mm). - Usa un trapano elettrico per fare un foro a queste coordinate: 0,5 mm posteriormente al bregma e 1 mm lateralmente alla linea mediana verso destra.
NOTA: Durante la perforazione del foro nel cranio, fare attenzione a non rompere la dura madre. Assicurarsi che la punta del trapano sia sterile. Può essere collocato con altri strumenti nella stessa busta per autoclave per la sterilizzazione. - Inserire un emostatico sotto la pelle incisa e spingerlo nel punto in cui verrà impiantata la minipompa osmotica. Aprire e chiudere delicatamente l'emostatico per creare una tasca per la minipompa.
- Utilizzare un emostatico sterile per prelevare una minipompa osmotica innescata dalla punta del modulatore di flusso. Spingere la pompa attraverso la pelle incisa nella tasca.
NOTA: Fare attenzione a non lasciare che la pompa e la cannula tocchino superfici non sterili. - Applicare un po 'di colla sul lato inferiore della cannula e fissarla nel supporto della cannula. Abbassare lentamente la cannula attraverso il foro praticato ventrale di 2 mm sulla superficie del cranio. Lasciarlo lì per almeno 5 minuti per consentire alla colla di solidificarsi.
- Prima di inserire la cannula nel cervello, assicurarsi che la cannula non sia ostruita e che la soluzione scorra correttamente.
NOTA: A volte, il glucosio può depositarsi sulla punta della cannula a causa di una portata molto bassa, bloccando il flusso. - Con l'aiuto di una forbice, agganciare la parte superiore della cannula assicurandosi che non si stacchi dalla superficie del cranio.
- Coprire la cannula con uno strato di cemento dentale per un supporto extra.
- Utilizzare suture di nylon (dimensioni 5-0 e 30 pollici di lunghezza) per chiudere la ferita e applicare antibiotici topici sulla ferita per prevenire l'infezione.
- Spegnere l'isoflurano e lasciare che l'animale si riprenda dall'anestesia. Quindi, trasferire l'animale in una nuova gabbia pulita.
- Assistenza post-operatoria
- Dopo l'intervento chirurgico, monitorare il mouse per almeno 1 settimana.
- Somministrare 5 mg/kg di carprofen per via sottocutanea, una volta ogni 24 ore per tre giorni dopo l'intervento.
- Lasciare che la ferita guarisca completamente prima di rimuovere le suture 7-10 giorni dopo l'intervento.
NOTA: È stato osservato che i topi con alto livello di glucosio nel liquido cerebrospinale impiegavano più tempo a guarire. Tagliare le unghie sulle zampe posteriori del topo riduce al minimo la possibilità di lesioni al sito dell'incisione a causa del comportamento graffiante dei topi.
3. Sostituzione delle minipompe
NOTA: Poiché le minipompe utilizzate in questo studio durano solo 4 settimane, la sostituzione delle minipompe è stata testata anche per prolungare la durata dell'infusione di glucosio, come potrebbe essere richiesto nel caso di studi a lungo termine. Ciò ha comportato i seguenti passaggi.
- Preparare i topi per la chirurgia come descritto sopra.
- Fare una piccola incisione verticale di 1 cm nella pelle leggermente sopra la pompa.
- Inserire un emostato sotto la pelle incisa ed estrarre la pompa.
- Rimuovere la pompa dal tubo e collegare una nuova pompa innescata al tubo.
- Inserire nuovamente la pompa all'interno e cucire la pelle.
- Seguire le stesse istruzioni di cura post-operatoria come descritto sopra.
4. Procedura di raccolta dei QCS
- Preparazione
- Tirare capillari di vetro di 1 mm di diametro con un estrattore di micropipette per ottenere punte da 0,5 mm di diametro. Le impostazioni sono: calore = 800, trazione = 15, velocità = 5 e tempo = 200 unità. Mettere i capillari tirati in una scatola sterile fino all'uso.
- Collegare un ago da 27 G a una siringa da 1 ml. Inserire il capillare tirato sull'ago e utilizzare un piccolo nastro adesivo per fissare la connessione.
- Fissare saldamente la siringa in un supporto capillare di un micromanipolatore.
- Quindi, preparare il topo per la chirurgia, come descritto nella procedura pre-operatoria sopra.
- Procedura chirurgica
- Posizionare il mouse sulla cornice stereotassica. Dopo aver fissato la testa sul telaio, come descritto in precedenza, ruotare le manopole per inclinare la testa in modo che il naso sia rivolto verso il basso. Applicare teli sterili per fissare l'area chirurgica.
- Fai una piccola incisione sulla superficie dorsale, partendo dal piano intra-uditivo fino al lato caudale.
NOTA: Fare attenzione a non danneggiare il tubo durante l'incisione. - Rimuovere il supporto dal corpo del mouse e lasciare riposare il mouse verticalmente in modo che il collo sia completamente esteso dorsalmente.
- Con l'aiuto di una pinza smussata curva, taglia delicatamente in due i muscoli posteriori del collo dalla linea mediana per creare una piccola finestra. Quindi, utilizzare un applicatore di punta di cotone bagnato per spostare delicatamente i muscoli del collo dalla linea mediana alla periferia.
- Osservare se la cisterna magna è esposta, che appare come una finestra triangolare con una membrana dura trasparente.
- Posizionare il gruppo micromanipolatore sul telaio stereotassico accanto al mouse assicurandosi che la punta capillare non tocchi alcuna superficie.
- Rompere delicatamente la punta capillare senza disturbare la configurazione.
- Mentre si guarda nella lente d'ingrandimento (ingrandimento di 2,25x), ruotare le manopole corrispondenti sul micromanipolatore per allineare lentamente e spostare la punta capillare verso la cisterna magna.
- Una certa resistenza si avverte una volta che la punta capillare tocca la membrana della cisterna magna. Spingere molto lentamente la punta contro la membrana con l'aiuto delle manopole.
NOTA: Fare attenzione a non danneggiare i vasi sanguigni nella membrana. Questo passaggio è molto importante per evitare qualsiasi contaminazione del sangue nel liquido cerebrospinale. - Forare molto delicatamente la membrana. Il liquido cerebrospinale inizierà a fluire nel capillare in una sola volta a causa della pressione negativa nel capillare.
- Lasciare la configurazione per alcuni minuti fino a quando ~ 10 μL di CSF non vengono raccolti nel capillare.
- Quindi, estrarre lentamente il capillare dalla cisterna magna e premere delicatamente un applicatore sterile a punta di cotone contro l'apertura della cisterna magna per fermare la perdita di liquido cerebrospinale.
- Rimuovere con cautela il capillare dalla siringa e collegarlo a un distributore di lampadine a microcap. Premere il bulbo per trasferire il liquido cerebrospinale in una provetta sterile per microcentrifuga.
- Posizionare un supporto sotto il mouse e ruotare le manopole stereotassiche per livellare la testa.
- Chiudere la ferita con punti di sutura in nylon.
- Iniettare 300 μL di soluzione salina sterile per via sottocutanea prima di rimuovere il topo dall'apparecchio.
- Dare cure post-operatorie agli animali come descritto sopra, fino al momento di rimuovere le suture - ~ 7-10 giorni dopo l'intervento chirurgico.
5. Dosaggio del glucosio
- Seguire il protocollo come descritto nel kit di analisi colorimetrica del glucosio.
- Diluire la soluzione tampone fosfato di sodio fornita nel kit fino a 50 mM di concentrazione in acqua ultrapura.
- Preparare gli standard di glucosio in intervalli 0, 2,5, 5, 7,5, 10, 15, 20, 25 e 50 mg / dL dalla soluzione madre da 1.000 mg / dL fornita nel kit in soluzione tampone diluita.
- Preparare una diluizione di 7 volte dei campioni di CSF nel tampone. Ad esempio, se il volume totale del CSF raccolto è di 10 μL, il volume diluito di sette volte sarà di 70 μL.
- Pipettare 15 μL di glucosio standard e CSF diluito in duplicati in una piastra da 96 pozzetti.
- Pipettare 85 μL di tampone diluito in ciascuno dei pozzetti con standard e CSF.
- Aggiungere 6 mL di tampone diluito al flaconcino della miscela enzimatica calorimetrica del glucosio e vortire per alcuni secondi per miscelare accuratamente.
- Aggiungere 100 μL della preparazione della miscela enzimatica a ciascun pozzetto per avviare la reazione.
- Sigillare la piastra con un foglio di copertura e picchiettare delicatamente sulla piastra per miscelare i reagenti.
- Posizionare la piastra in un'incubatrice a 37 °C per 10 minuti. Le fiale con alto contenuto di glucosio iniziano a diventare immediatamente viola.
- Dopo 10 minuti, rimuovere il coperchio e misurare l'assorbanza a 500-520 nm utilizzando un lettore di piastre.
- Calcolare la concentrazione di glucosio nei campioni di CSF interpolando i loro valori dalla curva standard.
6. Saggio della glicemia
- Fai un piccolo nick laterale alla coda del topo usando una lama di rasoio e usa una goccia di sangue per misurare la glicemia con un glucometro, secondo le istruzioni del manuale.
Risultati
I topi maschi sono stati impiantati con una cannula assemblata a una minipompa osmotica (Figura 1) per infondere cronicamente aCSF o una soluzione di glucosio al 50% nei loro ventricoli laterali (Figura 2). Il liquido cerebrospinale è stato raccolto 10 giorni dopo l'intervento chirurgico (Figura 3) per convalidare l'efficacia di questa procedura. I risultati hanno mostrato un aumento dei livelli di glucosio nel liquido cerebrospinale (media: 327,7 mg / dL) nei topi infusi con glucosio al 50% rispetto a quello (media: 56,5 mg / dL) nei topi infusi con aCSF. Questo è circa un aumento di sei volte dei livelli di glucosio nel CSF nei topi sperimentali rispetto ai loro compagni di controllo (Figura 4A). I livelli di glucosio nel sangue non erano diversi tra i gruppi (Figura 4B).
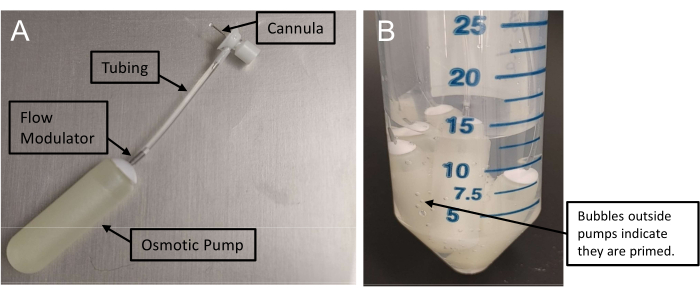
Figura 1: Assemblaggio di minipompe osmotiche . (A) Gruppo infusione con una cannula collegata ad una minipompa tramite tubi. Queste pompe richiedono almeno 48 ore per l'innesco. (B) La presenza di bolle d'aria all'esterno delle minipompe conferma l'adescamento. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Apparecchi stereotassici e accessori. (A,B) Apparecchiature stereotassiche con un micromanipolatore collegato e altri accessori. (C) Coordinate del foro di bava per inserire la cannula. (D) Impianto della mini pompa osmotica, (E,F) Inserimento della cannula nel foro praticato. Mantenere le condizioni asettiche durante l'intervento chirurgico. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Procedura di raccolta del liquido cerebrospinale (CSF). (A) I muscoli dorsali del collo sono stati delicatamente spostati con una pinza smussata per esporre la cisterna magna. Un capillare di 1 mm con una punta di 0,5 mm di diametro è stato utilizzato per (B) rompere e (C,D) raccogliere CSF dalla cisterna magna. Fare clic qui per visualizzare una versione ingrandita di questa figura.
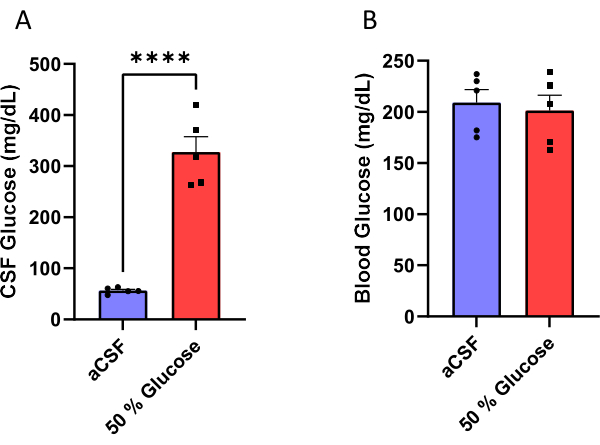
Figura 4: Misurazione del glucosio. (A) Aumento del glucosio nel liquido cerebrospinale (B) senza influire sui livelli di glucosio nel sangue non a digiuno nei topi infusi con soluzione di glucosio al 50% nel ventricolo laterale. L'efficacia di questo protocollo è stata convalidata misurando il liquido cerebrospinale e la concentrazione di glucosio nel sangue 10 giorni dopo l'inizio dell'infusione di glucosio. I topi infusi con una soluzione di glucosio al 50% avevano livelli di glucosio nel liquido cerebrospinale di 327,7 ± 30,1 mg / dL (errore medio ± standard della media) rispetto ai topi che hanno ricevuto infusione artificiale di CSF che avevano livelli di glucosio di 56,5 ± 2,6 mg / dL. p < 0,0001, test t spaiato. Le barre di errore rappresentano l'errore standard della media (n = 5). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Questo articolo riporta un protocollo dettagliato per aumentare il glucosio nel liquido cerebrospinale nei topi utilizzando minipompe osmotiche collegate a una cannula impiantata nel ventricolo laterale. L'infusione cronica di glucosio nel cervello del topo attraverso questa procedura sarà utile per delineare gli effetti dell'iperglicorrichia a lungo termine sulla cognizione, sul metabolismo sistemico del glucosio e sul bilancio energetico e per una migliore comprensione della patogenesi delle complicanze del diabete.
Il diabete cronico provoca danni cerebrali che interrompono la comunicazione tra il cervello e gli organi periferici15. Il diabete aumenta anche il rischio di malattie neurodegenerative, tra cui il morbo di Alzheimer 3,4. Il diabete di tipo 1 indotto da streptozotocina (STZ) è stato il modello standard di roditori nella ricerca sul diabete16; STZ danneggia le cellule β nel pancreas, portando a patologia simile al diabete di tipo 1. Inoltre, in una versione modificata, l'uso di STZ accompagnato da nicotinamidi può indurre il diabete di tipo 2. Un altro modo per sviluppare fenotipi simili al diabete di tipo 2 negli animali è attraverso l'alimentazione con una dieta ricca di grassi16. Tuttavia, nel contesto dello studio dell'effetto dell'iperglicemia sulla funzione cerebrale, queste tecniche sono limitate nel controllo di un gran numero di fattori (ad esempio, i livelli periferici di insulina / glucagone e la funzione metabolica in generale). Pertanto, qualsiasi effetto del diabete indotto da STZ sulla funzione cerebrale può essere interpretato solo come una complicanza associata, invece di individuare un singolo fattore eziologico. L'iniezione acuta o l'infusione cronica di sostanze nello spazio cerebroventricolare è una tecnica spesso utilizzata per testare i loro effetti diretti sulla funzione cerebrale. L'iniezione intracerebroventricolare (ICV) di STZ è stata utilizzata per sviluppare un modello di roditore della malattia di Alzheimer, tuttavia, rimane incerto se il danno neurale associato a STZ sia dovuto alla disregolazione nel rilevamento / omeostasi del glucosio o ad altri meccanismi indipendenti, come lo stress ossidativo indotto da STZ e il danno al DNA17.
Le procedure descritte nell'attuale protocollo saranno utili nello sviluppo di modelli di roditori in grado di rispondere a domande di ricerca, come se un aumento della concentrazione di glucosio nel CSF possa causare deterioramento cognitivo. Il protocollo qui descritto potrebbe essere utilizzato per determinare gli effetti diretti di alti livelli di glucosio nel liquido cerebrospinale sull'ipotalamo e sull'ippocampo, tra le altre regioni del cervello coinvolte nel rilevamento dei nutrienti, nel metabolismo e / o nella cognizione. Questo metodo chiarirebbe anche se un aumento dei livelli di glucosio nel CSF influisce sulla sensibilità all'insulina, sulla secrezione di insulina, sull'assunzione di cibo e / o sul bilancio energetico al basale e in risposta agli insulti metabolici. Inoltre, il protocollo qui riportato sarebbe applicabile nelle ipotesi di test che richiedono studi longitudinali. Ad esempio, i dati potrebbero essere raccolti prima, durante e alla fine delle infusioni di glucosio per confrontare i risultati degli stessi animali in momenti diversi. Tale strategia affronterebbe se le complicanze derivanti da un alto livello di glucosio nel CSF sono reversibili dopo il ripristino del normale livello di glucosio nel CSF. Al contrario, il metodo potrebbe essere utilizzato anche per studi che generano ipotesi. Ad esempio, il liquido cerebrospinale potrebbe essere raccolto dagli stessi animali in momenti diversi e sottoposto ad analisi metabolomiche o proteomiche per identificare biomarcatori o eventuali insulti metabolici prodotti da alti livelli di glucosio nel liquido cerebrospinale. Allo stesso modo, diverse regioni del cervello potrebbero essere analizzate dalla trascrittomica spaziale per produrre informazioni specifiche delle cellule che potrebbero essere state alterate da un alto glucosio nel liquido cerebrospinale.
Il razionale per l'infusione di aCSF privo di glucosio a un gruppo fittizio era quello di mantenere la concentrazione di glucosio nel CSF al livello basale, in modo che qualsiasi cambiamento nel livello di glucosio CSF indotto dall'impianto di cannula potesse essere naturalmente controllato. I risultati di questo studio hanno mostrato che il gruppo sham aveva una concentrazione di glucosio nel CSF di ~ 60 mg / dL (~ 3 mM), che è nel normale intervallo di glucosio CSF nei topi18. I livelli di glucosio nel liquido cerebrospinale osservati negli individui con diabete di tipo 2 sono ~ 110 mg / dL o ~ 6 mM9. Nel presente studio, l'infusione ICV del 50% di glucosio ad una velocità di 125μg / h ha elevato i livelli di glucosio nel CSF a ~ 300 mg / dL (16 mM), che è soprafisiologico19. Sebbene questo livello sovrafisiologico di glucosio nel liquido cerebrospinale possa non essere clinicamente rilevante per i livelli osservati negli individui con diabete di tipo 2, i risultati presentati in questo studio mostrano che l'infusione di glucosio nel liquido cerebrospinale può indurre un aumento cronico della concentrazione di glucosio nel liquido cerebrospinale nei topi.
Il metodo qui presentato presenta alcune limitazioni. Si tratta di una sofisticata chirurgia del cervello di topo che richiede formazione, abilità ed esperienza pertinenti nell'esecuzione di tali procedure avanzate. Poiché il catetere e le minipompe vengono impiantati a lungo termine, è necessaria una cura meticolosa dei topi durante lo studio per monitorare problemi di salute o danni all'assemblaggio del catetere. È stata scelta una concentrazione di glucosio del 50% perché la viscosità di una soluzione oltre questa concentrazione potrebbe aver influenzato l'infusione di glucosio nei ventricoli. Le minipompe utilizzate in questo protocollo avevano una portata di 0,25 μL / h, quindi il gruppo di topi con infusione di glucosio al 50% ha ricevuto glucosio ad una velocità di 125 μg / h, o 3 mg di glucosio al giorno. Questa dose di glucosio per unità di tempo era quindi limitata dalla portata delle minipompe.
In sintesi, questo articolo riporta un metodo convalidato per l'aumento cronico del glucosio nel liquido cerebrospinale nei topi. Le informazioni ottenute da questo modello saranno utili per determinare se o come un aumento dei livelli di glucosio nel CSF è coinvolto nel mediare le complicanze associate al diabete, come i disturbi neurodegenerativi, o causare insulti metabolici periferici nel diabete e nell'obesità.
Risoluzione dei problemi
Se il tubo si stacca dalla cannula nei mouse, è possibile applicare una piccola quantità di colla sulla connessione cannula-tubo durante il montaggio della minipompa. Se i punti si staccano e la cannula diventa visibile, l'area di incisione può essere completamente chiusa utilizzando punti di sutura o graffette. Le unghie delle zampe posteriori del topo devono essere tagliate, in modo che vi sia una minore possibilità di graffiare l'area chirurgica da parte del mouse. Inoltre, fai attenzione a non legare le suture così strette che la pelle si strappa, poiché i topi hanno la pelle delicata.
Per un rapido recupero dopo la raccolta del liquido cerebrospinale, si raccomanda l'iniezione di 300 μL di soluzione salina sterile per via sottocutanea dopo l'intervento chirurgico. Inoltre, è importante mantenere il volume massimo di raccolta del liquido cerebrospinale a 10 μL.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Il National Institutes of Health concede DK124619 a KHC.
Premio per i fondi di avviamento e la ricerca pilota, Dipartimento di Medicina, Università di Rochester, NY, a KHC.
Il Del Monte Institute for Neuroscience Pilot Research Award, Università di Rochester, a KHC.
Premio per la ricerca universitaria, Ufficio del vicepresidente per la ricerca, Università di Rochester, NY, a KHC.
MUR ha progettato ed eseguito il metodo, analizzato i risultati, preparato grafici e figure e scritto e modificato il manoscritto. KHC ha concepito e supervisionato lo studio, analizzato i risultati e scritto e modificato il manoscritto. KHC è il garante di questo lavoro. Tutti gli autori hanno approvato la versione finale del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Membrane solutions | SFPES030022S | |
| 1 mL sterile Syringe (Luer-lok tip) | BD | 309628 | |
| 1 mL TB syringe | BD | 309659 | |
| 100 mL Glass beaker | Fisher | N/a | |
| 100% Ethanol (Koptec) | DLI | UN170 | Use 70% dilution to clean the surgery area |
| 50 mL conical tube | Fisher | N/A | |
| Allignment indicator | KOPF | 1905 | |
| Alzet brain infusion kit | DURECT | Kit # 3; 0008851 | Cut tubing in the kit to 1 inch length |
| Alzet osmotic pump | DURECT | 2004 | Flow rate 0.25 µL/h |
| Anesthesia system | Kent Scientific | SomnoSuite | |
| Betadine solution | Avrio Health | N/A | |
| CaCl2 . 2H2O | Fisher | C79-500 | |
| Cannula holder | KOPF | 1966 | |
| Centering scope | KOPF | 1915 | |
| Dental Cement Liquid | Lang Dental | REF1404 | |
| Dental cement Powder | Lang Dental | REF1220-C | |
| D-glucose | Sigma | G8270 | |
| Electric drill | KOPF | 1911 | While drilling a hole avoid rupturing dura mater |
| Eye lubricant (Optixcare) | CLC Medica | N/A | |
| Glass Bead sterilizer (Germinator 500) | VWR | 101326-488 | Place instruments in sterile water to let them cool before surgery |
| Glucose Assay Kit | Cayman chemical | 10009582 | |
| H2O2 | Sigma | H1009-500ml | Apply 3% H2O2 on skull surface to make the cranial sutures visible. |
| Hair Clipper | WAHL | N/A | |
| heating pad | Heatpax | 19520483 | |
| Hemostat | N/A | N/A | |
| Isoflurane (Fluriso) | Zoetis | NDC1385-046-60 | |
| KCl | VWR | 0395-500g | |
| Magnetic stand | WPI | M1 | |
| Magnifying desk lamp | Brightech | LightView Pro Flex 2 | |
| Metal Spatula | N/A | N/A | |
| MgCl2 . 6H2O | Fisher | BP214-500 | |
| Micromanipulator (Right handed) | WPI | M3301R | |
| Micromanipulator with digital display | KOPF | 1940 | |
| Na2HPO4 . 7H2O | Fisher | S373-500 | |
| NaCl | Sigma | S7653-5Kg | |
| NaH2PO4 . H2O | Fisher | S369-500 | |
| Neosporin | Johnson & Johnson | N/A | Apply topical oinment to prevent infection |
| Parafilm | Bemis | DM-999 | |
| Rimadyl (Carprofen) 50mg/ml | Zoetis | N/A | 5 mg/kg, subcutaneous, for analgesia |
| Scalpel | N/A | N/A | |
| Stereotaxic allignment system | KOPF | 1900 | |
| Sterile 27 gauge needle | BD | 305109 | |
| Sterile cotton tip applicators (Solon) | AMD Medicom | 56200 | |
| Sterile nylon sutures (5.0) | Oasis | MV-661 | Use non-absorable suture for closing the wound |
| Sterile sharp scissors | N/A | N/A | |
| Sterile surgical blades | VWR | 55411-050 | |
| Surgical gloves (Nitrile) | Ammex | N/A | Change gloves if there is suspision of contamination |
| Tray | N/A | N/A |
Riferimenti
- Moheet, A., Mangia, S., Seaquist, E. R. Impact of diabetes on cognitive function and brain structure. Annals of the New York Academy of Sciences. 1353, 60-71 (2015).
- Takeda, S., et al. Diabetes-accelerated memory dysfunction via cerebrovascular inflammation and Abeta deposition in an Alzheimer mouse model with diabetes. Proceedings of the National Academy of Sciences. 107 (15), 7036-7041 (2010).
- Arvanitakis, Z., Wilson, R. S., Bienias, J. L., Evans, D. A., Bennett, D. A. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function. Archives of Neurology. 61 (5), 661-666 (2004).
- Zilliox, L. A., Chadrasekaran, K., Kwan, J. Y., Russell, J. W. Diabetes and cognitive impairment. Current Diabetes Reports. 16 (9), 87(2016).
- Reno, C. M., Litvin, M., Clark, A. L., Fisher, S. J. Defective counterregulation and hypoglycemia unawareness in diabetes: mechanisms and emerging treatments. Endocrinology and Metabolism Clinics of North America. 42 (1), 15-38 (2013).
- Cryer, P. E., Davis, S. N., Shamoon, H. Hypoglycemia in diabetes. Diabetes Care. 26 (6), 1902-1912 (2003).
- Hwang, J. J., et al. Hypoglycemia unawareness in type 1 diabetes suppresses brain responses to hypoglycemia. The Journal of Clinical Investigation. 128 (4), 1485-1495 (2018).
- Cryer, P. E., Gerich, J. E. Glucose counterregulation, hypoglycemia, and intensive insulin therapy in diabetes mellitus. The New England Journal of Medicine. 313 (4), 232-241 (1985).
- Tigchelaar, C., et al. Elevated cerebrospinal fluid glucose levels and diabetes mellitus are associated with activation of the neurotoxic polyol pathway. Diabetologia. 65 (7), 1098-1107 (2022).
- Zheng, H., et al. Cognitive decline in type 2 diabetic db/db mice may be associated with brain region-specific metabolic disorders. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (1), 266-273 (2017).
- Ernst, A., et al. Diabetic db/db mice exhibit central nervous system and peripheral molecular alterations as seen in neurological disorders. Translational Psychiatry. 3 (5), 263(2013).
- Wang, Y., Yang, Y., Liu, Y., Guo, A., Zhang, Y. Cognitive impairments in type 1 diabetes mellitus model mice are associated with synaptic protein disorders. Neuroscience Letters. 777, 136587(2022).
- Jolivalt, C. G., et al. Type 1 diabetes exaggerates features of Alzheimer's disease in APP transgenic mice. Experimental Neurology. 223 (2), 422-431 (2010).
- Paxinos, G., Franklin, K. B. J. Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , Academic Press. (2019).
- Vinik, A. I., Maser, R. E., Mitchell, B. D., Freeman, R. Diabetic autonomic neuropathy. Diabetes Care. 26 (5), 1553-1579 (2003).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), 78(2021).
- Grieb, P. Intracerebroventricular streptozotocin injections as a model of Alzheimer's disease: in search of a relevant mechanism. Molecular Neurobiology. 53 (3), 1741-1752 (2016).
- Kealy, J., et al. Acute inflammation alters brain energy metabolism in mice and humans: role in suppressed spontaneous activity, impaired cognition, and delirium. The Journal of Neuroscience. 40 (29), 5681-5696 (2020).
- Dougherty, J. M., Roth, R. M. Cerebral spinal fluid. Emergency Medicine Clinics of North America. 4 (2), 281-297 (1986).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon