Method Article
زرع مضخة صغيرة تناضحية لزيادة تركيز الجلوكوز في السائل النخاعي للفأر
In This Article
Summary
توضح هذه المقالة بروتوكولا مفصلا لزيادة تركيز الجلوكوز في السائل النخاعي (CSF) للفئران. يمكن أن يكون هذا النهج مفيدا لدراسة آثار ارتفاع الجلوكوز CSF على التنكس العصبي والإدراك واستقلاب الجلوكوز المحيطي في الفئران.
Abstract
يزيد مرض السكري من خطر التدهور المعرفي ويضعف وظائف المخ. ما إذا كانت هذه العلاقة بين ارتفاع الجلوكوز والعجز المعرفي سببية أم لا تظل بعيدة المنال. علاوة على ذلك ، من غير الواضح أيضا ما إذا كان هذا العجز يتم بوساطة زيادة مستويات الجلوكوز في السائل النخاعي (CSF) و / أو الدم. هناك عدد قليل جدا من الدراسات التي تبحث في الآثار المباشرة لارتفاع مستويات الجلوكوز CSF على وظيفة الجهاز العصبي المركزي (CNS) ، وخاصة على التعلم والذاكرة ، لأن نماذج مرض السكري الحالية ليست متطورة بما فيه الكفاية لمعالجة مثل هذه الأسئلة البحثية. توضح هذه المقالة طريقة لزيادة مستويات الجلوكوز CSF بشكل مزمن لمدة 4 أسابيع عن طريق ضخ الجلوكوز باستمرار في البطين الجانبي باستخدام مضخات صغيرة تناضحية في الفئران. تم التحقق من صحة البروتوكول عن طريق قياس مستويات الجلوكوز في السائل الدماغي الشوكي. زاد هذا البروتوكول من مستويات الجلوكوز CSF إلى ~ 328 مجم / ديسيلتر بعد ضخ محلول جلوكوز بنسبة 50٪ بمعدل تدفق 0.25 ميكرولتر / ساعة ، مقارنة بتركيز الجلوكوز CSF ~ 56 مجم / ديسيلتر في الفئران التي تلقت السائل النخاعي الاصطناعي (aCSF). علاوة على ذلك ، لم يؤثر هذا البروتوكول على مستويات الجلوكوز في الدم. لذلك ، يمكن استخدام هذه الطريقة لتحديد الآثار المباشرة لارتفاع الجلوكوز CSF على وظائف المخ أو مسار عصبي معين بشكل مستقل عن التغيرات في مستويات الجلوكوز في الدم. بشكل عام ، سيسهل النهج الموصوف هنا تطوير نماذج حيوانية لاختبار دور الجلوكوز CSF المرتفع في التوسط في سمات مرض الزهايمر و / أو الاضطرابات العصبية التنكسية الأخرى المرتبطة بمرض السكري.
Introduction
كل من مرض السكري من النوع 1 والنوع 2 يضعف وظائف المخ1،2،3. على سبيل المثال ، يزيد مرض السكري من خطر التدهور المعرفي والاضطرابات التنكسية العصبية ، بما في ذلك مرض الزهايمر 3,4. علاوة على ذلك ، يعاني مرضى السكري من خلل في استشعار الجلوكوز في الدماغ 5,6. يساهم هذا العيب في التسبب في نقص السكر في الدم المرتبط بعدم الوعي وعدم كفاية الاستجابة المضادة للتنظيم لنقص السكر في الدم 7,8 ، والتي يمكن أن تكون قاتلة إذا لم يتم علاجها على الفور.
بالنظر إلى أن مرض السكري يزيد من مستويات الجلوكوز في الدم وكذلك في السائل النخاعي (CSF)9 ، من المهم تحديد ما إذا كان أحد هذين العاملين أو كليهما يساهم في ضعف وظائف المخ. ما إذا كان مرض السكري يسبب تلفا في الدماغ بسبب ارتفاع نسبة الجلوكوز CSF بمفرده أو بالاشتراك مع عوامل أخرى مثل نقص الأنسولين أو مقاومة الأنسولين هو أيضا سؤال مفتوح. تظهر النماذج الحيوانية لمرض السكري من النوع 1 والنوع 2 تدهورا معرفيا وانحطاطا عصبيا بالإضافة إلى توازن الطاقة المتأثر واستقلاب الجلوكوز المحيطي10،11،12،13. ومع ذلك ، من هذه النماذج ، ليس من الممكن فصل التأثيرات الانتقائية لارتفاع الجلوكوز CSF مقابل مستويات الجلوكوز في الدم في التوسط في مضاعفات مرض السكري على وظائف المخ.
يصف هذا البروتوكول طرقا لتطوير نموذج فأر لفرط سكر الدم لاختبار آثار مستويات الجلوكوز CSF المرتفعة بشكل مزمن على وظائف المخ وتوازن الطاقة وتوازن الجلوكوز. يقدم نموذج الفأر الذي تم تطويره من خلال هذه التقنية أداة للدراسات التي تبحث في الدور المسبب لتوازن الجلوكوز غير المنظم على الوظيفة العصبية والسلوكية.
لذلك ، سيكون النهج المقترح مفيدا في فهم الآثار المباشرة لمستويات الجلوكوز CSF المرتفعة في مختلف الحالات الفيزيولوجية المرضية.
Protocol
تمت الموافقة على جميع إجراءات الفئران من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات في جامعة روتشستر وتم تنفيذها وفقا لإرشادات خدمة الصحة العامة الأمريكية للرعاية الإنسانية واستخدام التجارب. تم الحصول على ذكور الفئران C57BL / 6J البالغة من العمر ستة أسابيع المستخدمة في هذه الدراسة تجاريا. تم إيواء جميع الحيوانات بشكل جماعي (5 فئران لكل قفص) في غرفة ذات دورة نهارية / ليلية مدتها 12 ساعة وتم منحهم إمكانية الوصول إلى الطعام والماء حسب الحاجة. بعد أن تم زرع الفئران بقنية لحقن الجلوكوز في البطين الجانبي ، تم إيواؤها بشكل فردي لمنع أي ضرر للزرع من الفئران الأخرى.
1. تجميع المضخات الصغيرة التناضحية
- تحضير السائل النخاعي الاصطناعي (aCSF) وفقا للبروتوكول التالي. قم بإذابة كلوريد الصوديوم (8.66 جم) ، KCl (0.224 جم) ، CaCl 2.2H 2 O (0.206 جم) ، و MgCl 2.6H 2 O (0.163 جم) في 500 مل من الماء المعقم لتحضير المحلول A. قم بإذابة Na 2 HPO 4.7H 2 O (0.214 جم) و NaH 2 PO4. H2O (0.027 جم) في 500 مل من الماء المعقم لتحضير المحلول ب. بعد ذلك ، امزج المحلول A و B بنسبة 1: 1 لتحضير aCSF.
ملاحظة: لا تحتوي هذه التركيبة من aCSF على الجلوكوز. - لتحضير محلول الجلوكوز بنسبة 50٪، أضف 50 g من الجلوكوز إلى 50 mL من السائل الدماغي الشوكي في كأس زجاجية. ضع الدورق على طبق ساخن وارفع درجة حرارة المعلق إلى 60 درجة مئوية. امزج التعليق مع محرك مغناطيسي حتى يذوب الجلوكوز تماما.
- أضف السائل الدماغي الشوكي إلى الكأس الزجاجية ليصبح الحجم النهائي 100 mL. مرر المحلول من خلال مرشح المسام 0.22 ميكرومتر لتعقيمه.
- قم بإعداد محلول ملحي بنسبة 0.9٪ (NaCl) وقم بتمرير المحلول عبر مرشح 0.22 ميكرومتر.
- ضع جميع مكونات المضخة الصغيرة ومجموعة التسريب في صينية معقمة واقطع الأنبوب من مجموعة ضخ الدماغ إلى 1 بوصة بطول مقص معقم. امسك الأنبوب بمرقئ معقم وادفعه أعلى أحد طرفي القنية. قم بتوصيل الطرف الآخر من الأنبوب بالجانب العلوي من معدل التدفق. قم بتغطية طرفي الأنبوب بكمية صغيرة من الغراء للحصول على اتصال أقوى.
- قم بتوصيل إبرة 27 جم بحقنة سعة 1 مل واملأها إما بالسائل الدماغي النخاعي أو محلول الجلوكوز. أدخل إبرة 27 G في قطعة صغيرة من الأنابيب. بعد ذلك ، قم بتوصيل الأنبوب بالطرف المفتوح لمعدل التدفق واملأه بالمحلول المقابل حتى تبدأ قطرات المحلول في الخروج من القنية. قم بإزالة أي فقاعات هواء محاصرة في الأنبوب.
- لملء المضخة الصغيرة ، أمسك المضخة في وضع مستقيم وأدخل إبرة المحقنة في المضخة. املأه بالمحلول المقابل حتى تبدأ قطرة من المحلول في التكون عند فتح المضخة الصغيرة.
- أدخل معدل التدفق ببطء في المضخة مع التأكد من عدم إدخال أي فقاعات هواء في التجميع.
- بعد تجميع المضخات الصغيرة التناضحية ، قم بنقلها إلى أنبوب مخروطي سعة 50 مل. املأ الأنبوب بالمحلول الملحي المعقم بحيث يتم غمر المضخات بالكامل ، مع التأكد من بقاء القنية خارج المحلول الملحي. يمكن وضع أربع مضخات مجمعة في أنبوب واحد سعة 50 مل.
- ضع الغطاء بشكل غير محكم على كل أنبوب واحتضن المضخات عند 37 درجة مئوية للتجهيز لمدة 48 ساعة على الأقل.
2. جراحة لزرع المضخات التناضحية
- إجراء ما قبل الجراحة
- تعقيم الأدوات الجراحية في الأوتوكلاف والسماح لها تبرد لمدة 30 دقيقة على الأقل قبل الاستخدام. تتضمن ظروف الأوتوكلاف التعقيم بالبخار عند 121 درجة مئوية لمدة 30 دقيقة.
- تطهير منطقة الجراحة بنسبة 70٪ من الإيثانول. امسح المقابض وقضبان الأذن وسطح الإطار المجسم.
ملاحظة: يجب إجراء الجراحة في بيئة معقمة ، مع الأخذ في الاعتبار تجنب لمس الأسطح غير المعقمة أثناء إجراء الجراحة. استبدل القفازات إذا كان هناك اشتباه في التلوث. - ضع الفأر في غرفة التخدير لتخديره ب 3٪ إيزوفلوران ممزوج بالهواء لمدة 3-5 دقائق. ثم أخرج الماوس من الحجرة وضعه على ستارة معقمة. الحفاظ على التخدير عن طريق مخروط الأنف بنسبة 1.5٪ -2٪.
- قرصة مخلب الماوس الخلفي لمراقبة أي رد فعل والتحقق من عمق التخدير.
- يحقن 5 ملغ/ كغ كاربروفين تحت الجلد للتسكين.
- استخدم كليبرز نظيفة لقص منطقة الجراحة على رأس الفأر. فرك فروة الرأس أولا بمحلول البوفيدون اليود ثم بمسحات الكحول جيدا لمدة 2 دقيقة على الأقل. كرر هذه العملية ثلاث مرات على الأقل.
- ضع مزلق للعين لمنع جفاف العينين أثناء الجراحة.
- جراحة
- ضع الماوس على الإطار التجسيمي وتناسب الرأس على شريط القاطعة. تغطية الأنف مع مخروط الأنف. ضع ستائر معقمة لتأمين منطقة الجراحة.
- تحويل تدفق isoflurane إلى مخروط الأنف. الاستمرار في الحفاظ على التخدير في 1.5 ٪ -2 ٪ إيزوفلوران.
- ضع وسادة تدفئة تحت الماوس للحفاظ على درجة حرارة الجسم.
- ارتد قفازات معقمة جديدة ، وباستخدام مشرط ، قم بعمل شق في خط الوسط (~ 10-15 مم) على فروة الرأس. كشف سطح الجمجمة بملعقة أثناء استخدام أطراف القطن لمسح أي نزيف.
ملاحظة: استخدم الكي إذا كان النزيف بغزارة ، وهو أمر نادر الحدوث. - فرك مع طرف القطن مغموسة في 3 ٪ بيروكسيد الهيدروجين لفضح الغرز الجمجمة.
- لاحظ bregma و lambda للتنقل في إحداثيات الجمجمة. اضبط جميع الإحداثيات على الصفر عند bregma.
ملاحظة: تم الحصول على هذه الإحداثيات من أطلس دماغالفأر 14. المسافة المرجعية bregma-lambda في الأطلس هي 4.21 ملم. لتصحيح الاختلافات القائمة على العمر والجنس في حجم الجمجمة ، تم قياس مسافة bregma-lambda لكل فأر ثم قسمتها على 4.21 مم للحصول على عامل الضرب. على سبيل المثال ، إذا كانت المسافة بين bregma و lambda 4.65 مم ، فإن القسمة على 4.21 مم أعطت عامل ضرب 1.10. ثم تم ضرب جميع الإحداثيات التي تم الحصول عليها من الأطلس مع هذا العامل لقياس الإحداثيات الفعلية التي تم استخدامها لحفر الحفرة. في المثال أعلاه ، ستكون الإحداثيات الأمامية الخلفية (AP) والإنسية الجانبية (ML) الناتجة 0.55 و 1.1 مم ، على التوالي (أي 1.1 × 0.5 أو 1 مم). - استخدم مثقابا كهربائيا لعمل ثقب في هذه الإحداثيات: 0.5 مم من الخلف إلى bregma و 1 مم من الجانبي إلى خط الوسط باتجاه اليمين.
ملاحظة: أثناء حفر الثقب في الجمجمة ، احرص على عدم تمزق الأم الجافية. تأكد من أن مثقاب الحفر معقم. يمكن وضعها مع أدوات أخرى في نفس كيس الأوتوكلاف للتعقيم. - أدخل مرقئا تحت الجلد المقطوع وادفعه إلى المكان الذي سيتم فيه زرع المضخة الصغيرة التناضحية. افتح وأغلق المرقئ برفق لعمل جيب للمضخة الصغيرة.
- استخدم مرقئ معقم لاختيار مضخة صغيرة تناضحية معدة من طرف معدل التدفق. ادفع المضخة عبر الجلد المقطوع إلى الجيب.
ملاحظة: احرص على عدم ترك المضخة والقنية تلمس أي سطح غير معقم. - ضع بعض الغراء على الجانب السفلي من القنية وقم بتثبيته في حامل القنية. خفض القنية ببطء من خلال ثقب حفر 2 مم البطني إلى سطح الجمجمة. اتركه هناك لمدة 5 دقائق على الأقل للسماح للغراء بالتصلب.
- قبل إدخال القنية في الدماغ ، تأكد من عدم انسداد القنية وأن المحلول يتدفق بشكل صحيح.
ملاحظة: في بعض الأحيان ، قد يترسب الجلوكوز عند طرف القنية بسبب معدل التدفق المنخفض للغاية ، مما يمنع التدفق. - بمساعدة مقص ، قم بقص الجزء العلوي من القنية للتأكد من أنها لا تزيح من سطح الجمجمة.
- قم بتغطية القنية بطبقة من الأسمنت السني للحصول على دعم إضافي.
- استخدم خيوط النايلون (حجم 5-0 وطول 30 بوصة) لإغلاق الجرح وتطبيق مضاد حيوي موضعي على الجرح لمنع العدوى.
- قم بإيقاف تشغيل الأيزوفلوران ودع الحيوان يتعافى من التخدير. ثم ، نقل الحيوان إلى قفص نظيف جديد.
- رعاية ما بعد الجراحة
- بعد الجراحة ، راقب الماوس لمدة 1 أسبوع على الأقل.
- تطبيق 5 ملغ/ كغ كاربروفين تحت الجلد، مرة كل 24 ساعة لمدة ثلاثة أيام بعد الجراحة.
- دع الجرح يلتئم تماما قبل إزالة الغرز بعد 7-10 أيام من الجراحة.
ملاحظة: لوحظ أن الفئران التي تحتوي على نسبة عالية من الجلوكوز CSF استغرقت وقتا أطول للشفاء. يقلل تقليم الأظافر على الكفوف الخلفية للفأر من فرصة إصابة موقع الشق بسبب سلوك خدش الفئران.
3. استبدال المضخات الصغيرة
ملاحظة: نظرا لأن المضخات الصغيرة المستخدمة في هذه الدراسة تستمر لمدة 4 أسابيع فقط ، فقد تم اختبار استبدال المضخات الصغيرة أيضا لإطالة مدة ضخ الجلوكوز ، حيث قد يكون ذلك مطلوبا في حالة الدراسات طويلة الأجل. وشمل ذلك الخطوات التالية.
- تحضير الفئران للجراحة كما هو مفصل أعلاه.
- قم بعمل شق عمودي صغير 1 سم في الجلد أعلى قليلا من المضخة.
- أدخل مرقئ تحت الجلد الشق واسحب المضخة للخارج.
- قم بإزالة المضخة من الأنبوب وقم بتوصيل مضخة معدة جديدة بالأنبوب.
- أدخل المضخة مرة أخرى في الداخل وقم بخياطة الجلد.
- اتبع نفس تعليمات الرعاية بعد الجراحة كما هو موضح أعلاه.
4. إجراءات جمع السائل الدماغي النخاعي
- اعداد
- اسحب الشعيرات الدموية الزجاجية بقطر 1 مم باستخدام آلة مجتذبة ماصة للحصول على أطراف قطرها 0.5 مم. الإعدادات هي: الحرارة = 800 ، السحب = 15 ، السرعة = 5 ، والوقت = 200 وحدة. ضع الشعيرات الدموية المسحوبة في صندوق معقم حتى الاستخدام.
- قم بتوصيل إبرة 27 جم بحقنة سعة 1 مل. أدخل الشعيرات الدموية المسحوبة على الإبرة واستخدم شريطا لاصقا صغيرا لتأمين الاتصال.
- إصلاح بحزم حقنة في حامل الشعرية من micromanipulator.
- بعد ذلك ، قم بإعداد الماوس للجراحة ، كما هو موضح في إجراء ما قبل الجراحة أعلاه.
- الإجراء الجراحي
- ضع الماوس على الإطار المجسم. بعد تثبيت الرأس على الإطار ، كما هو موضح سابقا ، قم بتدوير المقابض لإمالة الرأس بحيث يكون الأنف متجها لأسفل. ضع ستائر معقمة لتأمين منطقة الجراحة.
- قم بعمل شق صغير على السطح الظهري ، بدءا من المستوى داخل السمع إلى الجانب الذيلي.
ملاحظة: احرص على عدم إتلاف الأنبوب أثناء إجراء الشق. - قم بإزالة الدعم من جسم الماوس واترك الماوس يرتاح عموديا بحيث يتم تمديد الرقبة بالكامل ظهريا.
- بمساعدة ملقط حاد منحني ، قم بتقسيم عضلات الرقبة الخلفية برفق من خط الوسط لإنشاء نافذة صغيرة. بعد ذلك ، استخدم أداة وضع طرف قطني مبلل لإزاحة عضلات الرقبة برفق من منتصف الخط إلى المحيط.
- لاحظ ما إذا كانت الصهريج ماجنا مكشوفة ، والتي تظهر كنافذة مثلثة مع غشاء جافية شفاف.
- ضع مجموعة micromanipulator على الإطار التجسيمي بجوار الماوس مع التأكد من أن الطرف الشعري لا يلمس أي سطح.
- كسر طرف الشعيرات الدموية برفق دون الإخلال بالإعداد.
- أثناء النظر إلى العدسة المكبرة (تكبير 2.25x) ، قم بتدوير المقابض المقابلة على micromanipulator لمحاذاة وتحريك الطرف الشعري ببطء نحو cisterna magna.
- يتم الشعور ببعض المقاومة بمجرد أن يلامس الطرف الشعري غشاء الصهريج الكبير. ببطء شديد دفع الطرف ضد الغشاء بمساعدة المقابض.
ملاحظة: احرص على عدم إتلاف أي أوعية دموية في الغشاء. هذه الخطوة مهمة جدا لتجنب أي تلوث للدم في السائل الدماغي النخاعي. - اخترق الغشاء بلطف شديد. سيبدأ السائل الدماغي النخاعي بالتدفق إلى الشعيرات الدموية مرة واحدة بسبب الضغط السلبي في الشعيرات الدموية.
- اترك الإعداد لبضع دقائق حتى يتم جمع ~ 10 ميكرولتر من السائل الدماغي النخاعي في الشعيرات الدموية.
- بعد ذلك ، اسحب الشعيرات الدموية ببطء من الصهريج ماجنا واضغط برفق على قضيب طرف قطني معقم مقابل فتحة الصهريج ماجنا لوقف تسرب السائل الدماغي النخاعي.
- قم بإزالة الشعيرات الدموية بعناية من المحقنة وإرفاقها بموزع لمبة microcap. اضغط على المصباح لنقل السائل الدماغي النخاعي إلى أنبوب طرد مركزي دقيق معقم.
- ضع دعامة تحت الماوس وقم بتدوير المقابض المجسمة لتسوية الرأس.
- أغلق الجرح بخيوط النايلون.
- حقن 300 ميكرولتر من المحلول الملحي المعقم تحت الجلد قبل إزالة الماوس من الجهاز.
- إعطاء الرعاية بعد الجراحة للحيوانات كما هو موضح أعلاه ، حتى يحين الوقت لإزالة الغرز - ~ 7-10 أيام بعد الجراحة.
5. فحص الجلوكوز
- اتبع البروتوكول كما هو موضح في مجموعة مقايسة قياس الجلوكوز اللوني.
- قم بتخفيف محلول مخزون فوسفات الصوديوم الموفر في المجموعة إلى تركيز 50 مللي متر في الماء فائق النقاء.
- تحضير معايير الجلوكوز في 0 و 2.5 و 5 و 7.5 و 10 و 15 و 20 و 25 و 50 مجم / ديسيلتر يتراوح من محلول مخزون 1000 مجم / ديسيلتر المتوفر في المجموعة في محلول عازل مخفف.
- قم بإعداد تخفيف 7 أضعاف لعينات السائل الدماغي النخاعي في المخزن المؤقت. على سبيل المثال ، إذا كان إجمالي حجم CSF الذي تم جمعه هو 10 ميكرولتر ، فإن الحجم المخفف سبعة أضعاف سيكون 70 ميكرولتر.
- ماصة 15 ميكرولتر من معايير الجلوكوز والسائل الدماغي النخاعي المخفف في نسختين في لوحة 96 بئر.
- ماصة 85 ميكرولتر من المخزن المؤقت المخفف في كل من الآبار مع المعايير و CSF.
- أضف 6 مل من المخزن المؤقت المخفف إلى قارورة خليط إنزيم الجلوكوز المسعر ودوامة لبضع ثوان حتى تمتزج جيدا.
- أضف 100 ميكرولتر من تحضير خليط الإنزيم إلى كل بئر لبدء التفاعل.
- أغلق اللوحة بورقة غطاء واضغط على اللوحة برفق لخلط الكواشف.
- ضع الطبق في حاضنة على حرارة 37 درجة مئوية لمدة 10 دقائق. تبدأ القوارير التي تحتوي على نسبة عالية من الجلوكوز في التحول إلى اللون البنفسجي على الفور.
- بعد 10 دقائق ، قم بإزالة الغطاء وقياس الامتصاص عند 500-520 نانومتر باستخدام قارئ الألواح.
- احسب تركيز الجلوكوز في عينات السائل الدماغي الشوكي عن طريق استيفاء قيمها من المنحنى القياسي.
6. فحص الجلوكوز في الدم
- اصنع شقا جانبيا صغيرا على ذيل الفأر باستخدام شفرة حلاقة واستخدم قطرة دم لقياس نسبة الجلوكوز في الدم باستخدام جهاز قياس السكر ، وفقا للتعليمات اليدوية.
النتائج
تم زرع ذكور الفئران بقنية مجمعة في مضخة صغيرة تناضحية (الشكل 1) لتسريب السائل الدماغي الشوكي المزمن أو محلول جلوكوز بنسبة 50٪ في البطينين الجانبيين (الشكل 2). تم جمع السائل الدماغي الشوكي بعد 10 أيام من الجراحة (الشكل 3) للتحقق من فعالية هذا الإجراء. أظهرت النتائج زيادة في مستويات الجلوكوز CSF (يعني: 327.7 مجم / ديسيلتر) في الفئران التي تم ضخها بنسبة 50٪ من الجلوكوز مقارنة بتلك (المتوسطة: 56.5 مجم / ديسيلتر) في الفئران التي تم حقنها ب aCSF. هذا هو حوالي ستة أضعاف زيادة في مستويات الجلوكوز CSF في الفئران التجريبية مقارنة مع زملائهم في القمامة السيطرة (الشكل 4A). لم تكن مستويات الجلوكوز في الدم مختلفة بين المجموعات (الشكل 4 ب).
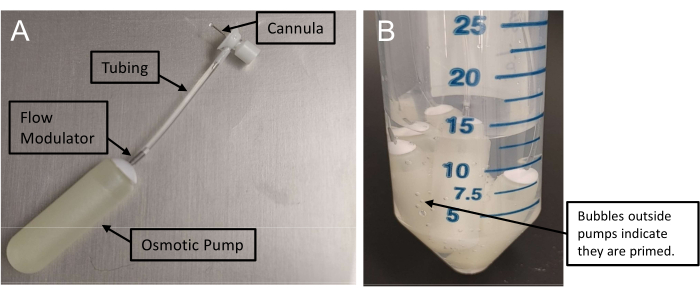
الشكل 1: تجميع المضخات الصغيرة التناضحية. أ: تجميع التسريب بقنية متصلة بمضخة صغيرة عبر أنبوب. تتطلب هذه المضخات 48 ساعة على الأقل للتجهيز. (ب) وجود فقاعات هواء خارج المضخات الصغيرة يؤكد التحضير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: جهاز التجسيم وملحقاته . (أ ، ب) معدات مجسمة مع معالج دقيق متصل وملحقات أخرى. (ج) إحداثيات ثقب الأزيز لإدخال القنية. (د) زرع مضخة صغيرة تناضحية ، (E ، F) إدخال القنية في الحفرة المحفورة. الحفاظ على الظروف المعقمة طوال الجراحة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: إجراء جمع السائل الدماغي الشوكي (CSF). (أ) أزاحت عضلات الرقبة الظهرية برفق باستخدام ملقط غير حاد لكشف الصهريج الكبير. تم استخدام شعيرات دموية 1 مم مع طرف قطره 0.5 مم ل (B) تمزق و (C ، D) جمع CSF من الصهريج الكبير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
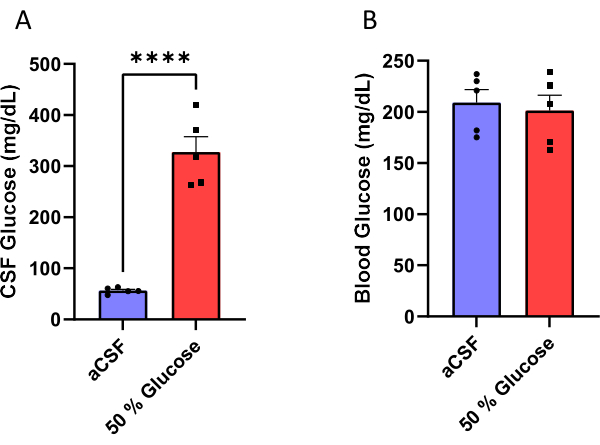
الشكل 4: قياس الجلوكوز. أ: زيادة الجلوكوز CSF (ب) دون التأثير على مستويات الجلوكوز في الدم غير الصائم في الفئران التي تم ضخها بمحلول جلوكوز بنسبة 50٪ في البطين الجانبي. تم التحقق من فعالية هذا البروتوكول عن طريق قياس السائل الدماغي الشوكي وتركيز الجلوكوز في الدم بعد 10 أيام من بدء ضخ الجلوكوز. كان لدى الفئران التي تم حقنها بمحلول الجلوكوز بنسبة 50٪ مستويات جلوكوز CSF تبلغ 327.7 ± 30.1 مجم / ديسيلتر (متوسط ± خطأ معياري للمتوسط) مقارنة بالفئران التي تلقت تسريب السائل الدماغي النخاعي الاصطناعي الذي كان لديه مستويات جلوكوز 56.5 ± 2.6 مجم / ديسيلتر. P < 0.0001 ، اختبار t غير مزاوج. تمثل أشرطة الخطأ الخطأ القياسي للمتوسط (n = 5). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تقدم هذه المقالة تقريرا عن بروتوكول مفصل لزيادة جلوكوز السائل الدماغي النخاعي في الفئران باستخدام مضخات صغيرة تناضحية متصلة بقنية مزروعة في البطين الجانبي. سيكون التسريب المزمن للجلوكوز في دماغ الفأر من خلال هذا الإجراء مفيدا في تحديد آثار ارتفاع السكر على المدى الطويل على الإدراك ، واستقلاب الجلوكوز الجهازي ، وتوازن الطاقة ولفهم أفضل للتسبب في مضاعفات مرض السكري.
يسبب مرض السكري المزمن تلفا في الدماغ يقطع الاتصال بين الدماغ والأعضاء الطرفية15. يزيد مرض السكري أيضا من خطر الإصابة بالأمراض التنكسية العصبية ، بما في ذلك مرض الزهايمر 3,4. كان مرض السكري من النوع 1 الناجم عن الستربتوزوتوسين (STZ) هو نموذج القوارض القياسي في أبحاث مرض السكري16 ؛ STZ يدمر الخلايا β في البنكرياس ، مما يؤدي إلى أمراض تشبه مرض السكري من النوع 1. علاوة على ذلك ، في نسخة معدلة ، يمكن أن يؤدي استخدام STZ مصحوبا بالنيكوتيناميد إلى الإصابة بمرض السكري من النوع 2. هناك طريقة أخرى لتطوير الأنماط الظاهرية الشبيهة بمرض السكري من النوع 2 في الحيوانات وهي من خلال إطعامهم نظاما غذائيا عالي الدهون16. ومع ذلك ، في سياق دراسة تأثير ارتفاع السكر في الدم على وظائف المخ ، فإن هذه التقنيات محدودة في التحكم في عدد كبير من العوامل (على سبيل المثال ، مستويات الأنسولين / الجلوكاجون المحيطية ، ووظيفة التمثيل الغذائي بشكل عام). وبالتالي ، لا يمكن تفسير أي تأثير لمرض السكري الناجم عن STZ على وظائف المخ إلا على أنه مضاعفات مرتبطة ، بدلا من تحديد عامل مسبب واحد. الحقن الحاد أو التسريب المزمن للمواد في الفضاء الدماغي البطيني هو تقنية تستخدم غالبا لاختبار آثارها المباشرة على وظائف المخ. تم استخدام حقن بطانة الرحم البطينية (ICV) من STZ لتطوير نموذج القوارض لمرض الزهايمر ، ومع ذلك ، لا يزال من غير المؤكد ما إذا كان الضرر العصبي المرتبط ب STZ ناتجا عن خلل التنظيم في استشعار الجلوكوز / التوازن أو آليات مستقلة أخرى ، مثل الإجهاد التأكسدي الناجم عن STZ وتلف الحمض النووي17.
ستكون الإجراءات الموضحة في البروتوكول الحالي مفيدة في تطوير نماذج القوارض التي يمكن أن تجيب على أسئلة البحث ، مثل ما إذا كانت الزيادة في تركيز الجلوكوز CSF يمكن أن تسبب ضعفا إدراكيا. يمكن استخدام البروتوكول الموصوف هنا في تحديد الآثار المباشرة لارتفاع مستويات الجلوكوز في السائل الدماغي النخاعي على منطقة ما تحت المهاد والحصين ، من بين مناطق الدماغ الأخرى المشاركة في استشعار المغذيات والتمثيل الغذائي و / أو الإدراك. ستوضح هذه الطريقة أيضا ما إذا كانت الزيادة في مستويات الجلوكوز CSF تؤثر على حساسية الأنسولين ، وإفراز الأنسولين ، وتناول الطعام ، و / أو توازن الطاقة عند خط الأساس واستجابة للإهانات الأيضية. علاوة على ذلك ، سيكون البروتوكول المذكور هنا قابلا للتطبيق في اختبار الفرضيات التي تتطلب دراسات طولية. على سبيل المثال ، يمكن جمع البيانات قبل وأثناء وفي نهاية ضخ الجلوكوز لمقارنة النتائج من نفس الحيوانات في أوقات مختلفة. ستعالج هذه الاستراتيجية ما إذا كانت المضاعفات الناشئة عن ارتفاع مستوى الجلوكوز في السائل الدماغي الشوكي يمكن عكسها بعد استعادة مستوى الجلوكوز الطبيعي في السائل الدماغي النخاعي. في المقابل ، يمكن أيضا استخدام الطريقة للدراسات المولدة للفرضيات. على سبيل المثال ، يمكن جمع السائل الدماغي الشوكي من نفس الحيوانات في أوقات مختلفة وإخضاعه لتحليل الأيض أو البروتينات لتحديد المؤشرات الحيوية أو أي إهانات أيضية ناتجة عن ارتفاع مستوى الجلوكوز CSF. وبالمثل ، يمكن تحليل مناطق مختلفة من الدماغ بواسطة النسخ المكاني لإنتاج معلومات خاصة بالخلايا ربما تكون قد تغيرت بسبب ارتفاع نسبة الجلوكوز في السائل الدماغي الشوكي.
كان الأساس المنطقي لغرس السائل الدماغي الشوكي الخالي من الجلوكوز في مجموعة وهمية هو الحفاظ على تركيز الجلوكوز CSF عند مستوى خط الأساس ، بحيث يمكن التحكم بشكل طبيعي في أي تغيير في مستوى الجلوكوز CSF الناجم عن زرع القنية. أظهرت النتائج في هذه الدراسة أن المجموعة الوهمية كان لديها تركيز جلوكوز CSF ~ 60 مجم / ديسيلتر (~ 3 mM) ، وهو في نطاق الجلوكوز CSF الطبيعي في الفئران18. مستويات الجلوكوز CSF التي لوحظت في الأفراد المصابين بداء السكري من النوع 2 هي ~ 110 ملغ / ديسيلتر أو ~ 6 mM9. في الدراسة الحالية ، أدى ضخ ICV بنسبة 50٪ من الجلوكوز بمعدل 125 ميكروغرام / ساعة إلى رفع مستويات الجلوكوز CSF إلى ~ 300 مجم / ديسيلتر (16 مللي مول) ، وهو فوقالفسيولوجي 19. على الرغم من أن هذا المستوى فوق الفسيولوجي من الجلوكوز CSF قد لا يكون ذا صلة سريريا بالمستويات التي لوحظت في الأفراد المصابين بداء السكري من النوع 2 ، إلا أن النتائج المقدمة في هذه الدراسة تظهر أن ضخ الجلوكوز في السائل الدماغي الشوكي يمكن أن يؤدي إلى ارتفاع مزمن في تركيز الجلوكوز CSF في الفئران.
الطريقة المعروضة هنا لها بعض القيود. إنه ينطوي على جراحة دماغ فأر متطورة تتطلب التدريب والمهارات والخبرة ذات الصلة في تنفيذ مثل هذه الإجراءات المتقدمة. نظرا لأن القسطرة والمضخات الصغيرة يتم زرعها على المدى الطويل ، فإن الرعاية الدقيقة للفئران طوال فترة الدراسة ضرورية لمراقبة المخاوف الصحية أو تلف مجموعة القسطرة. اختير تركيز الجلوكوز بنسبة 50٪؛ لأن لزوجة محلول يتجاوز هذا التركيز ربما أثرت على ضخ الجلوكوز إلى البطينين. كان للمضخات الصغيرة المستخدمة في هذا البروتوكول معدل تدفق 0.25 ميكرولتر / ساعة ، لذلك تلقت مجموعة الفئران التي تحتوي على ضخ الجلوكوز بنسبة 50٪ الجلوكوز بمعدل 125 ميكروغرام / ساعة ، أو 3 ملغ من الجلوكوز يوميا. لذلك كانت هذه الجرعة من الجلوكوز لكل وحدة زمنية محدودة بمعدل تدفق المضخات الصغيرة.
باختصار ، تشير هذه المقالة إلى طريقة تم التحقق من صحتها للزيادة المزمنة في جلوكوز السائل الدماغي النخاعي في الفئران. ستكون المعلومات التي تم الحصول عليها من هذا النموذج مفيدة في تحديد ما إذا كانت الزيادة في مستويات الجلوكوز في السائل الدماغي الشوكي تشارك في التوسط في المضاعفات المرتبطة بمرض السكري ، مثل الاضطرابات التنكسية العصبية ، أو التسبب في إهانات التمثيل الغذائي المحيطي في مرض السكري والسمنة.
استكشاف الاخطاء
إذا خرج الأنبوب من القنية في الفئران ، فيمكن وضع كمية صغيرة من الغراء على وصلة أنابيب القنية أثناء تجميع المضخة الصغيرة. إذا خرجت الغرز وأصبحت القنية مرئية ، يمكن إغلاق منطقة الشق تماما باستخدام الغرز أو الدبابيس. يجب تقليم الأظافر من الكفوف الخلفية للماوس ، بحيث يكون هناك احتمال أقل لخدش منطقة الجراحة بواسطة الماوس. علاوة على ذلك ، احرص على عدم ربط الغرز بإحكام بحيث يتمزق الجلد ، لأن الفئران لديها بشرة حساسة.
للتعافي السريع بعد جمع السائل الدماغي الشوكي ، يوصى بحقن 300 ميكرولتر من المحلول الملحي المعقم تحت الجلد بعد الجراحة. علاوة على ذلك ، من المهم أيضا الحفاظ على الحد الأقصى لحجم مجموعة السائل الدماغي النخاعي إلى 10 ميكرولتر.
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح.
Acknowledgements
تمنح المعاهد الوطنية للصحة DK124619 إلى شركة المملكة القابضة.
صناديق بدء التشغيل وجائزة البحوث التجريبية، قسم الطب، جامعة روتشستر، نيويورك، إلى شركة المملكة القابضة.
جائزة معهد دل مونتي للبحوث التجريبية لعلم الأعصاب، جامعة روتشستر، إلى شركة المملكة القابضة.
جائزة البحوث الجامعية، مكتب نائب الرئيس للأبحاث، جامعة روتشستر، نيويورك، إلى شركة المملكة القابضة.
قامت MUR بتصميم وتنفيذ الطريقة ، وتحليل النتائج ، وإعداد الرسوم البيانية والأشكال ، وكتابة المخطوطة وتحريرها. قامت شركة المملكة القابضة بوضع تصور الدراسة والإشراف عليها، وتحليل النتائج، وكتابة المخطوطة وتحريرها. شركة المملكة القابضة هي الضامن لهذا العمل. وافق جميع المؤلفين على النسخة النهائية من المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Membrane solutions | SFPES030022S | |
| 1 mL sterile Syringe (Luer-lok tip) | BD | 309628 | |
| 1 mL TB syringe | BD | 309659 | |
| 100 mL Glass beaker | Fisher | N/a | |
| 100% Ethanol (Koptec) | DLI | UN170 | Use 70% dilution to clean the surgery area |
| 50 mL conical tube | Fisher | N/A | |
| Allignment indicator | KOPF | 1905 | |
| Alzet brain infusion kit | DURECT | Kit # 3; 0008851 | Cut tubing in the kit to 1 inch length |
| Alzet osmotic pump | DURECT | 2004 | Flow rate 0.25 µL/h |
| Anesthesia system | Kent Scientific | SomnoSuite | |
| Betadine solution | Avrio Health | N/A | |
| CaCl2 . 2H2O | Fisher | C79-500 | |
| Cannula holder | KOPF | 1966 | |
| Centering scope | KOPF | 1915 | |
| Dental Cement Liquid | Lang Dental | REF1404 | |
| Dental cement Powder | Lang Dental | REF1220-C | |
| D-glucose | Sigma | G8270 | |
| Electric drill | KOPF | 1911 | While drilling a hole avoid rupturing dura mater |
| Eye lubricant (Optixcare) | CLC Medica | N/A | |
| Glass Bead sterilizer (Germinator 500) | VWR | 101326-488 | Place instruments in sterile water to let them cool before surgery |
| Glucose Assay Kit | Cayman chemical | 10009582 | |
| H2O2 | Sigma | H1009-500ml | Apply 3% H2O2 on skull surface to make the cranial sutures visible. |
| Hair Clipper | WAHL | N/A | |
| heating pad | Heatpax | 19520483 | |
| Hemostat | N/A | N/A | |
| Isoflurane (Fluriso) | Zoetis | NDC1385-046-60 | |
| KCl | VWR | 0395-500g | |
| Magnetic stand | WPI | M1 | |
| Magnifying desk lamp | Brightech | LightView Pro Flex 2 | |
| Metal Spatula | N/A | N/A | |
| MgCl2 . 6H2O | Fisher | BP214-500 | |
| Micromanipulator (Right handed) | WPI | M3301R | |
| Micromanipulator with digital display | KOPF | 1940 | |
| Na2HPO4 . 7H2O | Fisher | S373-500 | |
| NaCl | Sigma | S7653-5Kg | |
| NaH2PO4 . H2O | Fisher | S369-500 | |
| Neosporin | Johnson & Johnson | N/A | Apply topical oinment to prevent infection |
| Parafilm | Bemis | DM-999 | |
| Rimadyl (Carprofen) 50mg/ml | Zoetis | N/A | 5 mg/kg, subcutaneous, for analgesia |
| Scalpel | N/A | N/A | |
| Stereotaxic allignment system | KOPF | 1900 | |
| Sterile 27 gauge needle | BD | 305109 | |
| Sterile cotton tip applicators (Solon) | AMD Medicom | 56200 | |
| Sterile nylon sutures (5.0) | Oasis | MV-661 | Use non-absorable suture for closing the wound |
| Sterile sharp scissors | N/A | N/A | |
| Sterile surgical blades | VWR | 55411-050 | |
| Surgical gloves (Nitrile) | Ammex | N/A | Change gloves if there is suspision of contamination |
| Tray | N/A | N/A |
References
- Moheet, A., Mangia, S., Seaquist, E. R. Impact of diabetes on cognitive function and brain structure. Annals of the New York Academy of Sciences. 1353, 60-71 (2015).
- Takeda, S., et al. Diabetes-accelerated memory dysfunction via cerebrovascular inflammation and Abeta deposition in an Alzheimer mouse model with diabetes. Proceedings of the National Academy of Sciences. 107 (15), 7036-7041 (2010).
- Arvanitakis, Z., Wilson, R. S., Bienias, J. L., Evans, D. A., Bennett, D. A. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function. Archives of Neurology. 61 (5), 661-666 (2004).
- Zilliox, L. A., Chadrasekaran, K., Kwan, J. Y., Russell, J. W. Diabetes and cognitive impairment. Current Diabetes Reports. 16 (9), 87(2016).
- Reno, C. M., Litvin, M., Clark, A. L., Fisher, S. J. Defective counterregulation and hypoglycemia unawareness in diabetes: mechanisms and emerging treatments. Endocrinology and Metabolism Clinics of North America. 42 (1), 15-38 (2013).
- Cryer, P. E., Davis, S. N., Shamoon, H. Hypoglycemia in diabetes. Diabetes Care. 26 (6), 1902-1912 (2003).
- Hwang, J. J., et al. Hypoglycemia unawareness in type 1 diabetes suppresses brain responses to hypoglycemia. The Journal of Clinical Investigation. 128 (4), 1485-1495 (2018).
- Cryer, P. E., Gerich, J. E. Glucose counterregulation, hypoglycemia, and intensive insulin therapy in diabetes mellitus. The New England Journal of Medicine. 313 (4), 232-241 (1985).
- Tigchelaar, C., et al. Elevated cerebrospinal fluid glucose levels and diabetes mellitus are associated with activation of the neurotoxic polyol pathway. Diabetologia. 65 (7), 1098-1107 (2022).
- Zheng, H., et al. Cognitive decline in type 2 diabetic db/db mice may be associated with brain region-specific metabolic disorders. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (1), 266-273 (2017).
- Ernst, A., et al. Diabetic db/db mice exhibit central nervous system and peripheral molecular alterations as seen in neurological disorders. Translational Psychiatry. 3 (5), 263(2013).
- Wang, Y., Yang, Y., Liu, Y., Guo, A., Zhang, Y. Cognitive impairments in type 1 diabetes mellitus model mice are associated with synaptic protein disorders. Neuroscience Letters. 777, 136587(2022).
- Jolivalt, C. G., et al. Type 1 diabetes exaggerates features of Alzheimer's disease in APP transgenic mice. Experimental Neurology. 223 (2), 422-431 (2010).
- Paxinos, G., Franklin, K. B. J. Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , Academic Press. (2019).
- Vinik, A. I., Maser, R. E., Mitchell, B. D., Freeman, R. Diabetic autonomic neuropathy. Diabetes Care. 26 (5), 1553-1579 (2003).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), 78(2021).
- Grieb, P. Intracerebroventricular streptozotocin injections as a model of Alzheimer's disease: in search of a relevant mechanism. Molecular Neurobiology. 53 (3), 1741-1752 (2016).
- Kealy, J., et al. Acute inflammation alters brain energy metabolism in mice and humans: role in suppressed spontaneous activity, impaired cognition, and delirium. The Journal of Neuroscience. 40 (29), 5681-5696 (2020).
- Dougherty, J. M., Roth, R. M. Cerebral spinal fluid. Emergency Medicine Clinics of North America. 4 (2), 281-297 (1986).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved