Method Article
Implante de Minibomba Osmótica para Aumento da Concentração de Glicose no Líquido Cefalor de Camundongos
Neste Artigo
Resumo
Este artigo descreve um protocolo detalhado para aumentar a concentração de glicose no líquido cefalorraquidiano (LCR) de camundongos. Esta abordagem pode ser útil para estudar os efeitos da glicose elevada no LCR sobre a neurodegeneração, cognição e metabolismo periférico da glicose em camundongos.
Resumo
O diabetes aumenta o risco de declínio cognitivo e prejudica a função cerebral. Se essa relação entre glicose alta e déficits cognitivos é causal ou não, permanece indefinido. Além disso, também não está claro se esses déficits são mediados por um aumento nos níveis de glicose no líquido cefalorraquidiano (LCR) e/ou no sangue. Há poucos estudos investigando os efeitos diretos dos altos níveis de glicose no LCR sobre a função do sistema nervoso central (SNC), especialmente sobre a aprendizagem e a memória, uma vez que os modelos atuais de diabetes não estão suficientemente desenvolvidos para abordar tais questões de pesquisa. Este artigo descreve um método para aumentar cronicamente os níveis de glicose no LCR por 4 semanas por meio da infusão contínua de glicose no ventrículo lateral usando minibombas osmóticas em camundongos. O protocolo foi validado medindo-se os níveis glicêmicos no LCR. Esse protocolo aumentou os níveis de glicose no LCR para ~328 mg/dL após a infusão de uma solução de glicose a 50% a uma taxa de fluxo de 0,25 μL/h, em comparação com uma concentração de glicose no LCR de ~56 mg/dL em camundongos que receberam líquido cefalorraquidiano artificial (LCRa). Além disso, esse protocolo não afetou os níveis glicêmicos. Portanto, este método pode ser usado para determinar os efeitos diretos da glicose elevada no LCR sobre a função cerebral ou uma via neural específica, independentemente de alterações nos níveis de glicose no sangue. Em geral, a abordagem descrita aqui facilitará o desenvolvimento de modelos animais para testar o papel da glicose elevada no LCR na mediação de características da doença de Alzheimer e/ou outras doenças neurodegenerativas associadas ao diabetes.
Introdução
Tanto o diabetes tipo 1 quanto o tipo 2 prejudicam a função cerebral 1,2,3. Por exemplo, o diabetes aumenta o risco de declínio cognitivo e doenças neurodegenerativas, incluindo a doença de Alzheimer 3,4. Além disso, pessoas com diabetes apresentam sensibilidade cerebral defeituosa de glicose 5,6. Esse defeito contribui para a patogênese da hipoglicemia associada ao desconhecimento e a uma resposta contra-regulatória insuficiente à hipoglicemia7,8, que pode ser fatal se não tratada imediatamente.
Considerando que o diabetes aumenta os níveis de glicose no sangue, bem como no líquido cefalorraquidiano (LCR)9, é importante determinar se um ou ambos os fatores contribuem para o comprometimento da função cerebral. Se o diabetes causa danos cerebrais por glicose elevada no LCR sozinho ou em combinação com outros fatores, como deficiência de insulina ou resistência à insulina, também é uma questão em aberto. Modelos animais de diabetes tipo 1 e tipo 2 apresentam declínio cognitivo e neurodegeneração, além de comprometimento do balanço energético e do metabolismo periférico da glicose10,11,12,13. No entanto, a partir desses modelos, não é viável desacoplar os efeitos seletivos da glicose no LCR versus os níveis glicêmicos na mediação das complicações do diabetes na função cerebral.
Este protocolo descreve métodos para desenvolver um modelo de hiperglicorraquia em camundongos para testar os efeitos de níveis cronicamente altos de glicose no LCR sobre a função cerebral, balanço energético e homeostase da glicose. O modelo murino desenvolvido através desta técnica apresenta uma ferramenta para estudos que investigam o papel etiológico da homeostase desregulada da glicose na função neural e comportamental.
Portanto, a abordagem proposta será útil na compreensão dos efeitos diretos dos níveis elevados de glicose no LCR em várias condições fisiopatológicas.
Protocolo
Todos os procedimentos em camundongos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Rochester e foram realizados de acordo com as diretrizes do Serviço de Saúde Pública dos EUA para o cuidado humano e uso de animais de experimentação. Camundongos machos C57BL/6J com seis semanas de idade utilizados para este estudo foram obtidos comercialmente. Todos os animais foram alojados em grupo (5 camundongos por gaiola) em uma sala com ciclo dia/noite de 12 h e tiveram acesso a ração e água ad libitum. Depois que os camundongos foram implantados com uma cânula para infusão de glicose no ventrículo lateral, eles foram alojados individualmente para evitar qualquer dano aos implantes de outros camundongos.
1. Montagem de minibombas osmóticas
- Preparar o líquido cefalorraquidiano artificial (LCRa) de acordo com o seguinte protocolo. Dissolver NaCl (8,66 g), KCl (0,224 g), CaCl 2,2H 2 O (0,206 g) e MgCl2,6H 2 O (0,163 g) em 500 mL de água estéril para preparar a solução A. Dissolver Na 2 HPO 4,7H 2 O (0,214 g) e NaH2 PO4. H2O (0,027 g) em 500 mL de água estéril para preparar a solução B. Em seguida, misture as soluções A e B na proporção de 1:1 para preparar o aCSF.
NOTA: Esta formulação de aCSF não contém glicose. - Para preparar a solução de glicose a 50%, adicione 50 g de glicose a 50 mL de aCSF em um béquer. Coloque o copo numa placa quente e leve a temperatura da suspensão a 60 °C. Misture a suspensão com um agitador magnético até que a glicose esteja completamente dissolvida.
- Adicionar aCSF ao copo para completar o volume final de 100 mL. Passar a solução através do filtro de poros de 0,22 μm para esterilizá-la.
- Preparar uma solução salina a 0,9% (NaCl) e passar a solução através do filtro de 0,22 μm.
- Coloque todos os componentes da minibomba e do kit de infusão em uma bandeja estéril e corte a tubulação do kit de infusão cerebral para 1 polegada de comprimento com uma tesoura estéril. Segure a tubulação com um hemostático estéril e empurre-a na parte superior de uma extremidade da cânula. Conecte a outra extremidade da tubulação ao lado superior do modulador de fluxo. Cubra ambas as extremidades da tubulação com uma pequena quantidade de cola para uma conexão mais forte.
- Ligue uma agulha de 27 G a uma seringa de 1 ml e preencha-a com aCSF ou com a solução de glicose. Insira a agulha de 27 G em um pequeno pedaço de tubo. Em seguida, conecte a tubulação à extremidade aberta do modulador de fluxo e preencha-a com a solução correspondente até que gotas da solução comecem a sair da cânula. Remova todas as bolhas de ar presas na tubulação.
- Para encher a minibomba, segure a bomba na vertical e insira a agulha da seringa na bomba. Encha-o com a solução correspondente até que uma gota da solução comece a se formar na abertura da minibomba.
- Insira lentamente o modulador de fluxo na bomba, certificando-se de não introduzir bolhas de ar no conjunto.
- Após a montagem das minibombas osmóticas, transfira-as para um tubo cônico de 50 mL. Encha o tubo com o soro fisiológico estéril para que as bombas fiquem completamente submersas, certificando-se de que a cânula fique fora da solução salina. Quatro dessas bombas montadas podem ser colocadas em um tubo de 50 mL.
- Coloque a tampa em cada tubo e incube as bombas a 37 °C para prime durante, pelo menos, 48 horas.
2. Cirurgia para implante de bombas osmóticas
- Procedimento pré-operatório
- Esterilizar os instrumentos cirúrgicos em autoclave e deixá-los esfriar por pelo menos 30 minutos antes do uso. As condições de autoclave envolvem esterilização a vapor a 121 °C por 30 min.
- Desinfetar a área cirúrgica com etanol 70%. Limpe os botões, as barras auriculares e a superfície da estrutura estereotáxica.
NOTA: A cirurgia deve ser realizada em um ambiente asséptico, tendo em mente evitar tocar em superfícies não estéreis durante a realização da cirurgia. Substitua as luvas se houver suspeita de contaminação. - Coloque o camundongo em uma câmara de anestesia para anestesiar com isoflurano a 3% misturado ao ar por 3-5 min. Em seguida, retire o rato da câmara e coloque-o sobre um campo estéril. Manter a anestesia através de um cone nasal a 1,5%-2%.
- Aperte a pata traseira do rato para observar qualquer reflexo e verificar a profundidade da anestesia.
- Injetar 5 mg/kg de carprofeno por via subcutânea para analgesia.
- Use cortadores limpos para cortar a área de cirurgia na cabeça do mouse. Esfregue o couro cabeludo primeiro com solução de iodopovidona e, em seguida, com cotonetes de álcool completamente por pelo menos 2 min. Repita esse processo pelo menos três vezes.
- Aplique um lubrificante ocular para evitar que os olhos sequem durante a cirurgia.
- Cirurgia
- Coloque o mouse sobre a armação estereotáxica e encaixe a cabeça na barra do incisivo. Cubra o nariz com o cone do nariz. Aplicar campos estéreis para fixar a área cirúrgica.
- Deslocar o fluxo de isoflurano para o cone nasal. Continuar a manter a anestesia a 1,5%-2% de isoflurano.
- Coloque uma almofada de aquecimento sob o mouse para manter a temperatura corporal.
- Coloque novas luvas estéreis e, com um bisturi, faça uma incisão na linha média (~10-15 mm de comprimento) no couro cabeludo. Exponha a superfície do crânio com uma espátula enquanto usa pontas de algodão para limpar qualquer sangramento.
NOTA: Use um cauterizador se sangrar profusamente, o que é raro. - Esfregue com uma ponta de algodão mergulhada em peróxido de hidrogênio a 3% para expor as suturas cranianas.
- Tome nota de bregma e lambda para navegar pelas coordenadas do crânio. Defina todas as coordenadas como zero no bregma.
NOTA: Estas coordenadas foram obtidas a partir de um atlas cerebral de camundongos14. A distância de referência bregma-lambda no atlas é de 4,21 mm. Para corrigir as diferenças de idade e sexo no tamanho do crânio, a distância bregma-lambda para cada camundongo foi medida e, em seguida, dividida por 4,21 mm para obter um fator de multiplicação. Por exemplo, se a distância entre bregma e lambda foi de 4,65 mm, a divisão por 4,21 mm deu um fator de multiplicação de 1,10. Todas as coordenadas obtidas a partir do atlas foram então multiplicadas com este fator para medir as coordenadas reais que foram usadas para perfurar o furo. No exemplo acima, as coordenadas anteroposterior (AP) e médio-lateral (ML) resultantes seriam de 0,55 e 1,1 mm, respectivamente (ou seja, 1,1 x 0,5 ou 1 mm). - Use uma furadeira elétrica para fazer um furo nestas coordenadas: 0,5 mm posterior ao bregma e 1 mm lateral à linha média em direção à direita.
NOTA: Ao fazer o furo no crânio, tenha cuidado para não romper a dura-máter. Certifique-se de que a broca é estéril. Pode ser colocado com outros instrumentais na mesma bolsa de autoclave para esterilização. - Insira um hemostático sob a pele incisada e empurre-o para o local onde a minibomba osmótica será implantada. Abra e feche suavemente o hemostático para fazer um bolso para a minibomba.
- Use um hemostático estéril para escolher uma minibomba osmótica preparada da ponta do modulador de fluxo. Empurre a bomba através da pele incisada para o bolso.
NOTA: Tenha cuidado para não deixar a bomba e a cânula tocarem em qualquer superfície não estéril. - Aplique um pouco de cola na parte inferior da cânula e fixe-a no suporte da cânula. Abaixe a cânula lentamente através do orifício perfurado 2 mm ventral até a superfície do crânio. Deixe por pelo menos 5 min para que a cola se solidifique.
- Antes de inserir a cânula no cérebro, certifique-se de que a cânula não está entupida e que a solução está fluindo corretamente.
NOTA: Às vezes, a glicose pode se depositar na ponta da cânula devido a uma taxa de fluxo muito baixa, bloqueando o fluxo. - Com a ajuda de uma tesoura, prenda a parte superior da cânula certificando-se de que ela não se desloque da superfície do crânio.
- Cubra a cânula com uma camada de cimento dentário para um suporte extra.
- Use suturas de nylon (tamanho 5-0 e 30 polegadas de comprimento) para fechar a ferida e aplicar antibiótico tópico na ferida para prevenir a infecção.
- Desligue o isoflurano e deixe o animal se recuperar da anestesia. Em seguida, transfira o animal para uma nova gaiola limpa.
- Cuidados pós-cirúrgicos
- Após a cirurgia, monitore o mouse por pelo menos 1 semana.
- Administrar 5 mg/kg de carprofeno por via subcutânea, uma vez a cada 24 horas durante três dias pós-operatórios.
- Deixe a ferida cicatrizar completamente antes de remover as suturas 7-10 dias após a cirurgia.
NOTA: Observou-se que camundongos com glicose no LCR elevada demoraram mais tempo para cicatrizar. O corte de unhas nas patas traseiras de camundongos minimiza a chance de lesão no local da incisão devido ao comportamento de arranhões dos camundongos.
3. Substituição das minibombas
NOTA: Como as minibombas utilizadas neste estudo duram apenas 4 semanas, a substituição das minibombas também foi testada para prolongar a duração da infusão de glicose, pois pode ser necessária no caso de estudos de longo prazo. Isso envolveu as seguintes etapas.
- Prepare os ratos para a cirurgia conforme detalhado acima.
- Faça uma pequena incisão vertical de 1 cm na pele ligeiramente acima da bomba.
- Insira um hemostático sob a pele incisada e puxe a bomba para fora.
- Remova a bomba da tubulação e conecte uma nova bomba preparada à tubulação.
- Insira a bomba de volta para dentro e costurar a pele.
- Siga as mesmas instruções de cuidados pós-operatórios descritas acima.
4. Procedimento de recolha do LCR
- Preparação
- Puxe capilares de vidro de 1 mm de diâmetro com uma máquina extratora de micropipeta para obter pontas de 0,5 mm de diâmetro. As configurações são: calor = 800, tração = 15, velocidade = 5 e tempo = 200 unidades. Coloque os capilares puxados em uma caixa estéril até o uso.
- Ligue uma agulha de 27 G a uma seringa de 1 ml. Insira o capilar puxado na agulha e use uma pequena fita adesiva para fixar a conexão.
- Fixe firmemente a seringa em um suporte capilar de um micromanipulador.
- Em seguida, prepare o mouse para a cirurgia, conforme descrito no procedimento pré-operatório acima.
- Procedimento cirúrgico
- Coloque o mouse sobre o quadro estereotáxico. Depois de fixar a cabeça no quadro, como descrito anteriormente, gire os botões para inclinar a cabeça de modo que o nariz fique voltado para baixo. Aplicar campos estéreis para fixar a área cirúrgica.
- Realizar pequena incisão na face dorsal, iniciando-se do plano intra-aural até o lado caudal.
OBS: Cuidado para não danificar a tubulação durante a incisão. - Remova o suporte do corpo do mouse e deixe o mouse descansar verticalmente para que o pescoço fique totalmente estendido dorsalmente.
- Com a ajuda de pinças rombas curvas, separa suavemente os músculos posteriores do pescoço da linha média para criar uma pequena janela. Em seguida, use um aplicador de ponta de algodão molhado para deslocar suavemente os músculos do pescoço da linha média para a periferia.
- Observe se a cisterna magna está exposta, que aparece como uma janela triangular com uma membrana de dura-máter transparente.
- Coloque o conjunto do micromanipulador na estrutura estereotáxica ao lado do mouse, certificando-se de que a ponta capilar não toque em nenhuma superfície.
- Quebre suavemente a ponta capilar sem atrapalhar o setup.
- Ao olhar para a lupa (ampliação de 2,25x), gire os botões correspondentes no micromanipulador para alinhar lentamente e mover a ponta capilar em direção à cisterna magna.
- Alguma resistência é sentida quando a ponta capilar toca a membrana da cisterna magna. Muito lentamente, empurre a ponta contra a membrana com a ajuda dos botões.
NOTA: Tenha cuidado para não danificar quaisquer vasos sanguíneos na membrana. Este passo é muito importante para evitar qualquer contaminação sanguínea no LCR. - Perfure muito suavemente a membrana. O LCR começará a fluir para o capilar imediatamente devido à pressão negativa no capilar.
- Deixe o setup por alguns minutos até que ~10 μL de LCR sejam coletados no capilar.
- Em seguida, retire lentamente o capilar da cisterna magna e pressione suavemente um aplicador de ponta de algodão estéril contra a abertura da cisterna magna para impedir o vazamento de LCR.
- Retire cuidadosamente o capilar da seringa e fixe-o a um dispensador de bulbo de microtampa. Pressione o bulbo para transferir o LCR para um tubo de microcentrífuga estéril.
- Coloque um suporte sob o mouse e gire os botões estereotáxicos para nivelar a cabeça.
- Feche a ferida com suturas de nylon.
- Injetar 300 μL de soro fisiológico estéril por via subcutânea antes de remover o camundongo do aparelho.
- Dar cuidados pós-operatórios aos animais conforme descrito acima, até chegar a hora de retirar as suturas-~7-10 dias após a cirurgia.
5. Dosagem de glicose
- Seguir o protocolo descrito no kit de dosagem colorimétrica de glicose.
- Diluir a solução-mãe tampão de fosfato de sódio fornecida no kit até à concentração de 50 mM em água ultrapura.
- Preparar padrões de glicose em intervalos de 0, 2,5, 5, 7,5, 10, 15, 20, 25 e 50 mg/dL a partir da solução-estoque de 1.000 mg/dL fornecida no kit em solução tampão diluída.
- Preparar uma diluição de 7 vezes das amostras de LCR no tampão. Por exemplo, se o volume total de LCR coletado for de 10 μL, o volume diluído sete vezes será de 70 μL.
- Pipetar 15 μL de padrões de glicose e LCR diluído em duplicatas em placa de 96 poços.
- Pipetar 85 μL de tampão diluído em cada um dos poços com padrões e LCR.
- Adicione 6 ml de tampão diluído ao frasco para injetáveis de mistura de enzimas calorimétricas de glicose e agite-o durante alguns segundos para misturar completamente.
- Adicionar 100 μL da preparação da mistura enzimática a cada poço para iniciar a reação.
- Sele a placa com uma folha de cobertura e bata na placa suavemente para misturar os reagentes.
- Colocar a placa numa incubadora a 37 °C durante 10 min. Frascos com glicose alta começam a ficar violetas imediatamente.
- Após 10 min, retire a tampa e meça a absorbância a 500-520 nm usando um leitor de placas.
- Calcular a concentração de glicose nas amostras de LCR interpolando seus valores a partir da curva padrão.
6. Dosagem de glicemia
- Faça um pequeno corte lateral na cauda do rato usando uma lâmina de barbear e use uma gota de sangue para medir a glicose no sangue com um glicosímetro, de acordo com as instruções do manual.
Resultados
Camundongos machos foram implantados com uma cânula montada em uma minibomba osmótica (Figura 1) para infundir cronicamente aCSF ou uma solução de glicose a 50% em seus ventrículos laterais (Figura 2). O LCR foi coletado 10 dias após a cirurgia (Figura 3) para validar a eficácia desse procedimento. Os resultados mostraram um aumento nos níveis de glicose no LCR (média: 327,7 mg/dL) em camundongos infundidos com glicose a 50% em comparação com (média: 56,5 mg/dL) em camundongos infundidos com aCSF. Isso representa um aumento de cerca de seis vezes nos níveis de glicose no LCR nos camundongos experimentais em comparação com suas ninhadas controle (Figura 4A). Os níveis glicêmicos não foram diferentes entre os grupos (Figura 4B).
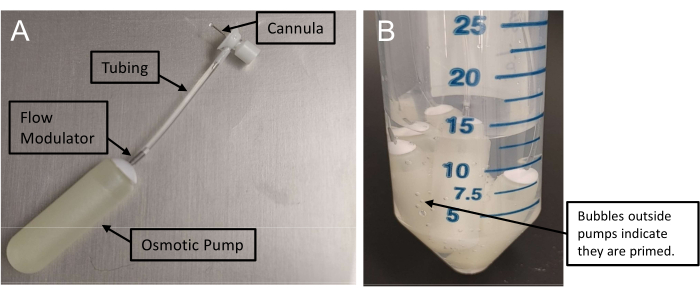
Figura 1: Montagem das minibombas osmóticas . (A) Conjunto de infusão com cânula conectada a uma minibomba através de tubulação. Essas bombas exigem pelo menos 48 h para serem acionadas. (B) A presença de bolhas de ar fora das minibombas confirma o priming. Clique aqui para ver uma versão maior desta figura.

Figura 2: Aparelhos estereotáxicos e acessórios. (A,B) Equipamento estereotáxico com micromanipulador acoplado e outros acessórios. (C) Coordenadas do orifício da broca para inserir a cânula. (D) Implante de mini bomba osmótica, (E,F) Inserção da cânula no furo perfurado. Manter condições assépticas durante toda a cirurgia. Clique aqui para ver uma versão maior desta figura.

Figura 3: Procedimento de coleta do líquido cefalorraquidiano (LCR). (A) Os músculos do pescoço dorsal foram suavemente deslocados com pinça romba para expor a cisterna magna. Um capilar de 1 mm com ponta de 0,5 mm de diâmetro foi usado para (B) ruptura e (C,D) coleta de líquor da cisterna magna. Clique aqui para ver uma versão maior desta figura.
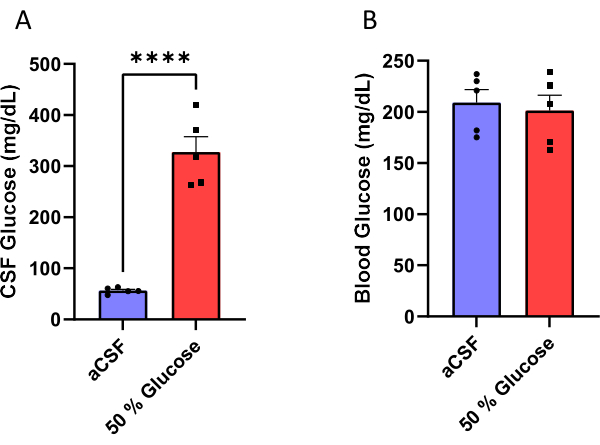
Figura 4: Dosagem de glicose . (A) Aumento da glicose no LCR (B) sem afetar os níveis glicêmicos não em jejum em camundongos infundidos com solução glicosada a 50% no ventrículo lateral. A eficácia desse protocolo foi validada medindo-se a concentração de líquor e glicemia 10 dias após o início da infusão de glicose. Camundongos infundidos com solução glicosada a 50% apresentaram níveis de glicose no LCR de 327,7 ± 30,1 mg/dL (média ± erro padrão da média) em comparação aos camundongos que receberam infusão artificial de LCR que apresentaram níveis de glicose de 56,5 ± 2,6 mg/dL. p < 0,0001, teste t não pareado. As barras de erro representam o erro padrão da média (n = 5). Clique aqui para ver uma versão maior desta figura.
Discussão
Este artigo relata um protocolo detalhado para aumentar a glicose no LCR em camundongos usando minibombas osmóticas conectadas a uma cânula implantada no ventrículo lateral. A infusão crônica de glicose no cérebro de camundongos através deste procedimento será útil para delinear os efeitos da hiperglicorraquia a longo prazo sobre a cognição, metabolismo sistêmico de glicose e balanço energético e para melhor compreensão da patogênese das complicações do diabetes.
O diabetes crônico causa dano cerebral que interrompe a comunicação entre o cérebro e os órgãos periféricos15. O diabetes também aumenta o risco de doenças neurodegenerativas, incluindo a doença de Alzheimer 3,4. O diabetes tipo 1 induzido por estreptozotocina (STZ) tem sido o modelo padrão de roedores na pesquisa do diabetes16; STZ danifica as células β no pâncreas, levando a patologia tipo 1 semelhante ao diabetes. Além disso, em uma versão modificada, o uso de STZ acompanhado de nicotinamidas pode induzir diabetes tipo 2. Outra maneira de desenvolver fenótipos semelhantes ao diabetes tipo 2 em animais é alimentando-os com uma dieta rica em gordura16. No entanto, no contexto do estudo do efeito da hiperglicemia na função cerebral, essas técnicas são limitadas no controle de um grande número de fatores (por exemplo, níveis periféricos de insulina/glucagon e função metabólica em geral). Assim, qualquer efeito do diabetes induzido por STZ sobre a função cerebral só pode ser interpretado como uma complicação associada, em vez de apontar um único fator etiológico. A injeção aguda ou infusão crônica de substâncias no espaço cerebroventricular é uma técnica frequentemente utilizada para testar seus efeitos diretos sobre a função cerebral. A injeção intracerebroventricular (ICV) de STZ tem sido usada para desenvolver um modelo de doença de Alzheimer em roedores, no entanto, permanece incerto se o dano neural associado a STZ é devido à desregulação na detecção/homeostase da glicose ou a outros mecanismos independentes, como estresse oxidativo induzido por STZ e dano ao DNA17.
Os procedimentos descritos no protocolo atual serão úteis no desenvolvimento de modelos de roedores que possam responder a questões de pesquisa, como se um aumento na concentração de glicose no LCR pode causar comprometimento cognitivo. O protocolo aqui descrito pode ser usado para determinar os efeitos diretos de altos níveis de glicose no LCR sobre o hipotálamo e hipocampo, entre outras regiões cerebrais envolvidas no sensoriamento de nutrientes, metabolismo e/ou cognição. Esse método também esclareceria se um aumento nos níveis de glicose no LCR afeta a sensibilidade à insulina, a secreção de insulina, a ingestão alimentar e/ou o balanço energético basal e em resposta a insultos metabólicos. Além disso, o protocolo aqui relatado seria aplicável para testar hipóteses que requerem estudos longitudinais. Por exemplo, os dados poderiam ser coletados antes, durante e ao final das infusões de glicose para comparar os achados dos mesmos animais em momentos diferentes. Tal estratégia abordaria se as complicações decorrentes do alto nível de glicose no LCR são reversíveis após o nível normal de glicose no LCR ser restaurado. Por outro lado, o método também poderia ser usado para estudos geradores de hipóteses. Por exemplo, o LCR poderia ser coletado dos mesmos animais em momentos diferentes e submetido à análise metabolômica ou proteômica para identificar biomarcadores ou quaisquer insultos metabólicos produzidos por altos níveis de glicose no LCR. Da mesma forma, diferentes regiões do cérebro poderiam ser analisadas por transcriptômica espacial para produzir informações específicas de células que podem ter sido alteradas por glicose elevada no LCR.
A justificativa para a infusão de aCSF livre de glicose em um grupo sham foi manter a concentração de glicose no LCR no nível basal, de modo que qualquer alteração no nível de glicose no LCR induzida pelo implante da cânula possa ser naturalmente controlada. Os resultados deste estudo mostraram que o grupo sham tinha uma concentração de glicose no LCR de ~60 mg/dL (~3 mM), que está na faixa normal de glicose no LCR em camundongos18. Os níveis de glicose no LCR observados em indivíduos com diabetes tipo 2 são ~110 mg/dL ou ~6 mM9. No presente estudo, a infusão de ICV de glicose a 50% a uma taxa de 125μg/h elevou os níveis de glicose no LCR para ~300 mg/dL (16 mM), o que é suprafisiológico19. Embora esse nível suprafisiológico de glicose no LCR possa não ser clinicamente relevante para os níveis observados em indivíduos com diabetes tipo 2, os resultados apresentados neste estudo mostram que a infusão de glicose no LCR pode induzir uma elevação crônica da concentração de glicose no LCR em camundongos.
O método aqui apresentado apresenta algumas limitações. Envolve cirurgia sofisticada do cérebro de camundongos que requer treinamento, habilidades e experiência relevantes na realização de procedimentos tão avançados. Como o cateter e as minibombas são implantados a longo prazo, é necessário um cuidado meticuloso dos camundongos durante todo o estudo para monitorar problemas de saúde ou danos à montagem do cateter. Uma concentração de glicose de 50% foi selecionada porque a viscosidade de uma solução além dessa concentração pode ter afetado a infusão de glicose nos ventrículos. As minibombas utilizadas neste protocolo apresentaram fluxo de 0,25 μL/h, de modo que o grupo de camundongos com infusão de glicose a 50% recebeu glicose a uma taxa de 125 μg/h, ou 3 mg de glicose por dia. Essa dose de glicose por unidade de tempo foi, portanto, limitada pela vazão das minibombas.
Em resumo, este artigo relata um método validado para o aumento crônico de glicose no LCR em camundongos. As informações obtidas a partir desse modelo serão úteis para determinar se ou como um aumento nos níveis de glicose no LCR está envolvido na mediação de complicações associadas ao diabetes, como doenças neurodegenerativas, ou causando insultos metabólicos periféricos em diabetes e obesidade.
Solucionando problemas
Se a tubulação sair da cânula nos ratos, uma pequena quantidade de cola na conexão cânula-tubulação pode ser aplicada durante a montagem da minibomba. Se os pontos saírem e a cânula se tornar visível, a área da incisão pode ser completamente fechada com o uso de suturas ou grampos. As unhas das patas traseiras do rato devem ser aparadas, para que haja uma menor possibilidade de coçar a área de cirurgia pelo rato. Além disso, tenha cuidado para não amarrar as suturas tão apertadas que a pele rasgue, pois os ratos têm pele delicada.
Para rápida recuperação após a coleta do LCR, recomenda-se a injeção de 300 μL de solução salina estéril por via subcutânea após a cirurgia. Além disso, manter o volume máximo de coleta de LCR em 10 μL também é importante.
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
National Institutes of Health concessão DK124619 para KHC.
Fundos de start-up e prêmio de pesquisa piloto, Departamento de Medicina, Universidade de Rochester, NY, para KHC.
Prêmio de Pesquisa Piloto do Instituto Del Monte de Neurociência, Universidade de Rochester, para KHC.
Prêmio de Pesquisa Universitária, Escritório do Vice-Presidente de Pesquisa, Universidade de Rochester, NY, para KHC.
MUR desenhou e executou o método, analisou os resultados, elaborou gráficos e figuras, escreveu e editou o manuscrito. KHC concebeu e supervisionou o estudo, analisou os resultados, escreveu e editou o manuscrito. A KHC é a fiadora desse trabalho. Todos os autores aprovaram a versão final do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Membrane solutions | SFPES030022S | |
| 1 mL sterile Syringe (Luer-lok tip) | BD | 309628 | |
| 1 mL TB syringe | BD | 309659 | |
| 100 mL Glass beaker | Fisher | N/a | |
| 100% Ethanol (Koptec) | DLI | UN170 | Use 70% dilution to clean the surgery area |
| 50 mL conical tube | Fisher | N/A | |
| Allignment indicator | KOPF | 1905 | |
| Alzet brain infusion kit | DURECT | Kit # 3; 0008851 | Cut tubing in the kit to 1 inch length |
| Alzet osmotic pump | DURECT | 2004 | Flow rate 0.25 µL/h |
| Anesthesia system | Kent Scientific | SomnoSuite | |
| Betadine solution | Avrio Health | N/A | |
| CaCl2 . 2H2O | Fisher | C79-500 | |
| Cannula holder | KOPF | 1966 | |
| Centering scope | KOPF | 1915 | |
| Dental Cement Liquid | Lang Dental | REF1404 | |
| Dental cement Powder | Lang Dental | REF1220-C | |
| D-glucose | Sigma | G8270 | |
| Electric drill | KOPF | 1911 | While drilling a hole avoid rupturing dura mater |
| Eye lubricant (Optixcare) | CLC Medica | N/A | |
| Glass Bead sterilizer (Germinator 500) | VWR | 101326-488 | Place instruments in sterile water to let them cool before surgery |
| Glucose Assay Kit | Cayman chemical | 10009582 | |
| H2O2 | Sigma | H1009-500ml | Apply 3% H2O2 on skull surface to make the cranial sutures visible. |
| Hair Clipper | WAHL | N/A | |
| heating pad | Heatpax | 19520483 | |
| Hemostat | N/A | N/A | |
| Isoflurane (Fluriso) | Zoetis | NDC1385-046-60 | |
| KCl | VWR | 0395-500g | |
| Magnetic stand | WPI | M1 | |
| Magnifying desk lamp | Brightech | LightView Pro Flex 2 | |
| Metal Spatula | N/A | N/A | |
| MgCl2 . 6H2O | Fisher | BP214-500 | |
| Micromanipulator (Right handed) | WPI | M3301R | |
| Micromanipulator with digital display | KOPF | 1940 | |
| Na2HPO4 . 7H2O | Fisher | S373-500 | |
| NaCl | Sigma | S7653-5Kg | |
| NaH2PO4 . H2O | Fisher | S369-500 | |
| Neosporin | Johnson & Johnson | N/A | Apply topical oinment to prevent infection |
| Parafilm | Bemis | DM-999 | |
| Rimadyl (Carprofen) 50mg/ml | Zoetis | N/A | 5 mg/kg, subcutaneous, for analgesia |
| Scalpel | N/A | N/A | |
| Stereotaxic allignment system | KOPF | 1900 | |
| Sterile 27 gauge needle | BD | 305109 | |
| Sterile cotton tip applicators (Solon) | AMD Medicom | 56200 | |
| Sterile nylon sutures (5.0) | Oasis | MV-661 | Use non-absorable suture for closing the wound |
| Sterile sharp scissors | N/A | N/A | |
| Sterile surgical blades | VWR | 55411-050 | |
| Surgical gloves (Nitrile) | Ammex | N/A | Change gloves if there is suspision of contamination |
| Tray | N/A | N/A |
Referências
- Moheet, A., Mangia, S., Seaquist, E. R. Impact of diabetes on cognitive function and brain structure. Annals of the New York Academy of Sciences. 1353, 60-71 (2015).
- Takeda, S., et al. Diabetes-accelerated memory dysfunction via cerebrovascular inflammation and Abeta deposition in an Alzheimer mouse model with diabetes. Proceedings of the National Academy of Sciences. 107 (15), 7036-7041 (2010).
- Arvanitakis, Z., Wilson, R. S., Bienias, J. L., Evans, D. A., Bennett, D. A. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function. Archives of Neurology. 61 (5), 661-666 (2004).
- Zilliox, L. A., Chadrasekaran, K., Kwan, J. Y., Russell, J. W. Diabetes and cognitive impairment. Current Diabetes Reports. 16 (9), 87(2016).
- Reno, C. M., Litvin, M., Clark, A. L., Fisher, S. J. Defective counterregulation and hypoglycemia unawareness in diabetes: mechanisms and emerging treatments. Endocrinology and Metabolism Clinics of North America. 42 (1), 15-38 (2013).
- Cryer, P. E., Davis, S. N., Shamoon, H. Hypoglycemia in diabetes. Diabetes Care. 26 (6), 1902-1912 (2003).
- Hwang, J. J., et al. Hypoglycemia unawareness in type 1 diabetes suppresses brain responses to hypoglycemia. The Journal of Clinical Investigation. 128 (4), 1485-1495 (2018).
- Cryer, P. E., Gerich, J. E. Glucose counterregulation, hypoglycemia, and intensive insulin therapy in diabetes mellitus. The New England Journal of Medicine. 313 (4), 232-241 (1985).
- Tigchelaar, C., et al. Elevated cerebrospinal fluid glucose levels and diabetes mellitus are associated with activation of the neurotoxic polyol pathway. Diabetologia. 65 (7), 1098-1107 (2022).
- Zheng, H., et al. Cognitive decline in type 2 diabetic db/db mice may be associated with brain region-specific metabolic disorders. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (1), 266-273 (2017).
- Ernst, A., et al. Diabetic db/db mice exhibit central nervous system and peripheral molecular alterations as seen in neurological disorders. Translational Psychiatry. 3 (5), 263(2013).
- Wang, Y., Yang, Y., Liu, Y., Guo, A., Zhang, Y. Cognitive impairments in type 1 diabetes mellitus model mice are associated with synaptic protein disorders. Neuroscience Letters. 777, 136587(2022).
- Jolivalt, C. G., et al. Type 1 diabetes exaggerates features of Alzheimer's disease in APP transgenic mice. Experimental Neurology. 223 (2), 422-431 (2010).
- Paxinos, G., Franklin, K. B. J. Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , Academic Press. (2019).
- Vinik, A. I., Maser, R. E., Mitchell, B. D., Freeman, R. Diabetic autonomic neuropathy. Diabetes Care. 26 (5), 1553-1579 (2003).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), 78(2021).
- Grieb, P. Intracerebroventricular streptozotocin injections as a model of Alzheimer's disease: in search of a relevant mechanism. Molecular Neurobiology. 53 (3), 1741-1752 (2016).
- Kealy, J., et al. Acute inflammation alters brain energy metabolism in mice and humans: role in suppressed spontaneous activity, impaired cognition, and delirium. The Journal of Neuroscience. 40 (29), 5681-5696 (2020).
- Dougherty, J. M., Roth, R. M. Cerebral spinal fluid. Emergency Medicine Clinics of North America. 4 (2), 281-297 (1986).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados