Method Article
Implantation d’une minipompe osmotique pour augmenter la concentration de glucose dans le liquide céphalorachidien de souris
Dans cet article
Résumé
Cet article décrit un protocole détaillé pour augmenter la concentration de glucose dans le liquide céphalorachidien (LCR) des souris. Cette approche peut être utile pour étudier les effets d’une glycémie élevée dans le LCR sur la neurodégénérescence, la cognition et le métabolisme périphérique du glucose chez la souris.
Résumé
Le diabète augmente le risque de déclin cognitif et altère la fonction cérébrale. Que cette relation entre une glycémie élevée et des déficits cognitifs soit causale ou non reste insaisissable. De plus, on ne sait pas non plus si ces déficits sont médiés par une augmentation des taux de glucose dans le liquide céphalorachidien (LCR) et / ou le sang. Il existe très peu d’études portant sur les effets directs des taux élevés de glucose dans le LCR sur la fonction du système nerveux central (SNC), en particulier sur l’apprentissage et la mémoire, car les modèles actuels du diabète ne sont pas suffisamment développés pour répondre à de telles questions de recherche. Cet article décrit une méthode pour augmenter chroniquement les niveaux de glucose dans le LCR pendant 4 semaines en perfusant continuellement du glucose dans le ventricule latéral à l’aide de minipompes osmotiques chez la souris. Le protocole a été validé en mesurant les niveaux de glucose dans le LCR. Ce protocole a augmenté les niveaux de glucose du LCR à ~328 mg / dL après perfusion d’une solution de glucose à 50% à un débit de 0,25 μL / h, par rapport à une concentration de glucose dans le LCR de ~ 56 mg / dL chez les souris ayant reçu du liquide céphalorachidien artificiel (aLCR). De plus, ce protocole n’a pas affecté la glycémie. Par conséquent, cette méthode peut être utilisée pour déterminer les effets directs d’une glycémie élevée dans le LCR sur la fonction cérébrale ou une voie neuronale spécifique indépendamment des changements dans les niveaux de glucose dans le sang. Dans l’ensemble, l’approche décrite ici facilitera le développement de modèles animaux pour tester le rôle d’une glycémie élevée dans le LCR dans la médiation des caractéristiques de la maladie d’Alzheimer et / ou d’autres troubles neurodégénératifs associés au diabète.
Introduction
Le diabète de type 1 et de type 2 altère les fonctions cérébrales 1,2,3. Par exemple, le diabète augmente le risque de déclin cognitif et de troubles neurodégénératifs, y compris la maladie d’Alzheimer 3,4. De plus, les personnes atteintes de diabète ont une détection de glucose défectueuse dans le cerveau 5,6. Ce défaut contribue à la pathogenèse de l’hypoglycémie associée à l’inconscience et à une réponse contre-réglementaire insuffisante à l’hypoglycémie7,8, qui peut être fatale si elle n’est pas traitée immédiatement.
Étant donné que le diabète augmente le taux de glucose dans le sang ainsi que dans le liquide céphalorachidien (LCR)9, il est important de déterminer si l’un de ces facteurs ou les deux contribuent à une altération de la fonction cérébrale. La question de savoir si le diabète provoque des lésions cérébrales par une glycémie élevée dans le LCR seul ou en combinaison avec d’autres facteurs tels que la carence en insuline ou la résistance à l’insuline reste également ouverte. Les modèles animaux de diabète de type 1 et de type 2 montrent un déclin cognitif et une neurodégénérescence en plus d’un bilan énergétique affecté et d’un métabolisme périphérique du glucose10,11,12,13. Cependant, à partir de ces modèles, il n’est pas possible de dissocier les effets sélectifs d’une glycémie élevée dans le LCR par rapport à la médiation des complications du diabète sur la fonction cérébrale.
Ce protocole décrit des méthodes pour développer un modèle murin d’hyperglycorrhachie afin de tester les effets des niveaux de glucose chroniquement élevés dans le LCR sur la fonction cérébrale, l’équilibre énergétique et l’homéostasie du glucose. Le modèle murin développé grâce à cette technique présente un outil pour les études sur le rôle étiologique de l’homéostasie du glucose dérégulée sur la fonction neuronale et comportementale.
Par conséquent, l’approche proposée sera utile pour comprendre les effets directs des taux élevés de glucose dans le LCR dans diverses conditions physiopathologiques.
Protocole
Toutes les procédures relatives aux souris ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux de l’Université de Rochester et ont été effectuées conformément aux directives du Service de santé publique des États-Unis pour le soin et l’utilisation sans cruauté des animaux de laboratoire. Des souris mâles C57BL/6J âgées de six semaines utilisées pour cette étude ont été obtenues commercialement. Tous les animaux ont été logés en groupe (5 souris par cage) dans une pièce avec un cycle jour/nuit de 12 h et ont eu accès à de la nourriture et de l’eau ad libitum. Après que les souris ont été implantées avec une canule pour perfuser du glucose dans le ventricule latéral, elles ont été logées seules pour éviter tout dommage aux implants d’autres souris.
1. Assemblage de minipompes osmotiques
- Préparer le liquide céphalorachidien artificiel (aLCR) selon le protocole suivant. Dissoudre NaCl (8,66 g), KCl (0,224 g), CaCl 2,2H 2 O (0,206 g) et MgCl 2,6H2O (0,163 g) dans 500 mL d’eau stérile pour préparer la solution A. DissoudreNa2HPO 4,7H2O (0,214 g)et NaH 2 PO4. H2O(0,027 g) dans 500 mL d’eau stérile pour préparer la solution B. Ensuite, mélanger les solutions A et B dans un rapport de 1:1 pour préparer le LCRa.
REMARQUE: Cette formulation d’aCSF ne contient pas de glucose. - Pour préparer la solution de glucose à 50 %, ajouter 50 g de glucose à 50 mL de LCR dans un bécher. Placez le bécher sur une plaque chauffante et portez la température de la suspension à 60 °C. Mélanger la suspension avec un agitateur magnétique jusqu’à ce que le glucose soit complètement dissous.
- Ajouter aCSF au bécher pour obtenir le volume final de 100 mL. Passez la solution à travers un filtre à pores de 0,22 μm pour la stériliser.
- Préparer une solution saline à 0,9 % (NaCl) et faire passer la solution à travers le filtre à 0,22 μm.
- Placez tous les composants de la minipompe et du kit de perfusion dans un plateau stérile et coupez le tube du kit de perfusion cérébrale à 1 pouce de longueur avec un ciseau stérile. Tenez le tube avec un hémostatique stérile et poussez-le sur le dessus d’une extrémité de la canule. Connectez l’autre extrémité du tube à la partie supérieure du modulateur de débit. Couvrez les deux extrémités du tube avec une petite quantité de colle pour une connexion plus solide.
- Fixez une aiguille de 27 G à une seringue de 1 mL et remplissez-la avec du LCR ou de la solution de glucose. Insérez l’aiguille de 27 G dans un petit morceau de tube. Ensuite, connectez le tube à l’extrémité ouverte du modulateur de débit et remplissez-le avec la solution correspondante jusqu’à ce que des gouttes de la solution commencent à sortir de la canule. Enlevez toutes les bulles d’air emprisonnées dans le tube.
- Pour remplir la minipompe, maintenez la pompe à la verticale et insérez l’aiguille de la seringue dans la pompe. Remplissez-le avec la solution correspondante jusqu’à ce qu’une goutte de solution commence à se former à l’ouverture de la minipompe.
- Insérez lentement le modulateur de débit dans la pompe tout en veillant à ne pas introduire de bulles d’air dans l’assemblage.
- Une fois les minipompes osmotiques assemblées, transférez-les dans un tube conique de 50 mL. Remplissez le tube avec la solution saline stérile afin que les pompes soient complètement immergées, tout en vous assurant que la canule reste hors de la solution saline. Quatre pompes assemblées peuvent être placées dans un tube de 50 mL.
- Placer le bouchon sur chaque tube et incuber les pompes à 37 °C pour amorcer pendant au moins 48 h.
2. Chirurgie pour implanter des pompes osmotiques
- Procédure préopératoire
- Stérilisez les instruments chirurgicaux dans un autoclave et laissez-les refroidir pendant au moins 30 minutes avant utilisation. Les conditions de l’autoclave impliquent une stérilisation à la vapeur à 121 °C pendant 30 min.
- Désinfectez la zone chirurgicale avec de l’éthanol à 70%. Essuyez les boutons, les barres d’oreille et la surface stéréotaxique du cadre.
REMARQUE: La chirurgie doit être effectuée dans un environnement aseptique, en gardant à l’esprit d’éviter de toucher des surfaces non stériles lors de la chirurgie. Remplacez les gants en cas de suspicion de contamination. - Placez la souris dans une chambre d’anesthésie pour l’anesthésier avec 3% d’isoflurane mélangé à de l’air pendant 3-5 min. Ensuite, retirez la souris de la chambre et placez-la sur un champ stérile. Maintenir l’anesthésie via un cône nasal à 1,5%-2%.
- Pincez la patte postérieure de la souris pour observer tout réflexe et vérifier la profondeur de l’anesthésie.
- Injecter 5 mg/kg de carprofène par voie sous-cutanée pour l’analgésie.
- Utilisez des tondeuses propres pour clipser la zone chirurgicale sur la tête de la souris. Frottez d’abord le cuir chevelu avec une solution de povidone iodée, puis avec des tampons d’alcool à fond pendant au moins 2 minutes. Répétez ce processus au moins trois fois.
- Appliquez un lubrifiant pour les yeux pour empêcher les yeux de sécher pendant la chirurgie.
- Chirurgie
- Placez la souris sur le cadre stéréotaxique et placez la tête sur la barre d’incisive. Couvrez le nez avec le cône nasal. Appliquez des champs stériles pour sécuriser la zone chirurgicale.
- Déplacer le flux d’isoflurane vers le cône nasal. Continuer à maintenir l’anesthésie à 1,5 % -2 % d’isoflurane.
- Placez un coussin chauffant sous la souris pour maintenir la température corporelle.
- Mettez de nouveaux gants stériles et, avec un scalpel, faites une incision médiane (~10-15 mm de long) sur le cuir chevelu. Exposez la surface du crâne avec une spatule tout en utilisant des pointes en coton pour essuyer tout saignement.
REMARQUE: Utilisez un cautériseur en cas de saignement abondant, ce qui est rare. - Frottez avec une pointe en coton trempée dans du peroxyde d’hydrogène à 3% pour exposer les sutures crâniennes.
- Prenez note de bregma et lambda pour naviguer dans les coordonnées du crâne. Réglez toutes les coordonnées à zéro au bregma.
NOTE: Ces coordonnées ont été obtenues à partir d’un atlas du cerveau de souris14. La distance de référence bregma-lambda dans l’atlas est de 4,21 mm. Pour corriger les différences de taille du crâne basées sur l’âge et le sexe, la distance bregma-lambda pour chaque souris a été mesurée, puis divisée par 4,21 mm pour obtenir un facteur de multiplication. Par exemple, si la distance entre bregma et lambda était de 4,65 mm, la division de 4,21 mm donnait un facteur de multiplication de 1,10. Toutes les coordonnées obtenues à partir de l’atlas ont ensuite été multipliées avec ce facteur pour mesurer les coordonnées réelles qui ont été utilisées pour percer le trou. Dans l’exemple ci-dessus, les coordonnées antéro-postérieure (AP) et médiale-latérale (ML) résultantes seraient respectivement de 0,55 et 1,1 mm (c.-à-d. 1,1 x 0,5 ou 1 mm). - Utilisez une perceuse électrique pour faire un trou à ces coordonnées : 0,5 mm en arrière du bregma et 1 mm latéral à la ligne médiane vers la droite.
REMARQUE: Lorsque vous percez le trou dans le crâne, veillez à ne pas rompre la dure-mère. Assurez-vous que le foret est stérile. Il peut être placé avec d’autres instruments dans la même pochette autoclave pour la stérilisation. - Insérez un hémostatique sous la peau incisée et poussez-le à l’endroit où la minipompe osmotique sera implantée. Ouvrez et fermez doucement l’hémostat pour faire une poche pour la minipompe.
- Utilisez un hémostatique stérile pour prélever une minipompe osmotique amorcée à l’extrémité du modulateur de débit. Poussez la pompe à travers la peau incisée dans la poche.
REMARQUE: Veillez à ne pas laisser la pompe et la canule toucher une surface non stérile. - Appliquez un peu de colle sur la face inférieure de la canule et fixez-la dans le porte-canule. Abaissez lentement la canule à travers le trou percé de 2 mm ventralement jusqu’à la surface du crâne. Laissez-le là pendant au moins 5 minutes pour permettre à la colle de se solidifier.
- Avant d’insérer la canule dans le cerveau, assurez-vous que la canule n’est pas obstruée et que la solution coule correctement.
REMARQUE: Parfois, le glucose peut se déposer à l’extrémité de la canule en raison d’un débit très faible, bloquant le flux. - À l’aide d’un ciseau, coupez le haut de la canule en vous assurant qu’elle ne se déloge pas de la surface du crâne.
- Couvrir la canule d’une couche de ciment dentaire pour un soutien supplémentaire.
- Utilisez des sutures en nylon (taille 5-0 et 30 pouces de longueur) pour fermer la plaie et appliquez un antibiotique topique sur la plaie pour prévenir l’infection.
- Éteignez l’isoflurane et laissez l’animal se remettre de l’anesthésie. Ensuite, transférez l’animal dans une nouvelle cage propre.
- Soins post-opératoires
- Après la chirurgie, surveillez la souris pendant au moins 1 semaine.
- Administrer 5 mg/kg de carprofène par voie sous-cutanée, une fois toutes les 24 heures pendant trois jours après la chirurgie.
- Laissez la plaie guérir complètement avant de retirer les sutures 7 à 10 jours après la chirurgie.
REMARQUE: Il a été observé que les souris avec un taux élevé de glucose dans le LCR mettaient plus de temps à guérir. Couper les ongles sur les pattes postérieures de la souris minimise le risque de blessure au site de l’incision en raison du comportement de grattage des souris.
3. Remplacement des minipompes
REMARQUE: Étant donné que les minipompes utilisées dans cette étude ne durent que 4 semaines, le remplacement des minipompes a également été testé pour prolonger la durée de la perfusion de glucose, comme cela peut être nécessaire dans le cas d’études à long terme. Cela impliquait les étapes suivantes.
- Préparez les souris pour la chirurgie comme détaillé ci-dessus.
- Faites une petite incision verticale de 1 cm dans la peau légèrement au-dessus de la pompe.
- Insérez un hémostatique sous la peau incisée et retirez la pompe.
- Retirez la pompe du tube et connectez une nouvelle pompe amorcée au tube.
- Réinsérez la pompe à l’intérieur et cousez la peau.
- Suivez les mêmes instructions de soins postopératoires que celles décrites ci-dessus.
4. Procédure de collecte du LCA
- Préparation
- Tirez des capillaires en verre de 1 mm de diamètre avec une machine à micropipettes pour obtenir des pointes de 0,5 mm de diamètre. Les paramètres sont les suivants : chaleur = 800, traction = 15, vitesse = 5 et temps = 200 unités. Placez les capillaires tirés dans une boîte stérile jusqu’à utilisation.
- Fixez une aiguille de 27 G à une seringue de 1 mL. Insérez le capillaire tiré sur l’aiguille et utilisez un petit ruban adhésif pour fixer la connexion.
- Fixez fermement la seringue dans un support capillaire d’un micromanipulateur.
- Ensuite, préparez la souris pour la chirurgie, comme décrit dans la procédure préopératoire ci-dessus.
- Intervention chirurgicale
- Placez la souris sur le cadre stéréotaxique. Après avoir fixé la tête sur le cadre, comme décrit précédemment, faites pivoter les boutons pour incliner la tête de sorte que le nez soit orienté vers le bas. Appliquez des champs stériles pour sécuriser la zone chirurgicale.
- Faites une petite incision sur la surface dorsale, en partant du plan intra-aural jusqu’au côté caudal.
REMARQUE: Veillez à ne pas endommager la tubulure lors de l’incision. - Retirez le support du corps de la souris et laissez la souris reposer verticalement afin que le cou soit complètement étendu dorsalement.
- À l’aide de pinces émoussées incurvées, coupez doucement les muscles postérieurs du cou à partir de la ligne médiane pour créer une petite fenêtre. Ensuite, utilisez un applicateur à embout de coton humide pour déplacer doucement les muscles du cou de la ligne médiane vers la périphérie.
- Observez si la citerne magna est exposée, qui apparaît comme une fenêtre triangulaire avec une membrane de dure-mère transparente.
- Placez l’ensemble micromanipulateur sur le cadre stéréotaxique à côté de la souris tout en vous assurant que l’extrémité capillaire ne touche aucune surface.
- Casser doucement l’extrémité capillaire sans perturber la configuration.
- Tout en regardant dans la loupe (grossissement de 2,25x), faites pivoter les boutons correspondants sur le micromanipulateur pour aligner lentement et déplacer l’extrémité capillaire vers la citerne magna.
- Une certaine résistance est ressentie une fois que l’extrémité capillaire touche la membrane de la citerne magna. Poussez très lentement la pointe contre la membrane à l’aide des boutons.
REMARQUE: Veillez à ne pas endommager les vaisseaux sanguins de la membrane. Cette étape est très importante pour éviter toute contamination du sang dans le LCR. - Percez très doucement la membrane. Le LCR commencera à couler dans le capillaire immédiatement en raison de la pression négative dans le capillaire.
- Laissez l’installation pendant quelques minutes jusqu’à ce que ~10 μL de LCR soit recueilli dans le capillaire.
- Ensuite, retirez lentement le capillaire de la citerne magna et appuyez doucement sur un applicateur à embout de coton stérile contre l’ouverture de la citerne magna pour arrêter la fuite de LCR.
- Retirez délicatement le capillaire de la seringue et fixez-le à un distributeur d’ampoules à microcapuchon. Appuyez sur l’ampoule pour transférer le LCR dans un tube microcentrifuge stérile.
- Placez un support sous la souris et faites pivoter les boutons stéréotaxiques pour niveler la tête.
- Fermez la plaie avec des sutures en nylon.
- Injecter 300 μL de solution saline stérile par voie sous-cutanée avant de retirer la souris de l’appareil.
- Donnez des soins postopératoires aux animaux comme décrit ci-dessus, jusqu’à ce qu’il soit temps de retirer les sutures - ~ 7-10 jours après la chirurgie.
5. Dosage de la glycémie
- Suivez le protocole décrit dans le kit de dosage colorimétrique du glucose.
- Diluer la solution tampon de phosphate de sodium fournie dans le kit à une concentration de 50 mM dans de l’eau ultra-pure.
- Préparer les étalons de glucose dans des plages de 0, 2,5, 5, 7,5, 10, 15, 20, 25 et 50 mg / dL à partir de la solution mère de 1 000 mg / dL fournie dans le kit dans une solution tampon diluée.
- Préparer une dilution 7 fois des échantillons de LCR dans le tampon. Par exemple, si le volume total de LCR recueilli est de 10 μL, le volume dilué de sept fois sera de 70 μL.
- Pipeter 15 μL d’étalons de glucose et de LCR dilué en double dans une plaque de 96 puits.
- Pipeter 85 μL de tampon dilué dans chacun des puits avec étalons et LCR.
- Ajouter 6 mL de tampon dilué dans le flacon de mélange d’enzymes calorimétriques au glucose et vorter pendant quelques secondes pour bien mélanger.
- Ajouter 100 μL de la préparation du mélange enzymatique à chaque puits pour commencer la réaction.
- Scellez la plaque avec une feuille de couverture et tapotez doucement sur la plaque pour mélanger les réactifs.
- Placer la plaque dans un incubateur à 37 °C pendant 10 min. Les flacons avec une glycémie élevée commencent à devenir violets immédiatement.
- Après 10 min, retirez le couvercle et mesurez l’absorbance à 500-520 nm à l’aide d’un lecteur de plaques.
- Calculer la concentration de glucose dans les échantillons de LCR en interpolant leurs valeurs à partir de la courbe standard.
6. Test de glycémie
- Faites une petite entaille latérale à la queue de la souris à l’aide d’une lame de rasoir et utilisez une goutte de sang pour mesurer la glycémie avec un glucomètre, selon les instructions du manuel.
Résultats
Des souris mâles ont été implantées avec une canule assemblée à une minipompe osmotique (Figure 1) pour perfuser chroniquement un aLCR ou une solution de glucose à 50% dans leurs ventricules latéraux (Figure 2). Le LCR a été prélevé 10 jours après la chirurgie (figure 3) afin de valider l’efficacité de cette procédure. Les résultats ont montré une augmentation des taux de glucose dans le LCR (moyenne: 327,7 mg / dL) chez les souris perfusées avec 50% de glucose par rapport à celle (moyenne: 56,5 mg / dL) chez les souris perfusées avec aLCR. Il s’agit d’une augmentation d’environ six fois des taux de glucose dans le LCR chez les souris expérimentales par rapport à leurs compagnons de portée témoins (Figure 4A). Les taux de glucose sanguin n’étaient pas différents entre les groupes (figure 4B).
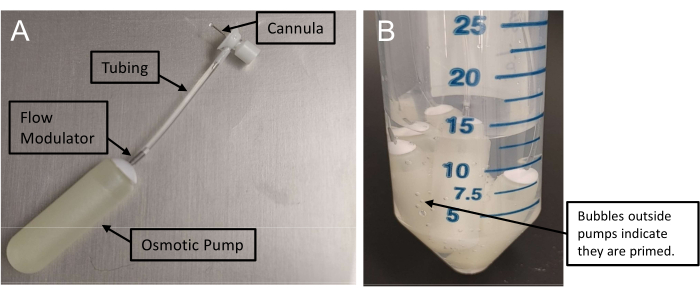
Figure 1 : Assemblage de minipompes osmotiques. (A) Ensemble de perfusion avec une canule reliée à une minipompe par un tube. Ces pompes nécessitent au moins 48 h pour amorcer. (B) La présence de bulles d’air à l’extérieur des minipompes confirme l’amorçage. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Appareils stéréotaxiques et accessoires. (A,B) Équipement stéréotaxique muni d’un micromanipulateur et d’autres accessoires. (C) Coordonnées du trou de bavure pour insérer la canule. (D) Implantation de mini-pompe osmotique, (E,F) Insertion de la canule dans le trou foré. Maintenez des conditions d’asepsie tout au long de la chirurgie. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Procédure de prélèvement du liquide céphalorachidien (LCR). (A) Les muscles du cou dorsal ont été doucement déplacés avec des pinces contondantes pour exposer la citerne magna. Un capillaire de 1 mm avec une pointe de 0,5 mm de diamètre a été utilisé pour (B) rompre et (C,D) recueillir le LCR de la citerne magna. Veuillez cliquer ici pour voir une version agrandie de cette figure.
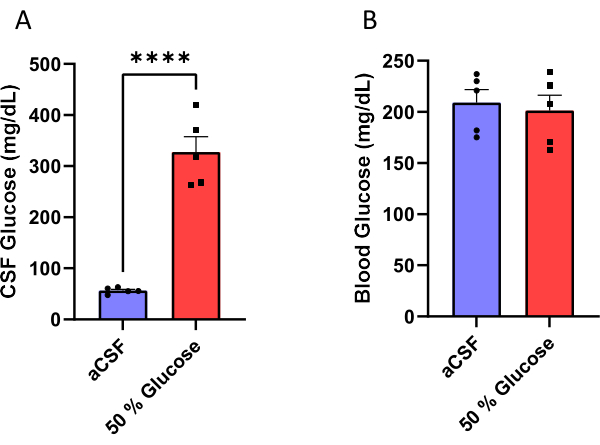
Figure 4 : Mesure du glucose. (A) Augmentation de la glycémie dans le LCR (B) sans affecter la glycémie non à jeun chez les souris perfusées d’une solution de glucose à 50 % dans le ventricule latéral. L’efficacité de ce protocole a été validée en mesurant le LCR et la concentration de glucose dans le sang 10 jours après le début de la perfusion de glucose. Les souris perfusées avec une solution de glucose à 50% avaient des taux de glucose dans le LCR de 327,7 ± 30,1 mg / dL (moyenne ± erreur type de moyenne) par rapport aux souris qui ont reçu une perfusion artificielle de LCR qui avait des niveaux de glucose de 56,5 ± 2,6 mg / dL. p < 0,0001, test t non apparié. Les barres d’erreur représentent l’erreur-type de la moyenne (n = 5). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cet article rapporte un protocole détaillé pour augmenter la glycémie du LCR chez la souris en utilisant des minipompes osmotiques connectées à une canule implantée dans le ventricule latéral. La perfusion chronique de glucose dans le cerveau de la souris par cette procédure sera utile pour délimiter les effets de l’hyperglycorrhachie à long terme sur la cognition, le métabolisme systémique du glucose et l’équilibre énergétique et pour mieux comprendre la pathogenèse des complications du diabète.
Le diabète chronique provoque des lésions cérébrales qui interrompent la communication entre le cerveau et les organes périphériques15. Le diabète augmente également le risque de maladies neurodégénératives, y compris la maladie d’Alzheimer 3,4. Le diabète de type 1 induit par la streptozotocine (STZ) a été le modèle standard de rongeurs dans la recherche sur le diabète16; STZ endommage les cellules β dans le pancréas, conduisant à une pathologie de type 1 semblable au diabète. De plus, dans une version modifiée, l’utilisation de STZ accompagnée de nicotinamides peut induire un diabète de type 2. Une autre façon de développer des phénotypes semblables au diabète de type 2 chez les animaux consiste à leur donner un régime richeen graisses 16. Cependant, dans le contexte de l’étude de l’effet de l’hyperglycémie sur la fonction cérébrale, ces techniques sont limitées dans le contrôle d’un grand nombre de facteurs (par exemple, les niveaux périphériques d’insuline / glucagon, et la fonction métabolique en général). Ainsi, tout effet du diabète induit par les STZ sur la fonction cérébrale ne peut être interprété que comme une complication associée, au lieu d’identifier un seul facteur étiologique. L’injection aiguë ou la perfusion chronique de substances dans l’espace cérébroventriculaire est une technique souvent utilisée pour tester leurs effets directs sur la fonction cérébrale. L’injection intrarébroventriculaire (ICV) de STZ a été utilisée pour développer un modèle rongeur de la maladie d’Alzheimer, cependant, il n’est pas certain que les dommages neuronaux associés aux STZ soient dus à une dérégulation de la détection du glucose / homéostasie ou à d’autres mécanismes indépendants, tels que le stress oxydatif induit par STZ et les dommages à l’ADN17.
Les procédures décrites dans le protocole actuel seront utiles pour développer des modèles de rongeurs qui peuvent répondre à des questions de recherche, comme si une augmentation de la concentration de glucose dans le LCR peut causer des troubles cognitifs. Le protocole décrit ici pourrait être utilisé pour déterminer les effets directs des taux élevés de glucose dans le LCR sur l’hypothalamus et l’hippocampe, entre autres régions du cerveau impliquées dans la détection des nutriments, le métabolisme et / ou la cognition. Cette méthode permettrait également de déterminer si une augmentation des taux de glucose dans le LCR affecte la sensibilité à l’insuline, la sécrétion d’insuline, l’apport alimentaire et / ou l’équilibre énergétique au départ et en réponse à des agressions métaboliques. De plus, le protocole rapporté ici serait applicable pour tester des hypothèses qui nécessitent des études longitudinales. Par exemple, des données pourraient être recueillies avant, pendant et à la fin des perfusions de glucose pour comparer les résultats des mêmes animaux à différents moments. Une telle stratégie permettrait de déterminer si les complications découlant d’un taux élevé de glucose dans le LCR sont réversibles après le rétablissement du taux normal de glucose dans le LCR. En revanche, la méthode pourrait également être utilisée pour des études génératrices d’hypothèses. Par exemple, le LCR pourrait être prélevé sur les mêmes animaux à différents moments et soumis à une analyse métabolomique ou protéomique pour identifier des biomarqueurs ou toute altération métabolique produite par un taux élevé de glucose dans le LCR. De même, différentes régions du cerveau pourraient être analysées par transcriptomique spatiale pour produire des informations spécifiques aux cellules qui peuvent avoir été modifiées par une glycémie élevée dans le LCR.
La raison d’être de l’injection d’aLCR sans glucose à un groupe fictif était de maintenir la concentration de glucose dans le LCR au niveau de base, de sorte que tout changement du taux de glucose dans le LCR induit par l’implantation d’une canule puisse être contrôlé naturellement. Les résultats de cette étude ont montré que le groupe fictif avait une concentration de glucose dans le LCR de ~ 60 mg / dL (~ 3 mM), ce qui se situe dans la plage de glucose normale du LCR chez la souris18. Les taux de glucose dans le LCR observés chez les personnes atteintes de diabète de type 2 sont de ~110 mg / dL ou ~ 6 mM9. Dans la présente étude, la perfusion de VCI de glucose à 50 % à un taux de 125 μg/h a élevé les taux de glucose dans le LCR à ~300 mg/dL (16 mM), ce qui est supraphysiologique19. Bien que ce niveau supraphysiologique de glucose dans le LCR puisse ne pas être cliniquement pertinent pour les niveaux observés chez les personnes atteintes de diabète de type 2, les résultats présentés dans cette étude montrent que la perfusion de glucose dans le LCR peut induire une élévation chronique de la concentration de glucose dans le LCR chez la souris.
La méthode présentée ici présente certaines limites. Il s’agit d’une chirurgie sophistiquée du cerveau de souris qui nécessite une formation, des compétences et une expérience pertinentes dans l’exécution de procédures aussi avancées. Étant donné que le cathéter et les minipompes sont implantés à long terme, des soins méticuleux des souris tout au long de l’étude sont nécessaires pour surveiller les problèmes de santé ou les dommages à l’assemblage du cathéter. Une concentration de glucose de 50 % a été choisie parce que la viscosité d’une solution au-delà de cette concentration pourrait avoir affecté la perfusion de glucose dans les ventricules. Les minipompes utilisées dans ce protocole avaient un débit de 0,25 μL / h, de sorte que le groupe de souris avec une perfusion de glucose à 50% a reçu du glucose à un débit de 125 μg / h, soit 3 mg de glucose par jour. Cette dose de glucose par unité de temps était donc limitée par le débit des minipompes.
En résumé, cet article rapporte une méthode validée pour l’augmentation chronique de la glycémie dans le LCR chez la souris. L’information obtenue à partir de ce modèle sera utile pour déterminer si et comment une augmentation de la glycémie dans le LCR est impliquée dans la médiation des complications associées au diabète, telles que les troubles neurodégénératifs, ou causant des agressions métaboliques périphériques dans le diabète et l’obésité.
Dépannage
Si le tube se détache de la canule chez les souris, une petite quantité de colle sur la connexion canule-tube peut être appliquée lors de l’assemblage de la minipompe. Si les points de suture se détachent et que la canule devient visible, la zone d’incision peut être complètement fermée à l’aide de sutures ou d’agrafes. Les ongles des pattes postérieures de la souris doivent être coupés, de sorte qu’il y ait moins de possibilité de gratter la zone chirurgicale par la souris. De plus, veillez à ne pas attacher les sutures si serrées que la peau se déchirera, car les souris ont une peau délicate.
Pour une récupération rapide après la collecte du LCR, l’injection de 300 μL de solution saline stérile par voie sous-cutanée après la chirurgie est recommandée. En outre, il est également important de maintenir le volume maximal de collecte du LCR à 10 μL.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas de conflit d’intérêts.
Remerciements
Subvention DK124619 des National Institutes of Health à KHC.
Fonds de démarrage et prix de recherche pilote, Département de médecine, Université de Rochester, NY, à KHC.
Le Del Monte Institute for Neuroscience Pilot Research Award, Université de Rochester, à KHC.
Prix de recherche universitaire, Bureau du vice-président pour la recherche, Université de Rochester, NY, à KHC.
MUR a conçu et exécuté la méthode, analysé les résultats, préparé des graphiques et des figures, et écrit et édité le manuscrit. KHC a conçu et supervisé l’étude, analysé les résultats, écrit et édité le manuscrit. KHC est le garant de ce travail. Tous les auteurs ont approuvé la version finale du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Membrane solutions | SFPES030022S | |
| 1 mL sterile Syringe (Luer-lok tip) | BD | 309628 | |
| 1 mL TB syringe | BD | 309659 | |
| 100 mL Glass beaker | Fisher | N/a | |
| 100% Ethanol (Koptec) | DLI | UN170 | Use 70% dilution to clean the surgery area |
| 50 mL conical tube | Fisher | N/A | |
| Allignment indicator | KOPF | 1905 | |
| Alzet brain infusion kit | DURECT | Kit # 3; 0008851 | Cut tubing in the kit to 1 inch length |
| Alzet osmotic pump | DURECT | 2004 | Flow rate 0.25 µL/h |
| Anesthesia system | Kent Scientific | SomnoSuite | |
| Betadine solution | Avrio Health | N/A | |
| CaCl2 . 2H2O | Fisher | C79-500 | |
| Cannula holder | KOPF | 1966 | |
| Centering scope | KOPF | 1915 | |
| Dental Cement Liquid | Lang Dental | REF1404 | |
| Dental cement Powder | Lang Dental | REF1220-C | |
| D-glucose | Sigma | G8270 | |
| Electric drill | KOPF | 1911 | While drilling a hole avoid rupturing dura mater |
| Eye lubricant (Optixcare) | CLC Medica | N/A | |
| Glass Bead sterilizer (Germinator 500) | VWR | 101326-488 | Place instruments in sterile water to let them cool before surgery |
| Glucose Assay Kit | Cayman chemical | 10009582 | |
| H2O2 | Sigma | H1009-500ml | Apply 3% H2O2 on skull surface to make the cranial sutures visible. |
| Hair Clipper | WAHL | N/A | |
| heating pad | Heatpax | 19520483 | |
| Hemostat | N/A | N/A | |
| Isoflurane (Fluriso) | Zoetis | NDC1385-046-60 | |
| KCl | VWR | 0395-500g | |
| Magnetic stand | WPI | M1 | |
| Magnifying desk lamp | Brightech | LightView Pro Flex 2 | |
| Metal Spatula | N/A | N/A | |
| MgCl2 . 6H2O | Fisher | BP214-500 | |
| Micromanipulator (Right handed) | WPI | M3301R | |
| Micromanipulator with digital display | KOPF | 1940 | |
| Na2HPO4 . 7H2O | Fisher | S373-500 | |
| NaCl | Sigma | S7653-5Kg | |
| NaH2PO4 . H2O | Fisher | S369-500 | |
| Neosporin | Johnson & Johnson | N/A | Apply topical oinment to prevent infection |
| Parafilm | Bemis | DM-999 | |
| Rimadyl (Carprofen) 50mg/ml | Zoetis | N/A | 5 mg/kg, subcutaneous, for analgesia |
| Scalpel | N/A | N/A | |
| Stereotaxic allignment system | KOPF | 1900 | |
| Sterile 27 gauge needle | BD | 305109 | |
| Sterile cotton tip applicators (Solon) | AMD Medicom | 56200 | |
| Sterile nylon sutures (5.0) | Oasis | MV-661 | Use non-absorable suture for closing the wound |
| Sterile sharp scissors | N/A | N/A | |
| Sterile surgical blades | VWR | 55411-050 | |
| Surgical gloves (Nitrile) | Ammex | N/A | Change gloves if there is suspision of contamination |
| Tray | N/A | N/A |
Références
- Moheet, A., Mangia, S., Seaquist, E. R. Impact of diabetes on cognitive function and brain structure. Annals of the New York Academy of Sciences. 1353, 60-71 (2015).
- Takeda, S., et al. Diabetes-accelerated memory dysfunction via cerebrovascular inflammation and Abeta deposition in an Alzheimer mouse model with diabetes. Proceedings of the National Academy of Sciences. 107 (15), 7036-7041 (2010).
- Arvanitakis, Z., Wilson, R. S., Bienias, J. L., Evans, D. A., Bennett, D. A. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function. Archives of Neurology. 61 (5), 661-666 (2004).
- Zilliox, L. A., Chadrasekaran, K., Kwan, J. Y., Russell, J. W. Diabetes and cognitive impairment. Current Diabetes Reports. 16 (9), 87(2016).
- Reno, C. M., Litvin, M., Clark, A. L., Fisher, S. J. Defective counterregulation and hypoglycemia unawareness in diabetes: mechanisms and emerging treatments. Endocrinology and Metabolism Clinics of North America. 42 (1), 15-38 (2013).
- Cryer, P. E., Davis, S. N., Shamoon, H. Hypoglycemia in diabetes. Diabetes Care. 26 (6), 1902-1912 (2003).
- Hwang, J. J., et al. Hypoglycemia unawareness in type 1 diabetes suppresses brain responses to hypoglycemia. The Journal of Clinical Investigation. 128 (4), 1485-1495 (2018).
- Cryer, P. E., Gerich, J. E. Glucose counterregulation, hypoglycemia, and intensive insulin therapy in diabetes mellitus. The New England Journal of Medicine. 313 (4), 232-241 (1985).
- Tigchelaar, C., et al. Elevated cerebrospinal fluid glucose levels and diabetes mellitus are associated with activation of the neurotoxic polyol pathway. Diabetologia. 65 (7), 1098-1107 (2022).
- Zheng, H., et al. Cognitive decline in type 2 diabetic db/db mice may be associated with brain region-specific metabolic disorders. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (1), 266-273 (2017).
- Ernst, A., et al. Diabetic db/db mice exhibit central nervous system and peripheral molecular alterations as seen in neurological disorders. Translational Psychiatry. 3 (5), 263(2013).
- Wang, Y., Yang, Y., Liu, Y., Guo, A., Zhang, Y. Cognitive impairments in type 1 diabetes mellitus model mice are associated with synaptic protein disorders. Neuroscience Letters. 777, 136587(2022).
- Jolivalt, C. G., et al. Type 1 diabetes exaggerates features of Alzheimer's disease in APP transgenic mice. Experimental Neurology. 223 (2), 422-431 (2010).
- Paxinos, G., Franklin, K. B. J. Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , Academic Press. (2019).
- Vinik, A. I., Maser, R. E., Mitchell, B. D., Freeman, R. Diabetic autonomic neuropathy. Diabetes Care. 26 (5), 1553-1579 (2003).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), 78(2021).
- Grieb, P. Intracerebroventricular streptozotocin injections as a model of Alzheimer's disease: in search of a relevant mechanism. Molecular Neurobiology. 53 (3), 1741-1752 (2016).
- Kealy, J., et al. Acute inflammation alters brain energy metabolism in mice and humans: role in suppressed spontaneous activity, impaired cognition, and delirium. The Journal of Neuroscience. 40 (29), 5681-5696 (2020).
- Dougherty, J. M., Roth, R. M. Cerebral spinal fluid. Emergency Medicine Clinics of North America. 4 (2), 281-297 (1986).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon