Method Article
Implantación de minibomba osmótica para aumentar la concentración de glucosa en líquido cefalorraquídeo de ratón
En este artículo
Resumen
Este artículo describe un protocolo detallado para aumentar la concentración de glucosa en el líquido cefalorraquídeo (LCR) de ratones. Este enfoque puede ser útil para estudiar los efectos de la glucosa alta en LCR en la neurodegeneración, la cognición y el metabolismo periférico de la glucosa en ratones.
Resumen
La diabetes aumenta el riesgo de deterioro cognitivo y afecta la función cerebral. Si esta relación entre la glucosa alta y los déficits cognitivos es causal sigue siendo difícil de alcanzar. Además, tampoco está claro si estos déficits están mediados por un aumento en los niveles de glucosa en el líquido cefalorraquídeo (LCR) y / o la sangre. Hay muy pocos estudios que investiguen los efectos directos de los niveles altos de glucosa en el LCR en la función del sistema nervioso central (SNC), especialmente en el aprendizaje y la memoria, ya que los modelos actuales de diabetes no están lo suficientemente desarrollados para abordar tales preguntas de investigación. Este artículo describe un método para aumentar crónicamente los niveles de glucosa en LCR durante 4 semanas mediante la infusión continua de glucosa en el ventrículo lateral utilizando minibombas osmóticas en ratones. El protocolo se validó midiendo los niveles de glucosa en LCR. Este protocolo aumentó los niveles de glucosa en LCR a ~ 328 mg / dL después de la infusión de una solución de glucosa al 50% a una velocidad de flujo de 0.25 μL / h, en comparación con una concentración de glucosa en LCR de ~ 56 mg / dL en ratones que recibieron líquido cefalorraquídeo artificial (aCSF). Además, este protocolo no afectó los niveles de glucosa en sangre. Por lo tanto, este método se puede utilizar para determinar los efectos directos de la glucosa alta en LCR en la función cerebral o una vía neuronal específica independientemente de los cambios en los niveles de glucosa en sangre. En general, el enfoque descrito aquí facilitará el desarrollo de modelos animales para probar el papel de la glucosa alta en el LCR en la mediación de las características de la enfermedad de Alzheimer y / u otros trastornos neurodegenerativos asociados con la diabetes.
Introducción
Tanto la diabetes tipo 1 como la diabetes tipo 2 afectan la función cerebral 1,2,3. Por ejemplo, la diabetes aumenta el riesgo de deterioro cognitivo y trastornos neurodegenerativos, incluyendo la enfermedad de Alzheimer 3,4. Además, las personas con diabetes tienen una detección defectuosa de glucosa en el cerebro 5,6. Este defecto contribuye a la patogénesis de la hipoglucemia asociada al desconocimiento y a una respuesta contrarreguladora insuficiente a la hipoglucemia7,8, que puede ser fatal si no se trata inmediatamente.
Teniendo en cuenta que la diabetes aumenta los niveles de glucosa en la sangre, así como en el líquido cefalorraquídeo (LCR)9, es importante determinar si uno o ambos de estos factores contribuyen a la función cerebral deteriorada. Si la diabetes causa daño cerebral por la glucosa alta en LCR sola o en combinación con otros factores como la deficiencia de insulina o la resistencia a la insulina también es una pregunta abierta. Los modelos animales de diabetes tipo 1 y tipo 2 muestran deterioro cognitivo y neurodegeneración, además de un balance energético afectado y un metabolismo periférico de la glucosa10,11,12,13. Sin embargo, a partir de estos modelos, no es factible desacoplar los efectos selectivos de los niveles altos de glucosa en LCR versus los niveles de glucosa en sangre en la mediación de las complicaciones de la diabetes en la función cerebral.
Este protocolo describe métodos para desarrollar un modelo de ratón de hiperglicerrafia para probar los efectos de los niveles crónicamente altos de glucosa en LCR sobre la función cerebral, el equilibrio energético y la homeostasis de la glucosa. El modelo de ratón desarrollado a través de esta técnica presenta una herramienta para estudios que investigan el papel etiológico de la homeostasis desregulada de la glucosa en la función neuronal y conductual.
Por lo tanto, el enfoque propuesto será útil para comprender los efectos directos de los niveles elevados de glucosa en LCR en diversas condiciones fisiopatológicas.
Protocolo
Todos los procedimientos con ratones fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Rochester y se realizaron de acuerdo con las pautas del Servicio de Salud Pública de los Estados Unidos para el cuidado humanitario y el uso de animales de experimentación. Se obtuvieron comercialmente ratones machos C57BL / 6J de seis semanas de edad utilizados para este estudio. Todos los animales fueron alojados en grupo (5 ratones por jaula) en una habitación con un ciclo día/noche de 12 h y se les dio acceso a alimentos y agua ad libitum. Después de que a los ratones se les implantó una cánula para infundir glucosa en el ventrículo lateral, se alojaron solo para evitar cualquier daño a los implantes de otros ratones.
1. Montaje de minibombas osmóticas
- Prepare el líquido cefalorraquídeo artificial (LCR) de acuerdo con el siguiente protocolo. Disuelva NaCl (8,66 g), KCl (0,224 g), CaCl 2,2H 2 O (0,206 g) y MgCl 2,6H 2 O (0,163 g) en 500 ml de agua estéril para preparar la solución A. Disuelva Na 2 HPO 4.7H 2 O (0,214 g) y NaH 2 PO4. H2O(0,027 g) en 500 mL de agua estéril para preparar la solución B. Luego, mezcle la solución A y B en una proporción de 1: 1 para preparar el aCSF.
NOTA: Esta formulación de aCSF no contiene glucosa. - Para preparar la solución de glucosa al 50%, agregue 50 g de glucosa a 50 ml de aCSF en un vaso de precipitados. Coloque el vaso de precipitados en una placa caliente y lleve la temperatura de la suspensión a 60 °C. Mezcle la suspensión con un agitador magnético hasta que la glucosa se disuelva por completo.
- Agregue aCSF al vaso de precipitados para que el volumen final sea de 100 ml. Pase la solución a través del filtro de poros de 0,22 μm para esterilizarla.
- Prepare una solución salina al 0,9% (NaCl) y pase la solución a través del filtro de 0,22 μm.
- Coloque todos los componentes de la minibomba y el kit de infusión en una bandeja estéril y corte el tubo del kit de infusión cerebral a 1 pulgada de largo con una tijera estéril. Sostenga el tubo con un hemostático estéril y empújelo en la parte superior de un extremo de la cánula. Conecte el otro extremo del tubo a la parte superior del modulador de flujo. Cubra ambos extremos del tubo con una pequeña cantidad de pegamento para una conexión más fuerte.
- Coloque una aguja de 27 G en una jeringa de 1 ml y llénela con aCSF o la solución de glucosa. Inserte la aguja de 27 G en un pequeño trozo de tubo. Luego, conecte el tubo al extremo abierto del modulador de flujo y llénelo con la solución correspondiente hasta que las gotas de la solución comiencen a salir de la cánula. Retire cualquier burbuja de aire atrapada en el tubo.
- Para llenar la minibomba, sostenga la bomba en posición vertical e inserte la aguja de la jeringa en la bomba. Llénelo con la solución correspondiente hasta que comience a formarse una gota de la solución en la apertura de la minibomba.
- Inserte lentamente el modulador de flujo en la bomba mientras se asegura de no introducir burbujas de aire en el conjunto.
- Después de ensamblar las minibombas osmóticas, transfiéralas a un tubo cónico de 50 ml. Llene el tubo con la solución salina estéril para que las bombas queden completamente sumergidas, mientras se asegura de que la cánula permanezca fuera de la solución salina. Cuatro de estas bombas ensambladas se pueden colocar en un tubo de 50 ml.
- Coloque la tapa suelta en cada tubo e incube las bombas a 37 °C para cebar durante al menos 48 h.
2. Cirugía para implantar bombas osmóticas
- Procedimiento prequirúrgico
- Esterilice los instrumentos quirúrgicos en un autoclave y déjelos enfriar durante al menos 30 minutos antes de usarlos. Las condiciones del autoclave implican esterilización por vapor a 121 °C durante 30 min.
- Desinfecte el área de la cirugía con etanol al 70%. Limpie las perillas, las barras para los oídos y la superficie del marco estereotáxico.
NOTA: La cirugía debe realizarse en un ambiente aséptico, teniendo en cuenta evitar tocar superficies no estériles mientras se realiza la cirugía. Reemplace los guantes si hay sospecha de contaminación. - Coloque el ratón en una cámara de anestesia para anestesiarlo con isoflurano al 3% mezclado en aire durante 3-5 min. Luego, retire el ratón de la cámara y colóquelo en una cortina estéril. Mantener la anestesia a través de un cono nasal en 1.5% -2%.
- Pellizque la pata trasera del ratón para observar cualquier reflejo y verificar la profundidad de la anestesia.
- Inyecte 5 mg/kg de carprofeno por vía subcutánea para analgesia.
- Use cortapelos limpios para sujetar el área de la cirugía en la cabeza del ratón. Frote el cuero cabelludo primero con solución de povidona yodada y luego con hisopos de alcohol a fondo durante al menos 2 minutos. Repita este proceso al menos tres veces.
- Aplique un lubricante ocular para evitar que los ojos se sequen durante la cirugía.
- Cirugía
- Coloque el ratón sobre el marco estereotáxico y ajuste la cabeza en la barra incisiva. Cubra la nariz con el cono de la nariz. Aplique cortinas estériles para asegurar el área quirúrgica.
- Cambie el flujo de isoflurano al cono de la nariz. Continúe manteniendo la anestesia al 1,5% -2% de isoflurano.
- Coloque una almohadilla térmica debajo del ratón para mantener la temperatura corporal.
- Póngase guantes estériles nuevos y, con un bisturí, haga una incisión en la línea media (~ 10-15 mm de largo) en el cuero cabelludo. Exponga la superficie del cráneo con una espátula mientras usa puntas de algodón para limpiar cualquier sangrado.
NOTA: Use un cauterizador si sangra profusamente, lo cual es raro. - Frote con una punta de algodón sumergida en peróxido de hidrógeno al 3% para exponer las suturas craneales.
- Tome nota de bregma y lambda para navegar por las coordenadas del cráneo. Establezca todas las coordenadas en cero en bregma.
NOTA: Estas coordenadas se obtuvieron de un atlas cerebral de ratón14. La distancia bregma-lambda de referencia en el atlas es de 4,21 mm. Para corregir las diferencias basadas en la edad y el sexo en el tamaño del cráneo, se midió la distancia bregma-lambda para cada ratón y luego se dividió por 4,21 mm para obtener un factor de multiplicación. Por ejemplo, si la distancia entre bregma y lambda era de 4,65 mm, la división por 4,21 mm daba un factor de multiplicación de 1,10. Todas las coordenadas obtenidas del atlas se multiplicaron con este factor para medir las coordenadas reales que se utilizaron para perforar el agujero. En el ejemplo anterior, las coordenadas resultantes anterior-posterior (AP) y medial-lateral (ML) serían 0,55 y 1,1 mm, respectivamente (es decir, 1,1 x 0,5 o 1 mm). - Use un taladro eléctrico para hacer un agujero en estas coordenadas: 0,5 mm posterior a bregma y 1 mm lateral a la línea media hacia la derecha.
NOTA: Mientras perfora el orificio en el cráneo, tenga cuidado de no romper la duramadre. Asegúrese de que la broca sea estéril. Se puede colocar con otros instrumentos en la misma bolsa de autoclave para su esterilización. - Inserte un hemostático debajo de la piel incisa y empújelo hasta el lugar donde se implantará la minibomba osmótica. Abra y cierre suavemente el hemostático para hacer un bolsillo para la minibomba.
- Use un hemostático estéril para recoger una minibomba osmótica cebada de la punta del modulador de flujo. Empuje la bomba a través de la piel incisa en el bolsillo.
NOTA: Tenga cuidado de no dejar que la bomba y la cánula toquen ninguna superficie no estéril. - Aplique un poco de pegamento en la parte inferior de la cánula y fíjelo en el soporte de la cánula. Baje la cánula lentamente a través del orificio perforado 2 mm ventral hasta la superficie del cráneo. Déjelo allí durante al menos 5 minutos para permitir que el pegamento se solidifique.
- Antes de insertar la cánula en el cerebro, asegúrese de que la cánula no esté obstruida y que la solución fluya correctamente.
NOTA: A veces, la glucosa puede depositarse en la punta de la cánula debido a un caudal muy bajo, bloqueando el flujo. - Con la ayuda de una tijera, recorte la parte superior de la cánula asegurándose de que no se desprenda de la superficie del cráneo.
- Cubra la cánula con una capa de cemento dental para un soporte adicional.
- Use suturas de nylon (tamaño 5-0 y 30 pulgadas de largo) para cerrar la herida y aplique antibióticos tópicos en la herida para prevenir infecciones.
- Apague el isoflurano y deje que el animal se recupere de la anestesia. Luego, transfiera al animal a una nueva jaula limpia.
- Atención postoperatoria
- Después de la cirugía, controle al ratón durante al menos 1 semana.
- Administrar 5 mg/kg de carprofeno por vía subcutánea, una vez cada 24 horas durante tres días después de la cirugía.
- Deje que la herida sane completamente antes de retirar las suturas 7-10 días después de la cirugía.
NOTA: Se observó que los ratones con niveles altos de glucosa en LCR tardaron más en sanar. Recortar las uñas en las patas traseras del ratón minimiza la posibilidad de lesiones en el sitio de la incisión debido al comportamiento de rascado de los ratones.
3. Sustitución de las minibombas
NOTA: Dado que las minibombas utilizadas en este estudio duran solo 4 semanas, el reemplazo de minibombas también se probó para extender la duración de la infusión de glucosa, ya que puede ser necesario en el caso de estudios a largo plazo. Esto implicó los siguientes pasos.
- Prepare a los ratones para la cirugía como se detalla anteriormente.
- Haga una pequeña incisión vertical de 1 cm en la piel ligeramente por encima de la bomba.
- Inserte un hemostático debajo de la piel incisa y saque la bomba.
- Retire la bomba del tubo y conecte una nueva bomba cebada al tubo.
- Inserte la bomba de nuevo dentro y cose la piel.
- Siga las mismas instrucciones de cuidado después de la cirugía que se describieron anteriormente.
4. Procedimiento de recogida de la peste porcina clásica
- Preparación
- Tire de capilares de vidrio de 1 mm de diámetro con una máquina extractora de micropipetas para obtener puntas de 0,5 mm de diámetro. Los ajustes son: calor = 800, tracción = 15, velocidad = 5 y tiempo = 200 unidades. Coloque los capilares extraídos en una caja estéril hasta que los use.
- Acople una aguja de 27 G a una jeringa de 1 ml. Inserte el capilar tirado en la aguja y use una pequeña cinta adhesiva para asegurar la conexión.
- Fije firmemente la jeringa en un soporte capilar de un micromanipulador.
- A continuación, prepare el ratón para la cirugía, como se describe en el procedimiento previo a la cirugía anterior.
- Procedimiento quirúrgico
- Coloque el ratón sobre el marco estereotáxico. Después de fijar la cabeza en el marco, como se describió anteriormente, gire las perillas para inclinar la cabeza de modo que la nariz quede hacia abajo. Aplique cortinas estériles para asegurar el área quirúrgica.
- Haga una pequeña incisión en la superficie dorsal, comenzando desde el plano intraaural hasta el lado caudal.
NOTA: Tenga cuidado de no dañar el tubo mientras hace la incisión. - Retire el soporte del cuerpo del ratón y deje que el ratón descanse verticalmente para que el cuello quede completamente extendido dorsalmente.
- Con la ayuda de pinzas romas curvas, divida suavemente los músculos posteriores del cuello desde la línea media para crear una pequeña ventana. Luego, use un aplicador de punta de algodón húmedo para desplazar suavemente los músculos del cuello desde la línea media hasta la periferia.
- Observe si la cisterna magna está expuesta, que aparece como una ventana triangular con una membrana de duramadre transparente.
- Coloque el conjunto del micromanipulador en el marco estereotáxico junto al ratón mientras se asegura de que la punta capilar no toque ninguna superficie.
- Rompa suavemente la punta capilar sin alterar la configuración.
- Mientras mira dentro de la lupa (aumento de 2.25x), gire las perillas correspondientes en el micromanipulador para alinear lentamente y mover la punta capilar hacia la cisterna magna.
- Se siente cierta resistencia una vez que la punta capilar toca la membrana de la cisterna magna. Muy lentamente empuje la punta contra la membrana con la ayuda de las perillas.
NOTA: Tenga cuidado de no dañar ningún vaso sanguíneo en la membrana. Este paso es muy importante para evitar cualquier contaminación de la sangre en el LCR. - Perfore muy suavemente la membrana. El LCR comenzará a fluir hacia el capilar de inmediato debido a la presión negativa en el capilar.
- Deje la configuración durante unos minutos hasta que se recojan ~ 10 μL de LCR en el capilar.
- Luego, extraiga lentamente el capilar de la cisterna magna y presione suavemente un aplicador de punta de algodón estéril contra la abertura de la cisterna magna para detener la fuga de LCR.
- Retire con cuidado el capilar de la jeringa y conéctelo a un dispensador de bulbo de microtapa. Presione la bombilla para transferir el LCR a un tubo de microcentrífuga estéril.
- Coloque un soporte debajo del mouse y gire las perillas estereotáxicas para nivelar la cabeza.
- Cierre la herida con suturas de nylon.
- Inyecte 300 μL de solución salina estéril por vía subcutánea antes de retirar el ratón del aparato.
- Dar cuidado postoperatorio a los animales como se describió anteriormente, hasta que sea el momento de retirar las suturas-~7-10 días después de la cirugía.
5. Ensayo de glucosa
- Siga el protocolo descrito en el kit de ensayo colorimétrico de glucosa.
- Diluir la solución madre reguladora de fosfato de sodio suministrada en el kit hasta una concentración de 50 mM en agua ultrapura.
- Prepare estándares de glucosa en rangos de 0, 2.5, 5, 7.5, 10, 15, 20, 25 y 50 mg / dL de la solución madre de 1,000 mg / dL proporcionada en el kit en solución tampón diluida.
- Prepare una dilución de 7 veces de muestras de LCR en el tampón. Por ejemplo, si el volumen total de LCR recogido es de 10 μL, entonces el volumen diluido de siete veces será de 70 μL.
- Pipetear 15 μL de patrones de glucosa y LCR diluido por duplicados en una placa de 96 pocillos.
- Pipetear 85 μL de tampón diluido en cada uno de los pocillos con patrones y LCR.
- Agregue 6 ml de tampón diluido al vial de mezcla de enzimas calorimétricas de glucosa y vórtice durante unos segundos para mezclar bien.
- Agregue 100 μL de la preparación de la mezcla enzimática a cada pocillo para comenzar la reacción.
- Selle la placa con una hoja de cubierta y golpee suavemente la placa para mezclar los reactivos.
- Colocar la placa en una incubadora a 37 °C durante 10 min. Los viales con niveles altos de glucosa comienzan a volverse violetas inmediatamente.
- Después de 10 minutos, retire la tapa y mida la absorbancia a 500-520 nm con un lector de placas.
- Calcular la concentración de glucosa en las muestras de LCR interpolando sus valores de la curva estándar.
6. Análisis de glucosa en sangre
- Haga un pequeño corte lateral a la cola del ratón con una cuchilla de afeitar y use una gota de sangre para medir la glucosa en sangre con un glucómetro, de acuerdo con las instrucciones manuales.
Resultados
A los ratones machos se les implantó una cánula ensamblada en una minibomba osmótica (Figura 1) para infundir crónicamente aCSF o una solución de glucosa al 50% en sus ventrículos laterales (Figura 2). El LCR se recolectó 10 días después de la cirugía (Figura 3) para validar la eficacia de este procedimiento. Los resultados mostraron un aumento en los niveles de glucosa en LCR (media: 327,7 mg / dL) en ratones infundidos con 50% de glucosa en comparación con eso (media: 56,5 mg / dL) en ratones infundidos con aCSF. Esto es aproximadamente un aumento de seis veces en los niveles de glucosa en LCR en los ratones experimentales en comparación con sus compañeros de camada de control (Figura 4A). Los niveles de glucosa en sangre no fueron diferentes entre los grupos (Figura 4B).
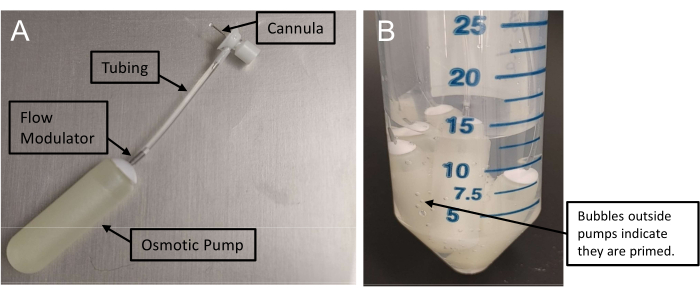
Figura 1: Montaje de minibombas osmóticas . (A) Conjunto de infusión con una cánula conectada a una minibomba a través de tubos. Estas bombas requieren al menos 48 h para cebarse. (B) La presencia de burbujas de aire fuera de las minibombas confirma el cebado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Aparatos estereotáxicos y accesorios. (A,B) Equipo estereotáxico con un micromanipulador adjunto y otros accesorios. (C) Coordenadas del orificio de rebabas para insertar la cánula. (D) Implantación de mini bomba osmótica, (E,F) Inserción de la cánula en el orificio perforado. Mantener condiciones asépticas durante toda la cirugía. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Procedimiento de recolección de líquido cefalorraquídeo (LCR). (A) Los músculos dorsales del cuello se desplazaron suavemente con pinzas romas para exponer la cisterna magna. Se utilizó un capilar de 1 mm con una punta de 0,5 mm de diámetro para (B) romper y (C,D) recoger el LCR de la cisterna magna. Haga clic aquí para ver una versión más grande de esta figura.
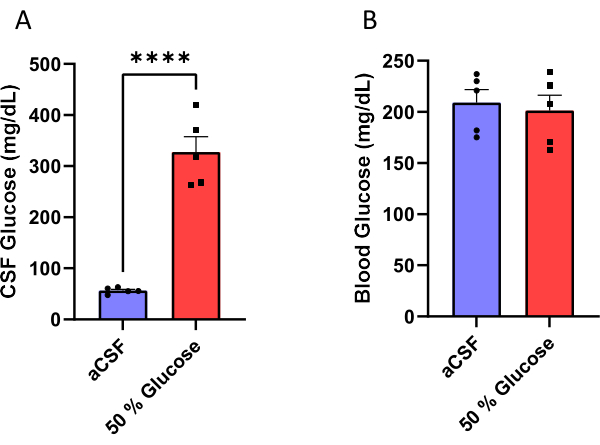
Figura 4: Medición de la glucosa. (A) Aumento de la glucosa en LCR (B) sin afectar los niveles de glucosa en sangre sin ayuno en ratones infundidos con solución de glucosa al 50% en el ventrículo lateral. La eficacia de este protocolo se validó midiendo la concentración de LCR y glucosa en sangre 10 días después de iniciar la infusión de glucosa. Los ratones infundidos con solución de glucosa al 50% tenían niveles de glucosa en LCR de 327,7 ± 30,1 mg / dL (media ± error estándar de la media) en comparación con los ratones que recibieron infusión artificial de LCR que tenían niveles de glucosa de 56,5 ± 2,6 mg / dL. p < 0,0001, prueba t no pareada. Las barras de error representan el error estándar de la media (n = 5). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este artículo informa un protocolo detallado para aumentar la glucosa en LCR en ratones mediante el uso de minibombas osmóticas conectadas a una cánula implantada en el ventrículo lateral. La infusión crónica de glucosa en el cerebro del ratón a través de este procedimiento será útil para delinear los efectos de la hiperglicerrafia a largo plazo en la cognición, el metabolismo sistémico de la glucosa y el equilibrio energético y para comprender mejor la patogénesis de las complicaciones de la diabetes.
La diabetes crónica causa daño cerebral que interrumpe la comunicación entre el cerebro y los órganos periféricos15. La diabetes también aumenta el riesgo de enfermedades neurodegenerativas, incluyendo la enfermedad de Alzheimer 3,4. La diabetes tipo 1 inducida por estreptozotocina (STZ) ha sido el modelo estándar para roedores en la investigación de la diabetes16; STZ daña las células β en el páncreas, lo que lleva a una patología similar a la diabetes tipo 1. Además, en una versión modificada, el uso de STZ acompañado de nicotinamidas puede inducir diabetes tipo 2. Otra forma de desarrollar fenotipos similares a la diabetes tipo 2 en animales es a través de alimentarlos con una dieta alta en grasas16. Sin embargo, en el contexto del estudio del efecto de la hiperglucemia en la función cerebral, estas técnicas son limitadas para controlar un gran número de factores (por ejemplo, los niveles periféricos de insulina/glucagón y la función metabólica en general). Por lo tanto, cualquier efecto de la diabetes inducida por STZ en la función cerebral solo puede interpretarse como una complicación asociada, en lugar de señalar un solo factor etiológico. La inyección aguda o la infusión crónica de sustancias en el espacio cerebroventricular es una técnica que se utiliza a menudo para probar sus efectos directos sobre la función cerebral. La inyección intracerebroventricular (ICV) de STZ se ha utilizado para desarrollar un modelo de roedor de la enfermedad de Alzheimer, sin embargo, sigue siendo incierto si el daño neural asociado a STZ se debe a la desregulación en la detección / homeostasis de glucosa u otros mecanismos independientes, como el estrés oxidativo inducido por STZ y el daño al ADN17.
Los procedimientos descritos en el protocolo actual serán útiles para desarrollar modelos de roedores que puedan responder preguntas de investigación, como si un aumento en la concentración de glucosa en LCR puede causar deterioro cognitivo. El protocolo descrito aquí podría usarse para determinar los efectos directos de los niveles altos de glucosa en LCR en el hipotálamo y el hipocampo, entre otras regiones cerebrales involucradas en la detección de nutrientes, el metabolismo y / o la cognición. Este método también aclararía si un aumento en los niveles de glucosa en LCR afecta la sensibilidad a la insulina, la secreción de insulina, la ingesta de alimentos y / o el equilibrio energético al inicio y en respuesta a las agresiones metabólicas. Además, el protocolo aquí informado sería aplicable en la prueba de hipótesis que requieren estudios longitudinales. Por ejemplo, los datos podrían recopilarse antes, durante y al final de las infusiones de glucosa para comparar los hallazgos de los mismos animales en diferentes momentos. Dicha estrategia abordaría si las complicaciones derivadas del nivel alto de glucosa en LCR son reversibles después de que se restablezca el nivel normal de glucosa en LCR. En contraste, el método también podría usarse para estudios de generación de hipótesis. Por ejemplo, el LCR podría recolectarse de los mismos animales en diferentes momentos y someterse a análisis metabolómicos o proteómicos para identificar biomarcadores o cualquier lesión metabólica producida por un alto nivel de glucosa en LCR. Del mismo modo, diferentes regiones del cerebro podrían analizarse mediante transcriptómica espacial para producir información específica de las células que puede haber sido alterada por la glucosa alta en LCR.
La justificación para infundir aCSF libre de glucosa a un grupo simulado fue mantener la concentración de glucosa en LCR en el nivel basal, de modo que cualquier cambio en el nivel de glucosa en LCR inducido por la implantación de cánulas pueda controlarse naturalmente. Los resultados en este estudio mostraron que el grupo simulado tenía una concentración de glucosa en LCR de ~ 60 mg / dL (~ 3 mM), que está en el rango normal de glucosa en LCR en ratones18. Los niveles de glucosa en LCR observados en individuos con diabetes tipo 2 son ~ 110 mg / dL o ~ 6 mM9. En el presente estudio, la infusión de ICV de glucosa al 50% a una velocidad de 125 μg / h elevó los niveles de glucosa en LCR a ~ 300 mg / dL (16 mM), que es suprafisiológico19. Aunque este nivel suprafisiológico de glucosa en LCR puede no ser clínicamente relevante para los niveles observados en individuos con diabetes tipo 2, los resultados presentados en este estudio muestran que la infusión de glucosa en LCR puede inducir una elevación crónica de la concentración de glucosa en LCR en ratones.
El método presentado aquí tiene algunas limitaciones. Se trata de una sofisticada cirugía cerebral de ratón que requiere capacitación, habilidades y experiencia relevantes en la realización de procedimientos tan avanzados. Debido a que el catéter y las minibombas se implantan a largo plazo, es necesario un cuidado meticuloso de los ratones durante todo el estudio para controlar los problemas de salud o daños en el conjunto del catéter. Se seleccionó una concentración de glucosa del 50% porque la viscosidad de una solución más allá de esta concentración podría haber afectado la infusión de glucosa en los ventrículos. Las minibombas utilizadas en este protocolo tenían un caudal de 0,25 μL/h, por lo que el grupo de ratones con infusión de glucosa al 50% recibió glucosa a una velocidad de 125 μg/h, o 3 mg de glucosa por día. Por lo tanto, esta dosis de glucosa por unidad de tiempo estaba limitada por el caudal de las minibombas.
En resumen, este artículo informa un método validado para el aumento crónico de glucosa en LCR en ratones. La información obtenida de este modelo será útil para determinar si un aumento en los niveles de glucosa en LCR está involucrado en la mediación de complicaciones asociadas a la diabetes, como trastornos neurodegenerativos, o causar insultos metabólicos periféricos en la diabetes y la obesidad.
Solución de problemas
Si el tubo se desprende de la cánula en los ratones, se puede aplicar una pequeña cantidad de pegamento en la conexión del tubo de la cánula mientras se ensambla la minibomba. Si los puntos se desprenden y la cánula se hace visible, el área de la incisión se puede cerrar completamente mediante el uso de suturas o grapas. Las uñas de las patas traseras del ratón deben recortarse, de modo que haya una menor posibilidad de rascarse el área de la cirugía por el ratón. Además, tenga cuidado de no atar las suturas tan apretadas que la piel se rasgará, ya que los ratones tienen una piel delicada.
Para una recuperación rápida después de la recolección de LCR, se recomienda la inyección de 300 μL de solución salina estéril por vía subcutánea después de la cirugía. Además, también es importante mantener el volumen máximo de recolección de LCR en 10 μL.
Divulgaciones
Los autores declaran que no tienen conflicto de intereses.
Agradecimientos
Los Institutos Nacionales de Salud otorgan DK124619 a KHC.
Fondos iniciales y premio de investigación piloto, Departamento de Medicina, Universidad de Rochester, NY, a KHC.
Premio de Investigación Piloto del Instituto Del Monte para la Neurociencia, Universidad de Rochester, a KHC.
Premio de Investigación Universitaria, Oficina del Vicepresidente de Investigación, Universidad de Rochester, NY, a KHC.
MUR diseñó y realizó el método, analizó los resultados, preparó gráficos y figuras, y escribió y editó el manuscrito. KHC concibió y supervisó el estudio, analizó los resultados y escribió y editó el manuscrito. KHC es el garante de este trabajo. Todos los autores aprobaron la versión final del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Membrane solutions | SFPES030022S | |
| 1 mL sterile Syringe (Luer-lok tip) | BD | 309628 | |
| 1 mL TB syringe | BD | 309659 | |
| 100 mL Glass beaker | Fisher | N/a | |
| 100% Ethanol (Koptec) | DLI | UN170 | Use 70% dilution to clean the surgery area |
| 50 mL conical tube | Fisher | N/A | |
| Allignment indicator | KOPF | 1905 | |
| Alzet brain infusion kit | DURECT | Kit # 3; 0008851 | Cut tubing in the kit to 1 inch length |
| Alzet osmotic pump | DURECT | 2004 | Flow rate 0.25 µL/h |
| Anesthesia system | Kent Scientific | SomnoSuite | |
| Betadine solution | Avrio Health | N/A | |
| CaCl2 . 2H2O | Fisher | C79-500 | |
| Cannula holder | KOPF | 1966 | |
| Centering scope | KOPF | 1915 | |
| Dental Cement Liquid | Lang Dental | REF1404 | |
| Dental cement Powder | Lang Dental | REF1220-C | |
| D-glucose | Sigma | G8270 | |
| Electric drill | KOPF | 1911 | While drilling a hole avoid rupturing dura mater |
| Eye lubricant (Optixcare) | CLC Medica | N/A | |
| Glass Bead sterilizer (Germinator 500) | VWR | 101326-488 | Place instruments in sterile water to let them cool before surgery |
| Glucose Assay Kit | Cayman chemical | 10009582 | |
| H2O2 | Sigma | H1009-500ml | Apply 3% H2O2 on skull surface to make the cranial sutures visible. |
| Hair Clipper | WAHL | N/A | |
| heating pad | Heatpax | 19520483 | |
| Hemostat | N/A | N/A | |
| Isoflurane (Fluriso) | Zoetis | NDC1385-046-60 | |
| KCl | VWR | 0395-500g | |
| Magnetic stand | WPI | M1 | |
| Magnifying desk lamp | Brightech | LightView Pro Flex 2 | |
| Metal Spatula | N/A | N/A | |
| MgCl2 . 6H2O | Fisher | BP214-500 | |
| Micromanipulator (Right handed) | WPI | M3301R | |
| Micromanipulator with digital display | KOPF | 1940 | |
| Na2HPO4 . 7H2O | Fisher | S373-500 | |
| NaCl | Sigma | S7653-5Kg | |
| NaH2PO4 . H2O | Fisher | S369-500 | |
| Neosporin | Johnson & Johnson | N/A | Apply topical oinment to prevent infection |
| Parafilm | Bemis | DM-999 | |
| Rimadyl (Carprofen) 50mg/ml | Zoetis | N/A | 5 mg/kg, subcutaneous, for analgesia |
| Scalpel | N/A | N/A | |
| Stereotaxic allignment system | KOPF | 1900 | |
| Sterile 27 gauge needle | BD | 305109 | |
| Sterile cotton tip applicators (Solon) | AMD Medicom | 56200 | |
| Sterile nylon sutures (5.0) | Oasis | MV-661 | Use non-absorable suture for closing the wound |
| Sterile sharp scissors | N/A | N/A | |
| Sterile surgical blades | VWR | 55411-050 | |
| Surgical gloves (Nitrile) | Ammex | N/A | Change gloves if there is suspision of contamination |
| Tray | N/A | N/A |
Referencias
- Moheet, A., Mangia, S., Seaquist, E. R. Impact of diabetes on cognitive function and brain structure. Annals of the New York Academy of Sciences. 1353, 60-71 (2015).
- Takeda, S., et al. Diabetes-accelerated memory dysfunction via cerebrovascular inflammation and Abeta deposition in an Alzheimer mouse model with diabetes. Proceedings of the National Academy of Sciences. 107 (15), 7036-7041 (2010).
- Arvanitakis, Z., Wilson, R. S., Bienias, J. L., Evans, D. A., Bennett, D. A. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function. Archives of Neurology. 61 (5), 661-666 (2004).
- Zilliox, L. A., Chadrasekaran, K., Kwan, J. Y., Russell, J. W. Diabetes and cognitive impairment. Current Diabetes Reports. 16 (9), 87(2016).
- Reno, C. M., Litvin, M., Clark, A. L., Fisher, S. J. Defective counterregulation and hypoglycemia unawareness in diabetes: mechanisms and emerging treatments. Endocrinology and Metabolism Clinics of North America. 42 (1), 15-38 (2013).
- Cryer, P. E., Davis, S. N., Shamoon, H. Hypoglycemia in diabetes. Diabetes Care. 26 (6), 1902-1912 (2003).
- Hwang, J. J., et al. Hypoglycemia unawareness in type 1 diabetes suppresses brain responses to hypoglycemia. The Journal of Clinical Investigation. 128 (4), 1485-1495 (2018).
- Cryer, P. E., Gerich, J. E. Glucose counterregulation, hypoglycemia, and intensive insulin therapy in diabetes mellitus. The New England Journal of Medicine. 313 (4), 232-241 (1985).
- Tigchelaar, C., et al. Elevated cerebrospinal fluid glucose levels and diabetes mellitus are associated with activation of the neurotoxic polyol pathway. Diabetologia. 65 (7), 1098-1107 (2022).
- Zheng, H., et al. Cognitive decline in type 2 diabetic db/db mice may be associated with brain region-specific metabolic disorders. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (1), 266-273 (2017).
- Ernst, A., et al. Diabetic db/db mice exhibit central nervous system and peripheral molecular alterations as seen in neurological disorders. Translational Psychiatry. 3 (5), 263(2013).
- Wang, Y., Yang, Y., Liu, Y., Guo, A., Zhang, Y. Cognitive impairments in type 1 diabetes mellitus model mice are associated with synaptic protein disorders. Neuroscience Letters. 777, 136587(2022).
- Jolivalt, C. G., et al. Type 1 diabetes exaggerates features of Alzheimer's disease in APP transgenic mice. Experimental Neurology. 223 (2), 422-431 (2010).
- Paxinos, G., Franklin, K. B. J. Paxinos and Franklin's The mouse brain in stereotaxic coordinates. , Academic Press. (2019).
- Vinik, A. I., Maser, R. E., Mitchell, B. D., Freeman, R. Diabetic autonomic neuropathy. Diabetes Care. 26 (5), 1553-1579 (2003).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Current Protocols. 1 (4), 78(2021).
- Grieb, P. Intracerebroventricular streptozotocin injections as a model of Alzheimer's disease: in search of a relevant mechanism. Molecular Neurobiology. 53 (3), 1741-1752 (2016).
- Kealy, J., et al. Acute inflammation alters brain energy metabolism in mice and humans: role in suppressed spontaneous activity, impaired cognition, and delirium. The Journal of Neuroscience. 40 (29), 5681-5696 (2020).
- Dougherty, J. M., Roth, R. M. Cerebral spinal fluid. Emergency Medicine Clinics of North America. 4 (2), 281-297 (1986).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados