Method Article
Ex Vivo Анализ механически активированных переходных процессовCa 2+ в уротелиальных клетках
В этой статье
Резюме
Этот протокол описывает методологию оценки функции механически активированных ионных каналов в нативных уротелиальных клетках с использованием флуоресцентного датчика Ca2+ GCaMP5G.
Аннотация
Механически активируемые ионные каналы являются биологическими преобразователями, которые преобразуют механические стимулы, такие как силы растяжения или сдвига, в электрические и биохимические сигналы. У млекопитающих механически активированные каналы необходимы для обнаружения внешних и внутренних раздражителей в таких разнообразных процессах, как ощущение осязания, слух, регуляция объема эритроцитов, регуляция базального артериального давления и ощущение наполненности мочевого пузыря. В то время как функция механически активированных ионных каналов была широко изучена в условиях in vitro с использованием метода патч-зажима, оценка их функции в их естественной среде остается сложной задачей, часто из-за ограниченного доступа к сайтам экспрессии этих каналов (например, афферентным терминалям, клеткам Меркеля, барорецепторам и почечным канальцам) или трудностей с применением метода патч-зажима (например, апикальные поверхности уротелиальных зонтичных клеток). В этом протоколе описывается процедура оценки механически вызванных переходных процессов Ca 2+ с использованием флуоресцентного датчика GCaMP5G в уротелиальном препарате ex vivo, метод, который может быть легко адаптирован для изучения механически вызванных событий Ca2+ в других препаратах нативной ткани.
Введение
Эпителиальные клетки в мочевыводящих путях подвергаются механическим воздействиям, когда фильтрат мочи проходит через нефроны, а моча откачивается из почечной лоханки и проходит через мочеточники для хранения в мочевом пузыре. Давно признано, что механические силы (например, напряжение сдвига и растяжение), действующие жидкостями на эпителиальные клетки, выстилающие мочевыводящие пути, регулируют реабсорбцию белка в проксимальных канальцах и растворенных веществ в дистальном отделе нефрона 1,2,3,4,5,6,7,8,9,10,11, 12,13, а также накопление мочи в мочевом пузыре и мочеиспускании14,15,16,17.
Преобразование механических стимулов в электрические и биохимические сигналы, процесс, называемый механотрансдукцией, опосредуется белками, которые реагируют на деформацию клеточных структур или связанного с ними внеклеточного матрикса 18,19,20,21. Механически активированные ионные каналы уникальны в том смысле, что они переходят из замкнутого состояния в открытое проницаемое состояние в ответ на изменения натяжения мембраны, давления или напряжения сдвига 18,19,20,21,22. Кроме того, переходные процессы Ca2+ могут быть инициированы интегрин-опосредованной механотрансдукцией или активацией механочувствительных адгезионных систем на межклеточных соединениях23,24,25,26. Функцию ионного канала обычно оценивают с помощью метода пластыря-зажима, который включает образование гигаомного уплотнения между клеточной мембраной и пластырем-пипеткой27. Однако клетки, расположенные в глубоких тканевых слоях с плотным внеклеточным матриксом (например, почечные канальцы) или окруженные физическим барьером (например, гликокаликсом), труднодоступны с помощью стеклянной микропипетки. Аналогичным образом, клетки, встроенные или являющиеся неотъемлемыми частями тканей с плохой механической стабильностью (например, уротелий), не могут быть легко изучены с помощью метода пластыря. Поскольку многие механически активированные ионные каналы проницаемы для Ca 2+, альтернативным подходом является оценка их активности с помощью флуоресцентной микроскопии с использованием Ca2+-чувствительного красителя или генетически кодируемых кальциевых индикаторов (GECI), таких как GCaMP. Недавние усилия в области белковой инженерии значительно увеличили динамический диапазон, чувствительность и реакцию GECI28,29,30, а достижения в области генетики позволили их экспрессию в определенных клеточных популяциях, что сделало их идеально подходящими для изучения механотрансдукции.
Уротелий, многослойный эпителий, покрывающий внутреннюю часть мочевого пузыря, функционирует как барьер, предотвращая диффузию растворенных веществ в моче в интерстиций мочевого пузыря, но также функционирует как преобразователь, определяя наполненность мочевого пузыря и сообщая об этих событиях нижележащим нервам и мускулатуре16. Предыдущие исследования показали, что для связи между уротелием и подлежащими тканями требуются механически активированные ионные каналы Piezo1 и Piezo231. Для оценки механически индуцированных переходных процессов Ca 2+ в уротелиальных клетках была разработана новая описанная методика, которая использует перенос генов аденовируса для экспрессии датчика Ca2+ GCaMP5G в уротелиальных клетках. В этом методе используется подготовка листа слизистой оболочки, которая обеспечивает легкий доступ к самому внешнему зонтичному клеточному слою, и компьютерная система для одновременной механической стимуляции отдельных клеток с помощью закрытой стеклянной микропипетки и регистрации изменений флуоресценции с течением времени.
протокол
Уход за животными и обращение с ними осуществлялись в соответствии с Комитетом по уходу за животными и их использованию Университета Питтсбурга. Для настоящего исследования использовались самки мышей C57Bl/6J в возрасте 2-4 месяцев. Мыши были получены коммерчески (см. Таблицу материалов).
1. Сборка и настройка оборудования
- Выполняйте визуализацию Ca2+ с помощью вертикального микроскопа, оснащенного камерой высокого разрешения и стабильным источником света (см. Таблицу материалов).
- Получайте изображения с помощью программного обеспечения, совместимого с микроскопом, которое позволяет напрямую управлять камерой, источником света и пьезоприводом через цифровое устройство ввода-вывода USB (см. Таблицу материалов).
ПРИМЕЧАНИЕ: На рисунке 1 показана схема установки. GCaMP5G имеет пиковую длину волны возбуждения 470 нм и пиковую длину волны излучения 497 нм28. Используйте куб фильтра, подходящий для обработки изображений GCaMP5G.
- Получайте изображения с помощью программного обеспечения, совместимого с микроскопом, которое позволяет напрямую управлять камерой, источником света и пьезоприводом через цифровое устройство ввода-вывода USB (см. Таблицу материалов).
- Для стимуляции отдельных уротелиальных клеток в препарате слизистой оболочки мочевого пузыря (см. шаг 2) используют пьезоэлектрический привод, управляемый одноканальным пьезоконтроллером с разомкнутым контуром (см. Таблицу материалов). Установите пьезоэлектрический привод в микроманипулятор.
- Установите стеклянные микропипетки в держатель пипетки, прикрепленный к пьезоэлектрическому приводу (рис. 1). Дистанционное управление пьезоконтроллером с помощью аналого-цифрового преобразователя, управляемого программой сбора и анализа электрофизиологических данных (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Внешний триггер в виде сигнала транзисторно-транзисторной логики (TTL), инициируемого программным обеспечением для обработки изображений, используется для запуска протокола стимуляции в программном обеспечении для сбора и анализа данных электрофизиологии, которое перемещает пьезоэлектрический привод (рис. 1).
- Установите стеклянные микропипетки в держатель пипетки, прикрепленный к пьезоэлектрическому приводу (рис. 1). Дистанционное управление пьезоконтроллером с помощью аналого-цифрового преобразователя, управляемого программой сбора и анализа электрофизиологических данных (см. Таблицу материалов).
- Убедитесь, что программное обеспечение для обработки изображений (см. Таблицу материалов) взаимодействует с цифровым устройством ввода-вывода. Настройте цифровой выходной канал в цифровом устройстве ввода-вывода USB для доставки сигнала TTL на аналого-цифровой преобразователь, который инициирует протокол в программном обеспечении электрофизиологии, который перемещает пьезоэлектрический привод.
- Используйте кабель для подключения порта Start BNC в аналого-цифровом преобразователе к земле (GND) и винтовую клемму в цифровом устройстве ввода-вывода USB.
- Настройте протокол записи в программном обеспечении для обработки изображений.
ПРИМЕЧАНИЕ: Следующие шаги описывают, как сгенерировать протокол, который отправит сигнал TTL и начнет сбор изображений через определенные промежутки времени.- Настройте протокол сбора данных в программном обеспечении для обработки изображений, щелкнув диспетчер экспериментов и выбрав « Новый эксперимент». Откроется новое окно.
- Выберите значок Time Lapse Loop и перетащите его во вновь открывшееся окно; Установите количество циклов равным 2, а интервал — самым быстрым параметром, разрешенным в настройке.
- На значке Transmit Shutter/Manual Shutter выберите значок NI USB-6501 и перетащите его в окно Time Lapse Loop, а затем установите NI USB-6501 как закрытый. Перетащите дополнительный NI USB-6501 с передающего затвора/ручного затвора в окно Time Lapse Loop и установите его как открытый. Чтобы соединить два значка NI USB-6501, перетащите стрелку сбоку от значка закрытия NI USB-6501 и тяните, пока он не коснется значка открытия NI USB-6501. Появится линия, соединяющая оба значка.
- Перетащите другой цикл замедленной съемки в окно диспетчера экспериментов и соедините его с первым, потянув за наконечник стрелки. Задайте параметры для записи. Установите количество циклов нового цикла замедленной съемки равным 2400.
- На значке « Получение изображения » перетащите фильтр GFP в недавно открытый цикл замедленной съемки и установите время экспозиции на 100 мс.
- Установите тип изображения камеры на 8 бит, разрешение на 576 x 576 (объединение 4 x 4), тактовую частоту пикселей на 480 МГц и стандартную коррекцию горячих пикселей.
ПРИМЕЧАНИЕ: Параметры можно регулировать в зависимости от уровня экспрессии флуоресцентного датчика, чувствительности камеры и конфигурации настройки.
- Настройте лабораторный стол в программном обеспечении для электрофизиологии (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Это определит выходной сигнал аналого-цифрового преобразователя в мВ.- Перейдите в меню «Настроить» в программном обеспечении для электрофизиологии и выберите «Лабораторный стенд». В появившемся окне «Выходные сигналы» выберите «Аналоговый выход #1», нажмите кнопку «Добавить сигнал» и назовите его (например, «Пьезо»). Установите сигнальную единицу измерения на мВ, а коэффициент масштабирования (мВ/В) — на 1.
- Сгенерируйте протокол стимуляции в программном обеспечении для электрофизиологии, выполнив следующие действия.
- Чтобы сгенерировать новый протокол стимуляции в программе для электрофизиологии, перейдите в пункт меню « Получить » и выберите « Новый протокол».
- Установите для параметра «Режим/скорость» значение «Эпизодическая стимуляция», для параметра «Запуск/пробная версия» — значение 1, для параметра «Развертка/прогон» — значение 1, а для параметра «Продолжительность развертки» — значение 150.
- В меню « Выходы » выберите канал #1 Piezo в качестве аналогового выхода.
- В меню «Триггер » установите триггер на « Вход запуска дигитайзера » и « Внутренний таймер».
- В меню «Форма сигнала» выберите «Канал #1» и «Аналоговый сигнал с эпохами». Задайте для шага A значение Step, для параметра First Level — значение 0, для параметра Delta level — значение 0, для параметра First duration — значение 10000, а для параметра Delta duration — значение 0.
- Установите для шага B значение «Шаг», для первого уровня — значение 10, для дельта-уровня — значение 0, для параметра «Первая продолжительность» — значение 1000, а для параметра «Дельта-длительность» — значение 0. Задайте для шага C значение Шаг, для первого уровня — значение 0, для дельта-уровня — значение 0, для параметра Первая длительность — значение 130000, а для параметра «Дельта-длительность» — значение 0.
- Сохраните протокол и назовите его Протокол стимуляции.
- Используйте кабель BNC для подключения аналогового выхода #1 в аналого-цифровом преобразователе к EXT INPUT в передней части одноканального пьезоконтроллера с разомкнутым контуром (см. Таблицу материалов).
- Изготовьте стеклянные микропипетки для механической стимуляции зонтичных клеток из капиллярной стеклянной трубки, выполнив следующие действия.
- Поместите капиллярное стекло в съемник (см. Таблицу материалов) и отрегулируйте его с помощью капиллярных удерживающих ручек.
- Расположите нагревательный блок на полную высоту. Отрегулируйте ползунок первого положения фиксации вытягивания съемника на 5.
- Установите первую ручку нагревателя на 76,7, а вторую ручку на 52,7.
- Потяните стеклянный капилляр в два приема, нажав кнопку запуска.
- Закройте наконечник микропипетки микрокузницей (см. Таблицу материалов) ручкой регулировки нагревателя, установленной на 60.
ПРИМЕЧАНИЕ: Для настоящего протокола конечный диаметр наконечника микропипетки, используемого для протыкания отдельных клеток, составляет ~ 1-3 мкм.
- Убедитесь, что стимулирующая микропипетка перемещается на расстояние, указанное в протоколе стимуляции.
ПРИМЕЧАНИЕ: Следующие шаги предназначены для обеспечения того, чтобы через 12,5 с после запуска протокола стимуляции в программном обеспечении электрофизиологии генерировался импульс напряжения длительностью 1 с, заставляющий пьезоэлектрический привод перемещаться на 20 мкм.- Установите микропипетку в держатель и прикрепите ее к пьезоэлектрическому приводу.
- Разместите пьезоэлектрический привод и прикрепленную микропипетку параллельно центру предметного столика микроскопа и в зоне обзора.
- Сосредоточьтесь на наконечнике пипетки и иммобилизуйте пьезоэлектрический монтажный стержень (см. Таблицу материалов) с помощью ленты. При ярком полевом освещении отрегулируйте параметры камеры, чтобы получить четкое изображение наконечника пипетки.
- Откройте протокол стимуляции в программе электрофизиологии и настройте его на воспроизведение.
ПРИМЕЧАНИЕ: Протокол электрофизиологии не запустится до тех пор, пока не будет получен сигнал TTL, отправленный программным обеспечением для визуализации. - В Experiment Manager в программном обеспечении для работы с изображениями нажмите кнопку Пуск, чтобы начать сбор данных.
ПРИМЕЧАНИЕ: Это запустит протокол в программном обеспечении электрофизиологии, который будет управлять пьезоэлектрическим приводом. Протокол в программном обеспечении для обработки изображений сгенерирует файл с изображениями эксперимента.
- Проверьте расстояние, пройденное пипеткой, выполнив следующие действия.
- Чтобы измерить расстояние, пройденное пипеткой во время протокола стимуляции, выберите пункт «Подсчет и измерение » в программном обеспечении для визуализации.
- В меню «Измерение» выберите параметр «Измерение и окупаемость инвестиций», и под окном фильма появится новое окно.
- В меню « Мера » выберите « Произвольная линия».
- В окне фильма нарисуйте произвольную линию, начинающуюся с кончика пипетки. Обратите внимание, что конец произвольной строки будет скорректирован позже.
- Щелкните правой кнопкой мыши произвольную линию , чтобы преобразовать ее в интересующую область (ROI), которая будет видна во всех кадрах фильма.
- Осмотрите пленку и отрегулируйте конец произвольной линии (ROI) до конечного положения, пройденного пипеткой в ответ на стимул.
ПРИМЕЧАНИЕ: Расстояние, пройденное пипеткой в мкм, появится в окне «Измерение и окупаемость инвестиций ». Протокол стимуляции может быть изменен в соответствии с потребностями пользователя.
2. Трансдукция in situ и изоляция слизистой оболочки мочевого пузыря
- Трансдуцировать мочевой пузырь самок мыши in situ с помощью аденовируса, кодирующего кДНК CGaMP5G, в соответствии с процедурой, описанной в протоколе31 трансдукции вируса.
- При трансдуцировании уротелиальных клеток для экспериментов по визуализации Ca2+ закапывают мочевой пузырь 50 мкл раствора, содержащего 2 x 107 инфекционных вирусных частиц (IVP).
ПРИМЕЧАНИЕ: Этот метод имеет тенденцию ограничивать экспрессию CGaMP5G зонтичным клетным слоем. В качестве альтернативы эксперименты могут быть проведены с мочевыми пузырями, собранными у трансгенных мышей, экспрессирующих CGaMP5G в уротелиальных клетках (т.е. экспрессия GCaMP5G, управляемая промотором уроплакина-2) или любого другого типа клеток, представляющих интерес.
- При трансдуцировании уротелиальных клеток для экспериментов по визуализации Ca2+ закапывают мочевой пузырь 50 мкл раствора, содержащего 2 x 107 инфекционных вирусных частиц (IVP).
- Через 24-72 ч после трансдукции усыпляют мышей путем удушенияСО2 и выполняют торакотомию, вскрывая грудную полость ножницами, чтобы вызвать коллапс легких.
- Канулировать мочеиспускательный канал с помощью катетера 24 G. Обнажите мочевой пузырь разрезом брюшной полости ~ 1,5 см через кожу и мышцу и используйте шов 6,0 (см. Таблицу материалов), чтобы закрепить катетер на мочеиспускательном канале.
- Соберите мочевой пузырь иуретру 32 и прикрепите к прокладке-держателю из силиконовой резины (см. Таблицу материалов), залитой регистрирующим раствором, содержащим (в мМ): 135 NaCl, 5,0 KCl, 1 MgCl 2, 2,5 CaCl2, 10 глюкозы, 10 HEPES, pH7,4 и вздутие со 100% O2 (рис. 2A).
- Отделите слизистую оболочку мочевого пузыря от нижележащего мышечного слоя тонкими щипцами в соответствии с ранее опубликованными отчетами32 (рис. 2B).
- Разрежьте слизистую оболочку мочевого пузыря и прикрепите ее уротелием лицом вверх к вставке из силиконового эластомера на дне чашки для культивирования ткани диаметром 35 мм (рис. 2C).
3. Механическая стимуляция отдельных уротелиальных клеток и визуализацияCa2+
- Установите чашку для культивирования ткани с закрепленной слизистой оболочкой мочевого пузыря в столике микроскопа, оснащенном инкубатором для культивирования с резистивными нагревательными элементами (рис. 2E). Перфузируйте (следуя инструкциям производителя, см. Таблицу материалов) чашку для культивирования клеток непрерывно со скоростью 1,7 мл / мин с регистрирующим раствором, нагретым при ~ 37 ° C с помощью встроенного нагревателя.
- Поддерживайте температуру инкубатора с тканевой посудой и растворов на уровне ~ 37 °C с помощью двухканальной модели биполярного регулятора температуры (см. Таблицу материалов). Уравновесьте ткань в камере непрерывной перфузией в течение не менее 15 мин, прежде чем проводить дальнейшие экспериментальные процедуры.
- Для регистрации механически индуцированных переходных процессов Ca2+ погрузите микропипетку в раствор, омывая слизистую оболочку прижатого мочевого пузыря в тканевой чашке. Переместите микропипетку в центр поля с помощью сканирующего объектива с малым увеличением (4x) с использованием яркой подсветки.
- Перемещайте микропипетку вблизи поверхности уротелиальной ткани, координируя перемещение микроманипулятора в вертикальной плоскости и регулируя фокус.
- Переключите объектив на объектив с большим увеличением (20x), подходящий для иммунофлуоресценции с высокой числовой апертурой (NA).
- Установите микроманипулятор в положение «Точно » и переместите микропипетку в верхнюю часть клетки-мишени.
- Измените поле зрения на камеру и нажмите Live в программном обеспечении для обработки изображений.
ПРИМЕЧАНИЕ: Это должно включить отраженный затвор и позволить наблюдать за флуоресцентным сигналом, излучаемым тканью в компьютере. - Отрегулируйте фокус, чтобы визуализировать верхнюю часть ячейки, и при необходимости отрегулируйте положение пипетки.
- Откройте протокол стимуляции в программе электрофизиологии и настройте его на воспроизведение.
ПРИМЕЧАНИЕ: Протокол в программном обеспечении для электрофизиологии не запустится до тех пор, пока не будет получен сигнал TTL, отправленный программным обеспечением для визуализации. - В Experiment Manager в программном обеспечении для работы с изображениями нажмите кнопку Пуск, чтобы начать сбор данных. Это запустит протокол в программном обеспечении электрофизиологии, который будет управлять пьезоэлектрическим приводом и генерировать файл с изображениями эксперимента. Протокол стимуляции может быть изменен в соответствии с потребностями пользователя.
4. Анализ данных
- Количественно оцените интенсивность флуоресценции с течением времени, выполнив следующие действия.
- Откройте файл изображения в программе обработки изображений и выберите окно « Подсчет и измерение ». Выберите инструмент «Многоугольник » и нарисуйте ROI на границах ячейки, в которую было вставлено.
- Перейдите в окно « Измерение», выберите « Профиль интенсивности», установите для измерения значение « С течением времени», « Результаты » — значение « Среднее», « Фоновое вычитание » — значение «Нет», а затем нажмите «Выполнить». Средняя интенсивность флуоресценции будет рассчитана с течением времени (рис. 3).
- Чтобы экспортировать данные профиля интенсивности, щелкните значок Excel в окне «Результаты профиля интенсивности ». Это позволит пользователю выбрать папку назначения и имя файла и сохранить данные в формате .xlsx.
- Выполняйте анализ данных с помощью научного графика и программного обеспечения для анализа данных (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Амплитуда пика Ca2+ , вызванного тычком, выражается как изменение интенсивности флуоресценции (ΔF / F), где F - интенсивность флуоресценции GCaMP5G в момент времени 0, а ΔF - разница между максимумами интенсивности флуоресценции и базальной в момент времени 0. Затухание отклика Ca2+ также может быть рассчитано (не показано).
Результаты
Настоящий протокол описывает метод оценки механически вызванных переходных процессов Ca 2+ в зонтичных клетках с использованием флуоресцентного датчика Ca2+ GCaMP5G. Аденовирусная трансдукция использовалась для экспрессии GCaMP5G в уротелиальных клетках из-за ее высокой эффективности и повышения уровня экспрессии. Флуоресцентные изображения окрашенных криосекций из трансдуцированного мочевого пузыря показаны на рисунке 2D. Для этих экспериментов экспрессия GCaMP5G является самой высокой в слое зонтичной клетки. Последовательность репрезентативных изображений, полученных во время эксперимента, в котором была проткнута зонтичная ячейка, показана на рисунке 3A. На первом изображении на рисунке 3A показан флуоресцентный вид стимулирующей пипетки, расположенной на верхней части зонтичной клетки слизистой оболочки мочевого пузыря, экспрессирующей GCaMP5G. Механическая стимуляция зонтичной клетки, экспрессирующей GCaMP5G, вызывает деформацию (см. изображение на рисунке 3A через 12,5 с) с последующим быстрым увеличением флуоресцентного излучения (см. изображение на рисунке 3A через 13,5 с). Изменение флуоресценции было построено в зависимости от времени (рис. 3B). Как сообщалось ранее31, тыкание вызывает реакцию Ca2+ в большинстве зонтичных клеток, протестированных в мочевом пузыре контрольной группы и мышей дикого типа, трансдуцированных GCaMP5G. Удаление Piezo1 и Piezo2 из зонтичных ячеек уменьшало пиковую амплитуду ответа Ca2+ 31. При сравнении влияния различных методов лечения или генетических предпосылок на механически вызванные реакции Ca2+ важно стандартизировать экспериментальные условия, включая трансдукцию мочевого пузыря, крепление ткани, размер кончика пипетки, используемой для вдавливания, продолжительность и амплитуду механического стимула, а также условия визуализации.
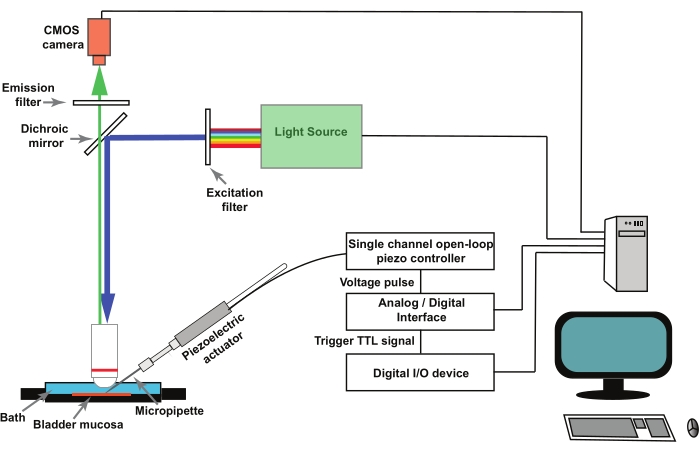
Рисунок 1: Экспериментальная установка для регистрации механо-активированных переходных процессов Ca2+ в уротелиальных клетках. Установка состоит из вертикального микроскопа, флуоресцентного источника света, фильтров возбуждения и излучения, а также КМОП-камеры. Программное обеспечение для обработки изображений управляет системой. Пьезоэлектрический привод, управляемый одноканальным пьезоконтроллером с разомкнутым контуром, используется для перемещения тыкающей микропипетки. Стеклянные микропипетки монтируются в держатель пипетки, прикрепленный к пьезоэлектрическому приводу. Пьезоэлектрический привод и связанная с ним микропипетка установлены на микроманипуляторе (не показан). Пьезоконтроллер с разомкнутым контуром дистанционно управляется аналого-цифровым преобразователем и программным обеспечением для электрофизиологии. Протокол записи в программном обеспечении визуализации подает сигнал TTL через цифровое устройство ввода-вывода, и это инициирует протокол стимуляции в программном обеспечении электрофизиологии, которое управляет пьезоэлектрическим и, следовательно, захватом изображения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Выделение и монтаж слизистой оболочки мочевого пузыря для визуализации Ca2+ . (A) Препарирование слизистой оболочки с прикрепленным катетером. Слизистая оболочка мочевого пузыря была удалена из нижележащего мышечного слоя тонкими щипцами. (B) Увеличенное изображение ободранной слизистой оболочки мочевого пузыря, показанное на диаграмме (А). (C) Слизистая оболочка была прикреплена уротелием вверх штифтами для насекомых толщиной 0,15 мм к вставке из силиконового эластомера. (D) Конфокальные иммунофлуоресцентные изображения поперечного сечения препарата слизистой оболочки, окрашенного антителом против GFP и вторичным конъюгированным антителом против кролика осла (зеленый), родамин-фаллоидин (красный) и DAPI (синий). Препарат слизистой оболочки мочевого пузыря включает в себя часть собственной пластинки (ЛП). Стрелки указывают на расположение слоя зонтичной клетки (Ub). Масштабные линейки = 50 мкм. (E) Фотография экспериментальной установки. а, линейный нагреватель; б, пьезоэлектрический привод; c, нагревательные элементы и контроллер; d, держатель пипетки и микропипетка; Лист слизистой оболочки прикрепляют к силиконовой вставке в тканевую культивируемую посуду и инкубатор для посуды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3. Регистрация и анализ механоактивированных переходных процессовCa2+ в уротелиальных клетках. (A) Последовательность флуоресцентных изображений, полученных в различные моменты времени в ходе эксперимента. Обратите внимание, что механическая стимуляция зонтичной клетки вызывает деформацию с последующим быстрым увеличением излучения GCaMP5G (стрелка). Границы стимулированной клетки (ROI) отмечены красным цветом. (B) Изменение интенсивности флуоресценции (ΔF/F) с течением времени для восьми независимых механически стимулированных клеток в препарате слизистой оболочки мочевого пузыря контрольной мыши. Время отступа (12,5 с) отмечено синей стрелкой. Данные, приведенные в подпункте (В), были изменены по сравнению с Dalghi et al.31. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Все организмы и, по-видимому, большинство типов клеток экспрессируют ионные каналы, которые реагируют на механические раздражители 20,33,34,35,36,37. Функция этих механически активированных каналов была в основном оценена с помощью метода патч-зажима. Однако из-за проблем с доступностью исследования механически активированных ионных каналов с помощью патч-зажима были в значительной степени ограничены диссоциированными клетками и клеточными линиями. Поскольку многие механически активированные ионные каналы проницаемы для Ca2+, мы воспользовались последними достижениями в области микроскопии, биозондирования и микроманипуляций для разработки метода визуализации для оценки функции механически активированных каналов в уротелиальном препарате ex vivo. В этом протоколе уротелиальные клетки трансдуцируются аденовирусом, кодирующим GCaMP5G. Аденовирусные векторы идеально подходят для изучения передачи сигналов Ca 2+ в уротелии, поскольку они обеспечивают высокую скорость трансдукции и высокий уровень экспрессии GCaMP5G в уротелиальных клетках (рис. 2D). В этих условиях фоновая флуоресценция относительно низкая. Если аденовирусная трансдукция используется для экспрессии генетически кодируемого сенсораCa2+, особое внимание следует уделять оптимизации условий, чтобы только интересующие клетки экспрессировали сенсор. В качестве альтернативы экспрессия генетически кодируемых индикаторов Ca2+ (GECI) может быть достигнута путем скрещивания мышей, несущих флоксированный трансген, кодирующий интересующий белок (например, GCaMP5G), и мышей, экспрессирующих Cre рекомбиназу под контролем подходящего промотора. Этот подход не требует хирургических процедур и имеет то преимущество, что обеспечивает целевую экспрессию и даже уровни экспрессии белков в клетках, экспрессирующих Cre-рекомбиназу.
В описанном здесь протоколе используется вертикальный широкопольный микроскоп для оценки механически активированных переходных процессов Ca2+ в зонтичных клетках, стимулированных закрытой микропипеткой, отполированной огнем. Метод может быть адаптирован для изучения механотрансдукции в более глубоких слоях уротелия или даже клеток в собственной пластинке с помощью вертикального конфокального или двухфотонного микроскопа. Использование конфокального микроскопа может обеспечить необходимое разрешение для определения субклеточных изменений внутриклеточного Ca2+ , которые происходят в ответ на механическую стимуляцию. В этом протоколе используется закрытая микропипетка, отполированная огнем, для прокалывания отдельных зонтичных клеток. Основное преимущество использования микропипетки для стимуляции заключается в том, что механическое возмущение, воздействующее на ткань, является преходящим и ограничивается интересующей клеткой и окружающей областью. В то время как системы растяжения клеток могут быть использованы для механической стимуляции клеток, выращенных на мембранах PDMS, присущие им ограничения препятствуют использованию таких устройств для экспериментов по визуализации с препаратами ex vivo . Эти ограничения включают проблемы с установкой и визуализацией мочевого пузыря мыши и, учитывая складчатую природу слизистой оболочки мочевого пузыря, трудности в поддержании фокуса на интересующих клетках при растяжении ткани.
Протокол измерения механически активированных переходных процессовCa2+ в уротелиальных препаратах имеет некоторые ограничения. Во-первых, установка включает в себя относительно дорогие компоненты, а ее сборка и настройка требуют опыта работы с микроскопами, микроманипуляторами, аналого-цифровыми преобразователями и относительно специализированным программным обеспечением. Как и пластырь, этот метод требует, чтобы исследователь научился пользоваться микроманипулятором и делать стеклянные микропипетки для механической стимуляции. Однако, в отличие от метода патч-зажима, который включает в себя формирование высокопрочного уплотнения между пипеткой и мембраной, описанная здесь процедура измерения механически активированных переходных процессов Ca2+ относительно проста и требует от исследователя только расположения стимулирующей пипетки близко к поверхности стимулируемой клетки. Таким образом, обученный исследователь потенциально может оценить реакцию на протыкание 8-10 клеток за 1 час, что немыслимо при технике пластыря.
Учитывая важность, которую механически активированные ионные каналы имеют в нормальном функционировании организма и болезненных состояниях, необходимы новые методы для изучения этих каналов в их естественной среде. Как описано в этом протоколе, методы визуализации могут дать уникальное представление о том, как эти каналы ощущают изменения в окружающей среде и генерируют физиологические реакции. Учитывая доступность поверхности слизистой оболочки трубчатых или мешковидных органов, описанный здесь способ может быть адаптирован для изучения механотрансдукции в других условиях, включая кишечник, урогенитальный тракт, кровеносные сосуды и т. д. Таким образом, изучение механических реакций в организме может быть широко полезным.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была поддержана грантами NIH R01DK119183 (для G.A. и M.D.C.) и S10OD028596 (для G.A.), а также ядрами визуализации клеток и модельных организмов почек Питтсбургского центра исследований почек (P30DK079307).
Материалы
| Name | Company | Catalog Number | Comments |
| 20x Objective | Olympus | UMPlanFL N | |
| 24 G ¾” catheter | Medline | Suresite IV slide | |
| 4x Objective | Olympus | UPlanFL N | |
| Analog/digital converter | Molecular Devices | Digidata 1440A | |
| Anti-GFP antibody | Abcam | Ab6556 | |
| Beam splitter | Chroma | T495lpxr | |
| Bipolar temperature controller | Warner Instruments | TC-344B | |
| CaCl2 | Fluka | 21114-1L | 1 M solution |
| cellSens software | Olympus | Imaging software | |
| CMOS camera | Hamamatsu | ORCA fusion | |
| Donkey anti-rabbit conjugated to Alexa Fluor 488 | Jackson ImmunoResearch | 711-545-152 | |
| Excel | Microsoft Corporation | ||
| Filter | Chroma | ET470/40X | |
| Glass capillaries Corning 8250 glass | Warner Instruments | G85150T-4 | |
| Glucose | Sigma | G8270 | |
| HEPES | Sigma | H4034 | |
| Inline heater | Warner Instruments | SH-27B | |
| KCl | Sigma | 793590 | |
| Light source | Sutter Instruments | Lambda XL | |
| Manifold pump tubing | Fisherbrand | 14-190-510 | ID 1.52 mm |
| Manifold pump tubing | Fisherbrand | 14-190-533 | ID 2.79 mm |
| MgCl2 | Sigma | M9272 | |
| Mice | Jackson Lab | 664 | 2-4 months old female C57BL/6J |
| Microforge | Narishige | MF-830 | |
| Micromanipulator | Sutter Instruments | MP-285 | |
| Microscope | Olympus | BX51W | |
| Mounting media with DAPI | Invitrogen | S36964 | Slowfade Diamond Antifade with DAPI |
| NaCl | Sigma | S7653 | |
| pClamp software | Molecular Devices | Version 10.4 | Patch-clamp electrophysiology data acquisition and analysis software |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Piezoelectric actuator | Thorlabs | PAS005 | |
| Pipette holder | World Precision Instruments | ||
| Pipette puller | Narishige | PP-830 | |
| Quick exchange heated base with perfusion and adapter ring kit | Warner Instruments | QE-1 | Quick exchange platform fits 35 mm dish |
| Rhodamine-phalloidin | Invitrogen | R415 | |
| Sigma-Plot | Systat Software Inc | Version 14.0 | Scientific graphing and data analysis software |
| Silicone elastomer | Dow | Sylgard 184 | |
| Single channel open-loop piezo controller | Thorlabs | MDT694B | |
| Square grid holder pad | Ted Pella | 10520 | |
| Suture | AD Surgical | S-S618R13 | 6-0 Sylk |
| Teflon mounting rod | Custom made | Use to mount the piezoelectric actuator in the micromanipulator | |
| Tubing | Fisher Scientific | 14171129 | Tygon S3 ID 1/16 IN, OD 1/8 IN |
| USB Digital I/O device | National Instruments | NI USB-6501 |
Ссылки
- Kunau, R. T., Webb, H. L., Borman, S. C. Characteristics of the relationship between the flow rate of tubular fluid and potassium transport in the distal tubule of the rat. Journal of Clinical Investigation. 54 (6), 1488-1495 (1974).
- Engbretson, B. G., Stoner, L. C. Flow-dependent potassium secretion by rabbit cortical collecting tubule in vitro. American Journal of Physiology. 253 (5), 896-903 (1987).
- Satlin, L. M., Sheng, S., Woda, C. B., Kleyman, T. R. Epithelial Na(+) channels are regulated by flow. American Journal of Physiology Renal Physiology. 280 (6), 1010-1018 (2001).
- Woda, C. B., et al. Ontogeny of flow-stimulated potassium secretion in rabbit cortical collecting duct: functional and molecular aspects. American Journal of Physiology Renal Physiology. 285 (4), 629-639 (2003).
- Malnic, G., Berliner, R. W., Giebisch, G. Flow dependence of K+ secretion in cortical distal tubules of the rat. American Journal of Physiology. 256 (5), 932-941 (1989).
- Khuri, R. N., Strieder, W. N., Giebisch, G. Effects of flow rate and potassium intake on distal tubular potassium transfer. American Journal of Physiology. 228 (4), 1249-1261 (1975).
- Good, D. W., Wright, F. S. Luminal influences on potassium secretion: sodium concentration and fluid flow rate. American Journal of Physiology. 236 (2), 192-205 (1979).
- Wong, K. R., Berry, C. A., Cogan, M. G. Flow dependence of chloride transport in rat S1 proximal tubules. American Journal of Physiology. 269 (6), 870-875 (1995).
- Garvin, J. L. Glucose absorption by isolated perfused rat proximal straight tubules. American Journal of Physiology. 259 (4), 580-586 (1990).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of renal potassium excretion in the rat. American Journal of Physiology. 206 (4), 674-686 (1964).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of distal tubular potassium and sodium transport in rat nephron. American Journal of Physiology. 211 (3), 529-547 (1966).
- Cabral, P. D., Garvin, J. L. Luminal flow regulates NO and O2(-) along the nephron. American Journal of Physiology. 300 (5), 1047-1053 (2011).
- Raghavan, V., Rbaibi, Y., Pastor-Soler, N. M., Carattino, M. D., Weisz, O. A. Shear stress-dependent regulation of apical endocytosis in renal proximal tubule cells mediated by primary cilia. Proceedings of the National Academy of Sciences. 111 (23), 8506-8511 (2014).
- Lewis, S. A., de Moura, J. L. Apical membrane area of rabbit urinary bladder increases by fusion of intracellular vesicles: an electrophysiological study. The Journal of Membrane Biology. 82 (2), 123-136 (1984).
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Dalghi, M. G., Montalbetti, N., Carattino, M. D., Apodaca, G. The urothelium: life in a liquid environment. Physiological Reviews. 100 (4), 1621-1705 (2020).
- Khandelwal, P., Abraham, S. N., Apodaca, G. Cell biology and physiology of the uroepithelium. American Journal of Physiology Renal Physiology. 297 (6), 1477-1501 (2009).
- Sachs, F. Stretch-activated ion channels: what are they. Physiology. 25 (1), 50-56 (2010).
- Martinac, B. Mechanosensitive ion channels: molecules of mechanotransduction. Journal of Cell Science. 117 (12), 2449-2460 (2004).
- Ranade, S. S., Syeda, R., Patapoutian, A. Mechanically activated ion channels. Neuron. 87 (6), 1162-1179 (2015).
- Cox, C. D., Bavi, N., Martinac, B. Biophysical principles of ion-channel-mediated mechanosensory transduction. Cell Reports. 29 (1), 1-12 (2019).
- Carattino, M. D., Sheng, S., Kleyman, T. R. Epithelial Na+ channels are activated by laminar shear stress. Journal of Biological Chemistry. 279 (6), 4120-4126 (2004).
- Ross, T. D., et al. Integrins in mechanotransduction. Current Opinion in Cell Biology. 25 (5), 613-618 (2013).
- Dieterle, M. P., Husari, A., Rolauffs, B., Steinberg, T., Tomakidi, P. Integrins, cadherins and channels in cartilage mechanotransduction: perspectives for future regeneration strategies. Expert Reviews in Molecular Medicine. 23, 14 (2021).
- Huveneers, S., de Rooij, J. Mechanosensitive systems at the cadherin-F-actin interface. Journal of Cell Science. 126, 403-413 (2013).
- Sun, Z., Guo, S. S., Fässler, R. Integrin-mediated mechanotransduction. Journal of Cell Biology. 215 (4), 445-456 (2016).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. European Journal of Physiology. 391 (2), 85-100 (1981).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2 (2013).
- Sun, X. R., et al. Fast GCaMPs for improved tracking of neuronal activity. Nature Communications. 4, 2170 (2013).
- Dalghi, M. G., et al. Functional roles for PIEZO1 and PIEZO2 in urothelial mechanotransduction and lower urinary tract interoception. JCI Insight. 6 (19), 152984 (2021).
- Durnin, L., et al. An ex vivo bladder model with detrusor smooth muscle removed to analyse biologically active mediators released from the suburothelium. The Journal of Physiology. 597 (6), 1467-1485 (2019).
- Delmas, P., Coste, B. Mechano-gated ion channels in sensory systems. Cell. 155 (2), 278-284 (2013).
- Tavernarakis, N., Driscoll, M. Degenerins. At the core of the metazoan mechanotransducer. Annals of the New York Academy of Sciences. 940 (1), 28-41 (2001).
- Peyronnet, R., Tran, D., Girault, T., Frachisse, J. M. Mechanosensitive channels: feeling tension in a world under pressure. Frontiers in Plant Science. 5, 558 (2014).
- Blount, P., Iscla, I. Life with bacterial mechanosensitive channels, from discovery to physiology to pharmacological target. Microbiology and Molecular Biology Reviews. 84 (1), 00055 (2020).
- Booth, I. R., Miller, S., Müller, A., Lehtovirta-Morley, L. The evolution of bacterial mechanosensitive channels. Cell Calcium. 57 (3), 140-150 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены